Почему при лейкодерме необходимо обязательно исследования ликвора
Обновлено: 01.05.2024
Заболеваемость сифилисом нервной системы возрастает примерно на 15-25% в года.
В настоящее время не существует патогномоничных симптомов в диагностике раннего нейросифилиса и его клинических форм.
Различают ранний нейросифилис и поздний нейросифилис . Такое подразделение нейросифилиса условно: ранний нейросифилис может развиться спустя многие годы после заболевания сифилисом, наряду с этим, особенно при инфицировании ВИЧ, известны случаи раннего проявления табопаралича и спинной сухотки.
В настоящее время в раннем нейросифилисе выделяют:
1) асимптомный нейросифилис;
2) сифилитический менингит
3) менинговаскулярный нейросифилис.
О.К.Шапошников и И.И.Мавров приводят расширенную клиническую классификацию:
1) скрытый или латентный сифилитический менингит;
2) базальный менингит или менингоневритическая форма сифилитического менингита;
3) острый генерализованный или манифестный сифилитический менингит;
4) сифилитическая гидроцефалия;
5) сифилитический менингомиелит;
6) ранний менинговаскулярный сифилис.
Таким образом, остаётся спорным ряд положений – есть ранний нейросифилис или это нейросифилис в целом, выделять или нет асимптомный ранний нейросифилис.
Широкое применение антибиотикотерапии повлекло за собой заметный патоморфоз сифилиса, протекающего в настоящее время с атипичными и малосимптомными поражениями нервной системы.
Асимптомный нейросифилис. Данная форма характеризуется отсутствием клинических неврологических симптомов. Диагностика основана на исследовании ликвора, в котором выявляется повышенный уровень содержания белка, положительные RW и VDRL. Изменения одного или нескольких из этих показателей обнаруживается у 20-30% больных с нелеченым сифилисом после 2 лет течения болезни. Риск прогрессирования бессимптомного нейросифилиса и перехода его в симптоматический в 2-3 раза выше у лиц европеоидной расы по сравнению с негроидной и в 2 раза выше у мужчин, чем у женщин
Скрытый или асимптомный сифилитический менингит.
Наиболее частая форма раннего нейросифилиса. При первичном сифилисе асипмптомный менингит констатируется в 4% случаев, при вторичном свежем – в 15-25%, при вторичном рецидивном – в 30-50%.
Как правило, клинические симптомы отсутствуют. Иногда отмечаются головная боль, головокружение,. Диагноз скрытого менингита у больных ранним сифилисом устанавливают по изменениям в спинномозговой жидкости.
Менингоневритическая форма сифилитического менингита или базальный менингит встречается в 10-20% всех случаев раннего нейросифилиса. Протекает подостро. Отмечаются слабовыраженные менингиальные симптомы: головная боль, усиливающаяся по ночам, головокружение, иногда тошнота, рвота. Одним из проявлений базального менингита является поражение черепно-мозговых нервов – прежде всего, зрительных и слуховых.
В глазном яблоке чаще развиваются ирит (иридоциклит), сопровождающийся болевым синдромом, фотофобией, слезотечением, перикорнеальной инъекцией склеры, ослаблением зрения и хориоретинит.
При вовлечении в процесс зрительного нерва (чаще – одностороннее) ухудшается центральное зрение, суживаются поля зрения, больные отмечают появление тёмных пятен и “мушек” перед глазами.
При неврите слухового нерва прежде всего снижается костная проводимость (костно-воздушная диссоциация), что является патогномоничным для раннего нейросифилиса и может оставаться единственным признаком, даже при отрицательной реакции Вассермана.
Вестибулярные расстройства при сифилисе отражают обязательное вовлечение центральных отделов анализатора – головокружение в виде качки, уплывание пола из-под ног, отсутствие вестибулярной иллюзии противовращения.
Острый генерализованный сифилитический менингит , сифилитическая гидроцефалия встечаются крайне редко. Сифилитический менингомиелит возникает через 1-3 года после инфицирования. Отмечаются снижение или исчезновение сухожильных рефлексов. При этом развиваются параличи нижних конечностей с расстройством функции органов малого таза. Симптомы появляются рано и быстро регрессируют на фоне специфического лечения. Ранний менинговаскулярный сифилис характеризуется умеренным вовлечением в процесс мозговых оболочек. Клиническая картина довольно разнообразна: головная боль, интермиттирующие очаговые нарушения мозгового кровообращения с эпизодами дизартрии и анартрии, альтернирующие припадки, нарушения памяти, поражение черепно-мозговых нервов, нарушение чувствительности, гемипарезы.
Опираясь только на клинические проявления, нельзя с высокой долей достоверности давать заключение о специфическом поражении нервной системы. Поэтому, особый упор делается на лабораторную диагностику, призванную разрешить спорные вопросы о вовлечении нервной системы в сифилитический процесс.
Общепринятыми характеристиками ликвора являются: количество клеточных элементов, общее количество белка, результаты глобулиновых реакций Панди, Нонне-Апельта, реакции Ланге с коллоидным золотом, комплекса серологических реакций (КСР), РИФ-ц, РИФ-10 В норме цитоз в спинномозговой жидкости не превышает 6 × 10 6 /л, а уровень белка не превышает 0,45 г/л.
Когда состояние спинномозговой жидкости оценивали по количеству клеточных элементов, общему количеству белка, глобулиновым и коллоидным реакциям и реакции Вассермана, то патологический ликвор выявлялся у 17,3-31% больных сифилисом.
Чувствительность реакции Вассермана с ликвором при нейросифилисе с использованием кардиолипинового антигена составляет 63%, трепонемного антигена – 84%, антигена из атипичных форм культуральных бледных трепонем – 92%.
Ложноположительные результаты серологических реакций с ликвором отмечаются в случаях артефактной эритроцитрахии а также могут быть обусловлены:
1) заболеваниями, вызванными возбудителями со сходной антигенной структурой (фрамбезия, беджел, пинта, риккетсии, трепонемы полости рта и гениталий, лептоспиры);
2) техническими погрешностями при постановке реакции.
Следует учитывать, что ВИЧ-инфекция может существенно менять серологические реакции при сифилисе, что может отразиться и на результатах исследования ликвора. Отрицательные результаты КСР с ликвором не исключают нейросифилис.
Широко используемым на сегодняшний день за рубежом специфическим тестом является флюоресцентный тест абсорбции трепонемных антител (РИФ-абс,). Данный тест используется как «золотой стандарт».
В России РИФ, применительно к ликвору, используется в варианте РИФ-ц, то есть – с неразведённым ликвором.
Однако группа РИФ — тестов сложна в плане реализации. Каждый результат должен быть считан и оценен именно высококвалифицированным специалистом, что исключает автоматизацию и постановку реакций с большим количеством сывороток.
Реакцией гемагглютинации с ликвором, применяемой за рубежом, является ТРНА . При этом используется РПГА-индекс, рассчитываемый по формуле.
Прогресс во многих областях биологии и медицины в значительной мере связан с широким использованием количественных иммунологических методов, среди которых наибольшее распространение получили твердофазные варианты радиоиммунного анализа (РИА) и иммуноферментного анализа (ИФА).
Кроме того, в постановке диагноза нейросифилиса может помочь и выявление иммуноглобулинов в ликворе методом радиальной иммунодиффузии в геле и определение концентрации свободных лёгких цепей с помощью электрофореза с иммуноблотингом.
Полимеразная цепная реакция для выявления специфических последовательностей ДНК патогенных трепонем в цереброспинальной жидкости была применена в 1990 году.
Специфичность метода для образцов спинномозговой жидкости — 71%. Остаётся невыясненным вопрос — отражает ли наличие трепонемной ДНК присутствие жизнеспособных трепонем или это остатки генетического материала разрушенных микроорганизмов.
Суммирование литературных данных, касающихся использования рутинныхс серологических методов диагностики (РИФц, и серологические реакции с кардиолипиновым антигенам), позволяют упрощенно сформулировать алгоритм их интерпретации при исследовании СМЖ: отрицательный результат тестирования в РИФц. позволяет исключить поражение ЦНС; положительный результат в РИФц. не подтверждает поражение ЦНС; отрицательный результат в реакциях с кардиолипиновым антигеном не исключает поражение ЦНС; положительные реакции с кардиолипиновым антигеном с высокой степенью вероятности указывают на специфическое поражение ЦНС. Нетрудно представить, с какими сложностями сталкиваются клинические врачи с учетом необходимости совместной оценки результатов комплекса серологических методов. Учитывая возможность получения искаженных результатов (ложноположительных и ложноотрицательных) в каждом из тестов, лабораторное подтверждение диагноза нейросифилиса и вовсе становится трудновыполнимым и несоответствующим требованиям сегодняшнего дня.
При лечении нейросифилиса приоритетное значение придаётся методам, способствующим проникновению антибиотика через гематоэнцефалический барьер в трепонемоцидной концетрации.
Повышению концентрации пенициллина в ликворе способствуют: повышение температуры тела, введение гистамина, гиалуронидазы, лидазы, эуфиллина, пробеницида.
Воспаление мозговых оболочек снижает скорость элиминации антибиотиков. Увеличение доз парентерально вводимого пенициллина ведёт к возрастанию уровня антибиотика в ликворе, но не пропорционально. Пик концентрации антибиотика в ликворе отмечается через 2-4 часа после парентерального введения..
С помощью магниторезонансной томографии (МРТ) головного и спинного мозга определяется топический диагноз, форма нейросифилиса и проводится дифференциальная диагностика между нейросифилисом и различными другими неврологическими заболеваниями, в частности, новообразованиями, инсультными неспецифической этиологии.
Установление диагноза нейросифилиса невозможно без проведения ликворологического исследования, с учетом 4-х показателей: цитоза, белка, КСР, РИФ (РИФ с цельным ликвором).
Врач дерматовенеролог, наблюдающий пациента по окончании лечения, привлекает консультанта невролога для осмотра пациента 1 раз в 6 месяцев (по мере необходимости). Дерматовенеролог организует также консультации других специалистов.
Первое контрольное исследование ликвора проводится через 6 месяцев после окончания курса терапии, далее 1 раз в 6 месяцев в пределах 3-х лет после установления диагноза.
Цитоз быстро реагирует на специфическую терапию, следовательно, резкое снижение числа клеток является критерием адекватности проводимого лечения. Белок зачастую снижается значительно медленнее и в течение 2 лет может оставаться патологическим. Крайне важным является пусть медленное, но снижение белка. КСР в ликворе в течение 1 года после лечения может оставаться позитивным, но с тенденцией к снижению. РИФц долгое время сохраняется положительной в ликворе, поэтому не может использоваться как критерий излеченности.
Проведение контрольных пункций в сроки 1 раз в 6 месяцев необходимы по двум обстоятельствам:
Ликворея – это истечение спинномозговой жидкости (ликвора) через дефекты в твердой мозговой оболочке. Патология в основном возникает при черепно-мозговых травмах, реже причиной выступают церебральные опухоли, врожденные дефекты, осложнения нейрохирургических вмешательств. При ликворее прозрачная жидкость без запаха вытекает из уха или носа, зачастую присоединяются нарушения сознания и признаки очагового повреждения структур ЦНС. Для диагностики заболевания выполняется КТ и МРТ головного мозга, эхоэнцефалография, рентгенконтрастные исследования. Лечение проводится консервативным и/или хирургическим способом.
МКБ-10


Общие сведения
Ликворея возникает у 2-3% людей с травмами головы и в 5-11% случаев при переломе основания черепа. При тяжелых повреждениях лицевого скелета и назоэтмоидальноорбитального комплекса частота осложнения достигает 40%. Патология имеет большое клиническое значение в клинической неврологии, поскольку указывает на обширную травматизацию внутричерепных структур и требует неотложного комплексного лечения. Усилия врачей направлены на совершенствование диагностики ликвореи, что важно для ее своевременной и адекватной терапии.

Причины ликвореи
Основным этиологическим фактором патологического состояния называют ЧМТ, которые сопровождаются повреждениями костных структур и подлежащих оболочек мозга. Чаще всего проблема развивается при травмах основания черепа, пирамиды височной кости, лобной пазухи. По биомеханике повреждения различают ЧМТ следующих видов: ударно-противоударные, ускорения-замедления и сочетанные. Другие причины ликвореи:
- Объемные новообразования. Опухоли мозга и костных структур, имеющие инвазивный тип роста, способны повреждать оболочки и формировать дефект для истечения ликвора. Патология наблюдается при запущенных стадиях, когда новообразование достигает больших размеров.
- Врожденные пороки развития. При черепно-мозговых и спинномозговых грыжах развиваются патологические пути оттока цереброспинальной жидкости (ЦСЖ). Патология проявляется с раннего детства, сопровождается другими неврологическими нарушениями.
- Ятрогенные факторы. Вторичная ликворея возникает как осложнение нейрохирургических операций, при которых случайно травмируется твердая мозговая оболочка. Такая ситуация возможна при тяжелых травмах головы, дефиците современного оборудования для интраоперационной нейровизуализации.
Патогенез
При переломах черепа смещенные костные фрагменты повреждают мозговые оболочки, в результате чего наблюдается истечение ликвора. Существует 3 ведущих механизма повреждений: ущемление отломками костей, прободение церебральных оболочек, обширные разрывы без признаков регенерации. Пролабирование оболочек мозга в костные дефекты препятствует их заражению и способствует формированию грыжи, содержащей элементы мозгового вещества.
Высокая частота ликвореи обусловлена особенностями анатомического строения основания черепа. Кости имеют неоднородную структуру, содержат большое количество воздухоносных полостей и отверстий для сосудисто-нервных пучков. Мозговые оболочки плотно прилегают к твердым структурам, поэтому их разрывы наблюдаются даже при минимальных травмах головы и смещении внутричерепного содержимого.

Классификация
По времени развития выделяют первичную (раннюю) ликворею, появляющуюся в первые 24 часа после травмы, и вторичную (позднюю) возникающую спустя несколько дней и даже недель. Отдельным вариантом является скрытая ликворея, когда пациенты не замечают выделения ЦСЖ из носа или ушного прохода. В практической неврологии и нейрохирургии важное значение имеет классификация болезни по локализации:
- Назальная – вытекание цереброспинальной жидкости из одного или обоих носовых ходов.
- Отоликворея – истечение ликвора из наружного слухового прохода.
- Послеоперационная – патологическое выделение ликвора после трепанации черепа и других нейрохирургических манипуляций.
Симптомы ликвореи
В 97% случаев наблюдается вытекание прозрачной жидкости из носового или слухового хода. Ликворея носит постоянный или интермиттирующий характер, объем выделений варьирует от 1 до 30 мл в сутки. При перемене положения тела и наклонах головы количество отделяемого возрастает. Жидкость не имеет запаха и посторонних включений, при назальной форме пациенты могут принимать ее за первый симптом насморка или респираторной аллергии.
В горизонтальном положении, особенно во время сна, ликвор затекает из носовой полости в горло и раздражает слизистые. Больных беспокоят мучительные кашлевые приступы, которые уменьшаются в позе полусидя. Профузная ликворея сопровождается попаданием ЦСЖ в желудок. При этом возникает клиника острого неинфекционного гастрита: боли и рези в эпигастрии, дискомфорт после еды, тошнота и рвота.
Клиническая картина посттравматической ликвореи нередко сопровождается признаками сотрясения или ушиба головного мозга. Пациенты предъявляют жалобы на головные боли, слабость, головокружение и сильную тошноту. Симптомы усиливаются при попытках встать с постели и активных движениях. Также возникают вегетативные реакции: приливы крови к лицу, чрезмерная потливость, нарушения сердечного ритма.
Неврологические проявления включают асимметрию сухожильных рефлексов, анизокорию, нистагм. При более серьезных травмах головного мозга возникает двигательная дисфункция, умеренные менингеальные симптомы. Больные сообщают о кратковременной потере памяти на момент травмы, реже встречается ретроградная и антеградная амнезия.
Осложнения
Диагностика
Первичная оценка состояния пациентов с предполагаемой ликвореей проводится врачом-неврологом. Степень нарушения сознания определяется с помощью Шкалы Комы Глазго, далее проводится полный неврологический осмотр. Для обследования больных с сочетанными травмами привлекают нейрохирурга, анестезиолога-реаниматолога, травматолога. В комплексную диагностическую программу входят следующие методы:
- КТ головного мозга. Рентгенологическая диагностика с высокой точностью показывает костные дефекты, которые могут стать причиной повреждения dura mater. Дополнительные сведения для нейрохирургии дает церебральная МРТ, направленная на визуализацию содержимого черепной коробки.
- КТ-цистернография. Нейровизуализация с эндолюмбальным введением рентгеноконтрастных веществ – «золотой стандарт» в диагностике ликвореи. Методика определяет локализацию ликворных фистул, состояние костных структур пораженной области.
- Эхоэнцефалография. Церебральная сонография используется для быстрой и неинвазивной диагностики внутричерепных новообразований, визуализации косвенных признаков повреждения головного мозга. Важнейший показатель ЭхоЭГ – состояние срединных структур (М-эхо).
- ЛОР-обследование. При риноскопии определяется гиперемия и отечность слизистой оболочки, истечение водянистой жидкости по носовым ходам. Для уточнения топики патологического процесса проводится эндоскопия носа. При отоликворее визуализируется травматическая перфорация барабанной перепонки.
- Анализ ликвора. Микроскопическое и микробиологическое исследование вытекаемой жидкости необходимо для подтверждения ликвореи. При обнаружении в ликворе признаков гнойного воспаления, проводится расширенная диагностика для определения патогенного возбудителя.
Дифференциальная диагностика
При нетяжелых вариантах ЧМТ важно отличать назальную ликворею от серозного ринита, поскольку выделяющаяся жидкость не имеет патогномоничных признаков. ЦСЖ содержит много глюкозы (2,3-4 ммоль/л) и мало белка (0,1-0,22 ммоль/л), чем отличается от воспалительного экссудата, который образуется при ЛОР-заболеваниях. Дифференциальная диагностика также проводится с доброкачественными опухолями назальной полости, которые продуцируют слизь.

КТ-цистернография. Симптом «ликворной дорожки» — контрастированная СМЖ в правой половине полости носа (стрелка)
Лечение ликворея
Консервативная терапия
Основная задача – создать благоприятные условия для закрытия дефекта мозговых оболочек и формирования рубца на месте истечения ликвора. Пациентам назначают строгий постельный режим, приподнимание головного конца кровати на 30-70°. На период лечения исключаются любые физические нагрузки, натуживание, эмоциональное перенапряжение. Комплексная терапия при ликворее включает следующие направления:
- Дегидратация. Мочегонные препараты используются для уменьшения внутричерепного давления и нормализации циркуляции ликвора. Это ускоряет закрытие и регенерацию повреждений церебральных оболочек.
- Антибактериальная терапия. Превентивный прием противомикробных препаратов необходим для профилактики гнойных менингитов. Лекарства подавляют бактерии, колонизирующие верхние дыхательные пути, и препятствуют их распространению на структуры ЦНС.
- Дренирование ЦСЖ. Процедура проводится при неэффективности других консервативных методов лечения. Ликвороприемник устанавливают на уровне головы больного, чтобы избежать вторичной внутричерепной гипотензии.
Хирургическое лечение
Помощь нейрохирургов требуется при ликворее, продолжающейся более 7 суток. Чтобы устранить дефект и прекратить истечение цереброспинальной жидкости, проводятся открытые транскраниальные или мини-инвазивные трансназальные вмешательства. Преимущества эндоскопической хирургии: минимальная травматизация тканей, отсутствие риска послеоперационной аносмии. Техника операции подбирается индивидуально с учетом характера и тяжести травмы.
Существует 2 точки зрения относительно сроков выполнения нейрохирургического вмешательства. Сторонники ранних операций (в первые 1,5 недели после травмы) сообщают, что со временем возрастает риск развития менингита, из-за чего адекватное лечение осложняется. Медики, предпочитающие отсроченные операции, подчеркивают высокую частоту самопроизвольного прекращения ликвореи в течение 2-3 недель консервативной терапии.
Результативность хирургического вмешательства зависит от расположения ликворной фистулы, точности предоперационной диагностики, опыта нейрохирурга. Большинству пациентов требуется однократная операция. При повреждении латеральной стенки клиновидной пазухи может потребоваться повторное вмешательство, поскольку интраоперационная визуализация таких дефектов затруднена.
Реабилитация
Восстановительный период после операций в нейрохирургии занимает около 6 недель. Пациентам назначают комплексное медикаментозное лечение: антибактериальные, дегидратационные и симптоматические препараты. Поясничный дренаж устанавливается не более чем на 2-3 суток. Постепенная активизация пациентов начинается со второго дня послеоперационного периода, при этом важно избегать наклонов головы, поднятия тяжестей, повышения внутрибрюшного давления.
Прогноз и профилактика
Лейкодерма – полиэтиологическое дерматологическое состояние, которое характеризуется нарушением образования и накопления или ускоренным разрушением пигмента на определенных участках тела. Проявляется наличием обесцвеченных участков кожных покровов. Размеры, количество и локализация участков зависят от причин расстройства. Диагностика лейкодермы основывается на результатах осмотра дерматолога и общего обследования организма больного, проводимого для выявления скрытых патологий. В некоторых случаях может потребоваться биопсия тканей из пораженных участков. Тактика лечения зависит от этиологии данного состояния, возможны как специфическая терапия провоцирующего заболевания, так и поддерживающие мероприятия в виде витаминотерапии и УФ-облучения.
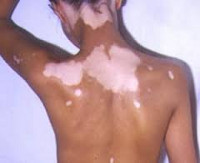
Общие сведения
Лейкодерма не является отдельным кожным заболеванием, это симптом, свидетельствующий об общем или местном нарушении пигментного обмена. Состояние известно с глубокой древности, в некоторых культурах больные с подобными изменениями кожи признавались как отмеченные богами. Лейкодерма является очень распространенной дерматологической патологией, по некоторым данным от ее различных форм страдает от 5 до 8% населения планеты. Может быть как приобретенным состоянием, возникшим вследствие определенного образа жизни человека или воздействия на его организм различных факторов внешней среды, так и врожденным, генетически обусловленным. Последняя разновидность характеризуется особой сложностью в процессе лечения и нередко беспокоит пациента уже в раннем детстве. Половое распределение лейкодермы зависит от типа и формы патологии. Одни состояния встречаются только у мужчин (сцепленные с Х-хромосомой наследственные разновидности), другие могут одинаково часто поражать лиц обеих полов или несколько чаще возникать у женщин.

Причины лейкодермы
Оттенок кожи человека зависит от наличия в ней нескольких пигментов, главным из которых является меланин. Скорость образования этого соединения зависит от двух факторов – наличия в организме тирозина, служащего субстратом для образования меланина, и перерабатывающего фермента тирозиназы. При альбинизме, который рассматривается некоторыми дерматологами как крайний вариант лейкодермы, имеются дефекты в структуре тирозиназы. Фермент не работает, что обуславливает отсутствие синтеза меланина. При некоторых формах лейкодермы наблюдается аналогичный процесс – нарушается работа фермента, пигмент не синтезируется, в результате появляются обесцвеченные участки кожи.
Есть и иной механизм гипопигментации при этом дерматологическом состоянии. Меланин должен не только синтезироваться, но откладываться в особых клеточных включениях – меланосомах. Существуют факторы экзогенной и эндогенной природы, затрудняющие этот процесс. Под их влиянием при нормальном или даже повышенном синтезе меланина на определенных участках кожи не откладывается пигмент, что приводит к появлению очагов лейкодермы. Вариантом такого процесса может быть избирательная гибель меланоцитов кожи, обусловленная инфекционными агентами, иммунологическими нарушениями или воздействием некоторых химических веществ. Из-за повышенной скорости распада пигментных клеток не происходит их своевременная замена, что также провоцирует возникновение симптомов лейкодермы.
К вышеописанным нарушениям может приводить огромное количество разнообразных патологических состояний и неблагоприятных факторов. Наиболее часто лейкодерма возникает вследствие некоторых инфекционных заболеваний (сифилиса, лепры, определенных дерматомикозов), аутоиммунных состояний (системной красной волчанки, склеродермии), генетических патологий (болезни Вульфа, Ваандербурга и пр.). Кроме того, существуют формы так называемой профессиональной лейкодермы, провоцируемой воздействием некоторых промышленных химических веществ на организм. Отдельно обычно выделяют витилиго и идиопатические формы патологии. Кроме того, к развитию лейкодермы могут приводить некоторые глистные инвазии, нарушения иммунитета и эндокринные расстройства.
Классификация лейкодермы
Современная классификация лейкодермы в дерматологии основана на этиологии этого состояния. Однако даже общепринятый перечень разновидностей не может охватить абсолютно все формы патологии. Из-за этого в отдельный тип выделяют идиопатическую лейкодерму, относя к ней все формы и разновидности состояния с неустановленной причиной. Данная классификация наиболее полно и объективно разделяет различные группы лейкодермы по причинам их появления. Удобство классификации заключается еще и в том, что лейкодермы, входящие в определенную группу, характеризуются сходством клинической симптоматики – это позволяет дерматологу только по внешнему виду больного примерно определить перечень возможных этиологических факторов. Чаще всего у пациентов выявляются следующие виды лейкодермы:
- Инфекционная лейкодерма – гипохромия, обусловленная воздействием на кожу различных микроорганизмов, которые могут либо прямо поражать меланоциты, либо нарушать местный метаболизм в тканях настолько, что в них затрудняется синтез и накопление пигмента. К этому типу относят сифилитическую и лепрозную лейкодерму, а также гипопигментацию вследствие различных форм лишая.
- Иммунная лейкодерма – в эту группу исследователи включают витилиго и некоторые другие аутоиммунные состояния (склеродермию, волчанку), которые могут сопровождаться нарушением пигментации кожи. Причинами иммунной лейкодермы также становятся иммунологические нарушения, возникающие на фоне глистных инвазий. Объединяющим фактором является поражение меланоцитов собственной иммунной системой.
- Токсическая лейкодерма обусловлена местным или общим воздействием некоторых химических веществ, в том числе лекарственных препаратов. К этой группе относится так называемая профессиональная гипохромия, которая возникает у сотрудников определенных химических производств при длительном воздействии промышленных токсинов.
- Врожденная лейкодерма имеет генетические причины или (реже) вызывается внутриутробным поражением. Характеризуется разнообразием симптоматики, нередко помимо кожных нарушений у больных встречаются пороки развития и другие нарушения.
- Послевоспалительная лейкодерма часто возникает на фоне рубцовых изменений после ожогов, а также при длительно протекающих кожных заболеваниях воспалительного характера (например, при экземе).
- Идиопатическая лейкодерма включает в себя все формы патологии с не выявленными или неясными причинами.
Симптомы лейкодермы
Основным проявлением лейкодермы является нарушение пигментации кожных покровов на различных участках тела. Характер нарушений пигментации различается в зависимости от формы и причин состояния. Так, при инфекционной сифилитической лейкодерме обесцвечивание кожи происходит в основном на шее, туловище, иногда лице и может иметь три клинические формы: сетчатую, мраморную и пятнистую. В первом случае участки депигментации состоят из множества мелких волокнистых очагов, напоминающих кружева, во втором – из беловатых точек с нечеткими контурами, имеющих тенденцию к слиянию. Пятнистая сифилитическая лейкодерма характеризуется образованием отдельных круглых очагов гипохромии с четкими контурами и практически одинакового размера.
Лепрозная лейкодерма часто возникает на руках, бедрах, спине и ягодицах. Ее особенностью является формирование круглых очагов поражения с четкими границами. Очаги после своего появления могут долгие годы сохраняться без изменений. Иммунные формы гипохромии, развивающиеся при системной красной волчанке, склеродермии и глистной инвазии, часто сопровождаются не только очаговой потерей пигмента, но и шелушением или атрофией кожи. При правильно проведенном лечении инфекционной или аутоиммунной лейкодермы выраженность кожных проявлений снижается, поскольку исчезает фактор, оказывающий негативное воздействие на меланоциты или метаболизм пигментов. Аналогичная картина наблюдается в случае химической или токсигенной гипохромии – зачастую центральным элементом лечения этих форм становится устранение провоцирующего фактора, само по себе позволяющее снизить выраженность кожных проявлений.
Врожденные формы лейкодермы имеют разнообразные симптомы, которые во многом определяются основным заболеванием. Кожные проявления (очаги депигментации различных размеров и форм) могут сочетаться с нарушениями со стороны других органов и систем. Послевоспалительная лейкодерма характеризуется появлением гипохромии на тех участках кожи, которые подверглись ожогам, псориазу или себорее. Нередко в центре очага с пониженной пигментацией можно обнаружить рубцовые изменения. Локализация пигментных нарушений зависит от расположения предшествовавших воспалительных поражений кожи. При этих формах лейкодермы, а также при витилиго восстановление нормальной окраски кожных покровов может быть сильно затруднено, нарушения сохраняются на протяжении многих лет.
Диагностика лейкодермы
Лейкодерму достаточно легко определить при обычном осмотре кожных покровов пациента, однако для выяснения ее причин может потребоваться целый комплекс различных клинических исследований. При осмотре кожи больного выявляются участки депигментации различной формы, размеров и локализации, в некоторых случаях очаги окружены ободком гиперпигментации (компенсаторная реакция организма). При подозрении на инфекционный характер лейкодермы производится общий анализ крови, в котором могут определяться неспецифические признаки воспаления (лейкоцитоз, увеличение СОЭ). Эозинофилия может указывать на наличие глистной инвазии. Для определения возбудителя также могут быть назначены серологические анализы: реакция Вассермана, тест на наличие лепры и другие.
Путем изучения основных показателей крови пациента и некоторых диагностических тестов можно выявить не только воспалительную, но и иммунную лейкодерму. Например, при волчанке определяют наличие антинуклеарных антител. Немаловажную роль в диагностике лейкодермы играет опрос больного и тщательное изучение анамнеза, поскольку при токсигенных и послевоспалительных формах этого дерматологического состояния именно предшествующие заболевания чаще всего обуславливают аномалии пигментации. Для более точного определения лейкодермы и ее дифференциации от некоторых форм лишая используют ультрафиолетовую лампу Вуда.
В спорных случаях могут прибегать к биопсии кожи из очагов пониженной пигментации и ее гистологическому исследованию. В зависимости от формы и причин лейкодермы в очагах могут выявляться признаки воспаления, рубцовая ткань, отек дермы или изменения эпидермиса. В наиболее распространенных случаях депигментации обычно отмечаются аномалии меланоцитов – они либо вовсе отсутствуют, либо имеют структурные изменения (низкое количество меланосом, деформации отростков). При некоторых врожденных формах лейкодермы используют генетические тесты.
Лечение лейкодермы
Терапия лейкодермы сводится к устранению причин, которые привели к нарушению пигментации кожи. При инфекционных формах используют антибиотики, при аутоиммунной патологии применяют иммуносупрессивные и цитостатические средства, при глистных инвазиях назначают противоглистные препараты. При токсической лейкодерме специального лечения может не потребоваться, в некоторых случаях достаточно обеспечить прекращение контакта больного с токсическим веществом. Это возможно путем смены рода деятельности (при работе на химических производствах) или отмены (замены) некоторых лекарственных средств. Сложнее всего поддаются лечению формы лейкодермы, обусловленные наследственными факторами, а также витилиго – при последнем некоторые специалисты практикуют пересадку нормально пигментированной кожи пациента, взятой с другой части тела, на очаги гипохроматоза.
Поддерживающая терапия может значительно улучшить состояние кожных покровов больного и ускорить восстановление нормальной пигментации. Назначают общие и местные формы витаминов А, Е, РР и группы В, витаминно-минеральные комплексы с содержанием цинка и меди. По некоторым данным обогащение рациона тирозином также способствует уменьшению симптомов лейкодермы, поэтому в питании больных должны присутствовать яйца, морепродукты, печень, овсяная и гречневая крупы. Из специфических методик, применяемых в дерматологии, используется ПУВА-терапия – обработка кожных покровов особыми фотоактивными веществами с последующим ультрафиолетовым облучением. Важно учитывать, что некоторые формы лейкодермы реагируют на УФО увеличением степени депигментации, поэтому подобные техники следует назначать с осторожностью.
Прогноз и профилактика лейкодермы
Прогноз лейкодермы относительно жизни пациента всегда благоприятный – данное дерматологическое состояние никогда не создает угрозу летального исхода или тяжелых осложнений, на это способны лишь сопутствующие пороки развития при врожденных формах и синдромах. Относительно выздоровления и восстановления нормальной пигментации кожных покровов прогноз чаще неопределенный даже в случае относительно легких токсигенных форм заболевания. Врожденные и иммунные разновидности лейкодермы, а также витилиго крайне тяжело поддаются лечению. Профилактика включает в себя употребление богатых тирозином продуктов, защиту кожи от ультрафиолетового излучения и избегание контакта с химическими веществами, способными вызвать депигментацию.
Первый МГМУ им. И.М. Сеченова
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы», Москва, Россия, 119071
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы, Москва, Россия, 119071
Роль сывороточно-ликворного соотношения в диагностике нейросифилиса
Журнал: Клиническая дерматология и венерология. 2015;14(6): 44‑49
Первый МГМУ им. И.М. Сеченова
Применяемый в настоящее время в РФ стандартный алгоритм клинико-лабораторного исследования в ряде случаев не позволяет осуществить адекватное обследование пациентов, что препятствует как постановке диагноза нейросифилис, так и назначению эффективной терапии. Цель — оценить эффективность используемых методов клинической лабораторной диагностики и оптимизация постановки адекватного диагноза путем исследования биопроб, полученных от пациентов с подозрением на сифилис нервной системы, с использованием одного из ранее не применявшихся в РФ методов диагностики — изучения сывороточно-ликворного соотношения с помощью ITPA — индекса (Intrathecal Treponema pallidum assay). Материал и методы. 20 пациентов (13 мужчин и 7 женщин) обследованы. Оборудование и тест-системы для определения общих иммуноглобулинов (IgG), для количественного определения концентрации общего белка в спинномозговой жидкости, для определения количества клеток в ликворе, для реакций иммуноферментного анализа, микропреципитации, пассивной гемагглютинации, иммобилизации бледных трепонем, реакции иммунофлюоресценции; подсчет индекса сывороточно-ликворного соотношения. Результаты. В работе представлены результаты лабораторного исследования биопроб (сыворотка и ликвор) пациентов с подозрением на нейросифилис с помощью ITPA-индекса. Проведена сравнительная оценка диагностической эффективности двух методологий при обследовании пациентов: регламентированного и ранее не применяемого в России. Из 20 больных, обследованных с помощью ITPA-индекса, в 8 случаях отмечен высокий коэффициент сывороточно-ликворного соотношения, свидетельствующий о наличии поражения нервной системы. Заключение. Клинико-лабораторные исследования сывороточно-ликворного соотношения в биопробах пациентов с подозрением на нейросифилис продемонстрировали возможность верификации диагноза в случаях дискордантных результатов регламентированных лабораторных и клинических методов обследования.
Первый МГМУ им. И.М. Сеченова
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы», Москва, Россия, 119071
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы, Москва, Россия, 119071
Нейросифилис (НС) — тяжелое, трудно поддающееся лечению заболевание, возникшее в результате инфицирования бледной трепонемой, приводящее к поражению различных отделов центральной и вегетативной нервной системы, результатом которого является значительное снижение качества жизни, инвалидизация и летальный исход, особенно в случаях неполноценного обследования и соответственно неадекватной терапии.
T. pallidum, как известно, обладает способностью проникать практически в любые органы и ткани инфицируемого организма на всех стадиях сифилитического процесса (ранние и поздние формы заболевания) [1, 2]. Вместе с тем поражения нервной системы, вызванные инвазией бледной трепонемы, не являются патогномоничными, т. е. они могут быть вызваны целым рядом причин: соматическими и другими тяжелыми инфекционными заболеваниями, возрастными особенностями пациента, неврологическими расстройствами, травмами головного мозга, неблагоприятными условиями жизни и труда, а также другими факторами.
В последние десятилетия проблема НС приобрела значительную актуальность: отмечается тенденция роста заболеваемости, причем истинная эпидемиологическая ситуация остается неизвестной, что во многом связано с серьезными недостатками в обследовании и ведении пациентов (непроведение люмбальной пункции, применение разноплановых лабораторных и клинических методов исследования), а также организации выявления (учет) пациентов с риском развития НС [3—5].
Следует учесть, что патогенетическая классификация НС основывается главным образом на установлении поражения нервной системы, тогда как классификации заболевания по иммунной реакции организма на внедрение T. pallidum в спинномозговой канал, по сути, не существует.
При постановке диагноза НС необходимо установить причинно-следственную связь между инфицированием бледной трепонемой и формированием заболевания — поражением нервной системы пациента. Это сложная задача реализуется с помощью комплекса лабораторных и клинических, в том числе неврологических, методов диагностики (включая параклинические или инструментальные), а результатом сопоставительного анализа полученных данных является диагноз заболевания.
Используемые с этой целью методы обследования регламентированы Приказами М.З. РФ, МЗ и Департаментами здравоохранения регионов, крупных городов, методическими рекомендациями и инструкциями [6—10].
К сожалению, до настоящего времени в РФ отсутствует единый стандарт обследования и ведения больных НС, а существующие регламентирующие документы не содержат конкретных указаний на участие врачей смежных специальностей (неврологи, психиатры, офтальмологи, оториноларингологи и др.), что значительно затрудняет как постановку диагноза, так и оценку эффективности терапевтических воздействий.
Постановка «лабораторного диагноза» НС, в отличие от других форм сифилитической инфекции, основывается, главным образом, на исследовании спинномозговой жидкости (СМЖ), полученной с помощью люмбальной пункции. Проводят трепонемные тесты, такие как реакции пассивной гемагглютинации (РПГА), иммунофлюоресценции (РИФ), иммобилизации бледных трепонем (РИБТ), иммуноферментный анализ (ИФА); нетрепонемные, такие как реакции микропреципитации (РМП), RPR, VDRL (последняя не регламентирована); определяют уровень белка (протеинархия), цитоз (плеоцитоз).
Однако во многих случаях даже при выполнении всех регламентированных исследований клинико-лабораторное обследование не приводит к однозначному выводу о наличии/отсутствии заболевания, что в свою очередь препятствует назначению адекватной патогенетической и симптоматической терапии.
С целью оценки эффективности используемых методов клинической лабораторной диагностики и оптимизации постановки адекватного диагноза, нами были предприняты научно-прикладные исследования биопроб, полученных от пациентов с подозрением на сифилис нервной системы, с помощью одного из ранее не применявшихся в России методов диагностики — изучения сывороточно-ликворного соотношения с помощью ITPA-индекса (Intrathecal Treponema pallidum assay) [11—13].
Материал и методы
Под нашим наблюдением (филиал «Клиника им. В.Г. Короленко» Московского научно-практического центра дерматовенерологии и косметологии Департамента здравоохранения Москвы) находились 20 пациентов (13 мужчин и 7 женщин). Клинические диагнозы были установлены в отделении сифилидологии: АНС — у 11 (6 женщин и 5 мужчин), НСС — у 7 (1 женщина и 6 мужчин), НС неуточненный — у 2 мужчин. Всем пациентам проведена люмбальная пункция и взята венозная кровь; в клинической диагностической лаборатории исследованы биопробы (СМЖ и сыворотка крови) — патология ликвора, трепонемные и нетрепонемные тесты в количественном варианте (титр и % иммобилизации бледных трепонем) (табл. 1).

Таблица 1. Результаты клинических лабораторных методов исследования биопроб пациентов с нейросифилисом Продолжение табл. 1 Примечание. * — титр указан в табл. 2.
Оборудование и тест-системы
1. Для определения общих иммуноглобулинов (IgG) использовался содержащий систему реагентов для диагностики in vitro набор (кассета) Кобас Интегра IgG IGGT, предназначенный для использования на автоматическом биохимическом анализаторе Кобас Интегра-800 для количественного иммунологического определения человеческого IgG в сыворотке и плазме (тест IGGT, 0−276) и цереброспинальной жидкости (тест IGGTC, 0−476). Производитель прибора и реагентов — «Roche Diagnostics GmbН» (Германия). Нормативные результаты: сыворотка 7—16 г/л, цереброспинальная жидкость 6,3—33,5 мг/л.
2. Для количественного определения концентрации общего белка в СМЖ использовали набор Кобас Интегра Total Protein Urine/CSF (TPC-2, 0−523). Колориметрический метод с использованием пирогаллового красного. Производитель прибора и реагентов — «Roche Diagnostics GmbH» (Германия). Нормативные результаты: спинномозговая жидкость 150—450 мг/л. Норма: не выше 0,33 г/л.
3. Для определения количества клеток в ликворе (цитоз) использовали набор реагентов для анализа СМЖ Клиника-СМЖ. Производитель — ЗАО «Эколаб» (Россия). Норма: до 5—8 клеток/мкл.
4. Для ИФА использовался набор реагентов Рекомбибест антипаллидум суммарные антитела (комплект № 2) Д-1856. Производитель — «Вектор БЕСТ» (Россия). Исследования проводились с помощью прибора Sirio S (Италия).
5. Для РМП использовались реактивы Люис-тест L-331, производства России (ООО НПО «Диагностические системы», Нижний Новгород).
6. Для РПГА использовались наборы Сифилис –РПГА-тест комплект № 1 (производитель ЗАО «Эколаб», Россия).
7. Для РИБТ использовали антиген (кролика), сыворотку (человека и морской свинки), комплимент.
8. Для РИФ использовали антиген (кролика), сыворотку (человека) и краситель — флюрохром.
Пробы всех больных (n=20), обследовавшихся стандартными методами, были подвергнуты дополнительным исследованиям: определен уровень общих иммуноглобулинов G (IgG) как в ликворе, так и в сыворотке, а также установлен титр IgG в РПГА (табл. 2). Подсчет индекса сывороточно-ликворного соотношения производился по формуле:

Таблица 2. Результаты сывороточно-ликворного соотношения у пациентов с нейросифилисом (ITPA-индекс) Примечание. * — ITPA-индекс соответствует сифилису с поражением нервной системы (НС).
Результаты
Анализ результатов клинических лабораторных исследований (см. табл. 1) продемонстрировал следующее.
У пациентов с АНС (n=11) обнаружено:
• повышение уровня белка — протеинархия (n=2);
• плеоцитоз (n=2);
• РМП: отрицательна (n=9), 3+ (n=1), 4+ (n=1);
• РИБТ (РИТ) — отрицательная (n=1), у остальных процент иммобилизации трепонем колебался от 42 до 54;
У пациентов с НСС (n=7) обнаружено:
• патологии ликвора не отмечено у 6 больных;
• у одного — протеинархия и плеоцитоз, однако в пробе имеется примесь крови;
• РМП — отрицательна у 4 пациентов, положительная — у 3 (2+, 3+, 4+);
• процент иммобилизации трепонем в ликворе составил 42—54.
У пациентов с НС неуточненный (2 больных) патологии ликвора не выявлено:
• РМП – положительна (3+ и 4+);
• процент иммобилизации трепонем в РИБТ колебался в 50—52.
Во всех пробах ликвора РПГА, РИФ, ИФА были положительными (см. табл. 1).
В сыворотке этих пациентов установлено следующее:
— у всех 20 пациентов РМП была положительная: 2+, 3+, 4+; положительными были также специфические трепонемные тесты (РПГА, РИФ, ИФА).
— процент иммобилизации при РИБТ у 12 обследуемых составил около 60%, у 8 — выше 60%, из них у 3 колебался от 75 до 82%. Это свидетельствует о том, что у этих лиц с помощью лабораторных методов исследования подтвердился диагноз «сифилис».
Из 20 больных, обследованных с помощью ITPA-индекса, у 8 (4 человека — НС; 2 — НСС; 2 — НС неуточненный) отмечен высокий коэффициент сывороточно-ликворного соотношения (21,4—102,9), свидетельствующий о поражении нервной системы [11—13]. Количество пациентов с высоким ITPA-индексом, вероятно, могло бы быть большим с учетом 2 больных НСС из 6, которые находятся на контроле после лечения (см. табл. 2).
Проведенные комплексные сопоставительные клинико-лабораторные исследования показали, что у большинства пациентов с клиническим диагнозом НС (АНС, НСС, НС неуточненный) отсутствует патология ликвора, у 12 из 20 пациентов отмечена отрицательная РМП, а процент иммобилизации трепонем колебался в пределах 54%.
Таким образом, основным критерием постановки «лабораторного диагноза» у этих больных является положительный результат специфических трепонемных тестов (РПГА, ИФА, РИФ). Аналогичные результаты были нами получены и в предыдущих исследованиях [14], выполненных на значительном фактическом материале: пробы от 28 больных НС.
Однако на основании лишь положительных результатов трепонемных тестов, при отсутствии патологии ликвора, отрицательных значений нетрепонемных тестов, а также РИТ (низкий процент иммобилизации), весьма проблематично подтвердить клинический диагноз, особенно в случаях НС без симптомов, т. е. фактически без каких-либо проявлений поражения нервной системы (АНС и НС неуточненный), которые в свою очередь не являются строго специфичными для Н.С. Необходимо также учитывать следующее: положительные результаты трепонемных тестов могут объясняться транзиторным (пассивным) проникновением компартментов T. pallidum через поврежденный гематоэнцефалический барьер (ГЭБ) в спинномозговой канал, а также длительным (месяцы и годы) отсутствием негативации трепонемных тестов даже после полноценной терапии.
В таких случаях (далеко не редких) следует, на наш взгляд, предпринять дополнительные, не регламентированные в настоящее время в РФ исследования, позволяющие верифицировать Н.С. За рубежом с целью оптимизации клинико-лабораторной диагностики этого заболевания применяется ряд подходов, часть из которых, по мнению известных специалистов, позволяет дифференцировать НС от поражения центральной нервной системы, вызванного причинами, не связанными с инвазией бледной трепонемы. Одним из них является концепция сывороточно-ликворного соотношения (ITPA-индекс) при ряде заболеваний нервной системы.
Изучение сывороточно-ликворного соотношения пациентов с подозрением на НС базируется на том, что при сифилисе без специфического поражения центральной нервной системы соотношение трепонемных и общих иммуноглобулинов G (IgG) одинаково (равно 1), тогда как у пациентов с неврологической симптоматикой, опосредованной сифилитической инфекцией (НС), оно меняется в сторону увеличения: до 2 при неясной симптоматике, не всегда обусловленной инвазией бледной трепонемы и более 2 (3 и выше) — связанной с Н.С. Такое положение, как известно, обусловлено локальной продукцией трепонемных антител (IgG) непосредственно в спинномозговом канале, т. е. в центральной нервной системе.
За рубежом и у нас в стране постепенно накапливаются сведения о возможности использования ITPA-индекса с целью установления интратекального синтеза трепонемного антительного ответа при НС [11—14].
Считаем, что такой подход при подтверждении его эффективности может иметь не только теоретическое, но и практическое применение, тем более что реализация этой методологии не требует сколько-нибудь значительных организационных усилий и финансовых затрат.
Заключение
Клинико-лабораторные исследования сывороточно-ликворного соотношения в биопробах пациентов с подозрением на НС, проводимые в Московском научно-практическом центре дерматовенерологии и косметологии Департамента здравоохранения Москвы продемонстрировали возможность верификации диагноза в случаях дискордантных результатов регламентированных лабораторных и клинических методов обследования. С целью получения достоверных результатов, базирующихся на принципах доказательной медицины, планируется продолжение широкомасштабных исследований эффективности различных методологий, что, вероятно, позволит оптимизировать диагностику такого тяжелого заболевания как НС.
Читайте также:

