Какие антибиотики при склеродермии
Обновлено: 28.04.2024
Так как причины, вызывающие системную склеродермию, в полной мере не изучены, то и специфической профилактики ее нет.
Важно убрать факторы, ее провоцирующие, и стараться:
- избегать переохлаждения и длительного воздействия холода на пальцы;
- не перегреваться, избегать длительного нахождения на солнце;
- отказаться о курения,
- помнить о вреде пассивного курения;
- избегать травм пальцев;
- уходить от стрессов;
- избегать производственных вредностей (вибрации, паров растворителей, контакта с вредными веществами);
- ограничить взаимодействие с бытовыми чистящими средствами;
- питаться правильно и разнообразно здоровой и качественной пищей, не включать в рацион пряные, острые и холодные продукты;
- помнить о пользе закаливания и тренировке сосудов контрастным душем
Если человек уже болен системной склеродермией, не стоит отчаиваться. Лечение – сложный и длительный процесс, требуется терпение и добросовестность в выполнении всех рекомендаций специалиста. Если соблюдать все советы, если тщательно следовать схеме терапии, если не запускать болезнь, то можно поддерживать организм в нормальном состоянии. Да и медицина не стоит на месте, а развивается огромными шагами. Вполне вероятно, что скоро будет открыто средство, которое сможет бороться с этим недугом.
Ответы на наиболее задаваемые вопросы страдающих системной склеродермией
Заразиться этой патологией нельзя, так как при ССД происходит сбой работы иммунитета и клеток, ответственных за образование коллагеновых волокон. Что именно является триггером пока не совсем ясно, но точно известно, в основе болезни лежит генетическая предрасположенность. За счет каких-то пока неизвестных точно факторов, ген мутирует, активизируется, провоцирует появление специфического белка, который воспринимается организмом как чуждая структура и атаковывается.
Недуг не считается наследственной патологией, но предрасположенность на генном уровне играет роль в появлении заболевания. Согласно медстатистики большинство больных имеют здоровых детей.
Соблюдение постельного и полупостельного режима становится важным и нужным при тяжелых проявлениях болезни, при поражении внутренних органов. В этих ситуациях даже легкая физическая нагрузка может спровоцировать ухудшение. В остальных случаях пациент не должен уменьшать физическую активность, мало того, врачи, наоборот, советуют больше двигаться, регулярно выполнять лечебную физкультуру, больше проводить времени на свежем воздухе (если температура позволяет). Мышцы необходимо нагружать, суставы должны работать, а при отсутствии движения болезнь будет быстрее прогрессировать.
При склеродермии часто поражаются слизистые. Они становятся сухими. Изменения касаются и носовой полости. Клинически это проявляется атрофическим ринитом. Сопутствующее утолщение уздечки языка, фарингит усугубляют катар верхних дыхательных путей.
Нет. Однозначности в этом вопросе нет. Есть люди, у которых возникают периодические проявления феномена, и они не приводят к поражению кожи. Но в этом случае все равно стоит обратиться к ревматологу, чтобы обследовать пальцы на предмет выявления сосудистых изменений и исключить склеродермию. В любом случае, надо сделать несколько визитов к врачу на протяжении нескольких лет (месяцев), чтобы он видел течение в динамике.
Беременность возможна. Склеродермия не является прямым противопоказанием для зачатия и рождения ребенка. Хорошие шансы выносить ребенка у больной без выраженных изменений со стороны других органов на начальных стадиях болезни. Но беременность может серьезно обострить течение болезни, так как происходит серьезный гормональный взрыв, и это уже может грозить существенным риском и для самой женщины, и для плода. Особенно сложный второй период беременности. На поздних сроках возможны преждевременные роды и мертворождение. Поэтому планирование беременности должно быть обязательно согласовано с лечащим врачом. Специалист откорректирует схему терапии, будет регулярно наблюдать за пациенткой в течение всего срока, а при необходимости предложит госпитализацию.
Сосуды реагируют не только на холод, но и на высокую температуру. Во время болезни сосуды становятся особенно уязвимыми, поэтому парные, сауны, горячие ванны необходимо исключить.
Бассейн посещать можно, если вода в нем не будет холодной, если в помещении не будет сквозняков, если после принятия душа, тщательно вытирать кожу полотенцем и не допускать переохлаждения.
В летнее время не стоит планировать отдых на море. Лучше выбирать сезон, когда солнечная активность не такая сильная. Купаться можно только, если температура воды теплая и находиться в ней не больше получаса. После выхода из воды надо сразу вытираться и смазывать кожу специальным защитным средством. Загорать нельзя, следует находиться в тени.
Специальной диеты при ССД нет. Но скорректировав свой рацион можно добиться улучшения состояния. Питание должно быть разнообразным, количество калорий не уменьшается. Следует ограничить острые и раздражающие продукты, отказаться от перца и жгучих приправ, ограничить употребление крепкого кофе, алкоголя и газированных напитков. В связи со снижением перистальтики, быстрого чувства насыщения и ощущения переполненности желудка, при явлениях дисфагии (затрудненного глотания) прием пищи должен быть частым и небольшими порциями, еда - теплой и мягкой (протертой или в виде пюре). Твердую пищу надо запивать водой.
Рождение ребенка со склеродермией возможно, но встречается очень редко. Малыш отстает в физическом развитии от своих сверстников, часто болеет.
Кожа вовремя болезни становится сухой и легкоранимой. За ней надо усиленно ухаживать и защищать ее:
- мыть руки теплой водой жидким мылом, содержащим смягчители или крем;
- несколько раз в день использовать кремы для рук и ног с ланолином;
- во время маникюра не обрабатывайте кутикулы ножницами, аккуратно смягчайте их другим способом;
- мыть посуду в резиновых перчатках;
- при игре на пианино или гитаре, вязании, печатании быть внимательным, быстрые движения могут травмировать уязвимые концы пальцев;
- регулярно делать гимнастику для пальцев;
Нет, нельзя! Курение вредно для любого человека, но для страдающего склеродермией, оно абсолютно противопоказано! Никотин сужает сосуды, вызывает новые атаки, ухудшает течение болезни, способствует возникновению серьезных осложнений. Мало того, лекарства не работают, если в это же время продолжать курить. Причем вредно и пассивное курение.
К сожалению, на сегодняшний день, врачи не могут вылечить болезнь. Это хроническая патология, которая длится многие годы. Но подавить ее активность, уменьшить скорость прогрессирования все-таки можно. Эффект лечения зависит от целеустремленности пациента, его настойчивости и добросовестном выполнении всех назначений врача. Врача необходимо посещать минимум 1 раз в 6 месяцев даже в состоянии ремиссии.
Изменение образа жизни при склеродермии
При правильном подходе к терапии болезни можно избежать опасных осложнений и жить полноценно, ограничивая себя только в некоторых моментах.
- Оберегать открытые участки тела от холода (особенно руки, уши и лицо). Пальцы ног являются тоже уязвимыми, поэтому ноги должны находиться в тепле, зимой – в шерстяных носках, а обувь не должна быть узкой, выбирать зимние сапоги (туфли) надо с широким мыском. Осенью и весной носить перчатки. Вместо перчаток зимой лучше использовать варежки, в этом случае пальцы будут дольше сохранять тепло. Часть лица и уши в прохладное время надо закрывать теплым шарфом.
- Надевать рукавицы даже вытаскивая продукты из холодильника.
- Если руль автомобиля без подогрева, то надо пользоваться теплыми меховыми покрытиями для него.
- Избегать кондиционеров, прямых лучей солнца и перепадов температуры. Под рукой всегда должна быть безрукавка, шаль или джемпер, если помещение холодное, ими можно воспользоваться.
- Не купаться в холодных водоемах, посещать бассейн только с теплой водой;
- Не мыть фрукты/овощи холодной водой, не погружать кисти в прохладную воду.
- Летом носить шляпы с широкими полями или бейсболки с длинными козырьками.
- Категорично отказаться от вредных привычек и особенно от курения. Не находиться рядом с активными курильщиками, пассивное курение также является ядом для организма.
- Принимать пищу небольшими порциями, в пюреобразном состоянии (при дисфагии), в теплом виде. Избегать горячего, холодного, раздражающего, острого, кофе, пряных напитков и маринадов. Исключить газированные напитки и алкоголь. Выпечку ограничить (особенно во время гормонотерапии)
- Не ложиться спать в холодную постель. Необходимо предварительно ее согреть грелкой или электрическим одеялом. Если ноги мерзнут, надевать носки перед сном.
- Наполнять ванну теплой водой и закрывать дверь, когда моетесь, чтобы температура в ванной комнате не падала.
Профилактика склеродермии на сегодняшний день сводится к здоровому образу жизни и к избеганию факторов внешней среды, которые могут спровоцировать этот опасный недуг.
ДЛЯ СВЯЗИ С НАМИ
Чтобы получить полную информацию о видах лечения и профилактике заболеваний ортопедии, ревматологии или неврологии, пожалуйста, обратитесь к нам:

Наш адрес - г. Москва, ул. Трифоновская 11
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия
МНПЦДК Департамент здравоохранения Москвы;
Первый МГМУ им. И.М. Сеченова
Оценка эффективности топической терапии Такролимусом при очаговой склеродермии у взрослых с помощью индекса mLoSSI
Журнал: Клиническая дерматология и венерология. 2013;11(6): 46‑51
Потекаев Н.Н., Вавилов В.В. Оценка эффективности топической терапии Такролимусом при очаговой склеродермии у взрослых с помощью индекса mLoSSI. Клиническая дерматология и венерология. 2013;11(6):46‑51.
Potekaev NN, Vavilov VV. Tacrolimus 0,1% topical treatment outcome measurement in patients with morphea using mLoSSI tool. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(6):46‑51. (In Russ.).
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия
МНПЦДК Департамент здравоохранения Москвы;
Первый МГМУ им. И.М. Сеченова
В настоящее время отсутствуют четкие рекомендации по лечению пациентов с очаговой склеродермией. В Российской Федерации в большинстве случаев при любой форме данного заболевания назначают пенициллинотерапию, а также внутримышечное введение ферментативных препаратов. Ни для одного из данных вариантов лечения нет доказательной базы, подтверждающей эффективность данных методов терапии при очаговой склеродермии, поскольку клинические исследования для них не проводились. В большинстве случаев курс лечения оказывается недостаточно эффективным для стабилизации процесса, и пациентам требуются дополнительные госпитализации. Учитывая, что заболевание чаще поражает лиц трудоспособного возраста, данный вариант лечения снижает качество жизни пациентов и оказывается экономически неэффективным.
В небольшом двойном слепом плацебо-контролируемом исследовании, проведенном в 2009 г., доказана эффективность 0,1% Такролимуса, применяемого наружно в форме мази у пациентов с бляшечной формой очаговой склеродермии. Авторами продемонстрировано достоверное уменьшение плотности очагов, нарушений пигментации, индурации, эритемы, телеангиэктазий и атрофии при применении препарата в течение 12 нед [1].
Такролимус представляет собой макроциклический лактон, ингибирующий фосфатазу кальцинейрина, а также MAP-киназы JNK и p38, таким образом препятствуя задержке T-клеток в G0-фазе за счет активации ядерных транскрипционных факторов NFAT и AP-1. В результате происходит снижение провоспалительных сигнальных молекул и достигается иммуносупрессивный эффект [2—4]. Учитывая повышение экспрессии генов транскрипционных факторов AP-1 у пациентов с очаговой склеродермией, можно предположить, что лечебный эффект Такролимуса связан с его ингибирующим воздействием на сигнальные пути AP-1, и, как следствие, — снижение отложения экстрацеллюлярного матрикса и воспаления [5]. В связи с этим перспективно дальнейшее изучение механизмов действия препарата на молекулярно-биологическом уровне.
Цель настоящего исследования — оценка эффективности препарата Такролимус 0,1% у пациентов с очаговой склеродермией с точки зрения изменения тяжести течения процесса. В качестве инструмента для оценки качества лечения был выбран индекс активности очаговой склеродермии mLoSSI. Данная специфичная для очаговой склеродермии оценочная система была недавно одобрена Научной Группой по Клиническому и Ультразвуковому Изучению Очаговой Склеродермии LOCUS [6]. Индекс позволяет оценить эритему кожи, инфильтрацию в пределах очагов и появление новых новообразований по шкале от 0 до 3 баллов в каждой из 18 анатомических областей. Метод был оценен с учетом поверхности поражения и без таковой. Оценка пораженной площади приводила к низкой межэкспертной и интраэкспертной надежности и низкой чувствительности к изменениям и была исключена из метода, в результате чего был сформирован модифицированный индекс mLoSSI [7]. Модификация индекса mLoSSI обладает межэкспертной надежностью 0,7 и внутриэкспертной надежностью 0,77 [7].
Материал и методы

Проведено пилотное открытое несравнительное исследование клинической эффективности мази Такролимус 0,1% у больных с бляшечной формой очаговой склеродермии. В нем участвовали 18 пациентов (12 женщин, 6 мужчин) в возрасте 25—65 лет, получавшие лечение препаратом Такролимус 0,1% наружно в течение 12 нед. У всех пациентов отмечались разные локализации очагов поражения и клинические стадии формирования бляшек: у 8 пациентов наблюдались очаги на стадии формирования эритематозного пятна с венчиком роста по периферии, у 3 — выраженная индурация бляшки, у 3 — атрофия разной степени выраженности в сочетании с венчиком роста. У 2 мужчин отмечались поражения гениталий с явлениями склероза, у 2 — сочетание разных клинических стадий формирования бляшки. Тяжесть поражения определялась согласно клинической классификации Tuffanelli и Winkelmann: у 5 пациентов отмечалась распространенная форма заболевания, у 13 — ограниченная [8]. Характеристика пациентов, получавших терапию Такролимусом 0,1%, представлена в табл. 1.
Критериями невключения в исследование были злокачественные новообразования и предраковые заболевания кожи в анамнезе и на момент осмотра. Всем пациентам проводилось предварительное исследование иммунного статуса для исключения иммунодефицита. Критериями исключения из исследования считали появление нежелательных явлений, связанных с терапией, несоблюдение режима терапии.
До начала наружной терапии Такролимусом лечение получали 7 пациентов. Ранее 6 человек получали по 1 курсу базовой терапии пенициллином (симптоматика сохранялась, была необходимость в повторной госпитализации). Одной пациентке проведено 5 курсов пенициллинотерапии и 1 курс тимодепрессином (без эффекта).
Пациенты были включены в исследование после получения письменного добровольного информированного согласия на участие в исследовании.
Больные 2 раза в сутки наносили мазь Такролимус 0,1% на пораженные участки. Контроль лечения осуществлялся каждые 4 нед.

Клиническую эффективность оценивали на основании индекса активности очаговой склеродермии (mLoSSI), включающего следующие показатели: изменение размеров очага, эритему и толщину ткани для 18 анатомических участков (табл. 2). Данный испытанный и достоверный полуколичественный метод доступен для рутинных клинических исследований и не требует сложной аппаратуры. Потенциальная погрешность в данной методике заключалась в возможной неверной интерпретации роста очага за последний месяц на момент первичного визита, поскольку данный показатель подтверждался только анамнестической информацией от пациента. Во время следующих визитов увеличение очага объективно оценивалось путем измерения бляшки.
Ответ на лечение определялся как исчезновение эритемы и/или снижение толщины ткани, отсутствие роста старых очагов и появление новых. Диаметр бляшек измеряли с помощью линейки, во время повторных визитов выполнялись фотоснимки для контроля.
Неудовлетворительным результатом считали отсутствие уменьшения эритемы и толщины очага.
Исследование одобрено локальным этическим комитетом МНПЦДК Департамента здравоохранения Москвы.
Оценка снижения индекса активности очаговой склеродермии mLoSSI, а также отдельно изменений индексов эритемы и толщины очага на момент посещения для 4 разных временных отметок (первичный визит, повторные посещения через 4, 8 и 12 нед) проводилась с помощью непараметрического метода Фридмана. Статистический анализ данных осуществлялся с помощью программы SPSS v.21. Метод Фридмана применялся в связи с небольшим количеством испытуемых, а также поскольку нельзя было подтвердить допущение о нормальности распределения. Достоверными считались различия при pрисунках и в таблицах представлены среднеарифметические значения показателей, в качестве разброса экспериментальных данных указаны среднеквадратичные отклонения.
Результаты
Клиническая оценка эффективности терапии мазью Такролимус 0,1% осуществлялась с помощью индекса активности очаговой склеродермии, измерявшегося до лечения, в процессе и после его окончания. Все пациенты завершили полный курс лечения и не пропустили ни одного контрольного визита.
При оценке изменения отдельных составляющих индекса активности с помощью метода Фридмана установлено, что у пациентов, получавших терапию Такролимусом, на фоне лечения достоверно снижалась выраженность эритемы (χ 2 =40,083; ррис. 2). Рисунок 2. Снижение показателя эритемы на фоне терапии Такролимусом в течение 12 нед. При проведении апостериорного анализа методом Вилкоксона выявлено, что статистически достоверное снижение эритемы у больных наблюдалось в течение 3 последних недель терапии (р=0,001) (табл. 4). Полное исчезновение эритемы наблюдалось у 7 пациентов, отсутствие эффекта от лечения и сохранение прежнего уровня гиперемии при этом отмечалось у 2 пациенток с генерализованной формой очаговой склеродермии, которые впоследствии были переведены на стационарное лечение для проведения системной терапии.
При оценке изменения степени инфильтрации бляшки методом Фридмана также выявлено статистически достоверное снижение данного показателя (χ 2 =40,083; р<0,001) (рис. 3). Рисунок 3. Снижение показателя инфильтрации на фоне терапии Такролимусом в течение 12 нед. Тем не менее апостериорный анализ с критическим уровнем значимости 0,0125 показал, что достоверные различия в степени инфильтрации пораженных участков на момент промежуточных контрольных визитов отсутствовали, достоверно отличались показатели на 1-й и последней неделе лечения (табл. 5). Полного регресса склероза и инфильтрации в очагах удалось достичь у 5 пациентов. У 4 пациентов отсутствовали изменения данного показателя на протяжении всего курса лечения.
Обобщая данные, полученные в результате зарубежных исследований, можно заключить, что наружное применение препарата Такролимус является перспективным методом лечения, влияющим на патогенетические механизмы данного заболевания. Данный метод является экономически эффективным, а также способствует большей социальной адаптации пациентов, поскольку для проведения курсов терапии им не требуются неоднократные госпитализации. Кроме того, блокаторы кальциневрина не обладают побочными эффектами стероидных мазей и могут применяться длительно. Важным аспектом в выборе данного препарата является ингибирующее влияние на систему транскрипционных факторов АР-1.
В проведенном исследовании с использованием мази Такролимус 0,1% продемонстрированы хорошая переносимость и эффективность данного препарата у пациентов с очаговой склеродермией. Выбор препарата основывался на ингибирующем характере действия данного ингибитора кальциневрина на компоненты системы AP-1. Пациенты в течение 12 нед наносили препарат на пораженные участки кожи 2 раза в сутки с контролем течения процесса каждые 4 нед.
В настоящее время проведено единственное небольшое плацебо-контролируемое исследование с доказанной эффективностью данного препарата у больных с бляшечной формой очаговой склеродермии [1]. В исследовании участвовали 10 пациентов с 2 очагами поражения и более, расположенными на расстоянии 15 см друг от друга. На одну из бляшек в течение 12 нед наносили Такролимус, на другую — вазелин. Эффективность лечения оценивали по площади поражения, показателям дурометрии, а также изменениям шкалы клинических проявлений (нарушение пигментации, индурация, эритема, телеангиэктазии и атрофия) со статистически достоверным регрессом данных показателей. Несмотря на то что данное исследование не было рандомизированным плацебо-контролируемым, в отличие от работы E. Kroft и соавт. [1] было продемонстрировано достоверное снижение выраженности клинической симптоматики, кроме того, отсутствовало обострение процесса в процессе лечения в виде появления новых очагов и усиления роста имеющихся бляшек. Полученные данные не противоречили результатам, продемонстрированным E. Kroft и соавт. [1]. В отличие от исследования E. Kroft в данной работе в качестве контроля эффективности применялся индекс mLoSSI, позволяющий в целом судить о степени активности склеродермического процесса.
На фоне применения препарата Такролимус 0,1% отмечалось достоверное снижение степени активности очаговой склеродермии на каждой неделе между контрольными визитами. У 61% испытуемых отмечалось снижение индекса mLoSSI более чем на 75%. Наилучший эффект отмечался у пациентов с бляшками в эритематозной стадии с регрессом индекса активности до 0, наименьший — у пациентов с генерализованной формой очаговой склеродермии, которые впоследствии были переведены на стационарное лечение. У одной пациентки с генерализованными очагами поражения показатель активности процесса сохранялся неизмененным при каждом контрольном визите, в связи с чем она была переведена на терапию циклоспорином А. Сохранение низких величин mLoSSI было чаще всего связано со склеротическими изменениями ткани и инфильтрацией в очаге.
Также оценивались отдельные показатели, формирующие индекс активности mLoSSI. Так, продемонстрировано статистически достоверное снижение выраженности эритемы на фоне применения Такролимуса 0,1%, что соответствовало данным E. Kroft. Достоверное снижение наблюдалось со 2-го месяца лечения и продолжалось до окончания курса. Полного регресса эритемы удалось достичь у 7 пациентов, при этом лучший эффект отмечался на ранних стадиях формирования бляшек. Несмотря на снижение выраженности инфильтрации по окончании курса терапии, достоверное снижение данного показателя наблюдалось лишь в течение последнего месяца лечения, что свидетельствует о возможном увеличении длительности лечения пациентов для получения более выраженного уменьшения плотности очага.
В проведенном исследовании мы не определяли процентное изменение показателя mLoSSI, а оценивали достоверность разницы между суммарными значениями индекса на момент контрольных визитов. Основными ограничениями были небольшое количество вовлеченных пациентов, недостаток контроля, отсутствие группы контроля или сравнительного лечения. Тем не менее наблюдался выраженный положительный ответ на проводимое лечение и отсутствие обострения в процессе применения Такролимуса. В настоящее время недостаточно проведенных крупных многоцентровых проспективных клинических исследований по лечению очаговой склеродермии, поэтому продемонстрированная статистически значимая эффективность наружного лечения Такролимуса позволяет предположить возможность применения Такролимуса наружно в качестве протокола для таких исследований в дальнейшем.
Выводы
Наружное применение мази Такролимуса 0,1% достоверно снижает активность склеродермии у пациентов с ограниченными формами, при этом полная ремиссия наблюдается у больных с эритематозной стадией формирования бляшек.
Очаговая склеродермия – это хроническое заболевание соединительной ткани, характеризующееся преимущественным поражением кожных покровов. Клинически проявляется уплотнением (индурацией) различных участков кожи с последующей атрофией и изменением пигментации, образованием контрактур. Диагноз ставится на основании симптоматики, обнаружения в крови антинуклеарного фактора и антицентромерных антител. В сомнительных случаях проводится гистологическое исследование кожи. Лечение заключается в применении глюкокортикостероидов, иммунодепрессантов, антифиброзных средств, блокаторов кальциевых каналов и проведении ПУВА-терапии. В ряде случаев выполняются хирургические операции.
МКБ-10
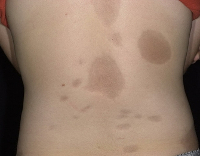
Общие сведения
Очаговая (локализованная, ограниченная) склеродермия – хроническое аутоиммунное заболевание из группы диффузных болезней соединительной ткани. Патология встречается повсеместно, распространенность составляет от 0,3 до 3 случаев на 100 000 человек. Чаще страдают женщины европеоидной расы. Возраст манифестации очаговой склеродермии зависит от формы. Бляшечная склеродермия чаще встречается у взрослых (30-40 лет), линейная - у детей от 2 до 14 лет, склероатрофический лихен – у женщин старше 50 лет. При локализованной форме, в отличие от системной, поражение внутренних органов в большинстве случаев либо минимально, либо отсутствует. Имеется ассоциация склеродермии с патологиями щитовидной железы (тиреоидитом Хашимото, болезнью де Кервена).

Причины
Точная причина заболевания неизвестна. Предполагается этиологическая роль бактерии Borrelia burgdorferi, вызывающей лайм-боррелиоз, однако убедительных данных за эту теорию на сегодняшний день нет. В развитии склеродермии важную роль играет наследственная предрасположенность. Были выявлены более частые случаи очаговой склеродермии среди близких родственников. При проведении генетических исследований обнаружена взаимосвязь между определенными генами гистосовместимости (HLA – DR1, DR4) и локализованной формой заболевания. Провоцирующими факторами, способствующими возникновению склеродермии, являются переохлаждения, травмы, постоянные вибрационные воздействия на кожу, прием лекарственных препаратов (блеомицина). Триггерными эффектами также обладают различные химические соединения (хлорвинил, кремний, нефтепродукты, сицилий, эпоксидная смола, пестициды, органические растворители).
Патогенез
Выделяют три основных патогенетических механизма склеродермии – фиброз (разрастание соединительной ткани), аутоиммунное повреждение и сосудистые нарушения. Иммунная аутоагрессия заключается в выработке лимфоцитами антител к соединительной ткани и ее компонентам. Также лимфоциты синтезируют интерлейкины, которые стимулируют пролиферацию фибробластов, гладкомышечных клеток и образование коллагена. Разрастающаяся при этом соединительная ткань замещает нормально функционирующую ткань. В результате повреждения эндотелия сосудов антителами и пролиферирующими гладкомышечными клетками снижается уровень простациклина (вещества, обладающего антиагрегантными и вазодилатирующими свойствами). Это приводит к спазму микрососудов, повышению адгезии и агрегации форменных элементов крови, внутрисосудистой коагуляции и микротромбозу.
Классификация
Очаговая склеродермия подразделяется на множество форм. Наиболее распространенными являются бляшечная и линейная. У ряда пациентов могут наблюдаться одновременно несколько вариантов заболевания. Существует целый ряд классификаций, но наиболее оптимальной и широко используемой считается классификация клиники Мэйо, включающей следующие разновидности очаговой склеродермии:
- Бляшечная. Данная форма в свою очередь подразделяется на поверхностную (морфеа) и узловатую (келоидоподобную). Характерны типичные участки уплотнения кожи с атрофией и нарушением пигментации.
- Линейная. К ней относятся полосовидная, саблевидная формы, а также прогрессирующая гемиатрофия лица Парри-Ромберга. Очаги располагаются в виде линий по ходу сосудисто-нервного пучка.
- Генерализованная (многоочаговая). Проявляется сочетанием бляшечного и линейного вариантов. Очаги распространены по всему телу.
- Буллезная. При данной разновидности на коже возникают пузыри с жидкостным содержимым, оставляющие после себя эрозии.
- Пансклеротическая инвалидизирующая. Наиболее неблагоприятная форма очаговой склеродермии. Характеризуется тяжелым, прогрессирующим течением, плохо поддается лечению. Поражаются все слои кожи и ткани, лежащие под ней. Развиваются грубые контрактуры суставов и длительно незаживающие язвы на коже.
- Склероатрофический лихен Цумбуша (болезнь белых пятен). Характерно образование пятен белого цвета, сопровождающихся нестерпимым зудом. Преимущественная локализация пятен – половые органы.
Симптомы
Для клинической картины типично образование на коже очагов, которые проходят три последовательных стадий развития – отек, индурацию (уплотнение) и атрофию. В начале заболевания на коже конечностей, шеи или туловища появляются пятна сиреневого или лилового цвета, имеющие нечеткие края. Размер пятен может сильно варьировать – от просяного зерна до размеров ладони и больше. На этом этапе пациент не испытывает каких-либо неприятных ощущений или боли. Затем пятна начинают отекать, кожа в центре очага уплотняется, становится блестящей, приобретает цвет слоновой кости. Пациент начинает ощущать зуд, покалывания, стянутость кожи, болезненность. Далее наступает стадия атрофии. Кожа в очагах истончается, прекращается рост волос, нарушается потоотделение, возникает стойкая дисхромия (гипер- или депигментация) и телеангиэктазии. Иногда развивается атрофодермия (участки западения кожи).
При линейной склеродермии очаги расположены по ходу нервов и сосудов. В случае локализации на коже лица очаги по внешнему виду напоминают рубец от удара саблей (саблевидная форма). Прогрессирующая гемиатрофия представляет собой глубокий процесс с поражением всех тканей половины лица - кожи, подкожной клетчатки, мышц и костей лицевого скелета, что приводит к выраженной деформации лица, обезображивающей внешний вид пациента. Также происходит атрофия половины языка и снижение вкусовой чувствительности.
Из внекожных признаков очаговой склеродермии стоит отметить офтальмологические и неврологические проявления при гемиатрофии Парри-Ромберга. Они включают выпадение ресниц и бровей на стороне поражения, западение глазного яблока из-за атрофии глазных мышц и орбитальной клетчатки, нейропаралитический кератит, головокружения, когнитивные нарушения, мигренозные головные боли, эпилептические припадки. Также возможно развитие феномена Рейно. Симптомы синдрома Рейно следующие – стадийное изменение окраски кожи пальцев рук вследствие вазоспазма и последующей гиперемии (бледность, цианоз, покраснение), сопровождающееся онемением, болью и покалыванием в пальцах рук. Остальные экстрадермальные проявления, характерные для системной склеродермии, встречаются крайне редко.
Осложнения
Наиболее распространенная проблема рассматриваемого заболевания – косметические дефекты. Серьезные осложнения, представляющие угрозу для жизни больного, возникают редко. К ним относятся нарушение мозгового кровообращения при гемиатрофии лица, ишемия и гангрена пальцев рук при феномене Рейно, выраженные контрактуры суставов, инвалидизирующие пациента. Через несколько лет после дебюта болезни могут развиться тяжелые поражения внутренних органов – фиброз легких, легочная гипертензия, фиброз миокарда, перикардит, стриктуры пищевода, острая нефропатия, почечная недостаточность.
Диагностика
Пациентов с очаговой склеродермией курируют врачи ревматологи и дерматологи. При постановке диагноза учитывается клиническая картина, семейный анамнез. Все методы диагностики направлены в первую очередь на определение степени вовлечения внутренних органов и исключение системной склеродермии. С этой целью применяются следующие исследования:
- Лабораторные. В анализах крови выявляются эозинофилия, повышение уровня ревматоидного фактора, гаммаглобулинов, высокие титры антицентромерных антител и антинуклеарного фактора (АНФ). Наличие антител к топоизомеразе (анти-Scl 70) свидетельствует в пользу системного процесса. При развитии «склеродермической почки» в моче появляются белок и эритроциты.
- Инструментальные. При капилляроскопии наблюдается дилатация капилляров без участков некроза. По данным ФЭГДС могут встречаться признаки эзофагита, стриктуры пищевода. При фиброзе миокарда на ЭКГ иногда обнаруживаются нарушения ритма сердца, на ЭхоКГ – зоны гипокинеза, выпот в перикардиальную полость. На рентгенографии или компьютерной томографии легких отмечаются интерстициальные изменения.
- Гистологическое исследование биоптата кожи. Заключительный этап, позволяющий достоверно поставить диагноз. Проводится при сомнительных результатах предыдущих исследований. Характерны следующие признаки - инфильтрация лимфоцитами, плазмоцитами и эозинофилами в ретикулярном слое дермы, утолщенные коллагеновые пучки, набухание и склероз сосудистой стенки, атрофия эпидермиса, сальных и потовых желез.
Очаговую склеродермию дифференцируют с другими формами склеродермии (системной, склеродермой Бушке), дерматологическим заболеваниями (саркоидозом кожи, липонекробиозом, склеродермоподобной формы поздней кожной порфирии, базально-клеточным раком), поражением мягких тканей (панникулитом, липодерматосклерозом, эозинофильным фасциитом). В дифференциальной диагностике принимают участие онкологи, гематологи.
Лечение
Этиотропной терапии не существует. Метод лечения и вид лекарственного средства необходимо подбирать с учетом формы заболевания, тяжести течения и локализации очагов. При линейной и бляшечной формах используются топические глюкокортикостероиды высокой и сверхвысокой активности (бетаметазон, триамцинолон), синтетические аналоги витамина Д. При выраженной индурации кожи эффективны аппликации с диметилсульфоксидом. В случае поражений внутренних органов с целью уменьшения фиброзообразования назначаются пеницилламин и инъекции гиалуронидазы.
При неглубоких процессах хорошим терапевтическим действием обладает ПУВА-терапия, которая включает облучение кожи ультрафиолетовыми волнами длинного спектра с одновременным пероральным или наружным применением фотосенсибилизаторов. Тяжелое поражение кожи служит показанием к применению иммунодепрессантов (метотрексата, такролимуса, микофенолата), синдром Рейно - блокаторов кальциевых каналов (нифедипина) и препаратов, улучшающих микроциркуляцию (пентоксифиллина, ксантинола никотината). При склероатрофическом лихене проводится низкоинтенсивная лазеротерапия. В случае развития контрактур суставов, значительно затрудняющих движения, или грубых деформаций скелета и косметических дефектов лица требуется хирургическая операция.
Профилактика и прогноз
В подавляющем большинстве случаев очаговая склеродермия имеет доброкачественное течение. Правильно подобранная терапия позволяет добиться регресса симптомов. Иногда наступают спонтанные ремиссии заболевания. Неблагоприятные исходы возникают при тяжелых формах (прогрессирующей гемиатрофии лица, пансклеротической инвалидизирующей склеродермии), а также поражении внутренних органов. Эффективных методов профилактики не разработано. Рекомендуется избегать или максимально ограничить контакт кожи с химическими соединениями (кремнием, сицилием, хлорвинилом, нефтепродуктами, органическими растворителями, пестицидами, эпоксидной смолой).
2. Ревматические заболевания/ Под ред. Дж.Х. Клиппела, Дж.Х. Стоуна, Л.Дж. Кроффорд, П.Х. Уайт – 2012.
3. Диффузные болезни соединительной ткани: руководство для врачей/ под ред. проф. Мазурова В.И. –2009.
Шевцова Т.П. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва , Надточеева В.Б. Факультет фундамен- тальной медицины, МГУ им. М.В. Ломоносова , Нимирицкая С.В. Факультет фундамен- тальной медицины, МГУ им. М.В. Ломоносова , Акулкина Л.А. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва , Буланов Н.М. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва , Новиков П.И. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
Оценка влияния ритуксимаба на течение интерстициального поражения легких, фиброз кожи и суставной синдром у пациентов с системной склеродермией (ССД).
Материалы и методы
В ретроспективное исследование включали всех пациентов с ССД, которые получали лечение ритуксимабом. Диагноз ССД устанавливали в соответствии с классификационными критериями ACR-EULAR 2013 г. Эффективность ритуксимаба оценивали через 1 год, а также в конце наблюдения на основании динамики форсированной жизненной емкости легких (ФЖЕЛ) и диффузионной способности легких по оксиду углерода (DLCO), счета DAS-28 ESR/CRP и модифицированного кожного счета по Роднану.
Ритуксимаб применяли у 14 больных ССД в возрасте в среднем 50,5 лет (от 29 до 66 лет), в том числе 12 женщин. У 13 из них имелось интерстициальное поражение легких. Все пациенты ранее получали глюкокортикостероиды и/или различные иммуносупрессивные препараты, в том числе циклофосфамид и микофенолата мофетил. Медиана ФЖЕЛ после лечения ритуксимабом достоверно не изменилась, а медиана DLCO достоверно увеличилась. Снижения этих показателей ни у одного пациента отмечено не было. У 10 (71,4%) пациентов, получавших лечение ритуксимабом, через год выявлено уменьшение модифицированного кожного счета по Роднану, а у 4 пациентов этот показатель не изменился. Медианы счета DAS28/CRP и DAS-28/ESR достоверно снизились через год после начала лечения ритуксимабом (p=0,007 и р=0,017, соответственно). У пациентов, получавших глюкокортикостероиды, средняя суточная доза преднизолона через год была достоверно ниже исходной (p=0,043). Переносимость ритуксимаба (медиана длительности лечения 2 года; от 1 до 6 лет) в целом была хорошей.
Полученные данные свидетельствуют о том, что ритуксимаб оказывает стабилизирующее влияние на показатели функции легких, вызывает уменьшение фиброза кожи и суставного синдрома у части больных ССД, не ответивших на другие иммуносупрессивные препараты.
Системная склеродермия (ССД) – аутоиммунное заболевание, сопровождающееся вовлечением в воспалительный процесс соединительной ткани и проявляющееся изменениями кожи, поражением внутренних органов, сосудов и суставов [1]. ССД характеризуется одним из наиболее высоких уровней смертности среди системных заболеваний соединительной ткани [2]. Прогрессирующее интерстициальное поражение легких является ведущей причиной смерти при ССД [3], при этом возможности терапии до сих пор ограничены [4]. Патогенез ССД изучен недостаточно, однако полагают, что ключевую роль в развитии данного системного заболевания играют иммунологические нарушения, в том числе активация В-клеточного звена иммунитета 5. Результаты опубликованных ранее серий наблюдений и неконтролируемых исследований продемонстрировали возможную эффективность ритуксимаба (химерное моноклональное антитело мыши/человека, которое специфически связывается с трансмембранным антигеном CD20 на поверхности В-лимфоцитов) в лечении поражения кожи и легких у пациентов с ССД 22. В исследовании European Scleroderma Trials and Research group (EUSTAR) и в проспективном когортном исследовании было отмечено, что у пациентов, получавших лечение ритуксимабом, наблюдались положительная динамика поражения кожи, особенно у пациентов с диффузной формой, а также стабилизация показателей функции внешнего дыхания [23,24]. Ритуксимаб характеризовался хорошим профилем безопасности у пациентов с ССД [23].
Целью ретроспективного исследования была оценка влияния ритуксимаба на течение интерстициального поражения легких, ние интерстициального поражения легких, фиброз кожи и суставной синдром у пациентов с ССД.
Материал и методы
В ретроспективное исследование включали всех пациентов с ССД, которые получали лечение ритуксимабом в клинике им. Е.М. Тареева с 2010 по 2020 г. Диагноз системной склеродермии устанавливали в соответствии с классификационными критериями ACR-EULAR 2013 года [25].
Регистрировали демографические показатели, длительность заболевания от возникновения первого “не-Рейно" симптома, клиническую форму, данные о предшествующем лечении другими препаратами и их дозировки, модифицированный кожный счет по Роднану, наличие/отсутствие легочного фиброза, форсированную жизненную емкость легких (ФЖЕЛ) в % от должной, диффузионную способность легких по оксиду углерода (DLCO) в % от должной, число болезненных и припухших суставов, DAS-28 ESR/CRP, уровень С-реактивного белка (СРБ), число инфузий и дозировку ритуксимаба, данные о сопутствующем лечении иммуносупрессивными средствами и глюкокортикостероидами.
Эффективность ритуксимаба оценивали через 1 год, а также в конце наблюдения на основании динамики показателей функции легких, суставного синдрома и кожного счета. Критерием прогрессирования легочного фиброза считали снижение ФЖЕЛ по крайней мере на 10% и/или DLCO по крайней мене на 15% [26]. Критерием прогрессирования кожного фиброза считали нарастание кожного счета более чем на 5 баллов или увеличение кожного счета по крайней мере на 25% [27]. Динамику суставного синдрома оценивали на основании индекса активности DAS-28 ESR/CRP.
Безопасность ритуксимаба оценивали на основании нежелательных явлений, в том числе гипогаммаглобулинемии [28] и инфекций.
Статистический анализ. Нормальность распределения данных оценивали с помощью теста Шапиро-Уилка. Демографические и исходные клинические характеристики представлены в виде медианы и межквартильного интервала для непрерывных переменных и в виде процентов для категориальных переменных. Сравнение непрерывных переменных проводилось с использованием U-критерия Манна-Уитни. Категориальные переменные между группами сравнивали при помощи точного теста Фишера или критерия χ2 Пирсона. Различия считали статистически значимыми при p менее 0,05. Статистическая обработка данных осуществлялась с использованием программного обеспечения STATISTICA 13.
Результаты
Характеристика пациентов. Ритуксимаб применяли у 14 больных ССД в возрасте в среднем 50,5 лет (от 29 до 66 лет), в том числе 12 женщин. Медиана продолжительности болезни с момента появления первого “не-Рейно" симптома составила 5,7 лет (от 2 до 19 лет). У большинства больных была диагностирована лимитированная форма ССД (табл. 1) и определялся антинуклеарный фактор (АНФ) в титре выше 1:160. Антитела к топоизомеразе были выявлены у 3 (21,4%) пациентов, антицентромерные антитела – у 4 (28,5%). Пред шествующее лечение циклофосфамидом проводилось 5 (35,7%) пациентам, микофенолата мофетилом – 6 (42,8%), азатиоприном – 4 (28,5%), гидроксихлорохином – 6 (42,8%), колхицином – 1 (11,1%), D-пеницилламином – 1 (%).
| Значения | |
|---|---|
| Женщины, n (%) | 12 (85,7) |
| Возраст, годы | 50,5 (36; 64) |
| Клиническая форма, n (%) | |
| диффузная | 4 (28,6) |
| лимитированная | 10 (71,4) |
| Давность болезни, годы | 5,3 (2,4; 8.1) |
| Давность болезни, n (%) | |
| (%)≤5 лет | 7 (50) |
| >5 лет | 7 (50) |
| Синдром Рейно, n (%) | 14 (100) |
| Дигитальные рубчики, n (%) | 5 (35,7) |
| Интерстицальное поражение легких, n (%) | 13 (92,8) |
| Снижение ФЖЕЛ ≤80% от должной, n (%) | 4 (28,6) |
| Снижение DLCO ≤80% от должной, n (%) | 10 (71,4) |
| Мышечно-скелетные проявления, n (%) | 10 (71,4) |
| АНФ в титре >1:160, n (%) | 13 (92,8) |
| антитела к топоизомеразе (anti-Scl-70) | 3 (21,4) |
| антицентромерные антитела (АСА) | 4 (28,6) |
| Перекрестный синдром, n (%) | |
| 5 (35,7) | полимиозит |
| 2 (14,3) | синдром Шегрена |
| системная красная волчанка | 1 (7,1) |
| Медиана дозы преднизолона, мг/сут | 8,8 (3,3; 13,7) |
У 13 из 14 больных показанием к лечению ритуксимабом было сохранение или прогрессирование интерстициального поражения легких на фоне предшествующей терапии. У одного пациента с перекрестным синдромом (ССД + системная красная волчанка) ритуксимаб был назначен в связи с наличием суставного синдрома и гематологических нарушений. Всем больным ритуксимаб вводили внутривенно в дозе 500 или 1000 мг после премедикации метилпреднизолоном (250-500 мг внутривенно). При этом трое больных получили 2 г (2 инфузии по 1000 мг с интервалом в 6 месяцев), двое – 3 г (3 инфузии по 1000 мг с интервалом в 6 месяцев), одна – 4 г (4 инфузии по 1000 мг с интервалом в 6 месяцев), семь – 5 г (5 инфузий по 1000 мг с интервалом в 6 месяцев), одна – 9,5 г (8 инфузий по 1000 мг с интервалом в 6 месяцев, далее 3 инфузии по 500 мг с интервалом в 6 месяцев), одна – 14 г (2 г –индукционная доза, затем 12 инфузий по 1000 мг каждые 6 месяцев).
Во время лечения ритуксимабом 10 (71,4%) пациентов получали лечение глюкокортикостероидами, при этом медиана дозы преднизолона составила 8,8 мг/сут (от 5 до 25 мг/сут). У 6 (42,8%) пациентов ритуксимаб применяли в комбинации с микофенолата мофетилом (у 4) или азатиоприном (у 2). Гидроксихлорохин получали 5 пациентов, колхицин – 1.
Поражение легких. Медиана ФЖЕЛ после лечения ритуксимабом достоверно не изменилась, а медиана DLCO достоверно увеличилась (табл. 2). Снижения ФЖЕЛ или DLCO ни у одного пациента отмечено не было. Увеличение ФЖЕЛ наблюдалось у 7 (50,0%) из 14 больных, а увеличение DLCO – у 8 (57,1%).
| Параметры | Исходно | Через год | р |
|---|---|---|---|
| ФЖЕЛ, % от должной | 79 (63; 81) | 83 (76; 86) | 0,111 |
| DLCO, % от должной | 66 (42; 81) | 75 (49; 85) | 0,004 |
| Кожный счет, баллы | 9,3 (5,5; 12,3) | 8,3 (5,0; 11,2) | 0,024 |
| DAS-28/CRP | 3,7 (2,8; 4,1) | 2,8 (2,2; 3,3) | 0,007 |
| DAS-28/ESR | 3,2 (2,1; 4,1) | 2,6 (2,0; 3,0) | 0,017 |
| СРБ, мг/л | 8,9 (3,5; 13,9) | 4,1 (2,2; 6,9) | 0,051 |
| Преднизолон, мг/сут | 10,8 (4,5; 15,6) | 6,5 (2,4; 12,0) | 0,043 |
Фиброз кожи. У 10 (71,4%) пациентов, получавших лечение ритуксимабом, через год выявлено уменьшение кожного счета по Роднану, у а 4 пациентов этот показатель не изменился. Наиболее выраженное снижение кожного счета (на 4-5 баллов) наблюдалось у трех пациентов с диффузной формой ССД (двое из них получали дополнительно микофенолата мофетил в дозе 1000 мг/сут) и у одной пациентки с лимитированной формой ССД и исходным кожным счетом, составлявшим 13 баллов (помимо ритуксимаба она получала терапию азатиоприном).
Суставной синдром. Медианы счета DAS-28/CRP и DAS-28/ESR достоверно снизились через год после начала лечения (p=0,007 и р=0,017). Случаев усиления суставного синдрома на фоне лечения ритуксимабом не было.
Показатели воспаления и сопутствующее лечение. Уровень СРБ во время лечения достоверно не изменился (р=0,051), однако у двух пациентов с исходно повышенным значением этого показателя он значительно снизился. У пациентов, получавших глюкокортикостероиды, средняя суточная доза преднизолона через год была достоверно ниже исходной (p=0,043) (табл. 2).
В нашем ретроспективном исследовании лечение ритуксимабом (медиана дозы 2 г за 12 мес) оказывало благоприятное влияние на показатели функции легких, кожный счет по Роднану и суставной синдром у 14 больных ССД. В исследование были включены пациенты с развернутой формой заболевания, медиана длительности которого составляла около 6 лет. Все больные ранее получали глюкокортикостероиды и/или различные иммуносупрессивные препараты, включая циклофосфамид и микофенолата мофетил. Более чем у 70% пациентов до назначения ритуксимаба отмечалось снижение DLCO менее 80% от должного, хотя ФЖЕЛ была снижена только у 28% больных. При лечении ритуксимабом ни у одного больного не было отмечено ухудшения этих показателей. Медиана ФЖЕЛ существенно не изменилась, в то время как медиана DLCO достоверно увеличилась, хотя клинически значимого нарастания DLCO мы не наблюдали ни в одном случае. Приведенные данные свидетельствуют о том, что лечение ритуксимабом может затормозить прогрессирование интерстициальной болезни легких по крайней мере у части пациентов с ССД.
Сходные результаты были получены в других исследованиях [10,14-17,21,22]. В клиническом исследовании у 63 больных ССД с поражением легких, включенных в базу данных EUSTAR, лечение ритуксимабом предупреждало дальнейшее снижение ФЖЕЛ по сравнению с контролем [24]. Л.П. Ананьева и соавт. в неконтролируемом исследовании у 27 пациентов с ССД выявили статистически значимое увеличение ФЖЕЛ через год после начала лечения ритуксимабом в 59% случаев, а клинически значимое – в 11% [29]. А Daoussis и соавт. наблюдали достоверное нарастание ФЖЕЛ в течение 2 лет наблюдения у 33 больных, получавших ритуксимаб, и отсутствие прироста ФЖЕЛ в контрольной группе у 18 больных, которым проводилась терапия азатиоприном, микофенолата мофетилом или метотрексатом [15]. В то же время польза ритуксимаба не была подтверждена в самом крупном проспективном клиническом исследовании, в котором было сопоставлено течение поражения легких и кожи у 254 больных ССД, получавших ритуксимаб, и 9575 подобранных пациентов, которым не назначали моноклональные антитела к В-лимфоцитам [23]. В этом исследовании у 146 больных с интерстициальным поражением легких как ФЖЕЛ, так и DLCO оставались стабильными во время лечения ритуксимабом. Тем не менее, применение этого препарата не привело к снижению частоты клинически значимого ухудшения функции легких (снижение ФЖЕЛ более чем на 10%) по сравнению с контролем
Следует отметить, что все опубликованные исследования были нерандомизированными, что затрудняет интерпретацию полученных результатов. Интерсти циальное поражение легких при ССД характеризуется постепенным ухудшением показателей функции легких, однако темпы прогрессирования варьируются в широких пределах. В одном исследовании было показано, что при отсутствии лечения иммуносупрессивными препаратами ФЖЕЛ у больных ССД с поражением легких снижается примерно на 4% за год [30], однако при естественном течении ССД могут наблюдаться периоды длительной стабилизации и даже улучшения ее отдельных проявлений. Для подтверждения возможности стабилизации интерстициального поражения легких под влиянием ритуксимаба необходимы рандомизированные клинические исследования. Тем не менее, применение этого препарата представляется оправданным у пациентов с прогрессирующим поражением легких, которые не отвечают на другие иммуносупрессивные средства, в частности циклофосфамид. Однако необходимо учитывать, что прогрессирование легочного фиброза на фоне иммуносупрессивной терапии может быть основанием для назначения антифиброзных препаратов, таких как нинтеданиб.
В нашей серии наблюдений лечение ритуксимабом привело к достоверному снижению медианы кожного счета по Роднану. Уменьшение кожного счета на 4-5 баллов наблюдалось у пациентов с наиболее выраженным фиброзом кожи. В проспективном исследовании Elhai и соавт. 32% из 254 больных получали ритуксимаб в связи с прогрессирующим фиброзом кожи. Авторы выявили достоверное снижение кожного счета при лечении ритуксимабом, а также двукратное увеличение вероятности улучшения кожного фиброза по сравнению с контролем [23]. Достоверное снижение кожного счета, особенно у пациентов с диффузной формой ССД, было выявлено и в исследовании Jordan и соавт. [24], а также в других небольших сериях наблюдений (от 5 до 20 пациентов) 15. Следует отметить, что при ССД установить истинную эффективность препарата в отношении фиброза кожи при отсутствии контрольной группы сложно, учитывая возможность спонтанного улучшения в течение первых нескольких лет.
В нашем исследовании лечение ритуксимабом сопровождалось некоторым улучшением суставного синдрома, а также снижением повышенного уровня СРБ. Сходные данные были получены в исследовании Elhai и соавт. [23]. Концентрация СРБ у больных ССД коррелирует с активностью и тяжестью заболевания [31]. Кроме того, у пациентов, получавших глюкокортикостероиды в дозе 12,5-25 мг/сут в пересчете на преднизолон, на фоне лечения ритуксимабом удалось снизить их дозы. В исследовании Elhai и соавт. также было показано, что терапия ритуксимабом у пациентов с ССД вдвое увеличивает вероятность отмены или снижения доз глюкортикостероидов [23], что имеет важное значение для снижения риска развития субклинического или клинического атеросклероза [32], а также почечного криза [33].
Эффективность ритуксимаба, который вызывает быструю деплецию CD20+ B-лимфоцитов в периферической крови, подтверждает роль В-лимфоцитов в патогенезе ССД [34], хотя действие ритуксимаба может объясняться не только подавлением выработки аутоантител [35], но и другими механизмами. Например, при идиопатической тромбоцитопенической пурпуре и реакции трансплантат против хозяина ритуксимаб оказывал действие на аутореактивные Т-лимфоциты [36, 37]. Обсуждается также возможность “перезагрузки" иммунной системы как о терапевтическом эффекте ритуксимаба [38].
Заключение
Основными ограничениями нашего исследования являются небольшое число пациентов, ретроспективный дизайн и отсутствие контрольной группы. Однако ССД относится к редким заболеваниям, а для ее лечения могут быть использованы различные иммуносупрессивные средства, а также антифиброзные средства (нинтеданиб) при наличии прогрессирующего интерстициального поражения легких. Эффективность ритуксимаба у пациентов с ССД в рандомизированных контролируемых исследованиях не изучалась. Тем не менее, наши данные, как и результаты других исследований, свидетельствуют о том, что этот препарат может оказать стабилизирующее влияние на показатели функции легких и вызывает уменьшение фиброза кожи у части больных ССД, не ответивших на другие иммуносупрессивные средства.
Читайте также:

