Иммунные препараты при опоясывающем лишае
Обновлено: 28.04.2024
По данным ВОЗ около 90% населения земного шара инфицированы одним или несколькими видами герпеса. В большинстве случаев первичное инфицирование происходит еще в детстве, после чего вирус переходит в латентное состояние. Он не размножается, его белки не синтезируются в клетках. Чаще всего реактивация вируса происходит на фоне других инфекций, неблагоприятных факторов внешней среды, психоэмоциональных перегрузок, эндокринных нарушений или изменений, а также иммунодефицитных состояний. Одна из самых распространенных детских инфекций – ветряная оспа – вызывается вирусом Varicella zoster (VZV), который относится к 3-му типу вирусов герпесгруппы и вызывает два заболевания: ветряную оспу и опоясывающий герпес (лишай). Причем как правило, при первичном заражении – развивается ветрянка, а впоследствии, – лишай.
Что такое опоясывающий лишай, чем он вызван и при чем здесь детская ветрянка
Это разновидность герпетической инфекции, поражающей нервную систему и имеющей кожные проявления. Вызвано заболевание тем же типом вируса, что и ветряная оспа. Принято считать ветрянку не слишком серьезным детским заболеванием, однако она не проходит бесследно. После перенесенной инфекции в ганглиях задних корешков спинного мозга формируется пожизненное носительство вируса в «дремлющем» состоянии, которое не требует лечения. В момент ослабления иммунитета, вызванного различными факторами, о которых говорилось выше, происходит реактивация вируса. Интересно, что опоясывающий герпес назван именно «опоясывающим», потому что клинически проявляется в виде сыпи, которая располагается вдоль нервных стволов и визуально, особенно при запущенных случаях, напоминает «пояс». Также важно понимать, что только опоясывающий лишай вызывается вирусом VZV. Другие лишаи могут иметь совершенно иное происхождение, от того и подход к их лечению может сильно отличаться.
Симптомы опоясывающего лишая
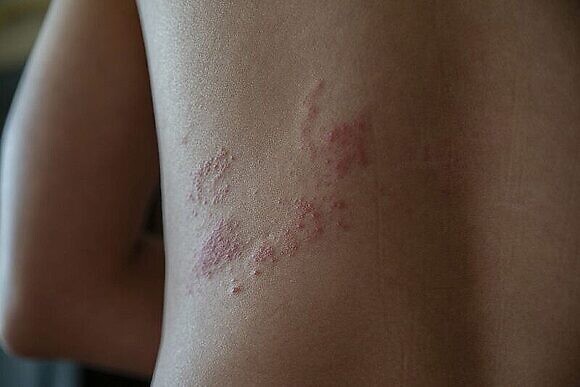
Помимо таких симптомов как увеличение лимфатических узлов, слабость, головная боль, тошнота, озноб и повышенная температура во время опоясывающего лишая на коже появляются участки, покрытые сыпью. Высыпания представлены мелкими сгруппированными пузырьками с прозрачной жидкостью внутри. Чаще они располагаются вдоль ребер, по ходу нервных стволов, как бы опоясывая тело. Однако высыпания при опоясывающем лишае могут появляться и на голове, животе, конечностях, ягодицах. Кожа на поражённых участках отекает, краснеет и нестерпимо зудит. Характерны интенсивные кожно-мышечные боли, обусловленные повреждением нервных волокон.
Кто может заболеть
Случаи заражения взрослых от больных опоясывающим лишаем чрезвычайно редки. При этом у детей, контактирующих с больными опоясывающим герпесом, может развиться ветряная оспа. Взрослые, общающиеся с ребенком, страдающим ветряной оспой, заболевают опоясывающим лишаем крайне редко. Заболевание чаще всего появляется один раз в жизни, эпидемий не наблюдается. Важным фактором риска развития опоясывающего герпеса является возраст. Заболеваемость ОГ в различных странах мира составляет от 0,4 до 1,6 случая заболевания на 1000 человек в год у лиц в возрасте до 20 лет, и от 4,5 до 11,8 случая на 1000 человек в год в старших возрастных группах. Риск развития опоясывающего герпеса у пациентов со сниженной способностью противостоять вирусам в 20-100 раз выше, чем у людей того же возраста с нормальным иммунитетом. К иммунодепрессивным состояниям, ассоциированным с высоким риском развития опоясывающего лишая, относятся: инфекция ВИЧ, пересадка костного мозга, лейкемия и лимфомы, химиотерапия и лечение системными кортикостероидами. Опоясывающий герпес может быть ранним маркером инфицирования ВИЧ, указывающим на первые признаки развития иммунодефицита. К другим факторам, увеличивающим риск развития опоясывающего герпеса, относят: женский пол, специфические поражения участков кожи, генетические нарушения i . Число больных увеличивается зимой и осенью.
Патогенез опоясывающего лишая не вполне ясен, однако, по современным данным, опоясывающий лишай можно расценивать как вторичную инфекцию на фоне частичного снижения иммунитета, развившуюся в результате контакта организма с вирусом в прошлом. Вирус в латентном состоянии находится в нервных ганглиях и при реактивации инфекции продвигается по ходу нерва к коже, где вызывает характерные высыпания. В большинстве случаев болезнь развивается у практически здоровых людей без видимых предрасполагающих факторов. Вместе с тем инфекция может быть спровоцирована травмой, рентгеновским облучением, переохлаждением, рядом других факторов, а также иммунодефицитом. Болезнь не рецидивирует, что отличает ее от ВПГ ii .
Сведения о вирусах герпесгруппы
На практике врачи многих специальностей довольно часто сталкиваются с лечением заболеваний, вызванными ВПГ 1 и 2 типа (лабиальный и генитальный герпес), ВВО (ветряная оспа, опоясывающий герпес), для которых разработаны и стандартизированы методы диагностики и терапии. Однако, несмотря на наличие большого арсенала противовирусных препаратов, эффективность системной терапии рецидивирующей герпетической инфекции зачастую, увы, невысока. Для достижения длительной ремиссии в лечении важен комплексный подход: препараты, которые оказывают воздействие непосредственно на вирус плюс стимуляция антивирусного иммунитета.
Герпес 3-го типа (VZV) особенно опасен для беременных женщин, так как негативно влияет на плод. Уровня антител в крови матери бывает недостаточно для защиты плода, это связано со снижением иммунитета во время беременности, могут потребоваться препараты, обладающие иммуномодулирующим действием. Опоясывающий герпес во время беременности является маркером иммунного ответа: если случился рецидив ветрянки, необходимо срочно принимать меры по недопущению заражения плода. Степень опасности для плода зависит от срока беременности и титра защитных антител у матери. Препараты, которые можно использовать при опоясывающем герпесе во время беременности – ВИФЕРОН Гель, ВИФЕРОН Мазь.
Лекарства от опоясывающего герпеса
Лечение тем эффективнее, чем раньше оно начато. Домашнее лечение допустимо в легких случаях. Основной целью лечебных мероприятий является: подавление репродукции вируса в период обострения; формирование адекватного иммунного ответа и его длительное сохранение; предотвращение развития или восстановление тех нарушений, которые вызывает активация инфекции в организме. Разумеется, золотым стандартом лечения герпетических инфекций являются препараты на основе ацикловира или его дериватов. Это препараты прямого противовирусного действия, которые способны достаточно быстро купировать симптомы острой фазы заболевания. Однако у этих препаратов часто имеются противопоказания по возрасту, а также ограничения по использованию во время беременности. Также нужно помнить, что в последние годы растет уровень резистентности вируса опоясывающего герпеса к препаратам на основе ацикловира, что может сказаться на эффективности лечения iv . Являясь препаратами прямого противовирусного действия, ацикловиры не оказывают никакого воздействия на показатели иммунитета, а значит не предотвращают развитие рецидивов. Именно поэтому все чаще и чаще специалисты отдают предпочтение комплексной терапии, которая помимо вышеуказанных методов лечения, включает в себя препараты для поддержания иммунитета, а также витамины группы В.
Клинические рекомендации по лечению герпеса у взрослых v среди прочих содержат препараты интерферона, которые помимо противовирусного действия обладают также выраженным иммуномодулирующими свойствами. К таким препаратам относится ВИФЕРОН Суппозитории/Мазь/Гель. Местная терапия при опоясывающем лишае заключается в соблюдении рационального режима (запрещается мытье, кожу вокруг очагов протирают 2% салициловым спиртом) и применении противовирусных препаратов локального действия и симптоматических средств. Для устранения болевого синдрома используют акупунктуру, физиотерапию, УФ облучение, лазер. К рекомендуемым иногда при опоясывающем лишае кортикостероидным средствам нужно относиться с осторожностью, так как их применение может вызвать распространение процесса. При присоединении вторичной инфекции проводится лечение антибиотиками. Лечение постгерпетических невралгий проводится неврологом. Опоясывающий лишай может приводить к развитию серьёзных осложнений, поэтому даже домашнее лечение опоясывающего лишая должно проводиться согласно врачебным рекомендациям.
Направленное действие интерферона
Целесообразно проводить лечение опоясывающего лишая иммуностимуляторами, так как оно обеспечивает направленное воздействие непосредственно в очаге воспаления. Для лечения герпетической инфекции используют противовирусные средства на основе интерферонов, например, ВИФЕРОН. Терапевтическое действие препарата во многом обусловлено его комплексным составом. Противовирусное и иммуномодулирующее действия интерферона усиливаются благодаря наличию высокоактивных антиоксидантов, витаминов Е и С. Для системной терапии применяются ректальные суппозитории ВИФЕРОН в дозировке 1 000 000 ME 2 раза в сутки, 10 дней. У беременных с 14-й недели используется дозировка 500 000 ME два раза в день, курс лечения – смотрите в инструкции по медицинскому применению.

Для наружной терапии опоясывающего лишая могут быть использованы препараты ВИФЕРОН Мази или ВИФЕРОН Гель. Их наносят 3–5 раз в день 5-7 дней чистым шпателем или ватным тампоном/палочкой на предварительно подсушенную пораженную поверхность до исчезновения клинических проявлений. Врач как правило назначает комплексную схему лечения. Рекомендуется применять ВИФЕРОН при появлении первых признаков: зуд, жжение, покраснение слизистых или кожи.
О безопасности данных средств свидетельствует то, что суппозитории и гель можно использовать у детей с первых дней жизни, а мазь — с одного года. Если высыпания покрыты корками, то для их размягчения следует использовать мазь. Если их нет, то лучше использовать гель, особенно на слизистых оболочках.
Опоясывающий лишай - одно из инфекционных заболеваний, спровоцированных вирусом герпеса. Патология сопровождается сильным болевым синдромом и кожными высыпаниями. При комплексном подходе к терапии симптомы удается быстро ликвидировать, при этом важно правильно подобрать препараты.

Лечение опоясывающего лишая
Инфекционная сыпь на теле развивается под воздействием вируса герпеса 3 типа. Это тот же патоген, который провоцирует развитие ветряной оспы. После ветрянки вирус скрыто живет в человеческом организме и при ослаблении иммунитета проявляется в виде опоясывающего лишая.
Перед появлением герпетических пузырьков кожные покровы отекают и сильно зудят. Причиной снижения защитных сил организма часто становятся хронические заболевания, тяжелые операции либо длительный прием сильнодействующих медикаментозных средств. Фаза обострения протекает от пары недель до месяца.

Терапия опоясывающего лишая заключается в применении противовирусных препаратов. Средствами выбора становятся мази, гели для наружного применения, которыми обрабатывают воспаленные участки кожи. Поскольку вирус герпеса базируется внутри нервных клеток, лечение затрудняется. Все препараты для местного применения помогают устранить только наружные проявления заболевания и частично уменьшить болевой синдром. Поэтому к терапии требуется подходить комплексно, используя помимо наружных средств таблетированную форму. Таким образом, воздействие на вирус будет происходить одновременно изнутри и снаружи, что позволит ускорить выздоровление.
Терпеть боль при опоясывающем лишае не рекомендуется, такое состояние часто приводит к хроническому болевому синдрому.
На сегодняшний день разработано много средств, которые помогают вылечить опоясывающий лишай, лечение у детей и взрослых проводится препаратами противовирусного действия.

Помимо этого, пациенту также назначат антисептические и антибактериальные препараты. Это нужно во избежание возникновения осложнений и развития бактериальной инфекции. Для снятия боли потребуется прием анальгезирующих препаратов, уменьшить зуд помогут антигистаминные медикаменты. Также потребуется прием лекарственных средств, стимулирующих иммунную систему.
Противовирусные препараты
Притормозить вирусную деятельность, а также остановить жизнедеятельность патогенов при описываемом заболевании помогут различные противовирусные средства. Наиболее эффективными из них признаны:
-
Ацикловир. Лекарственное средство выпускается в трех формах: мазь, капли глазные и таблетки. Активный компонент - ацикловир действует на клеточном уровне. Он восстанавливает пораженные патогеном ДНК клеток. Средний курс лечения составляет 7-14 дней. После консультации врача возможно более длительное применение.








При тяжелом течении заболевания, а также пожилым пациентам, у которых иммунная функция организма снижена противовирусные средства назначаются в таблетированной либо инъекционной форме. Наружные препараты используются только при первых кожных проявлениях.
Антибиотики и антисептики
При опоясывающем лишае кожные покровы воспаляются, сильно чешутся, что приводит к образованию ранок. Во избежание бактериального заражения требуется назначение антисептиков. Они быстро подсушивают высыпающие пузырьки, не давая бактериям проникнуть внутрь появившихся ранок. В качестве антисептиков при опоясывающем лишае чаще всего применяют:
- раствор марганца;
- перекись водорода;
- хлоргексидин;

При сочетании нескольких лекарственных средств, сначала обрабатывают кожу антисептиком, а уже после, примерно через полчаса наносят противовирусные препараты. Одновременное применение медикаментов категорически запрещено.
Максимально эффективными антибактериальными средствами являются Ципрофлоксацин, Эритромицин, Амоксициллин.
Применение антибиотиков требуется, когда есть риск присоединения посторонней инфекции.

Осложнения в данном случае приводят к развитию тяжелых патологий: менингит, воспаление мышцы сердца, недостаточность почечной деятельности. В таких случаях требуется стационарное лечение больного.
Обезболивающие препараты
В процессе появления высыпаний герпетический вирус поражает миеливидную оболочку нервных окончаний. Именно поэтому нервные импульсы проходят не только по нервному стержню, но и распространяются по всему телу. В результате пациент при поражении опоясывающим лишаем испытывает острую боль. Болевой синдром даже после исчезновения внешних проявлений вирусной инфекции может сохраняться до месяца. Это продолжается до тех пор, пока заново нервные окончания не восстановят миелин.

Для уменьшения боли при опоясывающем лишае, а также для снятия постгерпетического синдрома пациентам назначают обезболивающие препараты. Хорошим анальгезирующим действием в данном случае обладают:
-
Противовоспалительные средства нестероидного ряда. К таким лекарствам относят Ибупрофен, Кеторол, Нимесулид. Данные препараты эффективно снимают болевой синдром, оказывая параллельно жаропонижающее действие. Все подобные лекарства выпускаются в нескольких медикаментозных формах: сироп, порошок, таблетки.




Назначение обезболивающих средств необходимо в случае тяжелого течения болезни во избежание развития хронического болевого синдрома. При этом лекарственные препараты назначаются в индивидуальном порядке.
Препараты, снимающие зуд
Опоясывающий герпес всегда сопровождается сильнейшим зудом. Пациенты расчесывают образующиеся пузырьки, в результате образуются ранки, которые со временем воспаляются и также приносят дискомфорт. Для устранения зуда больным назначают следующие лекарственные средства:
- Зиртек;
- Эриус;
- Лоратадин;
- Цетрин;
- Супрастин;

Период курсового лечения обычно составляет около 7 дней. Если пациент нуждается в более длительном применении, то необходимо один антигистаминный препарат заменить на другой.
Иммуностимуляторы и иммуномодуляторы
Комплексное лечение опоясывающего лишая должно включает препараты, которые усиливают иммунный ответ организма на вирусное воздействие. Задача подобных средств сводится к улучшению выработки специфических антител в больших количествах. Такое действие позволяет укрепить защитные силы организма и избежать развития серьезных осложнений. Наиболее распространенными препаратами, способствующими улучшению иммунного ответа, являются:

Когда иммуностимуляторы не справляются со своей задачей, необходимо применение иммуномодуляторов. Особенно их эффективность проявляется при затяжном вирусном заболевании. Для этих целей обычно назначают Циклоферон, Лавомакс и другие.
Особенности терапии у беременных
Лечения герпетической инфекции у женщин, вынашивающих ребенка, проводится с применением препаратов, не оказывающих негативного влияния на беременную и плод. В большинстве случаев это препараты для наружного применения, из группы противовирусных. Для поддержки иммунной системы может быть выписать Интерферон. Со второго триместра его можно использовать в виде свечей.

Также в комплекс терапии могут добавлять витаминно-минеральные комплексы.
При возникновении опоясывающего лишая в предродовом периоде существует риск инфицирования будущего ребенка. В таком случае патогенные микроорганизмы приведут к развитию ветряной оспы у новорожденного. В столь раннем возрасте патология грозит развитием тяжелых поражений печени, почек, легких, а также нервной системы. Лечением заболеваний такой этиологии занимаются врач-инфекционист и неонатолог.

Как не заразиться?
Чтобы обезопасить себя от такого заболевания, как опоясывающий лишай, взрослому человеку требуется в первую очередь отказаться от посещения мест массового скопления людей. Помимо этого, нужно стараться избегать стрессовых ситуаций. Также доктора рекомендуют пациентам:
- не пользоваться чужими полотенцами;
- избегать контакта с человеком, если он заразен;
- вести здоровый образ жизни;
- стараться больше времени уделять прогулкам;

Если все же вирус герпеса начал поражать организм необходимо обратиться в лечебное учреждение. Лечение в каждом конкретном случае подбирается в индивидуальном порядке.
Домашние рецепты
Методы народного лечения опоясывающего лишая часто не менее эффективны, чем традиционные. При не ярко выраженном течении заболевания оно легко поддается лечению. Наиболее действенными признаны следующие рецепты:
| Метод | Рецепт | Показания | Противопоказания |
| Мокрое полотенце | Смоченное в холодной воде полотенце прикладывают к зудящим местам. | Холод помогает избавить от неприятных ощущений. Укрепление защитных сил организма. | Отсутствуют |
| Деготь | Смазывают пораженные места 2-3 раза в сутки. Смывать через 15-20 минут. | Эффективно борется с вирусом, снимает зуд. | Беременные, дети |
| Ванна с йодом и солью | 0,5 кг соли и 10 мл йода на 150 литров воды. Длительность процедуры составляет 15 минут. | Подсушивает пузырьки, ускоряет заживление | По назначению врача |
Для облегчения состояния при вирусе герпеса принимают травяные настои и отвары внутрь. Больше всего себя зарекомендовали: корень имбиря, мелисса, зверобой, кора ивы. Помимо этого, следует придерживаться диетического питания.
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем.
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем. Генитальный герпес вызывают два серотипа вируса простого герпеса: ВПГ-1 и ВПГ-2; причем наиболее часто — ВПГ-2. Согласно данным сероэпидемиологических исследований, инфицирование ВПГ-1 выявляется у 20—40%, а ВПГ-2 — у 50—70% больных генитальным герпесом [2]. Заболевание передается преимущественно при сексуальных контактах от больного генитальным герпесом. Нередко генитальным герпесом заражаются от лиц, не имеющих симптомов заболевания на момент полового контакта или не знающих о том, что они инфицированы [5]. Эта особенность ВПГ, связанная с бессимптомным вирусоносительством, является сложной задачей, от решения которой зависит не только трудоспособность и здоровье, но и личная судьба миллионов потенциальных больных. Имеются сведения о том, что от 60 до 80% новорожденных, у которых развивается неонатальный герпес, рождаются от матерей с бессимптомным носительством [6].
ВПГ-инфекция также может быть причиной нарушения репродуктивной функции, невынашивания беременности, преждевременных родов и патологии плода. Возможно участие ВПГ в развитии онкологических заболеваний гениталий, иммунодефицитных состояний, что позволяет считать герпесвирусные инфекции важной медико-социальной проблемой практического здравоохранения [2].
Лечение хронических, часто рецидивирующих форм ВПГ-инфекции, до настоящего времени представляет определенные трудности, которые объясняются особенностями взаимодействия вируса с макроорганизмом. Жизнедеятельность вирусов герпеса основывается на следующих биологических особенностях:
- все вирусы герпеса являются внутриклеточными паразитами;
- герпесвирусы пожизненно персистируют в аксоноганглиальных структурах центральной и периферической нервной системы;
- в течение жизни человек многократно реинфицируется новыми штаммами вирусов герпеса, при этом возможно одновременное сосуществование нескольких видов и штаммов вирусов [12];
- при нарушении динамического равновесия между иммунным гомеостазом и вирусами последние переходят в активную форму [9].
Согласно данным проведенных исследований только 20% инфицированных ВПГ имеют диагностированный генитальный герпес, 60% — нераспознанный симптоматический генитальный герпес (атипичную форму) и 20% — бессимптомный герпес. В настоящее время только 27% пациентов с диагнозом генитальный герпес получают противовирусную терапию, из них треть — местное лечение [2]. По данным некоторых авторов, около 95% пациентов с клиническими проявлениями генитального герпеса вообще никак не лечатся [11].
Все разнообразие методов терапии и профилактики герпесвирусных инфекций в конечном счете сводится к трем главным подходам:
- химиотерапия;
- иммунотерапия;
- комбинация этих двух методов.
Каждый врач в своей практической работе так или иначе сталкивается с необходимостью решения этой сложной задачи, требующей тонкого индивидуального подхода к каждому пациенту, страдающему ВПГ.
Теоретически идеальным вариантом химиотерапии был и остается механизм прямой инактивации вирусной ДНК, но из-за неизбежного общего токсического, цитопатического и канцерогенного эффекта этот способ для клинического использования оказался неприемлемым [8]. Поэтому был разработан менее опасный способ инактивации вирусной ДНК — подавление активности вирусных ферментов, обеспечивающих жизнедеятельность ДНК. Наиболее безопасным вариантом оказалось создание синтетических аналогов нуклеозидов герпесвирусной ДНК, которые избирательно фосфорилируются не клеткой, а вирусспецифическим ферментом — тимидинкиназой. В процессе копирования вирусной ДНК эти псевдонуклеазиды встраиваются в дочерние вирусные ДНК, что приводит к генетическому дефекту или нежизнеспособности вирусной ДНК [1]. Первый лечебный синтетический нуклеозид — ацикловир (ациклический аналог гуанозина) — стал «золотым стандартом» противогерпетической химиотерапии. Ацикловир, будучи включен в какой-либо участок новой ДНК, никогда не заменяется естественным гуанином [13]. В последнее время синтезированы и широко используются новые противовирусные препараты этой группы — валтрекс и фамвир.
Различают два способа применения противовирусных химиопрепаратов: эпизодическое назначение (при обострениях герпесвирусной инфекции по мере необходимости) и супрессивная или превентивная терапия. В первом случае препарат назначается коротким курсом (5—10 дней), во втором — ежедневный прием препарата в течение нескольких месяцев, а то и лет призван помочь не столько купировать рецидив, сколько предотвратить развитие рецидивов как таковых.
Однако за последние 10 лет увеличилось число исследований, в ходе которых было показано, что изоляты вируса простого герпеса, полученные от пациенток с продолжающимися рецидивами генитального герпеса на фоне длительной супрессивной терапии (более 4 месяцев), обладают резистентностью по отношению к ацикловиру [10].
К тому же ни ацикловир, ни другие противовирусные агенты — фамцикловир, валацикловир — не предотвращают перехода вируса в латентное состояние, возникновения рецидивов после их отмены либо передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции, то есть не гарантируют полного излечения. Поэтому на протяжении последних двух десятилетий ученые изыскивают методы непосредственного воздействия на иммунную систему больных генитальным герпесом с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса [1].
Главной мишенью применения иммуномодулирующих препаратов служат вторичные иммунодефициты, которые проявляются частыми, рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными процессами разной локализации [7]. Именно к таким процессам, требующим иммунокоррекции, и относится хроническая рецидивирующая герпесвирусная инфекция (ХРГВИ), в частности ее генитальная форма. Иммуномодуляторы назначают в комплексной терапии одновременно с противовирусными средствами.
Полиоксидоний — отечественный иммуномодулятор с широким спектром фармакологического действия, не имеющий аналогов в мире [3]. Опыт применения полиоксидония начиная с 1996 года показал его высокую клиническую эффективность в комплексном лечении многих вторичных иммунодефицитных состояний, проявляющихся хроническими, рецидивирующими, вялотекущими инфекционно-воспалительными процессами различной локализации, в том числе в ходе терапии вирусных инфекций [4].
У нас также имеется определенный позитивный опыт применения полиоксидония у пациентов, резистентных к ацикловиру [9].
Мы проводили исследование открытым методом у 50 пациентов с ХРГВИ. В исследование включались пациенты (возрастной интервал от 18 до 65 лет) мужского и женского пола с достоверным диагнозом ХРГВИ. К исследованию не допускались пациенты с гиперчувствительностью к полиоксидонию и беременные женщины. Все пациенты, включенные в исследование, находились в периоде продрома или обострения не более 48 часов от момента появления высыпаний. Обязательным условием для женщин детородного возраста было соблюдение полноценной контрацепции.
На предварительном этапе были сформированы две равнозначные группы пациентов по 25 человек. Пациенты, вошедшие в изучаемые группы, отбирались методом произвольной выборки. Все пациенты предъявляли жалобы на пузырьковые или эрозивные высыпания в области гениталий, зуд, жжение. До лечения всем пациентам проводилась ПЦР-диагностика ВПГ-2 (мазок) — положительный результат получен в 98,3 %.
Возрастной состав пациентов, страдающих генитальной формой герпесвирусной инфекции, в обеих группах был приблизительно одинаковым (43,6 года в первой группе и 38,9 — во второй), в то время как в первой группе средний возраст женщин и мужчин был несколько выше по сравнению со второй группой.
Дозировка и схемы введения. Всем пациентам производилась в/м инъекция препарата утром, под контролем врача. 1-я схема: терапия проводилась в течение 45 дней: пациенты получали по 6 мг полиоксидония в день в/м в течение 5 дней и по 6 мг в/м через день в течение 10 дней. Поддерживающая терапия — по 6 мг в/м 2 раза в неделю в течение месяца. 2-я схема: 6 мг полиоксидония в/м через день в течение 10 дней (всего 5 инъекций на курс).
Обследование проводилось до приема препарата и на 12—14-й день от начала приема препарата, а также на 3—6-й день после окончания приема препарата. Обследование включало общее клиническое, иммунологическое исследования крови, исследование мочи (общее), объективное исследование. Накануне приема препарата собирался подробный анамнез пациента. В состав исследуемых включались совершеннолетние пациенты мужского и женского пола с достоверным диагнозом ХРГВИ.
Объем сопутствующей терапии: все пациенты получали стандартную сопутствующую терапию (ацикловир по 0,2 г 5 раз в день в течение 5 дней и антиоксиданты).
Критериями оценки эффективности являлись следующие параметры: первичные критерии — время достижения полного выздоровления (полная реэпитализация); вторичные критерии — длительность ремиссии и частота рецидивов в ближайшем и отдаленном периоде после терапии полиоксидонием. С целью оценки местных симптомов проводился наружный осмотр места поражения. Оценивалось состояние кожных покровов и слизистых: наличие пузырьков, язвочек, корочек, гиперемии; выяснялись жалобы пациента (зуд, жжение, общее состояние, температура, миалгия).
На фоне лечения полиоксидонием по первой схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,44 до 3,5 дня, в то время как на фоне стандартной терапии (ацикловир и антиоксиданты) те же показатели изменились с 6,44 до 5,16 дня соответственно. После курса терапии в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем составляла 4 дня. В процессе лечения препаратом свежие высыпания ни у одного пациента не появились. 76% (19 человек) отметили уменьшение тяжести течения рецидива; остальные — 24% (6 человек) — не отметили разницы по сравнению с периодом до получения препарата. На фоне лечения полиоксидонием по второй схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,72 до 4,24 дня вместо 6,72 — 5,04 дня соответственно. После лечения полиоксидонием в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем также составляли 4 дня. 64 % (16 человек) отметили уменьшение тяжести течения рецидива; остальные — 36% (9 человек) — не отметили никаких изменений по сравнению с периодом до получения препарата.
Частота рецидивов у пациентов, получавших полиоксидоний по первой схеме в течение 6 месяцев после лечения, уменьшилась в среднем с 6,5 до 3 раз по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 27 до 75 дней. Максимальная длительность ремиссии увеличилась в среднем с 45 до 180 дней (у отдельных пациентов максимальная ремиссия достигала 190–220 дней, что связано с неравномерностью возникновения рецидивов в исследуемом временном интервале). У 84% пациентов (21 человек) отмечалось ослабление клиники течения рецидива; у 16% (4 человека) после лечения клиника не изменилась. Ухудшения течения заболевания отмечено не было. Частота рецидивов у пациентов, получавших полиоксидоний по второй схеме, в течение 6 месяцев после лечения уменьшилась в среднем с 6 до 3,6 раза по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 33 до 62 дней. Показатель максимальной длительности ремиссии в обеих группах вырос в среднем примерно одинаково — с 45 до 180 дней. У 72% пациентов (18 человек) отмечалось ослабление клиники течения рецидива; у 28% (7 человек) после лечения клиника не изменилась. Как и в первой группе, ухудшений течения заболевания отмечено не было.
Максимальная длительность ремиссии за период наблюдения (2 года) составила 1,9 года в первой группе (у 9 пациентов — 36 %) и 1,1 года во второй группе (у 4 пациентов — 16 %).
До лечения полиоксидонием в обеих группах частота встречаемости и выраженность местных и общих клинических проявлений ХРГВИ была выше по сравнению с теми же показателями на фоне лечения полиоксидонием.
Парентеральное (в/м) введение полиоксидония в соответствии со схемами (см. выше) не вызывало аллергических реакций, не оказывало гепатонефротоксического действия и токсического действия на кроветворные органы; пациенты отмечали хорошую переносимость препарата.
По данным общеклинических и лабораторных методов исследования, побочных эффектов и осложнений при приеме полиоксидония не было.
Использование полиоксидония в комплексной терапии пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции является эффективным способом уменьшения клинических проявлений в фазе обострения, сокращения длительности рецидивов и заметного уменьшения их частоты в отдаленном периоде.
Раннее назначение полиоксидония способствует более быстрой реэпителизации и более стойкой ремиссии.
Использование инъекционной формы полиоксидония не вызывает аллергических реакций, а также других побочных эффектов и осложнений.
При соблюдении указанного режима дозирования препарат не обладает нефро- и гепатотоксическим действием.
А. Е. Шульженко, кандидат медицинских наук ГНЦ — Институт иммунологии МЗ РФ, Москва
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Доказано, что повреждение нейрональных структур начинается перед появлением кожной сыпи. При этом VZV по ходу чувствительных нервных волокон проникает в кожу, «ускользая» от факторов врожденного и приобретенного иммунитета, что в конечном итоге обусловливает возникновение односторонней везикулярной кожной сыпи, характерной для опоясывающего лишая.
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Читайте также:

