Диспансеризация при раке кожи
Обновлено: 01.05.2024
Цель данной работы состоит в увеличении выявления ранних стадий онкологических заболеваний с помощью анкетирования на амбулаторном этапе.
The principles of oncological alertness at the outpatient therapeutic stage / A. S. Sycheva1, A. L. Kebina, A. V. Nosova, А. L. Vertkin / A. I. Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia
Резюме. Цель данной работы состоит в увеличении выявления ранних стадий онкологических заболеваний с помощью анкетирования на амбулаторном этапе. В исследование включены 25 467 пациентов, обратившихся к терапевту или врачу общей практики по любому поводу. Врачи первичного звена вне зависимости от цели посещения проводили структурированное анкетирование по вопросам рисков развития злокачественных новообразований. Частота выявления онкологических заболеваний возросла до 60,4% за первое полугодие 2018 г. против 56,3% за аналогичный период 2017 г. Выявляемость рака желудка выросла на 3%, ободочной кишки – на 2%, злокачественных новообразований трахеи, бронхов и легких – на 6%, опухолей молочной железы, шейки матки и предстательной железы на 1%, 8% и 2% соответственно. Формирование четкого стереотипа онкологической настороженности у врача первичного амбулаторного звена способствует раннему выявлению и снижению частоты продвинутых стадий опухолей и более раннему началу специализированного лечения. Выявление подозрительной на злокачественные новообразования симптоматики с использованием алгоритмизированного подхода с последующим направлением пациента в специализированное учреждение должно улучшить результаты лечения.
В настоящее время во всем мире отмечается устойчивый рост заболеваемости онкологической патологией, что объясняется несколькими причинами, включая старение населения, экологические, экономические и другие факторы. В 2019 г. в РФ впервые выявленный диагноз злокачественных новообразований (ЗНО) был выставлен 640 391 человеку, из них 291 497 мужчин и 348 894 женщины. Таким образом, прирост по сравнению с 2018 г. составил 2,5%.
На конец 2019 г. в специализированных учреждениях России онкологического профиля состояло на учете 3 928 338 пациентов (на конец 2018 г. − 3 762 218, +4,4%). Совокупный показатель распространенности составил 2 676,6 на 100 тыс. населения [1].
Структура самых частых локализаций общей (оба пола) онкологической заболеваемости в РФ такова: рак кожи – 13,1%, вместе с меланомой – 15,0%, рак молочной железы (РМЖ) – 11,6%, трахеи, бронхов и легких – 9,4%, ободочной кишки – 7,1%, предстательной железы – 7,1%, желудка – 5,7%, прямой кишки, ректосигмоидного соединения, ануса – 5,0%, ЗНО лимфатической и кроветворной ткани – 4,8%, тела матки – 4,2%, почки – 3,9%, поджелудочной железы – 3,1%, шейки матки – 2,7%, мочевого пузыря – 2,7%, яичника – 2,2% [1].
Материалы и методы исследования
Своевременно заподозрить злокачественное новообразование можно только при наличии у врача постоянной онкологической настороженности, умения провести углубленный и вдумчивый опрос больного, правильно истолковать жалобы и динамику развития заболевания.
Н. Н. Трапезников (1992 г.)
В 2018 г. проведено исследование с использованием специализированного опросника в поликлиниках Тюмени, в котором приняли участие 25 467 пациентов, обратившихся к прием к терапевту или врачу общей практики по любой причине. В ходе исследования врачи на приеме целенаправленно задавали вопросы, касающиеся факторов риска возникновения ЗНО.
- Возраст.
- Социальный статус.
- Наличие вредных привычек.
- Отмечаете ли немотивированное снижение веса?
- Сохранен ли аппетит?
- Отмечалось ли повышение температуры тела?
- Есть ли одышка?
Наиболее частыми ответами были:
- Возраст старше 40 лет.
- Курение – необязательный фактор риска (менее 40% у мужчин).
- Социальный статус – сохранный.
- Отмечалось прогрессирующее быстрое похудание.
- Аппетит сниженный.
- Повышение температуры (не часто).
- Эпизоды усиления одышки.
При подозрении на ЗНО пациенту назначали набор скрининговых исследований:
- Клинический анализ крови с обязательным определением скорости оседания эритроцитов (СОЭ).
- Биохимический анализ крови (общий белок, альбумин, креатинин, мочевина, глюкоза).
- Рентгенография органов грудной клетки.
- Ультразвуковое исследование (УЗИ) органов брюшной полости.
- Электрокардиография (ЭКГ).
Характерными изменениями у пациентов с впервые выявленным онкологическим заболеванием были:
- Наличие анемии, высокая СОЭ.
- Биохимические показатели: изменения либо отсутствовали, либо определялась гипопротеинемия.
- Наличие новообразований, выпота в плевральной полости.
- УЗИ: без изменений или сонографические находки в виде новообразований.
- По данным ЭКГ отмечались как варианты нормы, так и рубцовые изменения, гипертрофия левых и правых отделов сердца.
.jpg)
Полученные данные сравнивались с результатами приема пациентов в поликлинике за аналогичный период 2017 г. Выявляемость онкологических заболеваний составила 60,4% за первое полугодие 2018 г. против 56,3% за аналогичный период 2017 г. Отмечено, что алгоритмизированный подход к опросу/диагностике и ведению пациентов привел к повышению частоты раннего выявления ЗНО с 2% до 8% (обобщенные результаты отражены на рис. 1 и 2).
По конкретным локализациям были получены следующие результаты: выявляемость рака желудка выросла на 3%, ободочной кишки – на 2%, ЗНО трахеи, бронхов и легких – на 6%, молочной железы – на 1%, шейки матки – на 8%, предстательной железы – на 2%.
ЗНО как причина смертности занимают второе место после сердечно-сосудистых заболеваний [2].
- ЗНО обусловили 15,5% смертей в 2015 г. в России.
- Удельный вес ЗНО в структуре смертности мужского населения составил 16,4%, женского — 14,4%. Среди лиц обоего пола, умерших в трудоспособном возрасте, доля летальности от ЗНО составила 16,0%, среди женщин репродуктивного возраста — 16,3%.
- Более половины смертей людей трудоспособного возраста в России приходится на заболевания из группы предотвратимой смертности и еще треть — на предотвратимые причины, зависящие от первичной и вторичной профилактики, а также качества оказываемой медицинской помощи.
К ведущим медико-социальным причинам высокого показателя смертности от ЗНО относят:
- позднюю обращаемость населения за медицинской помощью;
- недостаточный уровень онкологической настороженности у медицинских работников;
- дефекты в маршрутизации пациентов с подозрением на ЗНО.
Доказано, что ведущим фактором увеличения продолжительности жизни населения является профилактика, рассматриваемая как активный метод укрепления и сохранения здоровья населения. Однако существующие в настоящее время подходы к пропаганде основ здорового образа жизни преимущественно направлены лишь на профилактику поведенческих факторов риска – табакокурения, нерационального питания, недостаточной физической активности и пагубного употребления алкоголя. При этом, по оценкам экспертов, даже воздействие только на эти факторы позволит предотвратить по меньшей мере 40% случаев ЗНО.
В России функционирует трехуровневая система оказания медицинской помощи. В основном профилактическая направленность здравоохранения реализуется на первом уровне: при оказании первичной медико-санитарной помощи. Правильно организованное проведение диспансеризации способно обеспечить существенный, до 30%, вклад в снижение общей смертности населения, в том числе и смертности от ЗНО. Очевидна необходимость повышения роли онкологической службы в первичном звене здравоохранения (амбулатории, поликлиники). В этой связи особое внимание должно уделяться мероприятиям по диспансеризации взрослого населения, играющей важную роль в раннем выявлении онкологических заболеваний и факторов риска их развития.
Первым звеном на пути онкологического заболевания являются терапевты, к которым пациенты обращаются с жалобами общего характера (утомляемость, субфебрилитет, боли в суставах и т. д.). Наиболее актуальной задачей в работе терапевта является своевременное выявление опухолевого заболевания и направление больного на лечение к врачу-онкологу.
Проведенное анкетирование выявило недостаточный уровень онкологической настороженности среди медицинских работников, особенно при раке легкого, колоректальном раке, РМЖ и меланоме.
Нами разработаны алгоритмы диагностики наиболее распространенных онкологических заболеваний, рекомендованные для применения на амбулаторном терапевтическом этапе (табл. 1-5) [4].
Заключение
Наличие у врача первичного звена четкого стереотипа онкологической настороженности может способствовать уменьшению количества продвинутых стадий опухолей вследствие начала специализированного лечения на более ранних этапах. В такой ситуации основной задачей терапевта и врача общей практики является выявление подозрительной на злокачественные новообразования симптоматики с использованием алгоритмизированного подхода и направление пациента в специализированное учреждение.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
- Злокачественные новообразования в России в 2019 году (заболеваемость и смертность) / Под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. М.: МНИОИ им. П. А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. 252 с. [Zlokachestvennye novoobrazovaniya v Rossii v 2019 godu (zabolevaemost' i smertnost') [Malignant neoplasms in Russia in 2019 (morbidity and mortality) / Ed. Kaprin A. D., Starinsky V. V., Petrova G. V.] M.: MNIOI P. A. Herzen branch of the National Medical Research Center of Radiology, 2020. 252 p. (in English).]
- Александрова Л. М., Старинский В. В., Каприн А. Д. и соавт. Профилактика онкологических заболеваний как основа взаимодействия онкологической службы с первичным звеном здравоохранения // Исследования и практика в медицине. 2017; 4 (1): 74-80. DOI: 10.17709/2409-2231-2017-4-1-10. [Alexandrova L. M., Starinskiy V. V., Kaprin A. D. et al. Profilaktika onkologicheskih zabolevanii kak osnova vzaimodeistviya onkologicheskoi sluzhby s pervichnym zvenom zdravoohraneniya [Prevention of oncological diseases as the basis for interaction of the oncological service with primary health care] // Issledovaniya i praktika v medicine. 2017; 4 (1): 74-80. DOI: 10.17709/2409-2231-2017-4-1-10.]
- Киселев И. Л, Хвостовой В. В., Долгин В. И. и соавт. Анализ общей онкологической настороженности у медицинских работников первичного звена. Материалы Первого Международного Форума онкологии и радиологии. Москва, 23–27 сентября 2019 г. С. 143. [Kiselev I. L., Khvostova V. V., Dolgin V. I. et al. Analiz obshchei onkologicheskoi nastorozhennosti u medicinskih rabotnikov pervichnogo zvena.Materialy Pervogo Mezhdunarodnogo Foruma onkologii i radiologii. [Analysis of malignancies among health care workers in primary care. Materials of the First International Forum of Oncology and Radiology] Moscow, September 23-27, 2019. P. 143.]
- Сычёва А. С., Верткин А. Л., Кебина А. Л. Онкологическая настороженность у пациентов на амбулаторном терапевтическом этапе // Медицинский алфавит. 2021; 7: 41-45. [Sycheva A. S., Vertkin A. L., Kebina A. L. Onkologicheskaya nastorozhennost u patsientov na ambulatornom terapevtichskom etape [Oncological alertness in patients at outpatient therapeutic stage] // Med. alfavit. 2021; 7: 41-45.]
А. С. Сычёва 1
А. Л. Кебина
А. В. Носова, кандидат медицинских наук
А. Л. Вёрткин, доктор медицинских наук, профессор
ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва, Россия
О пухоли кожи занимают особое положение в общей структуре новообразований человека. С одной стороны, они исключительно многообразны по своей клинико-морфологической картине, с другой - легко доступны для клинического и лабораторного исследования. Однако проблема ранней диагностики злокачественной трансформации кожи остается исключительно актуальной проблемой. Неуклонный рост заболеваемости злокачественными новообразованиями кожи и смертности от них сравнивают с «тихой» эпидемией XX века.
В структуре онкологической заболеваемости доля рака кожи колеблется от 0,8% в Японии до 50% в США. Удельный вес меланомы кожи достиг 4% среди всей впервые выявленной онкологической патологии в США в 1990 году.
В России в 1991 году в структуре заболеваемости рак кожи занимал 3 место, а меланома кожи - 9.
Анализ заболеваемости по полу и возрасту показывает, что раком кожи, наиболее часто страдают мужчины. Например, в странах Западной Европы этот показатель составляет 60% от всех впервые выявленных больных.
В России в 1991 году заболеваемость раком кожи женщин в 1,3 раза превысила таковую у мужчин. Эта тенденция характерна как для базально, так и плоскоклеточного рака. Частота и степень риска заболевания раком кожи растет прямо пропорционально возрасту и достигает своего максимума после 75 лет.
Меланома кожи чаще встречается у мужчин в США, Восточной Европе, Норвегии, Швеции, Финляндии.
На территории России женщины страдают меланомой кожи чаще чем мужчины в 1,5 раза. Однако прогноз, как известно, хуже у мужчин.
Какие наиболее реальные и эффективные пути борьбы с большинством форм злокачественных новообразований? П.А. Герцен указывал, что «залог уменьшения числа будущих раков - борьба не против уже образовавшегося рака, а против изменений заведомо могущих завтра стать таковыми». Н.Н. Петров обращал внимание на то, что основными методами профилактики рака являются предупреждение и лечение предраковых болезней.
Конкретным воплощением принципов профилактического направления является диспансеризация населения, т.е. постоянное динамическое наблюдение за состоянием здоровья населения, активное выявление заболеваний на ранних стадиях. Сравнительная оценка эффективности различных форм противораковых мероприятий в разных странах показывает низкую эффективность массовых профилактических осмотров в России. Это объясняется, в первую очередь, плохой организацией диспансерной системы обслуживания больных, в частности, отсутствием преемственности, несоблюдением сроков и объемов проведения.
Еще одной причиной низкой эффективности профилактических осмотров в области дерматоонкологии является отсутствие осмотра пациентов врачом-дерматологом в программе ежегодной диспансеризации.
Анализ причин запущенных форм рака кожи показывает, что на первом месте стоит отсутствие онкологической настороженности, прежде всего дерматологов, хирургов, недостаточное знание врачами других специальностей, клинической картины и течения злокачественных новообразований кожи.
Основные факторы риска, приводящие к развитию злокачественных новообразований кожи, одинаковы для рака кожи и для меланомы: светлая кожа, несклонная к загару, рыжий или светлые волосы, множественные веснушки, невусы, злокачественные новообразования кожи у близких родственников, избыточное ультрафиолетовой облучение. Кроме того, на риск возникновения меланомы кожи оказывают влияние генетические, репродуктивные, гормональные факторы.
В группу повышенного онкологического риска возникновения рака кожи следует включать пациентов старше 50 лет с облигатными и факультативными дерматозами и патологией регенерации.
Облигатные предраковые дерматозы. Эту группу образуют разнородные по клинике - морфологической картине заболевания, которые всегда перерождаются в рак. В эту группу входят: болезнь Боуэна, эритроп-лакия Кейра, болезнь Педжета, лучевой дерматит, пигментная ксеродерма, хейлит Мангатотти, бородавчатый предрак губ. Осмотр дерматологом пациентов этой группы рекомендуется проводить 4 раза в год. При необходимости - осмотр онкологом.
Факультативные предраковые дерматозы. Эту группу образуют различные по этиологическому патогенезу дерматозы, относящиеся к различным классификационным группам, но характеризующиеся на определенном этапе своего развития склонностью к атипичной гиперплазии эпидермиса. В эту группу входят актинический кератоз, кожный рог, керато-акантома, папилломатоз Готгрона, гигантская кандилома, лейкоплакия, предраковый гиперкератоз губ. Осмотр онкологом — по мере необходимости. Осмотр дерматологом пациентов этой группы 2 раза в год.
Дерматозы, с явлениями патологической регенерации, образуют особую группу. При этих дерматозах к возникновению рака ведет не само заболевание, а процессы патологической регенерации кожи на месте очага поражения. В эту группу составляют эритроматоз, туберкулезная волчанка, псориаз с длительностью течения болезни более 15 лет, трофические язвы, обширные рубцы, особенно послеожоговые, хронические неспецифические воспалительные процессы /хроническая язвенная или веге-тирующая пиодермия. Осмотр онкологом - по мере необходимости. Осмотр дерматологом пациентов этой группы 2 раза в год.
Диагностическими критериями, позволяющими заподозрить развитие рака кожи на ранних стадиях, являются следующие признаки:
1. Монотонно прогрессирующее течение без тенденции к инволюции;
2. Наличие в анамнезе постоянно или длительно действующих раздражающих факторов: ультрафиолетового, рентгеновского облучения, применения раздражающих мазей;
3. Отсутствие островоспалительных эксудативных явлений, сочности, яркости красок, преобладание синюшных и буроватых тонов;
4. Резкие границы очага поражения;
5. Легкая кровоточивость поверхности или дна образования;
6. Появление уплотнения в основании образования;
7. Отсутствие субъективных ощущений;
8. Стойкость к проводимой терапии.
В группу повышенного онкологического риска возникновения меланомы кожи следует включать лиц старше 40 лет, с выявленными облигатными или факультативными предшественниками меланомы.
Облигатными предшественниками меланомы являются пигментная ксеродерма /дебют в раннем детстве/, меланоз Дюбрейля, диспластический невус. Осмотр дерматологом пациентов этой группы следует проводить 4 раза в год. Осмотр онкологом 2 раза в год.
Факультативными предшественниками меланомы являются крупный врожденный невоцитарный невус /существующий с рождения/, крупный приобретенный невус, голубой невус. Осмотр дерматологом проводится в этой группе 2 раза в год, онкологом - по мере необходимости.
Диагностическими критериями, способствующими выявлению меланомы на ранних стадиях, являются следующие признаки:
1. Быстрый, зачастую асимметричный, рост очага поражения;
2. Неравномерное изменение пигментации в сторону более темной или светлой окраски;
3. Появление на поверхности очагов гиперкератоза, папилломатозных разрастаний, трещин, ульцирации, кровоточивости;
4. Неравномерное уплотнение в каком-либо участке;
5. Неровные, «рваные» границы, иногда розово-красная кайма или сателлиты по периферии очага поражения;
6. Выпадение волос /ранее имевшихся/;
7. Появление субъективных ощущений /зуд, жжение, болезненность/ ранее отсутствовавших.
В зависимости от степени местного распространения и локализации рака кожи в амбулаторных условиях выполняют вапоризацию /испарение/ лучом лазера или иссечение сфокусированным лучом СО2 - лазера.
При подозрении или наличии меланомы кожи любой локализации пациенты направляются в ЦКБ № 4 МПС им. П.А. Семашко для радикального лечения. Решающими критериями диагностики рака кожи или меланомы являются цитологическое или гистологическое исследования.
Профилактика базальноклеточного рака.
Вопросы профилактики базальноклеточного рака разработаны недостаточно. Интересен опыт профилактики рака кожи в Медицинском Центре УД Президента Российской Федерации. Начиная с 1982 г., в МЦ были разработаны и внедрены в практику скринин-говые программы обследования прикрепленного контингента с целью активного выявления рака основных локализаций, в том числе, и кожи.
В большинстве случаев скрининговые программы реализовывались в условиях поликлиник. Здесь каждый пациент проходил исследования, предусмотренные программой диспансеризации, принятой в МЦ.
Первично-множественную форму базалиомы мы наблюдали у 128 больных, что составило 17% от общего числа наблюдаемых. Число базалиом у этих пациентов варьировало от 2 до 6.
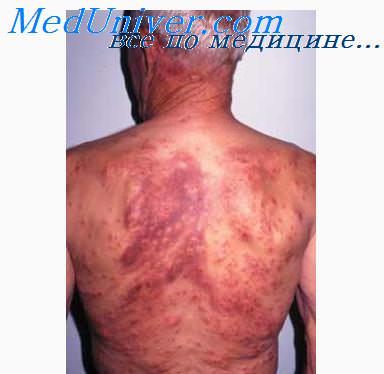
Рецидивы базальноклеточного рака в местах удаленных (пролеченных) опухолей выявлены у 18 больных, в том числе, у 7 (1,1%) с единичными и у 11 (8,6%) с первично-множественными формами базальноклеточного рака. При этом рецидивы в месте их удаления после криотерапии отмечены в 11 случаях, после хирургического иссечения — у 7 больных. При лучевом методе лечения рецидивов не возникало.
При анализе запущенных форм базальноклеточного рака (7 больных с опухолями, размеры которых превышали 1-2 см в диаметре) установлено, что основными причинами запущенности служили: сниженная самооценка состояния больного, прежде всего, обусловленная возрастными особенностями личности; отказ от лечения; наблюдение больных на дому и снижение ответственности за больных со стороны их близких родственников; длительное выбывание пациентов из-под наблюдения врачей поликлиники; недостаточная онкологическая настороженность участковых терапевтов.
Активное выявление и вопросы диспансеризации
Программа активного выявления базальноклеточного рака предусматривала тщательный осмотр кожных покровов пациентов при первичном прикреплении к медицинскому учреждению (ДО-1). Первый этап ДО-I дифференцировал осмот ренный контингент на 2 группы: здоровых и больных. Среди группы здоровых лиц на основе факторов риска формировались группы повышенного онкологического риска по ба-зальноклеточному раку. Наблюдение за ними осуществляли участковые (семейные! терапевты. Цель этого наблюдения — раннее выявление первых признаков базальноклеточного рака. Выявленные больные после проведенного лечения находились под активным диспансерным наблюденим дерматолога (ДО-П) с целью раннего выявления рецидива и возможного лечения.
Опыт наблюдения за больными (более 10 лет) показал, что в настоящее время целесообразно больных с единичными формами базальноклеточного рака без отягощающих факторов риска наблюдать не более 3 лет. Этого срока наблюдения вполне достаточно для уточнения прогноза и выявления возможного рецидива заболевания. При этом осмотр дерматологом проводится в первый год 4 раза, в последующие 2 года 1 раз. Больных с первично-множественным рецидивирующим базальноклеточным раком рекомендуется брать на активное наблюдение сразу пожизненно.
Это обусловлено тем, что у больных первично-множественными формами базальноклеточного рака заболевания число рецидивов в месте лечения опухоли было в 7,8 раза выше, чем у больных с единичной опухолью. Рецидивы в месте удаления базальноклеточного рака у больных с единичной формой заболевания возникали на протяжении первых 3 лет наблюдения, а с множественной — на 3-м и 5-м годах.
В этой группе больных проводилась углубленная ежегодная диспансеризация базальноклеточного рака, направленная на раннее выявление онкологических заболеваний различной локализации. Осмотр дерматологом осуществлялся 4 раза в год в течение первых 5 лет, затем 2 раза в год.
Внедрение данной программы позволило выявлять базальноклеточный рак и его рецидивы, а также сочетанные первично-множественные опухоли внекожных локализаций на самых ранних стадиях. Эта программа давала существенный экономический эффект за счет снижения врачебных нагрузок и сокращения штатного расписания врачей-дерматологов. Программа активного диспансерного наблюдения за больными базальноклеточным раком в условиях многопрофильной поликлиники представлена на схеме.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тактика диспансерного наблюдения больных злокачественными лимфомами кожи.
Известно, что диагностика начальных проявлений злокачественных лимфом кожи затруднительна, поскольку клинические симптомы заболевания в этот период имитируют доброкачественные воспалительные дерматозы: экзему, псориаз, нейродермит, токсикодермию и др. Дополнительные лабораторные методы уточнения диагноза (цитологические, морфологические, иммунологические, иммунофенотипические) также не всегда помогают. В клинических ситуациях, когда комплекс клинических и лабораторных данных не исключает развития в дальнейшем ЗЛК, больной подлежит диспансерному наблюдению как суспициозный в отношении такой возможности. Этот период заболевания наиболее опасный в плане тактических ошибок, которые допускаются врачами при ведении больных ЗЛК. Многолетний опыт наблюдений таких больных позволяет предложить некоторые принципы диспансерного наблюдения больных ЗЛК в начальной стадии заболевания.
Прежде всего врач, курирующий больного, должен ознакомиться с условиями труда пациента с учетом возможных вредных профессиональных факторов, с которыми больной сталкивается на производстве. Тщательный сбор анамнеза нередко помогает выявить ряд аллергенных, канцерогенных и токсических факторов производственного или бытового характера, которые могут играть инициирующую роль в развитии заболевания и/или стимулировать его обострения. При выявлении отрицательных производственных факторов больному с подозрением на ЗЛК или с установленным диагнозом ЗЛК рекомендуется изменить условия труда с целью исключения вредных факторов или (по возможности) прекратить работу на данном производстве.
В быту больному необходимо ограничить контакт с аллергенными веществами бытовой химии — чистящими, моющими и косметическими средствами — шампунями, кремами, содержащими поверхностно-активные вещества, обладающие сенсибилизирующими свойствами. Предпочтение нужно отдавать отечественным сортам мыла, без красителей и отдушек.
Больным, суспициозным в отношении возможности развития злокачественных лимфом кожи, не рекомендуется принимать горячие ванны, посещать бани, парные, пользоваться при мытье жесткими мочалками, проводить растирания и любые другие грубые воздействия на кожу, которые могут иметь стимулирующий эффект на развитие заболевания.
Особое значение имеет фактор инсоляции. Наш опыт свидетельствует о том, что у значительного числа больных загорание явилось пусковым фактором в обострении патологического процесса. До установления точного диагноза, исключающего ЗЛК, больным запрещается инсоляция в любых видах: длительное пребывание на солнце, поездки на юг, УФО в условиях физиотерапевтического кабинета. По-видимому, в этот период больному следует воздержаться от любых физиотерапевтических процедур. В связи с этим нежелательно рекомендовать таким больным санаторно-курортное лечение псориаза. В анамнезе многих больных имеются указания на стимулирование заболевания после массажа, получения радоновых, сероводородных ванн, грязевой терапии.
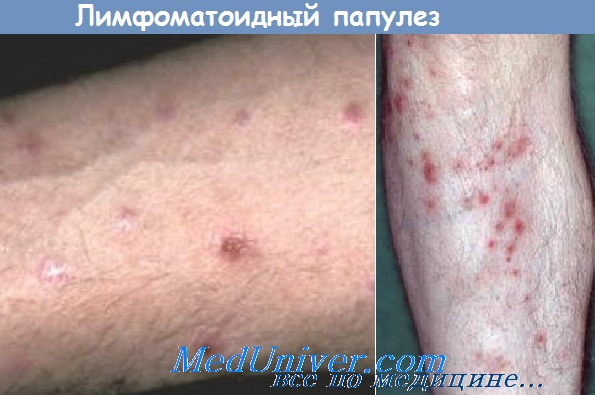
Большое значение для больных, суспициозных в отношении злокачественных лимфом кожи, имеет нерациональное применение наружных средств терапии. Следует признать, что мазевые основы, такие какла-нолин и вазелин, далеко не совершенны и у части больных могут оказывать раздражающее и/или сенсибилизирующее действие при контакте с кожей. Большой вред оказывают также косметические кремы, содержащие химические композиции, обладающие аллергенными свойствами и не рассчитанные на длительные смазывания больших площадей кожного покрова. Больным ЗЛК для смягчения кожи рекомендуется использовать натуральные жиры (топленое нутряное свиное или куриное сало, норковый жир и др.). Подбор натуральных жиров для наружного применения должен проводиться индивидуально с учетом клинической картины заболевания и переносимости.
В некоторых случаях при интенсивном зуде больным рекомендуется добавлять в жировые основы кортикостероидные мази. При этом следует иметь в виду, что длительное нанесение на кожу этих мазей способствует развитию атрофии кожи, в связи с чем их нужно применять не постоянно и осторожно. По-видимому, эти средства следует использовать только в период островоспалительныхявлений. Больным нужно объяснять, какие последствия могут быть от длительного применения этих мазей, равно как и рекомендовать наносить мази на кожу нежно, без интенсивного втирания и механического раздражения кожи.
Весь комплекс указанных мероприятий, хотя и не предотвращает развитие злокачественных лимфом кожи у больных с начальными их проявлениями, но необходим, чтобы исключить стимулирование патологического процесса.
С момента установления диагноза злокачественных лимфом кожи больные подлежат диспансерному наблюдению. Дерматолог определяет необходимость стационарного лечения, по окончании которого больной находится под наблюдением в межкурсовом периоде лечения или во время ремиссии.
Сроки периодических осмотров таких больных не должны носить шаблонный ха рактер. Некоторые больные нуждаются в ежемесячном наблюдении, для других больных эти сроки могут быть пролонгированы до нескольких месяцев. В период между курсами химиотерапии следует обращать внимание на назначение препаратов, устраняющих побочные действия цитостатических и кортикостероидных средств: анемию, лейкопению, вторичные инфекционные заболевания, нарушения белкового и углеводного обмена. В зависимости от состояния больного и объективных данных течения патологического процесса корректируется поддерживающая доза кор-тикостероидных препаратов и определяется время для проведения последующего курса терапии.
Диспансерный осмотр больных злокачественными лимфомами кожи должен включать клинический осмотр с фиксацией внимания врача на таких симптомах заболевания, как интенсивность зуда, распространение процесса, увеличение в размерах инфильтративно-бляшечных и опухолевых очагов, лимфатических узлов, наличие ознобов, потеря массы тела, развитие алопеции, дистрофических изменений ногтей. При посещении врача у больного пальпаторно проверяется состояние печени, селезенки. Периодически проводятся лабораторные анализы, включающие морфологический анализ крови, мочи, биохимические анализы крови на содержание билирубина, аминотрансфераз, глюкозы. При необходимости нужно проводить повторно исследование пунктата лимфатических узлов, биопсию кожи из очагов поражения. При патологических изменениях в морфологическом составе периферической крови назначается консультация гематолога для решения вопроса о целесообразности стернальной пункции или трепанобиопсии.
Диспансерное наблюдение больного злокачественной лимфомой кожи должно осуществляться дерматологом, однако при необходимости назначают консультации гематолога и онколога.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Первичная и вторичная профилактика базальноклеточного рака.
Внедрение разработанной нами дифференцированной программы активного диспансерного наблюдения позволило уточнить подходы к профилактике базальноклеточного рака и выделить принципы первичной и вторичной профилактики.
Первичная профилактика базальноклеточного рака, по нашему мнению, включает активное выявление опухоли на основе ДО-I и ДО-II, основанное на учении о факторах риска; формирование групп повышенного риска и выявление факторов риска; организационно-методическую работу среди врачей общей практики по ранней диагностике онкологических заболеваний кожи; санитарно-просветительную работу среди пациентов.
При формировании групп повышенного онкологического риска базальноклеточного рака необходимо учитывать особенности эпидемиологических и иммуногенетических исследований, что позволяет сократить число пациентов, требующих повышенной онкологической настороженности. Именно этим группам рекомендуется ограничение инсоляции и использование фотопротекторов, а также обязательное лечение предраковых дерматозов.
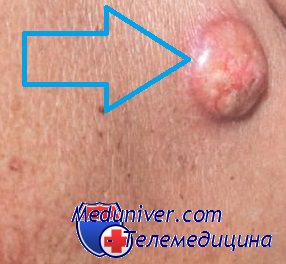
Вторичная профилактика базальноклеточного рака
В меры вторичной профилактики базальноклеточного рака мы включаем радикальное лечение первичной опухоли; раннее выявление и лечение рецидива; предотвращение рецидивов множественного и рецидивирующего рака кожи. Для предотвращения рецидивов множественного рака кожи мы считаем перспективным использование средств иммунокорригирующей терапии, а также применение ретиноидов.
Исследования по изучению иммунного статуса у больных с множественными базалиомами, т.е. мультицентричными формами базальноклеточного рака, подтверждают перспективность этого направления. Наш опыт системного и местного применения ретиноидов, а также данные литературы позволяют предполагать эффективность этого направления. В первую очередь, это касается первично-множественных форм базальноклеточного рака Здесь мы рекомендуем применение малых доз тигазона (неотигазона) по 10 мг/сут 2 раза в неделю 3-месячными курсами в год.
Местное применение 0,25-0,5% ретиноидов на участки удаленных опухолей или с ранними признаками рецидива позволило нам предотвращать их возникновение. Однако эти мероприятия мы считаем необходимыми в комплексной вторичной профилактике первично-множественных форм базальноклеточного рака кожи.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

