Цитология эпителий бронхов это
Обновлено: 07.05.2024
ГБУЗ Ярославской области «Клиническая онкологическая больница», Ярославль
ФГБУ «Московский научно-исследовательский онкологический институт им. Герцена» — филиал ФГБУ «НМИРЦ» МЗ РФ, Москва, Россия, 125284
Военная медицинская часть, Голицыно, Московская область, Россия, Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва
Диагностики эндобронхиальной предопухолевой патологии и ранних форм рака легкого
Журнал: Онкология. Журнал им. П.А. Герцена. 2016;5(5): 66‑71
ГБУЗ Ярославской области «Клиническая онкологическая больница», Ярославль
В настоящее время в мире рак легкого на протяжении последних десятилетий лидирует в структуре заболеваемости и смертности у мужчин. Однако при использовании стандартных рентгеноэндоскопических методов диагностики более 70—80% впервые выявленных больных раком легкого имеют III—IV стадию заболевания, когда радикальное хирургическое лечение невозможно. Развитие центрального рака легкого имеет ступенчатый процесс: трансформация нормального эпителия в гиперпластический, формирование очагов метаплазии, дисплазии, рак in situ (CIS) и микроинвазивный рак. Диагностика рака легкого включает флюорографию, рентгенографию органов грудной клетки, рентгеновскую компьютерную томографию, цитологическое исследование мокроты. Однако ведущую роль в диагностике центрального рака легкого играет эндоскопический метод, который благодаря современным методикам (узкоспектральная эндоскопия, аутофлюоресцентная эндоскопия, увеличительная эндоскопия) позволяет быстро и эффективно выявлять изменения слизистой оболочки трахеобронхиального дерева на разных стадиях канцерогенеза.
ГБУЗ Ярославской области «Клиническая онкологическая больница», Ярославль
ФГБУ «Московский научно-исследовательский онкологический институт им. Герцена» — филиал ФГБУ «НМИРЦ» МЗ РФ, Москва, Россия, 125284
Военная медицинская часть, Голицыно, Московская область, Россия, Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва
Рак легкого в мире на протяжении последних десятилетий остается на первом месте в структуре заболеваемости и смертности у мужчин [1, 2].
Современная медицина располагает новой аппаратурой и высокотехнологичными методиками диагностики рака легкого. В то же время, при использовании стандартных рентгеноэндоскопических методов диагностики более 70—80% впервые выявленных больных раком легкого имеют III—IV стадию заболевания [2, 3]. По данным научно-исследовательских онкологических центов России, Великобритании и Америки смертность при злокачественных опухолях легкого крайне высокая и достигает 87% от числа заболевших [1—4].
Выделяют две основные клинико-морфологические формы рака легкого, отличающиеся степенью злокачественности, частотой и характером метастазирования: 1) немелкоклеточный рак легкого (НМРЛ) и 2) мелкоклеточный рак легкого (МРЛ). К НМРЛ относятся плоскоклеточный, крупноклеточный рак и аденокарцинома. Многие авторы и сейчас пользуются этой терминологией [2, 5, 6]. Но в последних публикациях, в том числе морфологической классификации Всемирной организации здравоохранения (ВОЗ) 2015 г., каждый гистологический тип рассматривается отдельно, понятие НМРЛ не используется, хотя остается легитимным [7, 8].
Считается, что при развитии очага центрального рака легкого эпителий трахеобронхиального дерева проходит следующие ступени канцерогенеза: трансформацию нормального эпителия в гиперпластический, формирование очагов метаплазии, дисплазии, рак in situ (CIS) и микроинвазивный рак [9].
Характеристика интраэпителиальных новообразований бронхиального дерева
Очаги тяжелой дисплазии и CIS слизистой оболочки бронхов, как правило, имеют весьма незначительные размеры: 1—10 мм по плоскости и 200—300 мкм по толщине и не имеют статистически достоверного риска метастазирования [10, 11].
Микроскопические различия интраэпителиальных предраковых новообразований легких представлены в табл. 1.

Таблица 1. Микроскопические признаки плоскоклеточной дисплазии эпителия бронхов различной степени и CIS (W. Travis и соавт. [7])
В случаях формирования очагов дисплазии виде папиллярных структур, с образованием протрузий, приподнятых эпителиальных образований используется понятие ангиогенная плоскоклеточная дисплазия, которая является более агрессивной в динамике своего развития по сравнению с плоскими очагами [12].
Анализ работ, посвященных естественному развитию преинвазивных неоплазий, показал, что уровень прогрессии CIS до инвазивной опухоли оценивали от 39 до 69%, в зависимости от исследуемой группы и длительности наблюдения [13, 14]. В исследовании R. Breuer и соавт. [15] опубликованы результаты, согласно которым 32% очагов тяжелой дисплазии и 9% случаев легкой/средней дисплазии прогрессировали до CIS или инвазивной карциномы за период наблюдения от 11 до 21 мес, но при этом наблюдалась регрессия в 54% преинвазивных неоплазий разных типов.
Начальные формы инвазивного рака легкого
Согласно данным ВОЗ (2015 г.) диагноз микроинвазивная карцинома устанавливается в случае [16], когда:
— размер опухоли ≤3 см ;
— инвазивный компонент ≤5 мм.
К понятию ранний центральный рак легкого относится: рентгеннегативная опухоль, определяемая при бронхоскопии, доступная для верификации с помощью щипцовой биопсии; рост опухоли ограничен внутренними слоями стенки бронха; отсутствуют отдаленные метастазы и не вовлечены медиастинальные лимфатические узлы [17, 18].
Лучевые методы диагностики
Среди основных лучевых методов исследования для выявления рака легкого используются флюорография, рентгенография органов грудной клетки, рентгеновская компьютерная томография (КТ). Главным недостатком флюорографии легких при диагностике рака легкого является низкий уровень чувствительности и точности, а доля ложноположительных и ложноотрицательных заключений достигает 30% [19].
Согласно последним рекомендациям AJCC, рентгенография органов грудной клетки из-за низкой эффективности не рекомендована для скрининга рака легкого [20]. Для скринингового исследования в группах риска развития рака легкого рекомендуется проведение низкодозированной спиральной компьютерной томографии (СКТ) органов грудной клетки [21].
Однако центральные, поверхностно-распространяющиеся опухоли, рост которых происходит без сужения и деформации просвета, даже с помощью КТ, чаще всего выявляют уже в стадии специфической лимфаденопатии.
Цитологическое исследование мокроты
Классическим недорогим и неинвазивным методом скрининга центрального рака легкого является цитологическое исследование мокроты. Образец мокроты считается адекватным при наличии в ней макрофагов или бронхиальных альвеолярных клеток [23]. Однако большим недостатком этого метода является низкая чувствительность, которая в среднем не превышает 65% [24], из-за ошибки забора материала, технических трудностей подготовки материала, а также значительной вариабельности согласованности между специалистами. Вероятность обнаружения атипичных клеток в мокроте увеличивается при центральной локализации рака легкого, большом размере опухоли, более прогрессивных стадиях рака, плоскоклеточном раке (в отличие от аденокарциномы) [25].
Эндоскопические методы диагностики
Еще в 460—370 гг. до нашей эры Гиппократ пытался интубировать дыхательные пути пациентам, нуждающимся в экстренной нормализации дыхания. В 1895 г. отоларинголог Г. Киллиан впервые доложил об удалении инородного тела из правого главного бронха пациента с помощью ригидного бронхоскопа Я. Микулича [26].
Современное бронхологическое исследование является основным методом выявления и диагностики скрытых, ранних, рентгеннегативных форм центрального рака легкого [27, 28].
Последние десятилетия стремительно развиваются эндоскопические методики, такие как бронхоскопия с высоким разрешением изображения, аутофлюоресцентная (autofluorescence bronchoscopy (AFB)) и узкоспектральная эндоскопия (narrow band imaging (NBI)). Параллельно в разных странах идет разработка стандартов трактовки эндоскопического изображения, получаемого с помощью этих методик [29].
Бронхоскопия в белом свете
Бронхоскопия в белом свете (white light bronchoscopy (WLB)) является стандартной современной эндоскопической методикой исследования дыхательных путей, которая имеет наибольшую доказательную базу. Согласно последним (2013) клиническим рекомендациям [31] Американского Колледжа Торакальных Врачей (American College of Chest Physicians), WLB рекомендована для обследования:
— при подозрении на центральный рак легкого по результатам лучевых методов диагностики;
— при выявлении атипических клеток в цитологическом анализе мокроты;
— для динамического наблюдения при преинвазивной неоплазии бронхиального дерева;
— для обследования пациентов с инвазивным центральным раком легкого с целью уточнения границ опухоли и выявления мультифокальных дополнительных очагов рака легкого.
Несмотря на очевидные преимущества WLB в диагностике раннего центрального рака легкого по сравнению с КТ, бронхоскопия в белом свете лимитирована в идентификации интраэпителиальных очагов рака малого размера [30, 31]. Многочисленные исследования подтверждают, что сочетание WLB и новых эндоскопических технологий, таких как AFB и NBI улучшают диагностику предопухолевой патологии и ранних, малоинвазивных форм рака легкого [32—34].
Аутофлюоресцентная бронхоскопия
Спектроскопические диагностические методики исследования принято делить на фотодинамическую диагностику, при которой используются экзогенные и эндогенные фотосенсибилизаторы, и аутофлюоресцентную диагностику, основанную на регистрации флюоресцентной активности эндогенных флюорофоров и изменения оптических свойств очагов неоплазии слизистой оболочки бронхов за счет изменения концентрации в ткани аминокислот, коллагена, эластина и дыхательных ферментов (НАДН и др.) [35, 36]. Изменения аутофлюоресценции ткани связаны со многими факторами: с изменением концентрации и глубины распределения эндогенных флюорофоров; с нарушением тканевой микроархитектоники с увеличением толщины слизистой оболочки и нарушением структуры ее слоев; с изменением степени васкуляризации (концентрации гемоглобина); с изменением уровня обмена веществ в патологически измененной ткани [37, 38].
В современных эндоскопических системах в режиме аутофлюоресценции при освещении слизистой оболочки используется свет длиной волны 395—475 нм для индукции феномена аутофлюоресценции и узкий зеленый спектр света (G-спектр, 500 нм) для фиксирования отраженного изображения. Естественная собственная флюоресценция тканей и отраженный зеленый свет фиксируются специальной сверхчувствительной ПЗС-матрицей, которая располагается на дистальном конце эндоскопа. При этом электронная система искусственно окрашивает аутофлюоресцентное изображение нормальной ткани в зеленый цвет, очаги неоплазии и рака — в пурпурный цвет, синий цвет или в виде темного пятна. Полученные изображения суммируются и отображаются на экране [39].
Большинство авторов считают, что применение AFB повышает частоту выявления скрытых очагов интраэпителиальной неоплазии [40—46].
Основным недостатком AFB является ее низкая специфичность. Выявление значительного количества ложнопозитивных очагов приводит к большому количеству бесполезных гистологических исследований [47].
Узкоспектральная бронхоскопия
NBI — это сравнительно новая эндоскопическая диагностическая методика, которая представлена как альтернативная технология для оценки бронхиального эпителия и выявления раннего рака легкого [48].
Обычно при эндоскопическом исследовании используется весь видимый световой спектр от 400 до 800 нм. Для NBI-режима применяется освещение с использованием двух световых волн длиной 415 и 540 нм в диагностике сосудистых структур слизистой оболочки, так как эти световые волны хорошо поглощаются гемоглобином. Это позволяет получить детальное изображение сосудистого рисунка тканей, его изменений, характерных для патологических участков воспалительного генеза, а также для предраковых заболеваний и ранних форм рака [49].
Основоположник классификации сосудистого рисунка патологических новообразований бронхиального эпителия — K. Shibuya. В 2010 г. К. Shibuya и соавт. [49] опубликовали классификацию, в которой выделили 4 типа патологического сосудистого рисунка: извитые сосуды, точечные сосуды, спиралевидные и штопорообразные сосуды. При этом были измерены диаметры сосудов в патологическом очаге. Авторы показали, что сочетание вышеуказанных типов сосудистого рисунка соответствует неоплазии различной степени злокачественности (табл. 2).

Таблица 2. Распределение типов сосудистого рисунка при разных центральных новообразованиях легких [49]
Была доказана высокая чувствительность и специфичность NBI-режима в сочетании с бронхоскопией высокого разрешения в белом свете для выявления патологии сосудистого рисунка и подтверждена связь степени злокачественности образования с увеличением диаметра сосудов слизистой оболочки.
Другие авторы [50—52] провели исследования по изучению возможностей NBI для анализа изменений сосудистого рисунка (архитектоники) слизистой оболочки бронхиального дерева при проведении дифференциальной диагностики воспалительных и неопластических изменений.
Существует только одно проспективное исследование F. Herth и соавт. [53] по сравнению эффективности WLI, NBI и AFB. Авторы считают, что NBI может существенно увеличить специфичность в диагностике и идентификации эндобронхиальных очагов. В будущем методики NBI и AFI должны дополнять друг друга при комплексном обследовании пациентов с онкологической патологией легких.
Не решенной на данный момент задачей остается отсутствие единой валидизированной NBI-классификации сосудистых рисунков новообразований трахеобронхиального дерева.
Увеличительная бронхоскопия
Увеличительная бронхоскопия — это новейшая эндоскопическая методика, которая позволяет получить изображение поверхности слизистой оболочки бронхов с 100—110-кратным увеличением, благодаря чему возможна детальная оценка микрососудистой сети [49]. Она не является скрининговой и не имеет широкого распространения. Однако в крупных научных центрах уже ведутся работы по изучению и внедрению методики увеличительной бронхоскопии.
Таким образом, в настоящее время существует большой арсенал диагностических методик для выявления предопухолевой патологии и рака легкого на ранних стадиях. Ведущую роль в диагностике центрального рака легкого играет эндоскопический метод, который, благодаря современным методикам, позволяет быстро и эффективно выявлять изменения слизистой оболочки трахеобронхиального дерева на разных стадиях опухолевого процесса. Одним из перспективных направлений в совершенствовании современных эндоскопических методик является разработка автоматизированных систем поддержки принятия клинического решения, которые помогают врачу в интерпретации многофакторного эндоскопического исследования при использовании сложных эндоскопических оптических технологий.
Роль эпителия бронхов при воспалении.
Этот фрагмент не претендует на полноту, поскольку некоторые вопросы, рассматриваемые в других разделах сайта, в частности, роль лимфоцитов в воспалении, описывается в статьях, посвященных роли иммунной системы.
Эпителий бронхов. Большую роль в развитии воспаления бронхов играет повреждение эпителия. Функции его многообразны: во-первых, в эпителии находятся наиболее эффективные антиген-презентирующие дендритные клетки, которые после поглощения антигена мигрируют в региональные лимфоузлы, где контактируют со специфическими Т-лимфоцитами; во-вторых, клетки эпителия экспрессируют разнообразные рецепторы, благодаря которым с эпителиоцитами связываются различные БАВ, клетки воспаления, бактерии и; в-третьих, эпителиоциты активно продуцируют медиаторы, в частности, провоспалительные цитокины, поддерживающие хроническое воспаление.
Велика роль эпителия в регуляции экссудации плазмы в просвет бронхов: клетки эпителия, как и другие типы клеток, продуцируют вазоактивные медиаторы экссудации, включая различные лейкотриены (ЛТ), прежде всего ЛТД4, и фактор активации тромбоцитов (ФАТ), причем, первоначальная экссудация имеет защитное действие, поскольку плазма образует гель, который защищает обнаженную мембрану, поэтому имеется связь между степенью повреждения эпителия (аллергеном, поллютантом, бактерией) и выраженностью плазменной экссудации.
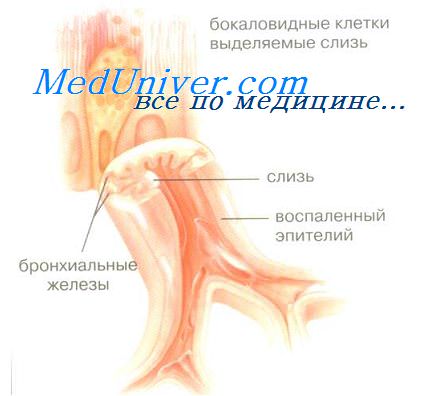
Эпителий продуцирует много провоспалительных цитокинов благодаря выраженной метаболической активности, в частности, метаболит арахидоновой кислоты 15-НЕТЕ (15-гидроксиейкозатетраеновая кислота), который стимулирует продукцию слизи и активирует 5-липоксигеназный путь обмена в тучных клетках, простагландины Е, и F2a, GM-CSP (гранулоцитарно-макрофагаяьный колониестимулируюший фактор), активирующий альвеолярные макрофаги, гранулоциты и базофилы, GCSP (гранулоцитарный колониестимулирующий фактор), интерлейкины (ИЛ), в частности ИЛ-1, ИЛ-6 и ИЛ-8 - хемоаттрактант и активатор эозинофилов и нейтрофилов. Одним из главных хемоаттрактантов, выделяемых эпителием со специфическим привлечением моноцитов - МСР-1 (моноцитарный хемоаттрактантный пептид-1). Эпителий бронхов выделяет также другие медиаторы воспаления: эндотелии-1,- активный вазо- и бронхоконстриктор и активатор фибробластов, цитокины группы RANTES из подсемейства полипептидов В или "С-С" (Regulated on Activation, Normal T-cell Expressed and Secreted), привлекающие эозинофилы, различные факторы роста (PDGE - пластиночный фактор роста, BFGF - основной фактор роста фибробластов, IGE - инсулиноподобный фактор роста),- все из них способны принимать участие в ремоделировании дыхательных путей.
В последнее время большое внимание уделяется выделению эпителием бронхов окиси азота (N0), которая обладает вазо- и бронходилатирующим действием и ее концентрация по-разному изменяется при различных легочных болезнях.
Важным в генезе воспаления является экспрессия различных молекул, прежде всего, молекул адгезии ICAM-I (intercellular adhesion molecnle-I), необходимая для транспорта нейтрофилов и эозинофилов через слизистую в просвет дыхательных путей, а также рецепторов автономной нервной системы, что указывает на влияние автономной нервной системы на функции эпителия и формирование нейрогенного воспаления. Помимо адренорецепторов, мускариновых холинорецепторов (в основном, М3), в последнее время интенсивно изучаются VIP-рецепторы (рецепторы вазоинтестинального пептида), возбудитель которых - VIP -сходен по действию с агонистами и дефицит которого может играть важную роль в патогенезе БА; тахикининовые рецепторы, которые с высокой плотностью находятся на эпителии и опосредуют действие мощных провоспалительных медиаторов - вещества П и нейрокинина А; а также большое количество медиаторных рецепторов, посредством которых различные БАВ модулируют метаболическую активность эпителиоцитов, стимулируют экспрессию других видов рецепторов или, наоборот, тормозят ее.
Таким образом, эпителиоциты действуют как трансдукторы между различными сигналами, возникающими в просвете бронха и на поверхности эпителия, и воспалительными событиями в стенке бронха, причем в нормальных условиях эпителий поддерживает баланс между про- и противовоспалительными эффектами.
При нарушении эпителиального покрова этот баланс нарушается в пользу преобладания провоспалительных эффектов, в просвет бронхов выходят клетки воспаления и жидкая часть плазмы, и при определенных условиях процесс может принять хроническое персистирующее течение.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Цитологическое исследование материала из легких. Цитология эпителия пищеварительного тракта.
Созданная в 1959 г международная номенклатура опухолей человека послужила исходной основой для создания гистологическкх классификаций опухолей специальными комиссиями ВОЗ. В настоящее время имеются 2 серии цитологических классификаций ВОЗ и одна СЭВ, в которых отражены только некоторые локализации новообразований. В вышедшей в 1985 г. книге «Цитологическая диагностика опухолей и предопухолевых процессов» при описании новообразований за основу были взяты имеющиеся гистологические классификации ВОЗ с учетом возможностей цитологического метода и имеющиеся уже цитологические классификации.
При диагностике заболеваний органов дыхания цитологическому исследованию подвергают спонтанно выделенную или индуцированную ингаляцией трипсина мокроту, материал, полученный соскобом, аспирацией, смывом, пункцией, в том числе лимфатических узлов средостения во время бронхоскопии; трансторакальной плевральной пункцией лимфоузлов и средостения. Трудности, встречающиеся при цитологической диагностике заболеваний .четких, связаны с разнородностью клеточных элементов в исследуемом материале, разнородностью нозологических форм, являющихся поводом для цитологического исследования, часто встречающимися метастазами в легкие злокачественных новообразований других локализаций. При различных острых и хронических заболеваниях легких в цитологическом материале имеется комплекс изменений, включающих гиперплазию, метаплазию и дистрофию различных эпителиальных клеток.
При острых воспалительных заболеваниях в эпителии могут развиваться реактивные изменения, симулирующие новообразование и являющиеся причиной ошибочного диагноза, иногда же. наоборот, воспалительный процесс маскирует опухоль.
Достоверная цитологическая диагностика туберкулеза легких основана на обнаружении в мазках из мокроты или содержимого бронхов двух видов клеток эпителноидных и клеток Пирогова — Лангханса.
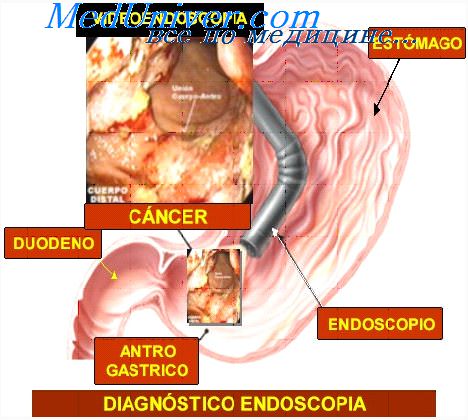
При цитологической диагностике опухолей легких процент обнаружения опухолевых клеток зависит от расположения опухоли в верхних или нижних долях, от формы роста. Около половины всех злокачественных опухолей легкого приходится на долю плоскоклеточного неороговевающего и ороговевающего рака. Цитологический материал при раке легкого характеризуется полиморфизмом размеров и формы клеток, которые располагаются среди слизи и бесструктурных масс.
Клетки плоскоклеточного ороговевающего рака лежат разрозненно или скоплениями. Изредка они располагаются в виде луковиц. Ядра опухолевых клеток, чаще всего гилерхромны, с грубым, неравномерно распределенным хроматином с неровными контурами. По форме ядра — неправильно округлые, палочковидные. Цитоплазма клеток плотная, часто с признаками жировой дегенерации. При плоскоклеточном ороговевающем раке нередко отмечают раннее ороговение.
Плоскоклеточный неороговевающий рак характеризуется наличием крупных округлых клеток, расположенных разрозненно или в виде комплексов. Ядра крупные, расположены центрально и занимают большую часть клетки, хроматин нежный, равномерно распределен по ядру. В ядрах нередко встречаются ядрышки, иногда гипертрофированные.
При железистой форме рака обнаруживают атипичные клетки крупных, средних и иногда мелких размеров округлой, овальной, призматической формы. Клетки расположены разрозненно, в виде железистых структур, папиллярных образований. Ядра крупные, округлой или овальной формы, расположены чаще всего эксцентрично. Хроматин нежный, в ядрах часто видно по нескольку гипертрофированных ядрышек. Встречаются дву- и трехъядерные клетки, цитоплазма очень нежная, в одних клетках она узким ободком окружает ядро, в других — занимает больший объем, вакуолизированная.
В зависимости от степени зрелости клеток можно говорить о степени дифференцировки данного варианта опухоли.
При недифференцированном мелкоклеточном раке опухолевые клетки расположены разрозненно, плотными группами, следующими друг за другом по ходу слизи, скоплениями. Клетки мелкие, округлые, напоминают лимфоциты. Ядра их крупные, плотные, гиперхромные, с компактным хроматином занимают почти всю клетку. Цитоплазма узеньким, еле заметным ободком окружает ядро. В комплексах клетки настолько тесно прилежат друг к другу, что в соседних клетках образуются вдавления, в связи с чем они принимают самую разнообразную форму треугольную, палочковидную, полулунную. Ядра принимают форму клетки.
Крупноклеточный недифференцированный рак характеризуется наличием крупных светлых клеток, расположенных разрозненно или в виде комплексов. Ядра повторяют форму клетки. Хроматин нежно-гранулярный или мелкопетлистый, равномерно распределен по ядру. Цитоплазма узеньким ободком окружает ядро, клетки часто выглядят голоядерными.
При цитологической диагностике заболеваний органов пищеварения исследуются смывы из пищевода, желудка, двенадцатиперстной, сигмовидной, прямой кишки («слепой» способ), целенаправленные смывы под визуальным контролем, аспираты через катетер, подведенный к участку поражения; соскобы нейлоновой щеткой во время эзофаго-, гастро-, дуодено-, сигмо-, ректоскопии; аспираты и соскобы щеткой из общего желчного и главного панкреатического протока во время ретроградной эндоскопической панкреатохолангиографии; пунктаты слюнных желез, печени; пунктаты, соскобы и отпечатки из различных органов брюшной полости при лапароскопии; асцитическая жидкость.
В пищеводе встречаются доброкачественные опухоли, такие как плоскоклеточная папиллома, а также некоторые неопухолевые заболевания эзофагиты различного происхождения, лейкоплакии. При цитологическом исследовании материала, полученного ил пищевода в этих случаях, в препаратах обнаруживается значительное количество клеток плоского эпителия и лейкоцитов. Нередко встречаются эпителиальные клетки в состоянии дистрофии
Из злокачественных новообразований в пищеводе встречают преимущественно плоскоклеточный рак, реже аденокарциному. Для цитологической картины плоскоклеточного рака характерно наличие детрита, разрушенных клеток-чешуек плоского эпителии, крупных полигональных клеток и клеток округлой формы. Ядра клеток грубые, пикнотизированные с неровными контурами, грубым глыбчатым хроматином. Цитоплазма преимущественно широкая, гомогенная от базофильной до почти бесцветной, местами с розоватым оттенком, мелковакуолизированная.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Перестройка бронхиального эпителия при хроническом бронхите.
Определение непрямым методом Кунса иммуноглобулинов классов A, G, М показало их определенную динамику и изменение взаимоотношений между ними. Для первой формы, где взаимоотношения между клетками бронхиального эпителия относительно сохранены и имеются лишь признаки гиперсекреции, в инфильтрате преобладают лимфоциты, лазмоциты и гистиоциты. В плазматических клетках выявляется Ig A. Секреторный иммуноглобулин А локализуется в апикальных отделах реснитчатых клеток. Клетки, синтезирующие Ig M и Ig G, встречаются редко.
Вторая форма характеризуется нарастанием альтеративных изменений в бронхиальных клетках, изменением соотношения между ними в пользу гиперплазированных и гипертрофированных бокаловидных клеток, при интактных пока базальных клетках, сопровождается изменениями местного иммунитета. В инфильтрате, помимо лимфоцитов и плазматических клеток, появляются эозинофилы, тучные клетки, по-линуклеарные нейтрофилы. Число глобулинопродуцирующих клеток, с преобладанием Ig А, значительно увеличивается. В капиллярах активируются эндотелиоциты, которые выглядят гипертрофированными, в них появляются пиноцитозные пузырьки, цитоплазматические выросты. В процесс вовлекается железистый аппарат БВБ, где также отмечается гиперплазия и гипертрофия клеток с накоплением ШИК-положительной слизи в концевых отделах и выводных протоках, лимфоплазмоклеточная инфильтрация стромы желез. В слизистых клетках желез и в апикальной зоне реснитчатых клеток выявляется секреторный иммуноглобулин А.
В дальнейшем, при третьей форме, процесс гиперсекреции бокаловидных клеток переходит в их дистрофию. Практически полностью нарушается реснитчатый покров. Частично реснитчатые и бокаловидные клетки замещаются эпителиоцитами полигональной формы. В эпителии редки клетки, содержащие Ig А, в собственной пластинке слизистой оболочки доминируют плазмоциты, маркированные Ig G. В стенках мелких вен выявляются иммунные комплексы, Ig G и М. Авторы трактуют эти изменения как смену "первой линии защиты" - второй, где ситуацию контролирует Ig G, заменяющий Ig А. Способность Ig G комплексироваться с антигеном с активацией комплемента по классическому пути создает предпосылки для развития иммунокомплексной реакции. В этих условиях нарушение микроокружения базальных клеток, фиксируемое авторами, с изменением дифференцировки и регенерации покровного эпителия, является "существенным звеном в самоподдержании воспалительного процесса".
При четвертой форме у больных находят метаплазию эпителия бронхов в многослойный плоский, инфильтрат собственной пластинки слизистой оболочки - скудный, основу его составляют фибробласты, плазматические клетки и лимфоциты. Собственная пластинка слизистой оболочки бронхов склерозирована. Имеется периваскулярный склероз. Единичные плазматические клетки маркированы Ig А, превалируют клетки с Ig G в цитоплазме, в бронхиальном эпителии секреторный иммуноглобулин А отсутствует.
Таким образом, перестройка бронхиального эпителия при хроническом бронхите сопровождается утратой способности синтезировать секреторный иммуноглобулин А. Это снижает свойства слизистой оболочки (БВБ), тем самым создается порочный круг, в котором важную роль играет состояние местного иммунитета и иммуннопатологические реакции. Развитие работ этого направления внесло некоторые уточнения в характер распределения иммуноглобулинов, в целом подтвердив, что недостаточность местных гуморальных факторов связана с нарушением взаимоотношений в эпителиальном компоненте БВБ.
Не вступая в дискуссию по поводу некоторой условности деления описанного процесса на формы, следует отметить, на наш взгляд, важный факт системной перестройки бронховаскулярного барьера, всех его компонентов при развитии хронического воспаления.
Количественные и качественные изменения в представительстве иммунокомпетентных клеток, заселяющих стромальный компонент БВБ, являются отражением общих системных нарушений иммунитета, предваряющих и сопровождающих развитие и течение хронического бронхита. Убедительно показано наличие дисфункции центральных звеньев иммунитета, наличие тимической недостаточности со снижением количества Т лимфоцитов и их пролиферативной активности, обнаруживаемой тестами с фитогемаглютинином и конканавалином А, особенно при наличии обструктивного синдрома.
Недостаточность неспецифических механизмов, в частности фагоцитарного, определяется исходно сниженной функциональной активностью про- и моноцитов костного мозга у этих больных. Снижены фагоцитарная активность и индекс миграции лейкоцитов на фоне угнетенного энергетического метаболизма. Изменения затрагивают и трахеобронхиальные лимфатические узлы. Тяжелое течение хронического бронхита сопровождается меньшим содержанием плазматических клеток, маркированных иммуноглобулинами классов А и М.
Наши результаты по подсчету различных типов клеток-эффекторов иммунной системы, локализованных в БВБ на уровне дольки при хроническом бронхите без клинических признаков обострения показали, что инфильтрат формируется не только из лимфоцитов. Суммарно - до 15-20% от общего числа клеток приходится на плазматические, тучные клетки, нейтрофильные и эозинофильные лейкоциты. Изменен не только качественный состав хронической воспалительной реакции, меняется характер взаимоотношений, между клетками - эффекторами.
Анализ межклеточных корреляционных связей показал, что при хроническом воспалении бронхов утрачиваются одни и появляются новые варианты кооперативных отношений между клетками иммунной системы. В макрофагах и нейтрофилах высока активность ферментов пентозного шунта и снижена - ферментов гликолиза. В лимфоцитах регистрируется низкая активность одного из ключевых ферментов цикла Кребса - СДГ, более высокая, чем у здоровых людей, активность лизосомального фермента - кислой фосфатазы.
Реактивность организма и ферментативная активность иммунокомпетентных клеток коррелируют, по некоторым данным, с формой и степенью дыхательной недостаточности. Согласно иммунологическим тестам возможны три варианта течения хронического бронхита: с нормальной иммунологической реактивностью - катаральная форма; с селективным увеличением числа циркулирующих "ноль" лимфоцитов в сочетании с недостаточностью антител классов А и G - обструктивная форма; с Т иммунодефицитом, увеличением продукции "ноль" лимфоцитов и антител класса М при недостаточности иммуноглобулина А - длительно текущая обструктивная и гнойно-обструктивная форма.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Лабораторная диагностика легочных и бронхиальных заболеваний основана на исследовании мокроты, бронхиального аспирата, материала щеточной и катетерной биопсии, трансбронхиальной и трансторакальной пункционной аспирационной биопсии, которые составляют обширный раздел практической цитологии [1]. Клиническая цитология - признанный полноценный метод морфологического анализа, основанный на изучении и оценке клеточного материала, полученного различными способами из патологического очага. К преимуществам цитологического исследования мокроты в амбулаторной практике относят ее простоту, быстроту, легкую повторяемость. Последнее позволяет использовать цитологический анализ для изучения динамики морфологических изменений в течение заболевания и в процессе лечения. Кроме того, цитологическое исследование не требует больших материальных затрат, недороги реактивы и оборудование. Все вышеизложенное позволяет широко использовать метод как для морфологической верификации в условиях поликлиники, так и для проведения массовых профилактических осмотров, выбора групп риска с последующим систематическим наблюдением за лицами входящими в группы риска.
Слизистый характер бронхиального секрета обусловлен сочетанным функционированием желез подслизистой оболочки бронхов и бокаловидных клеток эпителия. В ответ на инвазию инфекционными агентами эпителий бронхов выделяет цитоки- ны IL-8, IL-6, колониеобразующие факторы гранулоцитов, моноцитов, и др. Так, тучные клетки выделяют хемотаксические факторы «быстрого реагирования»: эозинофильный хемотаксический фактор анафилаксии; хемотаксический фактор нейтрофилов высокой молекулярной массы; хемотаксические факторы, направленные на лимфоциты, базофилы, моноциты; фактор, активирующий тромбоциты (ФАТ). Усиливается синтез и выделение простогландинов, простациклинов, Т-хелперов. Также увеличивается содержание альвеолярных макрофагов. Они осуществляют фагоцитоз, переработку антигена и «передачу» информации лимфоцитам, предотвращают развитие аллергических реакций. Иммунная защита, секреторная активность являются индукторами микроваскулярного просачивания и секреции слизи.
Цитологическое исследование мокроты позволяет выявить болезнетворные микроорганизмы (в том числе микобакте- рию туберкулеза), клетки злокачественных опухолей, примеси (кровь, гной и т.п.), характерные для определенных болезней, а также определить чувствительность бактериальной флоры к антибиотикам.
Возможно обнаружение в мокроте следующих клеток: эпителиальные клетки, или клетки цилиндрического мерцательного эпителия (при бронхитах, бронхиальной астме или злокачественных новообразованиях легких); бокаловидные клетки (при усиленной секреции); базальные или промежуточные клетки; альвеолярные макрофаги из нижних респираторных отделов. Плоский эпителий попадает в мокроту из полости рта и не имеет диагностического значения. Наличие в мокроте более 25 клеток плоского эпителия указывает на то, что данный образец мокроты загрязнен отделяемым из ротовой полости. Альвеолярные макрофаги локализуется в основном в межальвеолярных перегородках. Поэтому анализ мокроты, где присутствует хотя бы 1 макрофаг, указывает на то, что поражены нижние отделы дыхательной системы. При инфаркте легкого, застое в малом кругу кровообращения обнаруживаются «клетки сердечных пороков», т.е. альвеолярные макрофаги с включениями гемосидерина [2].
Встречаются также и макрофаги с липид- ными включениями (липофаги) при туберкулезе, хроническом заболевании легких. Отмечают повышение в мазке мокроты количества нейтрофилов, лимфоцитов, эозинофилов, моноцитов, «гигантских» клеток Пирогова-Лангерганса. Обнаружение более 25 нейтрофилов в поле зрения свидетельствует об инфекции (пневмония, бронхит). Единичные эозинофилы могут встречаться в любой мокроте; в большом количестве (до 50-90% всех лейкоцитов). Они обнаруживаются при бронхиальной астме, эози- нофильных инфильтратах, глистных инвазиях легких и т.п. Эритроциты появляются в мокроте при разрушении ткани легкого, пневмонии, застое в малом круге кровообращения, инфаркте легкого и т.д. Мокрота может содержать клетки злокачественных опухолей, особенно если опухоль растет эндобронхиально или распадается. Определять клетки как опухолевые можно только в случае нахождения комплекса атипичных полиморфных клеток, особенно если они располагаются вместе с эластическими волокнами.
В мазке мокроты могут встречаться волокнистые образования: эластические волокна, фибриновые волокна и спирали Куршмана (при туберкулезе, абсцессе легкого,раке). Эластические волокна имеют вид тонких двухконтурных волоконец одинаковой на всем протяжении толщины, дихотомически ветвящихся. Эластичные волокна исходят из легочной паренхимы. Выявление в мокроте эластичных волокон свидетельствует о разрушении легочной паренхимы (туберкулез, рак, абсцесс). Иногда их присутствие в мокроте используют для подтверждения диагноза абсцедирую- щей пневмонии.
Кристаллические образования также встречаются в мазке мокроты. Это кристаллы Шарко-Лейдена - бесцветные октаэдры различной величины, напоминающие по форме стрелку компаса, состоящие из белка, освобождающегося при распаде эозинофилов(при бронхиальной астме, эмфиземе, глистных инвазиях); кристаллы гематоидина - ромбы, иголки, звезды от желтого до оранжевого цвета (при некрозе ткани, кровоизлияниях при инфаркте легкого кристаллы холестерина (при распаде ткани - туберкулез, абсцесс легкого, рак); друзы актиномицетов [3]. Мокрота в норме не содержит паразитов и яйца гельминтов. Выявление паразитов позволяет установить природу легочной инвазии, а также диагностировать кишечную инвазию и ее стадию [2].
Читайте также:

