Что такое морфологическое исследование препарата кожи
Обновлено: 05.05.2024
Метод определения Гистологическое исследование биоптатов кожи (окрашивание гематоксилин-эозином) с морфологическим описанием и оценкой согласно гистологической классификации ВОЗ.
Согласно требованиям п. 17 Правил проведения патолого-анатомических исследований, утв. Приказом Минздрава России от 24.03.2016 № 179н, в целях уточнения диагноза заболевания (состояния) с учетом требований стандартов медицинской помощи и клинических рекомендаций (протоколов лечения) по вопросам оказания медицинской помощи на этапе микроскопии биопсийного (операционного) материала врачом-патологоанатомом дополнительно может быть назначено проведение:
- дополнительных методов окраски микропрепаратов (постановки реакции, определения) - гистохимических, иммуногистохимических, электронно-микроскопических, молекулярно-биологических, генетических и иных методов;
- дополнительных методов микроскопии - поляризационной, флуоресцентной, трансмиссионной или сканирующей электронной и иных методов.
Применение вышеуказанных методов исследования, назначенных врачом-патологоанатомом при проведении исследования в целях уточнения диагноза заболевания (состояния), подлежит дополнительной оплате по стоимости, указанной в утвержденном прайс-листе медицинского центра ИНВИТРО
Гистологическое исследование биоптатов кожи при наиболее тяжелых и распространенных заболеваниях, трудно поддающихся лечению из-за неясности пато- и гистогенеза многих из них (аллергические заболевания кожи, болезни обменного характера, генетически детерминированные заболевания, неинфекционные эритематозные, эритематозно-сквамозные и папулезные болезни, везикулобуллезные (везикулопустулезные) болезни, сосудистые поражения, болезни соединительной ткани, гранулематозные, инфекционные, вирусные и паразитарные болезни кожи).
В диагностике неонкологических болезней кожи большое значение имеет морфологическое (патогистологическое) исследование. Известно более тысячи неопухолевых заболеваний кожи, многие из которых, сходные по клиническим проявлениям, имеют разную этиологию и морфологическую картину. Биопсийное исследование дает возможность диагностировать заболевание на разных этапах его развития, определить стадию процесса, форму той или иной болезни.
Гистологическое исследование в дерматологии имеет свои методологические границы. В части случаев установить точный диагноз при морфологическом исследовании биоптата невозможно. Лишь немногие дерматозы, кроме опухолей, имеют характерное (специфичное) гистологическое строение. Чаще гистологическая картина позволяет только предполагать той или иной диагноз, а может быть совершенно неспецифичной.
Значение гистопатологического исследования часто заключается в подтверждении клинического диагноза или исключении тех дерматозов, диагностика которых основывалась на клинической картине заболевания.
Наибольшие трудности встречаются при гистологическом исследовании большой группы неинфекционных воспалительных дерматозов. При чешуйчатом и красном плоском лишае, красной волчанке гистологические изменения обычно специфичны, однако гистологический диагноз может быть только предположительным. При розовом лишае и парапсориазе гистологические изменения всегда неспецифичны. В случаях инфекционных заболеваний (глубокие микозы, туберкулез, сифилис) клинический диагноз может быть установлен только после применения более точных (ПЦР, иммунофлуоресценция) дополнительных методов определения возбудителя.
Сочетание клинических и морфологических данных делает клиническую диагностику возможной даже в тех случаях, когда изменения в структурах кожи не являются характерными.
Наиболее информативное гистологическое исследование возможно при получении патологоанатомом детальных клинических данных, включая дифференциальный диагноз и фотографии пораженного очага. Важно корректно провести биопсию пораженного очага. Гистологическое исследование полностью развившегося патологического элемента более информативно, чем исследование свежего или развивающегося элемента. Как правило, не рекомендуется включать нормальную ткань в участок биопсии (У.Ф. Левер, 2014) – многие дерматозы характеризуются гистологическими изменениями нижней части дермы и подкожной жировой ткани. Если на коже имеется несколько типов высыпных элементов, для точного гистологического диагноза целесообразно исследовать все.
Первый этап диагностики любого поражения кожи включает анализ анамнеза, симптомов, возникновения и течения заболевания, его продолжительности, локализации патологических изменений и других факторов экзогенного или эндогенного характера, в том числе эндокринных, обменных, нервных и иммунных нарушений. Большое значение имеют данные о давности заболевания, сезонности и склонности к рецидивам.
Пребывание больных в эндемичных районах позволяет установить диагноз инфекционных дерматозов (лейшманиоза, лепры, тропических трепонематозов и др.); работа с животными позволяет заподозрить глубокую трихофитию, сибирскую язву. Контакт с неблагоприятной профессиональной средой (углеводороды, химические соединения) обусловливает возникновение профессиональных дерматитов, экземы, меланодермий.
Метод определения Гистологическое исследование биоптатов кожи (окрашивание гематоксилин-эозином) с морфологическим описанием и оценкой согласно гистологической классификации ВОЗ.
Согласно требованиям п. 17 Правил проведения патолого-анатомических исследований, утв. Приказом Минздрава России от 24.03.2016 № 179н, в целях уточнения диагноза заболевания (состояния) с учетом требований стандартов медицинской помощи и клинических рекомендаций (протоколов лечения) по вопросам оказания медицинской помощи на этапе микроскопии биопсийного (операционного) материала врачом-патологоанатомом дополнительно может быть назначено проведение:
- дополнительных методов окраски микропрепаратов (постановки реакции, определения) - гистохимических, иммуногистохимических, электронно-микроскопических, молекулярно-биологических, генетических и иных методов;
- дополнительных методов микроскопии - поляризационной, флуоресцентной, трансмиссионной или сканирующей электронной и иных методов.
Применение вышеуказанных методов исследования, назначенных врачом-патологоанатомом при проведении исследования в целях уточнения диагноза заболевания (состояния), подлежит дополнительной оплате по стоимости, указанной в утвержденном прайс-листе медицинского центра ИНВИТРО
Гистологическое исследование биоптатов кожи при наиболее тяжелых и распространенных заболеваниях, трудно поддающихся лечению из-за неясности пато- и гистогенеза многих из них (аллергические заболевания кожи, болезни обменного характера, генетически детерминированные заболевания, неинфекционные эритематозные, эритематозно-сквамозные и папулезные болезни, везикулобуллезные (везикулопустулезные) болезни, сосудистые поражения, болезни соединительной ткани, гранулематозные, инфекционные, вирусные и паразитарные болезни кожи).
В диагностике неонкологических болезней кожи большое значение имеет морфологическое (патогистологическое) исследование. Известно более тысячи неопухолевых заболеваний кожи, многие из которых, сходные по клиническим проявлениям, имеют разную этиологию и морфологическую картину. Биопсийное исследование дает возможность диагностировать заболевание на разных этапах его развития, определить стадию процесса, форму той или иной болезни.
Гистологическое исследование в дерматологии имеет свои методологические границы. В части случаев установить точный диагноз при морфологическом исследовании биоптата невозможно. Лишь немногие дерматозы, кроме опухолей, имеют характерное (специфичное) гистологическое строение. Чаще гистологическая картина позволяет только предполагать той или иной диагноз, а может быть совершенно неспецифичной.
Значение гистопатологического исследования часто заключается в подтверждении клинического диагноза или исключении тех дерматозов, диагностика которых основывалась на клинической картине заболевания.
Наибольшие трудности встречаются при гистологическом исследовании большой группы неинфекционных воспалительных дерматозов. При чешуйчатом и красном плоском лишае, красной волчанке гистологические изменения обычно специфичны, однако гистологический диагноз может быть только предположительным. При розовом лишае и парапсориазе гистологические изменения всегда неспецифичны. В случаях инфекционных заболеваний (глубокие микозы, туберкулез, сифилис) клинический диагноз может быть установлен только после применения более точных (ПЦР, иммунофлуоресценция) дополнительных методов определения возбудителя.
Сочетание клинических и морфологических данных делает клиническую диагностику возможной даже в тех случаях, когда изменения в структурах кожи не являются характерными.
Наиболее информативное гистологическое исследование возможно при получении патологоанатомом детальных клинических данных, включая дифференциальный диагноз и фотографии пораженного очага. Важно корректно провести биопсию пораженного очага. Гистологическое исследование полностью развившегося патологического элемента более информативно, чем исследование свежего или развивающегося элемента. Как правило, не рекомендуется включать нормальную ткань в участок биопсии (У.Ф. Левер, 2014) – многие дерматозы характеризуются гистологическими изменениями нижней части дермы и подкожной жировой ткани. Если на коже имеется несколько типов высыпных элементов, для точного гистологического диагноза целесообразно исследовать все.
Первый этап диагностики любого поражения кожи включает анализ анамнеза, симптомов, возникновения и течения заболевания, его продолжительности, локализации патологических изменений и других факторов экзогенного или эндогенного характера, в том числе эндокринных, обменных, нервных и иммунных нарушений. Большое значение имеют данные о давности заболевания, сезонности и склонности к рецидивам.
Пребывание больных в эндемичных районах позволяет установить диагноз инфекционных дерматозов (лейшманиоза, лепры, тропических трепонематозов и др.); работа с животными позволяет заподозрить глубокую трихофитию, сибирскую язву. Контакт с неблагоприятной профессиональной средой (углеводороды, химические соединения) обусловливает возникновение профессиональных дерматитов, экземы, меланодермий.
Меня зовут Дмитрий Бейнусов, я – врач-дерматоонколог, занимаюсь лечением опухолей кожи: доброкачественных и злокачественных.

Гистологическое исследование опухолей, т. е. изучение характеристик ткани опухоли под микроскопом имеет большое, а иногда и решающее значение для лечения и прогноза. С 2011 года я направляю все удаленные образования кожи специалистам Национального центра клинической морфологической диагностики (НЦКМД); они уже почти 8 лет помогают мне с точной диагностикой.
Эту статью я написал с целью помочь своим пациентам и коллегам лучше ориентироваться в процессе гистологического исследования и понять, как это важно для лечения образований кожи.
Прочитайте эту статью до конца, и вы увидите, как в современных морфологических лабораториях максимально быстро и качественно выполняют исследования, а также сводят к минимуму вероятность человеческой ошибки.
Что такое гистологическое исследование и зачем его проводят
Согласно клиническим рекомендациям Минздрава РФ (2018), гистологическое (морфологическое) исследование – это стандарт диагностики при исследовании опухолей кожи и в первую очередь при подозрении на меланому или рак. Это обусловлено тем, что в настоящее время нет более точного метода для определения характера удаленного образования кожи.
Ни дерматоскопия, ни простой соскоб или пункция с последующим цитологическим исследованием, ни тем более простой визуальный осмотр подозрительной родинки не могут заменить гистологического исследования.
Мифы о гистологическом исследовании
Если ввести в поисковой строке слова «гистология родинки» или «гистология меланома» и посмотреть содержание первых, создается достаточно пугающее впечатление:
- здесь перепутали родинки разных людей;
- в этой лаборатории исследование делают 3 месяца;
- тут не сообщили пациенту об опасном диагнозе;
- там ошиблись с диагнозом, что закончилось печально.
К сожалению, после ознакомления с информацией в отечественном интернете создается ощущение, что в нашей стране нередко гистологические исследования образований кожи делают «на коленке» и «неизвестно кто и где».
В статье я покажу, что есть другая реальность. Кроме того, назову ошибки, которые могут возникнуть на различных этапах исследования, и, самое главное, какими способами их исключить.
Важные для пациента моменты на этапах гистологического исследования операционного и биопсийного материала кожи
Наш путь начинается в тот момент, когда удаленная опухоль кожи, например родинка, попадает в лабораторию.
Предположим, что врач сделал все правильно.
- Родинку сразу после удаления поместил в герметичный контейнер с формалином.

- Приложил к контейнеру направление на морфологическое исследование, которое поможет патоморфологу поставить точный диагноз.

Если врач все сделал именно так – смело сдаем контейнер и направление в лабораторию.

Администратор, получивший контейнер с родинкой, регистрирует ее – присваивает уникальный номер и QR-код. Эти данные, фамилию и инициалы пациента пишут на специальной кассете, в которой удаленная родинка пройдет все этапы исследования. Мне удалось заснять процесс изготовления кассет и их маркировки:
Все рабочие места врачей и лаборантов оборудованы сканерами QR-кодов. Они позволяют на любом технологическом этапе определить, кому принадлежит материал, и работать с ним. Таким образом, ошибка «перепутали родинки разных людей» в лаборатории исключена.
В Центре трепетно относятся к личным данным пациентов, поэтому Ф. И. О. на этом и других фото намеренно закрыты.

2. «Вырезка» и «фиксация»
Далее родинку внимательно осмотрят, опишут в протоколе и поместят особым образом в специальную пластиковую кассету для дальнейшего процесса. Весь процесс фиксируют на цифровую камеру. Видео понадобится в случаях неправильного расположения части родинки в кассете, когда нужно будет вернуться к этому этапу и переориентировать фрагмент.

Из промаркированного контейнера с транспортной средой извлекают родинку (невус):

Далее пигментное образование разделяют на несколько частей таким образом, чтобы для гистологического исследования были доступны все участки образования. Здесь все нужно сделать правильно, чтобы точно определить толщину меланомы по Бреслоу, состояние краев резекции кожи с опухолью – эти параметры имеют решающее значение в оценке адекватности операции и в прогнозе заболевания.
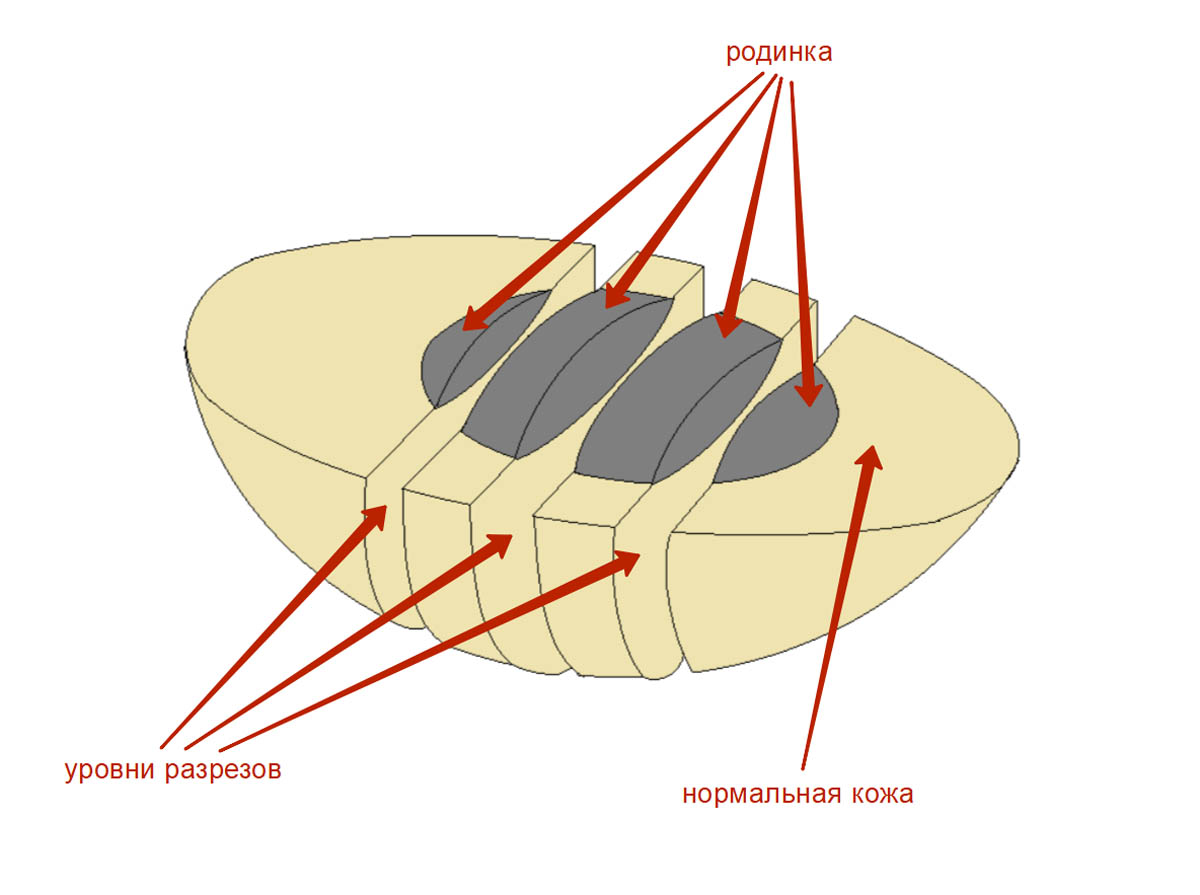
На кассете с родинкой пишут фамилию и инициалы пациента, которые были указаны на контейнере, а также QR-код и персональный числовой код.

Фрагменты размещают в кассете параллельно плоскости ее дна, как показано на картинке ниже. Если фрагмент положить перпендикулярно плоскости кассеты – это может затруднить оценку краев резекции, т. е. полноты удаления родинки или меланомы.
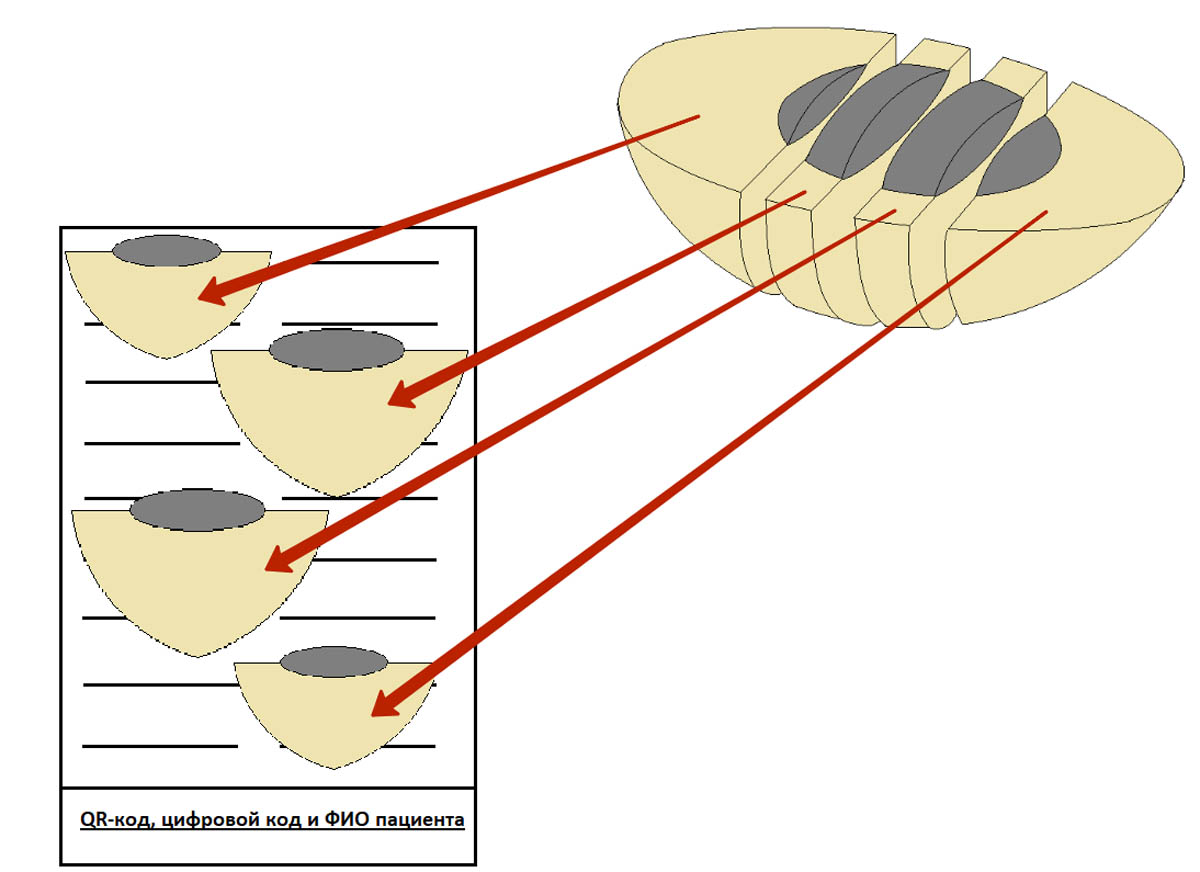
На правильном размещении фрагментов в кассете остановимся подробнее. Это очень важный момент, который позволяет избежать неинформативных срезов в будущем.
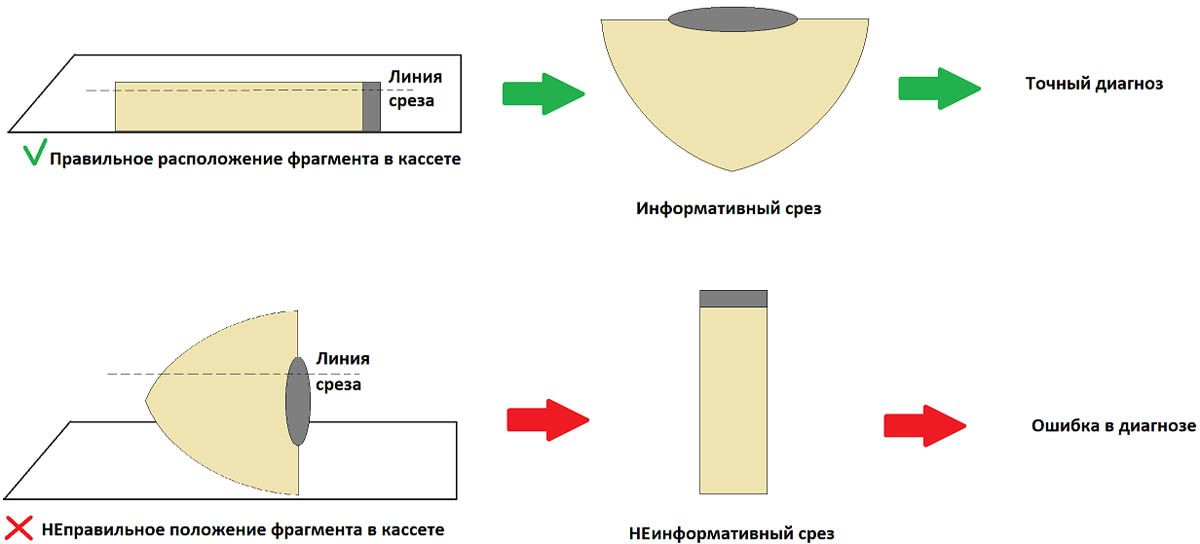
Чтобы исключить подобные ошибки, в процессе исследования используют автоматизированное оборудование.
После того как фрагмент уложат правильно, кассету плотно закрывают, что исключает утрату кусочков и переориентацию на последующем этапе 18–24-часовой фиксации операционного материала в специальном растворе (формалине).

3. Проводка
Этот этап проходит полностью в автоматическом режиме. Лаборант только загружает кассеты в гистопроцессор, выбирает программу и запускает ее.

Кассеты помещают в металлический бокс специальной камеры в верхней части аппарата.

Растворы из резервуаров в нижней части аппарата по очереди перекачиваются в камеру с кассетами. Каждая жидкость контактирует с фрагментами родинки (невуса) в течение определенного времени, после чего ее откачивают из камеры и заливают новую.

Кассета с фрагментами родинки проходит сложный процесс обезвоживания и подготовки к следующему этапу. Внешний вид ее остается прежним, но внутри происходят изменения:

После завершения этого этапа фрагменты уменьшаются, именно поэтому размеры родинки на стеклопрепарате при гистологическом исследовании примерно на 10 % меньше, чем ее реальный размер до удаления на коже.
4. Заливка парафином
Чтобы изготовить максимально тонкий срез с родинки, ее нужно надежно зафиксировать внутри плотного материала. Парафин идеально подходит для этого – он становится жидким при 56–58 градусах и быстро застывает уже при комнатной температуре.

На этом этапе, как и на предыдущем, все делает автомат, лаборант лишь загружает кассеты без парафина и достает уже готовые к получению срезов парафиновые блоки.
Автоматический процесс обеспечивает самое важное – неизменное положение фрагментов родинки (невуса) в кассете. Оно остается неизменным с момента, когда патоморфолог разделил родинку на несколько фрагментов и аккуратно уложил их в кассеты (см. раздел «Вырезка»).
Конечный продукт этого этапа – фрагмент родинки (невуса) с сохраненной исходной ориентацией и залитый парафином.

5. Приготовление срезов
Этот этап выполняет лаборант. Прибор, делающий тканевые срезы толщиной в несколько микронов, называется микротом. Срезы настолько тонкие, что разрушаются, если брать их руками. Поэтому сразу после нарезки их переносят в воду определенной температуры, а из нее – сразу на предметное стекло с персональной наклейкой с QR-кодом, числовым номером и Ф. И. О. пациента.
Конечный продукт этого этапа – НЕокрашенный срез из парафинового блока, расположенный на предметном стекле.
6. Окраска и «заключение» окрашенных срезов
На этом этапе лаборант загружает неокрашенные стекла в специальный аппарат, выбирает программу автоматической окраски и запускает ее. Вероятность любых технологических ошибок при этом сведена к нулю.
Роботизированный аппарат переносит кюретку с окрашиваемыми стеклами поочередно из одного красителя в другой, задерживаясь в одном положении в течение запрограммированного времени. После завершения окраски срезы автоматически покрываются специальной пленкой для защиты от повреждений при исследовании и последующем длительном хранении.
Вот красивый ролик о процессе с сайта производителя оборудования:
А вот небольшой фрагмент работы аппарата в лаборатории, который мне удалось заснять:
После завершения процесса из агрегата извлекают полностью готовые для последнего исследования стеклопрепараты.
8. Изучение препарата врачом-патоморфологом
Наконец родинка (невус) готова к изучению под микроскопом.
В современной лаборатории, такой как НЦКМД, на этом этапе также используются современные и высокие технологии. Но есть два момента, на которые, на мой взгляд, стоит обратить особое внимание.
Морфометрия
С помощью адаптера для микроскопа и специализированной программы врач-патоморфолог на экране компьютера измеряет параметры удаленной родинки в микрометрах (микронах).
Мне, как дерматоонкологу, это особенно важно для последующих измерений, к примеру, толщины по Бреслоу в случаях меланомы, а также расстояний от края опухоли до края резекции.

На картинках ниже примеры программного измерения различных участков препарата невуса кожи:
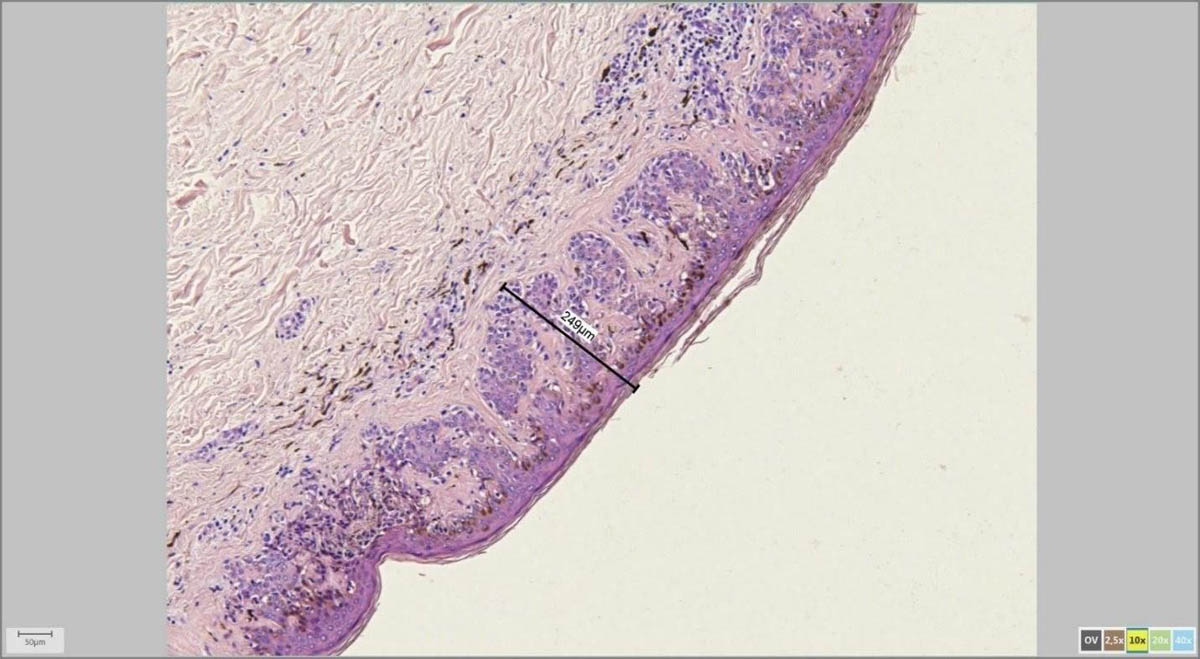
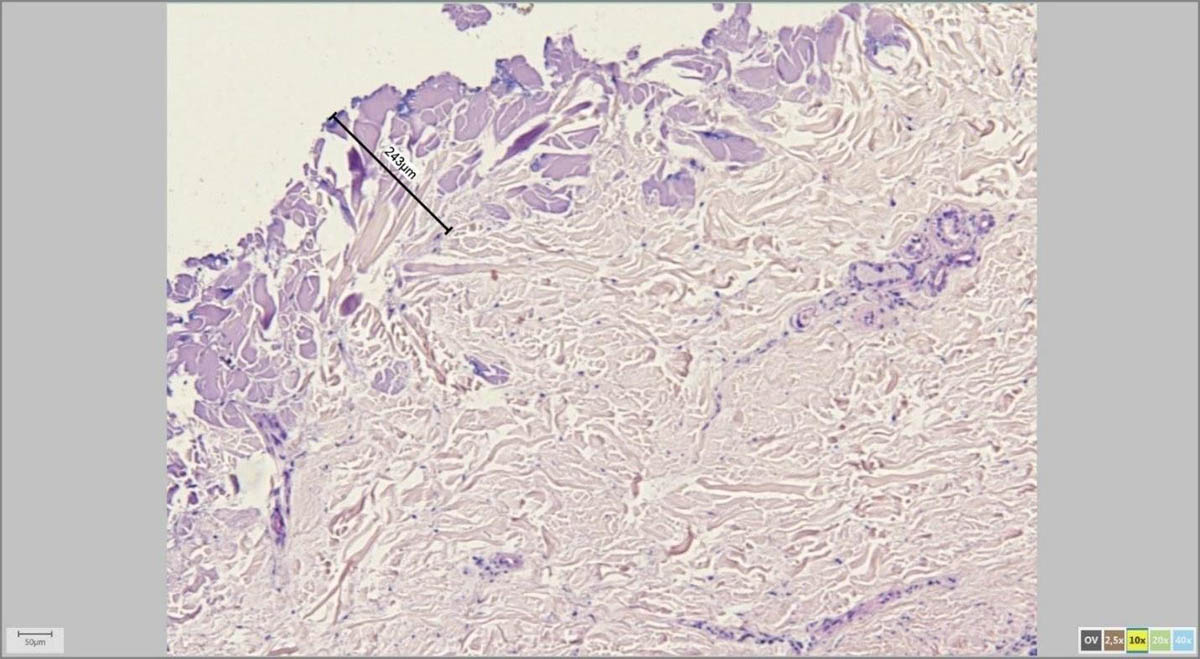
Коллегиальное мнение
До недавнего времени я не знал, что все заключения НЦКМД с диагнозом «злокачественная опухоль» выходят с подписью нескольких морфологов. Такой подход мне нравится и лишний раз подтверждает, что я не ошибся с выбором лаборатории.
Удаленные консультации
Благодаря передаче изображений препаратов на компьютер, открываются широкие возможности. На картинке ниже – специальный сканер гистологических препаратов VisionTek:

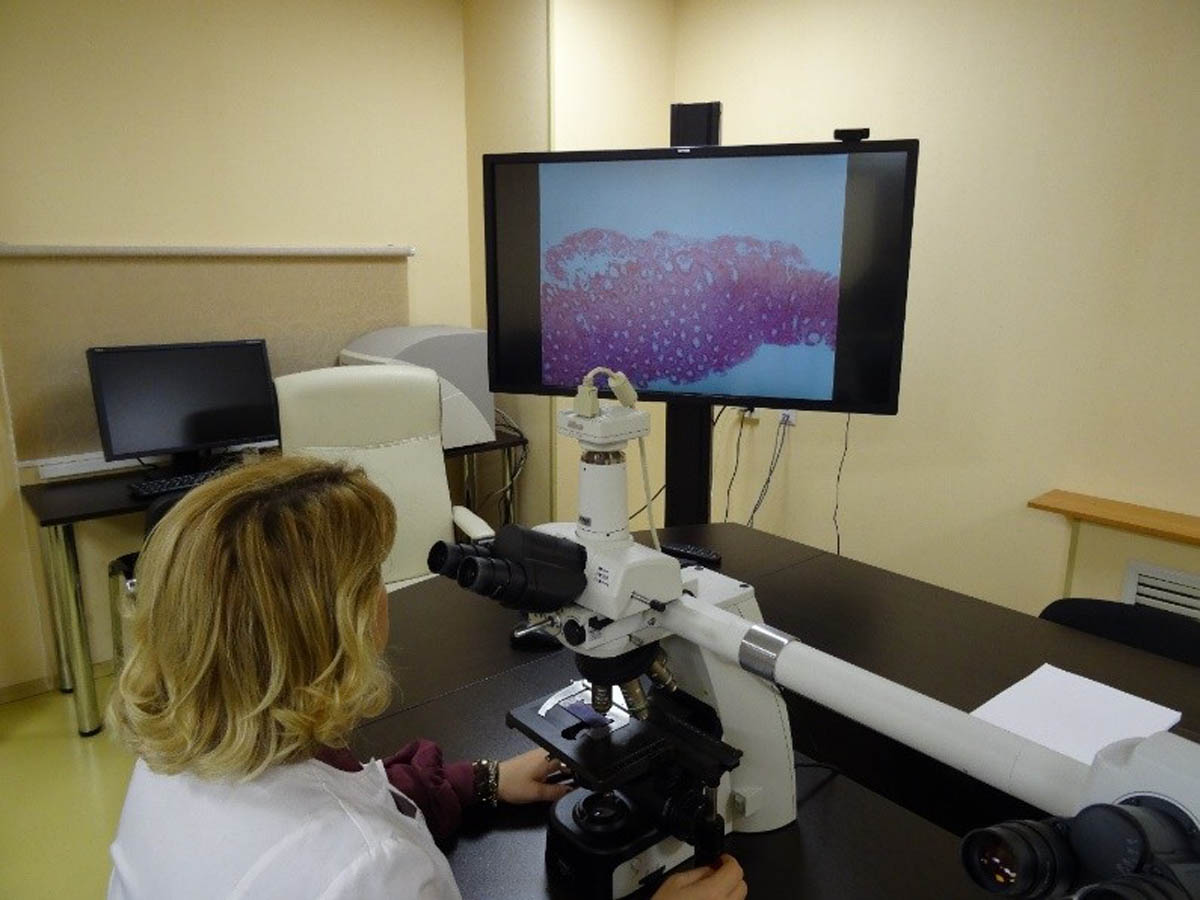
Он позволяет врачам-патоморфологам:
- Сканировать препараты в высоком разрешении, пересылать с помощью IT-технологий в другой город или страну, обсуждая результаты исследований с коллегами в нашей стране и за рубежом.

- Проводить презентации, клинические разборы и обучение, в том числе и телеконференции.

- Сохранять большое число изображений препаратов, которые не требуют физического места для хранения

9. Выдача заключения пациенту
Времена, когда гистологическое заключение выдавали в определенное время и ехать за ним нужно было через весь город, давно прошли. Сейчас результаты исследований из патоморфологической лаборатории отправляют по электронной почте сразу по мере готовности. Национальный центр клинической морфологической диагностики использует эту форму связи с медицинскими учреждениями и пациентами более 4 лет.
В заключении обязательно будут отмечены важные моменты:

- Название учреждения.
- Номер исследования.
- Патоморфологический диагноз.
- Дата исследования.
- Фамилия врача, выполнившего исследование.
Заключение
Теперь вы в деталях знаете, какой путь проходит удаленное образование кожи в современной патоморфологической лаборатории.
Коротко перечислю главные преимущества Центра, благодаря которым я сотрудничаю с этой лабораторией:
- Высокий уровень организации, автоматизации процессов регистрации и пробоподготовки операционного и биопсийного материала и адекватная подготовка лаборантов сводят вероятность ошибок к минимуму.
- Высокая квалификация врачей, возможность коллегиального мнения, в т. ч. с привлечением ведущих специалистов других учреждений, что является залогом точной диагностики.
- От момента регистрации контейнера с родинкой до отправки заключения на еmail проходит менее 48 часов, а не 7–10 дней как во многих других лабораториях.
Я, как дерматоонколог, уверен, что, отправив удаленное образование кожи в НЦКМД, гарантированно получу достоверный диагноз.
P.S. От всего сердца хочу поблагодарить сотрудников Национального центра клинической морфологической диагностики, без помощи которых я бы не написал эту статью.
Метод определения Гистологическое исследование биоптатов кожи (окрашивание гематоксилин-эозином) с морфологическим описанием и оценкой согласно гистологической классификации ВОЗ.
Согласно требованиям п. 17 Правил проведения патолого-анатомических исследований, утв. Приказом Минздрава России от 24.03.2016 № 179н, в целях уточнения диагноза заболевания (состояния) с учетом требований стандартов медицинской помощи и клинических рекомендаций (протоколов лечения) по вопросам оказания медицинской помощи на этапе микроскопии биопсийного (операционного) материала врачом-патологоанатомом дополнительно может быть назначено проведение:
- дополнительных методов окраски микропрепаратов (постановки реакции, определения) - гистохимических, иммуногистохимических, электронно-микроскопических, молекулярно-биологических, генетических и иных методов;
- дополнительных методов микроскопии - поляризационной, флуоресцентной, трансмиссионной или сканирующей электронной и иных методов.
Применение вышеуказанных методов исследования, назначенных врачом-патологоанатомом при проведении исследования в целях уточнения диагноза заболевания (состояния), подлежит дополнительной оплате по стоимости, указанной в утвержденном прайс-листе медицинского центра ИНВИТРО
Гистологическое исследование биоптатов кожи при наиболее тяжелых и распространенных заболеваниях, трудно поддающихся лечению из-за неясности пато- и гистогенеза многих из них (аллергические заболевания кожи, болезни обменного характера, генетически детерминированные заболевания, неинфекционные эритематозные, эритематозно-сквамозные и папулезные болезни, везикулобуллезные (везикулопустулезные) болезни, сосудистые поражения, болезни соединительной ткани, гранулематозные, инфекционные, вирусные и паразитарные болезни кожи).
В диагностике неонкологических болезней кожи большое значение имеет морфологическое (патогистологическое) исследование. Известно более тысячи неопухолевых заболеваний кожи, многие из которых, сходные по клиническим проявлениям, имеют разную этиологию и морфологическую картину. Биопсийное исследование дает возможность диагностировать заболевание на разных этапах его развития, определить стадию процесса, форму той или иной болезни.
Гистологическое исследование в дерматологии имеет свои методологические границы. В части случаев установить точный диагноз при морфологическом исследовании биоптата невозможно. Лишь немногие дерматозы, кроме опухолей, имеют характерное (специфичное) гистологическое строение. Чаще гистологическая картина позволяет только предполагать той или иной диагноз, а может быть совершенно неспецифичной.
Значение гистопатологического исследования часто заключается в подтверждении клинического диагноза или исключении тех дерматозов, диагностика которых основывалась на клинической картине заболевания.
Наибольшие трудности встречаются при гистологическом исследовании большой группы неинфекционных воспалительных дерматозов. При чешуйчатом и красном плоском лишае, красной волчанке гистологические изменения обычно специфичны, однако гистологический диагноз может быть только предположительным. При розовом лишае и парапсориазе гистологические изменения всегда неспецифичны. В случаях инфекционных заболеваний (глубокие микозы, туберкулез, сифилис) клинический диагноз может быть установлен только после применения более точных (ПЦР, иммунофлуоресценция) дополнительных методов определения возбудителя.
Сочетание клинических и морфологических данных делает клиническую диагностику возможной даже в тех случаях, когда изменения в структурах кожи не являются характерными.
Наиболее информативное гистологическое исследование возможно при получении патологоанатомом детальных клинических данных, включая дифференциальный диагноз и фотографии пораженного очага. Важно корректно провести биопсию пораженного очага. Гистологическое исследование полностью развившегося патологического элемента более информативно, чем исследование свежего или развивающегося элемента. Как правило, не рекомендуется включать нормальную ткань в участок биопсии (У.Ф. Левер, 2014) – многие дерматозы характеризуются гистологическими изменениями нижней части дермы и подкожной жировой ткани. Если на коже имеется несколько типов высыпных элементов, для точного гистологического диагноза целесообразно исследовать все.
Первый этап диагностики любого поражения кожи включает анализ анамнеза, симптомов, возникновения и течения заболевания, его продолжительности, локализации патологических изменений и других факторов экзогенного или эндогенного характера, в том числе эндокринных, обменных, нервных и иммунных нарушений. Большое значение имеют данные о давности заболевания, сезонности и склонности к рецидивам.
Пребывание больных в эндемичных районах позволяет установить диагноз инфекционных дерматозов (лейшманиоза, лепры, тропических трепонематозов и др.); работа с животными позволяет заподозрить глубокую трихофитию, сибирскую язву. Контакт с неблагоприятной профессиональной средой (углеводороды, химические соединения) обусловливает возникновение профессиональных дерматитов, экземы, меланодермий.
Эффективность лечения рака зависит не только от развития методов терапии - без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее - определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой - исследование образцов опухолевых клеток.

С каким образцами опухолевых клеток работает патоморфология?
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Зачем изучать опухоли под микроскопом?
Количество известных разновидностей опухолей - велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог - ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире - неверны. Половина этих ошибок не становятся фатальными - различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория - это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Гистология и иммуногистохимия - в чем отличие?
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли - т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению - иммуногистохимия.
Зачем нужно иммуногистохимическое исследование?
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
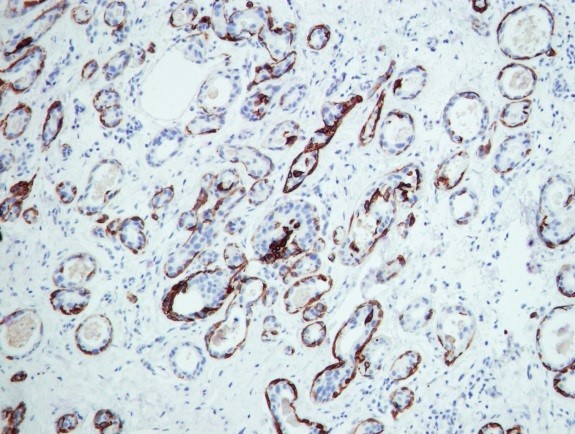
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы – дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также – для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
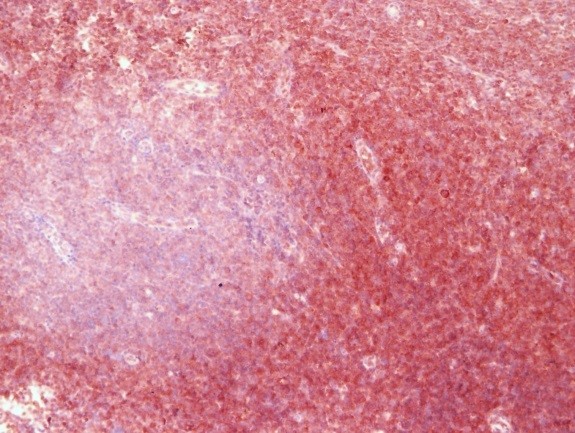
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Лечим метастазы. Когда не обойтись без патоморфолога?
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Молекулярные исследования + Таргетная терапия + Иммунотерапия = Эффективное лечение рака
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
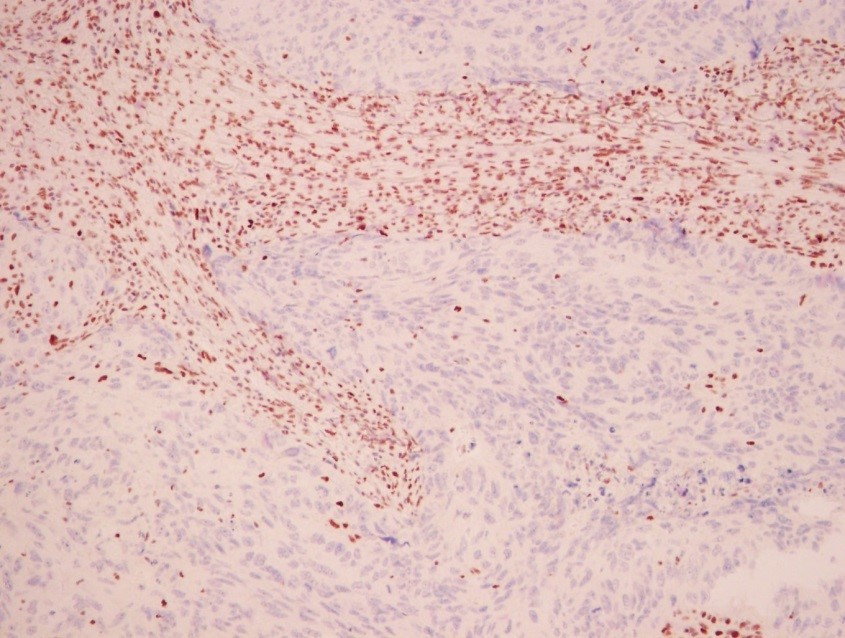
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Какой рак можно вылечить без операции?
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
-
; ;
- рак кишечника;
- рак легкого;
- лимфомы; ;
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Как повысить качество морфологической диагностики в клиниках России?
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
Читайте также:

