Что такое канальцевый эпителий
Обновлено: 29.04.2024
(аномальными) белками - парапротеинами. Учитывая это, миеломная нефропатия по своему происхождению рассматривается как классический пример "нефроза выделения" (Г. А. Алексеев, 1970). Специфическим для истинной миеломной почки считается отложение преципитатов патологических миеломных белков в дистальных отделах канальцев с закупоркой и повреждением последних. При этом синтезируемые миеломными клетками микромолекулярные белки Бенс-Джонса поступают в ток крови, достигают почек и легко проходят через неповрежденный клубочковый фильтр. В просвете канальцев, где жидкость имеет кислую реакцию, профильтровавшиеся в клубочках белковые массы свертываются, образуя большое количество цилиндров, приводящих к обтурации просвета дистальных отделов канальцев. В результате повышается внутриканальцевое давление в вышележащих (проксимальных) отделах канальцев с расширением их просвета и развитием так называемого интрареналъного гидронефроза (нефрогидроза). Кроме того, частично реабсорбированные канальцевым эпителием патологические белки проникают в интерстициальную ткань, вызывая отечность почечной стромы, застой лимфы с возникновением лимфоцитарных инфильтратов, т. е. воспалительного процесса в интерстициальной ткани (интерстициалъный нефрит). В дальнейшем развиваются гиалиноз и склероз интерстиция с последующей гибелью клубочков, нефронов и нефротическим сморщиванием почек. Повреждение канальцев может обусловить развитие нефротического синдрома.
Все другие поражения ночек, обнаруживаемые при миеломной болезни, имеют неспецифический характер. Так, в результате присоединения инфекции может возникнуть пиелонефрит. Примерно у 5-25 % больных развивается амилоидоз почек. Метаболические нарушения нередко приводят к развитию не только интерстициального нефрита, но и нефрокальциноза и уролитиаза.
Патогенез (что происходит?) во время Миеломной нефропатии:
Макроскопически почки при миеломной нефропатии увеличены в размерах, плотноватой консистенции, интенсивно-красного цвета. На разрезе выбухает отечный мозговой слой. В отдельных случаях почки могут быть уменьшены в размерах и сморщены.
Гистологически основные изменения обнаруживаются в дистальных отделах канальцев. Наиболее характерно для миеломной почки обилие цилиндров в расширенных просветах канальцев, в отдельных участках - с отложением кальция (известковые цилиндры). Появление этих цилиндров связано с преципитацией белка Бенс-Джонса. В ряде случаев большинство канальцев заполнено гомогенными белковыми массами. Иногда цилиндры характерной чешуйчатой формы по периферии окружены гигантскими клетками типа клеток рассасывания инородных тел. Эпителий канальцев подвергается значительным изменениям в виде гиалиново-вакуольной, вакуольной и зернистой дистрофии, легко слущивается. Эти изменения эпителия развиваются преимущественно в проксимальных отделах канальцев, где осуществляется реабсорбция белка Бенс-Джонса, который, как полагают, может оказывать прямое повреждающее действие на эпителиальные клетки. В отдельных случаях находят отложения парапротеинов в клубочках, интерстициальной ткани и вокруг сосудов.
Однако необходимо отметить, что почечные клубочки при миеломной нефропатии почти не подвергаются патологическим изменениям, за исключением тех случаев, которые сопровождаются развитием амилоидоза. В интерстициальной ткани выявляются (не менее чем в 50 % случаев) участки фиброза и клеточных инфильтратов. Сосуды почек, как и клубочки, при истинной миеломной почке остаются практически интактными. При выраженной и длительной гиперкальциемии развивается нефрокальциноз и образование конкрементов (примерно в 10 % случаев). Поскольку миеломная болезнь развивается преимущественно у лиц пожилого возраста, нередко обнаруживаются явления атеросклероза сосудов почек и с этим связывают возможность развития ишемии почек. Отмечающиеся в дальнейшем нарушения лимфо- и кровообращения приводят к гибели нефронов и развитию нефросклероза с клинической картиной ХПН. Необходимо отметить, что у отдельных больных независимо от тяжести клинических и лабораторных проявлений миеломной нефропатии в почках не обнаруживается существенных изменений.
Симптомы Миеломной нефропатии:
Клиническая картина миеломной нефропатии характеризуется значительным многообразием. Это зависит как от характера патологических изменений со стороны почек, так и от симптомов поражения других органов и систем, главным образом костной системы. Наиболее ранним и постоянным признаком миеломной почки является протеинурия, которая обнаруживается у 65-100 % больных. Выраженность ее колеблется в широких пределах - от следов белка до 3,3-10 г/л, а иногда она достигает 33 г/л и даже 66 г/л. Известны случаи, когда упорная, стойкая протеинурия была единственным симптомом миеломной болезни на протяжении многих лет. Иногда протеинурия может задолго предшествовать появлению других симптомов этой болезни. В подобных случаях заболевание долго протекает под маской хронического гломерулонефрита с изолированным мочевым синдромом. С помощью электрофореза белков мочи (из суточного ее объема) на бумаге или в крахмальном геле, а также иммуноэлектрофореза удается установить микромолекулярную (белок Бенс-Джонса) природу миеломного уропротеина в виде моноклонового пика ("М"-градиента), подобно аналогичному пику на электрофореграмме белков сыворотки крови. Уропротеин Бенс-Джонса электрофоретически выявляется в моче у 95 % больных миеломной болезнью (Г. А. Алексеев, 1970). Поэтому в каждом случае протеинурии неясной этиологии, особенно у лиц пожилого возраста, как правило, необходимо проводить электрофорез белков мочи, т. е. исследовать уропротеинограмму. Для уропротеинограммы больных миеломной нефропатией в отличие от протеинурии другого происхождения характерно преобладание глобулинов над альбуминами с наличием "пика глобулинурии". Учитывая сказанное, качественная характеристика белков мочи с помощью упомянутых методов имеет исключительно эажное диагностическое значение.
Для миеломной нефропатии характерно обнаружение в моче белка Бенс-Джонса. Однако при обычном исследовании путем нагревания мочи до 50-60 °С белок Бенс-Джонса выявляется лишь у 30-40 % больных. Между тем нахождение его имеет не только диагностическое, но и прогностическое значение, поскольку стойкое наличие этого белка в моче может свидетельствовать о скором развитии необратимой почечной недостаточности. Белок Бенс-Джонса составляет основную массу белков мочи и суточная его экскреция может достигать 20 г и более (И. Е. Тареева, Н. А. Мухин, 1986). В осадке мочи постоянно обнаруживаются гиалиновые цилиндры, реже - зернистые и эпителиальные, а в случае присоединения пиелонефрита выявляется лейкоцитурия. Гематурия не характерна для миеломной почки, и лишь в редких случаях отмечается незначительная эритроцитурия (3-10 эритроцитов в поле зрения). Примерно у 1/3 больных наблюдаются фосфатурия и щелочная реакция мочи.
Отеки, артериальная гипертензия и изменения со стороны сосудов глазного дна не характерны для миеломной нефропатии и обычно отсутствуют, даже при развитии почечной недостаточности. Артериальное давление, как правило, не повышается и имеет тенденцию к снижению по мере прогрессирования болезни. Отеки возможны лишь в тех редких случаях, когда миеломная нефропатия проявляется в виде амилоидоза почек с нефротическим синдромом.
Клинически миеломная нефропатия протекает в виде своеобразного "нефроза выделения" с относительно быстро (подостро) развивающейся почечной недостаточностью, которая проявляется полиурией, снижением клубочковой фильтрации, гиперазотемией, заканчиваясь летальным исходом вследствие азотемической уремии. Почечная недостаточность при миеломной болезни встречается у 20-40 % больных и расценивается как вторая по частоте причина смерти этих больных (после инфекционных осложнений). Развитию почечной недостаточности обычно предшествует более или менее длительная протеинурия с наличием примерно у 1/з больных белка Бенс-Джонса. Интересно отметить, что при отсутствии в моче этого белка почечная недостаточность не развивается даже при выраженной и продолжительной протеинурии. Б механизме развития почечной недостаточности, помимо белка Бенс-Джонса, который оказывает нефротоксическое действие на канальцевый эпителий, существенное значение имеют обтурация просвета канальцев (тубулярная обструкция), а также такие факторы, как гиперкальциемия, гиперуриекемия, повышенная вязкость плазмы крови, нефрокальциноз и развитие в отдельных случаях плазмоцитариых инфильтратов.
Протеинурия и хроническая почечная недостаточность - наиболее частые и характерные проявления миеломной нефропатии. Другие почечные синдромы и симптомы встречаются реже (острая почечная недостаточность, нефротический синдром, синдром Фанкони).
В некоторых случаях как начальное проявление миеломной нефропатии может развиться ОПН. Причины ее возникновения различные: чаще всего в результате блокирования канальцев белковыми преципитатами либо кристаллизации кальция (нефрокальциноз). Например, описаны случаи развития ОПН у больных миеломной болезнью непосредственно после внутривенной (экскреторной) урографии, которая проводилась для уточнения причины протеинурии неясного генеза. ОПН в таких случаях протекает очень тяжело и в основном заканчивается летальным исходом. Поэтому при подозрении на миеломную болезнь, а тем более при уже установленном диагнозе этого заболевания экскреторная урография таким больным противопоказана.
Нефротический синдром, как уже отмечалось, при миеломной болезни встречается редко и обычно является результатом присоединения амилоидоза.
В ряде случаев, когда миеломная нефропатия протекает с тяжелым поражением канальцев, развивается выраженная дисфункция последних с нарушением их парциальных функций. В результате могут появляться глюкозурия, аминоацидурия, фосфатурия, гипокалиемия и гипостенурия, т. е. признаки, характерные для синдрома Фанкони, который нередко осложняет течение миеломной болезни.
ечение миеломной нефропатии, как и самой миеломной болезни, хроническое, неуклонно прогрессирующее, с развитием хронической почечной недостаточности, которая примерно в 1/3 случаев является непосредственной причиной смерти. При диффузных формах миеломной болезни с тотальным поражением костного мозга причиной летального исхода являются выраженная анемия и геморрагический диатез. В других случаях летальный исход наступает при явлениях общей кахексии или вследствие осложнений, связанных с множественными переломами костей, - пневмонии при переломах ребер, уросепсиса в связи с компрессионными переломами позвонков.
Средняя продолжительность болезни от начала ее первых клинико-лабораторных проявлений составляет 2-5 лет и лишь в отдельных неосложненных случаях достигает 6-10 лет (Г. А. Алексеев, 1970).
Диагностика Миеломной нефропатии:
Поставить диагноз миеломной нефропатии очень трудно, особенно в тех случаях, когда она является первым либо основным синдромом миеломной болезни. Поражение почек, сопровождающееся изолированной и стойкой протеинурией, часто протекает под маской гломерулонефрита, амилоидоза или пиелонефрита. Прижизненная клиническая диагностика таких вариантов миеломной болезни весьма затруднена, а диагностические ошибки достигают 30-50 % (А. П. Пелещук, 1983). Наличие при этом анемии и увеличение СОЭ вначале не находят должного объяснения, и лишь в поздней стадии болезни им ретроспективно дается правильная оценка.
О возможности миеломной почки необходимо думать и в тех случаях, когда протеинурия возникает как бы "беспричинно" (без предшествующей ангины, при отсутствии в анамнезе указаний на острый гломерулонефрит, хронические нагноительные заболевания и т. п.) в сочетании с анемией, высокой СОЭ, особенно если такое сочетание наблюдается у лиц старше 40- 45 лет, при отсутствии отеков, артериальной гипертензии, гематурии и при наличии гиперпротеинемии и гиперкальциемии. Диагноз более убедителен, если упомянутые признаки развиваются на фоне костной патологии, т. е. на фоне болей в костях.
Для уточнения диагноза необходимо исследовать мочу на белок Бенс-Джонса, провести рентгенографию костей (черепа, ребер, подвздошных, позвонков), электрофорез белков крови и мочи (с целью обнаружить специфическую для миеломной болезни "М" -фракцию или "М"-градиент) и наконец стернальную пункцию. Что касается пункционной биопсии почки, то диагностическая ценность этого метода является спорной, поскольку морфологические изменения в почках при миеломной болезни характеризуются большим многообразием, и установить специфические признаки миеломной почки удается далеко не всегда. В то же время пункционная биопсия почки позволяет исключить амилоидоз и гломерулонефрит.
Хроническая почечная недостаточность, обусловленная миеломной почкой, в отличие от ХПН другой этиологии (в частности, гломерулонефрита) не сопровождается развитием артериальной гипертензии и гипокальциемией. Уровень кальция в крови таких больных всегда повышен, в том числе и в стадии ХПН. При развитии канальцевого ацидоза в крови повышается уровень натрия и хлора и снижается содержание калия, тогда как с мочой понижается суточная экскреция натрия, хлора, кальция, фосфора и повышается выделение калия.
Лечение Миеломной нефропатии:
До настоящего времени не существует надежных методов и. средств лечения миеломной болезни. Тем не менее применение комплексной терапии с использованием цитостатиков (сарколизин, циклофосфамид и др.) в сочетании с глюкокортикоидами и анаболическими гормонами позволяет во многих случаях добиться длительной (до 2-4 лет) клинической ремиссии и, следовательно, увеличения продолжительности жизни больного, временного восстановления его физической активности и даже трудоспособности (у лиц, не занятых физическим трудом).
Однако цитостатики и глюкокортикоиды можно назначать лишь при отсутствии признаков почечной недостаточности. У больных миеломной нефропатией в стадии хронической почечной недостаточности применение этих препаратов противопоказано. В таких случаях проводится симптоматическая терапия (как и при ХПН другой этиологии). Перитонеальный диализ и гемодиализ не рекомендуются. В отдельных случаях используют плазмаферез. Не показана таким больным и пересадка почки.
Для коррекции наблюдающейся при миеломной почке гиперкальциемии назначают кортикостероиды, диуретики, кальцитонин; рекомендуют обильный прием жидкости (в целях борьбы с дегидратацией и увеличения диуреза). При развитии гиперурикемии показан прием аллопуринола. Используют также введение дезинтоксикационных растворов, переливание крови и эритроцитарной массы.
К каким докторам следует обращаться если у Вас Миеломная нефропатия:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Миеломной нефропатии, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .

Сосудистый клубочек почки имеет 50 капиллярных петель, стенка которых является клубочковым фильтром. При электронно-микроскопическом исследовании нами установлено, что клубочковый фильтр состоит из трех элементов: эпителия клубочка, эндотелия его капилляров и располагающейся между ними базальной мембраны.
Эпителий клубочка (подоцит) состоит из крупного клеточного тела с ядром, митохондриями, аппаратом Гольджи и другими включениями. Цитоплазма имеет большие отростки - трабекулы, от которых в виде узких стебельков отходят малые отростки, или педикулы, которые своим внешним утолщенным концом «опираются» на базальную мембрану. Таким образом, трабекулы не лежат непосредственно на базальной мембране, а приподняты над ней благодаря педикулам, в результате чего создается так называемое подподоцитарное пространство. В этом пространстве переплетаются педикулы соседних клеток, образуя сложный лабиринт из щелей шириной от 300 до 1000 Å. Через которые фильтрат плазмы может поступать в полость капсулы Боумена - Шумлянского, минуя цитоплазму подоцита.
Эндотелий лежит на базальной мембране и пронизанной через довольно правильные промежутки порами размером от 600 до 1000 Å. Базальная мембрана клубочка - это непрерывный барьер между кровью и полостью капсулы Боумена - Шумлянского, который состоит по существу из двух мембран: наружной, субэпителиальной, которая продолжается в базальную мембрану капсулы Боумена - Шумлянского, и внутренней, субэндотелиальной, являющейся продолжением базальной мембраны артериол клубочка. Субэпителиальная мембрана довольно толстая, субэндотелиальная - тоньше и нежнее. Высокое содержание во фракции базальной мембраны коллагенового белка свидетельствует о тесной связи базальной мембраны гломерулярных капилляров с соединительной тканью клубочка, мезангиальные клетки которой способны нарабатывать вещество мембраны.
Между субэндотелиальной и субэпителиальной мембраной существует соединительная ткань, названная мезангиумом, который связывает капиллярные петли клубочка друг с другом и подвешивает их наподобие брыжейки к гломерулярному полюсу. Вместе с базальными мембранами он образует поддерживающий стержень клубочка. Мезангиум рассматривают как перикапиллярное или межкапиллярное интерстициальное пространство в котором найдены волокнистые структуры и интеркапиллярных, или мезангиальных клетки.
Изменения базальной мембраны клубочка характеризуются ее утолщением и гомогенизацией, возникновением пластинчатости, разрыхлением и фибриллярностью, а также появлением различных отложений.
Капсула клубочка состоит из эпителия и базальной мембраны, которая продолжается в проксимальный сегмент и по сравнению с базальной мембраной клубочка имеет иное строение. В ней различают внутренний - гомогенный и наружный - ретикулярный слой.
Эпителий капсулы представлен уплощенными клетками с четкими границами и выбухающим ядром. Они имеют немного митохондрий и не обладают той сложной организацией цитоплазмы, которая характерна для эпителия проксимальных канальцев.
Эпителиальные клетки капсулы отличаются весьма умеренной ферментативной активностью дегидрогеназ и диафораз. Исключение составляет дегидрогеназа изолимонной кислоты, содержание которой здесь довольно высоко. Отмечается также умеренная активность в этих клетках глюкозо-6-фосфатазы.
Эпителий капсулы крайне изменчив и в патологических условиях склонен к гиперпластическим реакциям. Кроме того, доказано, что изменчивость его структуры определяется рядом гормональных влияний.
Канальцевую часть нефрона принято делить на три сегмента: проксимальный каналец, состоящий из извитой и прямой части (толстый нисходящий отдел петли Генле), тонкий сегмент петли Генле, дистальный каналец, состоящий из прямой части (толстый восходящий отдел петли Генле) и извитой части. Дистальные извитые канальцы впадают в систему собирательных трубочек.
Кровеносная система почки В почках имеются два функционально различных круга кровообращения: большой - кортикальный и малый - юкстамедуллярный. Кортикальный (большой) круг представлен сосудами коркового вещества: междольковыми артериями, приносящими сосудами и «чудесной сетью» основной массы гломерул, выносящими сосудами и постгломерулярной капиллярной и венозной сетью коры. Юкстамедуллярный (малый) круг кровообращения почки составляют: проксимальные отрезки интерлобулярных артерий, приносящие артериолы юкстамедуллярных клубочков и их сосудистая сеть, выносящие артериолы юкстамедуллярных клубочков, артериальные и венозные компоненты прямых сосудов пирамид, а также проксимальные отрезки интер лобулярных вен. Элементами юкстамедуллярного пути почечного кровотока могут быть межканальцевые капилляры кортикомедуллярной зоны, перигломерулярные сосудистые сплетения, связующие афферентные и эфферентные артериолы юкстамедуллярных клубочков, а также негломерулярные артериовенозные анастомозы пограничного слоя почки.
Более детально изменения представленных структур мы изучали на примере гломерулонефрита. При заболевании выявлено накопление материала, идентичного по составу базальной мембране, между пролиферирующими эндотелиальными и интеркапиллярными клетками и появление преципитата комплекса антиген-антитело чаще на эпителиальной стороне мембраны.
Гломерулонефриты являются самостоятельными нозологическими формами, но могут встречаться и при многих системных заболеваниях: системной красной волчанке, геморрагическом васкулите, подостром бактериальном эндокардите и др.
Прогрессирование гломерулонефрита после воздействия различных начальных факторов определяется достаточно стереотипными процессами, постепенно ведущими к склерозу. Это пролиферация мезангиальных клеток и накопление мезангиального матрикса, а также поражение стенки капилляров клубочка. В индукции гломерулонефрита ведущее место отводится иммунным факторам повреждения, реакциям гуморального или клеточного иммунитета. В дальнейшем прогрессировании важную роль приобретают медиаторы воспаления и неиммунные механизмы - гемодинамические и метаболические. На всех этапах развития ведущую роль играет персистирование этиологического фактора, известного, к сожалению, лишь у 1/10 больных.
а) Хронический гломерулонефрит с минимальными поражениями. При эллектронной. микроскопии выявляются изменения в базальной мембране, в основном в подоцитах. Выросты подоцитов сливаются, представляя собой единую систему с иммунными отложениями.
б) Мембранозный вариант нефрита: базальная мембрана поражается более глубоко. При обычной микроскопии утолщается, разрывы мембраны, большое отложение иммуноглобулинов и комплемента.
в) Фибропластический вариант: быстро идут процессы на базальной мембране, происходит активация мезангия, дальнейшее разрастание мембраны, разрастание клубочков идет медленнее.
г) Пролиферативный вариант: идет массовая пролиферация в основном сосудистого эндотелия (эндокапиллярный тип), реже пролиферация носит экстракапиллярный тип - со стороны Боумановской капсулы.
д) Мембранозно-пролиферативный. Специально выделяется гипертоническая форма хронического гломерулонефрита с клиникой классической формы гипертонической болезни, но есть изменения со стороны мочи.
Этиология гломерулонефритов до конца не выяснена. Известно только, что в их этиологии играют роль инфекции (наиболее четко при остром постстрептококковом гломерулонефрите), токсические вещества (органические растворители, алкоголь, ртуть, свинец и др.), экзогенные антигены, действующие с вовлечением иммунных механизмов, в том числе и в рамках гиперчувствительности немедленного типа (атопии), редко - эндогенные антигены - ДНК, мочевая кислота, опухолевые. Этиологический фактор удается установить у 80-70% больных острым гломерулонефритом и у 5-10% больных хроническим гломерулонефритом. У остальных больных причина болезни остается неизвестной.
В подавляющем большинстве случаев гломерулонефрит развивается при участии иммунных механизмов. При остром пострептококковом гломерулонефрите - это образование антител через 10-12 дней после фарингита или ангины, при хроническом гломерулонефрите - это чаще медленное образование иммунных комплексов, содержащих антиген и антитела к нему, откладывающихся в клубочках при недостаточности механизмов их удаления, у большинства больных быстропрогрессирующим гломерулонефритом - это образование антител к ткани клубочков (базальной мембране капилляров). Иммунные комплексы и антитела к базальной мембране могут быть выявлены и идентифицированы в ткани почек при иммуногистохимическом исследовании. Почечный клубочек отвечает на иммунное повреждение двумя видами патологических реакций: пролиферацией клеток почечного клубочка (мезангиальных, эндотелиальных, эпителиальных) и выработкой этими клетками межклеточного вещества. Оба процесса стимулируют цитокины (в первую очередь интерлейкин-1, фактор некроза опухолей, тромбоцитарный фактор роста, трансформирующй фактор роста бета), которые выделяются клетками, инфильтрирующими почечный клубочек.
Таким образом, гломерулонефрит - это двухстороннее воспалительное заболевание почек иммунного генеза, которое характеризуется постепенной, но неуклонной гибелью клубочков, сморщиванием почки, понижением функции, развитием артериальной.
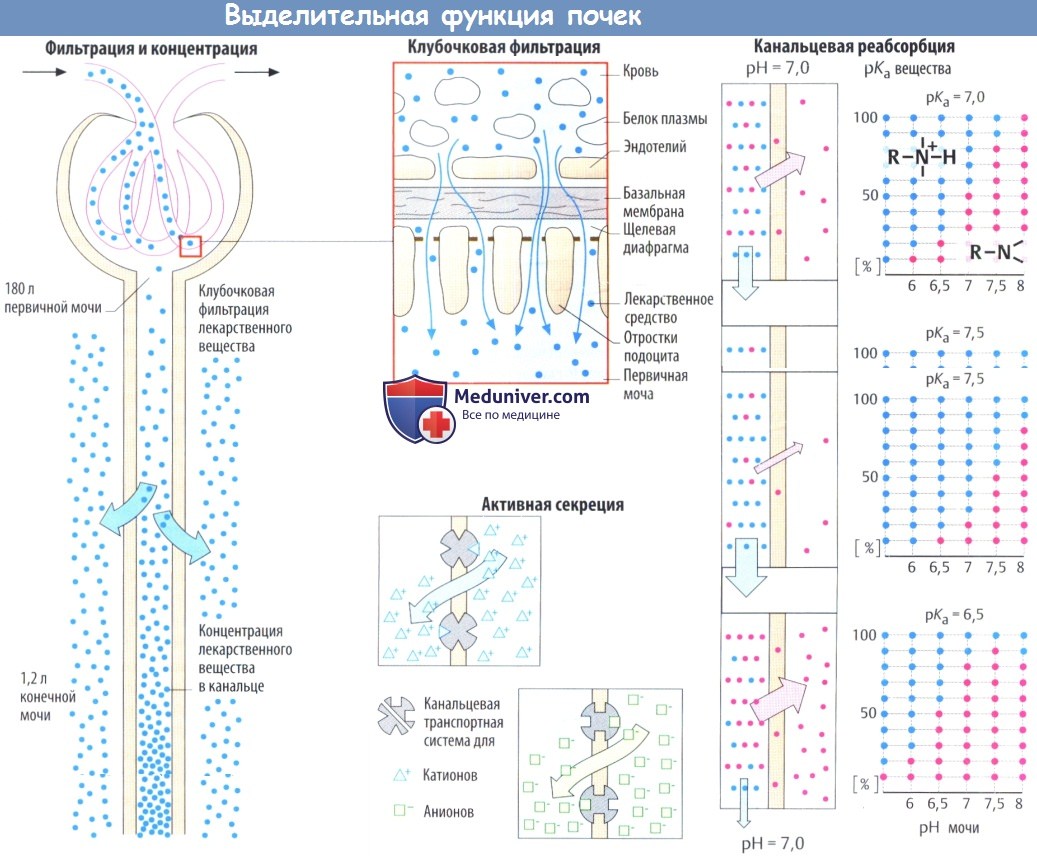
Механизм выделения лекарств через почки
Большинство лекарственных средств выводятся с мочой как в химически не измененном виде, так и в виде метаболитов. Почки могут осуществлять выделительную функцию благодаря особому строению стенки клубочковых капилляров, которая позволяет растворенным в крови веществам с молекулярной массой менее 5000 беспрепятственно поступать в мочу.
Фильтрация ограничена молекулярной массой 50 000 и снижается при молекулярной массе более 70 000. За небольшим исключением, у используемых при лечении лекарственных средств и их метаболитов гораздо меньшая молекулярная масса, поэтому они подвергаются клубочковой фильтрации, т. е. поступают из крови в первичную мочу.
Разделяя эндотелий капилляров и эпителий канальцев, базальная мембрана содержит отрицательно заряженные макромолекулы и действует в роли фильтрационного барьера для высокомолекулярных веществ. Относительная плотность данного барьера зависит от электрического заряда молекул, которые пытаются проникнуть через него. Кроме того, в клубочковой фильтрации также участвуют диафрагмальные щели между отростками подоцитов.
Помимо клубочковой фильтрации, лекарственные средства, находящиеся в крови, попадают в мочу путем активной секреции. Некоторые катионы и анионы секретируются эпителием проксимальных канальцев в канальцевую жидкость специальными энергозависимыми транспортными системами. Эти транспортные системы имеют ограниченную емкость. При наличии нескольких субстратов они могут конкурировать за переносчик.
При движении вдоль почечного канальца объем первичной мочи сокращается примерно до 1%. Следовательно, уменьшается и концентрация профильтрованного лекарственного вещества или его метаболитов. Выходной градиент концентрации между мочой и интерстициальной жидкостью сохраняется в том случае, когда лекарственные средства не могут проникнуть через канальцевый эпителий.
Тем не менее градиент концентрации липофильных лекарственных средств будет поддерживать реабсорбцию профильтрованных молекул. В данном случае реабсорбция не является активным процессом, а наоборот, происходит в результате пассивной диффузии. Следовательно, у протонированных веществ величина реабсорбции зависит от pH мочи или степени диссоциации. Степень диссоциации пропорциональна pH мочи и рKa, последний показатель соответствует величине pH, при которой половина веществ существует в протонированном (или непротонированном) виде.
Эта взаимосвязь изображена графически (D) с примером протонированного амина с рKa = 7. В данном случае при pH мочи 7,0 50% амина будут находиться в протонированной гидрофильной мембрано-непроницаемой форме (голубые точки), тогда как другая половина, представленная незаряженным амином (красные точки), может покидать просвет канальца по результирующему градиенту концентрации. При высоком (рKa = 7,5) или низком (рKa = 6,5) рKa амина соответственно большая или меньшая часть амина будет находиться в незаряженном реабсорбируемом виде. Уменьшение или повышение pH мочи на 1/2 единицы вызывают аналогичные изменения.
Аналогичные закономерности характерны для кислых молекул с таким важным различием, что подщелачивание мочи (повышение pH) приведет к стимуляции депротонизации групп -СООН и, следовательно, к нарушению реабсорбции. pH мочи целенаправленно изменяют при интоксикациях протон-акцепторными веществами, чтобы ускорить выведение токсина (подщелачивание при отравлении фенобарбиталом, окисление при отравлении метамфетаминами).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Функции проксимального канальца нефрона почки
Из клубочка фильтрат поступает в проксимальный каналец, в котором реабсорбируется две трети жидкости, полностью реабсорбируются глюкоза и аминокислоты, а также 80% отфильтровавшихся бикарбонатов и фосфатов. Транспорт большей части растворенных веществ через апикальную мембрану является Nа+-зависимым.
Движущей силой для этого транспорта (как в проксимальных канальцах, так и в других отделах нефрона) служит трансмембранный концентрационный градиент Na+, создаваемый за счет выкачивания Na+ из клетки Na+,К+-АТФазой базолатеральной мембраны. Угнетение Na+,K+-АТФазы уабаином резко подавляет транспорт в проксимальных канальцах как у взрослых, так и у новорожденных.
Возрастные изменения активности Na+,К+-АТФазы в нескольких отделах нефрона представлены на рисунке; этим изменениям в целом соответствуют и возрастные изменения транспорта растворенных веществ. Объем проксимальной реабсорбции Na+ и воды у новорожденных примерно в 3 раза меньше, чем у взрослых.
У доношенных новорожденных интенсивность проксимального транспорта в постнатальном периоде возрастает параллельно увеличению СКФ, и в результате реабсорбируемая в проксимальных канальцах фракция клубочкового фильтрата остается постоянной (это постоянство называется клубочково-канальцевым равновесием). У недоношенных же фильтрация многих веществ превышает реабсорбционную способность канальцев.
Глюкоза и аминокислоты переносятся через апикальную мембрану клетки проксимального канальца с помощью вторичного активного котранспорта (котранспорта Na+ и глюкозы и нескольких систем котранспорта Na+ и аминокислот). Через базолатеральную мембрану глюкоза и аминокислоты проходят за счет облегченной диффузии. Скорость котранспорта Na+ и глюкозы и Na+ и аминокислот, так же как активность Nа+,К+-АТФазы базолатеральной мембраны, у новорожденных ниже, чем у взрослых.
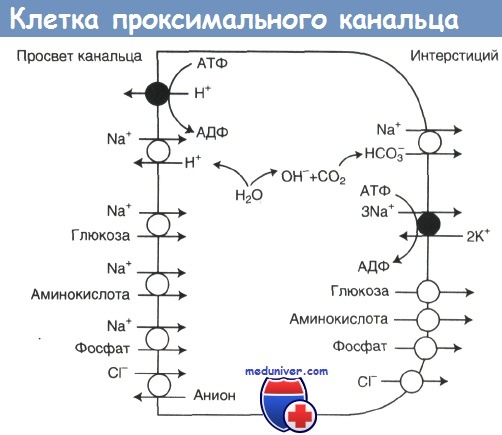
Клетка проксимального канальца; показаны переносчики апикальной и базолатеральной мембран. Транспорт большей части растворенных веществ через апикальную мембрану является Na+-зависимым. Движущей силой для этого транспорта служит трансмембранный концентрационный градиент Na+, создаваемый за счет выкачивания Na+ из клетки Na+,К+-АТФазой базолатеральной мембраны. Выход растворенных веществ через базолатеральную мембрану в основном осуществляется за счет облегченной диффузии, не зависящей от Na+.
Для так называемых пороговых веществ (например, глюкозы) существует некая минимальная концентрация в плазме, при которой они появляются в моче, — почечный порог. Если концентрация ниже почечного порога, то отфильтровавшееся вещество полностью реабсорбируется; в противном случае реабсорбционная способность канальцев превышается и часть вещества поступает в мочу. У взрослых глюкоза появляется в моче только при сывороточных концентрациях выше 200 мг%.
У недоношенных, родившихся в сроки до 30 нед, часто наблюдается глюкозурия в отсутствие гипергликемии. До 34-й недели реабсорбируется только 93% отфильтровавшейся глюкозы; после 34 нед эта цифра превышает 99% и глюкозурия появляется только на фоне гипергликемии. Сходная картина наблюдается и в отношении аминокислот.
Почечный транспорт фосфатов у новорожденных отличается уникальными особенностями. Фосфаты необходимы для роста и развития. Для взрослых характерно фосфатное равновесие (выведение фосфатов соответствует их всасыванию в ЖКТ), но у детей наблюдается положительный фосфатный баланс. У новорожденных выведение фосфатов с мочой составляет лишь 60% от их всасывания в ЖКТ. Сывороточная концентрация фосфата у новорожденных выше, чем у взрослых. Это связано не с низкой СКФ, а с более интенсивной канальцевой реабсорбцией. Фосфаты — единственные вещества, почечная реабсорбция которых у новорожденных интенсивнее, чем у взрослых (при пересчете на единицу СКФ).
Как у новорожденных, так и у взрослых снижение потребления фосфатов и гипофосфатемия приводят к увеличению плотности Na+-фосфатных переносчиков в апикальной мембране. Повышенное потребление фосфатов у взрослых вызывает снижение почечной реабсорбции этих веществ, но у новорожденных при увеличенном потреблении фосфатов скорость их реабсорбции остается высокой; в результате развивается гиперфосфатемия. Кроме того, у новорожденных ПТГ вызывает гораздо менее выраженную фосфатурию. Эти факторы частично объясняют развитие у новорожденных гиперфосфатемии с гипокальциемией при кормлении цельным коровьим молоком или другими продуктами с большим содержанием фосфатов.
В проксимальных канальцах реабсорбируется примерно половина отфильтровавшегося NaCl. В начальном отделе проксимального канальца с Na+ реабсорбируются преимущественно органические анионы и бикарбонат, и поэтому в канальцевой жидкости по сравнению с плазмой перитубулярных капилляров выше концентрация Cl- и ниже — бикарбоната. Этот высокий концентрационный градиент Cl- между канальцевой жидкостью и кровью служит движущей силой для диффузии Cl- из канальцев в кровь межклеточным путем. В результате NaCl в проксимальном канальце примерно наполовину реабсорбируется путем диффузии и наполовину — путем активного транспорта.
Чресклеточный перенос NaCl реализуется за счет одновременной работы Na+/Н+-обменника и Cl-/анионных обменников апикальной мембраны; среди последних значительную роль играет Cl-/ОН--обменник. В результате NaCl поступает в клетки, а вода (Н+ + ОН"), напротив, выходит в просвет канальца. Видимо, в активном транспорте NaCl в проксимальных канальцах участвуют и другие Cl-/анионные обменники. У новорожденных скорость работы Na+/Н+-обменника и Cl-/анионных обменников гораздо ниже, чем у взрослых. То же касается и пассивного транспорта NaCl: у взрослых проницаемость межклеточных промежутков проксимальных канальцев для Cl- высока, а у новорожденных проксимальные канальцы непроницаемы для этого иона.
В процессе роста происходят изменения как межклеточной проницаемости, так и активного транспорта, и в результате меняется и проксимальная реабсорбция.
В проксимальных канальцах вода следует за реабсорбируемыми веществами, и в результате осмолярность канальцевой жидкости и крови приблизительно одинакова. У взрослых вода реабсорбируется почти исключительно чресклеточным путем по водным каналам апикальной и базолатеральной мембран, образованным белком аквапорином-1. У новорожденных плотность таких каналов в апикальной и базолатеральной мембранах клеток проксимальных канальцев ниже, но проницаемость для воды — выше: значительное количество воды реабсорбируется через липидный бислой, текучесть которого существенно больше, чем у взрослых. Кроме того, в клетках проксимальных канальцев новорожденных ниже сопротивление цитоплазмы потоку воды.
Возможно, важную роль в постнатальных изменениях СКФ и канальцевого транспорта играют тиреоидные гормоны и глюкокортикоиды. После рождения сывороточные концентрации этих гормонов увеличиваются, что совпадает с изменениями активности почечных переносчиков. В промоторах генов некоторых переносчиков, чья активность меняется в период созревания, имеются глюкокортикоидили тиреоид-чувствительные регуляторные элементы, изменяющие скорость транскрипции гена в присутствии этих гормонов. Введение глюкокортикоидов или тиреоидных гормонов вызывает ускорение созревания ряда процессов канальцевого транспорта.
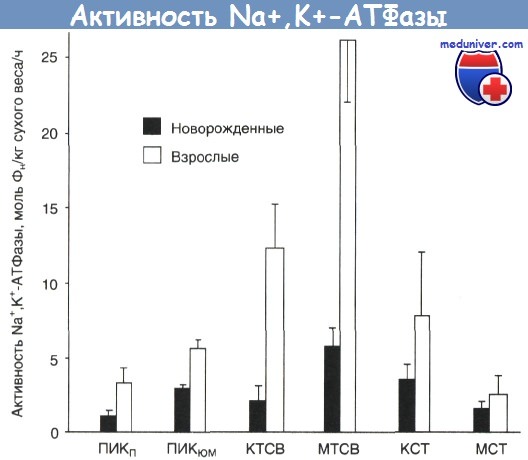
Активность Nа+,К+-АТФазы в различных отделах нефрона новорожденного и взрослого кролика. КСТ — корковый отдел собирательной трубочки; КТСВ — корковый отдел толстого сегмента восходящей части петли Генле; МСТ — мозговой отдел собирательной трубочки; МТСВ — мозговой отдел толстого сегмента восходящей части петли Генле; ПИКП — поверхностный проксимальный извитой каналец; ПИКЮМ — юкстамедуллярный проксимальный извитой каналец; Фн — неорганический фосфат.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Петля Генле. Нисходящий ( тонкий ) отдел петли Генле. Дистальный отдел канальцев ( дистальные канальцы ). Собирательные трубки.
Тонкий нисходящий отдел петли Генле, который покрыт плоскими клетками с щелевидными пространствами в цитоплазме шириной до 7 нм, спускающийся в мозговое вещество почки, где поворачивает на 180° и переходит в тонкую восходящую часть, соединяющуюся с дистальным отделом канальцев.
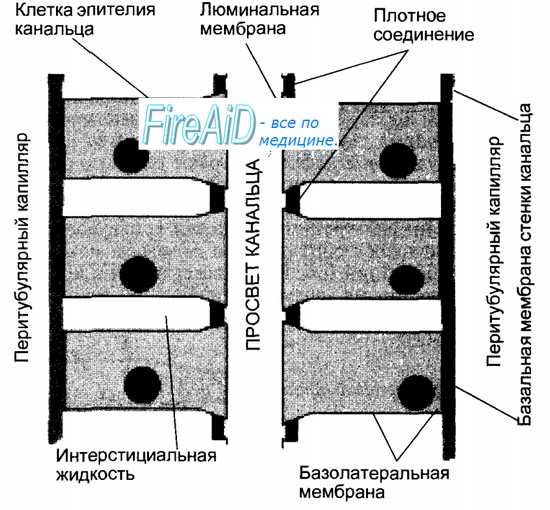
Рис. 14.4. Схема строения почечного канальца. Из просвета канальца через люминальную мембрану клеток эпителия канальца происходит процесс реабсорбции воды и веществ, содержащихся в первичной моче. Поступившие в клетки вещества далее транспортируются через базолатеральные мембраны. Выведение через базо-латеральные мембраны натрия в интерстициальную жидкость способствует повышению ее осмотического давления и обеспечивает осмотический транспорт воды. Из интерстициальной жидкости вода и вещества всасываются в кровь перитубулярных капилляров. Клетки эпителия канальцев обладают также способностью захватывать вещества из кровеносных перитубулярных капилляров и затем секретировать их в просвет канальца через люминальные мембраны.
Дистальный отдел канальцев, состоящий из толстой восходящей части петли Генле или прямого отдела и извитой части. Восходящая часть покрыта клетками, напоминающими клетки проксимального отдела, но лишенными щеточной каемки. Восходящая часть дистального канальца вновь входит в кору почки, подходит к клубочку и обязательно соприкасается с его полюсом между приносящей и выносящей артериолами. Здесь эпителий канальца становится цилиндрическим, ядра клеток — гипер-хромными, этот участок выглядит темным, плотным, что и дало ему название macula densa — плотное пятно. Поскольку непрерывная базальная мембрана здесь отсутствует и клетки эпителия канальца имеют тесный контакт с гранулированными миоэпителиоидными клетками артериолы клубочка (юкстагломерулярными клетками), плотное пятно является структурой юкстагломерулярного аппарата почки. Дистальные извитые канальцы через короткий связующий отдел впадают в коре почек в следующий отдел нефрона — собирательные трубки.
Собирательные трубки спускаются из коры почек вглубь мозгового вещества, где их эпителий из кубического становится цилиндрическим. Темные цилиндрические эпителиальные клетки дистальных отделов собирательных трубок богаты карбоангидразой и обеспечивают секрецию ионов водорода. В глубине мозгового вещества в области вершин пирамид собирательные трубки сливаются в выводные протоки, открывающиеся в полость лоханки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

