Биологическое покрытие при ожогах
Обновлено: 02.05.2024
Советы при ожоге
1. Почему ожоги часто вызывают у людей чрезмерную психоэмоциональную реакцию?
Тяжесть травмы при переломе бедра объективно превосходит тяжесть травмы при ожоге лица и шеи, однако психологическая и эмоциональная реакция семьи больного и даже врачей на ожог лица превосходит такую реакцию на перелом бедра. Каждый врач и каждая медицинская сестра должны знать об этой неадекватной эмоциональной реакции и стараться (с помощью аутотренинга и коррекции поведения) не усугублять тревогу и страх больного и членов его семьи своими словами, жестами и действиями.
2. Каким образом можно научиться избегать этих реакций и подавлять их?
Ключ — в знании. Надо иметь ясное, четкое, хорошо усвоенное понимание патофизиологии ожогов и механизмов их местного и системного воздействия на организм больного (см. ниже).
3. Почему такое простое на первый взгляд поражение, как ожог, приводит к большой угрозе благополучию и жизни больного?
Прежде чем приступить к изучению патофизиологии ожоговой травмы, надо вспомнить необычайно важную и сложную функцию кожи. Кожные покровы представляют собой уникальный гибкий футляр, обладающий избирательной проницаемостью и выполняющий иммунологические, терморегуляторпые и нейросенсорпые функции. На коже обитает громадное количество сапрофитных бактерий, однако она способна противостоять проникновению в организм этих и других бактерий и множества вредных физических и химических агентов. В нескольких словах невозможно описать даже малую часть всех важных и сложных функций кожи, являющейся уникальным и самым большим органом тела.
Кожа представляет собой живой покров, содержащий в себе 70% воды организма. Кожный кровоток равен 20% сердечного выброса. Человек может выжить без почки и без половины печени и вести более или менее сносную жизнь без половины кишечника, но ни один человек не может жить без половины кожи.
4. Так что же в действительности происходит при ожоговой травме?
Патологические изменения можно подразделить на местные и системные.
5. В чем заключаются местные изменения?
Место возникновения ожога и прилежащая область кожи могут быть разделены па три зоны: зону некроза, зону стаза и зону гиперемии. В зоне некроза происходят: денатурация всех белков; необратимые структурные и функциональные нарушения, разрушение клеток; что еще более важно, разрушаются все микро- и макроваскулярные структуры и прекращается их функция.
Таким образом, данный участок кожи необратимо утрачивается как в структурном, так и в функциональном отношении. К этой зоне смерти, разрушения и запустения непосредственно прилегает, окружая ее, зона стаза. При микроскопическом исследовании морфология клеток этой зоны представляется интактной, однако клетки отечны, в них имеются микроструктурные нарушения. При цитологическом исследовании выявляется экстравазация лейкоцитов, в интерстиции обнаруживаются эритроциты. Имеют место отек внеклеточного пространства и окклюзия капилляров (полная или частичная), что свидетельствует об уменьшении кровотока.
Зона стаза окружена зоной гиперемии, которая выявляется при микроскопическом исследовании: клетки представляются интактными, в них отсутствуют микроструктурпые изменения. Во внесосудистом пространстве отмечается минимально выраженный отек, капилляры расширены, но в них нет сладжа эритроцитов и микротромбов. Эта третья зона плавно переходит в нормальную ткань, в которой отсутствуют какие бы то пи было патологические изменения.

6. В чем заключаются системные изменения при ожогах?
На уровне целостного организма у больных с ожогами выявляются следующие изменения:
(1) тенденция к задержке жидкости и генерализованный отек, отчасти обусловленный увеличением проницаемости мелких сосудов, и
(2) явное и воспроизводимое уменьшение сердечного выброса. К иммунохимическим сдвигам относится выделение цитокинов, медиаторов воспаления и других сывороточных факторов, ответственных за потерю жидкости и повреждение миокарда.
В итоге ухудшается насосная функция сердца и увеличивается проницаемость сосудов, приводящая к потерям жидкости во внесосудистое пространство.
7. Как рационально вести больных с ожогами?
Ключевые принципы, лежащие в основе лечения больных с сочетанной травмой вполне и в первую очередь приложимы к ведению больных с ожогами; особенно важно правило оказания помощи в первый (золотой) час после травмы.
• Дыхательные пути — убедитесь, что во рту нет копоти.
• Дыхание — прослушайте легкие с обеих сторон, оцените качество дыхательных шумов.
• Кровообращение — немедленно начинайте внутривенную инфузию жидкостей, руководствуясь формулой Паркленда (Parkland): 4 мл/кг/% поражения поверхности тела.
Жизненно важны надежное обезболивание и психоэмоциональная поддержка больного. И наконец, поскольку имеет место катастрофическое нарушение целостности кожных покровов, мы должны обратить пристальное внимание на защиту этого участка от микробного заражения. Можно сказать, что ожог надо защитить от ятрогенных действий медицинского персонала.
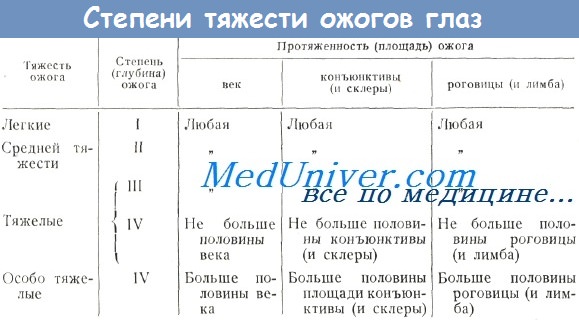
8. Как определить тяжесть ожогового поражения?
Самым главным фактором является обширность ожога. Обширность обычно выражается в процентах по отношению ко всей поверхности тела. Площадь ладони представляет собой 0,5% площади поверхности тела. Такое вычисление процента поражения полезно при множественных мелких ожогах. Если же размер ожога велик, то для вычисления его процента необходимо использовать правило девяток или номограмму Лунда-Браудера (Lund & Browder). Следует помнить, что у детей отношение поверхности кожи головы к поверхности тела отличается от такого отношения у взрослых (9% у взрослых, 15% у детей).
Вопреки распространенному мнению глубина ожога оказывает не столь сильное влияние на тяжесть течения ожоговой болезни, как его распространенность. Определение глубины ожога по клиническим признакам — задача невыполнимая даже для опытного специалиста. Однако глубина поражения при ожоге имеет значение, поскольку именно ею определяется прогноз — заживет ли дефект кожи самостоятельно или потребуется пересадка кожи.
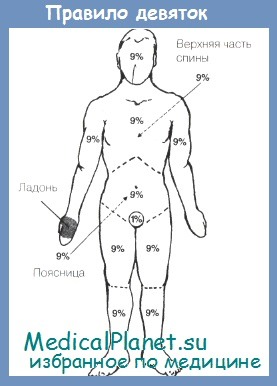
9. В чем заключается правило девяток?
Правило девяток является самым распространенным практическим методом определения площади поражения, хотя и не самым точным. Вся поверхность тела делится на участки, площадь которых составляет или 9% площади поверхности тела, или число процентов поверхности, кратное девяти. Площадь поверхности головы и шеи составляет 9%; площадь поверхности каждой верхней конечности равна 9%; площадь передней поверхности туловища составляет 2%9 (18%); то же самое относится и к задней поверхности туловища; площадь поверхности каждой нижней конечности составляет 18%. Площадь промежности составляет 1%, что в сумме равно 100% поверхности тела.
10. Как классифицируются ожоги по глубине?
Определять степень глубины поражения при ожоге следует потому, что это очень важно для прогноза: заживет ли ожог самостоятельно или для выздоровления потребуется пересадка кожи. Неопытные клиницисты часто встают в тупик при определении глубины поражения из-за того, что придатки кожи внедряются глубоко в базальный слой, который обеспечивает реэпителизацию. Следующая таблица призвана осветить этот вопрос.

11. Какие еще важные прогностические признаки выживаемости после ожогов были идентифицированы?
В недавно опубликованном анализе выживаемости после ожогов было выявлено три существенных фактора риска, имеющих одинаковый вес в предсказании смертности от ожога: поражение 40% поверхности тела, возраст старше 60 лет и ожог дыхательных путей.
0 факторов риска: смертность = 0,3%
1 фактор риска: смертность = 3%
2 фактора риска: смертность = 33%
3 фактора риска: смертность = 90%
12. Что имеют в виду, говоря об ожоге дыхательных путей?
Ожог кожных покровов является видимым повреждением, поддающимся в какой-то степени количественной оценке. Напротив, вдыхание горячего воздуха, окиси углерода и токсических и/или повреждающих веществ является не столь очевидным повреждающим фактором, который плохо поддается количественной оценке, но не становится от этого менее опасным. Повреждения, связанные с вдыханием горячего воздуха и продуктов горения, иногда ошибочно группируются вместе под названием поражения дыхательных путей, хотя воздействие этих факторов можно разделить по механизму воздействия на три раздельных группы. Все эти троякого рода поражения могут встречаться вместе и по отдельности.
а) Отравление окисью углерода. Окись углерода является продуктом неполного сгорания органических или синтетических веществ при недостаточном количестве кислорода, поддерживающего горение. Сродство окиси углерода к гемоглобину в 250 раз превышает сродство к нему кислорода, поэтому связывание окиси углерода с гемоглобином приводит к относительной гипоксемии с гипоксическим поражением головного мозга и почек. В крови курильщиков содержание окиси углерода достигает пяти процентов; симптомы отравления окисью углерода появляются у обожженных при концентрации ее в крови 15-20%; угроза жизни возникает при концентрации окиси углерода в крови свыше 30%.
Лечение заключается в дыхании чистым кислородом, поскольку оксигенотерания уменьшает время полужизии карбоксигемоглобина с 250 до 40 минут.
б) Термическое поражение верхних дыхательных путей. При пожаре в жилом помещении температура может достигнуть 1000°С. Длительное дыхание разогретым до высокой температуры воздухом, равно, как и дыхание перегретым паром, приводит к термическим поражениям носоглотки, ротоглотки и гортани, и что еще важнее, к поражению голосовых связок. Более того, даже минимальный отек голосовых связок приводит к изменению фонации, охриплости голоса и быстро прогрессирует, заканчиваясь отеком гортани, асфиксией и смертью. Поэтому всем больным с нарушениями фонации показана немедленная интубация трахеи.
в) Вдыхание токсичных продуктов горения происходит при сгорании современных синтетических материалов, используемых для отделки внутренних помещений зданий и салонов автомобилей. В качестве примеров можно назвать пластмассы, краски, синтетические ткани и синтетические покрытия полов. Смертность от отравлений продуктами горения синтетических материалов (для которых вполне правомерно употребление термина "дыхательные поражения") даже в лучших ожоговых центрах достигает 35-50%.
13. В чем заключается неотложное местное лечение ожоговой раны после того, как проведены экстренные мероприятия по нормализации гемодинамических и других жизненно важных показателей?
Рану необходимо прикрыть чистым, или, если возможно, стерильным хирургическим перевязочным материалом. В начале лечения не требуется применение мазей или антибактериальных препаратов, но это не значит, что па ожоговую рапу не надо обращать внимания и допустить ее микробное заражение, охлаждение или высыхание. Открытая рана — это причина гипотермии, а охлаждение и высыхание рапы приводят к углублению поражения и задерживают заживление.
Если лечение рапы проводится адекватно, то в тех местах, где в достаточном количестве сохранились зародышевые клетки, заживление происходит в течение 14-18 дней. Когда и если ожог поражает все слои дермы, самостоятельное заживление возможно только в том случае, если площадь ожогового поражения не превышает в диаметре 2 см. Единственным способом лечения в таких случаях является пересадка аллогенной кожи, если находится подходящий донор, или пластин, выращенных в культуре эпителиальных клеток и кератиноцитов.
14. Как ведут ожог, поражающий все слои дермы, до пересадки кожного лоскута?
В таких случаях рассматривают три возможных варианта: аутолитическое отторжение некротических тканей, внешняя энзиматическая обработка или хирургическое иссечение. Естественное отделение некротических масс происходит под воздействием протеолитических ферментов, вырабатываемых лейкоцитами, однако эго очень медленный процесс.
15. В чем заключается особая тяжесть циркулярных ожогов?
Человеческая кожа — это в высшей степени эластичный, гибкий и податливый конверт, в который упаковано тело. При ожоговом повреждении кожи волокна коллагена и других белков денатурируются, и кожа становится жестким футляром, струпом. Таким образом, она превращается в твердую раковину, лишенную какой бы то ни было эластичности. Это положение усугубляется выходом жидкости в интерстициальное пространство и отеком, что приводит к уменьшению венозного возврата.
Нет необходимости повторять, что этот процесс можно предотвратить или остановить в самом его начале. Некротомия — это процедура разрезания струпа таким образом, чтобы расколоть образовавшийся панцирь и уменьшить сдавливание тканей и сохранить обожженные пальцы и конечности. Иногда для облегчения дыхания некротомию выполняют при циркулярных ожогах торса.
16. Каковы свойства временных синтетических заменителей кожи?
Когда кожа наверняка или с большой долей вероятности заживет самостоятельно (то есть при ожогах не третьей степени), показано применение синтетических заменителей кожи. Было неоднократно показано, что эти материалы сокращают время заживления па 50%.
17. В чем заключается воздействие тяжелых ожогов на целостный организм? Какие требования предъявляются при этом к метаболизму?
Метаболизм при тяжелых ожогах подвергается максимальной стимуляции; основной обмен повышается в два с половиной раза. Такое повышение основного обмена приводит к стремительному и тяжелому усилению катаболических процессов, усугубляющихся периодами септицемии так же, как и потерями тепла вследствие усиленного испарения жидкости.
18. Как лучше всего “топить” метаболический котел организма при тяжелых ожогах?
То, что больного с тяжелыми ожогами надо усиленно питать, было понято несколько десятилетий назад. Однако понимание того, что кишечник является самым надежным путем доставки питательных веществ организму обожженного (в противоположность парентеральному питанию) пришло сравнительно недавно. Энтеральное питание (через гастроэнтеральный зонд в противоположность парентеральному питанию в вену) снабжает организм калориями и предупреждает атрофию слизистой оболочки кишечника, поддерживая ее барьерную функцию.
19. Какие угрожающие жизни осложнения возникают в течение периода выздоровления?
Пострадавшему от ожога, находящемуся на излечении в больнице, угрожают три осложнения на пути к выздоровлению: септицемия, септицемия и еще раз септицемия. Однако само знание этого факта привело к неправильному применению антибиотиков, а иногда и к злоупотреблению ими.
20. Какова роль антибиотиков в лечении ожогов?
При ожоговом поражении антибиотики никогда не вводят профилактически. За время всего пребывания в стационаре только 10% больных нуждаются в антибактериальной терапии антибиотиками. Однако лишь немногие больные с обширными и тяжелыми ожогами выживают без одного или нескольких курсов антибиотической терапии. Адекватная антибактериальная терапия — исключительно важный и сохраняющий жизнь больного инструмент лечения ожоговой болезни. Ключом к адекватной антибиотической терапии является верная и своевременная диагностика инфекционного или септического поражения и разумный выбор подходящего средства или нескольких средств, основанный на данных о природе микроорганизмов, вызвавших септический или инфекционный процесс именно у данного конкретного больного.
Реальной проблемой в лечении больного с ожогом является то обстоятельство, что у таких больных часто имеет место повышение температуры тела, не обусловленное инфекцией или сепсисом. Очень важно уметь увязать повышение температуры тела с другими отклонениями в клинических, биохимических и микробиологических данных.
К таким предупреждающим сигналам относятся внезапные изменения гемодинамических параметров, состояния сознания, объективных данных (например, больному внезапно стало хуже или он вдруг перестал сотрудничать с врачом), изменения ментальности, изменение газового состава артериальной крови, внезапно наступающая непереносимость энтерального питания, тромбоцитопения, уменьшение толерантности к глюкозе и многие другие симптомы, которые могут быть патогномоничными для изменений, патофизиологически обусловленных септическим поражением органов и систем.
21. Как вести больных с химическими ожогами?
Если химический агент представляет собой порошок, то прежде всего надо механически удалить его с поверхности кожи. После этого надо немедленно (в течение секунд) начать обильное и продолжительное (не меньше двадцати минут) орошение кожи проточной водой из-под крана. Некоторые химические агенты могут всасываться с поверхности кожи; поэтому надо немедленно связаться с ближайшим центром отравлений.
22. Как вести больных с электрическими травмами?
Электрические травмы можно подразделить на несколько типов, например, на ожоги пламенем электрического разряда и на поражения электрическим током. При травме электрическим током повреждение тканей обусловлено их электрической проводимостью и выделенной при прохождении тока энергией, количество которой зависит от силы тока (величина, выражаемая в амперах). В зависимости от проводимости или (что, собственно говоря, то же самое) сопротивления тканей при прохождении тока выделяется большее или меньшее количество тепла, которое приводит к денатурации белков, гибели или повреждению клеток.
Поскольку разные структуры организма имеют разный состав (кости, кожа, мышцы, сухожилия, нервы, легкие), то различается и их электрическая проводимость, поэтому ток протекает хаотично, и поражение конкретной ткани или органа является непредсказуемым; при этом поражение кожи может быть незначительным. Кожа поражается в минимальной степени только в точках входа и выхода тока, в то время как мышцы, нервы, сухожилия и даже кости могут подвергнуться тяжелым повреждениям и даже некротизироваться. Из-за сложного распределения этих повреждений самыми частыми осложнениями электротравмы являются мышечно-фасциальный синдром и миоглобинурия. Жизненно важными в этих условиях оказываются экстренная декомпрессия тканей и повторные ревизии раны с целью выявления и иссечения очагов некроза.
23. Какие реабилитационные мероприятия следует проводить после заживления ожоговой раны?
24. Являются ли дети с ожогами просто уменьшенными копиями взрослых больных, требующими точно такого же лечения?
Нет. В течении ожоговой болезни у детей имеются особенности, которые требуют участия педиатра в лечении.
25. Является ли данная статья исчерпывающим руководством по современным методам лечения больных с ожогами?
Нет, это лишь краткий обзор, вступление к теме. Для подробного ознакомления с современным состоянием вопроса рекомендуется прочитать книги, предствелнные в медицинской библиотеке на сайте.
Видео первой помощи при ожоге
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ПРИМЕНЕНИЕ БИОЛОГИЧЕСКОЙ ПОВЯЗКИ «КСЕНОДЕРМ» ПРИ ЛЕЧЕНИИ ОЖОГОВЫХ РАН
Алексеев А.А.
Тюрников Ю.И.
Попов С.В.
Бобровников А.Э.
Кафедра термических поражений, ран и раневой инфекции, РМАПО, г.Москва
Основной целью при лечении обожженных является максимально быстрое восстановление целостности кожного покрова. При поверхностных ожогах восстановление кожного покрова проводится при помощи местного консервативного лечения, создающего благоприятные условия для их заживления. При глубоких ожогах требуется проведение кожной пластики. Однако, при обширных глубоких ожогах более 15-20 % поверхности тела возникает дефицит донорских ресурсов кожи, существенно затрудняющий возможность одномоментной пластики всех ожоговых ран.
Между тем существующие ожоговые раны становятся входными воротами для инфицирования, через их поверхность теряются вода, белки, электролиты и другие важные биологические вещества. По мере увеличения площади ожогов эти проблемы оказывают все большее негативное влияние на течение ожоговой болезни, приводя к истощению, сепсису, а в неблагоприятных ситуациях и к летальному исходу. При дефиците донорских ресурсов также принципиальное значение приобретают максимально полное приживление пересаженных аутодермотрансплантатов и гладкое заживление донорских ран, поскольку в случае осложненного течения этих процессов общая площадь ран увеличивается.
Одним из вариантов проведения местного лечения ожоговых ран в условиях дефицита донорской кожи может быть использование временных раневых покрытий, разработка и совершенствование которых в настоящее время остается чрезвычайно важной научно-практической задачей в комбустиологии. Помимо замещения естественных функций здоровой кожи, действие таких покрытий, имитирующих свойства кожного покрова должно быть направлено на уменьшение возможности внешнего инфицирования, механического травмирования, создание оптимальных условий для регенерации и предотвращение чрезмерных потерь биологически важных для организма жидкостей и веществ. Использование покрытий обычно рассчитано на несколько дней и наиболее эффективно при местном лечении ран после удаления мертвых тканей. Для временного закрытия ран используются синтетические и биологические покрытия. В качестве синтетических заменителей кожи предложено большое количество покрытий, представляющих собой, чаще всего, пленки с различной структурой из полиуретана, полипропилена, полиэтилена, поливинилхлорида, поликаполактона и т.п. с определенными физико-химическими свойствами. Однако в настоящее время естественные функции кожи в лучшей степени выполняют временные биологические покрытия, полученные из кожи людей и животных. Среди биологических покрытий с конца позапрошлого столетия применяют аллогенную кожу. Аллогенная кожа, полученная от другого человека временно приживает на ранах реципиента с последующим отторжением, что дает время для подготовки к аутопластике. С этой целью чаще всего используют трупную кожу погибших от случайных причин (автокатастрофы, травмы и т.д.), хотя возможно применение и «утильных» тканей после редукционных пластических операций, ампутаций и т.д. Вместе с тем возможность инфицирования реципиентов от больных доноров (сифилис, гепатит, ВИЧ и др.) и проблемы юридического характера ограничивают широкое распространение аллогенной кожи в клинической практике. Среди ксенотрансплантатов, взятых от животных наиболее удачной оказалась свиная кожа. Она в значительной мере схожа по своему строению с кожей человека, не приживает, но успешно и надежно выполняет функции временного раневого покрытия.
В этой связи, в последние годы все более широкое применение получает отечественное биологическое покрытие «Ксенодерм» (ЗАО «АБ Медикал») из лиофилизированной свиной кожи, разработанное и прошедшее клинические испытания в России. Для его изготовления используется расщепленная кожа молодых особей, прошедших ветеринарный контроль на отсутствие инфекционных и паразитарных заболеваний. Покрытие стерилизуется ионизирующим излучением и консервируется лиофильным способом путем замораживания и высушивания в вакууме. Оно изготавливается в виде сплошных или перфорированных пластин белого или желтоватого «слоновой кости» цвета, размером 10 на 10 см и 10 на 15 см. Благодаря современной технологии изготовления пластины «Ксенодерм» обладают необходимой эластичностью и прочностью, хорошо моделируются по рельефу раневой поверхности, адгезивны, что препятствует их смещаемости. Целенаправленное разрушение и удаление компонентов межуточного вещества и имеющихся в свиной дерме минеральных примесей при изготовлении покрытия практически полностью лишают его раздражающего и аллергологенного действия. Основным показанием к применению покрытия «Ксенодерм» являются: раны после хирургической некрэктомии при невозможности их одномоментного закрытия и гранулирующие раны, очищенные от некроза в период подготовки их к аутодермопластике. Кроме того, покрытия «Ксенодерм» используют для защиты пересаженных расщепленных перфорированных аутодермотрансплантатов и донорских ран, что является немаловажным аспектом лечения пациентов с обширной ожоговой травмой. Возможно использование покрытий для защиты ран от экзогенной инфекции и травматизации при поверхностных и пограничных ожогов II-IIIA степени, особенно при обширных ожогах IIIАБ. Покрытие применяется следующим образом. Перед наложением его на рану предварительно проводят регидратацию пластин путем их погружения в физиологический раствор при температуре 15-200 С на 5-10 секунд. При ранах с высокой степенью микробной обсемененности регидратацию можно проводить в водных растворах антисептиков (0,02 % фурациллина, 0,1 % раствора фурагина, 1 % раствора йодопирона и т.п.). Перед наложением покрытия выполняют тщательный туалет раневой поверхности, удаляют нежизнеспособные ткани, остатки струпа, обрабатывают раны раствором антисептиков. При наложении покрытий «Ксенодерм» на операционные раны после хирургической некрэктомии предварительно проводят тщательный гемостаз. Пластины «Ксенодерма» свободно накладываются на всю раневую поверхность, вместе с тем наложение их на струп, отслоенный эпидермис нецелесообразно. Поверх перфорированных пластин «Ксенодерм» для усиления антибактериального эффекта, фиксации и предупреждения их быстрого высыхания рекомендуется укладывать повязки с антимикробными мазями или растворами антисептиков. При закрытии ран в труднодоступных местах тела больного, для удобства, пластины можно заранее равномерно распределить на подготовленной контурной повязке или зафиксировать скрепками. Смену «Ксенодерма» на гранулирующих ранах, обычно проводят через два-три дня, при значительном количестве раневого отделяемого ежедневно. При закрытии неинфицированных поверхностных ожогов, донорских ран пластины «Ксенодерм» удаляют после эпителизации ран. В случае нагноения раны проводятся перевязки с тщательным туалетом раневой поверхности.
Биологические раневые покрытия «Ксенодерм» использовались при лечении ожогов на клинических базах кафедры термических поражений, ран и раневой инфекции РМАПО у 100 пациентов с ожогами II-III-IV степени. Результаты клинического применения показали эффективность их применения после хирургической некрэктомии и при подготовке гранулирующих ран к пластическому закрытию, в качестве временного раневого покрытия. Для успеха лечения важно было отсутствие некрозов и гнойного воспаления в ране. При ожогах IIIA степени покрытие также было эффективно после очищения ран от фибрина и купирования гнойного воспаления. При наличии значительного раневого отделяемого оптимальным было применение перфорированных ксенопокрытий с наложением сверху повязки с мазью на водорастворимой основе, что усиливало антибактериальный эффект. Покрытие «Ксенодерм» также успешно применялось для лечения донорских ран и защиты перфорированных аутодермотрансплантатов в период их приживления на ожоговых ранах.
Таким образом, биологические покрытия «Ксенодерм», изготовленные из лиофилизированной свиной кожи являются эффективным средством для местного лечения ожоговых ран и могут с успехом применяться в комбустиологической практике в соответствие с представленными показаниями и методикой.
Своеобразной лекарственной формой являются раневые покрытия. Применение раневых покрытий позволяет существенно повысить эффективность лечения трофических язв, ран и ожогов. В настоящее время в клинической практике используется более 300 видов раневых покрытий. В статье рассмотрены основные виды раневых покрытий, применяемых на современном этапе для лечения ран различной этиологии. Дана подробная классификация по форме изготовления и способу применения раневых покрытий, по происхождению. Показано, что характерной тенденцией современных работ является использование биосовместимых природных и синтетических полимеров и их композиций в качестве основы покрытий для раны. Особое внимание уделено применению раневых покрытий на основе пектина. Описаны бактерицидные и репаративные свойства пектиновых пленок в экспериментальных и клинических исследованиях при лечении ожоговых ран и трофических язв.

2. Адамян A.A. Современные биологически активные перевязочные средства в комплексном лечении ран // Материалы 4 Международной конференции / под ред. В.Д. Федорова и A.A. Адамяна. – М., 2001. – С. 25–27.
4. Андреев Д. Ю. Современные раневые покрытия Ч. I / Д.Ю. Андреев, Б.А. Парамонов, А.М. Мухтарова // Вестн. хирургии им. И. И. Грекова. – 2009. – Т. 168, № 3. – С. 98–102.
5. Большаков И.Н. Применение коллаген-хитозанового раневого покрытия с культурой эмбриональных фибробластов при местном лечении глубоких ожогов / И.Н. Большаков, А.К. Кириченко, А.В. Еримеев, А.А. Власов // Фундам. исслед. – 2008. – № 10. – С. 59–60.
6. Бородин Ю.И. Раневое покрытие «Литопласт» / Ю.И. Бородин, Н.П. Бгатова // Успехи наук о жизни. – 2009. – № 1. – С. 31–51.
7. Воробьев С.А. Опыт применения раствора и геля «Пронтосан» в местном лечении гнойных ран различного происхождения / С.А. Воробьев, Е.Ю. Левчик // Хирургия. – 2009. – № 1(55). – С. 71–75.
8. Глухов А.А. Применение программной гидропрессивно-аспирационной санации в комплексном лечении больных с гнойными очагами мягких тканей / А.А. Глухов, В.А. Сергеев, В.М. Иванов // Вестн. эксперим. и клинич. хирургии. – 2009. – Т. 2, № 1. – С. 14–18.
9. Девятых Е.А. Гидрогелевые раневые покрытия в лечении венозных трофических язв : автореф. дис. … канд. мед.наук. – М., 2006. – 95 с.
10. Добыш С.В. Современные перевязочные средства для лечения ран во второй фазе раневого процесса / С.В. Добыш, А.В. Васильев, О.В. Шурупова // Материалы Международной конференции / под ред. В.Д. Федорова, А.А. Адамяна. – М., 2001. – С. 115.
11. Ефименко Н.А. Современные тенденции в создании биологически активных материалов для лечения гнойных ран / Н.А. Ефименко, Ф.Е. Шин, М.П. Толстых, А.С. Тепляшин // Воен. мед.журн. – 2002. – Т. 323, № 1. – С. 48–52.
12. Колсанов А.В. Комплексное лечение раневых дефектов кожи и мягких тканей различной этиологии с применением клеточных культур и биопокрытий. Экспериментально-клиническое исследование: дис. . д-ра мед.наук. – Самара, 2003. – 341 с.
13. Лазарева Е.Б. Эффективность местного применения пектинов в лечении ожоговых ран / Е.Б. Лазарева [и др.] // Антибиотики и химиотерапия. – 2002. – № 9. – С. 9–13.
14. Лазаренко В.А. Лечение гнойных ран с применением раневых покрытий «Биатравм» и «Ресорб» (экспериментальное исследование) / В.А. Лазаренко, А.И. Бежин, А.З. Гусейнов, А.В. Чердаков, А.В. Иванов, В.А. Жуковский // Вестн. новых мед.технологий. – 2010. – Т. 17, № 3. – С. 200–203.
15. Лесовой Д.Е. Восстановительная терапия тяжелых дефицитов мягких тканей в экспериментальной ожоговой ране с использованием гидрагелевого раневого покрытия ММ-Гель-Р / Д.Е. Лесовой, Н.Ю. Кузнецов, А.А. Артюхов, М.И. Штильман, С.М. Чудных // Биомедицина. – 2010. – № 4. – C. 33–39.
16. Новикова Н.Ф. Новые возможности лечения трофических язв, ран кожи и мягких тканей, пролежней и свищей / Н.Ф. Новикова, В.Н. Мордовцев, Т.В. Паренькова //Consiliummedicum. Хирургия. – 2000. – № 4. – С. 6–8.
17. Парамонов Б.А. Ожоги : рук.для врачей / Б.А. Парамонов, Я.О. Порембский, В.Г. Яблонский. – СПб.: Спец. Лит., 2000. – 480 с.
18. Сегура-Сенисерос Э.П. Оценка влияния пектин-папаиновых взаимодействий на стабильность фермента, и механические свойства пектиновых пленок из маракуйи, используемых для лечения кожных ран / Э.П. Сегура-Сенисерос [и др.] // Вестн. Моск. ун-та. Сер. 2: Химия. – 2006. – № 47. – С. 66–72.
19. Хатко З.Н. О лечебных свойствах пектиновой пленки: материалы 7 науч. Междунар. конф. «Современные наукоемкие технологии» // Фундам. исслед. – 2008. – № 1. – С. 150.
20. Хачатрян А.В. Оптимизация местного лечения ран и раневой инфекции кожи и мягких тканей (экспериментально-клиническое исследование): автореф. дис. … канд. мед. наук / А.В. Хачатрян. – Самара, 2009. – 15 с.
21. Чумаков П.А. Применение препарата пектина в комплексном лечении гнойных заболеваний мягких тканей: дис. канд. мед.наук. – Омск, 2006. – 135 с.
22. Шандуренко И.Н. Опыт клинического применения биологически активных гелевых повязок // Современные подходы к разработке и клиническому применению эффективных перевязочных средств, шовных материалов и полимерных имплантатов: материалы 4 Междунар. конф. – М., 2001. – С. 82–85.
23. Шестаков И. А. Влияние применения препарата «Коллост» на механическую прочность толстокишечных анастомозов (экспериментальное исследование) / Шестаков И.А. [и др.] // Науч. ведомости Белгород.гос. ун-та. Сер.: Медицина. Фармация. – 2009. – Т. 67, № 8. – С. 75–79.
24. Frykberg R.G. Chronicwoundstreatedwithaphysiologicallyrelevantconcentrationofplatelet-richplasmagel: aprospective case series / R.G. Frykberg [et al.] // Ostomy Wound Manage. – 2010. – Vol. 56, N 6. – P. 36–44.
25. Goossens A. New wound dressings: classification, tolerance / A. Goossens, M.-B. Cleenewerck // Eur. J. Dermatol. – 2010. – Vol. 20, № 1. – P. 24–26.
26. Jones, I. A guide to biological skin substitutes / I. Jones, L. Currie, R. Martin // Br. J. Plast. Surg. – 2002. – Vol. 55, № 3. – P. 185–193.
27. Kong M. Antimicrobial properties of chitosan and mode of action: a state of the art review / M. Kong, X.G. Chen, K. Xing, H.J. Park // Int. J. Food. Microbiol. – 2010. – Vol. 144, № 1. – P. 51–63.
28. Marissa J. Carter. Use of Platelet Rich Plasma Gel on Wound Healing: A Systematic Review and Meta-Analysis / M.J. Carter, C.P. Fulling, L.K. Parnell //Eplasty. – 2011. – Vol. 11. – P. e38.
29. Pham C. Bioengineered skin substitutes for the management of burns: a systematic review / C. Pham [et al.] // Burns. – 2007. – Vol. 33, № 8. – P. 946–957.
30. Reese R.J. Autologous platelet rich plasma (PRP): what do we know? Important concepts relevant to hair restoration surgery // Hair Transplant Forum Int. – 2010. – January/February. – P. 14–17.
Проблема лечения ран и раневой инфекции остается актуальной на протяжении всей истории хирургии [1, 2, 8, 27]. Другой проблемой является восстановление утраченного кожного покрова при заболеваниях и повреждениях различной этиологии [3, 16].
Своеобразной лекарственной формой являются раневые покрытия (РП). Применение РП позволяет существенно повысить эффективность лечения ТЯ, ран и ожогов [10, 17]. В настоящее время в клинической практике используется более 300 видов раневых покрытий [4].
Основные требования, предъявляемые к РП, заключаются в создании оптимальной микросреды для заживления ран, высокой абсорбционной способности в отношении раневого экссудата, способности предотвращать проникновение микроорганизмов, достаточной проницаемости для газов, паров воды, эластичности, отсутствии пирогенного, антигенного, токсического, местного раздражающего и аллергического действий.
По форме изготовления и способу применения РП подразделяются на: губки, гелеобразующие покрытия, пленочные покрытия, покрытия, формирующиеся при распылении композиции в виде аэрозоля, комбинированные покрытия [11, 25].
По своему происхождению РП можно условно разделить на природные и синтетические [12]. Препараты природного происхождения – это различные варианты консервированной кожи или дермы, амниотической оболочки человека или животных и являются «золотым стандартом» раневого покрытия. Зарубежными фирмами из донорской кожи человека выпускаются покрытия:
1) «TransCyte» – биосинтетическая полупроницаемая мембрана силикона на нейлоновой сетке, покрытая свиным коллагеном и человеческими фибробластами новорожденных, используется в качестве повязки на поверхностные ожоги, которые не требуют пересадки кожи;
2) «Dermagraft» – содержит фибробласты новорожденных на биоабсорбируемой сетке полиглактина [29];
3) «Apligraf» состоит из слоя эпидермиса аллогенных неонатальных кератиноцитов и фибробластов от новорожденных [26], который используется в качестве дополнения к аутотрансплантантному покрытию, что обеспечивает ускоренное заживление ран [29];
4) «Integra» – состоящая из матрицы бычьего коллагена, хондроитин-6-сульфата, гликозаминогликана из хрящей акулы.
Широкое распространение в настоящее время получили раневые покрытия из свиной кожи – «Свидерм» и «AlloaskD». Препаратом нового поколения, содержащим коллаген 1 типа, полученный из кожи крупного рогатого скота, является «Коллост». И.А. Шестаков (2009) получил положительный эффект, применяя «Коллост» для укрепления толстокишечного анастомоза.
Для лечебных целей может использоваться амниотическая мембрана человека или животных. Лечебное действие обусловлено наличием в ее составе ряда компонентов внеклеточного матрикса (коллагена, фибронектина, гликозамигликанов) и ростовых факторов. Сложная технология производства и высокая стоимость обусловливает трудность их использования в отечественном здравоохранении.
К РП биологического происхождения относят покрытия на основе белково-полисахаридных комплексов. Их преимуществом является нетоксичность, антигенность, они легко и быстро резорбируются организмом. И.Н. Большаковым и А.К. Кириченко (2008) показана эффективность применения раневого покрытия на основе коллаген-хитозанового комплекса, содержащего пролиферирующую культуру фибробластов, возможность полноценного восстановления тканевых структур, включая сосочковый слой кожи. Созданы различные коллаген-хитозановые раневые покрытия «Коллахит» – «Коллахит ФА», содержит антисептический препарат «Фурагин» и местный анестетик анилокаин и «Коллахит Ш», содержит антисептик растительного происхождения – шиконин.
К биологически активным текстильным перевязочным материалам относят семейство перевязочных материалов «Активтекс», которое насчитывает более 20 наименований изделий с различным лечебным действием. А.В. Хачатрян (2009) с хорошим эффектом использовала «Активтексфурагин» при подготовке гранулирующих ран, в том числе обширных, к кожной пластике.
Сорбенты отечественного и зарубежного производства все шире используются для лечения гнойных ран. Основной функциональной характеристикой сорбирующих покрытий является способность поглощать выделяющийся из раны экссудат, количество которого может быть значительно.
Ю.И. Бородин с соавт. (2009) в экспериментах на лабораторных животных показал, что применение РП «Литопласт» при лечении ожоговой раны III А степени оказывает протективный эффект на структурную организацию начальных звеньев лимфатической системы кожи, улучшает ее дренажную функцию, способствует снижению степени эндогенной интоксикации организма в послеожоговом периоде. В.А. Лазаренко с соавт. (2010) применял раневое покрытие «Ресорб» в лечении гнойных ран в I и II фазах раневого процесса, что способствовало сокращению основных стадий течения раневого процесса в два раза по сравнению с лечением официнальной мазью «Левомеколь». Лучшие результаты автор получал при совместном использовании «Ресорба» и «Биатравма».
Гелеобразующие покрытия формируются при смачивании экссудатом нанесенного на раневые поверхности в виде порошка вещества и чаще всего выполняют функцию дренирующих сорбентов. Эти вещества обеспечивают отток в повязку не только раневого экссудата, но и микроорганизмов.
Большим количеством препаратов представлены гидрогелевые раневые покрытия. К ним относят: гидроколлоиды – «Comfeelulcer», «Comfeelplus», «Hydrocoll», «SuprasorbH», «Opragel», «Granuflex», «DuoDerm» «Еxtra-thin», «Tegasorb»; гидрогели в тубах – «Purilongel», «Nu-Gel», «Hydrosorbgel», «Suprasorb G», «Granugel»; гидрогелевые повязки – «Hydrosorb», «Гелепран». По результатам исследования Е.А. Девятых (2006), применение отечественного гидрогелевого раневого покрытия «Гелепран» оказывает стимулирующее действие на процессы заживления. Создание и поддержание гидрогелями на язвенной поверхности влажной среды способствует более быстрому по сравнению со стандартной терапией регрессу клинических симптомов и закрытию венозных ТЯ.
Другим РП на основе макропористых гидрогелей поливинилового спирта является «ММ-Гель-Р (ЭГ)». На сегодняшний день исследуемый материал является единственным материалом, который может быть использован во всех трех фазах раневого процесса. Кроме того, при использовании данного материала отсутствует необходимость в оперативном вмешательстве по поводу некрэктомии и аутодермопластики, а также назначении пациенту противовоспалительных и обезболивающих препаратов [15]. При местном лечении гнойных ран и язв различного происхождения в первой и второй фазах раневого процесса эффективный результат показал гель «Пронтосан» за счет ускорения их очищения, сокращения сроков экссудации и заживления, снижения интенсивности местного болевого синдрома. По данным С.А. Воробьева с соавт. (2009), местное применение раствора и геля «Пронтосан» хорошо переносится и не вызывает побочных эффектов у пациентов с гнойными ранами и язвами различной этиологии.
Для лечения гнойно-воспалительных заболеваний ран И.Н. Шандуренко (2001) применил биологически активные гелевые повязки «АППОЛО-ПАК» и «АППОЛО-ПАА». В состав гидрогеля включены лекарственные вещества – антисептик (мирамистин) и анестетик местного действия – анилокаин. Автор установил, что гелевые повязки защищают ткани от высушивания и травмирования, способствуют лизису некротических тканей, обеспечивают дренаж раны, стимулируют пролиферативную и синтетическую активность соединительнотканных клеток, образование грануляционной ткани.
В странах Западной Европы и США на протяжении более 20 лет для стимуляции заживления ран используется PRP гель (гель, обогащенный тромбоцитами плазмы). Аутологичный PRP гель состоит из цитокинов, факторов роста, хемокинов и фибрина, полученных из крови пациента [R.G. Frykberg, V.R. Driveretal., 2010; RJ. Reese, 2010]. Механизм действия PRP-геля связан с молекулярной и клеточной индукцией, аналогичной той, которая наблюдается при активации тромбоцитов [30]. Marissa J. Carter (2011) провела систематический обзор и мета-анализ, которые показали, что полное и частичное заживление ран было быстрее у больных, которым применялся PRP-гель, по сравнению с контрольной группой.
Относительно недавно в клинической практике стали использоваться лекарственные средства на основе пектина. В 1975 году фирмой Conva Tec создана повязка на основе пектина и желатина для лечения венозных язв голеней – «Varihesive». Новый материал настолько активно стимулировал образование грануляционной ткани, что в некоторых наблюдениях приходилось прижигать избыточные грануляции. В последнее время при поиске новых средств для местного воздействия на гнойную рану в первую очередь учитывалась способность пектина эффективно подавлять раневую микрофлору и препятствовать суперинфицированию раны представителями внутрибольничной инфекции [21]. Бактерицидные свойства пектина позволяют использовать его в составе пектин-желатинового комплекса с добавками физиологически активных веществ в качестве водорастворимой пленки для лечения открытых ран и ожогов [19]. Э.П. Сегура-Сенисерос с соавт. (2006) использовали отходы производства сока маракуйи (пассифлоры) в качестве носителя для иммобилизации протеазы папаина при получении пленок, пригодных для лечения кожных ран. Исследования по лечению кожных ран, проведенные на добровольных пациентах с применением папаин-пектиновых пленок, продемонстрировали ускорение заживления ран без каких-либо негативных побочных эффектов независимо от типа и глубины раны.
В НИИ скорой помощи им. Н.В. Склифосовского Е.Б. Лазарева и соавт. (2002) использовала 1–2 % раствор пектинов (яблочного и свекловичного) для лечения ожоговых ран. Клинические наблюдения показали, что местное применение пектинов хорошо переносится больными, не вызывает побочных реакций и осложнений. При нагноении ожоговых ран IIIА -IIIБ степени наложение повязок с пектинами приводило к быстрому купированию нагноительного процесса. Сроки заживления ран, леченных пектинами, на 2–4 дня опережали контрольные за счет ускоренного очищения раны в экссудативную стадию течения раневого процесса. Также исследователи отметили выраженный бактерицидный эффект пектина в отношении стрептококков и синегнойной палочки. Авторами подчеркивается, что наибольший эффект достигался при использовании пектинов с первых дней после ожога.
Таким образом, обширный материал по данной проблеме, освященный в различных литературных источниках, свидетельствует об актуальности проблемы в лечении ран при помощи раневых покрытий.
Рецензенты:
Гуменюк С.Е., д.м.н., профессор, заведующий кафедрой педиатрического и стоматологического факультетов, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар;
Кульчиев А.А., д.м.н., профессор, заведующий кафедрой хирургических болезней № 3, ГБОУ ВПО СОГМА Минздрава России, РСО ‒ Алания, г. Владикавказ.
Лечение ожоговых раны. Тактика
Совершенствование методов лечения ожоговых ран и использование антибактериального покрытия резко снизили частоту летального сепсиса. Прежняя методика лечения, допускающая отделение струпа путем лизиса бактериальными энзимами, уступила место закрытию раны посредством раннего иссечения и пластики.
В отношении тех ран, которые не требуют кожной пластики, местное применение антибактериальных мазей способствует профилактике инфицирования и поддержанию влажной среды, оптимальной для репаративных процессов. Принятую в настоящее время тактику ведения ожоговых ран можно разделить на три этапа: оценка, лечение и реабилитация.
Сразу после оценки площади и глубины поражения проводят хирургическую обработку, за которой следует второй этап оказания помощи — лечение. Любую рану следует закрыть соответствующими средствами, каждое из которых преследует три цели, первая из которых — защита поврежденного эпителия, вторая — обеспечение герметичности с целью уменьшения потери тепла и воздействия холода, третья — создание ощущения комфорта над причиняющей боль ожоговой поверхностью.
Выбор соответствующего раневого покрытия зависит от особенностей ожога. Ожоги I степени вызывают незначительные деструктивные изменения с минимальной утратой барьерной функции. Такие ожоги не требуют раневого покрытия, и лечение заключается в аппликации мазей, предназначенных для уменьшения боли и поддержания кожи в увлажненном состоянии. Раны от ожогов II степени лечат путем ежедневного наложения повязок с антибактериальными мазями, такими как сульфадиазин серебра. Мазь, после нанесения, покрывают несколькими слоями марли, и неплотно фиксируют повязку эластичным бинтом.
Можно временно использовать биологические или синтетические покрытия, которые отторгаются в процессе эпителизации раны. Такие материалы обеспечивают восстановление кожного покрова без болезненной смены повязок и потерь от испарения, и, кроме того, уменьшают болевые ощущения. Их дополнительное преимущество состоит в том, что они не препятствуют эпителизации, чем отличаются многие антибактериальные средства для местного применения. Синтетические покрытия не обладают антибактериальными свойствами, поэтому процесс заживления необходимо внимательно контролировать.
Для покрытия ожоговых ран среди прочих используют аллотрансплантат (кадаверная кожа), ксенотрансплантат (свиная кожа) и Biobrane (Bertek, Morgantown, WV). Как правило, такие покрытия необходимо накладывать не позднее 24 часов с момента ожога, пока не произошло массивное обсеменение микроорганизмами.
Ожоги II глубокой и III степени не заживут в срок без аутодермопластики. Обожженные ткани представляют собой источник воспалительной реакции и инфекционных процессов, которые могут привести к смерти пострадавшего. Раннее иссечение и кожная пластика сегодня практикуется большинством ожоговых хирургов в ответ на публикации, показывающие положительное воздействие этапных хирургических обработок на выживаемость, кровопотерю и сроки госпитализации.
Хирургические обработки лучше выполнять после наложения кровоостанавливающего жгута или аппликации эпинефрина и тромбина, что позволяет свести к минимуму кровопотерю. После радикального иссечения некротических тканей рану закрывают кожным аутотрансплантатом или используют другое долговременное покрытие. Идеальным раневым покрытием является собственная кожа пострадавшего.
Раны площадью менее 20-30% поверхности тела обычно можно одномоментно закрыть кожей больного, для забора которой используют пригодный донорский участок.
При таких операциях применяют либо нерасщепленный кожный лоскут, либо сетчатый с перфорацией 2:1 и менее для лучших косметических результатов. При обширных ожогах возможен дефицит неповрежденной донорской кожи, не позволяющий полностью закрыть рану аутопластикой. Доступность трупной кожи изменила вектор современного лечения массивных ожогов. Стандартное лечение заключается в использовании аутотрансплантатов с коэффициентом растяжения 4:1 или более, поверх которых накладывают аллогенную кожу для полного закрытия тех ран, для которых имеются донорские ресурсы. Такой аутологичный трансплантат под аллокожей приживается примерно через три недели, а сам аллотрансплантат отторгается.
Иммунитет у пострадавших с массивными ожогами значительно ослаблен, и преждевременное отторжение аллотрансплантата происходит крайне редко. Участки раны, которые не удается закрыть сетчатым аутолоскутом с широкой перфорацией, укрывают аллогенной кожей в порядке подготовки к аутопластике после готовности донорских участков к повторному забору. В идеале, раны, локализующиеся на участках меньшего косметического значения, закрывают сетчатым трансплантатом с широкой перфорацией для увеличения площади закрытия до использования неперфорированных лоскутов в косметически важных областях, таких как кисти и лицо.
Большинство хирургов выполняют некрэктомию в первые 7 дней после ожога, иногда ежедневно иссекая по 20% поврежденных тканей за одну операцию. Другие проводят радикальное иссечение всего массива некроза за одну процедуру, что бывает непросто у больных с большой поверхностью ожога, развившейся гипотермией или большой кровопотерей. Авторы в своей практике выполняют хирургическую обработку сразу после стабилизации состояния пациента, так как кровопотеря будет минимальной, если состояние пациента позволит провести операцию в первые сутки после травмы. Возможно, это связано с относительным преобладанием в крови сосудосуживающих субстанций, таких как тромбоксан и катехоламины, и истинным отеком тканей, который развивается сразу после травмы. Через два дня рана становится гиперемированной, и кровопотеря во время хирургического вмешательства может стать серьезной проблемой.
При ожогах III степени, которые часто вызваны кипятком, необходимо выполнять раннюю хирургическую обработку. На это следует обратить особое внимание, так как ожоги кипятком очень распространены. Обычно такие повреждения бывают частичной или смешанной (на неполную и полную толщу дермы) глубины, и для их закрытия используют такие материалы, как аллотрансплантат, свиной ксенотрансплантат или Biobrane, выполняющие защитную функцию в процессе заживления раны.
Ожоги II глубокой степени в первые 24-48 часов после травмы можно принять за ожоги III степени, особенно при местном применении антибактериальных средств, которые при контакте с раневым экссудатом образуют псевдоструп. Рандомизированное проспективное сравнительное исследование ранней хирургической обработки и консервативного лечения ожогов кипятком с отсроченной трансплантацией показало, что ранняя обработка увеличивает объем некрэктомии, повышает кровопотерю и удлиняет время операции. При этом разницы в сроках госпитализации или частоте инфицирования выявлено не было.
Потеря использованных донорских трансплантатов происходит по одной или нескольким из следующих причин: скопление жидкости под трансплантатом; сдвигающие воздействия на уже сцепленный с раной трансплантат; нерадикальное иссечение некротических тканей в области раневого ложа. Профилактику бактериального заражения проводят путем периоперационного применения антибиотиков и интраоперационного покрытия трансплантатов антибактериальными средствами для местного применения.
Тщательный гемостаз, подходящий коэффициент перфорации или послеоперационная «прокатка» трансплантата и/или дополнительная фиксация окклюзирующими покрытиями в соответствующих областях, — все это уменьшает скопление жидкости. Подвижность трансплантата ограничивают за счет иммобилизации области дермопластики. Нерадикальное иссечение зоны некроза в области раневого ложа чрезвычайно редко встречается в практике опытных хирургов. Критерии достижения необходимой глубины иссечения — капиллярная кровоточивость, цвет дермы, визуализация жировой клетчатки в ране.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

