Антибиотики для лечения гангрены при сахарном диабете
Обновлено: 01.05.2024
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Возбудители
- Staphyloccocus aureus
- Streptococcal species
- Enterobacteriaceae
- Pseudomonas aeruginosa
- Enterococcus
- Анаэробы
- Поверхностные инфекции (целлюлит, поверхностные язвы) как правило, вызванные S.aureus или бета-гемолитическим стрептококком
- Инфицированные язвы, хронические или ранее получавшие лечение антибактериальными препаратами, могут быть вызваны грамотрицательными бактериями и анаэробами (анаэробные стрептококки, группа Bacteroidesfragilis,Clostridiumspp), но часто S.aureus может быть единственным возбудителем.
- Инфицированная диабетическая стопа является частым осложнением сахарного диабета (на ее долю приходится 25% диабетических госпитализаций); являясь фактором риска для проведения ампутации.
- Факторами риска для ее развития являются:
- Анамнез: целлюлит или язва обычно безболезненные из-за диабетической нейропатии
- Физикальное исследование: данные включают в себя:
- Анализ глубоких тканей (например, биопсия кости, содержимого абсцесса, хирургически обработанный образец со дна язвы) дает самый надежный результат. Поверхностные культуры (например, мазок) не коррелирует надежно с данными глубоких микробиологических культур.
- Rg-исследование:
§ МРТ является лучшим методом (95% чувствительность, 99% специфичность), но бывают ложные результаты из-за нейропатической остеонейропатии.
- Сканирование меченных лейкоцитов имеет лучшую специфичность, чем сканирование костей.
- Для диагностики остеомиелита считается возможным проверка кости у основания язвы, но некоторые считают, что это дает низкие положительные предикативные значения, но это может быть лучше так как зонд-тест позволяет исключить остеомиелит.
- Задачи антибактериальной терапии включают – перекрытие стептококков при целлюлите; мягкие язвы могут быть вызваны стафилококками +/- MRSA и грамотрицательными возбудителями. 500 мг per os (РО) 4 раза в день х 14 дней
- Амоксициллин/клавуланат 875-100 мг РО дважды в день х 14 дней
- Ампициллин/сульбактам 3 грамма в/в каждые 6 часов х 14 дней 1-2 грамма в/в каждые 8 часов х 14 дней
- Нафциллин или оксациллин 2 грамма каждые 4 часа х 14 дней 300 мг РО 3 раза/день х 14 дней (включая MRSA)
- Триметоприм-сульфаметоксазол 2 DS (у нас это бактрим форте) РО дважды в день х 14 дней (включая MRSA) 600 мг в/в каждые 6-8 часов х 14 дней 600 мг РО дважды в день х 14 дней 15 мг/кг в/в каждые 12 часов.
- Рекомендована консультация ургентного хирурга
- Учитывать сосудистую оценку
- Изменить режим в зависимости от полученных данных из глубоких слоев и полученных микробиологических культур
- Ампициллин/сульбактам 3 г в/в каждые 6 часов или тикарциллин/клавуланат 3,1 г в/в каждые 6 часов или пиперациллин/тазобактам 3,375 г в/в каждые 6 часов
- Альтернатива: клиндамицин 600 мг в/в каждые 6 часов + (левофлоксацин 750 мг РО один раз в день или ципрофлоксацин 750 мг РО [400 мг в/в] каждые 12 часов) 2 г в/в 1 р/д + метронидазол 500 мг в/в каждые 6-8 часов 1 г в/в 1 р/д
- Добавлять к указанным выше схемам ванкомицин 15 мг/кг в/в каждые 12 часов или линезолид 600 мг в/в РО каждые 12 часов, если подозрения на наличие MRSA достаточно высоки или инфекция тяжелая сама по себе
- Парентеральную терапию проводить до стабилизации состояния, затем переводить на пероральную терапию на срок до 4-х недель при отсутствии остеомиелита
- Для остеомиелита: часто требуется хирургическая обработка некротизированной кости и часто необходима > 2 недель парентеральная терапия и 4-6 недель общей антибиотикотерапии или при отсутствии хирургической обработки 2-6 недель парентеральной терапии и >2 месяцев пероральной терапии.
- Консультация ургентного хирурга, ургентная сосудистая оценка. Выбор антибактериального режима в соответствии с чувствительностью (если она известна), вероятность наличия MRSA (его следует рассматривать в большинстве случаев) 900 мг в/в каждые 8 часов + цефтазидим 2 г в/в каждые 8 часов или цефепим 2 г в/в каждые 8 часов или цефотаксим 2 г в/в каждые 8 часов или цефтриаксон 2 г в/в 1 р/день
- Пиперациллин/тазобактам 3, 375 г в/в каждые 4 часа или тикарциллина клавуланат 3,1 г в/в каждые 4 часа 500 мг в/в каждые 6 часов или меропенем 1 г в/в каждые 8 часов или эртапенем 1 г в/в 1 р/день 15 мг/кг в/в каждые 12 часов + цефепим 2 г в/в каждые 12 часов или цефтазидим 2 г в/в каждые 8 часов + метронидазол 500 мг в/в каждые 6 часов.
- Лечение обычно требует длительной парентеральной и пероральной терапии, продолжительность определяется результатом и наличием, либо отсутствием остеомиелита.
Антимикробная терапия должна сочетаться с гликемическим контролем, скрупулезным уходом за раной, полной хирургической обработки раны и резекции инфицированной кости.
И. Я. Михалойко 1 , В. Д. Скрипко 1 , Р. В. Сабадош 1 , А.Л. Коваленко 2
1 Ивано-Франковский национальный медицинский университет, 76018 Ивано-Франковск, ул. Галицкая, 2, Украина;
2 Институт токсикологии Федерального медико-биологического агентства, 192019 Санкт-Петербург, ул. Бехтерева, 1
Целью исследования стало изучение эффективности препарата «Цитофлавин» в комплексном лечении синдрома диабетической стопы смешанной формы с медиакальцинозом артерий у 75 пациентов пожилого возраста с сахарным диабетом 2-го типа. В зависимости от схемы лечения, больные были разделены на две группы: контрольная получала базовую терапию; основная группа, дополнительно к базовой, получала препарат «Цитофлавин» по 10 мл на 0,9 % NaCl 200 мл в течение 10 дней, с последующим переходом на таблетированную форму препарата - по 2 таблетки 2 раза в сутки внутрь в течение 1 мес. Включение Цитофлавина в схему лечения повышало эффективность терапии, что выражалось в улучшении оксигенации тканей за счет нормализации базального напряжения кислорода, восстановлении активности ферментов антиоксидантной системы и, как следствие, в достоверном уменьшении средних сроков стационарного лечения, в уменьшении числа повторных оперативных вмешательств и реампутаций в течение последующего года.
Ключевые слова: сахарный диабет 2-го типа, синдром диабетической стопы, медиакальциноз, Цитофлавин
I. Ya. Myhaloyko 1 , V. D. Skrypko 1 , R. V. Sabadosh 1 , A. L. Kovalenko 2 Optimization of treatment of elderly patients with diabetic foot syndrome and mediakaltsinozom arteries
1 Ivano-Frankivsk national medical university, 2, ul. Halytskaya, Ivano-Frankovsk 76018, Ukraine;
2 Institute of toxicology of Federal Medical-Biology Agency, 1, ul. Behtereva, St. Petersburg 192019
The objective of the research was to study the effectiveness of the drug Cytoflavin in the comprehensive treatment of mixed form diabetic foot syndrome with media calcification arteries in 75 elderly patients with type 2 diabetes. Depending on the regimen, patients were divided into two groups: control received basic therapy; main group in addition to the base, received the drug Cytoflavin 10 ml 0,9 % NaCl 200 ml for 10 days, followed by a transition to the tablet form of the drug - 2 tablets 2 times per day orally for one month. The inclusion of the drug Cytoflavin in the treatment regimen increased the effectiveness of treatment, which was shown to improve tissue oxygenation due to the normalization of the basal oxygen tension, restoring the activity of antioxidant enzymes and, consequently, in an authentic decrease in the average time of hospital treatment and a decrease in the number of repeated surgical interventions and reamputatsy over the next year.
Keywords: type 2 diabetes, diabetic foot syndrome, media calcification, Cytoflavin
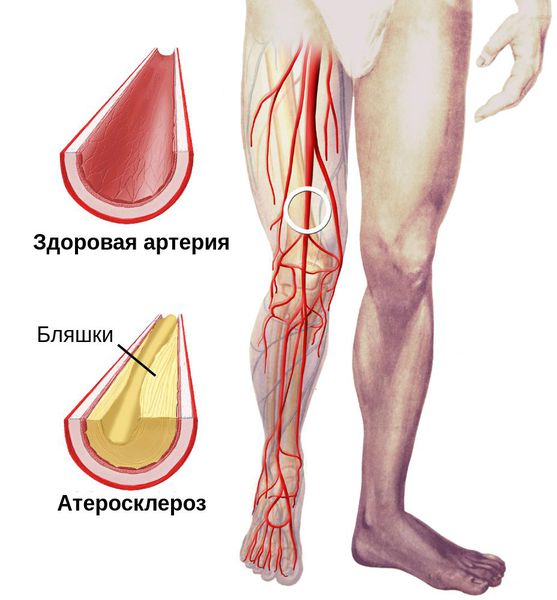
У пожилых пациентов с СД 2-го типа поражаются, преимущественно, крупные сосуды (макроангиопатия), что приводит к ишемическим осложнениям. В формировании диабетической макроангиопатии, по современным научным данным, участвуют два патогенетических механизма: атеросклероз крупных сосудов, который проявляется формированием атеросклеротических бляшек с сужением просвета сосудов, и кальцифицирующий артериосклероз Менкеберга, или медиакальциноз (МК) артерий [1, 5, 12].Синдром диабетической стопы - самое частое осложнение сахарного диабета (СД) [1]. С ним связана примерно 1/3 госпитализаций этих больных. Синдром возникает у 80 % больных СД спустя 15-20 лет после начала болезни и в половине случаев заканчивается ампутацией одной или обеих нижних конечностей. 2/3 пациентов умирают от гангрены нижних конечностей, причем ее развитие у больных СД наблюдают в 40 раз чаще, чем в общей популяции [2, 3, 6].
Особенности атеросклероза при СД изучены на сегодняшний день достаточно хорошо. Что касается МК, то о нем в литературе встречаются лишь единичные данные [1]. Вместе с тем, это осложнение привлекает к себе все большее внимание клиницистов. Это объясняется, во-первых, тем, что МК является распространенным патологическим процессом, частота которого сопоставима с атеросклерозом, во-вторых, отложение солей кальция в сосудистую стенку не является случайным явлением, как считалось ранее: обызвествление артерий не только нарушает их функциональные свойства, но и оказывает существенное влияние как на местное кровообращение, так и на общую гемодинамику [2, 5, 13]. В результате МК, артерия превращается в ригидную трубку с фиксированным диаметром, что создает предпосылки для развития «функциональной» ишемии конечности, - ишемии, возникающей на фоне состояний, требующих увеличения объемного кровотока и, в первую очередь, при физической нагрузке, а также, возможно, и при других состояниях (воспаление).
Поэтому использование вазодилататоров у пациентов с МК для улучшения оксигенации тканей стопы неэффективно и приводит к развитию «синдрома обкрадывания», тем самым углубляя ишемию [3, 6, 8]. При СД в процесс вовлекаются также мелкие коллатеральные артерии, в которых обнаруживают явления МК [11]. Это препятствует развитию коллатерального кровообращения, что, в свою очередь, усиливает явления гипоксии тканей [1, 7].
Кальциноз стенок артерий нижних конечностей может обнаруживаться у людей с нормальным углеводным обменом, причем с возрастом его частота возрастает. Его обнаруживают у лиц моложе 45 лет в 5 % случаев, у лиц 45-60 лет - в 16 %, у пожилых старше 60 лет - в 37 % [2, 6, 13]. Однако у больных СД, кальциноз артерий нижних конечностей во всех возрастных группах выявляется, в среднем, в 3 раза чаще - в 15; 53 и 100 %, соответственно. Наиболее выраженные изменения обнаруживают у мужчин старше 80 лет с длительностью СД более 10 лет. У больных с гангреной нижней конечности на фоне СД артериосклероз Менкеберга выявляют практически всегда[1, 7, 15].
Многие считают, что обызвествление артериальной стенки является важным предиктором тяжелых сосудистых событий, следовательно, своевременное выявление у пациентов кальцификации артерий должно сигнализировать об опасности и способствовать проведению адекватного лечения [8, 9]. По современным научным данным, в патогенезе медиакальциноза участвует дистальная полинейропатия, микроангиопатия (поражение vasa vasorum), а также оксидативный стресс. Арсенал современных лекарственных средств, которые обладают широким спектром воздействия на развитие и течение синдрома диабетической стопы, в наше время весьма ограничен [7, 14].
Цель работы - оценка эффективности препарата «Цитофлавин» в комплексном лечении синдрома диабетической стопы с медиакальцинозом артерий у пациентов с СД 2-го типа.
Материалы и методы
Проанализированы результаты лечения 75 пожилых (средний возраст - 68,7±4,2 года) больных (60 мужчин и 15 женщин) с диагнозом СД 2-го типа (субкомпенсированная форма), с синдромом диабетической стопы смешанной формы, с медиакальцинозом артерий стопы и голени, находившихся на лечении в хирургическом отделении Ивано-Франковской ЦГКБ.
В зависимости от схемы лечения, все больные были разделены на две группы: контрольная (n=37) получала базовую терапию: инсулинотерапию, антибактериальные, дезинтоксикационные, иммунномодулирующие средства, вазодилататоры, спазмолитики, анальгетики, витаминотерапию; основная (n=38), дополнительно к базовой терапии, получала препарат «Цитофлавин» по 10 мл на 0,9 % NaCl 200 мл в течение 10 дней, с последующим переходом на таблетированную форму препарата - по 2 таблетки 2 раза в сутки внутрь в течение 1 мес; больным основной группы была отменена вазодилатационная и спазмолитическая терапия.
Хирургическое лечение гнойно-некротических процессов при синдроме диабетической стопы (характер процесса оценивали по F. W. Wagner, 1979) включало: при гнойно-некротических ранах стопы - радикальную хирургическую обработку, при очаговых некрозах кожи стопы, трофических язвах - некрэктомию, при флегмонах, абсцессах стопы и панарициях пальцев стопы - радикальную некрэктомию и дренирование раны, при остеомиелите костей стопы - секвестрэктомию или некрэктомию. В случае развития влажной гангрены пальца проводили его экзартикуляцию с резекцией 2/3 плюсневых костей, при влажной гангрене дистальных отделов стопы - трансметатарзальную ампутацию или ампутацию по Лисфранку, при влажной гангрене всей стопы с переходом процесса на голень - ампутацию нижней конечности на уровне верхней или средней трети бедра.
Послеоперационное местное консервативное лечение проводили в зависимости от фазы раневого процесса: в I фазе при перевязках проводили химическую и ферментативную некрэктомию, накладывали повязки с гидрофильными мазями, антибиотиками широкого спектра действия, ингибиторами протеаз, антисептиками; во II фазе накладывали повязки с нейтральными мазями.
Помимо общепринятого клинико- лабораторного обследования, пациентам были проведены: рентгенография пораженной стопы и голени в прямой и боковой проекциях - для определения наличия и степени выраженности медиакальциноза, который оценивали по классификации В. А. Горелышева (1989) [5]; дуплексное сканирование - для определения типа кровотока по артериям стопы; определение ферментов анти-оксидантной системы - каталазы и СОД - по стандартным методикам [4]. Для оценки микроангиопатии изучали показатель транскутанного напряжения кислорода (tcpO2) аппаратом «ТСМ-2 Radiometer» (Дания), который укомплектован нагревательным кислородным электродом типа «Clark». При этом измеряли как базальный уровень tcpO2, так и динамику изменений при проведении ортостатической пробы с опусканием ноги (tcpO2OH) [6].
Все больные были обследованы в динамике - до начала лечения, на 10-й день и по завершении курса приема Цитофлавина (40-й день). Отдаленные последствия лечения (в течение года) оценивали по частоте повторных операций, в том числе реампутаций.
Статистическую обработку полученных результатов проводили с использованием стандартного пакета программ Statistica 6.0. Распределение каждой из исследуемых переменных была проверена «на нормальность» методом Шапиро-Уилка. Для описания переменных с нормальным распределением использовали среднее арифметическое значение (М) и среднее квадратическое отклонение (σ). Описание переменных, распределение которых отличалось от нормального, осуществлено с помощью медианы (Ме) нижнего и верхнего квартилей (q 1 и q 3 ). Оценка достоверности различий средних величин для выборок с нормальным распределением проведена с использованием критерия Стьюдента. При сравнении в двух независимых группах показателей, распределение которых не соответствовало закону нормальности, использовали критерий Манна-Уитни. Критический уровень значимости (p) при проверке статистических гипотез в данном исследовании принимали равным 0,05.
Результаты и обсуждение
Анализ полученных данных выявил более выраженную положительную динамику клинико-лабораторных данных у больных, получавших Цитофлавин, по сравнению с контрольной группой. Так, до начала лечения у пациентов обеих групп были выявлены признаки нарушения микроциркуляции субкомпенсированной формы (табл. 1). В динамике (на 10-е и 40-е сутки) лечения уровень базального напряжения кислорода в тканях стопы достоверно повысился у пациентов, получавших Цитофлавин, - 36,5±1,98 мм рт. ст. по сравнению с контрольной группой (27,4±1,18 мм рт. ст.), где он оставался на грани критической ишемии (p<0,05).
Это свидетельствует о выраженном положительном антигипоксическом эффекте Цитофлавина. Что касается уровня максимального напряжения кислорода, после пробы на реактивную гиперемию с опусканием конечности, то его возрастание было минимальным и достоверно не отличалось у больных обеих групп (p>0,05, P1>0,05, Р2>0,05, Р3>0,05). Это закономерно, поскольку антигипоксическое средство не может влиять на ригидность сосудистой стенки, а соответственно, и на максимальное напряжение кислорода в тканях. Таким образом, Цитофлавин улучшает оксигенацию тканей за счет нормализации базального напряжения кислорода.
Таблица 1. Динамика нарушения микроциркуляции в процессе лечения, M±σ

Примечание. Здесь и в табл. 2:
p - достоверность разницы показателей на 10-е, 40-е сутки лечения по сравнению с показателями до лечения;
р1 - достоверность разницы показателей на 40-е сутки лечения по сравнению с показателями на 10-е сутки;
р2 - достоверность разницы показателей на 10-е сутки лечения в основной группе больных по сравнению с контрольной;
р3- достоверность разницы показателей на 40-е сутки лечения в основной группе больных по сравнению с контрольной
Таблица 2. Динамика уровня ферментов антиоксидантной системы в процессе лечения, M±σ

В ряде исследований было подтверждено, что в основе антиоксидантного эффекта Цитофлавина лежит его способность к повышению уровня клеточных антиоксидантов за счет активного компонента - янтарной кислоты. Кроме того, препарат косвенно стимулирует синтез низкомолекулярных антиоксидантов (убихинон, α-токоферол) [6, 7].Изучение механизмов функционирования антиоксидантной системы (АОС) позволяет регулировать процессы ПОЛ и белков. Система антиоксидантов включает высокомолекулярные СОД, глутатионпероксидазу и каталазу, глутатионредуктазу и глутатионзависимую трансферазу и низкомолекулярные антиоксиданты (восстановленный глутатион, витамины Е, С, А и каротиноиды и др.). СОД является внутриклеточным ферментом, который участвует в реакциях дисмутации супероксидного анионрадикала. Каталаза катализирует расщепление пероксида водорода, который образуется в результате действия СОД и органических гидропероксидов липидов [7,12]. Анализ состояния АОС показал, что в динамике наблюдения (на 10-е и 40-е сутки) у пациентов основной группы по сравнению с контрольной были достоверно более высокие показатели каталазы и СОД (табл. 2).
Анализ сроков пребывания пациентов в стационаре выявил, что пациенты, получавшие Цитофлавин, находились на стационарном лечении в среднем 22±2 сут, в то время как больные контрольной группы достоверно больше - 32,7±5 сут (Р<0,05).
Таким образом, на основании полученных данных можно сделать вывод о том, что терапевтический эффект Цитофлавина проявляется в индуцирующем действии на активность ферментативного звена антиоксидантной защиты и блокировке образования свободных радикалов на мембранах клеток, что ведет к более быстрому разрешению клинического течения заболевания и, как следствие, уменьшает сроки лечения пациентов в стационаре.
Исходя из того, что использованная хирургическая тактика характеризовалась одномоментностью и радикальностью, следовательно, создавала предпосылки для снижения числа осложнений, были также проанализированы отдаленные результаты лечения. Выявлено, что в течение года повторные оперативные вмешательства вследствие прогрессирования гнойно- некротического процесса стопы были проведены у 9 (24,3 %) пациентов контрольной группы и только у 3 (7,9 %) - основной (p<0,05). Кроме того, в контрольной группе было проведено 10 реампутаций у 8 (21,6 %) пациентов (у 6 больных - по одной операции, у 2 - по две операции), в то время как в основной группе - 3 реампутации у 3 (7,9 %) пациентов (у каждого пациента - по одному оперативному вмешательству), p<0,05.
Выводы
Включение препарата «Цитофлавин» в схему лечения больных пожилого возраста с сахарным диабетом 2-го типа субкомпенсированной формы с синдромом диабетической стопы (смешанная форма) и медиакальцинозом артерий стопы и голени показало повышение эффективности терапии, которая проявлялась в улучшении оксигенации тканей за счет нормализации базального напряжения кислорода, восстановлении активности ферментов антиоксидантной системы и, как следствие, в достоверном уменьшении средних сроков стационарного лечения, в уменьшении числа повторных оперативных вмешательств и реампутаций в течение последующего года.
Что такое диабетическая стопа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Есипенко И. А., сосудистого хирурга со стажем в 37 лет.
Над статьей доктора Есипенко И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Диабетическая стопа (синдром диабетической стопы, СДС) — это тяжёлое осложнение сахарного диабета в виде инфекции, язв или разрушения глубоких тканей, которое возникает в связи с нарушением макроструктуры стопы и микроциркуляции крови, по причине разрушения нервных окончаний и нервных волокон. [10]
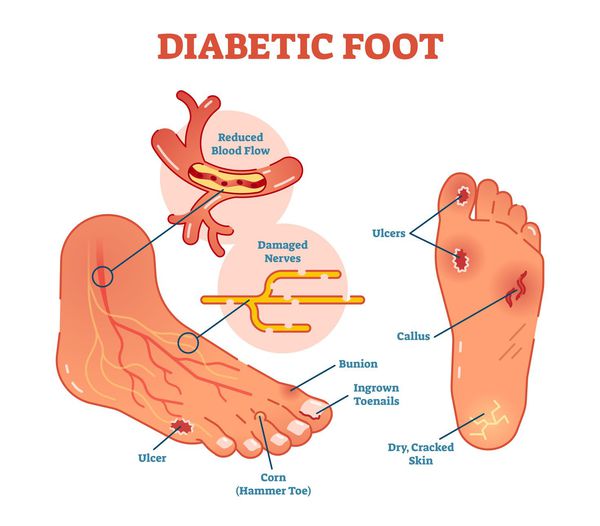
Главная причина ДС — это сахарный диабет (СД). И хотя синдром диабетической стопы не развивается с первого дня увеличения уровня глюкозы в крови более 7,0-8,0 ммоль/л, каждый пациент с диагнозом «сахарный диабет» должен помнить о таком грозном возможном осложнении.
Хронические раны на ногах у людей с сахарным диабетом встречаются в 4-15 % случаев. В некоторых случаях они становятся первым признаком развившегося диабета [10] .
Основные «пусковые механизмы» развития язв при СДС:
1. Ношение неудобной обуви. К изменению нагрузки на суставы стопы, сдавливанию или потёртости кожи, локальной микроишемии, инфильтрату, или некрозу могу привести любые дефекты обуви:
- несоответствующий размер обуви (меньше или больше, чем нужно);
- стоптанные и/или высокие каблуки;
- рубец на стельке;
- дефект подошвы;
- мокрая обувь;
- несоответствие обуви времени года.
2. Увеличенный вес тела. Учитывая площадь стоп, при увеличении веса тела (даже на 1 кг) увеличивается и нагрузка на каждый сустав стопы. Самая уязвимая область — подошвенная поверхность.
3. Разрастание эпидермиса (поверхности) кожи. Этот процесс происходит из-за нарушенных обменных процессов в коже на фоне СД (под утолщённым эпидермисом-"мозолью" в слоях кожи нарушается микроциркуляция, что приводит к микроишемии и некрозу).
4. Микротравмы:
- укусы животных;
- уколы шипами растений;
- порезы при педикюре и т. п.
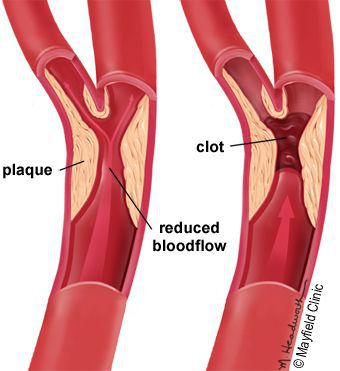
5. Стенозы (сужение) и окклюзии (закупорка) магистральных артерий. В результате отсутствия кровоснабжения в стопах и голенях к микроишемии присоединяется макроишемия и развитие гангрены конечности.
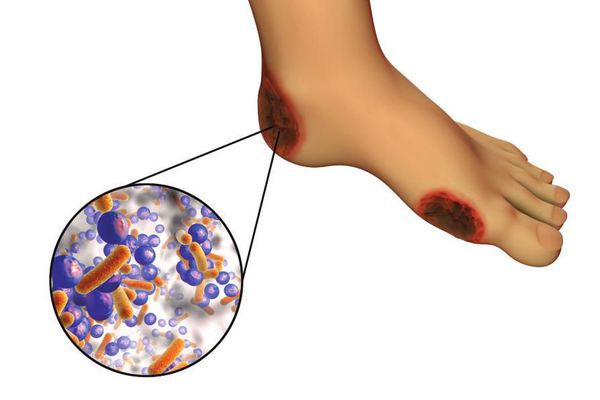
6. Условно патогенная или патогенная микрофлора. Активизация флоры (микробов и других микроорганизмов) на поверхности кожи в условиях СД приводит к воспалению кожного покрова, а в условия ишемии или микротравмы значительно ускоряется развитие гангрены.
Часто наблюдается сочетание нескольких причин возникновения язв при СДС.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы диабетической стопы
Отправной точкой развития СДС считается не дата установления диагноза «Сахарный диабет», а время, когда были выявлены первые симптомы СД (однократные подъёмы глюкозы крови, сухость во рту и другие).
Симптомы СДС:
- онемение, зябкость, жжение, отёки в стопах и другие неприятные ощущения;
- выпадение волос на на стопах и голенях, потливость стоп;
- изменение окраски кожи (гиперемия, гиперпигментация, цианоз);
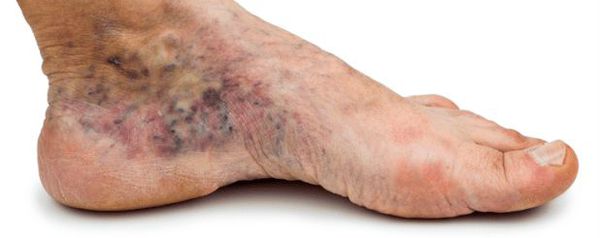
- утолщение, расслаивание, изменение формы и цвета ногтевых пластинок;
- кровоизлияния под ногтевой пластинкой в виде «синяков» под ногтями;
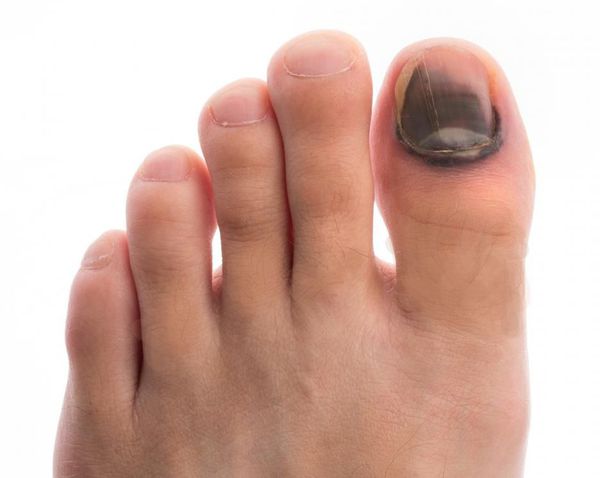
- деформация стоп;
- снижение чувствительности стоп — вибрационного, температурного, болевого и тактильного восприятия;
- боль в области стопы и язвы, возникающая как в покое или ночью, так и при ходьбе на определённые расстояния;
- истончение кожи, шелушение;
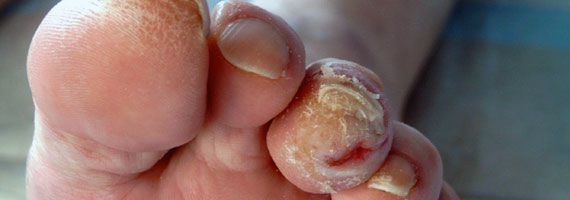
- понижение или увеличение температуры стоп и голеней;
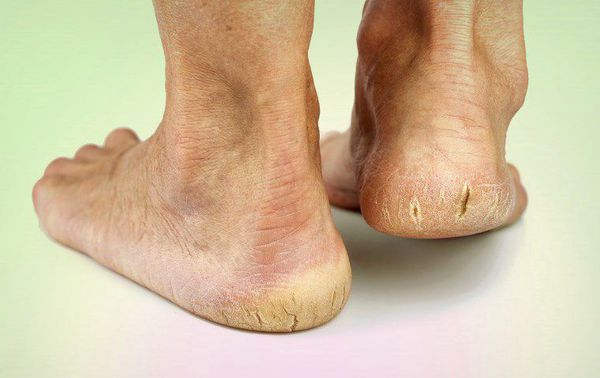
- длительная эпителизация (заживление) микротравм — до двух месяцев, при этом остаются коричневые рубцы;
- трофические язвы, длительно не заживающие на стопах.
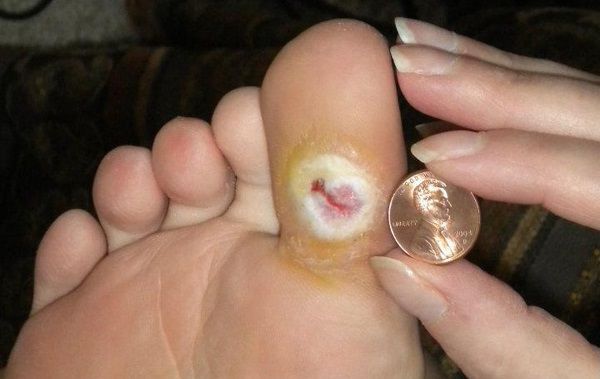
Чаще всего трофическим изменениям подвержены дистальные отделы конечности: пальцы и подошвенная поверхность стопы в проекции головок плюсневых костей. Зона образования трофической язвы зависит от причины её возникновения.
Патогенез диабетической стопы
Механизм развития СДС представляет собой следующую последовательность нарушений:
- Снижается выработка гормона инсулина.
- Увеличивается уровеь глюкозы в крови — развивается гипергликемия.
- Блокируется кровоток в мелких сосудах, через сосудистую стенку перестаёт поступать кислород и другие микроэлементы.
- Разрушаются нервные волокна и рецепторы.
- Наступает микро- и макроишемия тканей стопы.
- Образуются трофические язвы.
Таким образом, при СДС происходит повреждение всех тканей ноги.
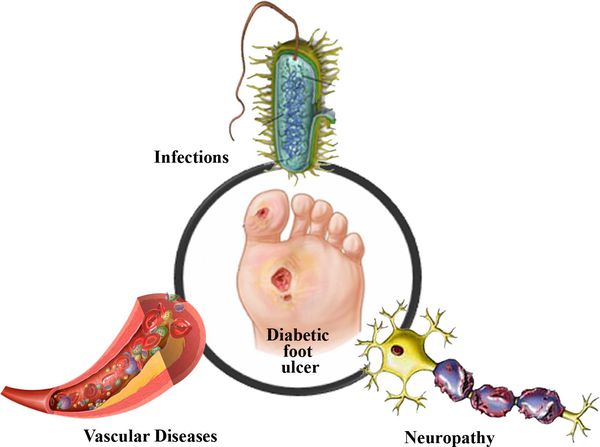
В результате дефицита инсулина в организме диабетика количество глюкозы в крови увеличивается. Это в свою очередь негативно сказывается на состоянии как мелких, так и крупных сосудов:
- на стенках сосудов скапливаются иммунологические вещества;
- мембраны становятся отёчными;
- просвет сосудов сужается.
В результате этих изменений кровообращение нарушается и образуются небольшие тромбы. Эти изменения в организме препятствуют поступлению достаточного количества микроэлементов и кислорода в клетки и тем самым приводят к нарушениям обменного процесса. Кислородное голодание тканей замедляет процесс деления клеток и провоцирует их распад.
Увеличение уровня глюкозы в крови также становятся причиной поражения нервных волокон — снижается чувствительность.
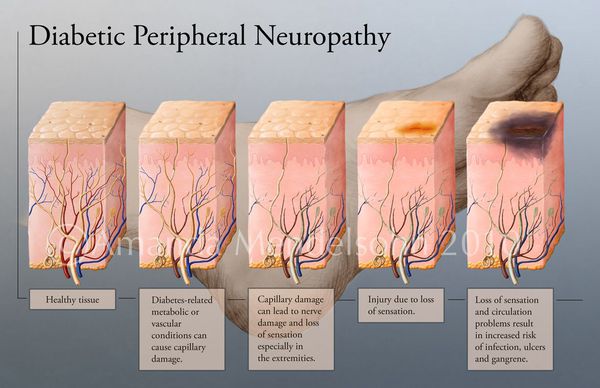
Все деструктивные процессы, происходящие в тканях стопы приводят к тому, что любое повреждение кожи становится лёгким процессом, а заживление — длительным. Усугубить состояние стопы могут присоединившиеся инфекции, которые способны привести к образованию гангрены — некрозу тканей. [9]
Классификация и стадии развития диабетической стопы
Классификация I Международного симпозиума по диабетической стопе
В 1991 году в Нидерландах на I Международном симпозиуме была принята классификация СДС, которая является наиболее распространённой. [1] Она предполагает разделение заболевания на три типа в зависимости от преобладающего патологического процесса:
- нейропатическая инфицированная стопа:
- длительное течение сахарного диабета;
- позднее возникновение осложнений;
- отсутствие болевого синдрома;
- цвет и температура кожи не изменены;
- уменьшение всех видов периферической чувствительности;
- наличие периферического пульса.
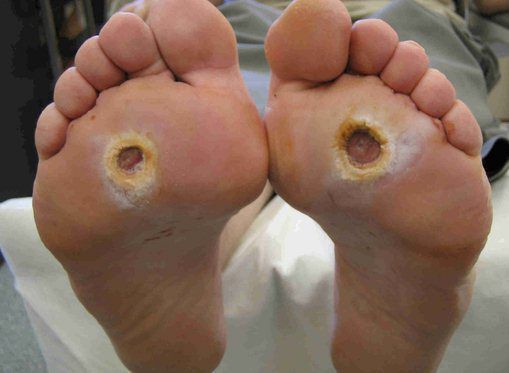
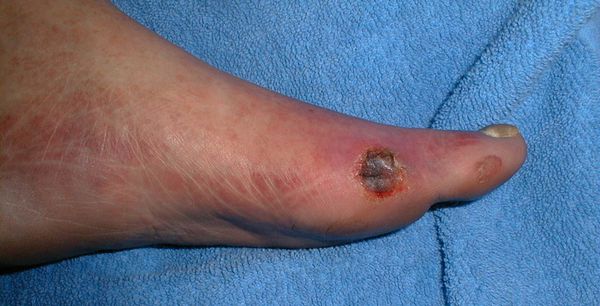
Классификация Вагнера
По степени выраженности поражений тканей стопы выделяют следующие стадии СДС: [6] [7]
- Стадия 0 — изменение костной структуры стопы — артропатия;
- Стадия 1 — изъязвление (язвы) кожи;
- Стадия 2 — изъязвление всех мягких тканей, дном язвы являются кости и сухожилия;
- Стадия 3 — абсцедирование и остеомиелит (воспаление костной ткани);
- Стадия 4 — образование гангрены дистальных отделов стопы (пальцев);
- Стадия 5 — образование гангрены стопы и отделов голени.
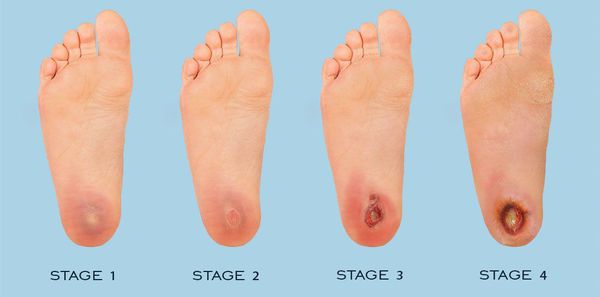
Классификация Техасского университета
Данная классификация была разработана в 1996-1998 годах. [8] В её основе лежит оценка язвы по глубине, наличию инфицирования и ишемии — риска ампутации конечности.
Что такое сухая гангрена? Причины возникновения, диагностику и методы лечения разберем в статье доктора Манасяна К.В., сосудистого хирурга со стажем в 10 лет.
Над статьей доктора Манасяна К.В. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Гангрена — это некроз (омертвление) тканей живого организма, связанных с внешней средой, например, кожи, лёгких, кишечника и других. С древнегреческого данный термин переводится как "разъедающая язва".
Сухая гангрена — это опасное заболевание, требующее незамедлительного лечения. При этой патологии отмирание ткани происходит без выраженного инфекционного и воспалительного процесса. Иначе такой характер течения заболевания называют мумификацией, т. е. отсыханием органа.
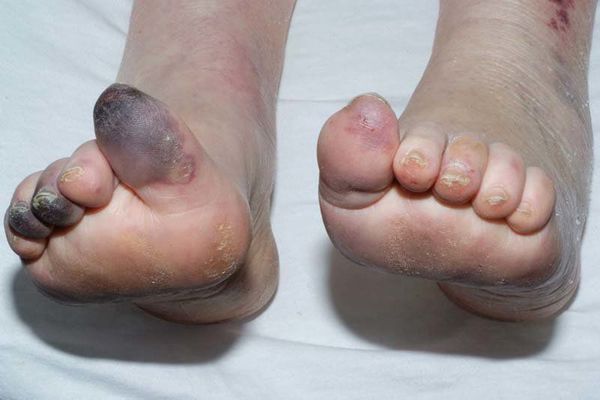
Механизмы возникновения гангрены бывают двух типов:
- прямыми (травматическими и токсическими) — появляются по причине непосредственного повреждения, иногда даже незначительного;
- непрямыми (ишемическими, аллергическими, трофоневрологическими) — происходит опосредованное отмирание тканей через анатомические каналы, в частности, при поражении сосудистой системы.
Исходя из этого факторы риска развития сухой гангрены можно также разделить на две группы:
- Внешние (экзогенные):
- переохлаждение (обмоорожение);
- химический ожог;
- удар током высокого напряжения.
- Внутренние (эндогенные): артерий нижних конечностей; ;
- курение;
- воспалительные заболевания артерий (васкулиты, в частности тромбангиит). [4][5][6]
Зачастую гангрена возникает при совокупности факторов, например, в результате механического повреждения кожи пациента с сахарным диабетом. По статистике, доля людей с мумификацией, развившейся на фоне подобных факторов и приведшей к ампутации конечности, составляет 4,2-6,4 на одну тысячу человек в год. В связи с этим люди с диабетической стопой относятся к группе риска развития гангрены. [10]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сухой гангрены
К симптомам сухой гангрены относятся:
- потемнение кожного покрова (вначале кожа бледнеет, приобретает синюшный оттенок, затем постепенно становится чёрной);
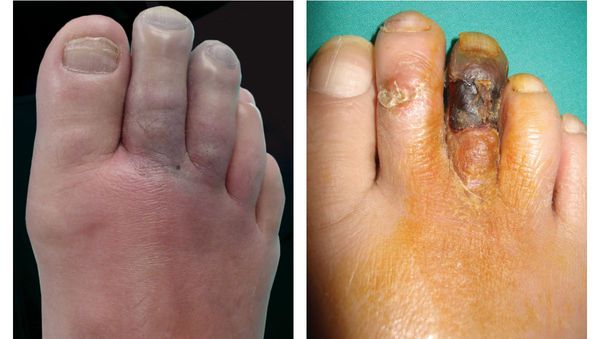
- уменьшение кожи в объёме, её высыхание, сморщивание и уплотнение;
- отслаивание эпидермального слоя кожи;
- снижение температуры конечности (зависимость от температуры окружающей среды);
- снижение чувствительности поражённых тканей (онемение);
- наличие специфического запаха отмирающего участка (хоть и не столь сильного);
- ощущение боли (простреливающие, жгучие и ноющие болевые ощущения, которые могут носить постоянный характер, а также усиливаться при минимальной нагрузке);
- покалывание, жжение или зуд в области поражения;
- нарушение функционирования конечности.
Болевой синдром отражает то, насколько сильно страдают окружающие ткани: чем сильнее боль в зоне некроза, тем больше в этой области живых клеток. Ослабление болезненных ощущений или их исчезновение указывает на прогрессирование заболевания, так как чувствительность отмирающей ткани пропадает в результате гибели нервных окончаний. В это время анатомические области, граничащие с сухой гангреной, остро нуждаются в артериальном кровотоке, которого им не хватает. В итоге в этих тканях вырабатываются продукты метаболизма и болевые импульсы.
Сухая гангрена начинается с появления небольшого очага на конечности (как правило, расположенного на пальце). Далее она распространяется на прилегающие пальцы, подошвенную и тыльную поверхность стопы, захватывая всё больше тканей конечности.
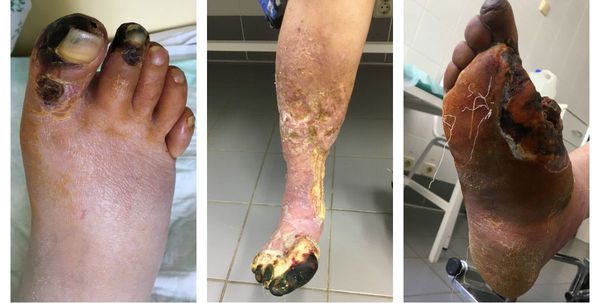
Изменения цвета отмирающих участков кожи связано с накоплением в них гемоглобина и выделением эритроцитарного железа, которое в результате соединения с сероводородом воздуха превращается в сульфид железа.
Зона, которая находится на границе гангрены и здоровой ткани называется демаркацией. Обычно она не оформлена. В исключительно редких случаях при естественном течении болезни она может самостоятельно ограничиться, что приведёт к самоампутации отмирающей конечности. [3] [5] [6]
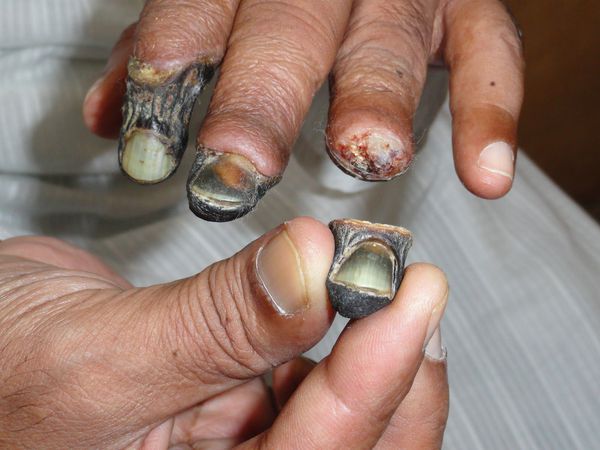
К первым признакам сухой гангрены относятся следующие состояния:
- замерзание конечности даже в тепле;
- боль в ногах и утомляемость после длительной ходьбы;
- наличие долго не заживающих ран и язв на коже конечности.
ВАЖНО: Возникновение одного из этих проявлений при наличии таких предрасполагающих факторов, как сахарный диабет или атеросклероз, — веский повод для скорейшего обращения к врачу-флебологу или хирургу. Промедление как минимум может обернуться для пациента утратой конечности.
Патогенез сухой гангрены
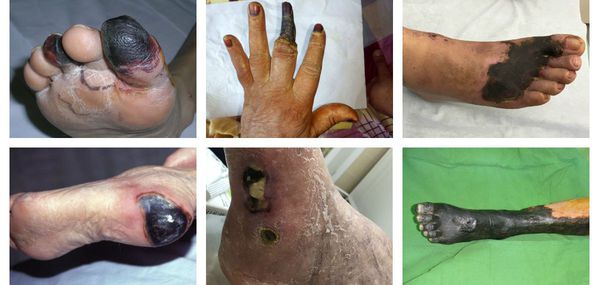
Процесс возникновения и развития сухой гангрены конечностей можно условно разделить на семь этапов:
При естественном течении сухой гангрены признаков инфекции не наблюдается (в отличие от влажной гангрены), однако в омертвевших тканях не исключено наличие возбудителей условно-патогенной инфекции. При этом в зонах некроза не происходит бурного развития инфекции.
Процесс развития сухой гангрены ног и рук может длится от нескольких дней до нескольких месяцев в зависимости от уровня поражения артерий и компенсаторных механизмов саморегуляции. [3] [4] [5] [6] Если некроз уже развился, то заживление без удаления некоторой части конечности невозможно.
Классификация и стадии развития сухой гангрены
В зависимости от распространения некроза на конечности можно выделить следующие виды заболевания:
- гангрена пальцев;
- гангрена дистального сегмента стопы (кисти);
- гангрена пяточной области;
- тотальная гангрена стопы (кисти) или голени (предплечья);
- гангрена бедра (встречается крайне редко, так как пациенты просто не доживают до столь массивного гангренозного поражения). [3][5][6]
По механизму развития различают два вида гангрены:
- Первичная гангрена — это некроз, развившийся в результате ишемии тканей. Иначе говоря, она связана с нарушением проходимости артериального сосуда, кровоснабжающего определённый участок организма.
- Вторичная гангрена — это некроз тканей, возникающий в результате острого гнойного воспаления клетчаточных пространств и фасциальных футляров. Чаще всего развивается при флегмоне стопы, затрагивая пальцы, а также при или глубоком абсцессе на фоне нейроптической формы синдрома сахарного диабета.
По распространённости выделяют три степени гангрены:
- поверхностную — поражается лишь дерма;
- глубокую — проникает в сухожилия, полости суставов, фасции и кости;
- тотальную — затрагивает все отделы органа или конечности.
Помимо сухой гангрены существует ещё влажная и газовая.
Влажная гангрена протекает с преобладанием инфекционного компонента, т. е. гнилостного расплавления. В процесс вовлекаются все без исключения ткани — кожа, подкожно-жировая клетчатка, фасции, связки, мышцы, сухожилия и кости. Кожные покровы местами приобретают багрово-синюшный, чёрный или серо-зелёный цвет. Характерно появление эпидермальный пузырей, наполненных вначале бурым, а затем зеленоватым содержимым с выраженным неприятным гнилостным запахом.
В отличие от сухой гангрены при влажной ткани не уплотняются, а распадаются, становятся рыхлыми и разжижаются. Отёк и гиперемия кожи быстро распространяются. Кожа голени может быть напряжена, лосниться. Без активного лечения демаркационная линия не появляется, так как процесс стремится к генерализации.
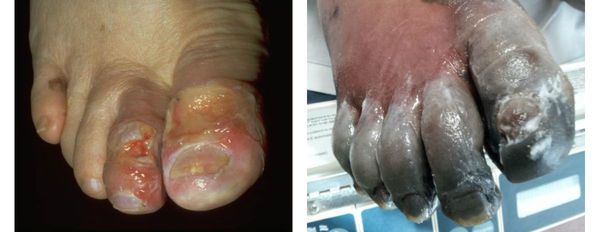
Газовая гангрена отличается возникновением вокруг очага некроза лёгкой крепитации газа под кожей, т. е. ощущением хруста, которое появляется из-за лопающихся пузырьков газа в тканях. Крепитация не слышна, но осязается пальцами как "скрип" крахмала или снега под ногами. Объективно газ в мягких тканях может быть обнаружен при рентгенографии конечности на достаточно "мягких" снимках. [11]
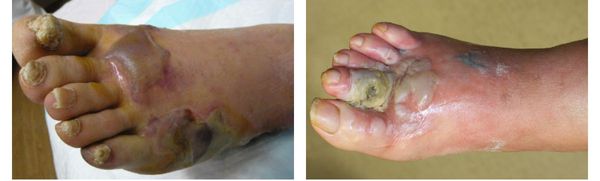
Осложнения сухой гангрены
Само по себе наличие гангрены указывает на полную нежизнеспособность и омертвление тканей, предполагая крайнюю степень патологического процесса. Поэтому отсутствие своевременного лечения может привести к потере поражённой конечности.
Сухая гангрена не может перерасти во влажную или газовую гангрену, как ошибочно утверждают многие источники, потому что изначально при возникновении некроза становится очевиден механизм развития гангрены. [1] [2] [3] [4] [7]
Редкими осложнениями сухой гангрены являются сепсис и септический шок. Они возникают в связи с токсическим действием продуктов распада при проникновении их в системный кровоток. Данные осложнения способны привести к полиорганной недостаточности и, как следствие, летальному исходу.
К проявлениям сепсиса относятся:
- ознобы;
- высокая или очень низкая температура тела (больше 38°C или меньше 36°C);
- одышка (частота дыхания более 20 в минуту);
- артериальная гипотензия (пульс более 90 ударов в минуту);
- аритмия;
- олигурия (объём мочи менее 0,5 мл/кг/ч);
- вялость, заторможенность;
- наличие различных лабораторные показания, не поддающаяся коррекции — низкий уровень белка, тромбоцитов и красных кровяных телец, а также высокий уровень билирубина, остаточного азота, мочевины, сахара в крови и ацетона в моче.
В случае септического шока давление становится крайне низким, даже на фоне интенсивного вливания внутривенных растворов. В связи с этим около 30-40 % пациентов умирает несмотря на оказываемое лечение. [12]
Диагностика сухой гангрены
Диагностика сухой гангрены достаточно проста, так как на некроз указывает внешний вид поражённого органа:
- его сухость;
- уменьшение участка кожи в объёме;
- тёмный, вплоть до чёрного, цвет кожи;
- наличие слабого неприятного запаха и болей непосредственно в мёртвом участке;
- наличие прохладных на ощупь окружающих тканей с выраженным болевым синдромом в них. [1][2][3][4][7]
При осмотре необходимо диагностировать причину сухой гангрены (например, атеросклероз артерий и тромбангиит). Для этого нужно проверить пульсацию артерий как поражённой, так и здоровой ноги на уровне паховых и подколенных областей, позади медиальной лодыжки и на тыле стопы. В дальнейшем необходимо подтвердить причинный диагноз с помощью ультразвукового исследования.
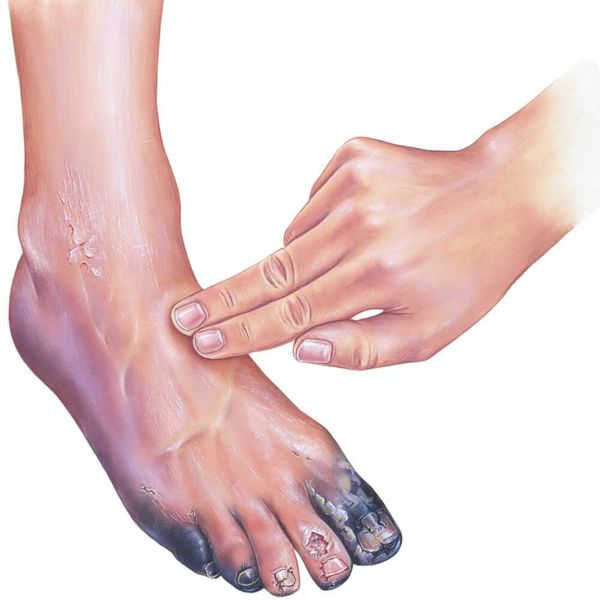
В качестве предоперационной подготовки для определения вида оперативного лечения выполняется ангиография нижних конечностей:
- при протяжённых поражениях артерий выполняется хирургическая операция — аутовенозное шунтирование;
- при коротких поражениях более предпочтительно выполнить эндоваскулярную операцию (наименее травматичное лечение). [1][2]
Для предоперационной подготовки нужно сдавать общий и биохимический анализ крови, а также бактериальный посев. Эти лабораторные исследования помогут выяснить, не является ли причиной сухой гангрены сахарный диабет.
Лечение сухой гангрены
С целью предотвращения гангрены и максимально возможного сохранения конечности требуется восстановить кровоток в тканях, окружающих гангренозный участок.
Нормализовать кровообращение в органе можно при помощи оперативного вмешательства:
- Реконструктивные операции на артериях конечности (как правило, руки):
- аутовенозное шунтирование;
- эндартерэктомия (удаление закупорки артерии) с аутовенозной пластикой;
- шунтирование артерий аорто-подвздошно-бедренного сегмента синтетичсекими протезами.
- Рентгенэндоваскулярные операции (не показаны пациентам с тромбангиитом):
- стентирование;
- баллонная ангиопластика артерий.
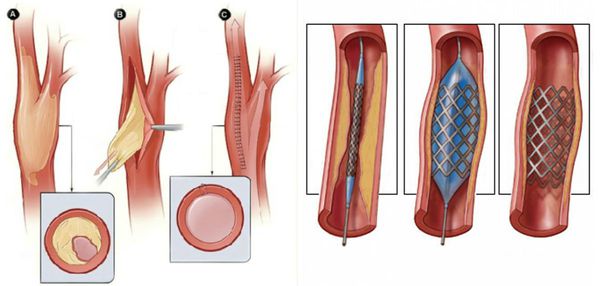
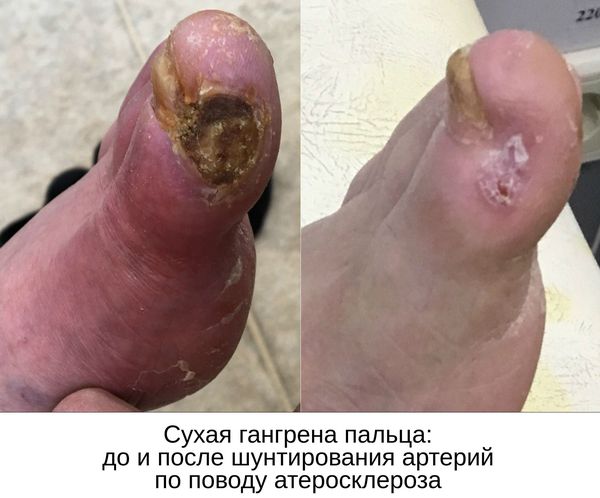
Паллиативные операции (поясничная симпатэктомия и остеотрепанация), проводящиеся для улучшения качества жизни, и другие нехирургические методы лечения (генная и физиотерапия) не способны предотвратить прогрессирование сухой гангрены.
Саму гангренозную ткань необходимо убрать. Для этого проводят:
- малые ампутации — удаление пальцев или части стопы с некрозом;
- некрэктомию — поверхностное удаление некротического струпа до пределов тканей с удовлетворительным кровотоком.
В случаях обширного гангренозного поражения с потерей опороспособной стопы прибегают к ампутации голени либо бедра. Чтобы избежать подобного печального исхода, важно при первых же признаках гангрены без промедления обратиться к врачу: потерять конечность куда страшнее, чем её лечить. Особенно это относится к людям с сахарным диабетом и атеросклерозом: нельзя ждать, когда гангрена начнёт прогрессировать, иначе удаление поражённой конечности будет неизбежным.
Если всё же обширная гангрена стопы привела к потере её опороспособности, то в таких случаях целесообразно выполнение ампутации голени на уровне границы средней и верхней трети. В дальнейшем это позволит подобрать и использовать удобный протез.
Даже после ампутации гангрены, возникшей из-за закупорки артерий ноги, необходимо выполнить реконструктивную (шунтирующую) или рентгенэндоваскулярную операцию на артериях нижней конечности. Делается это с целью обеспечения кровотока для успешного заживления постампутационной культи голени.
При физических причинах гангрены (отморожение) или химических (внутриартериальное введение синтетичсеких наркотиков) лечение заключается в нормализации вязкости крови. Для этого проводится:
- антикоагулянтная и инфузионная терапия;
- профилактика синдрома полиорганной недостаточности;
- хирургическое удаление участка, поражённого сухой гангреной. [1][2][3]
Прогноз. Профилактика
Прогноз зависит от степени гангренозного поражения:
- при гангрене пальцев или небольших участков стопы конечность можно восстановить при реставрации кровотока, удалении омертвевших тканей и создании благоприятных условий для заживления;
- при тотальной сухой гангрене стопы показана ампутация на уровне голени, но с условием, что кровоток в голени достаточен для заживления постампутационной культи;
- при обширной гангрене голени пациенту показана ампутация ноги на уровне бедра.
Пятилетняя выживаемость при сухой гангрене сравнима с выживаемостью при злокачественных новообразованиях (например, раковой опухолью кишечника): к концу первого года после подтверждения диагноза "Критическая ишемия" (критическое снижение кровоснабжения) лишь 45 % пациентов имеют шанс сохранения конечности, а около 30 % продолжают жить после ампутации бедра или голени, а 25 % — умирают.
Тем не менее число больших ампутаций остаётся высоким, а их исходы — крайне тяжёлыми. Риск смертности в течение 30 дней после таких ампутаций составляет 4-30 %, а риск развития осложнений, таких как инфаркт миокарда, инсульт, инфекция, — 20-37 %. [1] [7] [10]
Реабилитация и протезирование
Трудности в реабилитации пациентов после ампутаций и протезирования у многих пожилых пациентов отрицательно влияют на отдалённые результаты и качество их жизни.
Период реабилитации зависит от объёма гангренозного поражения, качества заживления дефекта, сопутствующих соматических заболеваний, возраста пациента и его желания вернуться к полноценной жизни. Как правило, при успешном лечении и соблюдении всех рекомендаций врача длительность реабилитации составляет 3-6 месяцев.
На качество реабилитации также влияет питание. Поэтому в период восстановления рацион должен состоять из белковой и калорийной (но не жирной) пищи: из мяса индейки, рыбы, фасоли, творога и яиц. От жирной пищи во время реабилитации лучше отказаться.
Первичный протез подбирается после заживления раны культи. Затем, когда сформирована мышца культи, пациенту подбирают вторичный протез. Этим занимается врач-реабилитолог совместно с протезистом. [7] [8] [9]
Профилактика
Для предупреждения развития гангрены у предрасположенных к этому людей (например, лиц с сахарным диабетом, атеросклерозом), важно соблюдать меры профилактики:
- отказ от курения — эта пагубная привычка может привести к ухудшению кровообращения и закупорке сосудов;
- контроль уровня сахара в крови;
- проверка тела на наличие повреждений, их лечение и ежедневное наблюдение за их заживлением;
- незлоупотребление алкоголем.
Также для профилактики гангрены нужно избегать обморожений и иных внешних причин образования некроза.
Что такое гангрена влажная? Причины возникновения, диагностику и методы лечения разберем в статье доктора Азатяна Кярама Арутюновича, сосудистого хирурга со стажем в 7 лет.
Над статьей доктора Азатяна Кярама Арутюновича работали литературный редактор Маргарита Тихонова , научный редактор Вячеслав Подольский и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Влажная гангрена — это процесс омертвения ткани, органа или части тела, вызванный нарушением кровообращения из-за травм или патологий сосудов. Выражается в побледнении кожи, появлении длительно заживающих язв и др. Отличается обильным отделяемым из раны и отёком органа или конечности.
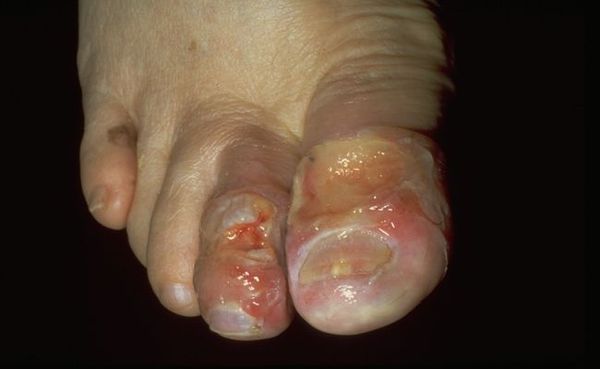
По причине возникновения патологию разделяют на две группы:
- возникшую от внутренних причин (заболеваний сосудов);
- возникшую в результате внешнего воздействия (травмы, ранения, инфекции, ожогов или обморожения).
Механизм развития гангрены связан с острой ишемией — нарушением оттока крови и/или лимфы. Это может произойти при механическом сдавлении сосудов и воспалении мягких тканей, лёгких, кишечника, кожи, матки или молочной железы. Однако основной причиной влажной гангрены является флеботромбоз — закупорка венозной системы.
Тромбоз возникает при застое крови, повреждении внутреннего слоя сосуда, тромбофилии (повышенной свёртываемости крови), сепсисе или при сочетании этих причин.
Ключевую роль в формировании тромба играет активное свёртывание крови. В ходе этого процесса образуется белок фибрин, который становится "каркасом" для строительства тромба [3] .
Развитию влажной гангрены способствуют гнилостные микроорганизмы, разлагающие и разжижающие мёртвую ткань. К таким бактериям относят анаэробы, бактероиды, дизентерийную амёбу, фузиформные бактерии, палочку путрификус, палочку спорогенес и др. Такая гангрена встречается в тканях и органах с большим содержанием крови, лимфы и тканевой жидкости [11] .
К другим факторам риска, способствующим образованию влажной гангрены, относят:
-
; ;
- декомпенсацию сахарного диабета (повышение уровня глюкозы в крови, не поддающееся коррекции);
- эндокринные и онкозаболевания; ;
- хронические заболевания вен (например, варикоз, сосудистые звёздочки, венозная мальформация);
- снижение иммунитета [11][13] .
Ежегодно острая ишемия нижних конечностей, как основная причина гангрены, развивается у 140 млн человек в мире [17] . Среди женщин такой диагноз встречается в 2 раза реже, чем среди мужчин. Причём чаще этот диагноз устанавливают мужчинам 60-64 лет и женщинам 80-84 лет. 25 % таких пациентов проводится ампутация ноги, 25 % умирают, а у оставшихся 50 % в процесс вовлекается вторая нога [12] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы влажной гангрены
Симптомы причинной болезни всегда предшествуют признакам гангрены.
Проявления тромбоза, как основной причины влажной гангрены, зависят от места расположения тромба, длительности болезни, характера и распространённости поражения венозного русла. Чаще тромб образуется в глубоких венах конечностей.
На начальных этапах тромбоза нижних конечностей симптоматика бывает стёртой или вообще не проявляется. К явным признакам болезни относят:
- отёк конечности или её части;
- синюшность кожи и выраженность подкожных вен;
- распирающую боль в ноге;
- боль по ходу магистральных сосудов [3] .
Отличительные признаки тромбоза глубоких вен верхних конечностей включают отёк руки, лица и шеи.
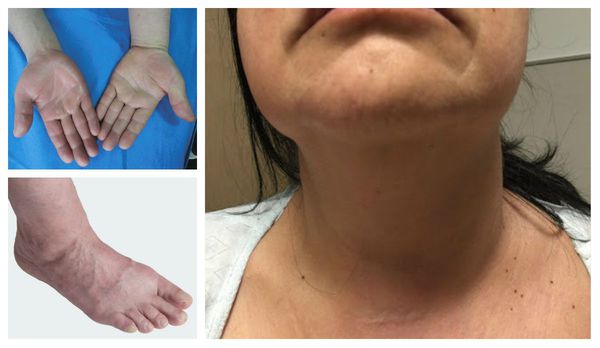
Характерные симптомы влажной гангрены:
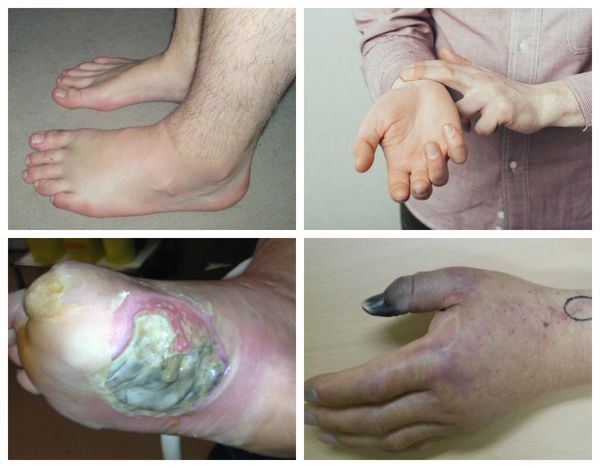
Патогенез влажной гангрены
Жизнеспособность органа и ткани зависит от работы сердечно-сосудистой системы: её основной, транспортной функции [5] .
Сердце и кровеносные сосуды снабжают организм кровью. С её притоком к органам и тканям поступает кислород и питательные вещества, а при оттоке кровь переносит углекислый газ и продукты метаболизма в лёгкие, почки, печень и другие органы-фильтры.
Нарушение транспортной функции ведёт к нарушениям микроциркуляции. Это происходит под воздействием одного или нескольких факторов. Среди них большое значение имеют:
- коллапс — внезапная сердечно-сосудистая недостаточность из-за отёка (избыточного накопления межтканевой жидкости и набухания эндотелия), повышенного слипания эритроцитов и тромбоцитов;
- образование лейкоцитарных пробок;
- повышение вязкости крови;
- формирование тромбов (сгустков крови) и эмболов (фрагментов тканей, бактерий и продуктов их жизнедеятельности);
- различные внешние факторы, например бактериальные токсины при инфицировании трофических язв.
Все эти изменения нарушают обмен веществ в органе или части тела, что ведёт к гибели клеток, некрозу (омертвению ткани) и гангрене [9] .
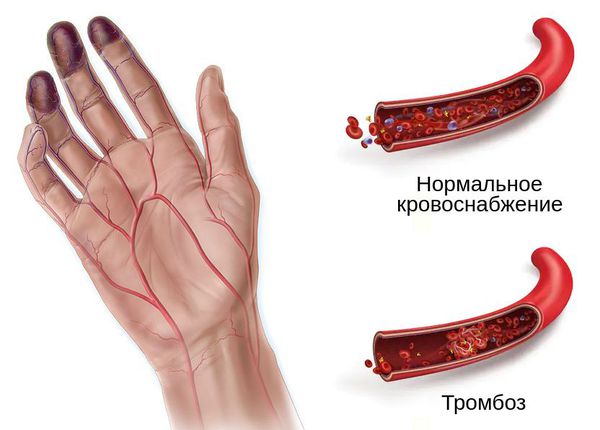
При влажной гангрене в основном нарушается механизм оттока, поэтому наблюдается отёк конечности или органа и обильные выделения из ран.
Механизм развития влажной гангрены примерно такой:
- после травмы ноги (или другого фактора) возникает тромбоз и закупорка глубоких вен, по которым кровь должна отводиться из конечности;
- возникает застой крови в ноге, отёк конечности, боль, цвет кожи или органа сначала становится бледным, потом тёмно-синим, появляются дефекты, из которых сочится жидкость, иногда присоединяется инфекция;
- отёк тканей сжимает и сдавливает артерии, нарушая приток крови и питательных компонентов;
- развивается некроз клеток, тканей и органов [6] .
Классификация и стадии развития влажной гангрены
Выделяют три типа гангрены:
-
— некроз ткани без выраженной инфекции и воспаления;
- влажная (гнилостная) — некроз с гнилостным распадом тканей;
- газовая — серьёзное осложнение, вызванное анаэробными микробами, с признаками сепсиса и интоксикации (высокой температурой и артериальным давлением, одышкой, слабостью, спутанностью сознания и др.) [2] .
Согласно классификации российского хирурга А. В. Покровского, влажная гангрена является последней стадией нарушения кровообращения конечности или органа [1] .
Фактически речь идёт о декомпенсации кровообращения, поскольку на IV стадии в поражённые ткани поступает мало кислорода, который может обеспечить нормальное потребление питательных веществ.
Классификация WIfI (Wound — язва, Ischemia — ишемия, foot Infection — инфицирование стопы) позволяет соотнести степень трофических нарушений и гангрены с ориентировочным объёмом лечения [7] .
Осложнения влажной гангрены
Влажная гангрена — опасное состояние, угрожающее жизни пациента. Промедление лечения чревато серьёзными осложнениями: увеличением раны, распространением инфекции, бактериальным эндокардитом, лёгочной недостаточностью и сепсисом.
Распространение гангрены сопровождается разрушением глубжележащих тканей. Токсины и вредные вещества, которые высвобождаются при распаде и некрозе, отравляют организм. Если процесс не остановить, пациент может лишиться конечности или органа, став инвалидом, или вовсе умереть [9] .
Тромбоз вен, как причина нарушения оттока крови, может стать причиной другого серьёзного осложнения — тромбоэмболии лёгочной артерии (ТЭЛА). Такое нарушение связано с миграцией тромба в систему лёгочных артерий. Из-за периодического изменения венозного оттока во время ходьбы, кашля или акта дефекации тромб может оторваться и закрыть просвет важных сосудов полностью или частично.
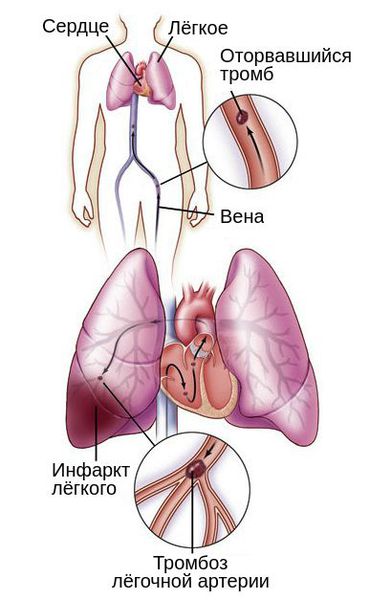
В зависимости от размера тромба закупориваются артерии различного диаметра: от сегментарных ветвей до лёгочного ствола. Тромбоз мелких веток обычно не приводит к расстройству кровообращения и дыхания, но может вызвать инфаркт участка лёгкого и пневмонию. Тромбоз лёгочного ствола заканчивается внезапной смертью.
Лёгочный инфаркт, который вызывает боль в груди, кашель, кровохарканье и образование жидкости в грудной клетке, развивается не всегда. Это осложнение относится к поздним проявлениям ТЭЛА и проявляется через несколько дней после дебюта болезни [3] .
Диагностика влажной гангрены
Диагноз влажной гангрены основывается на данных опроса, объективного осмотра, оценки распространённости процесса, состояния периферического кровотока и нервной передачи.
При опросе пациенты жалуются на длительно незаживающие раны стопы или голени с обильным выделением жидкости, образование волдырей с бурым или светлым содержимым и иногда неприятным запахом.
Важно уточнить, как давно возникли раны: они могут не заживать от нескольких недель до 2-6 лет. На скорость заживления влияют сопутствующие болезни: сердечная и дыхательная недостаточность, сахарный диабет, онкозаболевания и др. [10]
При осмотре врач обращает внимание на:
- состояние и цвет кожи (сухая или влажная, бледная, розовая или синюшная);
- объём конечностей (есть ли отёк);
- их температуру (холодные, тёплые или горячие);
- состояние ногтей — онихомикоз может являться дополнительным источником инфекции.
Периферическое кровоснабжение первично оценивается по пульсу: чем слабее удары, тем хуже состояние поражённой области.
Периферическая иннервация оценивается путём определения тактильной, вибрационной чувствительности и/или сухожильных рефлексов: чем слабее реакция пациента на раздражители, тем хуже прогноз для сохранения органа или конечности [10] .
О состоянии костных структур сложно судить без дополнительных методов исследования. Изначально можно определить только форму суставов, деформацию конечностей, объём движений и боль, возникающую в суставе.
Дополнительные методы исследования расположены в порядке значимости:
- УЗГД — ультразвуковое дуплексное сканирование артерий и вен. Безвредный метод диагностики. Позволяет выяснить, нарушено ли кровообращение в конечности или органе. Проводится в кабинете ультразвуковой диагностики. Во время процедуры пациент лежит на спине или стоит.
- Лабораторное обследование. С его помощью можно выявить системные заболевания, оценить общую тяжесть состояния и предполагаемый объём лечения. Для диагностики необходим клинический анализ крови, определение скорости оседания эритроцитов (СОЭ), развёрнутая коагулограмма (состояние свёртывающей системы крови), общий (клинический) анализ мочи и развёрнутый биохимический анализ крови. Для влажной гангрены характерны системные изменения: повышение СОЭ, лейкоцитов, D-димера и фибриногена, снижение АЧТВ, МНО, общего белка и т. д.
- Электрокардиограмма. Позволяет оценить состояние сердца. Проводится лёжа. На грудную клетку пациента накладываются специальные электроды, которые регистрируют электрическую активность сердечной мышцы — миокарда. Эта информация распечатывается на бумажной ленте в виде кардиограммы, отражающей работу сердца.
По данным этих исследований врач принимает решение о тактике лечения, его объёмах и необходимости других дополнительных методов исследования:
- МСКТ — мультиспиральная компьютерная томография. Может потребоваться для уточнения уровня и степени поражения сосудов при выявлении проблемы на УЗИ.
- Ангиография — определяет проводимость сосудов.
- Бактериологическое исследование раневой инфекции. Позволяет установить тип бактерий и их чувствительность к антибиотикам [10] .
- Рентгенография — оптимальный метод оценки состояния костей и суставов. С его помощью выявляются очаги разрушения [10] .
Дифференциальную диагностику влажной гангрены нужно проводить с другими состояниями:
- лимфатическим отёком и лимфедемой (слоновостью);
- хронической сердечной и почечной недостаточностью в стадии декомпенсации;
- острой печёночной недостаточностью и циррозом печени;
- липедемой ("жировым отёком").
Лечение влажной гангрены
Лечение влажной гангрены всегда комплексное. Оно состоит из ряда важнейших задач, которые формируются на этапах диагностики. По показаниям может потребоваться реваскуляризация — восстановление притока и оттока крови по артериям и венам. Выбор метода реваскуляризации зависит от типа сосудистой недостаточности — артериальной и/или венозной.
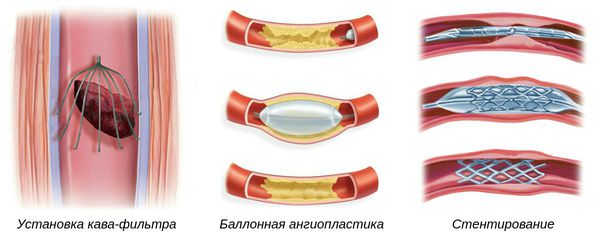
Одной из причин влажной гангрены является нарушение венозного оттока, а именно тромбоз глубоких вен конечности. Такая проблема чаще требует консервативной антикоагулянтной терапии — приёма таблеток, которые рассасывают тромб. Если причина в эмболизации артерий, восстановить кровоток позволяют реконструктивные операции:
- Установка кава-фильтра — специальной системы, которая препятствует миграции тромбов из нижних конечностей к лёгким. Устанавливается в нижнюю полую вену.
- Баллонная ангиопластика — способ ликвидации суженных участков артерий, препятствующих нормальному току крови. Выполняется при помощи специальных систем.
- Стентирование — установка специальных имплантов (стентов) в область артерии, поражённой атеросклеротической бляшкой, чтобы восстановить её проходимость.
Такие операции выполняются под местной анестезией через прокол, т. е. малоинвазивным и малотравматичным способом [1] .
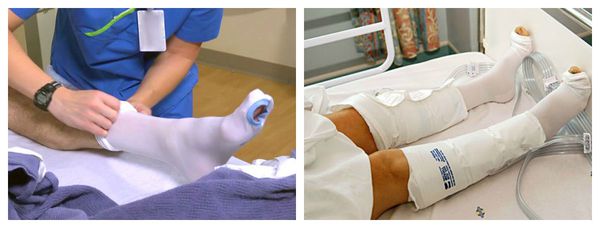
После восстановления кровообращения и купирования инфекционного процесса наступает восстановительный период. Он предполагает компрессионное лечение:
- Ношение трикотажа 2-3 класса компрессии в течение дня. Это могут быть бинты, чулки, перчатки, рукава и пр.
- Прерывистая пневмокомпрессия, или прессотерапия. Используется как противоотёчная терапия [3] . На пациента надеваются манжеты, в которые подаётся воздух. Манжеты постепенно нагнетают давление от периферии к центру, т. е. от пальцев стопы, усиливая отток лимфы.
Одновременно с перечисленными мерами проводится обработка раны. Она направлена на очищение и подготовку дефекта к заживлению.
Выбор метода обработки зависит от состояния раны и организма в целом. Возможны несколько вариантов:
- хирургический метод — иссечение омертвевших тканей;
- ферментный метод — наложение препаратов, расщепляющих омертвевшие ткани, например трипсина или химотрипсина;
- ультразвуковой метод — физический способ размельчения и удаления омертвевших тканей;
- комбинация нескольких методов очищения раны [10] .
При адекватной обработке и разгрузке поражённой конечности дефект начинает заживать в течение двух недель [10] .
Правильно выбрать повязку для раны — не менее важно. Чтобы поспособствовать заживлению, она должна отвечать четырём требованиям:
- поддерживать влажную среду в ране;
- контролировать объём воспалительного выпота;
- предотвращать повреждение краёв раны;
- хорошо фиксироваться, оставаться неподвижной.
Современные многокомпонентные повязки содержат все необходимые компоненты для заживления раны:
- гидрогели для создания оптимальной влажной среды на поверхности раны;
- альгинаты для устранения избыточной жидкости;
- гидроколлоиды для очищения раны от омертвевших тканей;
- ионы серебра для обеззараживания и т. д.
Для каждой стадии заживления раны существуют свои повязки. Они накладываются на 1-5 дней. На поверхности современных повязок имеются индикаторные метки, которые сигнализируют о том, что повязку пора сменить.
Прогноз. Профилактика
Если не лечить влажную гангрену или поздно обратиться к врачу, то в течение первого года 20 % больных умирают, 25 % пациентов проводится ампутация и лишь у 55 % больных есть шанс сохранить конечность или орган. Эти показатели отражают весь драматизм ситуации: угроза здоровью и жизни больных очень высока [8] .
Ампутация, как единственно возможный способ сохранения жизни пациента, показана при неэффективности комплексного лечения, увеличении раны, невозможности проведения операции, ухудшении состояния пациента и позднем обращении к врачу — развившейся гангрене.
Во избежание осложнений, связанных с ампутацией, операцию следует выполнять в два этапа:
- первичная ампутация — удаление омертвевших тканей, попытка восстановить кровоток и сохранить конечность;
- вторичная ампутация — проводится при неэффективности мероприятий по сохранению конечности и отсутствии положительной динамики: рана после первичной ампутации не заживает [9][14] .
При наличии гнойно-некротического очага и риске заражения крови его первичная санация должна быть выполнена до операции [10] .
Другие осложнения, связанные с лечением, возможны при критической ишемии конечности. Проводить хирургическую обработку раны в этом случае опасно: это может расширить зону некроза. Перед этим требуется провести реваскуляризацию конечности, например стентирование.
При реваскуляризации возможно развитие осложнения в виде нефропатии — нарушения работы почек. Особенно рискуют пациенты с генерализованным атеросклерозом, кальцификацией почечных артерий и хронической болезнью почек II стадии и выше [8] [15] [16] . Чтобы предупредить нефропатию, накануне и после операции пациентам из группы риска необходимо отменить метформин, петлевые диуретики и по каплям внутривенно ввести 1 л физраствора.
Профилактика влажной гангрены заключается в регулярном обследовании, контроле имеющихся заболеваний и раннем обращении к врачу при первых симптомах тромбоза или ишемии конечности. Даже небольшая на первый взгляд ранка может привести к утрате конечности.
При наследственной предрасположенности к варикозной болезни необходимо каждый год выполнять УЗИ вен нижних конечностей и консультироваться с флебологом. В профилактических целях врач может назначить ношение компрессионного белья: это позволит избежать образования тромбов и прогрессирования хронических заболеваний вен.
При сахарном диабете важно корректировать уровень глюкозы в крови, ежегодно выполнять УЗИ органов брюшной полости, артерий и вен нижних конечностей, а также правильно ухаживать за кожей ног:
Читайте также:

