Анализы на токсоплазмоз герпес при беременности
Обновлено: 25.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Токсоплазмоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Токсоплазмоз – широко распространенное паразитарное заболевание с поражением нервной системы, глаз, селезенки, печени, сердца. По данным ВОЗ, число лиц, инвазированных токсоплазмами, составляет около 1,5 млрд человек.
У взрослых токсоплазмоз обычно протекает бессимптомно. Заболевание с клиническими проявлениями часто развивается у наиболее восприимчивой и уязвимой группы населения – детей.
Причины появления токсоплазмоза
Возбудителем токсоплазмоза является Toxoplasma gondii. Токсоплазма – внутриклеточный паразит, который способен к размножению бесполым путем в клетках тканей человека. В процессе размножения образуются скопления паразитов внутри клетки с образованием псевдоцист. В случае хронизации процесса образуются истинные цисты с собственной оболочкой.
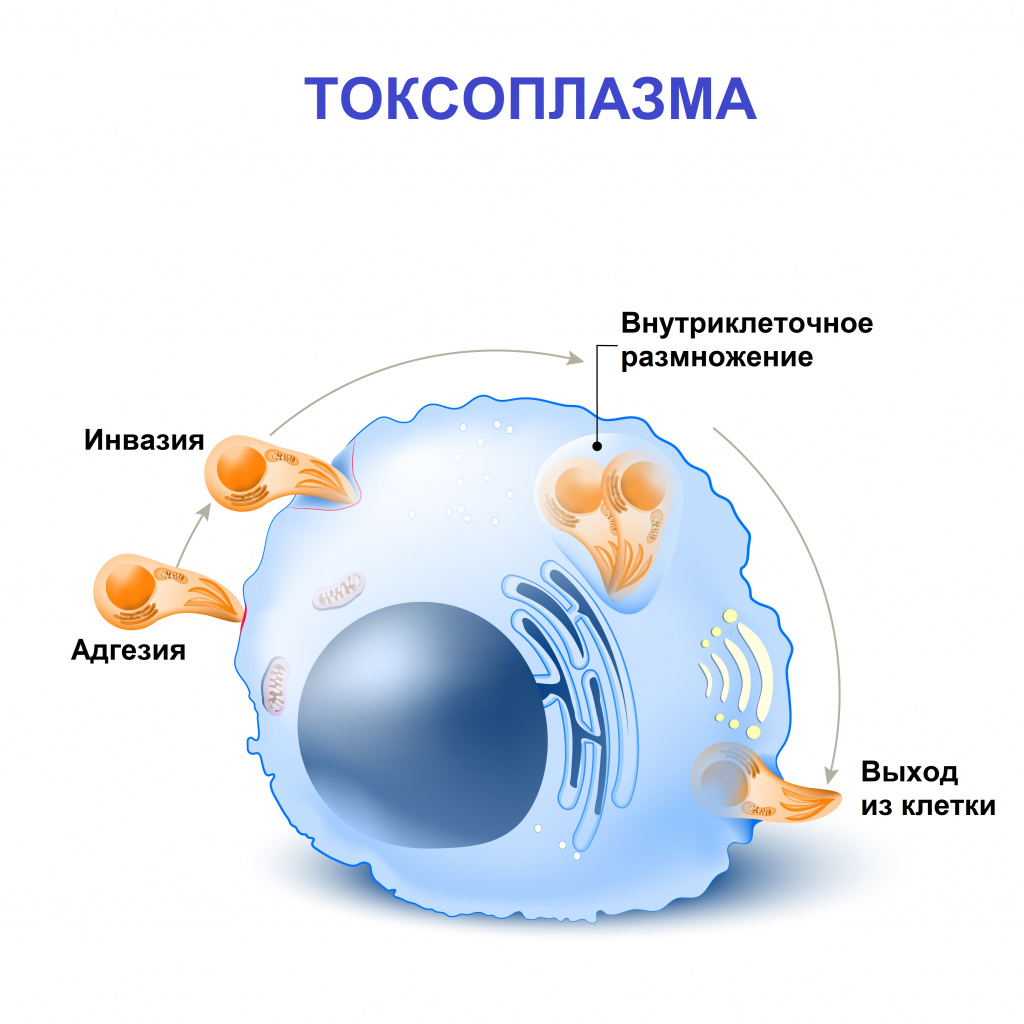
Человек является промежуточным хозяином и заражается спорозоитами – инвазивными формами токсоплазм, которые способны проникать в организм.
Спорозоиты выделяются с фекалиями кошек, и при нарушении правил личной гигиены происходит заражение человека (этим объясняется столь частое инфицирование токсоплазмами в раннем детском возрасте – в связи с особенностями поведения детей и не развитыми у них навыками гигиены).
Другая форма токсоплазм – цистозоиты – они проникает в организм человека при употреблении мяса больных животных, если оно было плохо термически обработано.

Токсоплазмы через желудочно-кишечный тракт попадают в лимфатическую систему и с током лимфы – в лимфатические узлы. На этом этапе на фоне интенсивного размножения токсоплазм формируются воспалительные изменения в лимфоидной ткани. Далее паразиты проникают в системный кровоток и разносятся по всему организму. В зависимости от конечной точки их миграции развивается соответствующая клиническая картина заболевания.
Размножение в клетках органов сопровождается выделением токсических продуктов жизнедеятельности токсоплазм, которые могут вызывать аллергические реакции организма.
Иммунная система со временем уничтожает все вегетативные формы, которые способны к размножению, и в организме остаются лишь цисты токсоплазм, спрятанные от иммунологического надзора благодаря толстой оболочке.
Под воздействием факторов, снижающих иммунные силы организма (например, ВИЧ, применение цитостатиков, глюкокортикостероидная терапия), возможна повторная активация токсоплазм с дальнейшим их распространением по всему организму.
Если заражение произошло во время беременности (после 2-го месяца), токсоплазмы могут проникнуть в кровоток плода и привести к развитию заболевания, а также к формированию тяжелых пороков развития.
Классификация заболевания
В зависимости от сроков заражения токсоплазмами выделяют врожденный токсоплазмоз (при внутриутробном заражении) и приобретенный (когда заражение произошло после рождения).
При развитии клинической симптоматики выделяют легкую, среднетяжелую и тяжелую формы токсоплазмоза.
Симптомы токсоплазмоза
Клиническая картина токсоплазмоза зависит от формы заболевания.
Наиболее часто встречается бессимптомная первичная токсоплазменная инфекция, которая при отсутствии факторов иммунодефицита никак себя не проявляет.
В редких случаях инвазия токсоплазм в организм ранее здоровых людей вызывает повышение температуры тела, незначительное увеличение и болезненность лимфатических узлов, пятнисто-папулезную сыпь, часто принимаемую за крапивницу (красного цвета с небольшими возвышениями – папулами), и увеличение печени. Еще реже токсоплазмы вызывают воспалительные процессы в органах зрения.
Инкубационный период токсоплазмоза составляет от 3 дней до нескольких месяцев. Обычно он протекает бессимптомно, в редких случаях больные жалуются на слабость и головную боль.
При острой форме токсоплазмоза по завершении инкубационного периода внезапно поднимается температура до 39°C градусов, появляется выраженная слабость, головная и мышечная боль, снижается аппетит, иногда бывают высыпания на коже. Сыпь распределяется равномерно по всему телу, редко встречается на волосистой части головы, ладонях и стопах. Характер высыпаний – пятнисто-папулезный со склонностью к слиянию. В это же время увеличиваются лимфатические узлы, печень и селезенка. При поражении сердца фиксируются нарушения сердечного ритма. Возможны психические расстройства, потеря сознания, парезы и параличи, повторяющаяся рвота, резкие головные боли – все эти симптомы указывают на поражение центральной нервной системы.
При легкой форме острого токсоплазмоза заболевание проявляется недомоганием, незначительным подъемом температуры, тошнотой, диареей.
При хроническом течении токсоплазмоза не наблюдается столь яркой клинической картины. Выявляются симптомы хронической интоксикации: слабость, снижение аппетита, нарушение сна, дискомфорт в мышцах и суставах, быстрая утомляемость, раздражительность, головные боли, учащенное сердцебиение. Одним из частых проявлений хронического токсоплазмоза является прогрессирующее поражение глаз. В редких случаях – судороги.
Длительное течение болезни может привести к снижению интеллектуального развития и различным психическим нарушениям.
Врожденный токсоплазмоз также подразделяется на острый и хронический. При остром врожденном токсоплазмозе состояние ребенка с первых дней тяжелое, прогноз неблагоприятный.
При хронической форме часто отмечается поражение нервной системы с задержкой умственного и физического развития ребенка.
Более легкие формы проявляются в возрасте 5–7 лет в виде повышенной утомляемости, судорог и поражения глаз.
Диагностика токсоплазмоза
Диагностика токсоплазмоза проводится на основании жалоб пациента, данных осмотра и комплекса лабораторно-инструментальных методов обследования. Объем обследования может меняться в зависимости от клинической картины, тяжести заболевания, а также наличия осложнений.
Для выявления возбудителя могут быть назначены следующие методы диагностики:
-
токсоплазма, определение ДНК в сыворотке крови;
Определение ДНК токсоплазмы (Toxoplasma gondii) в сыворотке крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени». Токсоплазмоз – распространенная инфекция, обусловленная внутриклеточным протозойным паразитом Тoxoplasma gondii. Осн.
Токсоплазмоз при беременности – это паразитарное заболевание, вызванное проникновением T.gondii в организм беременной женщины. В большинстве случаев данная патология протекает бессимптомно, реже сопровождается гриппоподобным симптомокомплексом. Диагностика токсоплазмоза при беременности включает в себя серологическое исследование с определением IgM и IgG, ультразвуковое обследование плода и амниоцентез с последующим проведением ПЦР околоплодных вод. Вариант медикаментозного лечения зависит от инфицирования плода и может состоять из антибиотиков макролидного ряда или комбинации сульфаниламида и антагониста фолиевой кислоты.
Общие сведения
Токсоплазмоз при беременности – это инфекционное заболевание, вызванное токсоплазмами, которое имеет большое значение в акушерстве и гинекологии за счет трансплацентарного пути передачи. Согласно статистике, порядка 15-25% женщин в возрасте от 15 до 45 лет инфицированы T.gondii. Общая частота врожденного токсоплазмоза составляет от 1 до 10 случаев на 10 000 новорожденных, из них 3-10% имеют тяжелые аномалии развития. При этом порядка 55% женщин, родивших инфицированных детей, не отмечали у себя каких-либо признаков заболевания. Как правило, более высокому риску развития токсоплазмоза при беременности подвержены женщины с иммунодефицитом и проживающие или путешествующие в эндемических зонах: Франции, Латинской Америке и южной Африке.

Причины токсоплазмоза при беременности
Возбудитель токсоплазмоза при беременности – Toxoplasma gondii. Она являет собой облигатного внутриклеточного паразита размером от 4 до 8 мкм. В зависимости от среды токсоплазма может находиться в трех формах: ооциста, тканевая циста и тахизоит. Первые две являются инвазивными для человека. Инфицирование цистами происходит при использовании зараженных мясных продуктов питания, ооцитами – при контакте с землей во время садовых работ или употреблении немытых овощей и фруктов. Токсоплазмы в форме ооцисты способны сохранять жизнеспособность длительное время, в особенности находясь в теплых и влажных условиях, что существенно повышает риск их передачами. При попадании в организм паразиты из инвазивных форм трансформируются в тахизоиты, которые обуславливают клинику заболевания и инфицирование плода на фоне токсоплазмоза при беременности.
Выделяют несколько вариантов пути заражения человека T.gondii – употребление в пищу сырого фарша или плохо термически обработанного мяса, контакт с испражнениями кошки или землей, содержащими ооцисты, трансплацентарная передача от матери к ребенку и переливание инфицированной крови. Значительная часть случаев (до 65%) токсоплазмоза при беременности возникает на фоне употребления инфицированных продуктов питания и воды, проходит в виде первичного инфицирования. При контакте с кошками основную опасность представляют питомцы, которые живут на улице или питаются сырым мясом.
Инфицированный человек может быть источником только в случае донорства крови или органов. Риск развития токсоплазмоза при беременности существенно возрастает при посещении регионов с высоким распространением токсоплазм: Франции, Латинской Америки и южной части Африки. Принято считать, что даже при единичном попадании в организм T.gondii человек остается инфицированным всю жизнь, а само заболевание протекает в субклинической форме. Однако только в отдельно взятых случаях токсоплазмоз при беременности вызывается активацией персистирующей инфекции.
Симптомы токсоплазмоза при беременности
Более чем 90% случаев токсоплазмоза при беременности протекает бессимптомно, в форме здорового носительства. Развитие выраженной клиники более вероятно у беременных с ослабленным иммунитетом – на фоне сопутствующих инфекционных или бактериальных заболеваний, употребления ГКС, ранних этапов СПИДа и т. д. Инкубационный период в таких случаях может колебаться от 1 до 3 недель после попадания паразита в организм. Для острого токсоплазмоза при беременности характерен гриппоподобный вариант течения: подъем температуры тела до 37,5-38°C, общая слабость и недомогание, головная боль, увеличение лимфатических узлов, реже – гепатоспленомегалия. У беременных редко возникает токсоплазмозный хориоретинит, еще реже – конъюнктивит, кератит или иридоциклит. Только на фоне выраженного дефицита иммунитета токсоплазмоз при беременности может вызывать тяжелые осложнения в виде энцефалита, гепатита, миокардита или пневмонии.
Токсоплазмоз относится к группе TORCH-инфекций, в которую входят инфекционные заболевания, способные оказывать тератогенное влияние. В основном опасность для плода представляет первичное заражение матери, хронический токсоплазмоз при беременности редко становится причиной внутриутробной передачи. Инфицирование происходит в промежутке от 1 до 4 месяцев после проникновения в плаценту тахизоитов, риск заражения возрастает со сроком гестации. Согласно статистике, частота передачи паразитов плоду на фоне отсутствия лечения токсоплазмоза при беременности в третьем триместре в 10-12 раз выше, чем в первом. Несмотря на это, чем раньше произошло инфицирование плода – тем хуже прогноз. При проникновении токсоплазм в организм плода в первом триместре могут наблюдаться спонтанные аборты, тяжелые аномалии развития. Более поздний врожденный токсоплазмоз проявляется тетрадой Сэбина: хориоретинит, водянка головного мозга, судорожный синдром, внутричерепная кальцификация. Также могут присутствовать выраженная задержка внутриутробного развития и микроцефалия. Их наличие свидетельствует о перенесенном остром токсоплазмозе при беременности.
Диагностика токсоплазмоза при беременности
Постановка диагноза токсоплазмоза при беременности основывается на анамнестических данных, выявленных симптомах, результатах лабораторных и инструментальных исследований. При сборе анамнеза акушером-гинекологом или инфекционистом выясняются все обстоятельства, при которых могло произойти инфицирование токсоплазмами: употребление сырого мяса, немытых овощей или фруктов, контакт с уличными кошками, работа с землей в саду, пребывание в эндемических зонах. Физикальный осмотр у женщин с токсоплазмозом при беременности может выявить гриппоподобный симптомокомплекс, но в подавляющем большинстве случаев он малоинформативен.
Ведущее место в диагностике токсоплазмоза при беременности играют серологические тесты, ультразвуковое сканирование и пункция амниотической оболочки плода. Лабораторная диагностика зачастую является первым шагом и реализуется она путем иммуноферментного анализа (ИФА) или специальных тест-систем. Суть этого исследования заключается в определении иммуноглобулинов класса М (IgM) и G (IgG). Их полное отсутствие опровергает диагноз токсоплазмоза при беременности. Наличие IgM и его нарастание в 4 раза и более указывает на первичное инфицирование T.gondii. Далее титр постепенно продолжает нарастать и достигает максимума через 5-20 дней после инвазии. Первое проявление IgG в крови матери наступает через 7-14 дней и достигает максимальной концентрации в промежутке от 3 до 6 месяцев. В большинстве случаев высокий уровень IgG свидетельствует о латентном течении токсоплазмоза при беременности. При получении позитивных результатов следует повторить исследование 3-4 раза в течение 2-3 недель.
Проведение УЗИ женщинам с подозрением на токсоплазмоз при беременности необходимо для оценки состояния плода. В большинстве случаев выявить какие-либо выраженные признаки врожденного токсоплазмоза не удается или присутствующих изменений недостаточно для подтверждения диагноза. К основным проявлениям инфицирования плода на фоне токсоплазмоза при беременности относятся общая задержка внутриутробного развития и нарушения структуры ЦНС – гидро- или микроцефалия, образование кальцификатов. Прерывание беременности рекомендуется только при обнаружении тяжелых морфологических аномалий.
Проведение пункции амниотической оболочки (амниоцентез) требуется в случаях первичного токсоплазмоза при беременности на фоне низкой информативности серологической диагностики и наличия УЗ-признаков поражения плода. Решение о целесообразности пункции амниотического мешка принимается лечащим инфекционистом совместно с неонатологами и акушерами-гинекологами. Суть заключается в заборе околоплодной жидкости и определении в ней наличия T.gondii путем полимеразной цепной реакции (ПЦР). Чувствительность и специфичность данной процедуры колеблется в пределах 90-95%. Как правило, амниоцентез при наличии признаков токсоплазмоза при беременности проводится на сроке не ранее 18 акушерских недель, что связано с высоким риском получения ложноположительных результатов. Также данное исследование показано только спустя 4 недели после предполагаемого инфицирования. Считавшийся ранее «золотым стандартом» кордоцентез сейчас почти не используется в связи с риском для плода, высокой информативностью амниоцентеза и ПЦР.
Лечение токсоплазмоза при беременности
Лечение необходимо только в случаях острого токсоплазмоза при беременности, сопровождающегося клиническими проявлениями. При отсутствии клинических симптомов инфекции выздоровление наступает самостоятельно. В зависимости от поражения плода выделяют два направления медикаментозной терапии токсоплазмоза при беременности. При отсутствии признаков заражения плода по результатам ПЦР амниотической жидкости используются антибиотики макролидного ряда (спирамицин). Данные средства способны накапливаться в тканях плаценты и предотвращать вертикальный путь передачи.
При подтверждении или подозрении на инфицирование плода на фоне токсоплазмоза при беременности фармакотерапия должна состоять из антагониста фолиевой кислоты (пириметамин) и сульфаниламида (сульфадиазин). Первый способен подавлять деление клеток в костном мозге, поэтому его назначение всегда дополняется препаратами фолиевой кислоты. Также использование препарата противопоказано в I триместре беременности в связи с потенциальным тератогенным эффектом. Такой вариант лечения направлен на снижение тяжести заболевания у ребенка и улучшение общего прогноза.
Прогноз и профилактика токсоплазмоза при беременности
Прогноз для женщины на фоне токсоплазмоза при беременности благоприятный. Практически все случаи заканчиваются клиническим выздоровлением. Прогноз для будущего ребенка напрямую зависит от триместра, в котором произошло инфицирование – проникновение паразитов в организм плода в I триместре связано с высоким риском спонтанного аборта или тяжелых аномалий развития.
Профилактика токсоплазмоза при беременности подразумевает разрыв всех механизмов передачи инфекции и скрининг беременных. Первая часть превентивных мер включает в себя употребление только чистой воды и продуктов, прошедших качественную термическую обработку, ограничение работы с землей и контакта с кошками, тщательное мытье овощей и фруктов и т. д. Скрининг токсоплазмоза показан только беременным с высоким риском заражения и включает в себя ежемесячный серологический контроль.
Цитомегаловирусная инфекция у беременных — это клинически манифестное или латентно протекающее инфекционное заболевание, вызванное цитомегаловирусом, возникшее до зачатия или во время гестации. Проявляется гипертермией, катаральными симптомами, шейным и подчелюстным лимфаденитом, сиалоаденитом, общей интоксикацией, беловато-голубыми белями, реже — гепатомегалией, спленомегалией, генерализованной лимфаденопатией. Диагностируется с помощью серологических и молекулярных лабораторных методов. Лечение проводится специфическим человеческим иммуноглобулином, рекомбинантным альфа-2-интерфероном, при тяжелом течении — синтетическими аналогами нуклеозидов.
МКБ-10
Общие сведения
Цитомегаловирусная инфекция (цитомегалия, ЦМВИ) — одно из наиболее распространенных инфекционных заболеваний, внутриутробно поражающих плод и вызывающих различные врожденные аномалии. В зависимости от региона антитела к цитомегаловирусу определяются у 40-98% пациенток репродуктивного возраста. Цитомегалия чаще встречается в группах населения с низким уровнем социального и экономического развития. В России серопозитивными к ЦМВИ являются до 90% женщин, инфицированность среди беременных старше 30 лет достигает 97-98%. В европейских странах врожденная цитомегалия выявляется с частотой 3-5 случаев на 1000 родов, в других государствах этот показатель составляет от 0,2 до 2,2%.

Причины
Заболевание вызывается крупным ДНК-содержащим цитомегаловирусом (ЦМВ), принадлежащим к семейству герпес-вирусов. Специалисты выделяют три штамма возбудителя, каждый из которых может самостоятельно инфицировать организм одного и того же человека. Заражение происходит до зачатия либо во время беременности. Вирусы пожизненно персистируют в организме женщины, поражая практически все виды тканей. Часть инфекционистов считает ЦМВ условно-патогенным микроорганизмом, клинически значимая реактивация которого наблюдается только при значительном угнетении иммунитета.
Усиление патогенности цитомегаловируса в гестационном периоде связано с физиологической иммуносупрессией, защищающей генетически чужеродный плод от отторжения. Под влиянием эстрогенов, прогестерона, кортизола у беременной уменьшается абсолютное и относительное количество Т-лимфоцитов, непосредственно участвующих в элиминации вирусов и поврежденных клеток, снижается их цитотоксичность. В результате ускоряется репликация цитомегаловирусов, они быстрее распространяются по организму и при недостаточном уровне защитных антител преодолевают плацентарный барьер.
Патогенез
Особенностью цитомегаловирусной инфекции является множественность путей заражения. Вирус распространяется аэрогенным, контактным, фекально-оральным, гемотрансфузионным, половым, вертикальным способами, в том числе трансплацентарно от беременной к плоду. Из-за сравнительно низкой вирулентности для инфицирования важен тесный контакт с зараженным. Возбудитель ЦМВИ определяется практически во всех биологических средах: слюне, крови, моче, слезной жидкости, ликворе, грудном молоке, цервикальном, вагинальном, уретральном секрете, сперме, слизи из прямой кишки, околоплодных водах.
После попадания в организм цитомегаловирусы адсорбируются на поверхности клеток, проникают в них, проходят полный цикл репликации ДНК, после чего сформированные вирионы распространяются на соседние клетки, с кровью разносятся по организму. Наиболее чувствителен к вирионам протоковый эпителий слюнных желез, в первую очередь околоушных, других экзокринных желез.
После лимфогенной и гематогенной генерализации обычно наступает фаза непродуктивной инфекции (скрытого носительства) с длительным сохранением вирусной частицы внутри зараженной клетки и передачей при делении дочерним клеткам. У женщин с нормальным иммунитетом клиническая манифестация не происходит, заболевание сразу приобретает характер носительства. Цитомегаловирус может длительное время персистировать в неактивной форме в чувствительных клетках. Проникновение ЦМВ в лимфоциты и мононуклеары обеспечивает его защиту от противовирусных антител.
При падении иммунитета у беременных возможна реактивация цитомегаловирусной инфекции с разрушением ядер клеток, в которых персистировал вирус, гематогенной диссеминацией, поражением железистых органов, развитием васкулитов, индукцией специфического цитомегалического метаморфоза клеток разных тканей. При гестации вирусы из межворсинчатого пространства проникают через плаценту и гематогенно инфицируют плод. Установлено, что ЦМВ способен повреждать мембрану трофобласта.
Классификация
Систематизация основных форм цитомегаловирусной инфекции у беременных проводится с учетом выраженности клинической картины и времени манифестации патологического процесса. Такой подход наиболее оправдан с точки зрения прогнозирования возможных осложнений заболевания и выбора оптимальной тактики ведения беременности. Специалисты в сфере акушерства и гинекологии, инфекционных болезней различают следующие варианты инфекции:
- Первично-манифестнаяЦМВИ. Самый неблагоприятный вариант течения патологии. Возникает в результате первичного инфицирования беременной, у которой отсутствуют специфические IgG. Отличается высокой вероятностью трансплацентарного переноса вируса (до 30-75%) и внутриутробного поражения плода. В период гестации выявляется не более чем у 4% пациенток. При заражении с острой симптоматикой в I триместре рекомендован аборт.
- Носительство. Наиболее частая форма цитомегаловирусной болезни у беременных. Носительницами являются женщины, у которых до зачатия была активная форма заболевания или инфекция на фоне сильного иммунитета сразу перешла в непродуктивную фазу. Иммуноглобулины G, циркулирующие в крови пациентки, защищают плод от заражения ЦМВ. При исключении иммуносупрессорных воздействий риск патологического течения гестации минимален.
- Реактивация латентной инфекции. При значительном снижении иммунитета у носительниц цитомегаловируса развивается характерная клиническая картина. Заболевание в той или иной степени обостряется у 40-50% серопозитивных беременных. В 0,15-0,36% случаев вирус передается трансплацентарно ребенку. Наибольший риск врожденных аномалий наблюдается при обострении цитомегаловирусной болезни на 7-12 неделях гестационного срока.
Симптомы ЦМВИ у беременных
Возможны беловато-голубые влагалищные выделения. При существенном снижении иммунитета определяется увеличение печени, селезенки с появлением тяжести, дискомфорта, распирания в правом и левом подреберьях, генерализованное увеличение лимфоузлов. Длительность острой фазы, как правило, составляет до 2-3 недель.
Осложнения
Осложненное течение гестации наблюдается преимущественно при острой или реактивированной инфекции. У таких пациенток чаще возникают спонтанные выкидыши, связанные с тяжелыми эмбрио- и фетопатиями, преждевременные роды, вызванные гипертонусом матки, замершие беременности, мертворождение. Из-за повреждения мембраны трофобласта ЦМВИ может осложниться приращением плаценты, гипертрофией и ранним старением плацентарной ткани, фетоплацентарной недостаточностью, внутриутробной гипоксией и задержкой развития плода.
Во время родов возможна преждевременная отслойка плаценты, массивная кровопотеря из-за атонического кровотечения. В послеродовом периоде отмечаются латентные эндометриты. В последующем повышается вероятность развития дисменореи.
При острой первичной цитомегаловирусной болезни существенно возрастает риск трансплацентарного инфицирования плода и развития многоводия. Дети зачастую рождаются недоношенными, с низкой малой тела. Особенно опасно заражение ЦМВ в 1-м триместре, часто вызывающее микроцефалию, хориоретинит, нейросенсорную тугоухость, другие аномалии развития.
Врожденная цитомегалия после внутриутробного инфицирования может протекать бессимптомно, проявляться тяжело протекающими манифестными формами или в виде последствий поражения отдельных органов (гепатомегалии, затяжной желтухи, нарушений сосания и глотания, стойкого снижения мышечного тонуса, тремора, анемии, тромбоцитопении, отставания в умственном и моторном развитии, пневмонии, миокардита, панкреатита, колита, нефрита). Отдаленными последствиями ЦМВИ у детей являются слепота, глухота, речевые нарушения, проявляющиеся на 2-5-м году жизни.
У беременных со значительной иммуносупрессией ЦМВИ протекает тяжелее, экстрагенитальные осложнения выявляются чаще. Неблагоприятными формами заболевания считаются цитомегаловирусные поражения легких (интерстициальная пневмония), мозга (менингит, энцефалит), периферической нервной системы (миелит, полирадикулоневрит), сердца (миокардит, перикардит), кроветворения (тромбоцитопения, гемолитическая анемия). Прямая угроза для жизни беременной возникает при быстрой генерализации инфекции с развитием сепсиса, инфекционно-токсического шока, ДВС-синдрома.
Диагностика
Сложность своевременного выявления ЦМВИ связана с отсутствием симптоматики у большинства беременных и полиморфностью клинической картины при манифестации. Учитывая повышенный риск перинатального заражения ребенка цитомегаловирусной инфекцией, в качестве скрининга рекомендовано проведение анализа на TORCH-комплекс. Ведущими методами диагностики являются лабораторные анализы, позволяющие верифицировать инфекционного агента, обнаружить серологические маркеры и определить остроту процесса. План обследования пациенток с подозрением на цитомегалию включает такие исследования, как:
- Иммуноферментный анализ. ИФА считается наиболее достоверным и информативным методом диагностики цитомегаловирусной болезни. Наличие активной инфекции подтверждает выявление IgM и более чем 4-кратное нарастание титра IgG. О давности инфицирования свидетельствуют данные об авидности иммуноглобулинов G (при показателе
- ПЦР-диагностика. Цитомегаловирусные нуклеиновые кислоты определяют в биологических секретах, которые могут содержать возбудителя. Обычно для анализа берут кровь, мочу, цервикальный секрет, буккальные мазки. Обнаружение вирусной ДНК подтверждает инфицированность, а количественные методы исследования позволяют контролировать течение инфекции.
Для оценки состояния плода, выявления фетоплацентарной недостаточности, возможных аномалий по показаниям проводятся:
- УЗИ плода и плаценты;
- допплерография маточно-плацентарного кровотока;
- фетометрия;
- КТГ;
- фонокардиография плода;
- биопсия хориона.
Цитомегалию дифференцируют с ВИЧ-инфекцией, инфекционным мононуклеозом, токсоплазмозом, листериозом, герпесом, вирусными гепатитами, бактериальным сепсисом, лимфогранулематозом, острым лейкозом. При необходимости пациентку консультирует инфекционист, вирусолог, иммунолог, онколог, онкогематолог.
Лечение ЦМВИ у беременных
Выбирая тактику ведения гестации, учитывают клиническую форму ЦМВИ и срок инфицирования. Женщинам с цитомегалией, первично-манифестировавшей в период 1 триместра, рекомендовано проведение аборта. Прерывание беременности по медицинским показаниям также показано пациенткам с клинически и лабораторно подтвержденной первичной инфекцией при обнаружении до 22 недели УЗ-признаков пороков развития плода. В остальных случаях возможна пролонгация гестации.
Беременным с носительством медикаментозное лечение не назначается. При отсутствии клинических и лабораторных признаков реактивации цитомегаловирусной болезни требуется коррекция образа жизни, направленная на предотвращение значительной иммуносупрессии. Больным необходимы достаточные отдых и сон, исключение чрезмерных физических и психологических нагрузок, полноценное питание, прием витаминно-минеральных комплексов, профилактика ОРВИ, осторожность при назначении препаратов, снижающих иммунитет.
Беременным с активной формой инфекции проводится лечение, направленное на купирование обострения и прекращение экскреции цитомегаловируса. Сложность выбора адекватной медикаментозной терапии связана с фетотоксичностью большинства противовирусных средств. С учетом возможных показаний и противопоказаний для лечения ЦМВИ при гестации применяются:
- Антицитомегаловирусный человеческий иммуноглобулин. Гипериммунные препараты позволяют восстановить титр специфических IgG, блокировать репликацию возбудителя и ограничить его диссеминацию. Использование иммуноглобулина человека существенно снижает риск внутриутробного инфицирования вирусом цитомегалии.
- Рекомбинантный α-2-интерферон. Препарат стимулирует Т-хелперы и Т-киллеры, повышая уровень Т-клеточного иммунитета. Усиливает активность фагоцитов и скорость дифференцировки В-лимфоцитов. Угнетает репликацию цитомегаловирусов и способствует их инактивации различными иммунными агентами. Рекомендован в виде ректальных свечей.
- Синтетические аналоги нуклеозидов. Назначаются только при тяжелых генерализованных формах цитомегаловирусной инфекции, когда риск токсических эффектов препаратов оправдан спасением жизни беременной. Противовирусные препараты ингибируют ДНК-полимеразу вирусных частиц и за счет этого тормозят синтез цитомегаловирусной ДНК.
Индукторы интерфероногенеза, иммуномодуляторы применяют крайне редко из-за возможного преждевременного прерывания гестации. В качестве немедикаментозных методов допустимо проведение эндоваскулярного лазерного облучения крови и плазмафереза.
Роды при ЦМВИ
Предпочтительным методом родоразрешения являются естественные роды. Кесарево сечение выполняется при наличии абсолютных акушерских или экстрагенитальных показаний или при сочетании относительных (внутриутробном инфицировании цитомегаловирусом, хронической гипоксии плода, II-III степенях задержки его развития, первичном и вторичном бесплодии в анамнезе).
Прогноз и профилактика
Своевременное выявление латентной ЦМВИ и профилактика ее активации существенно улучшают исход беременности как для женщины, так и для плода. Прогноз неблагоприятен при генерализации первичной цитомегаловирусной инфекции. При установленном диагнозе цитомегалии показано планирование зачатия с учетом рекомендаций акушера-гинеколога, купирование активного процесса, прегравидарная иммунокоррекция с использованием пептидных иммуностимуляторов и рекомбинантных интерферонов.
Противовирусная терапия женщин с манифестной ЦМВИ на 75% снижает риск реактивации инфекции в наиболее опасном по возникновению осложнений 1 триместре. Общая профилактика заражения предполагает соблюдение правил личной гигиены с частым мытьем рук, отказ от близких прямых контактов с другими людьми.
1. Цитомегаловирусная инфекция и беременность/ Мельникова С.Е., Троик Е.Б.// Детская медицина Северо-Запада – 2012 - Т. 3, №3.
2. Цитомегаловирусная инфекция и беременность (прегравидарная подготовка и терапия)/ Короткова Н.А., Прилепская В.Н.// Эффективная фармакотерапия. – 2016 - №22.
3. Цитомегаловирусная инфекция. Этиология, эпидемиология, патогенез, клиника, лабораторная диагностика, лечение, профилактика/ Марданлы С.Г., Кирпичникова Г.И., Неверов В.А. — 2011.
4. Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения/ Извекова И.Я., Михайленко М.А., Краснова Е.И.// Лечащий врач. – 2018.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Лабораторная диагностика токсоплазмоза основана только на определении специфических антител, так как антиген Toxoplasma gondii присутствует в крови очень непродолжительное время. При попадании возбудителя в организм человека в течение 7 - 14 дней начинается первичный иммунный ответ-выработка IgM антител. Максимальный уровень IgM антител достигается к 20-му дню от начала заболевания. Полное их исчезновение в большинстве случаев происходит в течение 3 - 4 месяцев. В этот же период в крови отмечаются максимальные значения IgG антител. После выздоровления происходит постепенное снижение титра IgG антител до определённого уровня, который сохраняется пожизненно и свидетельствует о наличии устойчивого иммунитета.
При определении IgG и IgM антител к токсоплазмозу в сыворотке крови возможны следующие варианты результатов:
- +IgG, -IgM - свидетельствует о бессимптомном здоровом носительстве (до 30% взрослого населения). Данное сочетание антител в крови беременных женщин не представляет угрозы для плода.
- -IgG, +IgM либо +IgG, +IgM - первичное инфицирование, острое или субклиническое течение. Во время беременности данная ситуация указывает на возможность внутриутробного инфицирования. В сомнительных случаях необходимо повторить анализ через 7 - 14 дней для подтверждения сероконверсии.
- -IgG, -IgM - отсутствие инфицирования. Беременные женщины с таким результатом должны быть включены в группу риска и обследоваться каждый триместр.
Вероятность врождённого токсоплазмоза составляет 1 на 1000 - 3500 родившихся детей. Это возможно при свежем случае инфицирования менее чем за 6 месяцев до наступления беременности и во время беременности. По данным НЦ АгиП РАН до 5 - 7% женщин заражаются во время беременности. Риск внутриутробного заражения плода увеличивается от 17% в первом триместре до 80% - в третьем триместре в случае острого токсоплазмоза беременной. Тяжесть поражения плода находится в зависимости от срока инфицирования (стадии внутриутробного развития).
| Срок беременности (недели) | Риск заражения (%) | Исход |
| 0 - 8 | 17 | Тяжёлые аномалии развития, в/у гибель плода |
| 8 - 18 | 25 | Поражения ЦНС (гидроцефалия, кальцификаты в ткани мозга), печени, хориоретинит, судорожный синдром. |
| 18 - 24 | 65 | Нарушения функций различных органов (гепатоспленомегалия, желтуха, анемия, тромбоцитопения) |
| 24 - 40 | 80 | Субклинические проявления болезни с манифестацией через несколько лет (глухота, хориоретинит) |
Наиболее тяжёлые последствия возникают при заражении до 24 недель. При подтверждении первичного инфицирования матери в первые 8 недель рекомендуется прерывание беременности. В более поздние сроки необходимы дополнительные исследования (УЗИ, забор пуповинной крови плода путём кордоцентеза с целью определения специфических антител IgM класса) для выработки тактики лечения и решения вопроса о возможном прерывании беременности.
Для установления диагноза определяются IgM антитела в сыворотке крови, максимальный титр которых наблюдается через 2 -3 недели от начала заболевания, а полное их исчезновение происходит через 1 - 3 месяца. IgG антитела определяются с 7-го дня заболевания, а максимальный титр - на 21-й день. Затем происходит снижение титра до определённого уровня, свидетельствующего об устойчивом иммунитете.
Возможны следующие сочетания IgG и IgM антител в сыворотке крови:
- +IgG, -IgM - свидетельствует о перенесённом заболевании и устойчивом иммунитете. Иммунитет вырабатывается в результате перенесённых клинически выраженных и бессимптомных форм. В последнее время появились данные, что иммунитет после перенесённой краснухи не такой прочный как считали ранее, так как взрослые иногда заболевают краснухой (5% случаев), несмотря на то, что болели ею в детстве. В таком случае в сыворотке крови наблюдается прирост вируснейтрализующих антител (IgG).
- -IgG, +IgM либо +IgG, +IgM - первичное инфицирование, острая форма или бессимптомное течение, которое наблюдается в 30% случаях. В данной ситуации велика опасность внутриутробного инфицирования. При заражении в первом триместре рекомендуется прерывание беременности. В сомнительных случаях анализ необходимо повторить через 7 - 14 дней для подтверждения сероконверсии.
- -IgG, -IgM - отсутствие иммунитета. По последним данным 10 - 20% женщин детородного возраста не имеют иммунитета к вирусу краснухи. Поэтому необходимо обследовать женщин до беременности и при отсутствии иммунитета рекомендовать вакцинацию. Беременные женщины, не имеющие IgG антител к вирусу краснухи, включаются в группу риска и обследуются каждый триместр.
Для подтверждения диагноза врождённой краснухи можно исследовать кровь плода, полученную с помощью кордоцентеза, на наличие специфических IgM антител. Данные антитела могут определяться в сыворотке крови плода с 23 недели гестации и сохраняются в крови внутриутробно инфицированного ребёнка в течение 6 - 12 месяцев после рождения. Иммунитет после врождённой краснухи менее стоек, так как формирование иммунитета происходит в условиях незрелой иммунной системы плода.
Для профилактики краснушной инфекции рекомендуется проведение вакцинации всех детей до 2-х лет и ревакцинация девочек в 12 - 14 лет для обеспечения иммунитета к вирусу краснухи в детородном возрасте, а также вакцинация женщин детородного возраста не имеющих иммунитета. Оценка эффективности вакцинации осуществляется с помощью определения в сыворотке крови специфических антител к вирусу краснухи IgG класса.
Цитомегаловирусная инфекция
Лабораторная диагностика ЦМВИ основана на определении специфических антител в сыворотке крови и других биологических жидкостях наряду с различными методами определения антигена и ДНК вируса. Наличие в крови специфических антител IgG и IgM класса зависит от формы и стадии ЦМВИ.
ЦМВ не выводится из организма полностью, поэтому при суперинфицировании нельзя говорить о реинфекции, так как повторное заражение возможно другими штаммами вируса. При первичном инфицировании сначала возрастает титр IgM антител, а затем IgG. Через 3 - 4 месяца IgM антитела исчезают, но при обострении ЦМВИ возможно незначительное и кратковременное увеличение их уровня (до 30% случаев), в то время как рост титра IgG антител во время реактивации инфекции более значительный.
Возможны следующие варианты сочетания IgG и IgM антител при ЦМВИ:
- -IgG, -IgM - отсутствие инфицирования. Наблюдается у 5 - 10% взрослого населения. Беременные женщины, не имеющие IgG антител к ЦМВ, включаются в группу риска и обследуются каждый триместр.
- ±IgG, +IgM - первичное инфицирование. Первичная ЦМВИ, возникающая у беременных в 1 - 4% случаях, сопровождается большим риском заражения плода, чем реактивированная.
- +IgG, ±IgM - персистирующая инфекция, реактивация. Можно рассматривать как косвенный признак вирусемии и обострения инфекции. Риск заражения плода составляет 0,5 - 2,5%. В большинстве случаев ЦМВИ протекает бессимптомно и при этом в анамнезе женщины имеются сведения о неблагоприятных исходах беременностей: выкидыши, мёртворождения, рождения детей с пороками развития.
- +IgG, -IgM - инфицированность, состояние ремиссии. Установлено, что наличие специфических IgG антител против ЦМВ в крови пациента указывает скорее на его инфицированность, чем на защищённость от инфекции. Данная ситуация не представляет непосредственной опасности для плода, но так как во время беременности развивается состояние физиологического иммунодефицита, в группу риска должны быть включены и серопозитивные и серонегативные женщины.
Герпесвирусная инфекция
Лабораторная диагностика ВПГИ включает в себя определение специфических антител к ВПГ в сыворотке крови наряду с определением антигена ВПГ в клетках крови, осадка мочи, слюне. Так как ВПГ I и ВПГ II имеют общие антигенные детерминанты, раздельное определение антител возможно только с помощью моноклональных антител. Поэтому для скрининговых обследований удобнее определять суммарные IgG к ВПГ I и ВПГ II и суммарные IgM антитела. При постановке диагноза необходимо учитывать лабораторные данные и клинические симптомы.
Возможны следующие варианты при определении специфических антител к ВПГ:
- -IgG, -IgM - отсутствие инфицирования. Наблюдается у 5 - 10% взрослого населения. Беременные женщины, не имеющие IgG антител к ВПГ, включаются в группу риска и обследуются каждый триместр.
- ±IgG, +IgM - первичное инфицирование. Клинические симптомы выявляются в 33% случаев. Возможна трансплацентарная передача. Риск заражения ребёнка во время родов - 50 - 70%. ВПГ передаётся через плаценту в 10 раз реже чем цитомегаловирус.
- +IgG, ±IgM - персистирующая инфекция, реактивация. Как и при ЦМВИ, можно рассматривать как косвенный признак вирусемии и обострения инфекции. В данном случае во время беременности риск заражения плода составляет 5%. В большинстве случаев ВПГИ имеет атипичное течение, и при этом в анамнезе женщины имеются сведения о неблагоприятных исходах беременностей: выкидыши, мёртворождения, рождения детей с пороками развития. Женщины с таким анамнезом подлежат обследованию до беременности.
- +IgG, -IgM - инфицированность, состояние ремиссии. Установлено, что наличие специфических IgG антител к ВПГ, как и при ЦМВИ, в крови пациента указывает скорее на его инфицированность, чем на защищенность от инфекции. Данная ситуация не представляет непосредственной опасности для плода, но так как во время беременности развивается состояние физиологического иммунодефицита, в группу риска должны быть включены и серопозитивные и серонегативные женщины (возможно и первичное инфицирование и обострение ВПГИ). При необходимости обследуют обоих супругов.
Чаще всего заражение происходит во время родов. Максимальный риск наличия ВПГ в родовых путях - рецидив за 6 - 8 недель и менее перед родами. Инкубационный период составляет 2 - 14 суток. Неонатальный герпес проявляется везикулами на кожных покровах, конъюктивитом, неврологическими симптомами, герпетическим энцефалитом. Летальность при генерализованной ВПГИ - до 75%. Для диагностики используют определение суммарных антител к ВПГ в крови новорождённого в динамике в течение первых 3 - 4 недель жизни. В случае обнаружения IgM антител можно предположить инфицирование.
- Клинические рекомендации «Нормальная беременность». Разраб.: Российское общество акушеров-гинекологов. – 2020.
- Клинические рекомендации «Многоплодная беременность». Разраб.: Российское общество акушеров-гинекологов. – 2021.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Токсоплазмоз - зоонозная протозойная инфекция, имеющая длительное течение и приводящая к поражению нервной, лимфатической, зрительной, мышечной систем, миокарда, печени, селезенки. Острый токсоплазмоз протекает с лихорадочно-интоксикационным синдромом, лимфаденопатией, гепатоспленомегалией, кожными высыпаниями; в тяжелых случаях – с развитием миокардита, энцефалита, энцефаломиелита. Диагноз токсоплазмоза устанавливается с помощью бактериологического посева, ПЦР, ИФА. Лечение токсоплазмоза включает прием этиотропных антипаразитарных препаратов, десенсибилизирующих, общеукрепляющих средств, иммунотерапию токсоплазмином.
МКБ-10
Общие сведения
Токсоплазмоз – хроническая паразитарная инвазия, вызываемая внутриклеточными простейшими (токсоплазмами) и сопровождающаяся развитием лимфаденита, гепатита, менингоэнцефалита, пневмонии, миокардита, миозита и др. Показатель инфицированности населения токсоплазмозом чрезвычайно высок: в Европе и Северной Америке он составляет 25-50%; в странах Африки, Южной и Латинской Америки – до 90%.
Огромную опасность токсоплазмоз представляет для беременных женщин и лиц со сниженным иммунитетом. В первом случае может происходить внутриутробное инфицирование плода с самопроизвольным прерыванием беременности, мертворождением или формированием эмбрио- и фетопатий; во втором - токсоплазмоз приобретает тяжелое манифестное течение. Учитывая множественные и разнообразные клинические проявления, токсоплазмоз актуален не только для инфекционных болезней, но также для неврологии, офтальмологии, пульмонологии, кардиологии.

Причины токсоплазмоза
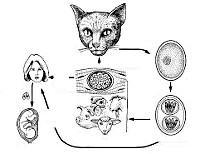
Инфекционным агентом, приводящим к заболеванию, выступает Toxoplasma gondii (токосплазма), принадлежащая к роду облигатных внутриклеточных микроорганизмов, отряду кокцидий, классу споровиков. Токсоплазма имеет изогнутую форму полумесяца, один конец которого заострен, а другой более закруглен, длину 4-7мкм и ширину 2-5 мкм. В своем развитии возбудитель токсоплазмоза проходит фазы полового и бесполого размножения и стадии трофозоитов, цист и ооцист.
Половой цикл протекает в эпителиальных клетках кишечника представителей семейства кошачьих (домашних кошек, рыси, ягуара, пумы и др.), которые выступают окончательными хозяевами токсоплазм. Здесь образуются гаметоциты, которые затем дифференцируются в мужские и женские гаметы; при их слиянии формируется зигота, а затем ооциста. С испражнениями кошек ооцисты выделяются во внешнюю среду, где превращаются в инвазивные формы – спорозоиты.
Бесполый цикл размножения токсоплазм происходит в клетках различных тканей (ЦНС, печени, миокарда, плаценты и др.) человека и теплокровных животных. В организме паразит существует в форме трофозоитов, размножающихся путем продольного деления. При хроническом течении токсоплазмоза возбудители принимают форму тканевых цист, которые десятки лет могут пребывать в «спящем» состоянии и реактивироваться при понижении иммунитета, вызывая рецидив токсоплазмоза. Цисты и ооцисты токсоплазм высокоустойчивы во внешней среде (в почве сохраняются более 1 года) и резистентны к воздействию химиопрепаратов.
Инфицирование токсоплазмозом чаще всего происходит алиментарным путем при употреблении в пищу продуктов, обсемененных ооцистами, а также сырого мяса инфицированных животных; реже – контактным путем через поврежденную кожу. При беременности возможна вертикальная передача инфекции плоду через плаценту. Реже заражение токсоплазмозом происходит парентеральным путем (при переливании крови или трансплантации органов).
Патогенез
Попав в организм человека через ЖКТ, ооцисты внедряются в энтероциты нижних отделов тонкой кишки, откуда проникают в мезентериальные лимфоузлы, вызывая их воспаление (мезаденит), некроз, кальцификацию и образование специфических гранулем. Из первичного лимфатического очага токсоплазмы попадают в кровь и гематогенным путем разносятся по организму, где фиксируются в органах-мишенях: печени, селезенке, миокарде, ЦНС, оболочках глаз, скелетной мускулатуре, вызывая формирование некрозов, гранулем, нарушение функции пораженных органов.
Жизнедеятельность токсоплазм сопровождается выделением аллергенов и токсинов, что находит выражение в развитии общеинфекционного и аллергического синдромов. По мере выработки специфических антител вегетативные формы токсоплазм инцистируются, что знаменуется переходом токсоплазмоза в хроническую форму. При снижении активности иммунной системы (у больных СПИДом, гематологических и онкологических больных) возможна реактивация инфекции с генерализованным течением.
Симптомы приобретенного токсоплазмоза
С учетом характера инфицирования различают врожденный и приобретенный токсоплазмоз. Приобретенная инфекция может протекать в острой, хронической и латентной форме; при этом латентная форма подразделяется на первичную и вторичную, развивающуюся после острого или рецидива хронического токсоплазмоза.
Латентная форма
Примерно у 95-99% людей токсоплазмоз протекает в виде латентной инфекции. При острой манифестной форме токсоплазмоза инкубационный период составляет 2-3 недели. Легкое и субклиническое течение токсоплазмоза обычно диагностируется ретроспективно по положительным результатам кожных проб с токсоплазмином, серологическим реакциям, кальцифицированным лимфоузлам и другим признакам.
Генерализованная форма
Хроническая форма
Хронический токсоплазмоз характеризуется длительным торпидным течением. Общие симптомы включают субфебрилитет, недомогание, похудание, генерализованные артралгии, лимфаденопатию. Проявлениями мезаденита служат диспепсические расстройства: тошнота, метеоризм, боли в животе, запор. Специфическими признаками хронического токсоплазмоза выступает поражение мышечной ткани, проявляющееся миозитом. Поражение сердца вызывает развитие очаговых или диффузных изменений миокарда или перикардита, проявляющихся утомляемостью, сердцебиением, одышкой, кардиалгиями.
Со стороны нервной системы отмечаются явления астении и вегето-сосудистой дистонии, неврастенические реакции и фобии. Многолетнее хроническое течение токсоплазмоза приводит к развитию эпилепсии, психических расстройств, снижению интеллекта. Эндокринные расстройства могут включать импотенцию, нарушение менструального цикла, вторичную надпочечниковую недостаточность. Поражение глаз при токсоплазмозе протекает в форме прогрессирующей близорукости, увеита, ретинита и хориоретинита с атрофией зрительного нерва.
Симптомы врожденного токсоплазмоза
Течение и исходы врожденного токсоплазмоза зависят от гестационного возраста плода. Инфицирование в I и II триместре приводит к внутриутробной гибели плода или формированию внутриутробных пороков – бластопатий, эмбрио- и фетопатий. В случае более позднего внутриутробного заражения (в III триместре) ребенок рождается с хронической, подострой или острой формой токсоплазмоза; при этом, чем позднее происходит инфицирование, тем тяжелее выражены симптомы на момент рождения.
Состояние новорожденных с острой формой токсоплазмоза тяжелое с первых дней. Отмечается фебрильная температура тела, выраженная интоксикация, обильные полиморфные высыпания на коже, генерализованная лимфоаденопатия, кровоизлияния в слизистые оболочки и склеры. Печень и селезенка обычно увеличены, часто развивается желтуха, диспепсические расстройства. Острый токсоплазмоз у новорожденных может приводить к развитию пневмонии, миокардита, энцефалита, менингоэнцефалита и летальному исходу. Подострое и хроническое течение токсоплазмоза характеризуется гидроцефалией, судорожным синдромом, длительной желтухой, субфебрилитетом, хориоретинитом.
В отдаленном периоде выявляются стойкие необратимые изменения, обусловленные внутриутробным инфицированием. Такими последствиями могут служить отставание в физическом развитии, задержка психического и речевого развития (ЗПР и ЗРР), микроцефалия, олигофрения, эпилепсия, микрофтальмия, слепота, тугоухость, глухота. Эти и другие нарушения расцениваются как резидуальный токсоплазмоз. Врожденный токсоплазмоз может иметь длительное латентное течение с клинической манифестацией на 2-7 году жизни ребенка.
Диагностика токсоплазмоза
В диагностике внутриутробного инфицирования большая роль отводится акушерскому анамнезу, результатам анализа на TORCH-инфекции у матери и серологических реакций у новорожденного, исследованию околоплодных вод и плаценты методом ПЦР. Дети нуждаются в наблюдении педиатра, детского офтальмолога, отоларинголога, невролога; проведении люмбальной пункции, КТ головного мозга, нейросонографии. Врожденный токсоплазмоз нужно дифференцировать с врожденной краснухой, герпесом, листериозом, цитомегалией, хламидийной инфекцией, внутричерепной родовой травмой.
Среди клинических проявлений наибольшее диагностическое значение при приобретенном токсоплазмозе имеет сочетание лимфаденопатии, гепатоспленомегалии, поражения глаз и ЦНС. Обязательно консультирование больного неврологом, офтальмологом, терапевтом или кардиологом. Основной перечень инструментальных исследований включает ЭЭГ, Эхо-ЭГ, рентгенографию или КТ черепа, офтальмоскопию, ЭКГ.
Для лабораторного подтверждения токсоплазмоза используются паразитологические и иммунологически методы. Первые предполагают микроскопическое выявление возбудителя в мазках-отпечатках пораженных органов, биоптате лимфоузлов, крови или спинномозговой жидкости. Возможно проведение биологической пробы с заражением лабораторных грызунов. Иммунологическая диагностика токсоплазмоза включает серологические методы (РСК, РНИФ, ИФА, РНГА), а также внутрикожную аллергическую пробу с токсоплазмином. В случае приобретенной инфекции в первую очередь исключается туберкулез, лимфогранулематоз, ревматизм, болезнь кошачьих царапин, инфекционный мононуклеоз, герпесвирусная инфекция.
Лечение токсоплазмоза
В зависимости от преимущественных органных поражений, лечение больных токсоплазмозом осуществляется в профильных отделениях: неврологических, терапевтических, кардиологических, офтальмологических и т. д. Этиотропная терапия при манифестном токсоплазмозе проводится препаратами противопаразитарного действия: чаще хлоридином в комбинации с сульфаниламидными препаратами или антибиотиками тетрациклинового ряда; при противопоказаниях - метронидазолом, хлорохином, аминохинолом. Обычно курс лечения токсоплазмоза состоит из 3-х 5-10-дневных циклов, повторяемых с интервалами 7-10 дней. Дополнительно назначаются антигистаминные и общеукрепляющие средства, поливитамины. При хроническом токсоплазмозе медикаментозный курс лечения дополняется иммунотерапией – внутрикожным введением токсоплазмина. Тактика ведения беременных с первично-хроническим или первично-латентным токсоплазмозом предполагает проведение химиопрофилактики спирамицином. При острой форме токсоплазмоза у беременной рекомендуется медицинский аборт.
Профилактика
Профилактика заражения человека токсоплазмозом включает комплекс ветеринарных (обследование и лечение домашних животных) и санитарно-гигиенических мероприятий. Последние предполагают избегание тесного контакта с кошками, тщательную термическую обработку мяса, защиту детских песочниц от испражнений безнадзорных животных, соблюдение мер личной гигиены. Обследование беременных на токсоплазмоз проводится трижды, в каждом триместре.
Читайте также:

