Акантолиз встречается при вульгарной пузырчатке
Обновлено: 02.05.2024
С обязательным определением уровня тромбоцитов не менее 1–2 раз в неделю.
Биохимический анализ крови
С определением уровня билирубина, трансаминаз, глюкозы, креатинина, белка, калия, натрия, кальция) не менее 1–2 раз в неделю.
Общий анализ мочи
Не менее 1–2 раз в неделю.
Цитологическое исследование
В мазках-отпечатках со дна эрозий при окраске по Романовскому-Гимзе обнаруживаются акантолитические клетки, отличающиеся от нормальных меньшими размерами, крупным ядром интенсивно-фиолетового цвета, занимающим почти всю клетку, и цитоплазмой, резко базофильной по периферии клетки и светло-голубой ближе к ядру. Наличие акантолитических клеток не является патогномоничным, но очень важным диагностическим признаком заболевания.
Гистологическое исследование
Для биопсии выбирают небольшой свежий пузырь, а если такого нет – край крупного пузыря или эрозии. Характерные признаки: 1) акантолиз (отделение кератиноиитов друг от друга) и 2) формирование полостей непосредственно над базальным слоем с образованием супрабазальных пузырей; 3) в пузырях содержатся круглые кератиноциты – акантолитическле клетки (клетки Тцанка).
Иммунофлюоресцентное окрашивание
При прямой реакции флюоресценции (прямая РИФ) выявляют сетчатообразные отложения IgG (антитела принадлежат преимущественно к подклассу IgG4) и нередко – отложения СЗ компонента комплемента, которые выявляются межклеточном веществе всех слоёв эпидермиса независимо от уровня образования пузыря. Эти отложения находят как в пораженной коже, так и в близлежащих участках неизменённой кожи или слизистой оболочки.
Серологические реакции
Методом непрямой реакции иммунофлюоресценции (непрямой РИФ) в сыворотке крови больных вульгарной пузырчаткой выявляют IgG-аутоантитела (пемфигус-антитела) к гликопротеиду с молекулярным весом 130 кДа, который называют десмоглеином 3, он принадлежит к семейству кадхеринов и входит в состав десмосом. У 50% больных выявляются также антитела к десмоглеину 1, гликопротеиду с молекулярным весом 160 кДа. Подходящим субстратом антигенов для непрямой иммунофлуоресценции являются криостатные срезы пищевода обезьяны - здесь пемфигусные антитела образуют характерный сетчатообразный межклеточный образец связывания. Титр антител отражает активность заболевания и нередко используется для контроля эффективности терапии и прогноза течения заболевания.
Консультации других специалистов
При поражении пузырчаткой слизистых оболочек рекомендуются консультации оториноларинголога, окулиста, гинеколога, уролога (при наличии соответствующих показаний). При возникновении побочных эффектов от лечения могут потребоваться консультации: терапевта, кардиолога, гастроэнтеролога, эндокринолога, психиатра, хирурга, травматолога, фтизиатра.
Диагноз
Оосновывается на сочетании клинической картины и результатов гистологического исследования, подтвержденных результатами прямой РИФ. При изолированном поражении слизистой полости рта постановка диагноза может оказаться сложной задачей. В этом случае необходимы гистологическое исследование кожи и слизистой, их иммунофлюоресцентное окрашивание и определение пемфигус-антител в сыворотке крови.
Материал подготовил: Раводин Роман Анатольевич, дерматовенеролог, дерматоонколог, дерматокосметолог. Доктор медицинских наук, доцент
Пузырчатка – хронический злокачественный аутоиммунный дерматоз, сопровождающийся развитием интраэпидермальных пузырей на коже и слизистых оболочках вследствие акантолиза, имеющих тенденцию к генерализации и слиянию между собой, характеризующийся отложением IgG в межклеточном пространстве эпидермиса [1,6] .
Категория пациентов: взрослые.
Пользователи протокола: дерматовенерологи, аллергологи, терапевты, врачи общей практики.
Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию.
Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию.
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Выделение различных клинических форм пузырчатки условно, так как клиническая картина одной формы может напоминать картину другой, кроме того возможен переход одной формы в другую.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: согласно внутреннему регламенту стационара с учетом действующего приказа уполномоченного органа в области здравоохранения.
Основные (обязательные) диагностические обследования, проводимые на стационарном уровне (при плановой госпитализации проводятся диагностические обследования не проведенные на амбулаторном уровне):
- цитологическое исследование на наличие акантолитических клеток в мазках – отпечатках со дна эрозий.
Дополнительные (необязательные) диагностические обследования, проводимые на стационарном уровне (при плановой госпитализации проводятся диагностические обследования непроведенные на амбулаторном уровне):
- гистологическое исследование биоптата – позволяет обнаружить внутриэпидермальное расположение щелей и пузырей;
- метод прямой иммунофлюоресценции – устанавливает наличие иммуноглобулинов класса G в межклеточном пространстве эпидермиса.
Диагностические мероприятия, проводимые на этапе скорой неотложной помощи: нет.
- кожные высыпания на слизистых оболочках полости рта, носа, глотки и/или красной кайме губ, вокруг естественных отверстий;
Наиболее частая форма заболевания, характеризующаяся наличием пузырей различных размеров с тонкой вялой покрышкой, с серозным содержимым, возникающих на видимо неизмененной коже и/или слизистых оболочках полости рта, носа, глотки, гениталий. Первые высыпания чаще всего появляются на слизистых оболочках полости рта, носа, глотки и/или красной кайме губ. Больных беспокоят боли при приеме пищи, разговоре, при проглатывании слюны. Характерный признак – гиперсаливация и специфический запах изо рта.
Через несколько месяцев процесс приобретает более распространенный характер с поражением кожного покрова. Пузыри сохраняются непродолжительное время (от нескольких часов до суток). На слизистых оболочках их появление иногда остается незамеченным, поскольку покрышки пузырей – тонкие, быстро вскрываются, образуя длительно незаживающие болезненные эрозии. Некоторые пузыри на коже могут ссыхаться в корки. Эрозии при пузырчатке обычно ярко-розового цвета с блестящей влажной поверхностью. Они имеют тенденцию к периферическому росту, возможна генерализация кожного процесса с формированием обширных очагов поражения, ухудшением общего состояния, присоединением вторичной инфекции, развитием интоксикации и смертельным исходом. Одним из наиболее характерных признаков акантолитической пузырчатки является симптом Никольского – клиническое проявление акантолиза, который при вульгарной пузырчатке может быть положительным как в очаге поражения, так и вблизи от него, а также на видимо здоровой коже вдали от очага поражения.
Листовидная пузырчатка (эксфолиативная пузырчатка) — клиническая форма пузырчатки, для которой характерно образование плоских ненапряженных пузырей, повторное появление пузырей под корками на месте уже разрешившихся элементов и резко выраженное расслаивание эпидермиса. Течение заболевания хроническое, многолетнее, со склонность к генерализации и поражению обширных участков кожи. Точная диагностика и дифференцировка заболевания от других форм пузырчатки осуществляется в ходе гистологического исследования. При листовидной пузырчатке проводится терапия иммуносупрессивными препаратами (кортикостероидными гормонами, цитостатиками), местное лечение.
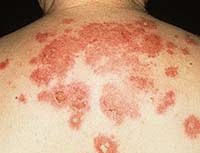
Общие сведения
Свое название листовидная пузырчатка получила за счет характерных слоистых корок, покрывающих образовавшиеся на месте пузырей эрозии. В структуре дерматозов заболеваемость листовидной пузырчаткой не превышает 1,5%. Листовидная пузырчатка является наиболее часто встречающейся формой пузырчатки у детей. У взрослых она преобладает над вегетирующей пузырчаткой. Как и другие виды пузырчатки, листовидная пузырчатка имеет аутоиммунный механизм развития с образованием аутоантител к клеткам эпидермиса. Без адекватной терапии больные могут погибнуть от присоединения вторичной инфекции, кахексии.

Симптомы листовидной пузырчатки
Листовидная пузырчатка начинается с появления покрасневших участков кожи с расположенными на них уплощенными дряблыми пузырями. В отдельных случаях начало заболевания протекает по типу вульгарной пузырчатки, дерматита Дюринга или напоминает эритематозные изменения при экземе, токсикодермии, себорейном дерматите. Иногда пузыри не выражены, а отслаивание эпидермиса определяется как участок с неровной поверхностью.
Пузыри имеют тонкую покрышку и быстро разрываются. Образуются ярко-красные эрозии с обильным отделяемым, которое подсыхает с образованием корок. Новые порции отделяемого формируют новые слои корок. В результате образуются характерные для листовидной пузырчатки элементы, покрытые слоистыми корками и напоминающие слоеное тесто.
Основной отличительной особенностью листовидной формы пузырчатки является ослабление связи зернистого и рогового слоев эпидермиса, которое проявляется даже на внешне здоровых участках кожного покрова. Это обуславливает резко положительный симптом Никольского — отслоение эпидермиса на значительное расстояние при потягивании за остатки покрышки разорвавшегося пузыря. По этой же причине даже незначительное поверхностное повреждение неизмененных участков кожи приводит к расслаиванию эпидермиса с образованием пузырей.
Эрозии заживают медленно. Часто под корками образуются новые пузыри и этот процесс может продолжаться постоянно, что также является клинической особенностью листовидной пузырчатки. При прогрессировании заболевания отдельные рядом расположенные пузыри склонны сливаться с образованием обширных участков поражения.
Общее состояние пациентов с листовидной пузырчаткой в начале заболевания может быть нормальным. По мере увеличения площади пораженных участков кожи оно ухудшается. Даже незначительные движения начинают причинять пациенту боль, из-за чего страдает психика и возникают нарушения сна. Отмечаются подъемы температуры, пациенты теряют аппетит и худеют, развивается кахексия. При распространении процесса на кожу головы, происходит выпадение волос. Ногти тускнеют, утолщаются и могут выпадать. Поражение слизистой полости рта наблюдается крайне редко.
Диагностика листовидной пузырчатки
Часто диагноз листовидной пузырчатки можно поставить на основании описанных выше клинических особенностей заболевания. В мазках-отпечатках с поверхности эрозий обнаруживаются характерные для всех видов пузырчатки акантолитические клетки, то есть клетки с нарушенными межклеточными связями. Гистологическое исследование обнаруживает наличие щелей или пузырей между роговым и зернистым слоем эпидермиса, разрыв связей между клетками (акантолиз). В старых очагах отмечается паракератоз и гиперкератоз, дегенерация клеток зернистого слоя кожи.
Из дополнительных методов диагностики применяют иммунологические исследования, подтверждающие аутоиммунный механизм развития заболевания. Однако реакции прямой и непрямой иммунофлуорисценции (РИФ) не позволяют точно отличить листовидную пузырчатку от вульгарной.
Листовидную пузырчатку дифференцируют от других форм пузырчатки, а также от дерматита Дюринга, эритродермии, синдрома Лайелла и других заболеваний.
Лечение и прогноз листовидной пузырчатки
Лечение проводится под наблюдением дерматолога в основном глюкокортикостероидами: дексаметазон, преднизолон, метилпреднизолон, триамцинолон и др. В тяжелых случаях терапию дополняют иммуносупрессорами (азатиоприн, метотрексат). Отмечен положительный эффект при комбинации кортикостероидных препаратов с синтетическими противомалярийными средствами (гидроксихлорохин, хлорохин и др.). Местно рекомендованы ванны с противовоспалительными, дезинфицирующими средствами или вяжущими добавками (например, отвар коры дуба).
Прогноз неблагоприятный. На фоне лечения заболевание может протекать длительное время. Но в итоге пациент погибает от кахексии, присоединившихся инфекций или осложнений постоянной глюкокортикоидной терапии.
В статье представлены современные взгляды на патогенез пемфигуса (акантолитической или истинной пузырчатки). Рассмотрены критерии диагностики (в том числе дифференциальной) этого заболевания и даны рекомендации относительно лечения.
The paper present the today's views on the pathogenesis of pemphigus (acantholytic or genuine), considers criteria for its diagnosis (including differential diagnosis, and gives recommendation on its treatment.
Е.В. Матушевская, доктор мед. наук, доцент кафедры кожно-венерических болезней Российского государственного медицинского университета.
Ye. V. Matushevskaya, MD, Associate Professor Department of Dermatovenereat Diseases, Medical University
П емфигус (акантолитическая или истинная пузырчатка) является одним из самых тяжелых заболеваний, причем его этиология до настоящего времени остается нераскрытой. На долю пузырчатки приходится от 0,7 до 1% всех кожных заболеваний. Пузырчатка встречается в любом возрасте, но наибольшая частота заболеваемости приходится на возраст старше 50 лет, а наиболее тяжелое течение отмечается в возрасте от 30 до 45 лет. В последние десятилетия участились случаи пузырчатки и возросла заболеваемость среди женщин.
На основании имеющихся научных данных пузырчатку считают аутоиммунным заболеванием. Одним из механизмов, объясняющих развитие заболевания, представляется изменение иммунной системы организма под воздействием экзогенных факторов при наличии генетических особенностей иммунной системы.
Первые непосредственные доказательства аутоиммунной природы пузырчатки были получены в начале 60-х годов, когда с помощью прямой и непрямой иммунофлюоресценции было показано присутствие циркулирующих антител к антигенам эпидермиса в сыворотке крови больных, а также наличие аутоантител группы IgG в связанном виде на клеточной поверхности кератиноцитов по всей толщине эпидермиса.
Морфологической основой пузырчатки является акантолиз, индуцируемый связыванием аутоантител с клеточными поверхностями кератиноцитов. Это приводит к освобождению протеолитического фермента, который и является непосредственным агентом, вызывающим акантолиз. Природа этого протеолитического фермента пока окончательно не выяснена, как и первичная причина появления антител при начале заболевания.
В последние годы исследования были сосредоточены на выяснении фундаментальной молекулярно-биологической природы и функций аутоантигенов пузырчатки. Так, было установлено, что аутоантигены- мишени, ассоциированные с истинной пузырчаткой, являются нормальными компонентами поверхностей клеток многослойного плоского эпителия и находятся в субклеточных органеллах кератиноцитов, ответственных за межклеточное сцепление. Выявлено, что вульгарная и листовидная пузырчатка четко различаются по своей антигенной специфичности на молекулярном уровне. Десмоглеин I, аутоантиген, характерный для листовидной пузырчатки, является одним из известных и хорошо охарактеризованных компонентов десмосом нормальных кератиноцитов. В нормальных кератиноцитах он содержится в сердцевинной части десмосом. Аутоантиген, ассоциированный с вульгарной пузырчаткой, является полипептидом, который по своей структуре не идентичен ни одному из известных белков и находится не только в десмосомах, но и в других частях клеточной поверхности кератиноцитов. Одним из возможных механизмов патогенеза вульгарной пузырчатки может быть непосредственное связывание аутоантител с соответствующими антигенными детерминантами, которое чисто механически нарушает межклеточное сцепление и приводит к акантолизу.
Диагностика истинной пузырчатки основывается на совокупности результатов клинического, цитологического, гистологического и иммунологического обследования. Нахождение акантолитических клеток (клеток Тцанка) в мазках-отпечатках с эрозий и пузырей после окраски по методу Романовского - Гимзы (тест Тцанка) является дополнительным тестом, но ни в коем случае не заменяет гистологического исследования.
Необходимым условием квалифицированной постановки диагноза истинной пузырчатки является проведение иммунофлюоресцентного исследования. Посредством непрямой иммунофлюоресценции выявляют антитела против компонентов эпидермиса при обработке люминесцирующей анти-IgG-сывороткой человека. Посредством прямой иммунофлюоресценции в срезах кожи выявляют антитела типа IgG, локализующиеся в межклеточных промежутках шиповидного слоя эпидермиса.
Благодаря последним достижениям в области изучения антигенов, ассоциированных с истинной пузырчаткой, в настоящее время стало возможным выполнять иммунохимические анализы, позволяющие четко дифференцировать пузырные дерматозы, а также различные формы истинной пузырчатки. За рубежом разработан и внедрен в клиническую практику иммуноблоттинговый ананализ антител к антигенами, ассоциированным с вульгарной и листовидной пузырчаткой. В отечественной дерматологии ввиду отсутствия коммерческих тест-систем диагностики истинной пузырчатки проведены исследования, позволяющие создать диагностические иммуноферментные методы анализа антител к антигенам эпидермиса и пузырной жидкости больных истинной пузырчаткой. Что особенно существенно, данный метод диагностики и лабораторного мониторинга в процессе лечения позволяет оценивать эффективность проводимой терапии, а также определять целесообразность продолжения поддерживающей медикаментозной терапии в стадии клинической ремиссии.
Истинную пузырчатку клинически подразделают на несколько форм: вульгарную, вегетирующую, себорейную и листовидную. Наиболее часто в дерматологической практике встречается вульгарная пузырчатка.
Дерматоз начинается с поражения слизистых оболочек полости рта и зева, а затем в процесс вовлекается кожа туловища, конечностей, волосистой части головы.
Характерно тяжелое, хроническое течение с нарушением общего состояния больного. При вульгарной пузырчатке на неизмененных кожных покровах и слизистых оболочках появляются дряблые пузыри с серозным содержимым, которые быстро (в течение 1 - 2 дней) вскрываются, образуя мокнущие эрозии с ярко-красным дном. Величина пузырей может быть различной - от мелких до крупных (диаметром 10 см и более). Важным диагностическим признаком вульгарной пузырчатки является симптом Никольского: отслойка внешне неизмененного эпидермиса при надавливании на его поверхность вблизи пузыря или на отдаленных от него участках.
Лечение истинной пузырчатки до настоящего времени вызывает большие затруднения. Поскольку основные звенья патогенеза трактуются с позиций аутоиммунной патологии, все существующие терапевтические мероприятия сводятся к иммуносупрессивным воздействиям на аутоаллергические процессы посредством использования кортикостероидных и цитостатических препаратов.
Пузырчатка является одним из немногих заболеваний, при которых назначение кортикостероидов производится по жизненным показаниям, а существующие противопоказания в этих случаях становятся относительными. Положительный эффект глюкокортикоидов объясняется прежде всего блокадой ключевых этапов биосинтеза нуклеиновых кислот и белков, выключением афферентной фазы иммуногенеза, уменьшением лимфоидных органов, разрушением средних и малых лимфоцитов тимуса, угнетением образования иммунных комплексов. Считается также, что кортикостероиды оказывают стабилизирующее влияние на мембраны лизосом и ингибируют синтез аутоантител.
В настоящее время в клинической практике для лечения больных акантолитической пузырчаткой применяют препараты, оказывающие преимущественно глюкокортикоидное действие: преднизолон, а также триамциналон (кенакорт, полькортолон), дексаметазон, бетаметазон. Больным пузырчаткой назначают высокие ударные дозы глюкокортикоидов от 60 - 100 до 150 - 300 мг/сут преднизолонового эквивалента.
Однако длительное применение кортикостероидных препаратов приводит к развитию серьезных осложнений и побочных явлений, а при быстрой их отмене возникает так называемый синдром отмены и заболевание рецидивирует.
Весьма серьезны осложнения со стороны желудочно-кишечного тракта. Изменение трофики слизистой оболочки желудка и секреторные нарушения могут привести к язвообразованию. Противовоспалительное действие кортикостероидов приводит к тому, что язвы могут не сопровождаться болевым сидромом, протекать бессимптомно вплоть до развития таких грозных осложнений, как перфорация или кровотечение.
На фоне применения кортикостероидов может возникнуть синдром Иценко - Кушинга, поддающийся обратному развитию после отмены препарата. Катаболическое действие стероидов, повышенный распад белков, развитие остеопороза увеличивают риск патологических переломов костей и возникновения асептических некрозов, спондилопатии. В ряде случаев отмечаются психические расстройства, гипокалиемия, задержка натрия, воды. Все кортикостероиды подавляют иммунную систему и могут способствовать развитию инфекционных осложнений.
Перечисленные выше осложнения требуют адекватной коррекции. Больные, получающие длительную кортикостероидную терапию, должны находиться на высокобелковой диете, им следует назначать анаболические стероиды, препараты типа тирокальцитонина (кальцитрин), в случае присоединения инфекции проводить антибиотикотерапию.
С целью профилактики синдрома отмены прекращать прием препаратов или снижать их суточную дозу рекомендуют весьма осторожно и постепенно. Так, при лечении пузырчатки по мере наступления явного улучшения суточную дозу гормона постепенно снижают, примерно 1 раз в 4 - 5 дней на 2,5 - 5 мг преднизолона до тех пор, пока не будет достигнута минимальная поддерживающая эффективная доза кортикостероида, введение которой обеспечивает ремиссию заболевания.
В дальнейшем поддерживающую дозу кортикостероидов советуют вводить попеременно. Однако периодически (каждые 4 - 6 мес) ее следует уменьшать на 2,5 мг эквивалента преднизолона. Таким образом, снижая поддерживающую дозу, можно уменьшить количество вводимого гормона в 3 - 4 раза по сравнению с первоначальной поддерживающей дозой, а иногда даже полностью прекратить лечение кортикостероидами.
Комбинированное применение цитостатических препаратов, иммуносупрессивных (сандиммун) препаратов с кортикостероидами позволяет в более короткие сроки и при меньших суточных дозах кортикостероидов добиться хороших терапевтических результатов.
Цитостатическими свойствами обладают многие препараты, например алкилирующие вещества и антиметаболиты. Из алкилирующих средств при лечении пузырчатки наиболее широко используется циклофосфамид.
Этот препарат способен вступать в реакции алкилирования с некоторыми группами белков и нуклеиновых кислот клетки, угнетать различные ферментные системы и резко нарушать жизнедеятельность клеток, прежде всего высокоактивных и лимфоидных. Антиметболиты, к которым относятся антагонисты пуриновых оснований (азатиоприн) и антагонисты фолиевой кислоты (метотрексат), напоминают по структуре естественные метаболиты клетки и, конкурируя с ними, нарушают внутриклеточный метаболизм. Следствием этого является накопление токсичных для клеток веществ, приводящее к гибели клеток, в первую очередь активно пролиферирующих.
Азатиоприн назначают в дозе 1,5 - 2 мг/кг в сутки в 2 - 4 приема в комбинации со стероидами. Метотрексат вводят по 50 мг в 2 приема или одномоментно 1 раз в неделю парентерально.
Сандиммун для лечения больных истинной пузырчаткой применяют в комплексе с кортикостероидными препаратами, причем суточная доза кортикостероидов при этом уменьшается в 3 - 4 раза и соответствует 25 - 50 мг преднизолонового эквивалента.
Суточная доза сандиммуна в комплексной терапии больных истинной пузырчаткой в стадии обострения не должна превышать 5 мг на 1кг массы тела больного и в среднем составляет 3 - 5 мг/кг в день. При этом учитывают клиническую картину, тяжесть и распространенность заболевания, возраст больного, наличие сопутствующих заболеваний.
Первые 2 дня для оценки переносимости препарата сандиммун назначают в половинной дозе, в последующем суточную дозу разделяют на 2 приема, утром и вечером с интервалом 12 ч. Снижение суточной дозы сандиммуна начинают после интенсивной эпителизации имеющихся эрозий. Обычно ударную дозу принимают в среднем в течение 14 - 20 дней с последующим постепенным снижением суточной дозы препарата до 2 - 2,5 мг на 1 кг массы тела больного. Полное очищение кожных покровов не должно считаться окончательной целью лечения.
После достижения ремиссии больному далее следует принимать минимальную эффективную поддерживающую дозу сандиммуна, которая должна подбираться индивидуально. В такой дозировке препарат можно длительно (2 - 4 мес) использовать в качестве поддерживающей терапии.
Снижение дозы кортикостероидных препаратов проводят по общепринятой схеме.
Для дополнительного лечения пузырчатки успешно применяют методы экстракорпоральной детоксикации (гемосорбция, плазмаферез).
Терапевтический эффект гемосорбции объясняется возможностью мощного направленного воздействия на иммунореактивность организма путем удаления иммуноглобулинов, комплемента, интерлейкинов, простагландинов, циркулирующих иммунных комплексов антиген - антитело или элиминацией определенных клеточных популяций и субпопуляций Т-системы иммунитета. К преимуществам гемосорбации перед другими методами лечения относится феномен постсорбционного резкого повышения чувствительности организма к лекарственной терапии, что позволяет быстро и значительно снизить дозу, а иногда и отменить кортикостероидные препараты и иммунодепрессанты у больных пузырчаткой. Гемосорбция не противопоказана пациентам, имеющим тяжелые сопутствующие заболевания (сахарный диабет, гипертиреоз, атеросклероз и др.) и пракически не сопровождается серьезными побочными явлениями.
Гемосорбция проводится по вено-венозному контуру с однократной экстракорпоральной гемоперфузией от 5 до 8 л крови при скорости кровотока через колонки с сорбентом 40 - 50 мл/мин.
Следующим методом эстракорпоральной детоксикации, заслужившим всеобщее признание и использующимся при лечении пузырчатки, является плазмаферез. Плазмаферез - обменное переливание плазмы с реинфузией собственных форменных элементов крови (эритроцитов, тромбоцитов, лейкоцитов) с интервалом 7 - 14 дней. При каждой процедуре удаляется от 500 до 2000 мл плазмы и взамен ее вводится свежая плазма донора или плазмозаменитель. Таким образом происходит удаление из крови больных пемфигусом циркулирующих аутоантител и иммунных комплексов. Наилучшие результаты отмечены у больных с тяжелыми формами пемфигуса, резистентных к высоким дозам кортикостероидов.
В последние годы получает распространение новый вид иммунотерапии, который называется фотохимиотерапией. Сущность метода заключается в экстракорпоральной фотоинактивации клеток периферической крови с помощью G-метоксипсоралена в сочетании с ультрафиолетовым облучением клеток крови и повторным введением их в кровяное русло. Результативность фотофореза очень высока за счет очищения крови от компонентов аутоиммуногенеза, токсичных веществ, патологических иммуноглобулинов.
Несмотря на успехи отечественных и зарубежных исследователей в уточнении механизмов патогенеза и совершенствования методов лечения больных истинной пузырчаткой, проблема пемфигуса остается актуальной и обусловлена тяжестью заболевания, его неизлечимостью и потенциальной летальностью.
1. Гребенников В. А., Белявский А. Д., Каминский М. Ю. Изучение иммунокорригирующего и детоксицирующего действия гемосорбции, плазмафереза и энтеросорбции при пузырчатке. Вестн. дерматол. - 1990. - № 5. - С. 33-8.
2. Матушевская Е. В. и соавт. Аутоантитела и аутоантигены при пузырчатке и пемфигоиде. Вестн. дерматол. 1995. № 5, с. 23-8.
3. Wolf R, Landau M, Tur E. Early treatment of pemphigus does not improve the prognosis. J Europen Academy Dermatol 1995;4(2):131-6.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Для цитирования: Свирщевская Е.В., Матушевская Е.В. ИММУНОПАТОГЕНЕЗ И ЛЕЧЕНИЕ ПЕМФИГУСА. РМЖ. 1998;6:6.
Ключевые слова: Пемфигус – акантолия – аутоиммунные нарушения – генетика – антигены гистосовместимости – антигены – десмоглеины – аутоантитела – толерантность – хелперы – супрессоры – глюкокортикоиды – дипроспан.
Статья посвящена тяжелому аутоиммунному заболеванию – пемфигусу. Описываются генетические основы предрасположенности к заболеванию, иммунопатология, патогенез, клинико-иммунологические особенности и лечение пемфигуса.
Key words: Pemphigus - acantholia - autoimmune disorders - genetics - histocompatibility antigens - desmogleins - autoantibodies - tolerance - helper cells - suppressors - glucocorticoids - diprospan.
The paper deals with pemphigus, a severe autoimmune disease, describes the genetic background of predisposition to the disease, its immunopathology, pathogenesis, clinical and immunological features and treatment.
Е.В. Свирщевская, канд биол. наук., старший научный сотрудник отдела иммунологии Института биоорганической химии им. М.М. Шемякина и Ю.В.Овчинникова РАН, Москва
Е.В. Матушевская, доктор мед. наук, проф. кафедры кожно-венерических болезней Российского государственного медицинского университета, Москва
E.V. Svirshchevskaya, PhD, senior research worker. Department of Immunology, Shemyakin and Ovchinikov Institute of Bioorganic Chemistry, RAS, Moscow
Ye.V. Matushevskaya, MD, Associate Professor, Department of Dermatological and Veneriological Diseases, Russian State Medical University, Moscow
П узырчатка (pemphigus) является тяжелым аутоиммунным заболеванием кожи и слизистых оболочек. Морфологической основой пузырчатки является акантолиз – нарушение адгезии между клетками эпидермиса кожи, индуцируемое связыванием аутоантител с кератиноцитами. Первые непосредственные доказательства аутоиммунной природы пузырчатки были получены в бО-х годах, когда с помощью прямой и непрямой иммунофлюоресценции было показано присутствие циркулирующих антител к антигенам эпидермиса в сыворотке крови больных, а также наличие аутоантител группы lgG в связанном виде по всей толщине эпидермиса.
Клинически пузырчатку подразделяют на несколько форм, из которых охарактеризованы две: вульгарная пузырчатка (ВП) и листовидная пузырчатка (ЛП). Наиболее часто в дерматологической практике встречается ВП.
Генетические основы предрасположенности к пузырчатке
В основе многих аутоиммунных заболеваний лежит генетическая предрасположенность. Это означает, что в процессе формирования иммунной системы индивидуума происходит дефектная селекция Т-клеток в тимусе и на периферию попадают аутореактивные клоны Т-клеток, способные распознавать комплекс аутоантиген – молекула II класса главного комплекса гистосовместимости – ГКГ (HLA-DR и HLA-DQ). Процесс селекции базируется на распознавании такого комплекса Т-лимфоцитами в тимусе и внутритимической элиминации распознающих Т-клеток. Нарушение этого процесса связано именно с особенностью молекулы ГКГ II класса, являющейся различной (полиморфной) у людей с разным генотипом, а не с особенностями аутоантигенов, набор которых более или менее стандартен. Таким образом, именно полиморфизм HLA-DR и HLA-DQ является основой генетической предрасположенности к пемфигусу (и другим аутоиммунным заболеваниям).
Характеристика антигенов вульгарной и листовидной пузырчатки
Дсг1 и ДсгЗ в эпидермисе кожи представлены с разной плотностью в различных слоях эпидермиса: по мере продвижения к поверхностому слою отношение ДсгЗ к общему десмоглеину снижается и в полностью стратифицированных кератиноцитах экспрессируется преимущественно Дсг1. Эти данные объясняют отмечающееся различие локализации пузырей при разных формах пузырчатки. Широкий скрининг распределения десмоглеинов по разным тканям показал, что Дсг1 и Дсг3 представлены только на клетках плоского слоистого эпителия. При этом антигены ВП и ЛП с разной плотностью экспрессированы в разных частях тела. Так, антиген ЛП максимально представлен в эпидермисе верхней части тела и минимально представлен на слизистой оболочке рта и нижней части тела, а антиген ВП максимально представлен в клетках слизистой оболочки рта и кожи головы.
Выделение большого количества антигена, необходимого для анализа различных аспектов патогенеза пузырчатки, оказалось невозможным. Поэтому возникла необходимость создания рекомбинантной формы антигенов пузырчатки. Уровень развития генной инженерии на настоящий момент позволяет создавать различные генные конструкции и внедрять их в геном любых клеток. Более того, возможно создание химерных молекул, состоящих из комбинации двух различных молекул. Создание рекомбинантной формы антигена позволяет использовать белок для дальнейшего изучения тонкой специфичности аутоантител. Кроме того, получение рекомбинантного белка создает базу для дальнейшего его использования в клинике, например для удаления плазмаферезом патогенных аутоантител из крови больных с помощью адсорбции на рекомбинантном белке, фиксированном на носителе.
Определение тонкой специфичности аутоантител при пемфигусе
Анализ иммуногенности различных участков молекул десмоглеинов выявил, что внеклеточный участок как Дсг1, так и ДсгЗ содержит антигенные детерминанты. Причем при ВП антигенность сохраняется и в денатурированной форме белка, т. е. антитела распознают линейную последовательность аминокислот, что позволяет тестировать сыворотки иммуноблоттингом. В отличие от ВП только часть сывороток больных ЛП распознает денатурированный Дсг1, однако все сыворотки больных с ЛП распознают антиген в нативной форме в составе кератиноцитов либо на поверхности клеток COS-1, в которые введен ген Дсг1. Сыворотки от здоровых доноров и больных пемфигоидом не распознают Дсг1 и ДсгЗ ни в нативной, ни в денатурированной форме.
Дальнейший анализ тонкой специфичности аутоантител при пемфигусе проводили с помощью рекомбинантных химерных белков, состоящих из относящихся к различным частям внеклеточного участка молекул Дсг1 или ДсгЗ и молекул глютатион S-трансферазы или b -галактозидазы, соответственно. Полученные данные показали наличие в Дсг1 не менее трех иммунодоминантных последовательностей, одна из которых (N-концевая) распознается, по-видимому, только в нативной форме, а две другие распознаются частью сывороток и в денатурированной форме. Иммуноблоттинг выявил также три основные распознаваемые аутоантителами последовательности в молекуле ДсгЗ, находящиеся в доменах 1, 2 и 4, однако патогенными свойствами обладали только антитела, распознающие N-концевой домен 1. Кроме того, в ВП и ЛП сыворотках обнаружены антитела к внутриклеточной части Дсг1, что свидетельствует о достаточно широком спектре антител при пузырчатке, из которых только часть является патогенной.
На настоящий момент ведутся работы по изучению аминокислотной последовательности иммунодоминантных сайтов Дсг1 и Дсг3 и синтезу соответствующих пептидов. Результатом этих исследований может быть разработка методы альтернативной кортикостероидам специфической терапии, базирующейся на использовании пептидов, вызывающих состояние толерантности к собственным антигенам кожи.
Клеточные основы патогенеза пузырчатки
Несмотря на генетическую предрасположенность, далеко не все индивидуумы с указанными генотипами будут страдать пемфигусом. Это связано с тем, что наряду с центральной толерантностью, устанавливаемой в тимусе, в организме функционируют также и механизмы периферической толерантности. Данных о том, как именно функционирует периферическая толерантность, пока крайне мало. Изучение механизмов нарушения состояния толерантности при пемфигусе поможет расширить наши знания по этому вопросу.
Схематически основу патогенеза пузырчатки можно представить следующим образом. Первый этап связан с активацией ауторактивных Т-клеток, о существовании которых в периферических лимфоидных органах людей с генетической предрасположенностью уже говорилось. На настоящий момент является загадкой, каким образом и какими клетками происходит сбор и представление антигена эпидермиса Т-клеткам. Наиболее вероятно, что по тем или иным причинам аутоантиген попадает в кровь, откуда уже собирается макрофагами и В-клетками. Попадание антигена в кровь может быть спровоцировано эндемичными факторами (укус черной мухи в Бразилии вызывает Fogo Selvagem – эндемичную форму ЛП), вирусными и бактериальными инфекциями, применением препаратов, содержащих сульфгидрильную группу, провоцирующую роль также играет длительное пребывание на жаре и солнце. Кроме того, в дерматологической практике известны случаи перехода других форм дерматозов, в частности дерматита Дюринга, в пузырчатку, т. е., по всей видимости, попадание антигенов кожи в кровь предшествует появлению клинической формы пемфигуса. Далее, после распознавания аутоантигена специфическими Т-клетками происходит второй этап иммунной реакции, который приводит к активации В-клеток той же специфичности. Развитие В-клеточного ответа имеет много своих закономерностей, важнейшей из которых является "созревание В-клеточного ответа", чему соответствует селекция высокоаффинных антител определенного субкласса иммуноглобулинов. Множеством работ было показано, что аутоантитела как при ВП, так и при ЛП рестриктированы главным образом антителами lgG класса и при этом наибольшей акантолитической активностью обладают антитела lgG4 субкласса, которые регистрируются в сыворотке 80 – 70% больных в состоянии обострения. Титр общих антител этого субкласса может быть относительно невысоким по сравнению с титром антител lgG1 субкласса. Однако важным является не общий титр антител lgG4 субкласса, а титр антител, специфичных к патогенному сайту десмоглеина. Их акантолитическая активность выше, чем у lgG1 антител, и они исчезают из крови больных после лечения. По всей видимости, процесс переключения В-лимфоцитов на синтез иммуноглобулинов с G1 на G4 субкласс является общим при пемфигусе и предшествует манифестации болезни.
Известно, что активированные В-лимфоциты переключаются на синтез иммуноглобулинов G4 клacca под действием интерлейкинов, продуцируемых Т-хелперами 2 типа (Th2). Таким образом, патогенность аутоантител G4 субкласса иммуноглобулинов позволяет предположить, что в патогенезе пузырчатки должны принимать участие Тh2. Прямого подтверждения участия Тh2 с использованием нативной или рекомбинантной формы антигена пока нет, однако есть данные, показывающие участие Тh2 при ВП с использованием пептидов, соответствующих иммунодоминантным сайтам ДсгЗ.
Одновременно с развитием иммунного ответа на аутоантиген по типу ответа на чужеродный (экзогенный) антиген в организме начинают функционировать и механизмы периферической толерантности. Одной из возможностей, объясняющих почему не все предрасположенные индивидуумы заболевают пемфигусом, является предположение, что в большинстве случаев происходит активация не Тh2, a Th1, не способных вызвать переключение В-клеток на синтез lgG4 субкласса. В этом случае в организме персистируют аутореактивные Т- и В-клетки, однако продуцируемые аутоантитела не вызывают акантолиза эпидермиса. Действительно, в крови 48% родственников больных пузырчаткой регистрируются аутоантитела lgG1 субкласса в низких титрах. Это предположение требует дальнейшей проверки.
Клинико-иммунологические особенности пузырчатки
Кроме участия Т-хелперов, в патогенезе пузырчатки могут быть задействованы и супрессорные/цитотоксические клетки (CD8+), распознающие антиген, представленный молекулами I класса ГКГ. Об их участии говорит тот факт, что терапия пемфигуса кортикостероидами в сочетании с сандиммуном (циклоспорином А), избирательно подавляющим функционирование Т-хелперов, эффективна только у части больных, имеющих гиперреактивный статус, т. е. высокое число Т-хелперов и CD4/ CD8 > 2,5. Больные с выраженным иммунным дефицитом и CD4/CD8 < 1,2, имеющие высокое число CD8+, поддаются лечению только высокими дозами глюкокортикоидов. Анализ фенотипических и функциональных показателей большой группы больных выявил распределение больных по трем группам: с гиперреактивным, нормальным и иммунодефицитным статусами. Самые тяжелые больные относились к третьей группе, что позволяет предположить вовлечение иммунной системы таких больных в наибольшей степени в процесс аутоиммунитета. Практически у всех больных с рецидивирующей формой пузырчатки и относительно короткими интервалами между обострениями наблюдается иммунодефицитный статус, который также усиливается приемом поддерживающей дозировки кортикостероидов. Можно предположить, что на начальной стадии болезни при ее первом проявлении в патогенез вовлечены преимущественно Т-хелперы, а затем и В-лимфоциты. Однако по мере ее прогрессирования и рецидивов многократные случаи акантолиза приводят к активации и цитотоксических клеток, следящих за внутренней "антигенной чистотой" организма и все чаще встречающих видоизмененные клетки эпидермиса.
При пузырчатке действительно наблюдается усиление клеточно-опосредованной цитотоксичности. Роль цитотоксических клеток в патогенезе пемфигуса требует дополнительного изучения.
Исходя из приведенных иммунных механизмов патогенеза и современных возможностей медицины, кортикостероиды пока являются основными препаратами в лечении пемфигуса. До начала применения кортикостероидов ВП являлась практически фатальной болезнью. Введение кортикостероидов в практику лечения пузырчатки снизило смертность среди больных с 90 до 10%. Режимы введения кортикостероидов значительно варьируют в клиниках разных стран. Так, возможно использование "мегадоз" внутривенно в течение коротких курсов (1 – 5 дней), что позволяет быстро остановить процесс и в некоторых случаях не использовать поддерживающую стероидную терапию в течение длительного периода. Аналогичным целям снижения побочных проявлений стероидной терапии служит использование различных адъювантов в сочетании с кортикостероидами. Применяемым в нашей стране традиционным схемам лечения пемфигуса посвящен обзор Е.В. Матушевской (1997).
Однако применяемые для лечения истинной пузырчатки высокие суточные дозы кортикостероидов, оказывая морбидостатическое действие, вызывают тяжелые побочные явления и осложнения, что снижает их терапевтическую ценность. В связи с этим актуальным является изучение возможности применения при истинной пузырчатке в терапевтических целях новых современных высокоэффективных кортикостероидных препаратов с минимальными побочными действиями.
Применение бетаметазона для лечения пемфигуса
1. Матушевская Е.В., Свирщевская Е.В., Кубанова А.А., Самсонов В.А., Хапилова В.И. Изучение фенотипа и функций Т-клеток больных вульгарной пузырчаткой при лечении сандиммуном и глюкокортикоидами. Вестн, дерматол. – 1995. – 6. – С. 6– 11.
2. Матушевская Е.В. Пемфигус. Рус. мед. журнал. – 1997. – Т. 5. – II. – С. 701–703.
3. Цурова З.С., Свирщевская Е.В., Вискова Н.Ю., Матушевская Е.В. Клинико-иммунологический анализ применения дипроспана для лечения пузырчатки. Вестн. дерматол. – 1997 (в печати).
4. Amagai М. Autoantibodies against cell adhesion molecules in pemphigus. J Dermatol 1994;21:833–7.
5. Stanley JR. Pemphigus. In Dermatology in General Medicine. T.B. Fitzpatrick, A.Z.Eisen, K. Wolff, I.M. Freedberg and K.F. Austen, editors. McGraw-Hill Inc., N-Y, 1993;606–15.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

