Вирус папилломы можно ли колоть гиалуроновую кислоту
Обновлено: 04.05.2024
Как охотники готовятся к охоте — изучают следы, устанавливают кормушки, размещают загонщиков, ставят стрелков на линию огня, выпускают собак — так же и иммунологи, чтобы избавить организм от вируса, поэтапно готовят и направляют процесс активации иммунной системы. Первое действие — определить мишень.
Мишень — белок вируса
Вирус папилломы, попав в клетки кожи, проявляет себя как двуликий Янус. Его геном может находиться в двух формах: или встроиться в хромосому клетки, или существовать в виде свободной молекулы — ДНК-эписомы. Если он встроился в клеточную хромосому, то при наличии предрасполагающих факторов происходит реализация программы его генома и вирус начинает размножаться. Пораженный участок превращается в папиллому, или бородавку. Причем порой это случается не на руке или ноге, а на слизистой оболочке в самых интимных местах человеческого тела. И если вирус принадлежит к особому подтипу, то лет через десять пораженные клетки, возможно, трансформируются в раковую опухоль.
Для своей успешной жизни вирус должен заставить клетку синтезировать несколько полезных ему белков. В частности, вирусу папилломы нужен белок L1, который идет на строительство оболочки новых вирусных частиц, а также белки Е6 и Е7 — они делают зараженную клетку бессмертной, это онкогенные белки.

Бороться с вирусом можно несколькими принципиально разными способами. Первый — запретить ему связываться с клетками-мишенями, второй — не дать ему в них размножаться, третий — уничтожать больные клетки вместе с вирусом. Поскольку в случае с вирусом папилломы больные клетки не содержат его в традиционном понимании — ведь после попадания в клетку от него остается одна ДНК, которая и задает синтез тех самых опасных белков, — запретить размножение нельзя. Поэтому в руках медиков остаются первый и третий способы, то есть профилактическая вакцина и терапевтическая. Недавно появился еще один — применение коротких, так называемых молчащих РНК, которые принуждают замолкнуть вирусные гены. Но движение по этому пути еще в самом начале.
Ситуация осложняется тем, что у каждого вида млекопитающих имеются свои вирусы папилломы, которые не живут в тканях других видов, а в культуре клеток вирус человека размножается чрезвычайно неохотно. В результате поиск вакцины приходится вести на мышах, а потом надеяться, что эти результаты удастся воспроизвести при испытаниях с участием добровольцев.
Большим успехом в борьбе с вирусом папилломы оказалось открытие в 1991 году интересного феномена, сделанное Чжоу Цзянем и Яном Фрэйзером, работавшими в брисбенском госпитале им. принцессы Александры, Австралия (Яна Фрэйзера в ноябре 2008 года наградили за эту работу итало-швейцарской премией фонда Бальцана в размере 1 млн швейцарских франков. — Примеч. ред.). Они обнаружили, что белки L1 самопроизвольно собираются в вирусоподобные частицы (ВПЧ) даже если внутри них нет никакого генетического материала. Такие белки очень просто и в больших количествах можно синтезировать с помощью дрожжей, встроив в них нужный ген. Из дрожжей они выходят уже в виде готовых частиц, причем их иммунногенные свойства такие же, как и у настоящего вируса. Если ВПЧ ввести в организм, то в нем начнут вырабатываться защитные антитела. Во многих экспериментах такая защита доказала свою надежность, и спустя одиннадцать лет после открытия большой эксперимент с участием 1533 добровольцев показал, что подобная вакцина от вируса папилломы человека подтипа 16 (HPV16), во-первых, вполне безопасна, а во-вторых, обеспечивает полную защиту организма. Этот результат важен еще потому, что именно на подтипы 16 вместе с 18, 31 и 45 приходится 80% всех случаев опухолевого перерождения пораженной вирусом ткани, прежде всего рака шейки матки. За оставшиеся 20% ответственны еще 13 разновидностей этого вируса. За шесть лет, прошедшие с начала эксперимента с участием добровольцев, действие вакцины не ослабло — ни одного случая заражения вирусом среди них зафиксировано не было.
В 2006 году компания «Merck» первой получила разрешение на продажу на территории США и Европы профилактической вакцины «Gardasil», которая защищает от папиллома-вирусной инфекции подтипов 6, 11, 16, и 18. Вакцинацию врачи рекомендуют проводить девочкам в возрасте от 9 до 26 лет. В 2007 году компания «GlaxoSmithKline» получила разрешение на вакцину «Cervarix», которая защищает от 16 и 18 подтипов вируса папилломы.
Пептидные пули
Однако это все — профилактические вакцины, причем пока неизвестно, сколь быстро иммунная система забудет о той информации, которую она получила в момент прививки. Поэтому огромный интерес вызывает терапевтическая вакцина, которая уничтожает уже зараженные клетки.
Для ее создания иммунологи надеются использовать столь яркий след вируса, как те самые два белка, Е6 и Е7. Они обязательно должны быть на поверхности заболевших клеток, и, стало быть, задача состоит в том, чтобы научить клетки-киллеры находить эти следы.
Многие лаборатории в мире соревнуются на этом поприще, ведь цена победы очень велика. Для возбуждения иммунного ответа применяют и сами Е-белки, и их пептидные фрагменты (Т-эпитопы), и химерные конструкции из Е- и L-белков. (Напомним, что вещества, которые возбуждают иммунный ответ, называются антигенами.) Для усиления ответа в вакцину добавляют цитокины, белки теплового шока и другие стимулирующие элементы.
Непременный компонент вакцины — вектор, который обеспечивают доставку антигенов — Е-белков или их пептидных фрагментов — в специальные клетки иммунной системы (макрофаги, дендритные клетки), после чего те начинают вырабатывать особые белки цитокины и давать инструкции клеткам-киллерам, что им, собственно, надо уничтожать. Векторами для антигенов папилломавируса в разных опытах служили вирус осповакцины, аденовирус, альфавирус, бактерии. Надо отметить, что дендритные клетки — самые активные партнеры для возбуждения сильного иммунного ответа, поэтому желательно, чтобы антигены попадали именно в них.
Вот почему большое внимание уделяют химерным конструкциям на основе белков теплового шока, то есть содержащим и Е-белок, и белок-усилитель иммунного ответа. Белок теплового шока имеет сродство к дендритным клеткам. Именно таким методом в модельных экспериментах удалось уже при однократной иммунизации зафиксировать уменьшение размера опухоли. Сейчас несколько кандидатов в терапевтические вакцины находятся на различных проверочных стадиях, но в отличие от профилактических вакцин пока ни одна из них не дала приемлемой эффективности. Возникает мысль, что успеха можно достичь, совершенствуя все части вакцины: пептидные фрагменты, которые наиболее правильно повторяют Т-эпитопы Е-белка, вектор для направленной доставки вакцины в дендритную клетку, стимулятор иммунного ответа, а также носитель вакцины, на котором все это держится.
Работу по реализации программы «Комбинированная вакцина к HPV 16, 18 и 31», которую под руководством академика РАМН М. Р. Хаитова вели коллективы двух институтов — Института иммунологии и ГОСНИИГенетики, мы начали с компьютерных расчетов. Чтобы проводить такое исследование, надо иметь хорошие инструменты — набор специфических антител к различным типам вируса, референс-препараты (вирусные белки), чтобы было с чем сравнивать получаемые продукты. В России ничего из этого купить было нельзя, и даже в США невозможно было купить антитела к некоторым L1-белкам — ни одна фирма их не делала для продажи. И здесь нам здорово помог профессор Нейл Кристенсен из Медицинского центра Милтон Херши в Пенсильвании, предоставив микрообразцы некоторых рекомбинантых белков и моноклонов. Но многое пришлось синтезировать самим, в том числе антитела к белкам L1 и Е7 трех типов и к различным их участкам, которые рассчитывались по компьютерным алгоритмам. Все пептиды синтезировали химическим путем твердофазным методом, их было около 20 штук. Такие пептиды для организма безопасны, и синтезировать их несложно, однако иммунная система недостаточно активно на них реагирует — чистые пептиды почти не индуцируют антител. Поэтому приходится их соединять, во-первых, с носителем, а во-вторых, добавлять вещества, которые стимулируют иммунную систему. В качестве носителей использовали гемоцианин (огромный белок из улитки) «полиоксидоний» на основе которого ранее была создана вакцина «Гриппол» (см. «Химию и жизнь», 2005, № 5. — Примеч. ред.), и некоторые другие стимуляторы.
Параллельно в ГОСНИИГенетики был налажен синтез в дрожжах белков L1 трех типов (с одним из них была проблема), который собирался в правильные вирусоподобные частицы и правильно реагировал с антипептидными антителами и референс-моноклональными антителами.
Ответы на разные пептиды сильно отличались, и эти эксперименты позволили выявить наиболее эффективные фрагменты как белка L1, так и Е7. Окончательная проверка показала, что если в качестве носителя-адъюванта к этим пептидам использовать гемоцианин улитки или специальный иммуностимулятор ПМ, то реакция иммунной системы будет наиболее сильной. Самое главное, что при этом вырабатывается сильный иммунный ответ к L1, а также активируются популяции специфических клеток-киллеров, так называемые цитотоксические Т-клетки CD8 + . Именно они должны уничтожать зараженные клетки. Фактически, полученные данные дают основание считать, что нам удалось создать отдельные компоненты прототипа комбинированной вакцины, профилактической и терапевтической. Пока это еще не вакцина, препарат надо испытывать на приемлемой биологической модели, например на мышах с перевиваемой опухолью, вызываемой онкогенным белком Е7. Причем полученные вакцинные препараты скорее ориентированы на профилактику, поскольку уже доказано, что белок L1 генерирует сильный защитный ответ даже в отсутствие адъюванта.
Пептиды — слабые иммуногены, в этом мы убедились, сделав конъюгат одного пептида из белка Е7 со стандартным адъювантом Фрейнда. Активировать Т-клетки таким путем непросто, и, вероятно, нужно менять тактику. Прежде всего для этого требуется обеспечить целевую доставку пептидных антигенов из Е-белка в дендритные клетки, чтобы достичь специфической и сильной активации киллерных CD8 + лимфоцитов.
И тогда мы решили применить новый подход: использовать как усилитель доставки фуллерены, высокая клеточно-проникающая способность которых хорошо известна, и добавить вектор, который бы направлял их в дендритные клетки. Для этого пришлось заняться работой, не имеющей прямого отношения к созданию вакцины: определить иммуногенность фуллерена и их производных с аминокислотами и пептидами, а также их способность проникать внутрь клеток. И здесь мы получили очень интересные результаты.
Фуллерен и жизнь
О токсичности фуллеренов сказано уже немало, причем есть две противоположные точки зрения: «они чрезвычайно вредны» и «они весьма полезны». Не исключено, что появлению столь разных точек зрения способствуют особенности физико-химических свойств фуллеренов, а именно то обстоятельство, что они в силу своей гидрофобности не растворимы в воде. В результате, чтобы приготовить препарат и ввести его, например, в кровь подопытному животному, молекулу фуллерена нужно как-то модифицировать: присоединить к ней гидрофильные группы или добавить в раствор поверхностно-активные вещества, способные подавить гидрофобность фуллеренов. Эти компоненты могут обладать специфической химической активностью, они оказываются сами по себе токсичными, что вполне способно привести к выводу о токсичности самого фуллерена. И такие случаи широко известны. Например, один из весьма авторитетных специалистов по изучению биологического действия фуллеренов, Г. В. Андриевский из Института терапии АМН Украины, доказал, что данные, приведенные в наиболее часто цитируемой статье о токсичности фуллеренов, связаны именно с артефактом: в изучаемой фуллеренсодержащей жидкости присутствовало токсичное вещество — тетрагидрофуран. Сам же Г. В. Андриевский известен тем, что сумел создать методику получения довольно концентрированного раствора (наносуспензии) фуллерена в воде.
Проблема токсичности фуллеренов и прочих наночастиц давно уже стала весьма актуальной. Сразу же за открытием фуллеренов среди ученых распространилась идея, что эти молекулы могут пригодиться в качестве средства для транспортировки лекарственных препаратов. Сейчас синтезированы сотни соединений фуллеренов, многие из них проявляют биологическую активность, однако до создания коммерческих препаратов дело не дошло. Возможно, потому, что у них нет особых преимуществ по сравнению с нефуллереновыми аналогами, а возможно — из-за недостаточно глубокого понимания механизмов метаболизма фуллеренов и их взаимодействия с живыми клетками.
Однако из-за развития нанотехнологий практически неизбежно возникают условия для загрязнения окружающей среды этими весьма стойкими соединениями, масштаб производства которых возрастает. Пора решать вопрос об опасности или безопасности фуллеренов в том числе и об иммунологической безопасности. Прежде всего речь идет о способности фуллеренов вызывать иммунный ответ, например аллергию.
Безразличный фуллерен
В своих опытах мы использовали кристаллический фуллерен, называемый фуллеритом, наносуспензию гидратированого фуллерена Андриевского, а также соединения фуллерена со всевозможными аминокислотами, пептидами и белками. При этом аминокислоты присоединялись непосредственно к шарику фуллерена. Способ получения таких производных разработали еще в 1994 году в ИНЭОС РАН им. А. Н. Несмеянова. Там же в содружестве с Институтом проблем химической физики РАН был создан еще один функциональный фуллерен, который очень быстро пришивается к пептидам и белкам, содержащим аминокислоту цистеин. Для чего нужно было получать столь сложные соединения?
Дело в том, что еще 12 лет назад мы уже пытались вызвать у мышей специфический иммунный ответ на чистые фуллерены и их аминокислотные производные и нисколько не преуспели в этом деле. Однако в 1998 году появились сведения, что одной американской группе удалось-таки добиться иммунного ответа на фуллерен в присутствии сильного иммуностимулятора. В своих опытах мы как раз и хотели проверить этот результат, а в качестве иммуностимуляторов взяли известные аллергены вроде яичного и сывороточного альбумина. Однако результат оказался тем же: никакого специфического ответа на собственно фуллерен замечено не было. Зато мы обнаружили хорошо выраженную реакцию на аминокислоты, пришитые к фуллерену. (На чистые аминокислоты ответ вообще не развивается, организм к ним толерантен.)
Отсутствие иммунной реакции на фуллерен можно объяснить следующим образом. Теоретически в водной среде молекулы гидрофобного фуллерена не могут существовать в одиночном состоянии, а собираются в кластеры из десятков, а то и сотен молекул. Попав в живой организм, эти кластеры должны взаимодействовать с гидрофобными компонентами среды и электронодонорными молекулами — белками, жирами или аминами. В результате углеродная сфера может быть полностью закрыта этими молекулами, и тогда она не способна связываться с рецептором В-лимфоцита, который дает сигнал на развитие иммунного ответа. Впрочем, само по себе наличие у В-клеток специфического рецептора на фуллерен вызывает серьезные сомнения. Фуллерены как искусственные молекулы получены совсем недавно, в 1991 году, и в процессе эволюции организмы с ним не могли контактировать, следовательно, вряд ли существуют клеточные клоны, распознающие такие молекулы. Как показали работы по созданию углеродных эндопротезов еще в 1979 году, антитела к другим формам углерода — графиту и алмазу получить невозможно. Хотя известен такой фермент, как протеаза ВИЧ, чей активный центр имеет гидрофобную полость: фуллерен (с гидрофильной подвеской) хорошо ее заполняет и тем самым блокирует активность вируса. Но рецепторы на В-лимфоците для улавливания чужеземцев располагаются снаружи, то есть обращены в водную среду, имеют гидрофильную природу и вряд ли будут захватывать фуллерен.
Как нож в масло
Если фуллерен не вызывает иммунного ответа, то может ли он как-то повредить клетку? Ответ на этот вопрос дает серия опытов, проведенная нами с эритроцитами, тромбоцитами человека и симбиосомами — продуктами симбиоза бобовых растений с азотфиксирующими бактериями рода Rhizobium. О том, что фуллерен проник внутрь симбиосомы можно судить по заряду ее мембраны. В присутствии АТФ и ионов магния она способны генерировать на внутренней стороне своей мембраны положительный заряд. Фуллерены с пришитыми аминокислотами пролином или аминокапоновой кислотой — отрицательно заряжены. Попав внутрь симбиосомы, они нейтрализуют заряд на мембране, что можно зафиксировать спектральными методами, используя специальные зонды. Как оказалось, процесс этот весьма быстрый: при добавлении раствора с производными фуллерена, мембрана клетки моментально теряла накопленный ею потенциал.
Фуллерен с другой кислотой, аргинином, наоборот, приобретает положительный заряд, и поэтому его влияние на симбиосому заметить не удалось. Зато оно проявилось на эритроцитах, мембрану которых заряжали отрицательно с помощью валиномицина (из клетки при этом выходит K + ): при добавлении C60-Arg происходила быстрая разрядка потенциала.
Изменение потенциала мембраны оказалось не единственным эффектом. Есть такой флуоресцентный краситель — акридин оранжевый. Он меняет свое свечение при изменении кислотности среды. С его помощью удалось дополнительно подтвердить, что аминокислотные производные фуллеренов в самом деле легко проникают внутрь клеток и меняют кислотность среды.
Мы подтвердили также, что фуллерены легко проникают в разные типы клеток. Например, в тромбоцитах много кальция, поэтому изучать транспорт фуллерена можно с помощью другого красителя, хлортетрациклина, свечение которого зависит от концентрации ионов кальция: если фуллерен с ним взаимодействует, то гасит это свечение. Так оно и вышло: при добавлении к тромбоцитам, нагруженным хлортетрациклином, фуллеренов, в том числе и фуллерена Андриевского, наблюдалось тушение флуоресценции. Правда, оказалось, что фуллерен Андриевского входит в клетку в сто раз медленнее, чем с аминокислотными производными.
Итак, установлено, что фуллерен благодаря своей гидрофобности достаточно свободно проходит сквозь липидную мембрану клетки. Отсюда появляется идея, которая уже у многих на слуху: фуллерен с закрепленным пептидом может протащить его внутрь клетки. А это значит: он может служить отличным средством доставки пептидов в дендритные клетки иммунной системы.
Чтобы проверить этот предположение, мы, во-первых, присоединили к фуллерену найденные на предыдущем этапе пептиды белка Е7, вызывающие наибольший иммунный ответ. Во-вторых, синтезировали носитель для вакцины на основе сополимера винилпирролидона и малеинового ангидрида, к которому были присоединены цепочки жирных кислот. К этим гидрофобным хвостам за счет ван-дер-ваальсовых связей и цеплялись молекулы фуллеренов с пептидами. Результат оказался очень неплохим уже в первом эксперименте. Препарат действительно вел себя, как и положено терапевтической вакцине, генерировал специфические Т-клетки и антитела. Но пока что нам не удалось детально проследить механизм его действия. К сожалению, из-за прекращения финансирования эту работу пришлось прервать. Хотя мы и не теряем надежды на продолжение, но время упущено, а зарубежные исследователи не стоят на месте.
Остроконечные кондиломы (синонимы: condylomata acuminate, вирусные кондиломы, остроконечные бородавки, генитальные бородавки) относятся к заболеваниям, вызываемым вирусом папилломы человека (ВПЧ). Заболевания, обусловленные ВПЧ, являются одними из на

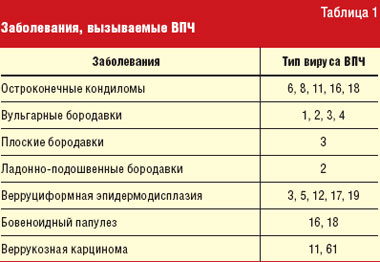
Остроконечные кондиломы (синонимы: condylomata acuminate, вирусные кондиломы, остроконечные бородавки, генитальные бородавки) относятся к заболеваниям, вызываемым вирусом папилломы человека (ВПЧ). Заболевания, обусловленные ВПЧ, являются одними из наиболее распространенных заразных вирусных инфекций человека. ВПЧ представляет собой небольшой округлый двухспиральный ДНК-вирус диаметром от 50 до 55 нм. На сегодняшний день описано более 80 типов ВПЧ (табл. 1). Инфекции, вызываемые ВПЧ, высокоспецифичны для эпидермиса, так как ВПЧ обладает тропизмом к эпителиальным клеткам кожи и слизистых оболочек.
За последние 20 лет отмечается рост заболеваемости остроконечными кондиломами. В США остроконечные кондиломы (или генитальные бородавки) относятся к наиболее часто встречающимся заболеваниям, передающимся преимущественно половым путем. Заболеваемость остроконечными кондиломами превышает 106,5 случая на 100 тыс. населения США, что составляет около 0,1% всей популяции [1]. Пристальное внимание к этому заболеванию объясняется тем, что некоторые из типов ВПЧ, которые вызывают остроконечные кондиломы, могут приводить к малигнизации процесса. Наиболее потенциально опасными являются типы 16 и 18. Неслучайно важно своевременно диагностировать и лечить остроконечные кондиломы. Рецидив остроконечных кондилом не всегда связан с повторным заражением, а может быть вызван реактивацией вируса.
Клиническая картина. Инкубационный период продолжается от 3 нед до 6 мес и в среднем составляет около 2,8 мес. Мужчины и женщины одинаково подвержены этому заболеванию. Средний возраст заболевших колеблется от 22 до 25 лет.
Обычно остроконечные кондиломы локализуются на половых органах и в перианальной области. У ВИЧ-инфицированных пациентов остроконечные кондиломы могут локализоваться в необычных местах, например на лице, веках и ушных раковинах. У мужчин наиболее частая локализация — пенис, уретра, мошонка, перианальная, анальная и ректальная области [2]. Элементы сыпи имеют телесный цвет, могут быть представлены гладкими папулами размером с булавочную головку и на начальных этапах развития не всегда заметны на половом члене. Для их выявления проводят пробу с 5% уксусной кислотой. После обработки кожи окраска папул становится белесоватой. В дальнейшем папулы разрастаются и приобретают бородавчатую или нитевидную форму, напоминая цветную капусту или петушиный гребень. Как правило, остроконечные кондиломы множественные и располагаются группами.
У женщин клиническая картина остроконечных кондилом может быть разнообразной. Классические экзофитные поражения на наружных половых органах носят распространенный характер и легко выявляются при осмотре, однако могут быть и случайными находками при проведении кольпоскопии или ректороманоскопии. На малых половых губах и в преддверии влагалища кондиломы представляют собой влажные, бархатистые или множественные пальцеобразные разрастания и занимают значительную площадь. Кондиломы в цервикальном канале обнаруживаются у 20% женщин, инфицированных ВПЧ и с локализацией остроконечных кондилом на наружных половых органах. Локализация остроконечных кондилом на шейке матки или в цервикальном канале считается неблагоприятным фактором, так как может способствовать развитию рака шейки матки [3].
Даже при своевременном и рациональном лечении остроконечные кондиломы часто рецидивируют. Это связано с тем, что вирус длительное время может сохраняться в инактивированном состоянии во внешне здоровых участках кожи и слизистых оболочках.
Дифференциальный диагноз остроконечных кондилом проводится со вторичным сифилисом (широкие кондиломы), контагиозным моллюском, бовеноидным папулезом, блестящим лишаем, красным плоским лишаем, ангиокератомами, ангиофибромами на венечной борозде головки полового члена, фолликулитами, мягкой фибромой, волосяной кистой (табл. 2).
Диагностика остроконечных кондилом, как правило, клинически не представляет трудности. Дополнительно в некоторых случаях проводят пробу с 5% уксусной кислотой. Для этого смоченную раствором медицинскую салфетку располагают в зоне предполагаемой локализации остроконечных кондилом на 5–10 мин, после чего высыпания приобретают белесоватый оттенок [4].
При установлении диагноза остроконечных кондилом необходимо проводить обследование на сифилис и ВИЧ-инфекцию.
Проведение биопсии показано тем больным, у которых возникает подозрение на предраковые заболевания или плоскоклеточный рак. Удаление остроконечных кондилом не снижает риск развития рака шейки матки. Поэтому всем женщинам, у которых в анамнезе имелись сведения об остроконечных кондиломах, необходимо ежегодно проводить цитологическое исследование мазков с шейки матки с целью своевременного выявления онкологического процесса.
Лечение и профилактика
Использование презервативов снижает риск заражения половых партнеров. Полностью удалить ВПЧ невозможно — можно лишь удалить остроконечные кондиломы, облегчив состояние больного и снизив риск заражения полового партнера. Существует несколько методов лечения остроконечных кондилом. Все они имеют определенные недостатки.
Криодеструкция — один из наиболее часто применяемых методов лечения. Пораженную поверхность обрабатывают жидким азотом с помощью ватного тампона или распылителя. Обработку повторяют каждые 1–2 нед до полного удаления всех кондилом. Метод редко приводит к рубцеванию, отличается невысокой стоимостью. Криодеструкция может вызывать сильную боль. Не всегда можно одномоментно обработать всю пораженную поверхность. В некоторых случаях после криодеструкции может развиваться гиперпигментация или гипопигментация.
Диатермокоагуляция является болезненным методом лечения и оставляет после себя стойкие рубцы, поэтому применяется только для удаления одиночных кондилом.
Удаление лазером осуществляется с помощью углекислотного и неодимового ИАГ-лазеров (лазеров на иттрий-алюминиевом гранате). После удаления могут оставаться рубцы.
Медикаментозные методы лечения. Кондилин (подофиллотоксин) — 0,5% раствор во флаконах по 3,5 мл с аппликатором. Компонент Кондилина подофиллотоксин — наиболее активный в составе растительного экстракта подофиллина, при местном применении он приводит к некрозу и деструкции остроконечных кондилом. Преимущество данного метода лечения состоит в том, что больной может самостоятельно обрабатывать пораженные участки кожи в доступных местах. С помощью пластикового аппликатора препарат наносится на кондилому; постепенно смачиваются все кондиломы, но не более 50 штук за 1 раз (по площади не более 10 см2). Препарат нужно наносить с осторожностью, избегая здоровых участков кожи. Первый раз обработку проводит врач или медсестра, обучая пациента правильно наносить препарат. После обработки препарат должен высохнуть, чтобы не возникло раздражения окружающей кожи или ее изъязвления. Кондилин наносят 2 раза в день в течение 3 дней, а затем делают 4-дневный перерыв. Продолжительность лечения не должна превышать 5 нед. Противопоказанием для применения препарата являются беременность, лактация, детский возраст, применение других препаратов, содержащих подофиллин.
Солкодерм представляет собой смесь кислот: 65% азотной, 98% уксусной, а также молочной и щавелевой кислоты и нитрата меди; выпускается в виде раствора (ампулы по 0,2 мл). После его нанесения на поверхность кожи она окрашивается в желтый цвет, после чего происходит мумификация обработанных тканей. Обработку должен осуществлять медицинский персонал. Препарат наносится на поверхность с помощью стеклянного капилляра или аппликатора, после чего препарат должен высохнуть. Одномоментно допускается обработка площади не более 4–5 см2. При необходимости обработку можно повторить через 4 нед. Нанесение препарата может сопровождаться сильным жжением и болью, в некоторых случаях может возникнуть гиперпигментация и образование рубцов.
Препараты интерферона вводят непосредственно в остроконечные кондиломы. Процедура болезненна и требует проведения повторной обработки.
Трихлоруксусная кислота в концентрации 80–90% наносится непосредственно на кондиломы. Остатки ее удаляют с помощью талька или бикарбоната натрия. При необходимости лечение повторяют с интервалом в 1 нед. Если после 6-кратной обработки остаются остроконечные кондиломы, то необходимо сменить метод лечения.
Литература
- K. R. Beutner, T. M. Becker, K. M. Stone. Epidemiology of HPV infections // J. Am. Acad. Dermatol. 1988; 18: 169–172.
- S. M. Syrjanen et al. Anal condylomas in men // Genitour. Med. 65: 1989; 216–224.
- M. J. Campion. Clinical manifestations and natural history of genital human papillomavirus infection // Obstet. Gynecol. Clin. North. Am. 1987; 14: 363–388.
- Д. Е. Фитцпатрик, Д. Л. Элинг. Секреты дерматологии // М.: ЗАО «Издательство БИНОМ», 1999. 511 с.
Л. П. Котрехова, кандидат медицинских наук, доцент
К. И. Разнатовский, доктор медицинских наук, профессор
СПбМАПО, Москва
Поражения кожи и слизистых, обусловленные вирусами папилломы человека (ВПЧ), человечеству известны давно. Особую актуальность папилломавирусная инфекция (ПВИ) приобрела в конце ХХ века в связи с ее широким распространением. Если в 1981-1986 гг. частота кондиломатоза составляла 5,4%, то в 1987-1990 гг. она возросла до 19,1 % [1]. В настоящий момент инфицированность ВПЧ лиц молодого и среднего возраста составляет 20-60%. По данным Центра по контролю за инфекционными заболеваниями (Атланта, США), до 20 млн американских граждан болеют генитальными бородавками, причем ВПЧ встречаются в 3 раза чаще, чем генитальный герпес, и не реже гонореи. Считается, что 20% злокачественных опухолей у женщин и 10% у мужчин обусловлены ВПЧ. Показано, что современное лечение не позволяет избежать рецидивирования ПВИ в 20-30% случаев [1, 2].
Инфекция передается преимущественно половым путем, при медицинских манипуляциях, вертикальным путем, во время беременности, а также при прохождении новорожденного через инфицированные родовые пути матери. Инкубационный период составляет 1-6 месяцев, максимальное содержание вируса в пораженных тканях обнаружено на шестой месяц.
Различают порядка 100 типов ВПЧ, они обладают видовой и тканевой специфичностью, способны инфицировать клетки плоского эпителия и проявлять внутри них репликативную активность. Кроме того, ВПЧ обнаруживаются на коже, слизистых оболочках полости рта, конъюнктивы, пищевода, бронхов, гортани, прямой кишки, половых органов. Полная репликация вирусов происходит только в ядрах высокоспециализированных клеток многослойного плоского эпителия: зернистых, шиповидных клеток кожи, поверхностных эпителиоцитов слизистых оболочек. Следствием инфицирования является развитие доброкачественных или злокачественных неоплазий.
Наиболее часто урогенитальный тракт поражают ВПЧ-6, -11, -16, -18, -31, -35 типов. На основании способности ВПЧ индуцировать неопластические процессы их принято подразделять на разновидности низкого (ВПЧ-6, -11, -42, -43, -44), среднего (ВПЧ-31, -33, -35, -51, -52, -58) и высокого (ВПЧ-16, -18, -45) онкологического риска [3]. В последнее время с раком цервикального канала шейки матки (95% случаев) связывают 15 типов ВПЧ. Среди них наиболее часто выявлются ВПЧ-16 (50% случаев) и ВПЧ-18 (10% случаев), в связи с чем женщины с подтвержденной ПВИ должны ежегодно проходить осмотр у гинеколога с кольпоскопией, цитологическим исследованием цервикальных мазков, вирусологическое и иммунологическое обследование. Считают, что в 50% случаев ПВИ выводится из организма женщины в течение 1 года, а в 85% случаев - в течение 4 лет [3]. Папилломавирусы - единственная группа вирусов, для которых доказано, что они индуцируют образование опухолей у человека в естественных условиях. В последние годы показана связь ВПЧ с дисплазией и плоскоклеточным раком шейки матки [4].
Существенной особенностью ВПЧ является их способность переключаться с непродуктивного типа инфекции на продуктивный и наоборот. В первом случае вирус реплицируется синхронно с клеткой и не приносит ей вреда. Во втором случае он быстро размножается и лизирует клетку, высвобождая множество новых вирионов, способных инфицировать другие клетки. Показано, что ВПЧ могут оказывать различное действие на слизистую. Так, проявлением продуктивного воздействия являются папилломы и кондиломы, а результатом трансформирующего действия могут быть внутриэпителиальные поражения (дисплазия, инвазивный рак) [4].
При ПВИ, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния (ИДС), обусловленные недостаточностью различных звеньев иммунной системы, поэтому для повышения эффективности лечения в схемы терапии необходимо включать иммунокорригирующие препараты, а также патогенетические средства, которые облегчают состояние пациента и способствуют более действенному применению используемых лекарств.
Лечение ПВИ остается довольно трудной задачей, несмотря на значительный арсенал средств и методов терапии. Поскольку полного излечения к настоящему времени достичь невозможно, считается, что целью проводимых лечебных манипуляций должна быть не элиминация возбудителя, а перевод инфекции в стадию устойчивой ремиссии (клинического выздоровления). В связи с этим предлагается следующая тактика ведения пациентов с ВПЧ-инфекцией [2]: 1) разрушение папилломатозных очагов; 2) стимуляция противовирусного иммунитета; 3) сочетание этих подходов. В основе местного лечения лежит удаление кондилом и измененных участков эпителия: деструктивные методы (физические и химические), цитотоксические препараты. Эффективность лечения кондилом составляет 50-94%, уровень рецидивирования в течение 3 месяцев после лечения 25%. Вероятно, одной из причин рецидивов является наличие латентных вирусов в клетках здоровой кожи и слизистых оболочек в зоне, прилегающей к очагу поражения.
В комплексной терапии ПВИ аногенитальной области использовали после удаления папиллом противовирусные препараты в сочетании с отечественным иммуномодулирующим препаратом «Галавит» (ЗАО «Центр современной медицины Сэлвим», Россия). Активным компонентом препарата Галавит является производное фталгидразина. Галавит оказывает действие на моноцитарно-макрофагальное звено иммунитета, регулирует синтез провоспалительных цитокинов (ИЛ-1, ИЛ-6, α-ФНО), восстанавливает работу Т-лимфоцитов и цитотоксическую активность естественных киллеров, стимулирует синтез интерферонов и повышает неспецифическую резистентность организма 6. Галавит показал хорошую терапевтическую эффективность при лечении ряда вирусных и бактериальных инфекций, вторичных иммунодефицитных состояний различного генеза 6.
Под наблюдением находилось 150 больных обоего пола с ПВИ аногенитальной области в возрасте от 19 до 50 лет. Диагностика проводилась на основании характерных клинических проявлений заболевания, цитологического исследования мазков и результатов ПЦР. В 45% случаев ВПЧ не удалось идентифицировать. У 120 больных при определении типа ВПЧ получили следующие результаты: у 40% - ВПЧ-11 типа, у 7% - ВПЧ-16, у 4% - ВПЧ-6 и у 3% - ВПЧ-18 типа. Клинически чаще регистрировали такие формы ПВИ, как остроконечные кондиломы, папилломы и плоские бородавки. Анализ иммунограммы до лечения показал уменьшение числа клеток CD4 + натуральных киллеров, снижение уровня трансферрина (ТФ), повышение уровня церулоплазмина (ЦП). Для оценки неферментативной антиоксидантной активности определяли соотношение ТФ/ЦП. Выявлено снижение синтеза интерферонов-α/ß (ИФН) и ИФН-γ(табл.).
Лечение проводили в 2 этапа. Сначала с помощью химической деструктивной терапии удаляли папилломатозные элементы. Вторым этапом проводили противорецидивный курс Галавита (системно и местно) у 50 больных (36 женщин и 14 мужчин). Галавит назначали внутримышечно по следующей схеме: 200 мг - 1-й день, 100 мг - 2-й день, а с 3-го дня по 100 мг через 48 часов, курс 10-15 инъекций. Одновременно на места бывших поражений наносили 1%-ную мазь «Галавит» ежедневно 5-10 дней.
50 больных группы 1 клинического контроля (32 женщины и 18 мужчин) с аналогичной патологией получали ликопид (глюкозаминилмурамил дипептид) по 10 мг 1 раз в день по общепринятой схеме, 50 больным контрольной группы 2 (35 женщин и 15 мужчин) были назначены ректальные свечи виферон-3 по стандартной схеме.
Таблица. Иммунологические показатели у больных ПВИ, леченных Галавитом
| Показатели иммунограммы | Норма | До лечения | После лечения |
| CD4, % | 5-48 | 29,5±2,8 | 46,2±3,0* |
| NK-клетки, % | 9-16 | 5,2±0,38 | 13,4±2,3* |
| ТФ, г/л | 2,344±0,048 | 1,731±0,032 | 2,311±0,035* |
| ЦП, г/л | 0,398±0,015 | 0,473±0,008 | 0,395±0,022 |
| К=ТФ/ЦП | 6,0 | 3,68 | 5,9* (ув. на 60%) |
| Циркулирующий IFN в сыворотке крови, МЕ/мл | 12-25 | 27,2±1,0 | 20,2±0,5 |
| Продукция IFN in vitro (МЕ): - IFNa/b - IFNg | 85-250 45-110 | 76,0±6,2 35,1±4,1 | 215,8±7,4* 72,2±2,4* |
После лечения Галавитом проявления ПВИ разрешались в среднем в течение 8,8±0,6 дня. Эпителизация у больных контрольных групп 1 и 2 наступала позднее (в течение 11,1±0,8 дня и 12,4± 0,7 дня соответственно). Проведенные через 30-35 дней после окончания курса лечения исследования методом ПЦР выявляли ВПЧ достоверно реже на фоне применения Галавита: у 6 (12%) больных, леченных Галавитом, у 14 (28%) больных контрольной группы 1 и у 27 (54%) больных контрольной группы 2.
Комплексное лечение ПВИ наряду с клиническим эффектом оказывало положительное влияние на показатели иммунного статуса пациентов. Так, после курса Галавита достоверно возросло число клеток CD4 + и натуральных киллеров, нормализовались показатели ТФ и ЦП и соотношение ТФ/ЦП. Это важно, ибо ТФ и ЦП относятся не только к основным металлопротеинам, которые характеризуют антиоксидантный потенциал сыворотки крови, но являются важными факторами неспецифической резистентности организма. Восстанавливается способность лейкоцитов синтезировать эндогенные ИФН-α, в и ИФН-γ, что говорит о повышении функциональной активности иммунокомпетентных клеток.
В заключение следует отметить, что использование Галавита в комплексной терапии ПВИ у больных с изначально рецидивирующим течением заболевания позволяет снизить частоту рецидивирования с 50% до 12%. Препарат Галавит оказывает иммунокорригирующее действие, увеличивает содержание лимфоцитов CD4 + и натуральных киллеров, восстанавливает антиоксидантный потенциал сыворотки крови и повышает неспецифическую резистентность организма.
Список использованной литературы
Статья посвящена папилломавирусной инфекции (ПВИ) - одной из самых распространенных вирусных инфекций, передаваемых половым путем. Представлены сведения о биологии вируса, путях заражения, патогенезе, клинических проявлениях инфекции. Рассматриваются различные клинические формы заболевания: манифестные - остроконечные кондиломы (аногенитальные бородавки), субклинические (интраэпителиальная неоплазия) и латентные. Обсуждаются подходы к лечению лечения ПВИ, включающие деструктивные (физические, химические), хирургические, иммунологические и комбинированные методы. Приводятся доказательства эффективности применения препарата Изопринозина - иммуномодулятора с противовирусной активностью при различных формах ПВИ, изученного в многочисленных зарубежных и отечественных исследованиях.
Ключевые слова: папилломавирусная инфекция, остроконечные кондиломы, деструктивные методы лечения, иммунокорригирующая терапия, Изопринозин
Папилломавирусная инфекция (ПВИ) относится к наиболее распространенным инфекциям, передаваемым половым путем. В США ежегодно выявляют около 5 млн новых случаев этого заболевания. По данным зарубежных исследований, практически каждый человек, живущий половой жизнью, инфицирован вирусом папилломы человека (ВПЧ). Заражение ВПЧ может произойти даже при однократном половом контакте вследствие высокой контагиозности вируса. Более половины женщин и мужчин приобретают эту инфекцию в течение первых двух лет сексуально активной жизни. Риск заражения значительно возрастает при наличии многочисленных половых партнеров и раннем начале половой жизни. По данным отечественных исследований, разные формы ПВИ гениталий встречаются у 44,3 % пациенток, обращающихся в гинекологические учреждения по различным причинам. По данным биопсий шейки матки, субклинические формы инфекции выявляются у 8,1 % женщин.
Этиопатогенез папилломавирусной инфекции
ВПЧ относится к безоболочечным вирусам, содержит двухцепочечную ДНК, имеет икосаэдрическую форму. Он является строго эпителиотропным, т. к. вначале поражает базальный слой эпителия кожи и слизистых оболочек гениталий и других органов (гортани, ротовой полости, глаз и др.), а его жизненный цикл связан с дифференциацией эпителиальных клеток. Репликация ДНК ВПЧ происходит только в клетках базального слоя, а в клетках других слоев эпидермиса вирусные частицы лишь персистируют. При заражении ВПЧ в клетках эпидермиса нарушается нормальный процесс дифференцировки. Происходит клональная экспансия инфицированных ВПЧ-клеток базального слоя с их трансформацией и последующей малигнизацией. Этот процесс контролируют гены ВПЧ, кодирующие ранние белки Е6 и Е7. Морфологически при этом наблюдаются деформация слоев эпидермиса, общее утолщение кожи и слизистых оболочек. В стадии развитой инфекции клетки шиповатого слоя при переходе в зернистый оказываются наиболее активными в синтезе вирусной ДНК. Эта фаза жизненного цикла ВПЧ характеризует второй этап экспансии вирусной инфекции внутри эпидермиса. Экспрессия поздних генов L1 и L2 наступает на конечной стадии дифференцировки в роговом слое, где наблюдаются активная сборка зрелых вирусных частиц и их выделение из клеток на поверхности кожи. Участки кожи и слизистых оболочек, на поверхности которых происходит активное выделение и почкование вируса, представляют наибольшую опасность для контактного заражения [1, 15].
Типы ВПЧ "высокого риска", особенно 16-й, 18, 31 и 45-й, ассоциируются с дисплазией шейки матки, а также с раком шейки матки, заднего прохода, вульвы и полового члена. Типы ВПЧ "низкого риска", прежде всего 6-й и 11-й, вызывают развитие остроконечных кондилом. Пациенты с остроконечными кондиломами могут быть одновременно инфицированы вирусами нескольких типов. Определение типа ВПЧ помогает оценить риск малигнизации [2].
Сексуальные контакты — основной путь заражения ВПЧ. Аутоинокуляция, контактнобытовой путь передачи инфекции допускаются, но изучены мало. Заражению способствуют микротравмы кожи и слизистых оболочек. Возможен вертикальный способ заражения, т. е. вирус может передаться новорожденному во время прохождения по родовым путям и послужить причиной развития рецидивирующего респираторного папилломатоза.
Клинические проявления ПВИ
В большинстве случаев инфекция ВПЧ протекает бессимптомно. Наиболее известными практическим врачам проявлениями этой инфекции являются остроконечные кондиломы, которые возникают в среднем через 1—3 месяца после заражения. С момента инфицирования и до развития предраковых заболеваний или рака in situ обычно проходит от 5 до 30 лет и очень редко - менее года. У 40 % больных отмечены субклинические, малосимптомные проявления заболевания в виде мелких плоских бородавок.
Манифестация инфекции ВПЧ наиболее часто сопровождается появлением остроконечных кондилом (аногенитальных бородавок). Они возникают, как правило, на коже и слизистых оболочках половых органов или в анальной области в местах трения и травматизации при половом акте. У лиц, практикующих орально-генитальные контакты, кондиломы могут возникнуть на губах, языке, небе. Чаще высыпания представлены узелковыми образованиями, сгруппированными по 5-15 элементов, иногда сливающимися в бляшки; реже высыпания бывают единичными. Слияние в крупные бляшки происходит при иммуносупрессии, соматических заболеваниях, метаболических нарушениях, интоксикациях. У некоторых больных с выраженными нарушениями клеточного иммунитета (ВИЧ-инфекцией, на фоне иммуносупрессивной терапии), при беременности развиваются очень крупные генитальные бородавки - гигантские кондиломы Бушке-Левенштейна. Эта предраковая инвазивная и деструктирующая опухоль ассоциируется с ВПЧ-6 и ВПЧ-11. Кондиломы могут быть плоской, конической или напоминающей цветную капусту форм. Цвет образований варьируется от беловато-телесного до розовато-синюшного, реже - красновато-коричневого.
Клинически выделяют четыре типа остроконечных кондилом:
Остроконечные кондиломы обычно бессимптомны и часто случайно выявляются самим больным или врачом при осмотре. Однако крупные или травмированные, изъязвленные или подвергшиеся вторичной инфекции бородавки сопровождаются зудом, болью, неприятным запахом и гнойным отделяемым. При локализации кондилом в уретре могут развиться признаки вялотекущего уретрита, кондиломы могут вызвать раздвоение струи мочи или даже обструкцию уретрального отверстия [3].
Диагностика и принципы лечения
Для диагностики ВПЧ-инфекции помимо клинического осмотра проводят лабораторные методы исследования: цитологические, гистологические, а также молекулярно-генетические, получившие в последнее время широкое распространение. ПЦР является более чувствительным методом диагностики, чем цитологическое исследование, и способна выявить субклинические и латентные формы заболевания. Метод имеет не только важную диагностическую ценность, но и прогностическое значение, т. к. позволяет идентифицировать отдельные типы ВПЧ [2].
Лечение ВПЧ-инфекции направлено на устранение ее клинических проявлений - остроконечных кондилом.
Для этого применяют различные методы наружной терапии:
Эффективность этих методов лечения составляет от 30 до 70 %. Активность ВПЧ зависит прежде всего от иммунного статуса и реакции организма на инфекцию. Для повышения эффективности терапии в лечебный комплекс необходимо включать противовирусные препараты и иммуномодуляторы для стимуляции иммунного ответа пациента [4, 16].
Показано, что иммунный ответ хозяина имеет большое значение в предотвращении клинической манифестации ВПЧ-инфекции. Клеточный иммунитет играет основную роль как в персистенции, так и в спонтанном регрессе кондилом, который может наступить через 6-8 месяцев. Это подтверждается данными о более высокой частоте ВПЧ-ассоциированных заболеваний у реципиентов трансплантата внутренних органов и ВИЧ-инфицированных. Нарушение Т-клеточного иммунитета у больных кондиломами проявляется снижением количества клеток Лангерганса в очагах поражения и большом числе CD4+- и CD8+-T-лимфоцитов в инфильтрате регрессирующих генитальных бородавок [1].
Изопринозин в лечении ПВИ
Иммуномодулирующее действие Изопринозина заключается в усилении пролиферации и стимулировании функций Т-лимфоцитов: Т-хелперов, естественных клеток-киллеров; увеличении продукции интерлейкинов и нормализации продукции интерферона. Препарат стимулирует биохимические процессы в макрофагах, повышает хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфноядерных клеток. Иммуномодулирующие потенции Изопринозина более активно проявляются в стимулировании клеточного, чем гуморального, иммунитета. Опытным путем было показано, что его действие в большей степени проявляется при иммуносупрессии по сравнению со здоровым организмом. Изопринозин восстанавливает и усиливает деятельность клеток иммунной системы, тем самым повышает способность организма эффективно противостоять инфекциям.
Препарат отличается от других иммуномодуляторов тем, что обладает не только иммуномодулирующим, но и противовирусным (подтвержденным in vivo и in vitro) действием. Противовирусное действие Изопринозина заключается в подавлении репликации ДНК и РНК вирусов посредством связывания с рибосомой клетки и изменения ее стереохимического строения. Фармакокинетика препарата хорошо изучена. Максимальная концентрация Изопринозина достигается через час после приема 1,5 г препарата. Первый период полувыведения (50 минут) связан в выведением инозина и проходит с образованием мочевой кислоты. Второй период полувыведения диметиламино-2-пропанол β-ацетамидо-бензоата равен 3—5 часам, при этом метаболиты выводятся почками. Во время приема Изопринозина не рекомендуется применять иммунодепрессанты, а также лекарственные препараты, обладающие нефротоксичным действием [5, 6].
Благодаря своему комплексному действию Изопринозин более 35 лет успешно применяется при лечении различных, в т. ч. трудно поддающихся терапии, инфекционных заболеваниях кожи и слизистых оболочек. Основными показаниями к применению препарата в дерматовенерологии служат вирусные дерматозы: ПВИ, простой герпес, опоясывающий лишай. Многочисленные исследования подтвердили высокую клиническую эффективность Изопринозина в лечении персистирующих герпес-вирусных инфекций. Антивирусная активность препарата проявляется не только в области клинических проявлений (везикулы, эрозии), но и в нервных ганглиях. Поэтому он оказывает свое лечебное действие как в фазе обострения герпетической инфекции, так и в межрецидивный период. Препарат можно назначать в поддерживающей дозе на период до 6 месяцев [7, 14, 18].
Проведенные исследования показали, что применение инозиплекса в комплексе с деструктивными методами у пациентов с остроконечными кондиломами способствует более активному их разрешению и уменьшает частоту рецидивов, что объясняется активным иммунокорригирующим и противовирусным действиями препарата во всех зонах инвазии ВПЧ в коже [10, 17]. Препарат применяли по 1000 мг три раза в сутки в течение 28 дней.
В настоящее время несомненной представляется ведущая роль ВПЧ в генезе рака шейки матки. ВПЧ также может инициировать и поддерживать хронические воспалительные процессы в нижних отделах гениталий, поскольку при ВПЧ-индуцированном изменении структуры эпителия создаются предпосылки к заражению различными вирусными, бактериальными, протозойными, грибковыми и другими инфекциями. Показано, что одновременное инфицирование ВПЧ и вирусом простого герпеса II типа в два раза повышает риск развития плоскоклеточного рака шейки матки [19]. Имеются данные об успешном применении Изопринозина в лечении ПВИ шейки матки, цервикальной интраэпителиальной неоплазии и даже преинвазивного рака шейки матки.
В поликлиническом отделении Центра охраны здоровья матери и ребенка была изучена эффективность комбинированного лечения (этиотропный препарат, Изопринозин и абляция) 64 больных с гистологически подтвержденными субклиническими формами ПВИ на фоне хронического цервицита. Все пациентки были разделены на основную группу, в которой применяли комбинированное лечение с Изопринозином и этиотропным средством, и контрольную группу, где после курса этиологического лечения проводили только локальную монодеструкцию очагов плоскоклеточного интраэпителиального поражения. Изопринозин назначали по 2 таблетки (1000 мг) 3 раза в сутки на протяжении 5 дней за 7-10 дней до деструкции очагов. Анализ результатов проведенного лечения и последующее наблюдение за пациентками показали, что эффективность комбинированного лечения с применением Изопринозина была выше и составила 87,5 %, а при монодеструкции - 65,6 %. Рецидивирование ПВИ к 6-му месяцу наблюдения было выявлено лишь у 9,4 % женщин, принимавших Изопринозин, а в контрольной группе - у 28,1 % пациенток. Симптоматика воспалительного процесса на шейке матки наблюдалась только при рецидиве ВПЧ-инфекции. Кроме того, на фоне комплексного лечения через 6 месяцев чаще наблюдалась элиминация ВПЧ (65,6 и 46,9 % соответственно) и более качественная эпителизация. На основании полученных данных авторы пришли к выводу, что адекватная иммунотерапия способствует более полной элиминации ПВЧ, т. к. позволяет воздействовать не только на участок эпителия, где произошла клиническая манифестация, но и на резервуары ВПЧ в эпителии, находящиеся в латентном состоянии. Поэтому включение антивирусного иммуномодулирующего препарата Изопринозин в курс лечения больных хроническим цервицитом и ПВИ является обоснованным и перспективным [5].
Заключение
ПВИ вследствие ее широкой распространенности и отсутствия надежных методов лечения на сегодняшний день является актуальной проблемой в клинической практике. Терапевтическая стратегия при этом заболевании должна быть направлена не только на удаление локальных очагов инфекции — остроконечных кондилом, но и на воздействие на субклинические и латентные формы ВПЧ-инфекции. При этом большое значение в предотвращении рецидива и процесса канцерогенеза имеет элиминация ВПЧ. Поэтому в терапевтический комплекс необходимо включать препараты с противовирусным и иммуномодулирующим действиями для активации иммунной системы организма и подавления вирусной активности. Изопринозин является одним из наиболее изученных и эффективных иммунных препаратов с противовирусным действием. Более 35 лет его с успехом применяют в широкой клинической практике для лечения ПВИ и других вирус-ассоциированных заболеваний кожи и слизистых оболочек. Хорошая переносимость препарата, минимум побочных эффектов, возможность применять его в индивидуальной дозировке и в комбинации с другими методами лечения позволяют использовать его в лечении ВПЧ как у детей, так и у взрослых.
Читайте также:

