Тинктура йода при раке кожи
Обновлено: 06.05.2024
Советы при раке
1. Что такое неоплазия?
Неоплазия — патологический процесс, характеризующийся безудержным, бесконтрольным ростом клеток, приобретших новые, не присущие нормальным клеткам свойства. Злокачественные новообразования дают метастазы и для них характерен инфильтрирующий рост.
P.S. Неоплазия (от греч. neos — новый + plasis — образование) — новообразование ткани, опухоль.
2. Какие существуют виды злокачественных опухолей?
Злокачественную опухоль, развившуюся из эпителия, называют раком. Злокачественные опухоли из клеток мезенхимы носят название сарком. Злокачественные новообразования мезенхимальной природы могут быть "твердыми" (солидными), как рак и саркомы или "жидкими", как гемобластозы — опухоли из кроветворной и лимфоидной ткани.
3. Что можно сказать о злокачественных опухолях кожи?
Как правило, базалиома и плоскоклеточный рак кожи могут угрожать жизни только в запущенных случаях. Они встречаются достаточно часто и при правильном лечении редко приводят к смерти больного. Хотя названные раки кожи менее злокачественны, чем прочие карциномы, к ним применяют те же основные принципы лечения.
4. Какой вред наносит рак организму?
Простое замещение нормальной ткани опухолью, в конечном счете, приводит к нарушению функции органа. Если вследствие роста опухоли нарушается ее кровоснабжение и образуются некрозы, то возможно развитие местного воспаления. Часто рост опухоли приводит к сдавлению органов. Например, раковая опухоль может перекрывать желудочно-кишечный тракт, желчные протоки или воздухоносные пути. Иногда раковая опухоль кровоточит. Инвазия в нервы или воспаление могут вызывать боль. Раковые опухоли также могут вырабатывать гуморальные факторы, что проявляется различными симптомами.
5. Все ли виды рака угрожают жизни?
Рак — фатальное заболевание. В настоящее время в Соединенных Штатах более половины больных раком излечиваются. Без лечения больные раком умирают от других причин крайне редко.
6. Как развивается рак?
Никто не знает почему, но аномальные клетки начинают делиться в условиях, при которых нормальные клетки не делятся. Процесс является многоступенчатым и включает в себя воздействие на дифференцировку, деление и рост клеток. Затем аномальные клетки проникают в окружающие нормальные ткани. Большинство видов рака в конечном итоге также метастазируют в отдаленные участки организма.
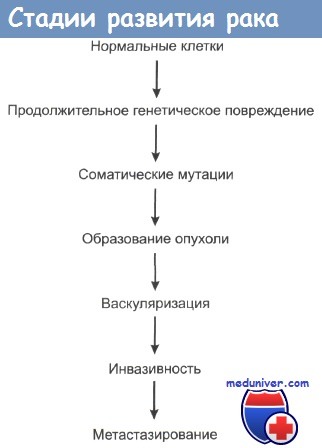
7. Какова роль онкогенов в этом процессе?
Гены, отвечающие за трансформацию нормальных клеток в злокачественные, называются онкогенами. Эти гены придают нормальным клеткам функции, ведущие к более агрессивному поведению. Гены-супрессоры ингибируют рост опухоли, и их потеря также может привести к развитию рака.
8. Как распространяется рак?
Больные умирают от рака вследствие инвазивного роста опухоли в нормальные ткани и метастазирования. Бесконтрольно растущие раковые клетки начинают формировать собственные питающие сосуды. Такой ангиогенез предшествует инвазии в нормальные ткани. Затем раковые клетки инфильтрируют окружающую ткань и проникают в кровь и лимфу. Циркулирующие раковые клетки могут задерживаться в лимфатических узлах или отдаленных органах, где образуются отдаленные метастазы, которые также начинают формировать свое кровоснабжение.
9. Всегда ли рак дает метастазы?
Примерно у четверти больных солидными опухолями к моменту установления диагноза определяются метастазы. Среди оставшейся части больных менее чем у половины метастазы разовьются во время лечения. К моменту постановки диагноза диаметр опухоли составляет 1 см и более (часто намного больше), и она содержит миллионы клеток. Удивительно, что к моменту постановки диагноза метастазы есть не у всех больных.
10. Как влияет способность рака к метастазированию на хирургическое лечение рака?
При операциях но поводу доброкачественных новообразований для исправления физиологического или анатомического дефекта удаляют настолько малое количество ткани, насколько возможно. Напротив, при операциях по поводу рака удаляют настолько максимально возможный объем ткани, насколько это позволяет нормально функционировать органам. При операциях по поводу рака стремятся удалить как первичную опухоль, так и лимфатические узлы, к которым от нее оттекает лимфа.
11. Зачем во время операций при раке удаляют лимфатические узлы?
Более 100 лет назад Вильям С. Холстед (William S. Hoisted) обратил внимание на то, что после удаления только самой молочной железы, местный рецидив опухоли в области рубца зависит от наличия метастазов в лимфатических узлах. Холстед решил, что рак молочной железы распространяется упорядоченно (или, возможно, последовательно) из первичной опухоли в регионарные лимфатические узлы и, наконец, в отдаленные органы.
Он популяризировал при раке молочной железы ее удаление единым блоком с подмышечными лимфатическими узлами. Принципиально такой подход был принят для лечения всех солидных опухолей.
12. Что такое сторожевой лимфатический узел?
Сторожевой лимфатический узел — это первый узел в региональном лимфатическом бассейне, в который поступает лимфа от первичной опухоли. Обычно сторожевых узлов бывает более одного, даже при небольшой опухоли. Если в сторожевом лимфатическом узле опухолевых клеток нет, то вероятность их наличия в других узлах мала. Сторожевые лимфатические узлы описаны для опухолей многих локализаций (включая кожу, молочные железы, толстую кишку и щитовидную железу).
Исследование сторожевого узла для определения показаний к полной лимфодиссекции стало стандартом лечения меланомы и является перспективным методом лечения рака молочной железы.
13. Всегда ли метастазирование солидных опухолей идет упорядоченно?
Необязательно. В 70-х годах появилась другая точка зрения па поведение рака молочной железы. Бернард Фишер (Bernard Fisher) утверждал, что рак является распространенным уже с самого начала. Он говорил, что "рак молочной железы — системное заболевание. и вряд ли изменения в местном и регионарном лечении могут существенно повлиять на выживаемость".

14. Как точки зрения на две модели “поведения” рака влияют на лечение?
Хирурги, которые согласны с тем, что опухоли распространяются упорядоченно, стараются выполнять вместе с удалением первичной опухоли агрессивную лимфодиссекцию, считая, что лимфаденэктомия излечит некоторых больных с поражением лимфатических узлов без отдаленных метастазов, и что таким образом можно предотвратить смертность от местного рецидива.
Хирурги, которые придерживаются альтернативной точки зрения, согласно которой метастазы в лимфатические узлы представляют собой лишь проявление системного заболевания, обычно относятся к лимфодиссекции менее агрессивно, поскольку (в их глазах) удаление лимфатических узлов, содержащих опухоль, не излечит больных, у которых, вероятно, уже есть метастазы.
15. Знаем ли мы, какая из этих моделей "поведения" рака правильна?
Вероятно, обе не вполне верпы. Ряд солидных опухолей (например, плоскоклеточный рак головы и шеи или рак толстой кишки) часто не дают отдаленные метастазы, даже если они уже метастазировали в лимфатические узлы. Похоже, что распространение этих опухолей упорядоченно. Другие солидные опухоли часто дают метастазы, даже несмотря на очень маленькие размеры и для них вовлечение лимфатических узлов — верный признак отдаленных метастазов.
При саркомах метастазирование в лимфатические узлы наблюдают редко, однако могут быть метастазы в легкие; таких больных иногда можно излечить с помощью операции.
16. Какие еще существуют способы лечения солидных опухолей?
Вместо оперативного удаления первичной опухоли и регионарных лимфоузлов для лечения можно использовать облучение всей области поражения. Некоторые виды рака особенно чувствительны к облучению. Лучевая терапия может сопровождаться тяжелыми осложнениями, которые нельзя игнорировать. Радиация, убивая раковые клетки, повреждает окружающие нормальные ткани и тем самым ухудшает качество жизни больного. Применение облучения в качестве монотерапии при раке ограничено способностью окружающих тканей переносить радиацию.
17. Что такое адъювантная терапия?
"Адъювантный" означает "вспомогательный". Доказана эффективность адъювантной терапии в лечении рака молочной железы, толстой и прямой кишок, опухолей яичников и яичек. Адъювантную лучевую терапию можно назначить после операции, чтобы снизить риск рецидива опухоли в области операции. Ее часто применяют для лечения рака прямой кишки, молочной железы, головы и шеи, а также сарком.
18. Какие существуют способы лечения рака помимо хирургического, лучевой терапии и цитотоксической химиотерапии?
Последние десятилетия для замедления роста некоторых опухолей используют гормональную терапию. Теоретически перспективным способом могла бы быть мобилизация иммунной системы на борьбу с раком, например, с помощью вакцинации, активации Т-клеток или стимуляции иммунного ответа. Новые типы противораковых препаратов включают средства, нарушающие ангиогенез в опухоли; моноклональные антитела против рецепторов к факторам роста; вещества, изменяющие межклеточные сигнальные пути, и средства, восстанавливающие контроль за клеточным циклом.
19. Борется ли с раком сам организм?
Конечно. Некоторые ученые считают, что иммунная система регулярно удаляет ранние формы рака, а развитие клинической формы рака возможно лишь при нарушении иммунного надзора. У людей с иммуносупрессией чаще развиваются некоторые виды рака. Описаны случаи регрессии первичной меланомы. Десятилетиями онкологи пытались разрешить загадку "спонтанных ремиссий" меланомы и почечно-клеточного рака. И в самом деле, ранее считалось, что эти разновидности опухолей хорошо отвечают на иммунотерапию и лечение интерлейкином-2.

а - Две кинетические модели опухолевого роста.
Кривая А представляет собой экспоненциальный рост,
кривая Б — прогрессивное замедление роста по мере увеличения размеров опухоли, получившее название гомпертциана роста.
б - Продолжительность жизни опухоли. Опухоль клинически выявляется после 33 удвоений своего объема.
Лечение приводит к уменьшению опухолевой массы, но после 4,5 лет опухоль вновь клинически детектируется.
20. Что такое инфильтрирующие опухоль лимфоциты (tumor-infiltrating lymphocyte)?
Это лимфоидные клетки, которые инфильтрируют солидные опухоли; при этом происходит сенсибилизация к аутологичным опухолевым антигенам. Инфильтрирующие опухоль лимфоциты гораздо более чувствительны к раковым клеткам, чем циркулирующие лимфоциты.
21. Что такое паллиативное лечение?
"Паллиативное" означает "приносящее облегчение, но не излечивающее".
22. Приведите примеры паллиативных процедур.
Для остановки кровотечения или в связи с обструкцией выполняют резекцию первичной опухоли даже при наличии отдаленных метастазов; при нерезектабельном раке формируют обходные кишечные или желчные анастомозы. Выполняют трахеотомии больным с обструкцией верхних дыхательных путей и формируют стомы для энтерального питания больных, которые не могут есть. Часто качество жизни улучшается после удаления изолированных метастазов в головной мозг. При гормонпродуцирующих опухолях оперативное уменьшение массы новообразования часто облегчает состояние больных.
23. Что такое циторедуктивная операция?
Циторедуктивная операция направлена на уменьшение количества опухолевых клеток (снижение массы опухоли). Простое уменьшение массы опухоли редко позволяет повысить выживаемость. Циторедуктивная операция приносит пользу, если она выполнена в сочетании с нехирургическим методом, к которому данная опухоль высокочувствительна — например, с облучением при глиобластоме.
24. Имеет ли удаление лимфатических узлов при раке молочной железы лечебное значение или оно нужно только для уточнения показаний к химиотерапии?
Те, кто считает, что удаление подмышечных лимфатических узлов не песет терапевтической ценности и нужно лишь для уточнения состояния опухоли, обычно ссылаются на исследование NSBAP В-04. В это рандомизированное мультицентровое исследование было включено 1665 больных, которым выполняли (1) радикальную мастэктомию; (2) тотальную мастэктомию с облучением или (3) мастэктомию с удалением подмышечных лимфоузлов, если на них распространялась опухоль.
Статистически достоверного различия в выживаемости в ранние и поздние сроки при удалении подмышечных лимфатических узлов не выявлено. Однако помимо всего прочего исследование было недостаточно большим, чтобы быть убедительным. Чтобы с 90% вероятностью обнаружить 7% различие в выживаемости между группами, каждая из групп исследования NSABP должна была включать 2000 больных (а не 550). Таким образом, существенное преимущество в выживаемости, связанное с удалением подмышечных лимфатических узлов, не могло быть обнаружено.
На самом деле последующие рандомизированные исследования эффективности различных методов лечения рака молочной железы показали, что удаление подмышечных лимфатических узлов приводит к увеличению выживаемости.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Человека, у которого диагностировано онкологическое заболевание, всегда волнует, как теперь изменится его жизнь. Помимо предстоящего лечения, возникают некоторые ограничения, противопоказания.
Не стоит бояться, что теперь вся жизнь будет состоять из сплошных запретов. В целом во время лечения и после наступления ремиссии можно вести привычную жизнь, заниматься любимыми делами, принимать пищу, которая нравится. Но важно соблюдать некоторые рекомендации, потому что от этого может зависеть успех в борьбе с заболеванием.

Какие продукты питания противопоказаны при онкологических заболеваниях?
Принципы здорового питания едины для здоровых людей и онкологических больных. К продуктам, способствующим развитию рака и в целом ухудшающим состояние здоровья, относят красное (баранина, свинина, говядина) и обработанное (соленое, копченое, гриль, барбекю, бекон) мясо, колбасы и сосиски, фастфуд, продукты с добавленными сахарами, в первую очередь кондитерские изделия и сладкую газировку.
Это не означает, что одна плитка шоколада или один бургер сразу же ухудшат состояние онкологического больного. Речь о регулярном употреблении. Важно, какую часть рациона составляют те или иные продукты. Всё «вредное», конечно, надо ограничить. Но иногда можно себя побаловать.
Некоторые химиопрепараты вызывают тошноту, запоры, потерю аппетита, приводят к изменению чувства вкуса, поражению слизистых оболочек. В таких случаях нужна специальная диета. Соответствующие рекомендации вы найдете в нашей статье «Побочные эффекты химиотерапии».
Еще один возможный побочный эффект химиопрепаратов — лейкопения, снижение уровня лейкоцитов в крови. Из-за этого ослабляется иммунная защита и возрастает риск развития инфекций, в том числе пищевых. Для пациента с лейкопенией запрещены следующие продукты:
- Недоваренное мясо. Стоит приобрести специальный пищевой термометр, чтобы проверять готовность продуктов.
- Сыровяленые и сырокопченые колбасы, мясо.
- Непастеризованное молоко и любые приготовленные из него продукты (сыры, йогурты).
- Суши из сырой рыбы.
- Немытые свежие овощи и фрукты.
- Яйца, вареные всмятку, продукты, приготовленные из сырых яиц (например, домашний майонез).
Рекомендуемые продукты питания при раке
Организм онкологического больного борется с опасным заболеванием, испытывает дополнительную нагрузку из-за лечения. Чтобы вовремя восстанавливать ресурсы, ему нужно достаточное количество белков и других нутриентов, калорий. При этом пища должна быть здоровой.
К продуктам с наиболее высоким содержанием белка и калорий относятся: фасоль, курятина, мясо, йогурты, рыба, яйца. Они особенно важны для онкологических пациентов, которые сильно потеряли в весе, страдают анорексией.
Некоторые больные, напротив, страдают избыточным весом, ожирением. Им рекомендуется есть больше овощей и фруктов, выбирать нежирное мясо, максимально ограничить продукты с высоким содержанием жиров (масло, майонез, десерты, жареное), соль.
Для каждого пациента в онкологии диету подбирают индивидуально. Важно учитывать не только потребности организма, но и личные предпочтения человека — пища должна быть вкусной. В «Евроонко» есть собственный ресторан, в нем работают профессиональные повара.
Сколько воды можно пить онкологическому больному?
У многих онкобольных повышен риск обезвоживания из-за рвоты, диареи, лихорадки, некоторых лекарственных препаратов, которые используются при лечении рака. Для профилактики этого состояния рекомендуется ежедневно выпивать 2¬—2,5 литра воды (проконсультируйтесь с врачом — потребности в жидкости индивидуальны и зависят от ряда факторов).
Лучше пить обычную воду. Для придания вкуса в нее можно положить дольку лимона. Можно пить травяные чаи. Чая и кофе следует избегать: в них содержится кофеин, который действует как мочегонное. В газировках и магазинных соках содержатся добавленные сахара — они вредны для здоровья.
При некоторых состояниях в онкологии потребление жидкости, напротив, рекомендуется ограничить. Такие пациенты получают соответствующие рекомендации от лечащего врача.
Витамины и рак
Витамины важны для организма человека, но их не стоит переоценивать. Тут не работает правило «больше — лучше». Витамины не лечат от рака, некоторые из них, напротив, способствуют прогрессированию опухоли и ухудшают течение заболевания. Вы можете узнать об этом подробнее из нашей статьи «Витамины и рак».
Курение
О том, что курение вредит здоровью и приводит к онкологическим заболеваниям, наверное, знают все еще со школьной скамьи. Но курильщиков это не останавливает: среди тех, у кого уже диагностирован рак, более половины не расстаются с вредной привычкой. Обычно это аргументируют тем, что всё самое страшное уже произошло, и бросать курить нет смысла.
На самом деле, смысл есть. Позаботиться о своем здоровье никогда не поздно. Например, одно исследование показало, что больные раком легкого, которые бросили курить сразу после того, как им был установлен диагноз, или незадолго до этого, в среднем живут дольше. После отказа от сигарет противоопухолевые препараты начинают работать эффективнее, снижается риск побочных эффектов, рецидива, сокращается восстановительный период после лечения, в целом улучшается самочувствие и появляется больше энергии. Мы подробно рассказывали об этом в статье «Если уже рак: курить или не курить?».
Посещение бань и саун
В прошлом веке в онкологии существовал строгий запрет на посещение бань и саун для больных и людей, которые находятся в ремиссии. Считалось, что высокая температура провоцирует развитие рака и способствует распространению злокачественных клеток в организме. В настоящее время известно, что всё не так однозначно. Температура выше 40 градусов повышает чувствительность опухолей к препаратам и помогает их уничтожать. Этот принцип даже используют в современных клиниках онкологии — например, во время гипертермической интраперитонеальной химиотерапии (HIPEC).
Конечно же, тут нет никакого призыва лечить рак с помощью бани, как предлагают некоторые народные целители. Онкологические больные должны лечиться в специализированных клиниках онкологии, в соответствии с актуальными протоколами. А после завершения лечения никто не запрещает посещать бани, сауны и спа.
Некоторые люди боятся, что высокие температуры в бане и сауне могут вызвать рак кожи. Этому нет никаких доказательств. Для кожи опасны только солярии, в которых есть ультрафиолетовые лучи. Высокие температуры повышают риск развития злокачественных опухолей кожи, только если они вызывают сильные ожоги.
Солнечный загар
Ультрафиолетовое излучение повреждает ДНК и может привести к злокачественному перерождению клеток. Это один из самых значимых факторов риска развития рака кожи и меланомы. Чрезмерного воздействия ультрафиолетовых лучей нужно избегать даже здоровым людям, а для онкологических больных они особенно опасны, потому что многие химиопрепараты и лучевая терапия повышают чувствительность кожи.
Во время лечения важно соблюдать эти рекомендации:
- Старайтесь не бывать на улице в пик солнечной активности (между 10.00 и 16.00).
- Максимально закрывайте тело одеждой. Но помните, что перегревание и дегидратация опасны для онкологических больных. Выбирайте «дышащие» ткани: льняные, бамбуковые, хлопчатобумажные.
- Надевайте шляпу с широкими полями. Это особенно важно, если в результате химиотерапии выпали волосы.
- Старайтесь находиться в тени.
- Не сидите подолгу возле водоемов. Вода отражает солнечные лучи.
- Когда собираетесь на улицу в жаркую погоду, возьмите бутылку с водой.
- Используйте солнцезащитный крем.
Читайте подробнее о влиянии ультрафиолетового излучения на кожу в нашей статье «Загар — прямая причина рака кожи».
Употребление алкоголя при онкологических заболеваниях
Алкоголь — один из факторов риска развития многих онкологических заболеваний. Но строгого запрета на его употребление для больных в современной онкологии нет.
Важно помнить о двух моментах:
- Риски зависят от объема и регулярности употребления алкогольных напитков. Существуют максимальные безопасные дозы: для мужчин 28 граммов этилового спирта в день (700 мл пива, 300 мл вина или 90 мл водки), для женщин вдвое меньше. Конечно же, это не повод каждый день выпивать всю «норму», особенно если у человека онкологическое заболевание. Но от одного бокала вина не случится ничего страшного.
- Многие химиопрепараты выводятся из организма через печень. Она же утилизирует алкоголь. Таким образом, при употреблении спиртного орган испытывает двойную нагрузку. Некоторые противоопухолевые препараты поражают слизистые оболочки. Поэтому, если человек, страдающий раком, хочет принять алкоголь, предварительно нужно посоветоваться с лечащим врачом.
Читайте подробности в статье «Алкоголь при онкологических заболеваниях» на канале «Евроонко» в Яндекс Дзен.
Можно ли делать онкологическим больным массаж?
Онкологическое заболевание не является абсолютным противопоказанием к лечебному массажу. Он не способствует распространению раковых клеток в организме, этому нет никаких научных доказательств. В целом онкологические больные могут посещать массажистов, существуют лишь некоторые небольшие ограничения:
- Предварительно нужно проконсультироваться с лечащим врачом.
- При онкологических заболеваниях противопоказан глубокий массаж.
- Не стоит посещать сомнительные массажные салоны: пользуйтесь услугами сертифицированных массажистов.
- При проведении массажа нужно учитывать общее ослабленное состояние организма пациента, влияние химиотерапии и лучевой терапии, а также все осложнения и сопутствующие патологии.
- Массаж нельзя делать на частях тела, на которых проводится лучевая терапия, если на коже имеются раны и другие повреждения.
- На конечностях с лимфедемой (отеком в результате нарушения оттока лимфы после удаления лимфатических узлов) нельзя делать классический массаж, но можно специальный лимфодренажный для уменьшения отека.
Почему нельзя заниматься самолечением при раке?
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
Нехирургические методы лечения базально-клеточного рака кожи
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Москва, Россия
Ежегодный прирост онкологической заболеваемости с локализацией процесса на коже составляет от 3 до 10%. В структуре онкологической заболеваемости России злокачественные опухоли кожи занимают второе место по частоте встречаемости (11—12%). Базально-клеточный рак (БКРК), или базалиома кожи, составляет до 80% от всех злокачественных эпителиальных опухолей кожи. Представлен обзор литературы по нехирургическим методам лечения БКРК. Из большого количества консервативных лечебных стратегий и эффективных методик лечения БКРК рассмотрены основные. Показаны результаты лечения БКРК с помощью фотодинамической (ФДТ), лучевой, местной лекарственной терапии, системной химио- и иммунотерапии. Описаны статистические данные по рецидивированию БКРК при различных методах консервативного лечения и проведено сравнение с частотой рецидивирования после хирургического лечения. Рассмотрены варианты лечения неоперабельных больных с помощью системной химиотерапии препаратами висмодегиб и сонедегиб; иммунотерапии рекомбинантными интерферонами альфа-2b — реафероном, вифероном (Россия) и интроном A (США). Приведены статистически достоверные данные по лечению БКРК различными нехирургическими методами. Представлены выводы о целесообразности применения консервативных методов лечения БКРК в клинической практике.
Московский клинический научно-практический центр Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы, Москва, Россия
В последние десятилетия в мире отмечают неуклонный рост заболеваемости раком кожи. Ежегодный прирост составляет от 3 до 10%. В структуре онкологической заболеваемости в России злокачественные опухоли кожи по частоте встречаемости занимают второе место (11—12%). Базально-клеточный рак кожи (БКРК), или базалиома кожи, составляет до 80% от всех злокачественных эпителиальных опухолей этой локализации. БКРК может возникать практически на любом участке кожного покрова, но наиболее часто на лице (в особенности в углах глаз, на носу, ушных раковинах и в височной области) и волосистой части головы. До 78% случаев БКРК регистрируют у лиц пожилого и старческого возраста (в среднем 64,4 года). Однако описаны редкие случаи возникновения данного онкологического заболевания кожи в более раннем возрасте, начиная с 20 лет [1—3].
Прогноз при ранних стадиях БКРК достаточно благоприятный: стойкое излечение достигается в 95—97% случаев. При местно-распространенном процессе (III стадия) излечение возможно в 40—50% наблюдений. Особенностью БКРК является его крайне медленное метастазирование (менее 0,5% случаев). Частота локальных рецидивов после различных методов лечения БКРК составляет, по данным разных авторов [2], от 1 до 40%.
В настоящее время в лечении БКРК применяют все существующие методы лечения злокачественных опухолей: хирургическое, лучевую терапию, электрокоагуляцию, крио- и лазерную деструкцию опухоли, местную и системную химиотерапию, иммунотерапию и комбинированное лечение [2]. Наряду с положительными сторонами стандартных способов лечения имеются существенные недостатки, в связи с чем продолжается поиск новых неинвазивных и косметически значимых методов.
Выбирая противоопухолевое лечение БКРК важно руководствоваться тем, насколько полную элиминацию опухолевых клеток обеспечивает метод, а также учитывать сохранение функции пораженного участка кожи и ориентироваться на наиболее приемлемый косметический результат [4]. Также необходимо оценивать факторы, связанные непосредственно с самим опухолевым процессом: клиническую форму БКРК, наличие первичного очага или рецидива, локализацию, размер и глубину инвазии опухоли, длительность ее существования, скорость опухолевого роста и возможность определения ее границ [5]. Кроме того, учитывают, имеется ли у пациента единичный очаг или множественный.
На сегодняшний день нет нехирургического метода лечения БКРК, который мог бы гарантировать 100% результат, т. е. предотвратить рецидивы. Их частота при различных методах лечения первичного очага достигает до 42,9%.

Вероятность рецидива БКРК зависит от выбранного метода лечения. Для определения наиболее эффективной тактики терапии в каждом конкретном случае были разработаны две концепции низкого и высокого риска вероятности развития рецидива БКРК (см. таблицу) Базалиома кожи низкого и высокого риска [5].
Лечение локального рецидива БКРК — задача более сложная, чем лечение первичной опухоли.
Среди большого количества консервативных лечебных стратегий и эффективных методик лечения БКРК в данной статье мы рассмотрим основные.
Одним из наиболее эффективных современных методов лечения БКРК является метод фотодинамической терапии (ФДТ) [6, 7]. В России ФДТ при лечении БКРК применяется с 1992 г.
ФДТ — фотодинамическое повреждение опухолевых клеток в ходе фотохимических реакций. Уникальной особенностью фотодинамического повреждения тканей являются некроз и апоптоз опухолевых клеток с сохранением коллагеновых структур, которые служат основным каркасом для репаративных процессов, что обеспечивает хорошие косметические результаты. После лечения формируется нежный, не деформирующий кожу рубец, по цвету мало отличающийся от окружающей кожи (редко встречается пигментация зоны воздействия от легкой до умеренной). Это очень важно для больных с опухолями кожи, расположенными на открытых участках тела и, конечно, на лице.
ФДТ опухолей реализуется посредством трех основных механизмов:
1) повреждение сосудистого русла опухоли (рассматривается как основной);
2) непосредственная цитотоксичность в результате фотохимической реакции;
3) формирование иммунного ответа на клетки опухоли, находящиеся в состоянии апоптоза.
Непосредственная эффективность ФДТ в зависимости от морфологической формы, размеров опухоли и качества используемых фотосенсибилизаторов составляет 73—95%. К безусловным преимуществам данного метода следует отнести возможность проведения процедуры в амбулаторных условиях, низкий уровень болевых ощущений (в большинстве случаев не требуется обезболивание), легкость при формировании фигурных полей, допустимость комбинирования с другими методами терапии, отсутствие лимитирующих доз фотосенсибилизатора и светового воздействия и, как следствие, возможность многократного повторения процедуры, удобство применения при множественном характере поражения и лучшие косметические результаты вследствие сохранения структуры коллагеновых волокон, что способствует формированию оптимальных рубцов. К недостаткам метода относят ограниченную глубину проникновения лазерного света (4—8 мм в зависимости от длины волны).
Эффективность ФДТ определяется правильным выбором дозы фотосенсибилизатора, плотностью мощности лазерного излучения и энергией, подведенной к опухоли. Наиболее успешно применение ФДТ при поверхностной форме БКРК, при которой достигается 90—100% излечение. Несколько хуже результаты ФДТ при более агрессивных формах БКРК (50—70% безрецидивного 3-летнего периода).
Накопленный к настоящему времени опыт свидетельствует о целесообразности и перспективности использования ФДТ и лазер-индуцированной термотерапии при лечении больных БКРК [8—10].
Лучевая терапия БКРК во многих регионах нашей страны является ведущим методом лечения. Используются близкофокусная рентгенотерапия, дистанционная гамма-терапия, электронная терапия, контактные и комбинированные (радиохирургические) методы. Самый распространенный и ведущий метод лечения БКРК — близкофокусная рентгенотерапия; разовая доза облучения составляет 3—5 Гр с достижением суммарной очаговой дозы 50—60 Гр.
Преимуществами данного метода являются его эффективность и отсутствие необходимости обезболивания (кроме случаев, когда опухоль локализована на веках или в углу глаза).
К недостаткам относят необходимость неоднократного проведения процедур, что требует госпитализации больного; наличие ранней и поздней постлучевой местной реакции (сухая и влажная десквамация кожи, эритема, гипопигментация, атрофия кожи, телеангиоэктазии, эпиляция, субдермальный фиброз) и возможность возникновения спустя годы малигнизации, индуцированной лучевой терапией [11].
Сегодня концепция активного обследования и лечения больных лучевыми методами при отсутствии соответствующих показаний пересматривается. Это вызвано озабоченностью, связанной с повышением лучевой нагрузки при обследовании больных в медицинских учреждениях [12]. Риск развития злокачественных новообразований после лучевой терапии очень низок и составляет 1:1000 через 10—15 лет после завершения терапии [13]. Однако его следует учитывать.
Была доказана повышенная чувствительность к лучевой терапии у лиц, имеющих антиген А10 в системе HLA, который встречается наиболее часто при синдроме Горлина—Гольтца [14, 15].
Учитывая небольшой риск малигнизации в очагах, подверженных лучевой терапии, особенно важно решить вопрос о целесообразности назначения данного вида лечения лицам моложе 50 лет [12, 16, 17]. Для этих лиц назначение лучевой терапии должно быть тщательно обосновано. При возможности лечения альтернативными методами им следует отдавать предпочтение [11].
БКРК I—II стадии с поверхностными очагами размером до 5 см, а также опухоли, располагающиеся в периорбитальной области, на коже носа и ушных раковинах, у больных пожилого возраста — главные критерии к назначению близкофокусной лучевой терапии.
При распространенных, неоперабельных формах БКРК проводят лучевую терапию с паллиативной целью, иногда сочетая ее с внутриартериальной селективной химиотерапией.
При первичном БКРК после лучевой терапии локальные рецидивы возникают у 1,2—6,9%, а при рецидивном раке — у 14—48% больных.
Системная лекарственная терапия может применяться при неоперабельном местно-распространенном (мр) и/или метастатическом (м) БКРК. Системная химиотерапия при БКРК характеризуется низкой эффективностью. Иногда этот метод лечения назначают с целью уменьшения исходных размеров очага в предоперационный период до криодеструкции или хирургического иссечения опухоли [4].
Ингибиторы Hedgehog-сигналинга
В 2012 г. FDA (Foodand Drug Administration, Управление по контролю за продуктами и лекарствами, США) был одобрен препарат висмодегиб для лечения распространенного БКРК у взрослых пациентов. Препарат обладает низкой токсичностью и избирательным механизмом действия [18]. Наиболее частыми нежелательными явлениями при приеме висмодегиба бывают мышечные спазмы, алопеция, изменение вкусовых ощущений, потеря массы тела, усталость, тошнота, рвота, диарея, констипационный синдром, артралгии, гипонатриемия, тератогенный эффект.
Показания к применению ингибитора Hedgehog-сигналинга — препарата висмодегиб:
2) рецидивирующий БКРК;
3) мрБКРК у пациентов, не подлежащих хирургическому или лучевому лечению.
Иммунотерапия — местное и системное применение иммуномодулирующих препаратов. Получен хороший эффект при лечении язвенной формы БКРК рекомбинатными интерферонами — альфа-2b: реафероном, вифероном (Россия) и интроном A (США). Реафероном и интроном, А обкалывали опухоли, а виферон вводили в свечах. Через 2 мес после курса терапии размеры опухолей уменьшались на 70%. Число курсов составляло 2—3 с интервалом 2—3 мес. Процесс разрешался рубцовой атрофией.
Однако метод характеризуется рядом побочных эффектов: общей слабостью, энцефалопатией, анорексией, психомоторными нарушениями, транзиторной лейкопенией, тромбоцитопенией, тошнотой, нарушением вкуса, диареей. Широкое применение крема имиквимод ограничено возникновением таких побочных эффектов, как выраженная воспалительная реакция, невозможность использования на чувствительных участках кожи, системные побочные реакции. Также к недостаткам иммунотерапии интерфероном относят высокую стоимость проводимой терапии и относительно низкую степень излеченности [19, 20].
Таким образом, данные методы успешно дополняют хирургические, обеспечивая хороший терапевтический и косметический эффекты, позволяют сократить сроки лечения и реабилитации пациентов.
Сведения об авторах
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Современный взгляд на проблему лечения витилиго
Журнал: Клиническая дерматология и венерология. 2012;10(2): 118‑123
Усовецкий И.А., Шарова Н.М., Короткий Н.Г. Современный взгляд на проблему лечения витилиго. Клиническая дерматология и венерология. 2012;10(2):118‑123.
Usovetskiĭ IA, Sharova NM, Korotkiĭ NG. The current view of the problem of vitiligo therapy. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(2):118‑123. (In Russ.).
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Представлены результаты собственных исследований, посвященных особенностям клинического течения разных форм витилиго, некоторым патогенетическим аспектам развития данного заболевания и оценке клинической эффективности комплексной терапии сегментарной и несегментарной формы витилиго.
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Витилиго характеризуется внезапным возникновением депигментированных пятен вследствие нарушения секреторной функции меланоцитов или их гибели, развивается у лиц с генетической предрасположенностью, сопровождается выраженными дисрегуляторными изменениями клеточно-опосредованных реакций иммунной системы, вегетативного дисбаланса с преобладанием симпатического тонуса и серьезной социальной дезадаптацией, обусловленной личностными особенностями и внешними социальными факторами.
Витилиго является распространенным дерматозом. В мире число больных с данным заболеванием превышает 1% всего населения. В 70% случаев заболевание начинается в возрасте 10—25 лет, дети младше 10 лет, в том числе новорожденные и грудного возраста, составляют приблизительно 25% всех больных витилиго [1]. Витилиго может возникнуть в любом возрасте, длиться неопределенно долго, самопроизвольное восстановление нормальной окраски кожи наблюдается редко.
Причины появления депигментированных очагов не известны. Недостаточно понятно, в результате каких нарушений резко прекращается синтез меланина и погибают меланоциты. Разные эндогенные и экзогенные факторы могут оказывать прямое и опосредованное повреждающее действие на меланоциты.
Среди внешних факторов наибольшее значение придают инфекционным и токсическим агентам, чрезмерному ультрафиолетовому облучению, стрессам. На протяжении многих десятилетий витилиго связывали с аутоиммунным тиреоидитом, ревматоидным артритом, красной волчанкой, атопическим дерматитом, заболеваниями печени инфекционного или токсического генеза, глистной инвазией и рядом врожденных синдромов [2]. Однако частота встречаемости витилиго у этих больных не выше, чем в популяции в целом. Ряд авторов [3, 4], подводя итоги многолетним исследованиям, считают, что больные витилиго в большинстве случаев не имеют никаких тяжелых или хронических сопутствующих заболеваний, а терапия выявленных у 28% больных функциональных расстройств органов пищеварения, вегетососудистой дистонии не оказывала влияния на результат репигментации.
Многие исследователи считают [5, 6], что витилиго является серьезным косметическим дефектом, возникает у лиц с генетической предрасположенностью и в у большинстве случаев, перенесших эмоциональные расстройства. Лишь у 4—7% больных витилиго сочетается с аутоиммунным тиреоидитом.
В современных генетических исследованиях продемонстрирована связь возникновения витилиго с разными аспектами наследования. Среди спорадических случаев витилиго в европейской популяции средний возраст возникновения заболевания составляет 24,2 года, тогда как в семьях с множественными случаями заболевания средний возраст составляет 21,5 года (статистически достоверные различия) [7]. Более раннее начало заболевания в «семейных» случаях и риск заболевания у отдаленных родственников является типичной характеристикой полигенного заболевания. Около 20% больных витилиго имеют не менее одного кровного родственника с подобным заболеванием. Формально-генетический сегрегационный анализ витилиго определяет существование многих локусов, нарушения в которых формируют предрасположенность к витилиго. Однако не обнаружены ключевые гены, ответственные за манифестацию, прогрессирующее течение или предрасположенность к данному заболеванию.
При витилиго обнаружено снижение антиоксидантного потенциала, приводящего к активному повреждающему воздействию на меланоциты свободных радикалов и накоплению продуктов перекисного окисления липидов [8, 9]. Позднее выяснилось, что свободные радикалы оказывают повреждающее действие на разные клетки, участвующие в воспалительных реакциях разного типа, и нарушения антиоксидантной защиты не являются основными механизмами депигментации при витилиго.
Теория нарушений иммунных механизмов регуляции является наиболее обоснованной. При длительном течении и распространенном патологическом процессе наблюдаются изменения в субпопуляционном составе Т-лимфоцитов. Одновременно с этим, особенно на начальных стадиях заболевания, повышаются уровни активационных рецепторов лимфоцитов, отражающие степень активации иммунокомпетентных клеток [10]. В настоящее время большинство исследователей полагают, что ведущая роль в развитии аутоиммунных заболеваний принадлежит клеточно-опосредованным реакциям, при которых наблюдается выраженный дисбаланс цитокинов. При витилиго выявляется снижение активности регуляторных Т-лимфоцитов, что подтверждается уменьшением количества трансформирующего фактора роста-β (TGF-β) и интерлейкина-10 (ИЛ-10) в сыворотке крови больных [11].
Лечение витилиго является сложнейшей задачей. Так как причины его возникновения неизвестны, в большинстве случаев заболевание развивается на фоне полного физического благополучия. Предлагается применять в основном топические стероиды и/или иммуномодуляторы при площади поражения до 20%, а также длительную фототерапию [12, 13]. В комплексную терапию включают ферментные препараты, гепатопротекторы, витамины и микроэлементы (цинк, медь) [14, 15]. В ряде рекомендаций содержатся сведения о применении седативных и антидепрессивных средств.
Цель настоящего исследования — изучение клинических особенностей течения витилиго и эффективности комплексной терапии, включающей иммуномодулирующий компонент — тимоген и наружно 1% пимекролимус, и коррекцию аффективных расстройств у больных разными формами витилиго с использованием препарата антидепрессивного действия агомелатин.
Материал и методы
Все больные разными формами витилиго были полностью обследованы (проведены клинические анализы крови и мочи, биохимический анализ крови, ультразвуковое исследование органов брюшной полости и щитовидной железы, гормоны щитовидной железы Т3, Т4, тиреотропный гормон — ТТГ и антитела к тиреоидной пероксидазе — АТ-ТПО по показаниям, консультация невропатолога по показаниям, консультация психиатра, иммунологические исследования — популяционный и субпопуляционный состав лимфоцитов, уровень провоспалительных и регуляторных цитокинов).
Результаты
Под нашим наблюдением с 2006 по 2011 г. находились 84 больных витилиго (46 женщин, 38 мужчин) в возрасте от 18 до 56 лет.

Давность заболевания варьировала от 6 мес до 30 лет, средняя продолжительность составила 6,5±4,8 года. Среди вероятных причин развития витилиго большинство больных называли перенесенный стресс (39 пациентов, 46%). Витилиго возникло после оперативных вмешательств у 3 (3,5%) пациентов, после травм — у 4 (4,5%). По мнению 4 (5%) женщин, впервые депигментированные пятна появились у них после родов, в период лактации, причем 1 пациентка отмечала, что после 2- и 3-х родов увеличивалась площадь поражения и появлялись свежие очаги. У 14 (17%) больных заболевание возникло после воздействия длительного ультрафиолетового излучения, 20 (24%) пациентов не могли связать появление депигментированных пятен с какими-либо значимыми причинами (рис. 1). Рисунок 1. Вероятные причины развития витилиго. У 21 больного среди ближайших родственников имелись проявления витилиго разной давности и степени распространенности, у 2 из них, помимо поражений кожи были обесцвечены участки волос.
При обследовании больных витилиго обнаружено, что наиболее часто (у 48 больных, 57,1%) встречаются дискинезия желчевыводящих путей и желчекаменная болезнь, хронический холецистит, жировой гепатоз. Гастрит обнаружен у 16 (19%) больных. В процессе обследования патология щитовидной железы (аутоиммунный тиреоидит, диффузный токсический зоб, кисты щитовидной железы) выявлена или подтверждена у 13 (15,4%) больных витилиго. Только у 4 больных из 13 с патологией щитовидной железы были обнаружены АТ-ТПО, что подтверждало диагноз аутоиммунный тиреоидит.

Гинекологические заболевания (дисфункциональные нарушения менструального цикла, миома) обнаружены у 5 (5,9%) женщин. У 10 (11,9%) больных подтверждена гипертоническая болезнь I—II степени, у 1 (1,2%) выявлен сахарный диабет 2-го типа, у 3 (3,5%) обнаружено алиментарное ожирение II—III степени. Достоверных отклонений от нормальных значений в клинических анализах крови не обнаружено. Тяжелых хронических заболеваний или декомпенсированных состояний у больных витилиго не выявлено (табл. 1).
Мы наблюдали за больными с разными формами витилиго (табл. 2). Среди них 7 (8,3%) больных имели сегментарную форму с площадью поражения 2% (рис. 2). Рисунок 2. Сегментарная форма витилиго. Вульгарная форма наблюдалась у 44 (52,3%) больных. В этих случаях площадь поражения составляла 3—70% площади кожного покрова (рис. 3, а, б). Рисунок 3. Пациентка (а) и пациент (б) с вульгарной формой витилиго. Отдельную группу составили больные с акрофациальной формой (31 человек, 36,9%) с депигментированными очагами на лице и конечностях (рис. 4, а—в). Рисунок 4. Акрофациальная форма витилиго (а—в). У 10 (11,9%) пациентов при клиническом обследовании обнаружены невусы Сеттона (рис. 5). Рисунок 5. Невусы Сеттона.
Витилиго является серьезной психологической проблемой [16, 17]. При исследовании уровня тревожности методом Спилбергера—Ханина низкий уровень реактивной тревожности наблюдается у 52 (61,9%) больных, а у 32 (38,1%) — умеренно выраженная реактивная тревожность. У 55 (77,4%) больных витилиго отмечен высокий уровень личностной тревожности, причем он не зависел ни от площади поражения, ни от давности заболевания. Наличие депрессивных расстройств подтверждены с помощью госпитальной шкалы Гамильтона (средний показатель 13,9±2,4 балла) и шкалы Бека (средний показатель 22,4±2,8 балла). У большинства обследованных выявлялись депрессивные расстройства невротического уровня, характеризующиеся подавленностью настроения, нарушением сна, тревожными и астеническими проявлениями.
Таким образом, в ходе обследования каких-либо тяжелых сопутствующих заболеваний не выявлено. По данным литературы, аффективные и вегетативные нарушения наблюдаются практически у всех больных витилиго и требуют адекватной коррекции.
При иммунологическом исследовании, проведенном 25 больным витилиго, обнаружены достоверные отклонения от контрольных значений в субпопуляционном составе Т-лимфоцитов и дисбаланс провоспалительных цитокинов (табл. 3; рис. 6). Рисунок 6. Содержание цитокинов в сыворотке больных витилиго. Примечание. ИЛ-2, ИЛ-8, ФНО-α, ИФН-γ, ИЛ-10 в пг/мл; TGFβ, в нг/мл. Так, содержание CD8+ в крови больных витилиго было достоверно выше, чем у здоровых, иммунорегуляторный индекс (ИРИ) также имел достоверные отличия от контрольных значений. В сыворотке крови больных витилиго обнаружено повышенное содержание ИЛ-2, ИЛ-6, ИЛ-8 и фактора некроза опухоли-α (ФНО-α), интерферона-γ (ИФН-γ) на фоне низкого уровня регуляторных цитокинов TGF-β и ИЛ-10 по сравнению с контролем.
Комплексное лечение больных проводили с учетом клинических особенностей витилиго, в том числе давности, распространенности и активности патологического процесса. Использовали направленную иммуномодулирующую терапию — тимоген (назальный спрей по 1 мл/сут в течение 20 дней) и пимекролимус (1% крем 2 раза в сутки в течение 4—6 мес). Психокорригирующую терапию проводили агомелатином, который является агонистом мелатонина (МТ1- и МТ2-рецепторов) и антагонистом 5НТ2с. Агомелатин больные витилиго принимали по 25 мг/сут 1 раз в день не менее 6 нед. После консультации психиатра 5 больным с умеренно выраженными признаками депрессии агомелатин был назначен в суточной дозе 50 мг на 12—24 нед.
Мы провели комплексное лечение 57 больным разными формами витилиго (3 пациента — с сегментарной формой, 25 — с акрофациальной, 29 — вульгарной).
У всех больных с сегментарной формой витилиго 100% репигментация наблюдалась через 4 мес после начала терапии.
У больных акрофациальной формой полная клиническая ремиссия отмечена в 16 (64%) случаях через 5 мес терапии. Значительное улучшение со 100% репигментацией большинства очагов и уменьшением площади очагов депигментации более чем на 60% имелось у 7 пациентов. Незначительная эффективность отмечена у 2 больных, причем полностью восстановилась нормальная окраска кожи в периорбитальных и периоральной областях, на тыльной поверхности кистей и в области фаланг площадь депигментированных очагов практически не изменилась, частично (до 40%) уменьшилась площадь очагов в области голеностопных суставов.
Положительные изменения после проведенной комплексной терапии наблюдались у всех больных вульгарной формой витилиго. Клиническая ремиссия отмечалась у 20 из 29 больных данной группы.
В течение первых 3 мес терапии (12 нед) у этих пациентов началась активная репигментация очагов, площадь которых сокращалась на 30—60%. К концу 6-го месяца цвет кожи восстановился полностью.

У 6 больных наблюдалось сокращение площади депигментированных очагов на 50—70% за счет полной репигментации отдельных очагов и частичного восстановления нормального цвета кожи отдельных участков. У 3 пациентов отмечались незначительные позитивные изменения, которые выражались в восстановлении пигментации свежих, небольших по площади участков (не более 2 см 2 ), сглаживании границ по периферии очагов депигментации (табл. 4).
Все больные хорошо переносили лечение, побочных эффектов, осложнений, отказов от терапии не было. В процессе терапии удалось изменить отношение пациентов к своему заболеванию, оценить позитивные изменения в процессе лечения. На фоне активной репигментации очагов нормализовались иммунологические показатели и произошла редукция признаков депрессивных расстройств.
Таким образом, полученные нами результаты свидетельствуют о возможности обоснованного эффективного и безопасного лечения витилиго.
Читайте также:

