Сухость кожи при пвт
Обновлено: 26.04.2024
ГБОУ "Омская государственная медицинская академия" Министерства здравоохранения Российской Федерации
ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
ГБОУ ВПО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
Мочевина — «золотой стандарт» терапии ксероза кожи
Журнал: Клиническая дерматология и венерология. 2020;19(1): 93‑100
ГБОУ "Омская государственная медицинская академия" Министерства здравоохранения Российской Федерации
Ксероз — многогранное и часто встречающееся состояние кожи, часто проявляется как единственный симптом, но может сопровождать такие хронические кожные или системные заболевания, как атопический дерматит, псориаз, фолликулярный кератоз, сахарный диабет и др. Дополнительными причинами ксероза являются дефицит натурального увлажняющего фактора (NMF), дефицит липидов рогового слоя кожи, а также уменьшение собственной сети влаги кожи, образованной водными каналами — аквапоринами. В большинстве случаев пациенты могут эффективно лечить ксероз с помощью эмолентов. Применение смягчающих и увлажняющих средств — обязательный компонент базисной наружной терапии хронических дерматозов, потенцирует лечебное (в том числе противовоспалительное) действие топических кортикостероидов и снижает риск развития побочных эффектов. Лечебно-косметические средства применяют не только для нормализации уровня трансэпидермальной потери воды, но и для восстановления барьерных свойств эпидермиса. Мочевина — хорошо изученный компонент NMF, широко используется в клинической практике для уменьшения сухости и гиперкератоза кожи. Увлажняющую активность мочевины можно увеличить путем сочетания ее с церамидами, гликоглицеролом и другими компонентами NMF.
ГБОУ "Омская государственная медицинская академия" Министерства здравоохранения Российской Федерации
ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
ГБОУ ВПО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
Ксероз кожи — состояние, при котором наблюдается чрезмерная сухость кожи вследствие изменения ее гидролипидной мантии, что проявляется шелушением, ощущением стянутости, зудом, появлением микротрещин, раздражением, а в некоторых случаях и присоединением кожных инфекций ввиду снижения барьерной функции [1].
Синдром сухой кожи лежит в основе многих патологических состояний кожи и ее придатков — атопического дерматита (АД), ихтиоза, врожденных кератодермий, астеатотической экземы, фотостарения кожи, псориаза и некоторых других [2].

Ксероз является распространенной дерматологической патологией, протекает как хронически, так и остро из-за влияния экзогенных (факторы окружающей среды), эндогенных (прием определенных лекарственных препаратов, сопутствующие заболевания, такие как сахарный диабет, заболевания почек и желчевыводящих путей) факторов и связан с возрастом (таблица) Таблица. Причины ксероза кожи [3, 4].
Медицинский скрининг жителей Германии продемонстрировал, что каждый третий в возрасте от 16 до 70 лет (29,4%) страдает от ксероза кожи [5]. Распространенность ксероза возрастает с увеличением возраста [5, 6]. В пожилом возрасте (средний возраст 83,6 года) ксероз кожи наблюдался в 99,1% случаев [7, 8]. Известно, что ксероз кожи часто встречается у больных А.Д. Данные исследований KIGGS (исследования здоровья детей и подростков в Германии) показали, что распространенность АД у детей и подростков составляет 13,2% [9, 10].
Своевременное выявление, диагностика и лечение ксероза кожи имеет большое значение, так как развивающееся в результате ксероза нарушение эпидермального барьера способствует повышению чувствительности кожи к факторам окружающей среды (воздействие аллергенов, бактериальных и грибковых патогенов), что может провоцировать возникновение атопического и контактного дерматита, а также других дерматозов [11].
Коррекция сухости кожи является обязательным компонентом базисной наружной терапии хронических дерматозов — псориаза, ихтиоза, АД и др., поскольку смягчение/увлажнение делает кожу менее чувствительной к ирритантам, бактериальным и контактным аллергенам [12—14]. Применение смягчающих и увлажняющих средств потенцирует лечебное действие (в том числе противовоспалительное) топических кортикостероидов и снижает риск развития побочных эффектов.
Ксероз кожи можно рассматривать как нарушение естественной барьерной функции кожи, приводящее к снижению ее гидратации [4]. Уровень гидратации рогового слоя — важный индикатор его барьерных свойств. Применение лечебно-косметических средств способствует восстановлению барьерной структуры эпидермиса и нормализации уровня трансэпидермальной потери воды (ТЭПВ) [15—18].
В последнее время барьерная функция кожи вызывает все больший интерес исследователей в связи с тем, что ее состоятельность напрямую влияет на течение АД, экземы и других заболеваний и состояний, сопровождающихся повышенной сухостью кожи.
В основе патогенеза ксероза лежат 3 ключевых момента:
— уменьшение уровня натурального увлажняющего фактора (NMF);
— изменения в составе межклеточного липидного слоя;
— нарушения собственной системы увлажнения кожи, образованной водными каналами — аквапоринами [19].
Особое значение в формировании сухости кожи придают изменениям NMF и липидов рогового слоя [20, 21].
NMF — это комплекс водорастворимых низкомолекулярных соединений органической и неорганической природы, способных за счет осмотической активности притягивать и удерживать молекулы воды [22, 23].

Исследования увлажненности рогового слоя эпидермиса в разных условиях позволили установить, что комплекс NMF способен захватывать воду из внешней среды и удерживать ее при сухом климате [22]. NMF представляет собой продукт распада белка филлагрина в роговом слое и играет ключевую роль в процессах гидратации кожи (см. рисунок) Компоненты натурального увлажняющего фактора. [24].
В состав NMF входят такие гидрофильные вещества, как мочевина, молочная, пирролидонкарбоновая кислоты, аминокислоты (аланин, аргинин, глицин, гистидин, лейцин, лизин, серин, треонин), аммиак и неорганические соли. Концентрация NMF в эпидермисе всегда снижена при ксерозе, АД и ихтиозе [25].
Регулярное использование сильнощелочных моющих средств, горячая вода, ультрафиолетовое облучение могут привести к уменьшению содержания NMF в роговом слое кожи. Доказано также, что NMF — эстрогензависимый компонент, поэтому вторичная сухость кожи всегда развивается у женщин в перименопаузальный период на фоне возрастной гипоэстрогении [26].
Значение компонентов NMF для поддержания гомеостаза рогового слоя сложно переоценить: они обладают выраженными увлажняющими свойствами, поддерживают кислотный уровень рН кожи, контролируют сцепление корнеоцитов и стимулируют эпидермальную дифференцировку; увеличивают синтез липидов кератиноцитами, повышая активность ферментов сфинголипидного метаболизма (таких как палмитолтрансфераза, холестеролсинтетаза, сфингомиелиназа и др.) [27, 28]. Клинически дефицит NMF проявляется шелушением кожи, зудом, ощущением стянутости, появлением трещин. Среди компонентов NMF, используемых в препаратах для местного применения, наиболее известны мочевина [29], молочная [30] и пирролидонкарбоновая [31] кислоты. Наиболее изучена из них мочевина. Она не только эффективно увлажняет кожу, но и улучшает ее барьерную функцию. К тому же одним из полезных свойств мочевины является способность усиливать проникновение других активных компонентов в более глубокие слои кожи, уменьшать зуд, а в более высоких концентрациях — оказывать кератолитический эффект [4].
Благодаря своим увлажняющим и кератолитическим эффектам мочевину используют для лечения дерматологических заболеваний кожи уже более столетия [32]. В последние годы установлены новые важные механизмы ее действия: геномный и транскриптомный анализы показали, что мочевина стимулирует экспрессию ряда эпидермальных антимикробных и транспортных белков. При исследовании эффектов мочевины на кожу в сравнении с плацебо продемонстрировано, что применение крема на основе мочевины в течение нескольких часов уменьшало ТЭПВ и тем самым улучшало барьерную функцию кожи.
Мочевина стимулировала экспрессию антимикробных пептидов — каталицидина и бета-дефензина-2, способствовала увеличению образования ферментов, ответственных за синтез липидов.
Мочевина способна удерживать воду внутри эпидермиса. В концентрациях до 10% мочевину применяют для терапии ксероза, в том числе сопровождающегося зудом, для устранения сухости кожи и для увлажнения. В концентрациях 10—25% она вызывает конформационные изменения в белковых структурах кожи и таким образом способствует отшелушиванию эпидермиса без влияния на физиологию и целостность кожи. В концентрациях свыше 25% кератолитический эффект мочевины более выражен, что часто используется для терапии гиперкератозов. В высоких концентрациях и при использовании окклюзионных повязок мочевина способна растворять твердый кератин ногтей, поэтому ее применяют для лечения онихомикозов в комплексе с антигрибковыми препаратами.
Основные эффекты мочевины:
— стимулирующий эпидермальную дифференцировку;
— увеличивающий синтез липидов кератиноцитами (за счет повышения активности ферментов сфинголипидного метаболизма);
— улучшающий барьерную функцию кожи (за счет усиления механизмов восстановления кожи);
— противомикробный (за счет выработки кератиноцитами антимикробных пептидов);
В сочетании с церамидами, витаминами, парафином, глицерином, гликоглицеролом и другими компонентами NMF (например, молочной кислотой) гидратирующий эффект мочевины увеличивается [37—41]. Кроме того, эффективность применения мочевины определяется лекарственной формой препаратов. Более интенсивное и продолжительное действие оказывают эмульсии типа «вода в масле» по сравнению с эмульсиями типа «масло в воде» [42].
В сухой коже содержание мочевины значительно снижено, а применение препаратов, содержащих мочевину, способно компенсировать дефицит мочевины в коже. С увеличением концентрации (от 2 до 15%) растет и гидратирующая способность мочевины. В ряде исследований в результате комбинирования средств, содержащих 5 или 10% мочевины, с пантенолом, бисабололом [43], церамидами и молочной кислотой [44] установлено, что лучшими гидратирующими свойствами обладали такие комбинированные препараты, чем комбинации без мочевины.
В 2 двойных слепых клинических исследованиях для терапии пациентов с ксерозом применяли комплексное увлажняющее средство, состоящее из комбинации мочевины (10%), дополнительных компонентов NMF и липидов рогового слоя. В качестве контрольного образца использовали инертную основу, не содержащую активных веществ. В отличие от препаратов с инертной основой комплексное увлажняющее средство в течение 2 нед значительно увеличивало содержание мочевины в роговом слое, а также улучшало гидратацию и барьерную функцию кожи. В процессе исследования продемонстрировано, что увлажняющая композиция активирует экспрессию аквапоринов [45].
Аквапорины — это семейство водных каналов, ответственных за транспортировку воды в тканях по всему организму. Аквапорин-3 (AQP-3) — преобладающий канал, расположен в эпидермисе, транспортирует воду и глицерин. Уровень AQP-3 снижается в сухой коже, что и приводит к увеличению ТЭПВ [46].
Более того, увлажняющая композиция стимулировала экспрессию генов, принадлежащих к комплексу эпидермальной дифференцировки, что свидетельствует о перспективности применения такой композиции при АД, ихтиозе и псориазе.
Комплекс эпидермальной дифференцировки также играет решающую роль в синтезе ω-О-ацилцерамидов, истощение которых считается признаком дисфункции кожного барьера [45].
В 2 одноцентровых рандомизированных двойных слепых контролируемых испытаниях протестированы 2 композиции с соответствующими базовыми основами, обогащенными только мочевиной и молочной кислотой. Обе увлажняющие композиции содержали компоненты NMF (в том числе мочевину и молочную кислоту), церамид-3 и гликоглицерол, последний, как было показано, стимулирует образование AQP-3 в сухой коже. Увлажняющие композиции были изготовлены по типу эмульсии «вода в масле».
Первая композиция Eucerin Urea Repair Plus Lotion содержала 5% мочевины, вторая — 10% мочевины. Результаты исследований показали, что обе композиции в отличие от базовых основ значительно улучшали увлажнение и барьерную функцию кожи, а также уменьшали ТЭПВ. Видимый эффект проявлялся на 1—2-й неделе терапии и сохранялся как минимум 6 дней после прекращения лечения [19].
В исследовании K.A. Jung продемонстрировано, что увлажняющая композиция с 10% мочевины после 4 нед лечения больных псориазом значительно улучшала гидратацию и барьерную функцию кожи. Кроме того, значительно уменьшились десквамация и зуд [47].
Эта же увлажняющая композиция продемонстрировала хорошие результаты и переносимость при лечении ксероза кожи у больных сахарным диабетом. Известно, что у 30—70% пациентов, страдающих диабетом, есть сопутствующие проблемы с кожей. Увлажняющую композицию, содержащую 10% мочевины, молочную кислоту и другие компоненты NMF, церамид-3 и гликоглицерол, наносили дважды в день в течение 2 нед на проблемные участки кожи на руках, ногах и стопах. Высокое содержание увлажняющих компонентов значительно уменьшало клинические и субъективные симптомы ксероза (ощущение стянутости, зуд, шелушение) [48]. В другом исследовании применение мочевины способствовало профилактике развития диабетической стопы [49, 50].
В мультицентровом исследовании, проведенном в 6 странах среди 1299 больных с ксерозом различной степени тяжести (от легкой до тяжелой) как единственным симптомом либо в составе хронических заболеваний (псориаз, сахарный диабет, фолликулярный кератоз), авторы использовали дерматокосметические средства, содержащие мочевину, церамиды, гликоглицерол и другие компоненты NMF, применяя их дважды в день в течение 4 нед. По завершении исследования отмечено значительное уменьшение тяжести проявления ксероза (на 91%), в том числе у больных хроническими заболеваниями, такими как псориаз и фолликулярный кератоз [51].
Выводы
В дерматологии мочевина используется для лечения широкого спектра заболеваний кожи, сопровождающихся сухостью (ихтиоз, атопический, контактный, себорейный дерматит, псориаз), а также онихомикоза [52]. Как правило, побочные реакции на мочевину встречаются редко и проявляются ощущением жжения или раздражения при нанесении на поврежденную кожу средств, содержащих высокую концентрацию мочевины [53]. Обзор средств, содержащих мочевину, показал, что большинство неблагоприятных реакций возникало не на саму мочевину, а на добавленные вспомогательные вещества [52].
Исходя из научных данных, можно сделать заключение, что мочевина является «золотым стандартом» в терапии ксероза. Она не только эффективно увлажняет кожу, но и улучшает ее барьерную функцию, а также собственные защитные и гидратационные механизмы кожи. Мочевина увеличивает проникновение активных ингредиентов в кожу и оказывает противозудное, а при более высоких концентрациях — кератолитическое действие.
При выборе концентрации мочевины и формы препарата следует учитывать индивидуальное состояние кожи больного и его заболевание. С точки зрения гидратирующего действия мочевины средства, содержащие комбинацию мочевины, церамидов и NMF, более эффективны. При использовании эмульсий типа «вода в масле» эффект может быть более длительным, чем при использовании эмульсий типа «масло в воде».
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Актуальность. Проблема этиотропного лечения хронического вирусного гепатита С (ХВГС), несмотря на большое количество исследований, по-прежнему остается актуальной и до конца не решена.
Эффективность лечения по данным разных исследователей не превышает 46-51% у больных ХВГС с 1-м генотипом и 70-80% у больных ХВГС с не 1-м генотипом 2. Так же ограничивают их применение высокая стоимость препаратов и большое количество побочных эффектов от проводимой терапии. Целью проведения этиотропной терапии ХВГС является подавление вирусной репликации, эрадикация вируса из организма и, соответственно, прекращение инфекционного процесса. Даже отсутствие вирусологического эффекта при специфической терапии приводит к замедлению прогрессирования заболевания, стабилизации или регрессии патологических изменений в печени, предупреждению формирования цирроза печени и первичной гепатоцеллюлярной карциномы, а также повышению качества жизни.
«Золотым стандартом» терапии ХВГС, является комбинация стандартного рекомбинантного α2 интерферона короткого действия и рибавирина, или комбинация пегилированного интерферона и рибавирина [1,4].
Оценку эффективности специфического лечения осуществляют на основании нескольких критериев: вирусологического (исчезновение рибонуклеиновой кислоты (РНК) вируса из сыворотки крови), биохимического (стойкая нормализация уровня ферментов печени) и морфологического (уменьшение индекса гистологической активности и стадии фиброза).
В целом около 5% больных [1,5] вынуждены отказаться от специфического противовирусного лечения в начале курса из-за многочисленных побочных эффектов, а 20% не доводят его до конца.
Побочные эффекты интерферона (ИФН) и рибавирина иногда вынуждают временно или постоянно снижать их дозы или отменять препараты. Некоторыми исследователями [5] показано, что для достижения устойчивого вирусологического ответа (УВО) необходимо получение не менее 2/3 дозы ИФН и рибавирина, поэтому эффективность комбинированной противовирусной терапии (КПВТ) напрямую зависит от наличия побочных эффектов и возможностью их коррекции.
Некоторые побочные эффекты не требуют медикаментозной терапии, так как носят легкий или среднетяжелый характер, другие - тяжелый и угрожающий жизни характер, при этом необходима специфическая коррекция. Как правило, после окончания терапии большинство побочных эффектов полностью исчезает без применения симптоматической терапии.
Проблема побочных эффектов на фоне проводимой КПВТ остается до конца не изученной, несмотря на проведенные многочисленные исследования.
Основными побочными явлениями, описанными в литературе, являются: гематологические изменения; гриппоподобный, диспепсический, неврологический и астеновегетативный синдромы; аутоиммунные поражения; снижение массы тела; выпадение волос; огрубение кожи; аллергические реакции различной степени выраженности; местная реакция в области введения интерферонов.
Таким образом, проблема побочного действия комбинированного противовирусного лечения ХВГС, его влияние на достижение УВО является актуальной в настоящее время.
Целью данного исследования было изучение побочных явлений КПВТ в зависимости от схемы лечения, сопутствующих заболеваний, влияние на достижение УВО. Для достижения поставленной цели были сформулированы следующие задачи: оценить переносимость КПВТ пациентами с различными схемами терапии, выявить частоту побочных эффектов КПВТ и взаимосвязь их с достижением УВО.
Материалы и методы. В исследование были включены 50 пациентов с установленным диагнозом ХВГС, которые получали КПВТ. Диагноз был подтвержден согласно общепринятым методикам.
Из исследования исключались пациенты с микст-инфекцией (вирусный гепатит В, ВИЧ-инфекция) а так же наличием сопутствующей патологии печени (первичный билиарный цирроз, болезнь Вильсона-Коновалова, синдром Бадда-Киари, гемохроматоз, аутоиммунный гепатит, дефицит альфа-1 антитрипсина) и предшествующего специфического противовирусного лечения по поводу ХВГС, больные с наличием любого из общепринятых противопоказаний для проведения КПВТ.
До начала терапии всем пациентам проводилось определение генотипа вируса гепатита С методом полимеразной цепной реакции (ПЦР) в режиме «реального времени» (с чувствительностью использованных тест-систем Амплисенс) 50 копий/мл), ультразвуковое исследование печени, клинический и биохимический анализы крови. Определение степени фиброза печени производилось методом фиброэластометрии (Fibroscan FS-502, Echosens, Франция) с определением индекса фиброза по Metavir или с помощью биопсии печени по Менгини с определением индекса гистологической активности по Ishak.
Продолжительность лечения составила 48 недель для пациентов, инфицированных генотипом 1в вирусного гепатита С или при наличии у больного цирроза печени; 24 недели для пациентов, инфицированных генотипом 2 и 3а. Согласно рекомендациям по ведению пациентов с ХВГС, КПВП включала комбинацию стандартного (Интрон или Альтевир 3 млн МЕ 3 раза в неделю) или пегилированного (ПегИнтрон 120 мкг или Пегасис 180 мкг в неделю) ИФН и рибавирина в дозировке 800-1200 мг в зависимости от массы тела.
Устойчивый вирусологический ответ (УВО) определялся как отсутствие РНК вируса в сыворотке крови спустя 24 недели после окончания КПВТ. Больные находились под наблюдение в течение терапии на базе Воронежской областной клинической инфекционной больницы и поликлиник Воронежа. Все пациенты были разделены на 2 группы: получающие в составе КПВТ стандартные ИФН – 52,0% (26 человек) или пегилированные ИФН – 48,0% (24 человек). Пациенты были сопоставимы по возрасту и полу: средний возраст составил 40,3 ±10,4, количество мужчин - 57,1%, женщин 42,9%. Распределение по группам показано в табл. 1.
Таблица 1. Характеристика пациентов в исследуемых группах

При анализе полученных результатов использовались описательные методы математической статистики с применением пакета программ Microsoft Excel 2010. Достоверность различий оценивалась методами непараметрической статистики, статистически значимыми считались различия результатов при р≤0,05.
Результаты. При анализе эпидемиологических данных выяснено, что в большинстве случаев (34% случаев) ХВГС выявлен случайно, без клинических проявлений. Одинаковое количество пациентов (по 8 человек - 19,2%) обследовались по поводу диспепсических жалоб и длительного повышения печеночных ферментов. У 30 % пациентов в анамнезе отмечались неоднократные операции или переливание крови; употребление внутривенных наркотиков - у 16% человек. Длительность заболевания до начала противовирусной терапии составила в 1 группе 3±1,4 лет, во 2 группе 5±3,4лет. Степень фиброза по Metavir в среднем составил в 1 группе 1±0,85 балла, во второй группе выше - 1,9±1,5 баллов.
Соотношение генотипов вируса гепатита С, определенных до начала КПВТ, показано в табл. 2.
Таблица 2. Соотношение генотипов вирусного гепатита С

Среди всех пациентов УВО определялся в большинстве случаев - 80,0%, при применении обоих видов терапии, но при этом достоверных различий между группами по этому признаку не выявлено. Эффективность терапии в 1 группе составила 75,1%, во 2 группе - 78,2%. Отсутствие вирусологического ответа в половине случаев связано с отменой препаратов из-за развития выраженных побочных эффектов (прогрессирование неврологической симптоматики с развитием энцефалопатии в 1 группе, длительная некупируемая лихорадка во 2 группе).
Частота побочных эффектов в общей выборке была достаточно высокой - 72,3% среди всех пациентов, при этом в 1 и 2 группе нежелательные явления встречались с одинаковой частотой (69,1% и 73% соответственно).
На протяжении всей терапии у большинства пациентов встречался астеновегетативный синдром в виде выраженной слабости, усталости, нарушения сна, при этом значительно чаще эти проявления отмечали пациенты 2 группы - принимающие пегилированные ИФН (30,7%), что в 2,1 раза чаще, чем во 1 группе (66,6%). Снижение настроения, появление раздражительности, неконтролируемой агрессии при опросе отмечали 23,0% пациентов 1 группы и 25,0% пациентов 2 группы. Данные жалобы чаще встречались на 24±2 неделе терапии. Описанная в литературе депрессия, индуцированная КПВТ, среди данной выборки не встречалась. Для выявления депрессии у всех пациентов применялся опросник Цунга в начале и при завершении КПВТ.
Гриппоподобный синдром, проявляющийся лихорадкой до 38±0,85?С, миалгией, артралгией, выявлен достоверно чаще в у пациентов 1 группы (38,4%), чем у 2 группы (30,1%). Длительность лихорадки составляла в среднем 14±2 недель, первый подъем температуры всегда сопровождал начало КПВТ. Лихорадка купировалась применением препаратов НПВС в стандартных дозировках.
Жалобы со стороны желудочно-кишечного тракта в виде снижения аппетита, тошноты, периодической диареи, боли, вздутия в животе отмечались у 34,6% пациентов 1 группы, что в 2,08 раза чаще, чем во 2 группе (16,6%) .Желтуха на фоне КПВТ встречалась у 2 человек в каждой группе (по 8,3% и 7,6% соответственно).
Снижение веса в среднем на 10,5±5,1 кг, регистрируемое к концу КПВТ, встречалась в 2,3 раза чаще у пациентов 1 группы (19,2%) чем у пациентов среди пациентов 2 группы (8,3%).
Выпадение волос, жалобы на сухость кожи, зуд кожи регистрировались редко: в 1 группе у 2 человек (7,6%среди группы), во 2 группе чаще - у 3 человек(12,5%).
Обострение имеющихся сопутствующих соматических заболеваний встречались в обеих группах приблизительно с одинаковой частотой (30,1% и 27,6% соответственно). Чаще всего встречались обострения хронического панкреатита, язвенной болезни желудка, сахарного диабета.
Частота манифестации впервые выявленных соматических заболеваний на фоне проведения КПВТ имеет прямую корреляционную связь с используемыми препаратами, то есть значительно чаще выявляется при применении ИФН короткого действия, чем пролонгированных форм. При этом в 1 группе на фоне КПВТ манифестировали псориаз (7,6%), аутоиммунный тиреодит (15,3%). А во 2 группе выявлялись гипотиреоз и сахарный диабет (по 4,1% пациентов).
Гематологические осложнения встречались в обеих группах. Анемия, регистрируемая в виде снижения гемоглобина ниже 110г/л, встречалась чаще всего в середине терапии (24±3недели КПВТ). Во второй группе анемия выявлена достоверно чаще – в 2,4раза чаще (38,4%случаев), чем в 1 группе (16% случаев). Эритропоэтин для коррекции анемии применялся в 4 случаях (8%), у остальных коррекции анемии не требовалось.
Среди пациентов обеих групп при наличии анемии УВО встречается в 49,7% случаев, при отсутствии анемии достоверно реже (в 1,35 раз) - у 36,6% пациентов. Таким образом, наличие анемии, в сочетании с другими факторами можно считать предиктором эффективности КПВТ.
Напротив, частота тромбоцитопении на фоне КПВТ коррелировала с отсутствием УВО. Пациенты со снижением уровня тромбоцитов в 1,8 раз реже достигали УВО. Среди всех пациентов тромбоцитопения встречалась только у 8,0% пациентов, что реже, чем по литературным данным. В обеих группах частота данного побочного действия была одинаковой.
Выводы
1. Эффективность терапии с применением препаратов пегилированных или стандартных интерферонов оказалась сходной.
2. Гематологические нежелательные эффекты выявлены достоверно чаще при использовании пегилированных ИФН в составе противовирусной терапии.
3. Гриппоподобный на фоне КПВТ встречались достоверно чаще у пациентов, получающих стандартные ИФН.
5. Выявлена зависимость между достижением устойчивого вирусологического ответа и величиной снижения уровня гемоглобина.
Список использованных источников:
1. Беляева Н.М., Турьянов М.Х., Рабинович Э.З. Комбинированная терапия гепатита С рибавирином и альфа-интерфероном: Пособие для врачей. - М.: РМАПО. – 2002.
2. Громова Н.И. и Богомолов Б.П. Клиническая эффективность этиотропной терапии хронического вирусного гепатита С// Клин. мед. - 2003.-№1. - С.48.
3. Ивашкин В.Т. Комбинированное лечение хронического гепатита В// Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1998. №5. С. 57-60.
4. Ferenci P., Fried M., Shiffman M. et al. Predicting sustained virological responses in chronic hepatitis C patients treated with peginterferon alfa-2a// J. Hepatol. – 2005. – Vol. 43. – P. 425–433.
5. Fried M.W. Side effects of therapy of hepatitis C and their management. Hepatology. 2002. - P.237-244
6. Князькина О.В., Каган Ю.Д., Скачков М.В. Микробиоценоз кишечника у больных хроническим вирусным гепатитом С и его лечение// Врач-аспирант, №3.4(52), 2012. – С.579-586.
7. Пирогова И.Ю., Пышкин С.А. Неинвазивная диагностика стадии фиброза у пациентов с хроническими гепатитами В и С// Врач-аспирант, №2(45), 2011. – С. 21-27.
8. Попов С.С., Попов С.Ф. Динамика биохимических показателей гепато-билиарной системы рабочих основных цехов металлургического завода, инфицированных вирусами гемоконтактных гепатитов В и С// Врач-аспирант, №6(55), 2012. – С.55-61.
9. Рихсиева Г.М. Особенности клинико-иммунологических показателей детей, больных острыми вирусными гепатитами А и В, родившихся от матерей, злоупотребляющих алкоголем// Врач-аспирант, №4.4(47), 2011. – С. 675-681.
10. Рюмин А.М., Корочкина О.В., Соболевская О.Л. Закономерности естественного течения хронического гепатита В// Врач-аспирант, №4.1(53), 2012. – С. 214-223.
Подписано в печать: 01.02.2013
Знакомая фраза: «Красота идет изнутри»? Это чистая правда. Чтобы поддержать красоту снаружи, нужно создать здоровье внутри. Сегодня мы поговорим о том, почему лечение заболеваний кожи, чистки и другие косметологические процедуры стоит начинать с печени и желчного пузыря.

Сначала — 3 реальные истории наших пациентов
История 1: похудение, дорогие кремы и желчный пузырь
Пациентка П., 36 лет. На новом рабочем месте – высокие требования к внешности. Пациентка села на строгую диету, занялась спортом и похудела за месяц на 8 кг. Однако, усилились высыпания на коже - появились участки покраснения, шелушения, акне. Лечение у косметолога не помогло и даже дорогие средства для кожи не давали результата.
По совету очередного дерматолога пациентка пришла на обследование к гастроэнтерологу-гепатологу. На приеме пациентка вспомнила, что во время занятий спортом иногда ощущала покалывание в правом боку, но внимания не обращала. Врач назначил УЗИ, где были выявлены изменения в желчном пузыре: из-за нерегулярного питания он был спазмирован, стала накапливаться густая желчь, и это тормозило перистальтику кишечника. Врач назначил лечение, и порекомендовал питание 4-5 раз в день небольшими порциями. Постепенно состояние кожи улучшилось, боли перестали беспокоить.
Вывод: грамотные косметологи знают, как состояние кожи связно с работой внутренних органов. Поэтому часто советуют при проблемной коже проконсультироваться у гастроэнтеролога. Прислушайтесь, красивая кожа начинается со здоровья внутри.
История 2: высыпания на коже и гепатит
Пациент К, 34 года. Никогда не страдал от аллергии. Неожиданно появились высыпания по типу крапивницы, которые стали регулярно рецидивировать. Пациент неоднократно консультировался у аллерголога и гематолога. Противоаллергические средства совсем не помогали. Дошло до того, что высыпания стали появляться вообще без видимых причин. Состояние ухудшалось, присоединилась слабость, сонливость, утомляемость.
Заметив это, пациент пришел на обследование к гастроэнтерологу. Врач куратор назначил анализы, УЗИ с эластографией. Диагноз: хронический гепатит С, генотип 1а, фиброз 2 стадии. При дообследовании обнаружили лямблии – именно они и вызывали высыпания на коже. Пациент прошел соответствующий курс лечения и противовирусную терапию, высыпания исчезли.
Вывод: если у вас высыпания, не спешите закупать дорогие лекарства и садиться на строгую диету. Часто причина в другом. Проверьте печень и желчный пузырь.
История 3: кожный зуд и цирроз печени
Пациентка О., 54 года, обратилась в «ПолиКлинику ЭКСПЕРТ» по рекомендации дерматолога с жалобами на кожный зуд. Длительное лечение у дерматолога оказалось неэффективным, и была назначена консультация гастроэнтеролога-гепатолога.
Врач выяснил, что за несколько лет до появления кожного зуда в биохимическом анализе крови были выявлены изменения, из-за проблем с выработкой и выведением желчи из печени. Много лет пациентка работала с химическими удобрениями. Кроме того, гинеколог назначил ей для нормализации менструального цикла гормональные контрацептивы, которые она принимала длительное время.
Пациентку полностью обследовали по одной из комплексных диагностических программ, в том числе провели биопсию печени. Исключили токсический и лекарственный гепатит. Все это помогло установить окончательный диагноз: первичный билиарный цирроз печени. Пациентке назначены препараты желчных кислот и лечение кожного зуда. Сейчас пациентка чувствует себя удовлетворительно, кожный зуд исчез, биохимические показатели печени в норме.
Вывод: если ваша печень подвергалась перегрузкам — вы контактировали с токсичными веществами, длительно принимаете лекарства - периодически обследуйтесь. Так можно вывить потенциально опасное заболевание на ранней стадии.
Что общего у кожи с печенью?
Одна из многочисленных задач печени — вывести из организма продукты обмена. Если по каким-либо причинам клетки печени перестают выполнять эту работу — выделение усиливается через кожу. Проявляется это высыпаниями, изменениями цвета кожи, и т.п.
Проверьте печень, если вы видите:
- ранние возрастные изменения — жировой гепатоз, гепатиты различного происхождения
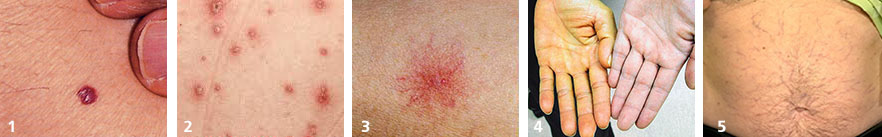
- кровяная роса (синдром Тужилина) – признак целого ряда заболеваний печени, желчного пузыря и поджелудочной железы (фото №1)
- везикулы и папулы — часто появляются при аутоиммунном процессе в печени и вирусном гепатите (фото №2)
- акне – жировое перерождение печени и воспаление клеток— неалкогольный стеатогепатит
- сосудистая звездочка (т.н. спайдеры) — частые признаки гепатита, цирроза, жирового гепатоза, акогольной болезни печени (фото №3)
- желтуха — признак выхода желчных пигментов в кровь из-за механического препятствия оттоку желчи или повреждения печеночных клеток (фото №4)
- печеночные ладони — появляется из-за накопления эстрогена при циррозе
- экскориации — расчесы из-за зуда кожи при гепатите и циррозе
- крапивница — хоть и не связана напрямую с печенью, но может косвенно указывать на повышенную аллергизацию, спровоцированную заболеванием в этом органе
- синяки без видимой травмы — признак нарушения свертываемости крови, заболеваний поджелудочной железы
- белые пятна на ногтях, трещины в углах рта — признак авитаминоза, анемии, заболеваний кишечника
- растяжки (стрии) — часто появляются при накоплении жидкости и увеличении объема брюшной полости при циррозе
- увеличение живота и «голова медузы» - асцит и расширение подкожных вен брюшной полости – признаки цирроза печени и портальной гипертензии, также встречается при онкологических заболеваниях внутренних органов (фото №5).
Что делать, если вы заметили изменения на коже?
Шаг 1. Проконсультируйтесь у врача и получите индивидуальный план обследования — биохимические анализы – АЛТ, АСТ, билирубин, щелочная фосфатаза, ГГТП, маркеры вирусных гепатитов, иммунологические тесты, УЗИ, и другие, согласно рекомендациям врача.
Шаг 2. Узнайте результаты анализов, диагноз и прогноз заболевания.
Шаг 3. Получите план лечения с учетом сопутствующих заболеваний.
Не ждите, пока состояние кожи ухудшится. Проверьте печень. На ранних стадиях можно достичь выздоровления. А специалисты ПолиКлиники ЭКСПЕРТ - гепатологи и дерматологи с большим опытом - будут рады помочь. Здоровья и красоты вашей коже!
Сухость кожи — это недостаток влаги в организме, который влечёт за собой множество отклонений и расстройств общего состояния здоровья. Для поддержания здорового внешнего и внутреннего вида необходимы регулярные процессы гидратации, или увлажнения мягких тканей. Нарушение увлажнения ускоряет старение и фотостарение, провоцирует формирование глубоких морщин, снижает выработку коллагена и приводит к более серьёзным патологиям. Чтобы вылечить сухую кожу и вернуть эластичность, необходимо обращаться к дерматологу — только врач сможет обнаружить причину симптома и назначить подходящее лечение.

Причины сухости кожи
В медицине симптом называется ксероз или ксеродермия. Сопровождается ороговением поверхности эпидермиса, зудом, шелушением, покраснением, появлением трещин и глубоких пор. Признаки указывают на расстройства деятельности сальных желез. Причины сухости кожи:
- Заболевания кожных и подкожных слоёв;
- Аллергические реакции на внешние и внутренние факторы;
- Генетическая предрасположенность к симптому;
- Замедление выработки эластана и коллагена;
- Аномальное ороговение верхнего эпидермиса;
- Сбои гормонального фона и обмена веществ;
- Инфекционные и грибковые заболевания;
- Нарушения желудочно-кишечного тракта;
- Дефицит микроэлементов и витаминов групп А, В, С, Е;
- Повреждения липидной прослойки из жира и корнеоцитов;
- Закупорка стенок кровеносных микрососудов;
- Расстройства нервной системы;
- Обезвоживание организма;
- Болезни эндокринной и мочеполовой систем;
- Почечная недостаточность, болезни печени;
- У женщин — возраст после 45 лет, климакс;
- Увеличение количества токсинов в крови и тканях.
Кроме аутоимунных нарушений жизнедеятельности, на состояние кожи влияют гигиена, окружающие факторы и образ жизни:
- Злоупотребление горячими ваннами и жарким воздухом;
- Перепады температур (жара, мороз, солярий, сауна, пляж);
- Употребление табака, алкоголя, наркотиков;
- Ненормированный график сна, отдыха и работы;
- Недостаточное количество воды в ежедневном рационе;
- Отсутствие или неправильный уход за кожей лица и тела;
- Недостаток увлажнения имеющихся морщин и пор;
- Использование мыла, скраба, спиртового лосьона;
- Косметологические чистки, пилинг и другие процедуры.
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 24 Июня 2022 года
Содержание статьи
Типы сухости кожи
Ксероз может быть приобретён по различным причинам, обнаружиться в раннем возрасте, что говорит о врождённом симптоме, или появиться в зрелом возрасте из-за естественных изменений в организме. Ксеродермия развивается постепенно — специалисты выделяют три степени сухости кожи. Некоторые признаки, например, шелушение или отслаивание чешуек эпидермиса, могут сопровождаться болью. Избавиться от боли обычно помогают увлажняющие мази, но для лечения стоит обязательно посетить врача. Терапия назначается в зависимости от вида и характера течения симптома.
Атопическая сухость кожи
Врождённое обезвоживание кожных покровов, которое диагностируется у маленьких детей и может самостоятельно проходить. При этом вылечить патологию невозможно — облегчить состояние помогают специальные препараты и косметические средства.
Приобретённая сухость кожи
Обычно диагностируется у людей из группы риска — это заболевания крови, кожи, ЦНС, пациенты дерматолога и кожвендиспансера, а также люди, чрезмерно увлекающиеся загаром, горячей водой, косметологическими очищающими процедурами. Внешние факторы, питание, экология и неправильный образ жизни способствуют образованию трещин на коже и повышенной сухости, что впоследствии может привести к воспалительным процессам.
Сенильная сухость кожи
Такой тип ксероза характерен после 40-50 лет. Возрастные изменения происходят под влиянием старения, ультрафиолетового излучения, засушливого климата. Чтобы избежать пересушенности, необходимо ещё в молодом возрасте позаботиться о здоровье и здоровом образе жизни.
Степени развития сухости кожи
- Первая. Выраженные симптомы отсутствуют — шелушение, зуд и другие признаки возникают после непосредственного контакта с раздражителем. После применения увлажняющего средства симптоматика уходит.
- Вторая. Характерные признаки (ощущение стянутости, жжение, отслоение чешуек) сопровождаются покраснением. Обычного средства для увлажнения недостаточно, необходима консультация дерматолога.
- Третья. Отчётливо заметны внешние проявления пересушенной кожи — красные зудящие пятна, ороговевшие чешуйки эпидермиса, выраженные морщины. Могут появиться воспаления и отёки, а также инфицирование стафилококками, дерматит, экземы.
Методы диагностики
Самостоятельно определить уровень пересушенности кожных покровов можно, нажав пальцем — если остался отчётливый след, значит, кожа сухая и тонкая. Для более точного диагноза необходимо посетить врача для обследования. На приёме дерматолог осматривает больного, проводит пальпацию и опрос пациента. Для получения достоверной клинической картины понадобится сдать общие анализы крови и мочи, возможно, биохимический анализ крови. Дополнительно назначается диагностика эпидермиса на выявление экземы, псориаза, дерматита, куратоза, ихтиоза и других болезней в области дерматологии.
В клинике ЦМРТ можно обследовать лицо и тело с помощью инновационных методик:
ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
Некоторые особенности топической терапии кожного зуда на фоне ксероза у пациентов пожилого возраста
Журнал: Клиническая дерматология и венерология. 2020;19(4): 489‑494
ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
АКТУАЛЬНОСТЬ
Ксероз, сопровождаемый зудом, — одно из наиболее частых изменений кожи у пожилых людей. Такие пациенты подвержены присоединению вторичной пиококковой или микотической инфекции. Все это приводит к снижению качества жизни и ставит определенные цели в лечении больных этой категории.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Определение эффективности кортикостероидного препарата, обладающего двойной формулой: метилпреднизолона ацепонат 0,1% + мочевина 2%, в терапии кожного зуда на фоне ксероза кожи у пациентов пожилого возраста.
МАТЕРИАЛ И МЕТОДЫ
Под наблюдением находились 30 пациентов в возрасте от 65 до 78 лет с диагнозом «ксероз кожи и кожный зуд». Для определения эффективности оценивали выраженность ксероза кожи, а также вторичных проявлений кожного зуда до и после терапии.
РЕЗУЛЬТАТЫ
ЗАКЛЮЧЕНИЕ
Местное использование препарата метилпреднизолона ацепонат 0,1% + мочевина 2% доказывает высокую эффективность и хорошую переносимость в лечении ксероза кожи, сопровождаемого кожным зудом, у пациентов пожилого возраста.
ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
Дата принятия в печать:
Ксероз, или сухость кожи, может быть транзиторным состоянием и наблюдаться в определенный период времени у практически здоровых людей. Сухость кожи провоцируется воздействием разнообразных негативных факторов окружающей среды (вследствие неправильного ухода) или неблагоприятных климатических условий (сильный ветер, сухой воздух и т. д.). Такая сухость является приобретенной, и после устранения негативных факторов состояние кожных покровов нормализуется.
На состояние кожи сильно влияют физиологические процессы, происходящие в организме с возрастом. Так, в течение жизни выделяют несколько возрастных периодов, характеризующихся повышенной сухостью кожных покровов: период новорожденности, детский и старческий возраст [1]. Сенильный ксероз — наиболее распространенный дерматоз пожилых людей, встречается у 75% лиц старше 64 лет [2].
Важным в развитии сухости кожи у пожилых людей является снижение уровня половых гормонов, стимулирующих сальные и потовые железы. Это приводит к уменьшению количества эккринных и апокриновых потовых желез и к нарушению ими продукции пота. Возрастные изменения в потовых железах проявляются атрофией концевых отделов, расширением просвета желез, уплощением и дегенерацией экзокриноцитов, что ведет к уменьшению потоотделения. Продукция сальными железами сального секрета в пожилом возрасте постепенно снижается каждое десятилетие у мужчин на 23%, у женщин на 32% [1, 2].
Инволютивные дистрофические процессы (низкий уровень митозов кератиноцитов, снижение синтеза церамидов и филаггрина) в коже пожилых людей приводят к структурным изменениям эпидермиса, главное из которых — его атрофия, характеризуемая уменьшением числа рядов клеток в каждом из слоев эпидермиса и утолщением рогового слоя. У лиц старшей возрастной группы хронические интоксикации, гиповитаминоз, нарушения кровообращения, эндокринная патология усугубляют клинические проявления ксероза и способствуют развитию осложнений. В этом случае недостаточная трофика кожных покровов приводит к их истончению, а снижение иммунной функции — к потере барьерной функции, что вызывает развитие воспалительных заболеваний [3].
Снижение уровня филаггрина приводит к уменьшению количества свободных аминокислот рогового слоя, которые являются естественными увлажняющими факторами. В состарившейся коже уровень филаггрина иммуногистохимически снижается по сравнению с молодой кожей. Иммуногистохимическое снижение содержания филаггрина в состарившейся коже может быть вызвано активацией протеолиза филаггрина в верхних слоях шиповатого слоя [4].
В результате сухости кожи нарушаются ее основные функции — защитная, терморегуляционная. Как следствие, кожа становится легко раздражимой, склонной к воспалительным явлениям, отмечается плохая переносимость косметических средств, развиваются дерматиты и экземы. В ходе возникновения воспалительной реакции в коже у пациента формируется ощущение зуда, в основе которого лежит феномен нейрогенного воспаления [5].
Кожный зуд — наиболее часто встречаемый симптом в дерматологии. Однако определить общую распространенность феномена зуда не представляется возможным в связи с тем, что многие исследования не учитывают зуд в качестве симптома, особенно в недерматологических дисциплинах. Кожный зуд может возникать на коже без видимых изменений и быть в этом случае симптомом системного заболевания либо возникать на фоне измененной кожи и являться следствием дерматоза [6].
Следует отметить, что с возрастом частота встречаемости зуда увеличивается, так как, помимо основных дерматологических заболеваний, увеличивается частота системной патологии и метаболических нарушений, а также дегенеративных изменений периферических нервов и иммунологических нарушений в коже. Так, результаты самого большого исследования гериартрических пациентов (n=4009), проведенного в Турции в 2006 г., свидетельствуют, что 11,5% лиц старше 65 лет страдали зудом, причем распространенность зуда увеличивалась с возрастом и у 85-летних пациентов составила 19,5%. В исследовании, проведенном в Тайване, зудящие кожные заболевания отмечены у 41% из 149 пожилых людей, и ксероз кожи был самым частым симптомом — 38,9% [6]. Исследования в Индии оценили распространенность старческого зуда в 9 и 10,6% [7].
Ключевым компонентом в оценке зуда у пациентов является наличие или отсутствие первичных кожных проявлений. Первичные повреждения кожи подтверждают наличие дерматологической патологии. У пациентов без кожных проявлений или со вторичным поражением кожи возможны системные, неврологические и психогенные причины, обусловливающие появление зуда. Если при детальном обследовании не удается выявить причину зуда (pruritus sine materia), в диагнозе указывают идиопатический, или зуд неясного генеза. Идиопатичекий зуд у лиц пожилого возраста чаще всего называют сенильным. Сенильный зуд встречается почти у 50% лиц старше 70 лет, причем чаще у мужчин [8].
Причина кожного зуда у пожилых людей часто многофакторная из-за физиологических изменений в стареющей коже, включая нарушение барьерной функции кожи, а также из-за снижения иммунологических, неврологических и психологических изменений, связанных с возрастом. Среди причин кожного зуда в стареющей коже рассматривают ксероз кожи, дерматологические расстройства (экзема, псориаз, красный плоский лишай), системные и психологические заболевания. Сопутствующие заболевания у пожилых людей приводят к полипрагмазии, увеличивая потенциальный риск побочных эффектов лекарств, которые могут привести к возникновению или усугублению зуда у пожилого пациента [9, 10].
Зуд у пожилых людей вследствие дерматозов возникает непосредственно в коже, опосредованно через возбуждение С-волокон и относится к категории пруритоцептивного зуда;
Зуд у пожилых людей вследствие системных причин, таких как холестаз, уремия, гипертиреоидизм, лимфома, относится к нейрогенному и возникает в результате нейрохимической активности медиаторов, например, в результате действия опиодиных пептидов при холестатической болезни печени.
Наиболее распространенной причиной зуда у пожилых людей является ксероз. Зуд чаще вызывается дерматозом, реже — системными причинами [11].
Пациенты с кожным зудом подвержены риску развития замкнутого цикла зуд—царапина, который в конечном счете приводит к развитию кожных поражений, что еще больше увеличивает ощущение зуда из-за разрушения кожного барьера и ведет к возникновению таких осложнений, как присоединение вторичной пиококковой или микотической инфекции [12, 13]. Все это снижает качество жизни пациента и указывает на необходимость успешного лечения для предотвращения расчесов и ставит определенные цели в лечении пациентов данной категории. Основными требования к лечению пациентов с кожным зудом, протекающим на фоне ксероза кожи, являются: 1) устранение сухости кожи; 2) устранение пруритогенных медиаторов воспаления.
В ряде исследований доказано, что местное применение увлажняющего крема, содержащего компоненты натурального увлажняющего фактора, повышает гидратацию кожи, снижает трансэпидермальную потерю воды и таким образом делает его подходящим для восстановления ксеротической кожи. А поддержание барьерной функции кожи важно для снижения чувствительности кожи к раздражителям, аллергенам и микробам [14].
Крем Комфодерм М2 содержит метилпреднизолона ацепонат 0,1% и 2% мочевину. В креме Комфодерм М2 метилпреднизолона ацепонат представлен в микронизированной форме. В результате микронизации происходит уменьшение частицы действующего вещества до 10 мкм и менее, что позволяет улучшить биодоступность и эффективность препарата и снизить риск побочных эффектов [15].
Метилпреднизолона ацепонат имеет высокий терапевтический индекс, поскольку высоколипофильная молекула способствует быстрому проникновению в роговой слой и повышению биодоступности. Метилпреднизолона ацепонат способен к быстрому началу активности при высокой эффективности [16].
Высокий профиль безопасности крема Комфодерм М2 обусловлен тем, что метилпреднизолона ацепонат активен прицельно в очаге поражения и не влияет на здоровую кожу, обладает минимальной системной абсорбцией, быстрой и полной инактивацией, не влияет на циркадный ритм кортизола [17—19].
Мочевина входит в состав натурального увлажняющего фактора (NMF) наряду с комплексом низкомолекулярных гигроскопических веществ, таких как свободные аминокислоты, молочная кислота и пироглутамат натрия. NMF расположен в толще рогового слоя. С NMF ассоциирована значительная часть воды, присутствующая в роговом слое. Компоненты NMF, нанесенные на кожу в составе кремов, проникают в толщу рогового слоя и повышают его водоудерживающий потенциал [5]. Использование 2% мочевины в составе крема Комфодерм М2 обеспечивает гидратирующий эффект, т. е. увлажняет кожу, устраняет сухость и, как следствие, зуд кожи, а также обладает антисептическими свойствами и восстанавливает защитные свойства кожи.
Цель исследования — определение эффективности крема Комфодерм М2, обладающего двойной формулой, в терапии кожного зуда на фоне ксероза кожи у пациентов пожилого возраста.
Материал и методы
Под наблюдением врача-дерматовенеролога в Томской клинической психиатрической больнице находились 30 пациентов в возрасте от 65 до 78 лет с диагнозом «ксероз кожи и кожный зуд», примеры клинических случаев представлены на рис. 1, 2.

Рис. 1. Пациентка, 75 лет, с кожным зудом на фоне ксероза.

Рис. 2. Пациентка, 71 год, с кожным зудом на фоне ксероза.
Патологический процесс у пациентов носил в большинстве случае распространенный характер с наибольшей локализацией на коже спины, предплечий и голеней. Процесс был представлен сухостью кожных покровов, шелушением. Местами на фоне сухой кожи отмечались эритематозные пятна, точечные и линейные экскориации, геморрагические корки, микротрещины.
Схема лечения: крем метилпреднизолона ацепонат 0,1% + мочевина 2% (Комфодерм М2) наносили тонким слоем на пораженные участки кожи 1 раз в сутки. Продолжительность лечения от 28 дней. Осмотр пациентов проводили 1 раз в неделю весь период наблюдения.
Формирование выборочной совокупности пациентов осуществляли в соответствии с критериями включения и исключения. В исследование включали пациентов, соответствующих следующим критериям: мужчины и женщины в возрасте от 65 до 78 лет с кожным зудом, возникающим на фоне ксероза кожи. В исследование не включали пациентов, соответствующих хотя бы одному из следующих критериев: больные с гиперчувствительностью к препарату или его составным частям; лица, получающие системные и наружные кортикостероиды; лица, получающие системные препараты, уменьшающие проявления кожного зуда. В исследовании не принимали участие пациенты с заболеваниями и состояниями, указанными в качестве противопоказаний к применению препарата: туберкулез кожи, вирусные инфекции.
До начала лечения и в ходе терапии оценивали выраженность ксероза кожи (степень сухости кожи и шелушения), а также вторичные проявления кожного зуда (эритемы, наличие точечных и линейных экскориаций, геморрагических корок и микротрещин).
Для оценки показателей безопасности и переносимости учитывали нежелательные явления, оцененные по 4-балльной категорийной шкале: отличная (1 балл) — отсутствие побочных эффектов; хорошая (2 балла) — легкие побочные эффекты, не требующие медицинского вмешательства; удовлетворительная (3 балла) — умеренные побочные эффекты; плохая (4 балла) — выраженные побочные эффекты, требующие отмены препарата.
Сопутствующие заболевания лечили по обычной схеме, так как сопутствующие патологические состояния не были критерием исключения пациента из выборочной совокупности, а используемые в их терапии лекарственные препараты можно было применять одновременно с кремом Комфодерм М2.
Результаты и обсуждение
Клиническое излечение отмечено у 25 (83,3%) пациентов, у 5 (16,7%) пациентов наступило значительное улучшение.
Высокую эффективность крема метилпреднизолона ацепонат 0,1% + мочевина 2% в лечении ксероза кожи, сопровождаемого кожным зудом, у пациентов пожилого возраста можно объяснить его двойной формулой, содержащей метилпреднизолона ацепонат 0,1% и 2% мочевину. Комбинация компонентов в креме отвечает поставленным целям лечения — устранить сухость кожи, пруритогенные медиаторы воспаления, нейрогенное воспаление кожи, следствием которого является кожный зуд.
Заключение
Проведенное клиническое исследование доказывает высокую эффективность и хорошую переносимость крема, содержащего метилпреднизолона ацепонат 0,1% + мочевина 2%, в терапии ксероза кожи, сопровождаемого кожным зудом, у пациентов пожилого возраста. С учетом высокой безопасности крем можно использовать длительное время на больших участках кожного покрова.
Читайте также:

