Проницаемость кожи повышается при всем перечисленном кроме
Обновлено: 29.04.2024
Структурное и функциональное здоровье кожи во многом связано с содержанием и распределением в ней воды. Сухость кожи влечет за собой ее легкую проницаемость для токсичных и сенсибилизирующих веществ, способствует развитию иммунных нарушений и формированию
Структурное и функциональное здоровье кожи во многом связано с содержанием и распределением в ней воды. Сухость кожи влечет за собой ее легкую проницаемость для токсичных и сенсибилизирующих веществ, способствует развитию иммунных нарушений и формированию аллергического воспаления [1–3]. Нарушение гидратации рогового слоя эпидермиса является основной причиной патологической десквамации эпителия и ксероза. Поскольку корнеоциты представляют собой клетки, лишенные ядра, дерматологи до последнего времени не относились к роговому слою с должным вниманием. Но оказалось, что, воздействуя на роговой слой, можно не только добиться косметических эффектов, но и облегчить симптомы кожного заболевания, улучшить результат от медикаментозного лечения и повысить качество жизни больного.
Основа ухода за кожей при кожных заболеваниях — «корнеотерапия», система восстановления функционирования и целостности рогового слоя. В современных условиях грань между косметическими и лекарственными средствами постепенно стирается ввиду усложнения рецептуры косметологических препаратов. Современные косметические средства могут влиять на физиологические процессы в коже так же, как это делает фармацевтический препарат. Мастерство дерматолога основано на его умении использовать в терапии различные активные и индифферентные средства наружной терапии, добиваясь максимального успеха.
В поддержании водного баланса участвуют многочисленные структуры, регулирующие скорость трансэпидермальной потери воды и осуществляющие поступление воды из дермы в эпидермис. Очевидно, что для полноценного функционирования кожи необходима опорная структура корнеоцитов, при ее нарушениях увеличивается трансэпидермальная потеря воды, что ведет к гиперплазии эпидермиса и гиперкератозу. Роговой слой служит сенсором для подлежащих слоев [1]. В эпидермисе контроль за водным балансом осуществляет роговой слой и компоненты рогового слоя эпидермиса (натуральный увлажняющий фактор, липиды кожи, кожное сало и кератин) [3].
Кожа начинает обезвоживаться именно с эпидермиса. Происходит это из-за того, что эпидермис лишен кровеносных сосудов, которые могли бы пополнять в нем запасы влаги, поэтому основную часть жидкости эпидермис получает из дермы. До последнего времени считалось, что вода просачивается в верхние слои кожи по закону перфузии. Свободные аминокислоты, образующиеся при разрушении белка филагрина, поддерживают в корнеоцитах высокое осмотическое давление, что вызывает приток воды, которая сохраняется даже при пониженной влажности окружающей среды [4]. Однако в последние годы установлено, что в поддержании нормального уровня гидратации эпидермиса важное значение имеет также механизм облегченной диффузии, т. е. попадание молекул воды через водные каналы, названные аквапоринами. Аквапорины представляют собой мембранные белки, формирующие сквозные поры на поверхности клеток, через которые проходит вода, а также небольшие водорастворимые соединения, такие как глицерин и мочевина. За открытие этих белков в 2003 г. группе американских учёных во главе с Питером Эгром присуждена Нобелевская премия по химии [3].
Достигнув поверхности кожи, вода стремится к испарению, однако этому препятствует роговой слой. Несмотря на низкое содержание воды в роговом слое — 15–20%, сохранение влаги одна из основных его функций [5]. Непроницаемость рогового слоя обусловлена барьерными свойствами кератина, ацилцерамидов и кожного сала. Эпидермис достаточно хорошо проницаем по направлению к своей поверхности и почти непроницаем в обратном направлении. При этом вода и водорастворимые вещества сквозь эпидермис проникают с большим трудом, тогда как жирорастворимые вещества значительно легче [6, 7]. Чтобы оценить важную роль рогового слоя эпидермиса в сохранении влаги в коже, необходимо четко знать его строение.
Роговой слой представляет собой конечный продукт дифференцировки кератиноцитов эпидермиса. В тонкой коже он состоит из 15–20 слоев роговых чешуек, в толстой из сотен слоев. Чешуйки располагаются колонками друг над другом, и каждая чешуйка в проекции покрывает 9–10 клеток базального слоя [8]. Корнеоцит имеет 6-угольную форму и каждой из шести сторон контактирует с соседними корнеоцитами, такое строение можно сравнить со «стеганым одеялом» [4]. Роговой слой эпидермиса имеет уникальное строение, которое называют «briсk and mortar» («кирпич и цемент»), где роль «кирпичей» играют роговые клетки, а «цемента» — межклеточные липиды. На поперечном срезе роговой слой представляется рыхлым, пористым, однако это только видимость. Такое впечатление создается за счет межклеточных пространств, которые составляют значительную часть рогового слоя. Однако все они заполнены особым веществом, склеивающим их в непреодолимую преграду липидами-ацилцерамидами, которые относятся к классу сфинголипидов, или церамидов [6, 7]. Впервые сфинголипиды были выделены из мозговой ткани, поэтому свое второе название — церамиды — они получили от латинского слова cerebrum (мозг). Позже было установлено, что церамиды участвуют в построении эпидермального барьера, формируя липидную прослойку между роговыми чешуйками. Молекулы церамидов и фосфолипидов имеют гидрофильные «головы» (фрагменты, любящие воду) и липофильные «хвосты» (фрагменты, предпочитающие жиры). В водной среде молекулы полярных липидов самостоятельно группируются таким образом, чтобы гидрофобные хвосты были спрятаны от воды, а гидрофильные головы, напротив, были обращены в водную среду. Если таких липидов мало (и если смесь липидов и воды хорошо встряхнуть), то образуются шарики (липосомы). Это свойство полярных липидов используется в косметической промышленности при производстве липосом [5].
Церамиды состоят из жирного спирта сфингозина (образует «голову») и одной жирной кислоты («хвост»). Если в жирной кислоте имеются двойные связи, то она называется ненасыщенной, если двойных связей нет, то говорят, что кислота насыщенная. В зависимости от того, какая жирная кислота прикреплена к голове церамида, липидные пласты, построенные из них, получаются более или менее жидкими. Самые твердые (кристаллические) липидные пласты образованы церамидами с насыщенными хвостами. Чем длиннее хвост церамида и чем больше в нем двойных связей, тем более жидкими получаются липидные структуры [9–11]. Помимо рассмотренных выше межклеточных липидных пластов, в роговом слое обнаружены липиды, ковалентно связанные с корнеоцитами. Это особые длинноцепочечные церамиды, хвосты которых представлены жирными кислотами, имеющими в своей цепочке более 20 атомов углерода. Длинноцепочечные церамиды выполняют роль заклепок, скрепляя соседние липидные пласты. Благодаря им многослойная липидная прослойка не расслаивается и представляет собой целостную структуру. Церамиды в последнее время стали очень популярными ингредиентами в косметике. Популярность церамидов объясняется той ролью, которую они играют в поддержании целостности эпидермального барьера.
Благодаря наличию многослойной липидной прослойки между роговыми чешуйками, роговой слой способен эффективно защищать кожу не только от проникновения посторонних веществ извне, но и от обезвоживания. Диффузия воды через сухие полутвердые кератиновые пластинки, склеенные в сплошную массу церамидами, резко снижается, по сравнению с наполненными жидкостью живыми клетками.
Основными продуцентами межклеточного цемента являются гранулы Орланда клеток зернистого слоя [6, 7]. Именно они путем экзоцитоза выделяют свое содержимое в межклеточное пространство, где оно превращается в богатый липидами межклеточный цемент с пластинчатым строением. Таким образом, при ороговении происходит формирование гидрофобного эпидермального барьера, который не только препятствует проникновению в кожу вредных веществ, но и участвует в регуляции водного гомеостаза в дерме [4].
Кроме механизма биомеханической непроницаемости рогового слоя, влажность кожи поддерживают влагоудерживающие структуры.
Эпидермальные влагоудерживающие структуры кожи
1. Натуральный увлажняющий фактор (natural moisturizing factor, NMF) — это целый комплекс органических молекул на поверхности корнеоцитов, обладающий способностью связывать воду. К нему относятся свободные аминокислоты (40%); пироглутамат натрия (12%); мочевина (7%); аммиак, креатинин и др. органические соединения (17%); магний (1,5%); калий (4%); кальций (1,5%); натрий (5%); молочная и лимонная кислоты, ионы хлорида и фосфата (12%). Нарушение их баланса влечет за собой изменение состава NMF и, как следствие, неспособность кожи удерживать влагу. От количества влаги, связанной с NMF, зависит и эластичность рогового слоя. Доказано, что в жирной и нормальной коже больше NMF, чем в сухой [5].
Снижение синтеза филагрина, которое наблюдается, в частности, при ихтиозе и атопическом дерматите, приводит к уменьшению содержания аминокислот в составе NMF и уменьшению водоудерживающей способности кожи. Так как для работы ферментов, участвующих в гидролизе филагрина, необходимо достаточное количество влаги, при развитии сухости рогового слоя образование аминокислот NMF также снижается. В результате получается замкнутый круг, приводящий к хронической сухости кожного покрова.
Минеральный состав натурального увлажняющего фактора меняется в зависимости от времени года, и именно эти изменения вызывают снижение влажности рогового слоя в зимний период. В частности, в зимний период в роговом слое значительно понижается уровень калия, натрия, хлоридов и солей молочной кислоты [5].
При частом умывании горячей водой с мылом из NMF могут вымываться аминокислоты и минеральные вещества, что тоже приводит к развитию ксероза. Наиболее опасно сочетание «вымачивания», например длительного нахождения в горячей ванне, и воздействия растворителей и агрессивных поверхностно-активных веществ (ПАВ). Опасность ПАВ заключается в том, что они способны взаимодействовать с липидными пленками, поскольку в них, как и в полярных липидах, есть два участка — гидрофобный и гидрофильный, поэтому они могут встраиваться в липидный слой, обращаясь к ним своими гидрофобными «хвостами». При этом головы молекул ПАВ группируются вместе так, что в липидном слое оказываются гидрофильные, проницаемые для воды участки. Таким образом, первым следствием воздействия ПАВ на роговой слой является дегидратация липидных мембран, так называемый «Wash-Out-Effect» — эффект вымывания собственных липидов.
Длительное воздействие анионных ПАВ способствует их более глубокому проникновению вплоть до зернистого слоя эпидермиса, что приводит к разрушению клеточных мембран гранулоцитов — гранул Орланда, являющихся основной фабрикой межклеточных липидов. В результате снижается синтез липидов, необходимых для склеивания корнеоцитов [8].
Именно поэтому любые косметические процедуры, сопровождающиеся «отмачиванием» кожи с последующим ее очищением, должны завершаться применением увлажняющих средств на основе NMF [5, 14].
2. Эпидермальные межклеточные липиды (липидный барьер) — состоят из холестерола, церамидов и ненасыщенных жирных кислот (омега-3, омега-6), количество которых находится в строго определенной пропорции по отношению друг к другу. Если корнеоцит содержит лишь 3% липидов, то межклеточный цемент — 80%. По биохимическим данным в межклеточном матриксе обнаруживаются: церамиды — ~40%, свободные жирные кислоты — ~20%, холестерин и его эфиры — ~10%, холестерол — ~15%, фосфолипиды — ~5%, сквален — ~10% [4]. Холестерин предотвращает избыточную ригидность и ломкость слоя церамидов. Свободные жирные кислоты расположены вокруг церамидов в липидном слое и способствуют поддержанию водоотталкивающей функции кожи, защищают водорастворимые компоненты рогового слоя от выщелачивания вследствие образования водно-масляной эмульсии [4, 9]. Если эта пропорция меняется, липидная прослойка между роговыми чешуйками нарушается и, как следствие, нарушается барьерная функция, влага испаряется более интенсивно. Пытаясь предотвратить избыточную потерю влаги, кожа замедляет процесс физиологической десквамации, и клетки начинают скапливаться на поверхности. Внешне это проявляется избыточным шелушением, утолщением рогового слоя, сероватым оттенком. Ярким примером такого процесса является себорея. При себорее в кожном сале уменьшается концентрация линолевой кислоты, что также приводит к нарушению целостности кожного барьера и возникновению адаптивной реакции в виде увеличения количества роговых клеток [12].
Среди липидов поверхности кожи выявляются эпидермальные липиды и липиды сальных желез. Эпидермальные липиды составляют меньшую часть. Главные компоненты эпидермальных липидов — свободный холестерин и его эфиры — образуются при распаде оболочек клеток рогового слоя. Доказано, что эпидермальные липиды поверхности кожи не оказывают большого влияния на гидратацию кожи, но представляют собой ограничивающую мембрану для водного обмена [4, 6, 7].
Интересно, что липидный состав рогового слоя неоднороден. Концентрация фосфолипидов уменьшается по направлению к поверхности, тогда как содержание нейтральных липидов и церамидов, наоборот, повышается [4].
Изменение состава эпидермальных липидов происходит при многих заболеваниях: атопическом дерматите, псориазе, контактном дерматите, себорее, а также при некоторых физиологических процессах. Например, при атопическом дерматите в коже нарушен обмен жирных кислот, а при ихтиозе наблюдается их снижение (табл.). В результате формируется неполноценный защитный гидролипидный слой, что также приводит к траскутанной потери воды и облегчению проникновения аллергенов и ирритантов.
3. Кожное сало. Функциональное значение кожного сала очень велико, выделяясь из секреторного отдела сальных желез, заполняя их выводные протоки и устья волосяных фолликул, секрет распределяется по бороздкам кожи и неравномерно покрывает практически всю ее поверхность слоем 7–10 мкм. За одну неделю у здорового человека выделяется 100–200 г секрета сальных желез, а при себорее 300 г и более. На поверхности кожи кожное сало смешивается с секретом потовых желез и эмульгируется. Таким образом, формируется тонкая водно-липидная эмульсионная пленка (sebum). Водно-липидная мантия подобно восковому налету предохраняет от избыточного солнечного излучения, переувлажнения, вредных воздействий внешней среды, инфекций, препятствует испарению воды и высвобождает глицерин, который связывает воду из атмосферного воздуха и удерживает у поверхности кожи [12, 13].
4. Кератин — конечный продукт жизнедеятельности эпидермиса, характеризуется стойкостью по отношению к механическим, физическим и химическим факторам. По мнению некоторых авторов, кератин, как все белки, является коллоидом — в воде набухает и связывает молекулы воды [14].
При нарушении одной или нескольких влагоудерживающих структур (дефицит компонентов, структурные изменения и т. д.) уровень воды в роговом слое падает. Происходит нарушение его структуры, что влечет за собой и нарушение барьерных свойств. Это означает, что роговой слой перестает быть непроницаемой преградой для воды и ее испарение усиливается. Через нарушенный барьер могут легче проникать микроорганизмы, химические факторы агрессии, которые дополнительно поддерживают раздражение и воспаление кожи. Сухость кожи — неизменный симптом различных кожных заболеваний, таких как атопический дерматит, псориаз, экзема и т. д. В последние годы стала преодолеваться необоснованная позиция среди практикующих врачей, касающаяся пренебрежения таким важным аспектом, как уход за кожей и восстановление ее барьерных функции у больных дерматозами. Поэтому во второй части статьи речь пойдет не только о вспомогательной терапии космецевтики во время обострения, но и об очень важном вопросе — закреплении ремиссии путем активного восстановления целостности кожи и ее нормальной функции с помощью лечебно-косметических средств.
Литература
- Ломакина Е. А. Роль барьерной функции кожи в патогенезе некоторых дерматозов // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. 2009, № 2. С. 87–90.
- Калюжная Л. Д. Атопический дерматит и сухость кожи // Клиническая иммунология. Аллергология. Инфектология. 2009, № 1. С. 27–18.
- Ткаченко С., Эрнандес Е. Аквапорины в регуляции водного баланса кожи // Косметика и медицина. 2011, № 2. С. 26–33.
- Мядлец О. Д., Адаскевич В. П. Морфофункциональная дерматология. М.: Медлит, 2006. 752 с.
- Марголина А. А., Эрнандес Е. И., Зайкина О. Э. Новая косметология. М., 2002. 208 с.
- Кошевенко Ю. Н. Кожа человека. Т. 2. М.: Медицина, 2008. 754 с.
- Кошевенко Ю. Н. Кожа человека. Т. 1. М.: Медицина, 2006, 360 с.
- Современная наружная терапия дерматозов (с элементами физиотерапии) / Под. ред Н. Г. Короткого. Тверь: «Губернская медицина», 2001. 528 с.
- Cork M. J., Robinson D. A., Vasilopoulos Y. et al. New perspectives on epidermal barrier dysfunction in atopic dermatitis: gene-environment interactions // J Allergy Clin Immunol. 2006; 118 (1): 3–21.
- Dobrev H. Scientific Researches of the Union of Scientists // Series D. Medicine, Pharmacy and Stomatology. 2002; 1: 107–10. Plovdiv.
- Norlen L., Nicander I., Lundh Rozell B. et al. Inter- and intra-individual differences in human stratum corneum lipid content related to physical parameters of skin barrier function in vivo // J Invest Dermatol. 1999; 112 (1): 72–77.
- Roh M., Han M., Kim D., Chung K. Sebum Output as a Factor Contributing to the Size of Facial Pores // Br J Dermatol. 2006; 155 (5): 890–894.
- Аравийская Е. Р., Соколовский Е. В. Сухость кожи. Причины возникновения. Принципы коррекции // Журнал дерматовенерологии и косметологии. 2002, № 1. С. 23–25.
- Эрнандес Е. И. Увлажнение кожи. М.: ООО «Фирма Клавель», ООО «Школа косметических химиков», 2007. 32 с.
Ю. А. Галлямова, доктор медицинских наук, профессор
О. А. Баринова
РМАПО, Москва
Гидролипидная мантия кожи – одна из составляющих эпидермального барьера кожи.
Здоровье кожи в широком смысле этого слова – её качество, цвет, тонус, увлажненность и т.п. – напрямую зависит от состояния эпидермального барьера. Многие дерматологические проблемы возникают именно из-за «брешей» в его работе.
Нарушения функции и дефекты в этом барьере неизбежно провоцируют проникновение чужеродных микробов и аллергенов в кожу, активируют дегидратацию эпидермиса и вызывают сухость кожи, повышают её чувствительность к различным воздействиям окружающей среды.
Что же такое эпидермальный барьер
Кожа – самый большой орган человеческого тела. Она составляет почти 18% общего веса человека.
В составе кожи три основных слоя:
- 1. Самый глубокий - гиподерма или подкожно-жировая клетчатка;
- 2. Средний – дерма. В ней расположены основные каркасные белки – коллаген и эластин;
- 3. Верхний слой кожи - эпидермис состоит из четырёх слоёв и постоянно обновляется.
Кожа выполняет несколько очень важных для организма и самой кожи функций. При этом, основную - защитную функцию обеспечивает эпидермис.
Именно самый верхний слой кожи - эпидермис является своего рода барьером, защищающим ее от агрессивных атак множества микроорганизмов и аллергенов, внешних механических и химических воздействий, потери влаги – сохраняет коже увлажнение.
Эпидермальный барьер состоит из:
- Гидролипидной мантии, укрывающей поверхность кожи;
- Липидо-эпидермального барьера.
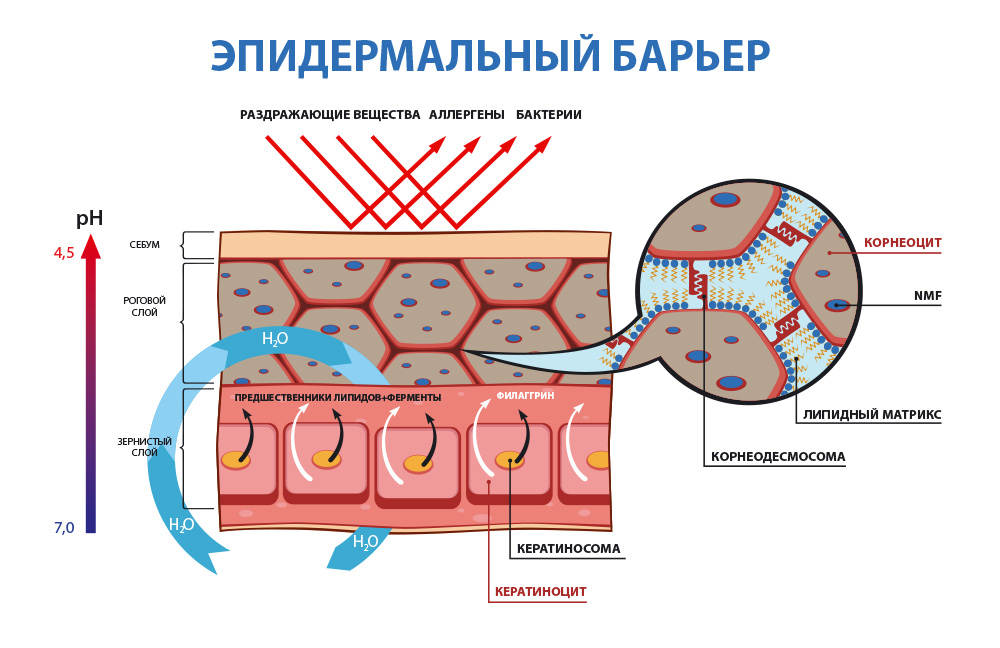
1. Гидролипидная или водно-жировая мантия
- это, некая, невидимая глазу пленка на поверхности кожи, которая образуется из смеси отслоившихся роговых чешуек, пота, кожного сала, а также органических кислот и микрофлоры.
Главная функциональная особенность гидролипидной мантии здоровой кожи человека - её кислая среда - pH от 4,7 до 5,7. (Для справки: кислотная среда pH 0 - 6,9; нейтральный pH – 7; щелочная среда pH 7,1 – 14).
Благодаря наличию кислой среды, в которой перестают размножаться и погибают вредоносные бактериии, гидролипидная мантия является самым первым звеном защиты кожи от большинства чужеродных микроорганизмов и агентов.
Свой вклад в формирование кислой среды на поверхности кожи вносят с одной стороны, органические кислоты - молочная, лимонная и другие, которые образуются в результате биохимических и метаболических процессов, протекающих в эпидермисе. С другой стороны, кислый pH гидролипидной мантии помогает поддерживать жизнедеятельность полезных бактерий - Staphylococcus epidermidis и лактобактерий, которые постоянно живут на коже и составляют её микробиоту.
Кислотность гидролипидной мантии может нарушаться в ту или иную сторону по разным причинам (будет описано ниже). Например, при грибковых заболеваниях рН возрастает до 6, при экземе до 6,5; при угревой болезни защелачивается до 7.
Повреждённая гидро-липидная мантия кожи восстанавливается самостоятельно при правильном очищении, грамотном уходе и защите.
2. Липидо-эпидермальный барьер
– основной защитный барьер кожи. Находясь непосредственно в эпидермисе, он защищает организм и кожу от обезвоживания путем механизма транс-эпидермальной потери влаги (ТЭПВ), а также является вторым звеном защиты после гидролипидной мантии от проникновения в кожу патологических бактерий и аллергенов, различных химических соединений.
Основу липидо-эпидермального барьера составляют три вида липидов — церамиды, свободные жирные кислоты и холестерин.
Механизм ТЭПВ. По большому счету кожа увлажняется изнутри – то есть из глубоких слоёв гиподермы и дермы вода поступает к эпидермису, липиды удерживают воду в эпидермисе, обеспечивая его увлажненность. Повреждённый липидо-эпидермальный барьер является главной причиной неадекватной трансэпидермальной потери влаги и в результате сухости кожи. Поэтому, чтобы обеспечить хорошую увлажненность кожи, необходимо в первую очередь восстановить липидный барьер.
Кроме того, бреши в липидо-эпидермальном барьере приводят не только к обезвоженности кожи, но и к её повышенной чувствительности, аллергическим реакциям, раздражениям и кожным заболеваниям.
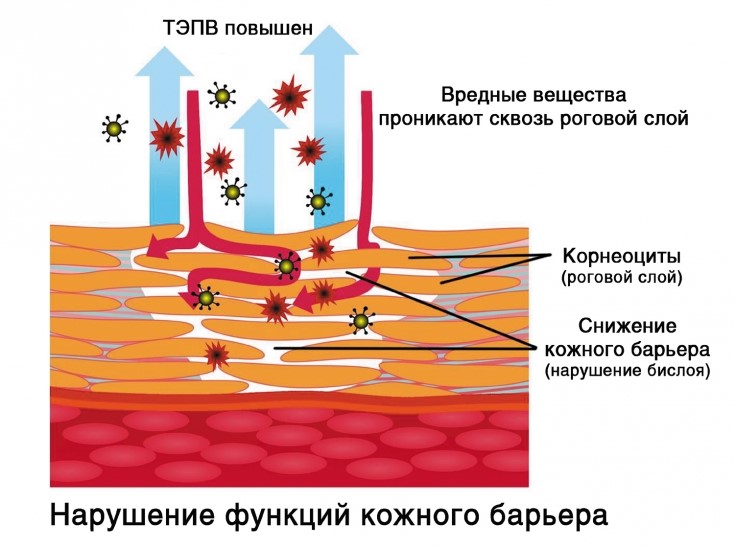
Незначительные повреждения липидо-эпидермального барьера клетки кожи восстанавливают сами. В случае выраженных нарушений – им необходимо помочь. В первую очередь это процедуры регулярного увлажнения, правильного ухода за поверхностью кожи и дермы, здоровый образ жизни и сбалансированное питание.
Внешние проявления, связанные с повреждением гидролипидной мантии
- Периодические или постоянные ощущения стянутости кожи, вызывающие дискомфорт; сухость и шелушение кожи даже в условиях привычного ухода;
- Выраженная гиперчувствительность и реакция кожи различные атмосферные явления: на ветер, солнце, мороз,
- Повышенная чувствительность кожи при применении очищающих и уходовых средств;
- Периодическое появление раздражений и покраснений, зудящих красных пятен; перманентные дерматиты.
Наличие вышеперечисленных проблем – повод обратиться к дерматологу.
Факторы, повреждающие кожные барьеры
Применение при очищении кожи мыла, умывалок и др., содержащих ПАВы и щелочи; частое использование обезжиривающих и спиртовых тоников.
Щелочи и ПАВы, присутствующие в большинстве очищающих средств нарушают кислый pН гидролипидной мантии. В результате водно-жировая мантия разрушается. Открываются входные ворота для чужеродных бактерий. Повреждается липидный барьер, вода активно начинает испаряться с поверхности кожи, вызывая её сухость.
Здоровый эпидермальный барьер — залог красивого вида любого типа кожи — жирной, проблемной, сухой, чувствительной и даже увядающей.
Сохранение и восстановление эпидермального барьера один их самых ключевых принципов в профессиональных программах по уходу за любым типом кожи и омолаживающих врачебных процедурах, а также домашнего хода за кожей.
Методы восстановления и сохранения барьеров кожи
Адекватное очищение кожи.
Домашний уход. Важно правильно определить с профессиональным дерматологом свой тип кожи и использовать ежедневно очищающие средства, которые соответствуют вашему типу кожи, не нарушая при этом эпидермальный барьер.
Профессиональный уход. В условиях клиники – проведение грамотно подобранных процедур очищения и эксфолиации кожи и соблюдения режима их выполнения: химического пилинга, и лазерного пилинга,ручной чистки лица с учётом вашего типа кожи и решаемых проблем.
Регулярное увлажнение.
Домашний уход. Ежедневно наносите на кожу увлажняющие кремы и периодически маски, содержащие компоненты, удерживающие влагу: аминокислоты, гиалуроновую кислоту, коллаген, эластин, алое вера и др. Плюс, как это ни банально, пейте адекватное количество чистой воды.
Профессиональный уход в условиях клиники. Регулярно (курсами 2 раза в год) проводите процедуры биоревитализации, биорепарации, мезотерапии
Профессиональный уход в условиях клиники. При повреждении кожи и развитии патологической флоры, например при угревой болезни – применение различных медикаментозных препаратов, назначенных врачом, а также лечение акне на лазерной установке Fotona с целью инактивации патологической флоры, уменьшения воспалительного процесса и улучшения трофики тканей.
Сбалансированное питание и уход.
Домашний уход. Ежедневно используйте питательные крема, соответствующие вашему типу кожи, возрасту и времени сезона года, чередуйте их с увлажняющими средствами. Отдавайте предпочтение средствам, содержащим церамиды, липосомы и жирные кислоты – они защищают и восстанавливают повреждённый липидный слой.
Употребляйте в пищу продукты, богатые омега 3 и омега 6 жирными кислотами. Не исключайте из рациона масла и жиры.
Постоянная защита.
Не используйте скрабы и избегайте сильного механического воздействия. Применяйте средства, содержащие в своём составе плёнкообразующие компоненты — коллаген, эластин, воска, силиконы, ланолин, парафин - руки. Регулярно наносите на кожу солнцезащитные крема при выходе на улицу, особенно летом.
Подводим итоги
Здоровье кожи напрямую зависит от целостности и нормального функционирования эпидермального барьера, основу которого составляет гидро-липидная мантия и липидо-эпидермальный барьер.
Сверху эпидермальный барьер «окутан» в гидролипидную мантию. Важно бережно относиться к ней и не повреждать её. Она первая «встречает» патогенные микробы и агенты, препятствуя их проникновению вглубь кожи.
Повреждение липидо-эпидермального барьера и гидролипидной мантии является серьёзной проблемой для кожи. Как правило, это приводит к обезвоживанию эпидермиса, появлению сухости, повышенной чувствительности, раздражениям, может спровоцировать и поддерживать кожные заболевания и др.
Нарушенный эпидермальный барьер можно восстановить, если правильно подобрать домашний уход, а также проводить профессиональные процедуры у косметолога. Сбалансированный уход за кожей и правильный образ жизни обеспечат защиту, увлажнение и восстановление кожи.
Поделитесь со знакомыми и друзьями:

Нарушить барьерную функцию кожи можно разными путями. Например, как сейчас, — путем нарушения структуры гидролипидной мантии обработкой органическими растворителями (спирт) или ПАВ, посредством физического разрушения рогового слоя (пилинг, дермабразия, лазерная шлифовка). Есть еще один способ ослабить барьерные свойства кожи — изменить состав поверхностных липидов, что произойдет, например, в результате длительного ограничения приема пищевых жиров или продолжительного применения большого количества косметического масла (любого!).
Сразу же после физического повреждения рогового слоя скорость испарения воды с его поверхности резко возрастает. Затем в течение нескольких часов она постепенно снижается, что говорит о том, что барьерный слой снова восстанавливается. Если проследить всю динамику восстановления барьерной функции кожи, то можно видеть, что сначала восстановление идет довольно быстро. У человека барьерная функция восстанавливается на 60% через 12 ч, но полное восстановление занимает 72 ч. Считается, что быстрое восстановление происходит за счет массового выброса из гранулярных кератиноцитов уже готовых ламеллярных телец. В медленную фазу восстановления барьера происходит усиление синтеза жирных кислот, холестерина и церамидов, а также образование новых ламеллярных гранул.
В ответ на повреждение рогового слоя кератиноциты секретируют ряд сигнальных молекул — цитокинов, факторов роста. Установлено, что сразу после повреждения рогового слоя повышается концентрация ИЛ-1а (интерлейкин 1а), TNFα (фактор некроза опухолей альфа) и некоторых других цитокинов. Точная роль этих молекул в восстановлении эпидермального барьера пока не известна, но сам факт повышения их концентрации важен. Скорее всего, они стимулируют синтез липидов и образование ламеллярных гранул в эпидермисе, но они же могут вызывать появление гиперпигментации, воспаления и эпидермальной гиперплазии. Показано, что даже незначительное, но систематическое повреждение барьерного слоя (например, частое умывание горячей водой с мылом) приводит к возникновению гиперплазии эпидермиса, что говорит о том, что цитокины, вырабатываемые кожей при повреждении рогового слоя, могут инициировать патологические процессы.
Нанесение на кожу различных веществ может помочь или, напротив, затормозить восстановительные процессы.
Полная окклюзия
Если на кожу наложить полиэтиленовую или резиновую пленку, то секреции ламеллярных телец и увеличения синтеза липидов не происходит. Более того, сейчас актуальна проблема с тем, что сама окклюзия — ношение резиновых перчаток, может стать причиной повреждения барьерной функции кожи, ведь повышенная влажность приводит к повышению проницаемости кожи.
По всей видимости, увеличение скорости испарения воды через роговой слой является главным сигналом к восстановительным работам при разрушении барьерных структур. Непроницаемая пленка, которая не позволяет воде испаряться, блокирует ответ клеток эпидермиса на повреждение.
Частичная окклюзия
Если кожу с разрушенным роговым слоем покрыть слоем вазелина, то в первые часы после повреждения наблюдается замедление восстановления. На электронных микрофотографиях в гранулярном слое эпидермиса можно видеть деформированные (словно поеденные молью) ламеллярные тельца. Это говорит о том, что вазелин в какой-то мере проникает в гранулярный слой эпидермиса и нарушает формирование ламеллярных телец. Тем не менее тонкий слой вазелина не препятствует газообмену, как это делает полиэтиленовая пленка. И некоторое количество трансдермальной воды через нее испаряется, а кислород и углекислый газ нормально проходят.
Поэтому в итоге под слоем вазелина восстановление барьера завершается быстрее, чем без него. Временный барьер, который создает вазелин, защищает кожу от сильного обезвоживания и проникновения токсических веществ. Поэтому клетки могут успешнее работать над восстановлением барьера, не отвлекаясь на борьбу с внешним стрессом.
Физиологические липиды
Если вазелин при нанесении на кожу лишь в незначительной степени проникает внутрь, то физиологические липиды (церамиды, нейтральные жиры, жирные кислоты, холестерин) ведут себя совершенно иначе. Используя флуоресцентные метки, удалось показать, что эти молекулы с легкостью преодолевают роговой слой и проникают в живые клетки эпидермиса. Поскольку в клетках кожи есть все необходимые ферменты для переработки экзогенных липидов, липидные молекулы, проникшие извне, быстро разбираются на «запчасти», из которых строятся липиды эпидермиса.
Тем не менее, если обратиться к динамике восстановления кожи, то будет видно, что эффективное восстановление ее барьерной функции наблюдается лишь при использовании смеси трех ключевых липидов кожи — церамидов, холестерина, жирных кислот, взятых в определенном соотношении. В ходе многолетних экспериментов удалось подобрать соотношение физиологических липидов в смеси, оптимальное для скорейшего восстановления барьера — 3:1:1. Обращаем внимание на то, что это молярная пропорция, отражающая соотношение числа липидных молекул в смеси и означающая, что на три молекулы одного вида липидов приходится по одной молекуле двух других видов. Примечательно, что липидную смесь следует адаптировать под конкретное состояние кожи:
- если проблемы с кожей вызваны дефицитом незаменимых жирных кислот (несбалансированное питание, фотоповреждение), то оптимальной рецептурой для восстановления барьерной функции кожи будет:
1 (церамиды) : 1 (холестерин) : 3 (незаменимые жирные кислоты);
- для стареющей кожи необходимо увеличить долю холестерина по сравнению с остальными липидами, так как в стареющем эпидермисе часто наблюдается нарушение метаболизма холестерина, поэтому смесь будет выглядеть следующим образом:
1 (церамиды) : 3 (холестерин) : 1 (незаменимые жирные кислоты);
- при лечении атопического дерматита и некоторых других кожных заболеваний рекомендуется рецептура:
3 (церамиды) : 1 (холестерин) : 1 (жирные кислоты).
С практической точки зрения важно, что свободные жирные кислоты можно заменить триглицеридами или фосфолипидами и все еще получить быстрое восстановление барьера. Можно заменить церамиды сфингомиелином или холестерин эфирами холестерина без какого-либо ущерба для процесса восстановления. Это подтверждает наличие в коже очень активных ферментов, с помощью которых клетки эпидермиса могут использовать экзогенные липиды для синтеза собственных липидов.
Быстрое восстановление барьерной функции наблюдается лишь в том случае, если три ключевых липида (церамиды, холестерин, жирные кислоты) присутствуют в необходимом соотношении. При этом неважно, использована концентрированная или разбавленная липидная смесь, важно, чтобы пропорция ключевых липидов в ней сохранилась.
Натуральные масла
С тех пор как была установлена исключительная роль незаменимых жирных кислот в физиологии кожи, в косметологии большую популярность приобрели натуральные масла. Зачастую их наносят на кожу в чистом виде. С одной стороны, казалось бы, идея хорошая. Натуральные масла не содержат никаких посторонних химических веществ, и многие из них богаты дополнительными активными компонентами, такими как фитостерины, витамин Е, каротиноиды. Однако увлекаться чистыми маслами все-таки не стоит. Напомним, что целостность липидных пластов рогового слоя поддерживается точным соотношением всех липидных компонентов — церамидов, холестерина, свободных жирных кислот. Масла являются по своей природе нейтральными жирами, в основе которых триглицериды. Хотя они могут быть разобраны на составные части с высвобождением свободных жирных кислот, сначала они должны проникнуть через липидные пласты. Если масла слишком много, оно будет разбавлять липидные пласты, временно нарушая их структуру. Обычно структура пластов быстро восстанавливается. Однако слишком обильное и частое применение масел может привести к стойкому нарушению барьерной функции кожи. Все хорошо в меру.
В составе косметических средств натуральные масла обычно содержатся в небольших количествах, поэтому они не так заметно влияют на структуру барьера.
Информацию по составу и свойствам растительных масел, использующихся в косметике и для ухода за кожей, а также нюансы, касающиеся использования физиологических липидов и средств для создания окклюзии вы найдете в наших книгах «НОВАЯ КОСМЕТОЛОГИЯ. Косметические средства: ингредиенты, рецептуры, применение», «Косметическая химия для косметологов и дерматологов» и «НОВАЯ КОСМЕТОЛОГИЯ. Основы современной косметологии. 2-е издание, переработанное и дополненное». Они все доступны в электронном виде, и вы можете познакомиться с ними уже сегодня!

К 2025 г. прогнозируемая продолжительность жизни в развитых странах достигнет 100 лет. Это приведет к увеличению численности пожилого населения, а значит, и частоты ассоциированных со старением заболеваний, в том числе кожных.
В возрасте 50+ в результате структурных изменений кожи начинает развиваться дисфункция эпидермиса, которая выражается в снижении гидратации рогового слоя, нарушении проницаемости барьера, повышении поверхностного рН. На этом фоне увеличивается риск развития или обостряются различные кожные патологии, в том числе атопический дерматит, контактный дерматит, зуд, ксероз.
В обзоре, выполненном группой специалистов под руководством Питера Элиаса, одного из начальников корнеотерапии, обсуждаются возрастные изменения эпидермиса, их связь с разными заболеваниями и способы профилактики и коррекции. Приводим часть перевода этого обзора.
Функции эпидермиса, меняющиеся с возрастом
На рисунке представлены все основные изменения эпидермиса, наблюдающиеся с возрастом. Остановимся на каждом из них подробнее.

Изменение барьерной функции
Оценка барьерной функции рогового слоя проводится путем измерения трансэпидермальной потери воды (ТЭПВ) — при нарушении барьера данный показатель резко возрастает.
У неповрежденной кожи средние нормальные значения ТЭПВ варьируют в зависимости от пола, участка тела, пигментации кожи. Что касается корреляции ТЭПВ с возрастом, то информации на эту тему не так много, и она в определенной степени противоречива. Так, в ряде работ говорится о том, что средние уровни ТЭПВ на некоторых участках тела у пожилых людей могут быть ниже, чем у молодых [1, 2], что на первый взгляд свидетельствует о более надежном барьере возрастной кожи. Вместе с тем в области декольте наблюдается возрастное увеличение ТЭПВ, что говорит об обратном [3]. На шее, предплечьях и кистях рук уровни ТЭПВ сопоставимы у молодых и пожилых женщин [3]. Также было установлено, что параметр ТЭПВ в среднем выше у пожилых женщин, чем у пожилых мужчин [4].
Несмотря на разбор результатов, ясно одно — уровни ТЭПВ в здоровой неповрежденной коже людей разного возраста хоть и несколько отличаются, но не настолько критично, чтобы говорить о патологическом нарушении барьерной функции при старении кожи. Однако возрастная проблема все же существует — после повреждения рогового слоя восстановление барьерной функции у пожилых людей происходит значительно медленнее по сравнению с более молодыми людьми. Этому есть объяснение, и оно заключается в биохимических и структурных изменениях в эпидермисе, которые проявляются с возрастом.
Напомним, что барьер проницаемости кожи локализован в роговом слое. Он состоит из корнеоцитов, заполненных кератином и окруженных белковым роговым конвертом, и чередующихся липидных и водных пластов, расположенных между корнеоцитами и регулирующих диффузию низкомолекулярных веществ через роговой слой. Функционирование барьера в значительной степени определяется количеством и качеством белковых и липидных компонентов, которые формируются в ходе созревания кератиноцитов и их финального превращения в корнеоциты.
Эпидермальный фактор роста. В эпидермисе стареющей кожи уровень эпидермального фактора роста снижается вместе с замедлением скорости деления базальных кератиноцитов. В то же время увеличивается число апоптозов кератиноцитов. Все эти приводит к истончению как живых слоев эпидермиса, так и рогового слоя [5, 6].
Ионы кальция. С возрастом наблюдается изменение градиента концентрации ионов кальция в эпидермисе — еще одного важного фактора, контролирующего деление и созревание кератиноцитов и формирование рогового слоя. Так, в базальном и шиповатом слоях эпидермиса пожилых людей концентрация кальция более высокая, что тормозит пролиферацию кератиноцитов [7, 8]. В гранулярном слое, напротив, уровень кальция падает, и это ухудшает созревание белков рогового слоя (филаггрин, лорикрин и др.) [9–11], что может привести к формированию дефектных корнеоцитов и изменению барьера проницаемости.
Межклеточные липидные пласты рогового слоя (липидный барьер). Что касается межклеточных липидных пластов, являющихся основой липидного барьера рогового слоя, то в них также выявляются возрастные изменения. Для формирования липидного барьера требуются холестерин, свободные жирные кислоты и церамиды примерно в равном молярном соотношении [12]. Эти липиды синтезируются кератиноцитами, и дефицит любого из них может привести к дефектам в барьерных структурах [13]. Исследования показали, что в «старом» роговом слое наблюдается снижение общего содержания липидов более чем на 30% по сравнению с «молодым» [2], что связано с ослаблением синтетической активности кератиноцитов — как в интактном состоянии, так и после острого повреждения. Аппликация смеси барьерных липидов может улучшить функцию барьера у пожилых людей, и это обстоятельство, в свою очередь, подтверждает наличие возрастной барьерной дисфункции [14].
рН рогового слоя. Одним из этапов формирования липидного барьера является ферментативное превращение предшественников липидов в барьерные липиды, и это превращение осуществляется уже вне кератиноцитов во внеклеточных пространствах рогового слоя [15]. Кроме ферментов, ответственных за липидный барьер, в роговом слое есть ферменты, обеспечивающие своевременное отшелушивание роговых чешуек путем разрушения корнеодесмосом (протеолитические ферменты). Все ферменты рогового слоя, как и любые другие ферменты, очень чувствительны к рН своего микроокружения. В роговом слое существует градиент рН — с кислого значения порядка 5,5 (гидролипидная мантия на поверхности кожи) к слабощелочному около 7,2 (на границе с гранулярным слоем). Таким образом, на разной глубине рогового слоя будет свой уровень рН, контролирующий работу ферментов на данной глубине (см. Вставку 1. — Прим. ред.).

С возрастом наблюдается тенденция к повышению поверхностного рН [16–17], что меняет градиент рН через роговой слой, и это сказывается на активности ферментов — протеолитические ферменты в середине и на поверхности рогового слоя при повышении рН активируются, что ускоряет отшелушивание. Напротив, ферменты, отвечающие за липидный барьер, при повышении рН угнетаются, что приводит к формированию измененного липидного барьера. Все это в совокупности приводит к ослаблению барьера проницаемости рогового слоя (см. Вставки 2 и 3. — Прим. ред.).


Аппликация препаратов с нейтральным рН задерживает восстановление барьера, напротив, подкисление рогового слоя ускоряет восстановление барьера как в молодой, так и в возрастной коже [18–20].
Глюкокортикоиды и кортизол. Биологическое старение сопровождается увеличением секреции глюкокортикоидов и повышением уровня кортизола в коже [5, 21]. Исследования показали, что системное или местное применение глюкокортикоидов тормозит пролиферацию кератиноцитов и ослабляет барьер [22]. В коже под действием 11β-гидроксистероиддегидрогеназы 1 кортизон превращается в активную форму — кортизол [23]. В возрастной коже активность этого фермента выше по сравнению с молодой [24], и это отрицательно сказывается на способности эпидермиса к восстановлению и формированию барьера [25]. Ингибирование 11β-гидроксистероиддегидрогеназы 1 не только корректирует вызванные глюкокортикоидами эпидермальные функциональные нарушения, но и способствует восстановлению структуры барьера [26, 27].
Другие факторы. Есть и другие факторы, связанные со старением изменения кожи, которые могут способствовать изменению функции эпидермиса. Например, по сравнению с молодым эпидермисом в стареющем эпидермисе наблюдается более чем 60% снижение уровня белка-антагониста рецептора ИЛ-1, а дефицит рецептора ИЛ-1α типа 1 задерживает восстановление барьера [28]. Напротив, как повышение экспрессии, так и введение ИЛ-1α укрепляет барьер как в стареющей коже, так и в коже плода [29, 30].
В стареющей коже также наблюдается снижение количества гиалуроновой кислоты. Исследования показали: местное применение гиалуроновой кислоты стимулирует дифференцировку кератиноцитов и выработку липидов, что приводит к усилению функции эпидермального барьера проницаемости как в молодой, так и в пожилой коже [31, 32].
Наконец, с возрастом наблюдается снижение экспрессии эпидермального аквапорина-3 — белка, формирующего водные каналы в мембране кератиноцитов и отвечающего за внутриклеточный водный баланс 34. Выключение гена, кодирующего аквапорин-3, задерживает восстановление барьера проницаемости [35]. Напротив, усиление экспрессии аквапорина-3 улучшает барьерную функцию [36].
Снижение гидратации рогового слоя
Примерно после 40 лет уровень гидратации рогового слоя начинает снижаться. Механизмы, лежащие в основе уменьшения гидратации рогового слоя в стареющей коже, можно объяснить дефицитом веществ, входящих в водорегулирующие и водоудерживающие его структуры.
Во-первых, в роговом слое стареющей кожи снижается количество барьерных липидов [2, 37], в том числе церамидов [38]. Их дефицит можно компенсировать путем перорального или местного применения церамидов, что приводит к повышению гидратации рогового слоя [39, 40].
Во-вторых, снижается уровень филаггрина [11] и его метаболитов, включая транс-урокановую и пироглутаминовую кислоты, входящие в состав натурального увлажняющего фактора (NMF). Аппликации этих веществ, а также и других компонентов NMF, таких как свободные аминокислоты, молочная кислота и мочевина, способствуют повышению гидратации рогового слоя.
В-третьих, в возрастной коже по сравнению с молодой ниже продукция себума в целом и глицерина в частности [16, 41]. Себум вместе с секретом потовых желез формирует гидролипидную мантию, регулирующую испарение воды с поверхности кожи. Если мантия нарушена, испарение усиливается, поэтому в себодефицитной коже наблюдается снижение гидратации рогового слоя, и аппликация препаратов, имитирующих гидролипидную мантию, помогает ее восстановить.
Наконец, в возрастном эпидермисе снижается уровень аквапорина-3 [33–35]. Это ухудшает движение воды в живых слоях эпидермиса и способствует развитию застойных явлений, на фоне которых тормозится деление и созревание кератиноцитов. Аквапориновые каналы могут активироваться в присутствии небольшого количества глицерина (несколько процентов) в окружающей среде [42], высокие концентрации глицерина (свыше 10%), напротив, ингибируют их работу.
Повышение pH поверхности кожи
Значение pH поверхности кожи человека в первые две недели жизни обычно выше, к 5–6-й нед оно снижается до среднего 5,5 [43]. После 55 лет pH поверхности кожи имеет тенденцию к повышению, и у людей старше 70 это повышение становится существенным [16, 18]. Нормальные значения pH поверхности кожи человека зависят от пола и участка тела [44].
Возрастное повышение рН поверхности кожи связано с несколькими факторами. Один из них — уменьшение продукции себума и, соответственно, количества триглицеридов [3, 16], из которых высвобождаются свободные жирные кислоты, подкисляющие гидролипидную мантию и поверхность рогового слоя [45]. В нижних слоях роговой слой подкисляется благодаря высвобождению свободных жирных кислот из фосфолипидов клеточных мембран под действием секреторной фосфолипазы 2 (sPLA2) [46], экспрессия которой заметно снижается с возрастом.
Натрий-водородный обменник 1 (NHE1) — еще один механизм, регулирующий градиент pH в роговом слое: при дефиците NHE1 pH поверхности кожи повышается [47]. В стареющей коже экспрессия NHE1 значительно ниже, чем в молодой коже, что может способствовать повышению поверхностного рН.
И наконец, в стареющей коже наблюдается низкий уровень экспрессии филаггрина [10], который может расщепляться до транс-урокановой кислоты по филаггрин-гистидин-урокановокислотному пути [48]. Урокановая кислота подкисляет роговой слой [49].
Узнать больше о последствиях возрастных изменений эпидермиса, а также подходах к улучшению эпидермальных функций в стареющей коже — что именно нужно делать, чтобы поддержать здоровье кожи, вы можете в полной версии статьи, опубликованной у журнале «Косметика и медицина» №4-2020. Журнал доступен в печатной и электронной версии. Рекомендуем — там еще много очень интересных материалов!
Литература:
© Wang Z., Man M.Q., Tienan L., et al. Aging-associated alterations in epidermal function and their clinical significance. Aging 2020; 12(6): 5551–5565. Перевод и публикация в сокращенном виде — в соответствии с лицензией Creative Commons Attribution License.
В представленной статье обобщены современные данные о строении и функции эпидермального барьера, рассмотрены вопросы его роли в развитии атопического дерматита.
This article summarizes current data on the structure and function of the epidermal barrier, we also considered its role in development of atopic dermatitis.
С тех пор как наземная жизнь стала угрожать млекопитающим обезвоживанием, все более становятся актуальными исследования структурных, клеточных, биохимических и регуляторных механизмов организма, участвующих в поддержании гомеостаза проницаемости эпидермального барьера [1].
Кожа обеспечивает жизненно важную функцию, защищая позвоночных от повседневных и экстремальных влияний факторов внешней среды, таких как воздействие антигенов, ультрафиолетового света, моющих средств, микроорганизмов, токсинов, наночастиц и иных повреждений [2]. Таким образом, эпидермальный барьер, являясь физическим барьером [3], обеспечивает защиту организма на границе двух сред, ограничивая как потерю воды из организма, так и попадание патогенных микроорганизмов в организм [4].
Важнейшая составная часть эпидермального барьера, от которой зависит проникновение раздражителей и аллергенов, находится в нижней части рогового слоя [5]. Несмотря на минимальные размеры (толщина около 7–35 мкм), он играет определяющую роль в формировании защитного барьера и способствует предотвращению чрезкожного проникновения патогенов. Кроме роли физического барьера, роговой слой участвует в терморегуляции, газообмене, гидратации, обеспечении врожденного иммунитета, а создавая определенную pH поверхности кожи (слегка кислую), обеспечивает дополнительную защиту от болезнетворных микроорганизмов [6].
Во время терминальной дифференцировки кератиноциты зернистого слоя «заменяют» свою клеточную мембрану на нерастворимый белковый слой — роговую оболочку [7]. Она придает прочность корнеоцитам и является «платформой» для прикрепления липидов. Роговая оболочка в основном сформирована структурными белками, такими как лорикрин, инволюкрин, филаггрин (ФЛГ) и малыми пролин-богатыми белками. Особенно важен филаггрин, объединяющий кератиновые волокна клеток, «скручивая» кератиноциты в уплощенные диски с большой площадью поверхности [8].
Вокруг корнеоцитов расположены холестерин, фосфолипиды и церамиды, создавая многослойную мембрану из липидных пластинок [3, 9]. Последние играют важную роль в регуляции водного гомеостаза кожи, помогают сохранять воду в организме, а также предотвращают проникновение патогенных микроорганизмов и аллергенов [10].
На границе между роговым и зернистым слоями происходит секреция ламеллярных телец, содержащих предшественники липидов, а также необходимые ферменты для переработки этих прекурсоров в зрелые составляющие липидной матрицы [11]. Перед секрецией происходит сборка ламеллярных телец в пластинчатом комплексе, посредством дифференцированной их упаковки с различным содержимым [12]. Кроме вышеупомянутых метаболитов липидов, липидные тельца доставляют в межклеточное пространство рогового слоя протеолитически активные ферменты, такие как сериновые протеазы семейства калликреина, а также их ингибиторов, в том числе и лимфоэпителиальный ингибитор сериновых протеаз типа Kazal-5 (LEKTI) [13].
Единство между корнеоцитами рогового слоя зависит прежде всего от корнеодесмосом. Подобно десмосомам, они поддерживают целостность тканей посредством молекул межклеточной адгезии с помощью кальций-зависимых взаимодействий между двумя представителями семейства кадгерина, внеклеточных трансмембранных гликопротеинов — десмоглеина и десмоколлина. Внутри корнеоцитов десмоглеин и десмоколлин соединяют кератиновые филламенты корнеодесмосом посредством «соединительной бляшки», состоящей из плакоглобина, десмоплакина и плакофиллина. Десмоглеин и десмоколлин перемещаются от оболочки корнеоцитов в липидную пластину между корнеоцитами и связывают воедино белки соседних клеток. Кроме того, в процессе кератинизации эпителия экспрессируется специфический белок с молекулярной массой 52 кДа — корнеодесмосин [8, 14]. После секреции в экстрацеллюлярное пространство корнеодесмосин перемещается в область между зернистым и роговым слоями и проникает в десмосому. Появление корнеодесмосина знаменует переход от десмосом к корнеодесмосомам [3, 12].
Во время «нормальной» десквамации рогового слоя самые поверхностные корнеоциты «уходят» с поверхности кожи, замещаясь кератиноцитами, подвергшимися терминальной дифференцировке [14, 15]. Таким образом, существует «тонкий» баланс между базальной клеточной пролиферацией и десквамацией рогового слоя. Это обеспечивает постоянное обновление клеток эпидермиса, а также способствует поддержанию одинаковой толщины эпителия [14, 16]. Caubet и соавт. [15] описали несколько деградационных протеаз, которые разрушают внеклеточные корнеодесмосомальные адгезивные белки, связывающие корнеоциты вместе.
В роговом слое среди протеаз, вовлеченных в процесс десквамации, присутствуют хемотрипсиновые (SCCE) и трипсиновые ферменты (SCTE), которые экспрессируются кератиноцитами зернистого слоя и находятся во внеклеточном пространстве рогового слоя [14]. Данные протеазы гидролизуют корнеодесмосин и десмоколлин [15]. Их активность контролируется семейством специфических ингибиторов, в которое входит LEKTI [17]. При этом скорость десквамации коррелирует с количеством ингибиторов протеаз, поступивших из ламеллярных телец [3].
На барьерную функцию эпидермиса влияют структура, дифференцировка, функциональная активность кератиноцитов, качественный и количественный состав липидов рогового слоя эпидермиса, наличие веществ, относящихся к естественному увлажняющему фактору, а также рН поверхности кожи [18]. При изменении каких-либо из перечисленных показателей барьерная функция эпидермиса нарушается, что приводит к усиленному испарению воды через роговой слой. У человека эпидермальный барьер восстанавливается на 60% через 12 часов, а полное восстановление занимает 72 часа [19]. Полагают, что быстрое восстановление эпидермального барьера происходит за счет массового выброса из клеток готовых ламеллярных телец. В медленную фазу восстановления усиливается синтез жирных кислот, холестерина, церамидов, а также образование новых ламеллярных гранул. Нарушение восстановления кожного барьера приводит к обезвоживанию эпидермиса и развитию выраженной сухости кожи, что и наблюдается при развитии атопического дерматита (АД) [20].
Повреждение эпидермального барьера способствует проникновению через кожу микробов, аллергенов и различных поллютантов (токсины, раздражающие и загрязняющие вещества). Проникновение агентов с антигенными свойствами увеличивает риск сенсибилизации, поскольку взаимодействие аллергенов и аллерген-представляющих клеток кожи инициирует воспаление [14]. Степень дисфункции барьера коррелирует со степенью воспаления и тяжестью АД [11]. Впервые Y. Werner и M. Lindberg (1985 г.) привели доказательства нарушений барьерной функции кожи, измерив трансэпидермальную потерю воды (ТЭПВ) у лиц с АД. Авторам удалось показать, что у больных АД нарушения эпидермального барьера отмечаются не только в очагах активного воспаления, но и на клинически неизмененной коже [10, 21].
Изменения в свойствах эпидермального барьера, которые наблюдаются при АД, включают увеличение ТЭПВ, изменения рН поверхности кожи, повышение ее проницаемости, увеличение бактериальной колонизации, изменение в экспрессии антимикробных пептидов, а также нарушение его целостности. При аномалии эпидермального барьера аллергены, раздражающие и другие вещества могут проникать через кожу, способствуя обострению АД [6].
В настоящее время нарушение функции кожного барьера является одним из ведущих этиопатогенетических факторов АД. По данным разных авторов у 30–66% больных АД протекает без изменения уровня общего IgE в сыворотке крови и специфичных IgE к аллергенам. Полагают, что именно у этих пациентов нарушение функции кожного барьера играет ведущую роль в развитии и прогрессировании заболевания [22].
В последние годы определен ряд генетических мутаций, приводящих к изменениям в роговом слое эпидермиса. Так, у больных АД определяются мутации гена профилаггрина [23], способствующие нарушению синтеза белка ФЛГ — одного из компонентов цитокератинового скелета, обеспечивающего ороговение кератиноцитов. В результате изменения терминальной дифференцировки кератиноцитов развивается их функциональная несостоятельность [24]. Кроме того, снижение экспрессии гена ФЛГ уменьшает уровень «натурального увлажняющего фактора» [25]. Дефицит ФЛГ и/или продуктов его деградации способствует сухости кожи, что коррелирует с клинической картиной нарушения эпидермального барьера при АД [26]. Более того, при уменьшении ФЛГ усиливается «раздражающий» эффект аллергенов на дендритные клетки, понижая при этом порог их чувствительности к воспалению, что демонстрирует важность этого белка в предотвращении пенетрации аллергенов [27].
Кроме того, у больных АД выявлены полиморфные варианты гена SPINK5, приводящие к дизрегуляции синтеза ингибитора сериновой протеазы LEKTI, который в норме блокирует избыточную продукцию SCCE [28]. Активность деградационных протеаз также значимо связана с дефектом кожного барьера при АД [23]. Разбалансировка функционирования этих ферментов ведет к усиленному отшелушиванию клеток и истончению рогового слоя, увеличивая проницаемость эпидермального барьера [14]. Установлено, что у больных АД изменена липидная мантия рогового слоя, предупреждающая ТЭПВ. Отмечается низкий уровень церамидов первого и третьего типов в сочетании с повышением уровня свободного холестерола [29]. Повышение уровня рН на поверхности кожи приводит к снижению синтеза липидов и активизации ферментов (в частности, SCCE), повреждающих корнеодесмосомы. Уменьшение количества веществ, относящихся к «натуральному увлажняющему фактору», также способствует нарушению функционирования эпидермального барьера [30].
Таким образом, у больных АД отмечается комплекс нарушений, приводящих к дисфункции кожного барьера, усилению ТЭПВ и обезвоживанию кожных покровов [14]. Из вышеуказанного следует, что пациенты с АД могут иметь дефект кожного барьера, в основе которого лежат как генетические, так и приобретенные механизмы. Этот дефект способны спровоцировать внешние факторы, такие как царапины, использование моющих средств, микробная колонизация, а также воздействие протеаз различных аллергенов (в частности, протеаз клещей домашней пыли) [10]. Распознание конкретных механизмов, участвующих в патогенезе воспалительных заболеваний кожи, в частности, АД, безусловно, будет способствовать поиску и разработке новых, более эффективных методов воздействия на патологический процесс с минимальным количеством системных эффектов [8].
Литература
- Elias P. M. The skin barrier as an innate immune element // Semin. Immunopathol. 2007. Vol. 29 (1); р. 3–14.
- De Benedetto A., Kubo А., Beck L. A. Skin barrier disruption — a requirement for allergen sensitization? // J. Invest. Dermatol. 2012. Vol. 132 (3); р. 949–63.
- Danby S. G., Cork M. J. New understanding of atopic dermatitis: the role of epidermal barrier dysfunction and subclinical inflammation. // J. Clin. Dermatol. 2010. Vol. 1 (2); р. 33–46.
- Котлуков В. К., Кузьменко Л. Г., Антипова Н. В. Наружные дерматологические средства серии «Бепантен» в практике педиатра // Медицинский совет. 2012. Т. 5; с. 81–85.
- Madison K. С. Barrier function of the skin: «la raison d’etre» of the epidermis // J. Invest. Dermatol. 2003. Vol. 121; р. 231–241.
- Lorena S. T., Morello III A. P., Mack Correa M. C. et al. The infant skin barrier: can we preserve, protect, and enhance the barrier? // Dermatol. Res. Pract. 2012. Doi: 10.1155/2012/198789.
- Candi E., Schmidt R., Melino G. The cornified envelope: a model of cell death in the skin // Nat. Rev. Mol. Cell Biol. 2005. Vol. 6; р. 328–340.
- Michael J. C., Simon G. D., Yiannis V. et al. Epidermal barrier dysfunction in atopic dermatitis // J. Invest. Dermatol. 2009. Vol. 129; р. 1892–908.
- Ревякина В. А. Современные тенденции в комплексной наружной терапии атопического дерматита у детей // Лечащий Врач. 2014. № 6, с. 38.
- De Benedetto А., Agnihothri R., McGirt L. Y. et al. Atopic dermatitis: a disease caused by innate immune defects? // J. Invest. Dermatol. 2009. Vol. 129; р. 14–30.
- Roelandt T., Thys B., Heughebaert C. et al. LEKTI-1 in sickness and in health // Int. J. Cosmetic Sci. 2009. Vol. 31 (4); р. 247–254.
- Ishida-Yamamoto A., Simon M., Kishibe M. et al. Epidermal lamellar granules transport different cargoes as distinct aggregates // J. Invest. Dermatol. 2004. Vol. 122; р. 1137–1144.
- Ishida-Yamamoto A., Deraison C., Bonnart C. et al. LEKTI is localized in lamellar granules, separated from KLK5 and KLK7, and is secreted in the extracellular spaces of the superficial stratum granulosum // J. Invest. Dermatol. 2005. Vol. 124; р. 360–366.
- Cork M. J., Robinson D. A., Vasilopoulos Y. et al. New perspectives on epidermal barrier dysfunction in atopic dermatitis: gene-environment interactions // J. Allergy Clin. Immunol. 2006. Vol. 118; р. 3–21.
- Caubet C., Jonca N., Brattsand M. et al. Degradation of corneodesmosome proteins by two serine proteases of the kallikrein family, SCTE/KLK5/hK5 and SCCE/KLK7/hK7 // J. Invest. Dermatol. 2004. Vol. 122; Р. 1235–1244.
- Goldstein A. M., Abramovits W. Ceramides and the stratum corneum: structure, function, and new methods to promote repair // Int. J. Dermatol. 2003. Vol. 42; р. 256–59.
- Chavanas S., Bodemer C., Rochat A. Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome // Nat. Genet. 2000. Vol. 25; р. 141–142.
- Мурашкин Н. Н. Нарушения дермального барьера как фактор хронизации дерматозов в детском возрасте, подходы к терапии: теоретические и практические инновации // Лечащий Врач. 2014. № 6, с. 19.
- Эрнандес Е., Марголина А., Петрухина А. Липидный барьер кожи и косметические средства // Косметика и медицина. 2005. Т. 6; с. 35–38.
- Тамразова О. Б. Синдром сухой кожи // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 3; с. 25–31.
- Хлебникова А. Н. Увлажняющие средства в терапии хронических дерматозов // Клиническая дерматология и венерология. 2010. Т. 4; с. 32–39.
- Palmer C. N., Irvine A. D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nat. Genet. 2006. Vol. 38 (4); р. 441–446.
- Молочков А. В., Тамразова О. Б. Ксероз кожи — основной патогенетический фактор развития атопического дерматита // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 4; с. 48–54.
- Vasilopoulos Y., Cork M. J., Murphy R. et al. Genetic association between an AACC insertion in the 3’UTR of the stratum corneum chymotryptic enzyme gene and atopic dermatitis // J. Invest. Dermatol. 2004. Vol. 123; р. 62–66.
- Smith F. J., Irvine A. D., Terron-Kwiatkowski A. et al. Loss-of-function mutations in the gene encoding filaggrin cause ichthyosis vulgaris // Nat. Genet. 2006. Vol. 38 (3); р. 337–342.
- Nemoto-Hasebe I., Akiyama M., Nomura T. et al. Clinical severity correlates with impaired barrier in? laggrin-related eczema // J. Invest. Dermatol. 2009. Vol. 129 (3); р. 682–689.
- Fallon P. G., Sasaki T., Sandilands A. et al. A homozygous frameshift mutation in the mouse Flg gene facilitates enhanced percutaneous allergen priming // Nat. Genet. 2009. Vol. 41 (5); р. 602–608.
- Kato A., Fukai K., Oiso N. et al. Association of SPINK5 gene polymorphisms with atopic dermatitis in the Japanese population // Br. J. Dermatol. 2003. Vol. 148; р. 665–669.
- Пампура А. Н., Чусляева А. А. Современные подходы к терапии атопического дерматита у детей // Медицинский вестник Башкортостана. 2014. Т. 9 (1); с. 93–98.
- Eberlein-Konig B., Schafer T., Huss-Marp J. et al. Skin surface pH, stratum corneum hydration, transepidermal water loss and skin roughness related to atopic eczema and skin dryness in a population of primary school children // Acta Dermatol. Venereol. 2000. Vol. 80; р. 188–191.
С. В. Левашева 1 , кандидат медицинских наук
Э. И. Эткина, доктор медицинских наук, профессор
Л. Л. Гурьева, кандидат медицинских наук
Л. И. Бабенкова, кандидат медицинских наук
Л. Я. Данилова
С. Э. Якута
Читайте также:

