Применение живицы при гангрене
Обновлено: 02.05.2024
Синдром диабетической стопы (СДС) — очень серьезное осложнение сахарного диабета (СД). Это осложнение (в 85% случаев представленное трофическими язвами стоп разной тяжести) выявляется у 4—10% от общего числа пациентов с СД.
Синдром диабетической стопы (СДС) — очень серьезное осложнение сахарного диабета (СД). Это осложнение (в 85% случаев представленное трофическими язвами стоп разной тяжести) выявляется у 4—10% от общего числа пациентов с СД. Бытует мнение, что эффективность лечения язвенных дефектов стоп при СД низка, однако это не соответствует действительности. На самом деле при нейропатической форме (50—70% всех больных СДС) заживление трофической язвы происходит в 80—90% случаев. Для этого необходимо соблюдение нескольких обязательных условий (см. таблицу 1), тогда как низкая эффективность лечения часто связана с тем, что условия соблюдаются не полностью. Как показывает практика последних 10 лет, появление специализированных отделений и кабинетов «Диабетической стопы» значительно повысило эффективность лечения этих пациентов и снизило число ампутаций. Одна из не решенных пока проблем, актуальных для таких специализированных отделений, — низкая эффективность консервативного лечения диабетических язв при (нейро)ишемической форме СДС.
Ишемическая и нейроишемическая формы составляют менее половины всех случаев СДС (5—10% и 25—40%, соответственно) (Дедов, 1998, Shаw, 1996; Международная рабочая группа по диабетической стопе, 2000; Staroverova, 2001). Однако наличие выраженной ишемии принципиально меняет прогноз лечения у этих пациентов: вероятность заживления язвенных дефектов без восстановления магистрального кровотока составляет 10—30% (Международная рабочая группа по диабетической стопе, 2000). Следует помнить, что назначение большинства вазоактивных средств не повышает вероятность заживления язвенных дефектов. Согласно данным метаанализа (Loosemore, 1994), непростаноидные препараты (эффективные при II стадии хронической артериальной недостаточности, ХАН) неэффективны при III-IV стадиях. Простаниоды (алпростадил, илиопрост) влияют на прогноз при III-IV стадиях ХАН, но в основном — у больных с умеренными проявлениями критической ишемии (tcpO2>20 mmHg). Прогрессирование поражения и отсутствие заживления ран после малых ампутаций на фоне критической ишемии приводят к высокой ампутации у значительной части пациентов. Однако хорошо известно, что проведенное в таких условиях реконструктивное вмешательство на артериях нижних конечностей кардинально меняет прогноз лечения, позволяет избежать высокой, а в ряде случаев — и малой ампутации. Это привело к тому, что в последние годы хирургическая реконструкция артерий (путем шунтирования или эндоваскулярных вмешательств) рассматривается в качестве метода выбора при лечении как перемежающейся хромоты, так и язвенных дефектов ишемического происхождения при СД (American Diabetes Association, 1999; Международная рабочая группа по диабетической стопе, 2000). Была показана высокая эффективность реконструктивных операций у пациентов с СД, в ряде случаев сопоставимая с таковой у пациентов без нарушений углеводного обмена. Результатом широкого внедрения этих методов в зарубежных странах явилось значительное снижение числа ампутаций при ишемической форме синдрома диабетической стопы в Европе. Реконструктивные операции на артериях у больных сахарным диабетом проводятся и в России (Покровский, 2002; Гавриленко, 2002; Мухамадеев, 2002).
Еще один недавно вошедший в практику метод лечения — иммобилизирующая разгрузочная повязка (ИРП), в зарубежной литературе — Total Contact Cast. Такая фиксирующая повязка на голень и стопу представляет собой более или менее жесткий «сапожок» (из гипса или современных полимерных материалов, съемный или несъемный), переносящий нагрузку с области язвы на другие участки. Важно, что этот метод позволяет ходить по улице, работать и т. п., не подвергая при этом рану механической нагрузке. В большинстве зарубежных стран ИРП стал «золотым стандартом» разгрузки, но в России он практически не применялся из-за боязни возникновения осложнений (не всегда обоснованной). В нашей стране основным, хорошо себя зарекомендовавшим методом разгрузки сегодня является «полубашмак». Однако в ряде ситуаций «полубашмак» оказывается неэффективен либо существуют противопоказания к его применению. Это расположение язвы в средней части стопы или пяточной области, необходимость выходить на улицу, работать, а также несоблюдение пациентом предписанного режима разгрузки. В этих случаях требуется использование ИРП.
Пациент В., 57 лет, обратился за консультацией в отделение «Диабетическая стопа» ЭНЦ РАМН 15.04.2003. Диагноз: сахарный диабет 2 типа, тяжелого течения, декомпенсация. Диабетическая дистальная полинейропатия. Диабетическая макроангиопатия: атеросклероз артерий нижних конечностей, критическая ишемия левой нижней конечности (ХАН IV ст). Синдром диабетической стопы, нейроишемическая форма: инфицированный язвенный дефект левой пяточной области II-III cт. по Wagner. Диабетическая микроангиопатия: диабетическая нефропатия в стадии протеинурии с сохранной азотовыделительной функцией почек (IV ст. по Morgensen); диабетическая ретинопатия II ст. ИБС, стенокардия напряжения I ф. к. Многоузловой эутиреоидный зоб 0 ст. (ВОЗ).
СД 2 типа диагностирован в 1990 г. Пациент получал лечение диабетоном 80 мг 1-2 таб/сут (принимал препарат нерегулярно), контроль гликемии был нерегулярным. На момент осмотра уровень гликемии достиг 17,5 ммоль/л натощак.
Перемежающуюся хромоту не отмечал (однако вел малоподвижный образ жизни, редко проходил более 500 м).
23.02.2003 появился язвенный дефект левой пяточной области. Рана не заживала, несмотря на проводившееся амбулаторное и стационарное лечение (включавшее вазапростан 40 мкг/сут N 15), осложнилась раневой инфекцией (St. aureus, Enterococcus).
На момент осмотра: рана 4,5 х 3,5 см, глубиной до 3 см (см. рисунок 1). Стопа отечна, теплая на ощупь. Вибрационная чувствительность на стопах = 0-1 балл, пульсация на артериях правой стопы ослаблена, левой — не определяется.
Общее состояние: относительно удовлетворительное, температура тела в норме. ЧСС = 70 уд/мин, АД = 140—150/80—90 mmHg.
Рентгенологически: дефект мягких тканей пяточной области, признаков деструкции пяточной кости нет.
УЗДГ: справа — признаки стеноза ~50% бедренно-подколенного сегмента, артерий голени. Слева — стенотические изменения бедренно-подколенного сегмента (~50%), окклюзия передней тибиальной артерии, субтотальный стеноз задней большеберцовой артерии.
Дуплексное сканирование брюшного отдела аорты и артерий нижних конечностей (в ГКБ №81): сосудистая стенка неровная, утолщена в дистальных сегментах обеих задних большеберцовых артерий (ЗББА) с медиокальцинозом. Толщина комплекса «интима-медиа» до 1,2 мм. В просвете дистальных сегментов ЗББА — множественные микрокальцинаты, стенозирование ЗББА справа до 90%, слева до 80%.
Восстановление артериального кровотока
На основании данных обследования и с учетом неэффективности проводившейся консервативной терапии, пациент был направлен к ангиохирургу для проведения реконструктивного вмешательства на артериях нижней конечности. Указанное лечение осуществлялось в 25-м Центральном военном клиническом госпитале РВСН с 13.05.03 по 02.06.03.
При обследовании в стационаре были получены следующие данные.
Клинический анализ крови: гемоглобин — 128 г/л, эритр. — 4,36*10 12 /л, лейк. — 6,8*10 9 /л (пал. — 2%, сегм. — 62%, эоз. — 2%, лимф. — 28%, мон. — 6%), СОЭ — 23 мм/ч.
Клинический анализ мочи: уд. вес — 1014, белок — 1,22%, цил. — нет, лейк. — 2—4 в п/зр, эритр. — 3—5 в п/зр.
Биохимический анализ крови: общий белок — 69,0 ммоль/л, билирубин — 10,0 ммоль/л, креатинин — 120 мкмоль/л, мочевина — 6,1 ммоль/л, холестерин — 4,8 ммоль/л, β-липопротеиды — 40%, триглицериды — 1,0 ммоль/л, АЛТ, АСТ — в норме.
ЭКГ: ритм синусовый, правильный, 68 уд/мин. Горизонтальное положение электрической оси сердца.
Ro-графия органов грудной клетки: легочные поля прозрачны. Корни фиброзные, с петрификатами. Гипертрофия левого желудочка, уплотнена дуга аорты.
УЗИ органов брюшной полости: печень, селезенка, желчный пузырь, поджелудочная железа, почки — без патологических изменений.
Ангиография артерий нижних конечностей: абдоминальный отдел аорты с неровными контурами, просвет ее сохранен. Контуры магистральных артерий нижних конечностей неровные, просвет сохранен, выраженный кальциноз стенок артерий. Магистральные артерии обеих голеней с неровными контурами, резко истончаются ниже уровня щели голеностопных суставов. В дистальном отделе левой задней большеберцовой артерии определяются два тандемных критических стеноза. Подошвенные артериальные дуги разомкнуты.
Проведенное лечение
Антибиотикотерапия (офлоксацин 200 мг два раза в день), хирургическая обработка раны (иссечение некротизированных тканей из кармана глубиной до 3 см), дезинтоксикационная терапия, дезагреганты в/в. Пациент переведен на инсулинотерапию (актрапид 8 ЕД п/з, 6 ЕД п/о, 6 ЕД п/у; монотард 8 ЕД п/з, 8 ЕД — 22.00), достигнута компенсация углеводного обмена (гликемический профиль 25.06.03: 8,9–6,5–4,7–7,4–5,1 ммоль/л). В связи с диабетической нефропатией IV ст. пациент постоянно получает эналаприл 10 мг/сут.
20.05.03 произведена рентгеноэндоваскулярная ангиопластика задней большеберцовой артерии слева, восстановлен артериальный кровоток.
Операция проводилась под местной анестезией 0,5%—20,0 Sol. Novocaini, левосторонним чрезбедренным доступом антеградно пунктирована бедренная артерия. Через интродюсер диаметром 5F введен коронарный проводник в заднюю большеберцовую артерию дистальнее стенозов. В область критических стенозов подведен баллонный сегмент катетера размерами 2, 5x20, 0 мм. Выполнена ангиопластика под рабочим давлением до 5 атм. На контрольной ангиограмме стеноз устранен, препятствий для кровотока не определяется. Проводник удален. Интродюсер подшит к коже. Асептическая повязка. За период вмешательства больному внутриартериально введено 7 тыс. ЕД гепарина. Состояние пациента не изменилось.
После выписки: при допплеровском исследовании магистрального кровотока справа и слева в задних большеберцовых артериях — магистральный измененный кровоток (ЛПИ > 1), в тыльных артериях стопы — коллатеральный кровоток, но ЛПИ > 1 (возможно завышение лодыжечно-плечевого индекса, вследствие артериосклероза Менкеберга).
Чрескожное напряжение кислорода (tcpO2) на тыльной стороне левой стопы (через три месяца после ангиопластики): лежа — 19 mmHg, сидя — 20 mmHg (возможно занижение показателя вследствие отека стопы). По совокупности клинических данных, состояния раны и результатов инструментального обследования было сделано заключение, что явления критической ишемии устранены.
Применение индивидуальной разгрузочной повязки (Total Contact Cast)
Пациент был выписан для амбулаторного лечения, которое включало:
- ежедневные перевязки с промыванием раны раствором диоксидина, фурацилина, наложением атравматической повязки (Atrauman, Branolind);
- регулярное удаление гиперкератоза с краев раны;
- разгрузку пораженной конечности (костыли);
- компенсацию углеводного обмена (инсулинотерапия).
Признаков ишемии конечности не наблюдалось, рана заполнилась полноценной грануляционной тканью (см. рисунок 2), но скорость сокращения размеров раны оказалась ниже расчетной (см. рисунок 3).
Известно, что скорость заживления соответствует расчетной при отсутствии значимой ишемии, инфекции и механической нагрузки на рану. Учитывая, что разгрузка конечности с применением костылей не является оптимальной, было решено изготовить иммобилизирующую разгрузочную повязку.
Эквивалентный радиус раны рассчитывается как (d1+d2)/4, где d1 и d2 — соответственно максимальный и перпендикулярный ему минимальный диаметр раны.
Расчетная скорость заживления (черная линия) определяется по формуле Cavanagh: r = -0.74 + 1.04*r0 — 0.1*t — 0.012*r0*t, где r — эквивалентный радиус раны в данный момент, r0 — исходный эквивалентный радиус раны, а t — время с начала лечения (дни) (Cavanagh, 2001).
Реальные размеры раны наносились на график (красная линия) при каждом осмотре пациента (точка «0» — 1 месяц после баллонной ангиопластики). Из графика видно, что после изготовления ИРП скорость заживления (угол наклона графика) значительно выросла и достигла расчетной.
При применении этого метода разгрузки рана начала затягиваться гораздо быстрее, и к 10.09.03 было достигнуто заживление язвы (см. рисунок 4).
Основными методами реваскуляризации нижних конечностей являются шунтирующие операции и чрескожная транслюминальная баллонная ангиопластика (ЧТБА). Зачастую ЧТБА считают недостаточно эффективной и предлагают не использовать у пациентов с СД. Известно, что долговременный эффект шунтирования выше, чем у баллонной ангиопластики, причем у больных с СД эта разница выражена сильнее (Dyet, 2000). Но в критических ситуациях (язвенные дефекты, критическая ишемия) ангиопластика представляет собой малоинвазивный метод, позволяющий стабилизировать ситуацию и избежать ампутации, что зачастую более важно, чем отдаленные результаты вмешательства. Это так называемая limb-saving angioplasty — ангиопластика для спасения конечности.
История болезни, представленная выше, демонстрирует также, как важна постоянная оценка эффективности проводимого лечения (в нашем случае — сопоставление динамики размеров язвы с результатами расчета по формуле Cavanagh). Если эффект от лечения недостаточен, необходимо выявить причину, по которой это происходит. В нашем случае отсутствие оптимального режима разгрузки оказалось достаточной причиной для замедленного заживления раны, и эта проблема могла быть решена только с помощью нового метода — иммобилизирующей разгрузочной повязки. Следует особенно отметить, что для приближения к «идеальной» скорости заживления не потребовалось использования ни «стимуляторов заживления» (солкосерил, актовегин, метилурацил и т. п.), ни «сосудистых» средств. Эти препараты широко применяются, однако их эффективность в отсутствии необходимых условий для заживления (см. таблицу 1) крайне низка.
В настоящее время становятся доступными новые методы лечения СДС, внедрение которых в повседневную практику вполне возможно и крайне необходимо. Только адекватное комбинированное лечение позволяет достичь оптимальных результатов, особенно в сложных случаях, таких, как синдром диабетической стопы.
По вопросам литературы обращайтесь в редакцию
О. В. Удовиченко, кандидат медицинских наук
Г. Р. Галстян, кандидат медицинских наук
И. А. Ерошкин, кандидат медицинских наук
А. А. Ефимов, О. В. Носов
Ю. Г. Васильев, кандидат медицинских наук
Эндокринологический научный центр РАМН (Москва), 25-й Центральный военный клинический госпиталь РВСН (Одинцово)
Настоящая работа посвящена исследованию возможности повышения эффективности комплексной терапии трофических язв и послеоперационных ран нижних конечностей с помощью топического иммуномодулятора. В исследовании приняли участие 44 больных
Настоящая работа посвящена исследованию возможности повышения эффективности комплексной терапии трофических язв и послеоперационных ран нижних конечностей с помощью топического иммуномодулятора.
В исследовании приняли участие 44 больных от 30 до 81 года (30 женщин, 14 мужчин) с хроническими трофическими язвами нижних конечностей. Трофические язвы развились из-за нарушения кровообращения в нижних конечностях по причине тромбофлебита или диабетической ангиопатии. У большинства больных тромбофлебит возник как осложнение варикозной болезни. Диагноз «варикозная болезнь, посттромбофлебитический синдром (ПТФС)» был постановлен 41 больному. На момент исследования признаки острого тромбофлебита на фоне ПТФС имелись у 9 человек, признаки рожистого воспаления кожи — у 5 человек. У 1 больного трофическая язва сочеталась с остеомиелитом большой берцовой кости, у двоих — с начинающейся гангреной пальцев ноги. В анамнезе трое больных перенесли флебэктомию, 1 больная — склерозирующую терапию по поводу варикозного расширения вен.
У подавляющего большинства исследованных больных имелась 1 трофическая язва и лишь у двоих больных были 2 язвы. В большинстве случаев язвы располагались на передней, внутренней или внешней поверхности голени, у 2 больных диабетической ангиопатией язвенный процесс локализовался на стопе. Размеры трофических язв варьировали от 0,5х0,5 см до 3х4,5 см. Кратер язвы был заполнен фибринозными массами у 30 больных, фибринозно-гнойными — у 6 больных, гнойно-некротическими фрагментами ткани — у 5 пациентов. В трех случаях на момент поступления больного язва выглядела чистой, без фибринозных, гнойных или некротических масс.
У 5 больных некротически-буллезной формой рожи на коже голени были признаки острого воспаления, пузыри с серозно-гнойным содержимым. У 2 других больных отмечались признаки начинающейся гангрены: соответственно I и III пальцы правой стопы были синюшно-черного цвета.
Лечение
При лечении всех 44 больных соблюдались следующие принципы лечения:
- постельный режим с приподнятым положением больной конечности для устранения застоя крови и лимфы;
- тщательный туалет кожи вокруг язвы;
- создание тока тканевой жидкости из язвы в повязку в начале лечения. Для этой цели использовали повязки с гипертоническим раствором NaCl в сочетании со спиртовым раствором хлорофиллипта, что обеспечивало очищение язвы, улучшение питания живых тканей дна и стенок язвы;
- активация регенеративных способностей организма после очищения кратера язвы.
Все больные ПТФС получали общее и местное лечение. Общими составляющими лечения были инфузионная (реополиглюкин 200 мл + трентал 5 мл + аскорбиновая кислота 5 мл в/в капельно, через день № 5), эскузан по 15 капель 3 раза в сутки, аспирин 0,5 г — 1 раз в сутки, троксевазин по 2 капсулы 3 раза в сутки в течение 15 дней или диовенор 600 мг по 1 табл. 1 раз в сутки в течение 30 дней. В дополнение к вышеописанному лечению пациенты с признаками острого тромбофлебита получали инъекции раствора гепарина 5000 ЕД п/к 4 раза в сутки в течение 6 дней.
Местное лечение в первые дни (от 1 до 4 дней) — хлорофиллипт спиртовой в сочетании с гипертоническим раствором, перевязки делались каждый день. После очищения язвы накладывались повязки с мазью гепона или солкосерил (контрольная группа, 10 человек). Как отмечалось выше, у 3 больных язва не содержала фибринозных, гнойных или некротических элементов. У этих больных сразу начинали лечение мазью гепона — иммуномодулятора, обладающего способностью повышать эффективность иммунной защиты, а также прямым противовирусным действием.
Мазь изготавливалась непосредственно в аптеке ГКБ №1 и имела следующий состав: гепона 0,006; ланолина 10,0; масла оливкового 10,0; воды для инъекций 10,0. Готовую мазь хранили при +4°С, использовали в течение 10 дней.
Мазь наносили тонким слоем на поверхность трофической язвы, повязки с мазью гепона меняли через день. Лечение проводилось в течение 10 дней (5 перевязок).
Лечение неосложненных трофических язв
В контрольной группе 10 больных получали такую же общую терапию, но местное лечение после очищения язвы проводили мазью солкосерил. Заживление язв у больных этой группы происходило на 5–15 дней дольше, чем при применении мази гепона. У 1 больной контрольной группы в ходе лечения мазью солкосерил произошло ухудшение, развилось рожистое воспаление кожи (некротически-буллезная форма). Этой пациентке было назначено адекватное хирургическое лечение, в дополнение к общему лечению применялись антибиотик и бисептол, для местного лечения вместо солкосерила использовалась мазь гепона.
Лечение язвенных дефектов кожи после некрэктомии по поводу некротически-буллезной формы рожи
Больные с некротически-буллезной формой рожи в дополнение к инфузионной терапии получали инъекции цефазолина по 1 г в/м 3 раза в сутки в течение 7 дней, а также бисептол 480 мг по 1 табл. 3 раза в сутки в течение 10 дней. На фоне консервативного лечения проводили оперативное вмешательство — некрэктомию. Пузыри вскрывались, некротизированные ткани удалялись, открытая рана обрабатывалась раствором перманганата калия. Далее открывшиеся после некрэктомии большие дефекты кожи лечили гепоном, как трофические язвы. У всех больных отмечались хорошие результаты лечения. Через 3–4 дня после начала применения мази гепона наблюдался выраженный рост грануляционной ткани с последующим формированием соединительнотканного рубца в кратчайшие сроки.
Лечение послеоперационных ран нижних конечностей у больных диабетической ангиопатией
При лечении больных диабетической ангиопатией консервативное лечение дополняли адекватными дозами инсулина (п/к). В качестве антибиотика использовали линкомицин по 600 мг в/м 2 раза в сутки в течение 14 дней. При начинающейся гангрене пальца на фоне консервативного лечения проводили адекватное оперативное вмешательство — ампутацию или ограниченное иссечение некротизированных элементов. В послеоперационном периоде промывали рану и свищевые ходы раствором гепона (0,002 г в 10 мл физиологического раствора), а также накладывали повязки с мазью гепона, как описано выше. Результаты лечения свидетельствуют о значительной активации роста грануляционной ткани и ускоренном заживлении послеоперационной раны под влиянием гепона.
Очевидно, что применение гепона в описанных выше клинических случаях стимулировало активный рост грануляционной ткани. Обычно у больных диабетической ангиопатией проходимость капиллярного русла оказывается минимальной, во время хирургических манипуляций кровь выделяется, как правило, только из подкожных сосудов, внутренние ткани практически обескровлены, имеют бледно-розовый цвет. Рост грануляционной ткани у таких больных либо не отмечается вовсе, либо протекает очень вяло, послеоперационные раны хронически не заживают, остаются трофические язвы. Применение гепона позволило добиться ускоренного заживления послеоперационных ран и незаживающих язв у больных диабетической ангиопатией.
Литература
Клинический пример
Больная О. Л. О., 52 года (ИБ № 5039).
Диагноз при поступлении: варикозная болезнь, посттромбофлебитический синдром, трофическая язва правой голени.
Диагноз окончательный: варикозная болезнь, посттромбофлебитический синдром, трофическая язва правой голени. Рожистое воспаление правой голени (некротически-буллезная форма).
Жалобы при поступлении: боли в области правой голени, усиливающиеся при ходьбе, наличие трофической язвы на передней поверхности нижней трети правой голени.
Anamnesis morbi: считает себя больной в течение 20 лет, когда впервые появились варикозные расширения вен правой голени. Неоднократно лечилась по поводу данного заболевания у ангиохирурга по месту жительства, от оперативного лечения отказывалась. Трофическая язва появилась около месяца назад, попытки самостоятельно лечиться облегчения не принесли, обратилась в хирургическое отделение 1-й ГКБ.
Anamnesis vitae: детских болезней не помнит, болезнь Боткина, туберкулез, наличие венерических заболеваний у себя и ближайших родственников отрицает. Аллергологический анамнез не отягощен.
Status praesens objectivus: общее состояние больной удовлетворительное, сознание ясное, положение в постели активное. Больная повышенного питания, костно-мышечная система без патологии. Кожа и видимые слизистые обычной окраски. Региональные лимфатические узлы не увеличены, подвижны, безболезненны. В легких дыхание везикулярное, ЧДД 16 в 1 мин. Тоны сердца ритмичные, пульс 68 уд. в 1 мин, АД 130/80 мм рт. ст. Язык влажный, розовый, живот мягкий, безболезненный, печень — по краю реберной дуги, селезенка не пальпируется, симптом «поколачивания» отрицателен с обеих сторон. Физиологические отправления в норме.
Locus morbi: правая нижняя конечность отечна, голень синюшного цвета, болезненна при пальпации. На передней поверхности нижней трети голени трофическая язва 2х2 см, края гиперемированы, в кратере фибринозное отделяемое.
Анализы: кровь на RW — отрицательная; биохимический анализ крови — белок 54 г/л, креатинин 76 мкмоль/л, мочевина 5,5 ммоль/л, остаточный азот 25 ммоль/л, диастаза 20 г/(ч/л), билирубин 16 — 4 — 12 мкмоль/л, глюкоза 3,2 ммоль/л; коагулограмма — протромбин 85%, фибриноген 3,2 мкмоль/л, время рекальцификации 90 с; общий анализ крови: Э — 5,5 млрд./мл, Л — 6,4 млн./мл, Hb — 115 г/л, цветной показатель — 0,92, СОЭ — 25 мм/ч; общий анализ мочи — норма.
Лечение: раствор гепарина по 5000 ЕД п/к каждые 6 ч, аспирин 0,25 г по 1 табл. 1 раз в день; местно трофическую язву обрабатывали спиртовым раствором хлорофиллипта, поверхность язвы 2 раза в день смазывали мазью троксевазин, на ночь — мазью солкосерил. Через 5 дней лечения общее состояние пациентки значительно ухудшилось, температура тела повысилась до 39,5°С. Кожные покровы правой нижней конечности резко гиперемированы, гипертрофированы, болезненны. Установлен диагноз: рожистое воспаление правой нижней конечности.
Коррекция лечения: цефазолин по 1 г 2 раза в сутки, бисептол 480 мг по 1 табл. 3 раза в сутки. Через двое суток в области пораженной конечности появились пузыри с серозной жидкостью, под которыми впоследствии образовались участки некроза дермы (некротически-буллезная форма рожи).
Ввиду отсутствия положительного эффекта от предшествующей терапии, у больной проведено лечение с применением гепона.
Местно — произведено рассечение пузырей, удаление некротических элементов тканей. Были назначены ванны с перманганатом калия, инфузионная терапия (реополиглюкин 200 мл + трентал 5 мл + аскорбиновая кислота 5 мл в/в капельно, через день № 5), эскузан по 15 капель 3 раза в сутки, аспирин 0,5 г — по 1 табл. 1 раз в сутки, троксевазин по 2 капсулы 3 раза в сутки в течение 15 дней или диовенор 600 мг по 1 табл. 1 раз в сутки в течение 30 дней.
Locus morbi на момент начала терапии гепоном: по передней поверхности правой голени 3 язвенных дефекта кожи 10х10 см, раны заполнены фиброзно-гнойным отделяемым. После санации раневой поверхности раствором риванола применялись повязки с гепоном. Смена повязок проводилась через день. Уже после второй перевязки появился значительный рост грануляционной ткани, к концу лечения (всего 5 перевязок в течение 10 дней) раны очистились. Проведена операция аутодермопластики марочным способом (15 марок). Гепон в виде мази продолжали применять на всей послеоперационной поверхности. На фоне применения гепона «прижились» все 15 марок, в кратчайшие сроки сформировался рубец.
Клинический пример
Больная К. Л. Н. , 78 лет (ИБ № 6784).
Диагноз при поступлении: облитерирующий атеросклероз сосудов нижних конечностей. Сахарный диабет.
Диагноз окончательный: сахарный диабет III степени. Диабетическая ангиопатия нижних конечностей. Начинающаяся гангрена III пальца (ногтевая фаланга) правой стопы.
Жалобы при поступлении на постоянные боли в нижних конечностях, особенно в области III пальца правой стопы, общую слабость, недомогание.
Anamnesis morbi: считает себя больной около 20 лет, когда впервые был обнаружен сахарный диабет. Неоднократно лечилась в эндокринологическом и хирургическом стационарах. Последнее обострение началось 3 недели назад, когда появились перечисленные выше жалобы. Попытки самостоятельного лечения оказались безрезультатными, обратилась в хирургическое отделение 1-й ГКБ.
Anamnesis vitae: аппендэктомия в 1950 году. Болезнь Боткина, туберкулез, венерические заболевания у себя и ближайших родственников отрицает. Аллергологический анамнез не отягощен. Отмечает длительно протекающие гнойные процессы при любых незначительных травмах.
Status praesens objectivus: общее состояние средней тяжести, сознание ясное, положение в постели активное. Больная обычного питания, костно-мышечная система без патологии. Региональные лимфатические узлы не увеличены, подвижны, безболезненны. В легких — везикулярное дыхание, ЧДД 16 в 1 мин. Тоны сердца ритмичны, слегка приглушены, Ps 68 уд. в 1 мин, АД 130/90 мм рт. ст. Язык слегка суховат, живот правильной формы, участвует в акте дыхания, при пальпации безболезненный. Симптомы раздражения брюшины отрицательны. Печень по краю реберной дуги, селезенка не пальпируется. Симптом «поколачивания» отрицателен с обеих сторон. Физиологические отправления в норме.
Locus morbi: кожные покровы обеих нижних конечностей бледные, сухие. На стопах кожа прохладная на ощупь. Кожа III пальца правой стопы в области ногтевой фаланги синюшно-черного цвета. Движения в пальце сохранены.
Анализы: RW — отрицательная. Общий анализ крови: Э — 4,2 млрд./мл, Л — 9,2 млн./мл, Hb — 105 г/л, цветной показатель — 0,95, СОЭ — 17 мм/ч. Биохимия крови: глюкоза (при поступлении) 18,5 ммоль/л, глюкоза (после коррекции) 5,4 ммоль/л; билирубин 20,3–5,8–14,5 мкмоль/л, АЛТ — 0,43 ммоль/(ч/л), АСТ — 0,3 ммоль/(ч/л). Общий анализ мочи — норма. Коагулограмма: протромбиновый индекс 90%, фибриноген 8,8 мкмоль/л, время рекальцификации 100 с.
Лечение: инъекции инсулина (п/к) 28 ЕД утром, 16 ЕД вечером, раствора линкомицина 600 мг в/м 3 раза в сутки в течение 14 дней. Инфузионная терапия (реополиглюкин 200 мл + трентал 5 мл + актовегин 5 мл в/в капельно, через день № 5).
Местно — в III палец правой стопы под жгутом ввели линкомицин. Ночью после инъекции в области III пальца появились «дергающие» боли. Утром в области некроза кожи произведен овальный разрез длиной около 2,5 см, иссечены некротические элементы в области лизированного участка ногтевой фаланги, удалены секвестры, поставлен резиновый выпускник, наложена асептическая повязка. Со следующего дня начали накладывать повязки с мазью гепона, перевязки проводили через день №5. Во время перевязок удалялись некротические элементы до «живой» ткани. Ампутации пальца удалось избежать. Последующее лечение прошло успешно по типу лечения костного панариция. Отмечались быстрое очищение раны, энергичный рост грануляционной ткани и формирование рубца из соединительной ткани.
Клинический пример
Больная Б. Л. А., 65 лет (ИБ № 4571).
Диагноз при поступлении: диабетическая ангиопатия сосудов нижних конечностей, начинающаяся гангрена I пальца правой стопы.
Диагноз окончательный: сахарный диабет II типа средней тяжести в стадии декомпенсации. Диабетическая ангиопатия нижних конечностей. Начинающаяся гангрена I пальца правой стопы. Диабетическая нефропатия I степени.
Жалобы при поступлении: постоянные боли в области правой стопы, черный цвет кожных покровов I пальца правой стопы, общая слабость и недомогание.
Anamnesis morbi: считает себя больной около 20 лет, когда впервые был выявлен сахарный диабет. Неоднократно лечилась в эндокринологическом отделении. Перечисленные выше жалобы появились около 2 недель назад. Пыталась лечиться самостоятельно — без результата. Обратилась за помощью в хирургическое отделение 1-й ГКБ.
Anamnesis vitae: детских болезней не помнит. Болезнь Боткина, туберкулез, венерические заболевания у себя и ближайших родственников отрицает. Аллергологический анамнез не отягощен. Периодически отмечает боли в области сердца, повышения АД.
Status praesens objectivus: общее состояние удовлетворительное, сознание ясное, положение в постели активное. Больная повышенного питания. Кожные покровы бледные, костно-мышечная система без патологии. Региональные лимфатические узлы не увеличены, подвижны, безболезненны. В легких — везикулярное дыхание, ЧДД 16 в 1 мин. Тоны сердца приглушены, ритмичны, Ps 82 удара в 1 мин, АД 140/80 мм рт. ст. Живот мягкий, при пальпации безболезненный. Печень по краю реберной дуги, селезенка не пальпируется. Симптом «поколачивания» с обеих сторон отрицателен. Физиологические отправления в норме.
Locus morbi: обе голени и стопы прохладные на ощупь. Пульсация на A.dorsalis pedis значительно ослаблена. I палец правой стопы в области ногтевой и средней фаланг синюшно-черного цвета, движения в пальце сохранены.
Анализы: RW — отрицательная; Э — 3,2 млрд./мл, Л — 13,5 млн./мл; Hb — 104 г/л, цветной показатель — 0,97; СОЭ — 56 мм/ч; протромбин — 100%, фибриноген 4,8 мкмоль/л, время рекальцификации 90 с: глюкоза крови 12,5 ммоль/л; общий анализ мочи — Л на все поле зрения.
Реовазография — общий кровоток правой голени снижен, левой голени достаточный. Тонус сосудов повышен. Затруднен венозный отток, больше справа.
Лечение: операция — ампутация I пальца правой стопы с головкой I плюсневой кости.
Режим II, диета 9. Инъекции инсулина (п/к) 26 ЕД утром, 16 ЕД вечером. Инъекции раствора линкомицина 600 мг в/м 3 раза в сутки в течение 14 дней. Местно — перевязки со спиртовым раствором хлорофиллипта, затем мазью левомиколь.
Locus morbi на момент начала лечения гепоном: послеоперационная рана в области I пальца правой стопы до 3 см в диаметре, имеется свищевой ход к культе плюсневой кости с гнойным отделяемым. Лечение препаратом гепон включало промывания свищевого хода и послеоперационной раны раствором гепона (0,002 г в 10 мл физиологического раствора). Процедуры с использованием гепона повторяли через день, всего 5 процедур в течение 10 дней. На 6-й день лечения гепоном из свищевого хода был извлечен секвестр. На 10-е сутки рана очистилась и уменьшилась в диаметре до 1,5 см. Края раны сцеплены лейкопластырем по типу наводящих швов. Продолжено лечение мазью гепона. К 14-му дню появилась грануляционная ткань, но из свищевого хода продолжали выделяться секвестры культи плюсневой кости. К 30-му дню рана зажила вторичным натяжением.
Хроническая рана – длительно заживающее или сложное повреждение мягких тканей, часто сопровождающееся заражением. Обычно, во время восстановления, пациент испытывает боль, дискомфорт, психологический стресс.
Если рана не заживает за 8 недель, тогда она считается хронической
Основные виды хронических ран
- Синдром диабетической стопы (СДС) – совокупность анатомо-функциональных изменений, развивающихся на фоне сахарного диабета, увеличивающих риск получения травмы и инфицирования мягких тканей стопы. По данным всемирной организации здравоохранения, риск развития СДС у диабетиков со «стажем» 5-10 лет составляет около 15%. У диабетиков со «стажем» более 15 лет он возрастает до 90%.
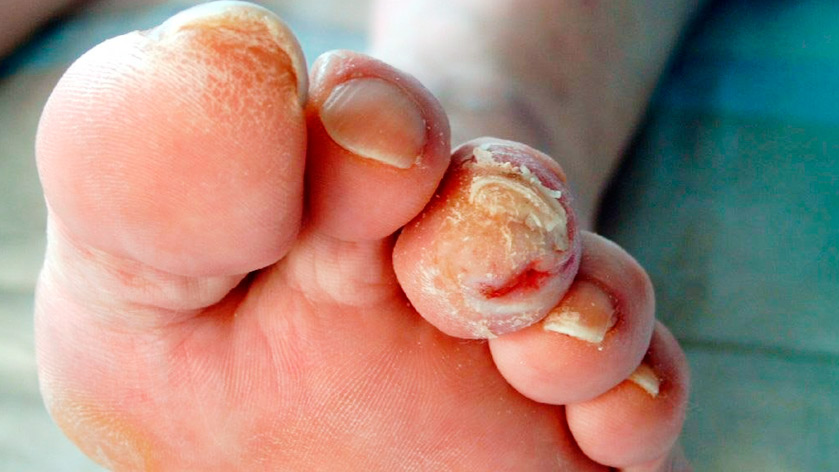
- Профилактика: защита ступней от травм, комплексный уход за ногами и ногтями, ношение обуви для диабетиков.
- Трофические язвы – осложнения при венозной недостаточности, вызванной изменениями из-за тромбофлебита или варикоза глубоких вен. Плохое кровообращение и кровоснабжение ног приводит к венозному застою, а он – к образованию плохо заживающих язв на лодыжках или голенях.
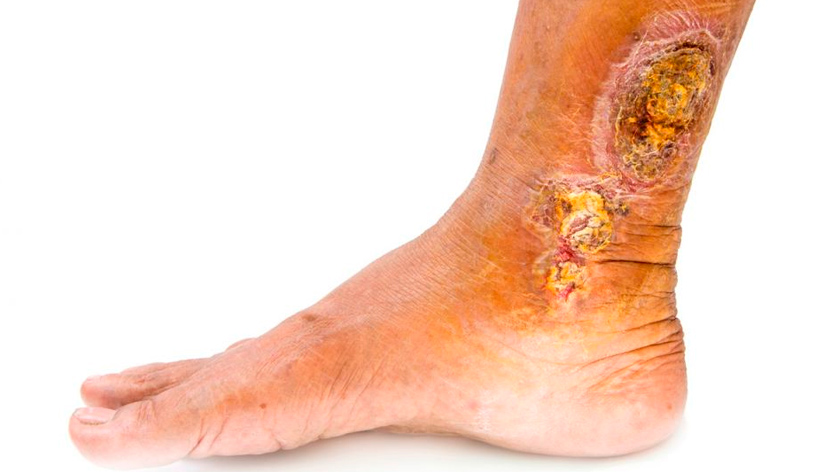
- Симптомы – отеки, нарушение пигментации кожи (покраснение или бледность), экзема, ощущение, что ноги распирает от давления (чаще к вечеру).
- Профилактика: своевременное лечение основного заболевания, ношения эластичных колготок, обработка кожи антисептическими и заживляющими средствами.
Пролежни – некроз (омертвение) тканей из-за давления и нарушения местного кровообращения. Часто образуются у пациентов с ограниченной подвижностью или полностью парализованных. Способствуют пролежням курение, избыточный или недостаточный вес, расстройства нервной и иммунной систем, недостаток гигиены. Первый тревожный признак – покраснение кожи.
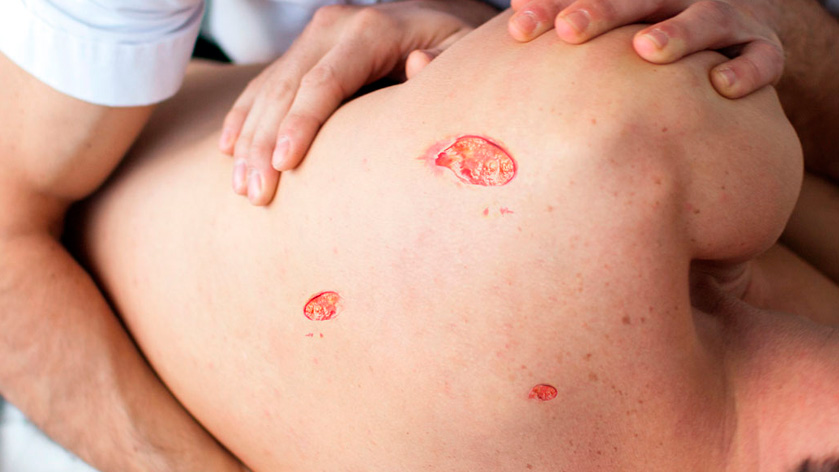
Профилактика: регулярная смена положения тела, обязательное использование противопролежневого матраса, использование специализированных средств ухода за кожей, сбалансированное питание.
Как вылечить хроническую рану?
Но что делать, если профилактика не помогла? Лечение долго незаживающих ран зависит от их вида, состояния больного и основного заболевания. Главное выявить первопричину образовавшихся патологий, чтобы предотвратить ухудшение состояния.
Лечение синдрома диабетической стопы:
- Прием назначенных врачом антибиотиков против инфекции, обработка и очищение ран самим доктором.
- Отказ от вредных привычек и снижение нагрузки на стопу.
- Подбор обуви и носков по рекомендации врача, их регулярная смена.
- Продолжение терапии дома: очищение раны, отслеживание выделений и защита от попаданий в нее инфекции.
Лечение трофических язв:
- Консервативная терапия – прием препаратов для устранения симптомов трофического поражения: антибиотики, флеботоники, антиагреганты, а также мази для обработки кожи (Солкосерил, Актовериг, Токоферол).
- Обработка пострадавших тканей мазью, содержащей антисептик, обезболивающий препарат или ферменты, ускоряющие заживление (Левомеколь, Левосин, Куриозин). Используются с компрессами.
- Хирургия – после заживания язв, врач восстанавливает кровоток посредством шунтирования и флебэктомии.
Лечение пролежней:
- Восстановление кровообращения с использованием антипролежневых кругов, противопролежневых матрасов, подушек.
- Очищение поврежденного участка от некротизированных тканей. При необходимости врач назначает антибиотики, чтобы предотвратить инфицирование. Также возможно хирургическое удаление некротических масс.
- Процедуры для заживления пролежня – регулярные перевязки с применением ранозаживляющих препаратов.
Средства и повязки для лечения хронических ран
Курс терапии подбирает лечащий врач, не стоит заниматься самолечением – это может привести к ухудшению ситуации.
Гели и растворы для промывания и очищения
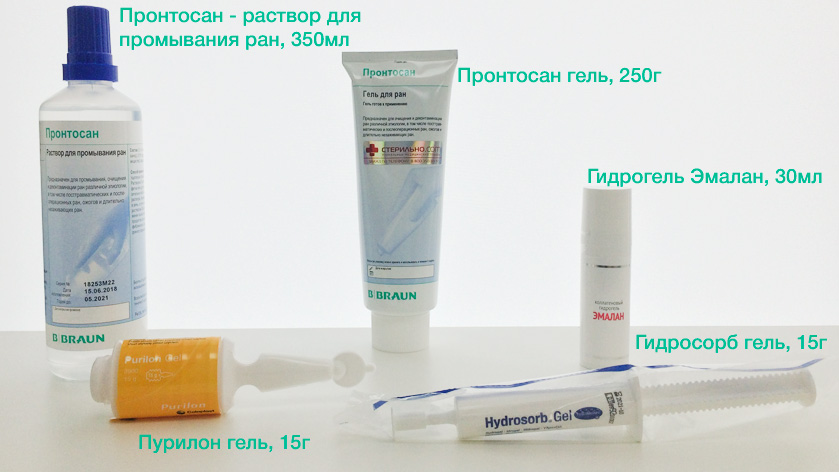
- Гели заполняют подкожные карманы и полости, оказывая противомикробное действие (Пронтосан гель), очищают от некротических масс (Аскина гель, Гидросорб гель), формируют оптимальную среду для заживления (Пурилон гель), работают как противовоспалительное антимикробное средство (коллагеновый гидрогель Эмалан). подойдет для профилактики инфекций, очищения и увлажнения раны, поможет в регенерации тканей, подавлении патогенной микрофлоры.
Гель для ран Пронтосан
Prontosan Wound Gel - для обработки и увлажнения контаминированных ран любого генеза
Тампонада и альгинатные повязки
- Специальная серия повязок, которые применяются во время лечения глубоких или инфицированных ран. Они создают оптимальную ранозаживляющую среду, ускоряющую процесс восстановления поврежденных тканей. К альгинатным повязкам относятся линейки Биатен Альгинат, Сорбалгон, Аскина сорб или Альгипор-М. К тампонадам – Гидроклин плюс кавити, ПемаФом кавити, Аскина Фоам кавити.
К особенностям альгинатных повязок относится их свойство превращаться в гель при взаимодействии с раневым экссудатом, который равномерно заполняет всю полость раны. Таким образом, в ней размножаются раневые клетки, останавливается развитие бактерий, начинается активный процесс заживления.
Повязки на рану
-
Есть много разных видов повязок, которые очень эффективны при лечении долго незаживающих ран, например:
-
– содержат высокую концентрацию активного вещества (Бранолинд Н с перуанским бальзамом, Гидротюль). – интерактивная терапии во влажной среде. С их помощью восстановление проходит вдвое быстрее (Гидроколл, Комфил плюс, Аскина Гидро). – обеспечивают оптимальную влажную среду в ране. Абсорбируют экссудат, стимулируют эпителизацию (Гидротак Транспарент, Гелиос). – эффективное лечение ран любой сложности (Протеокст-ТМ, Гидроклин плюс, Аскина Фоам, Аскина Калгитроль АГ) – применяются на сухих неинфицированных или уже заживающих ранах (Гидрофильм, Аскина дерм)
Повязки делятся на самоклеящиеся и несамоклеящиеся. Если в первом варианте, кроме раневого покрытия ничего больше ненужно, то во втором вам понадобятся фиксирующие материалы:
Пациентам с сахарным диабетом подойдут только неадгезивные повязки, которые нужно дополнительно фиксировать.
Трофические язвы – это тяжело заживающие раны, образующиеся на нижних конечностях в области голени или стопы. Причиной их появления зачастую выступает нарушение кровообращения в тканях. В 90% язвы на ногах возникают именно из-за сбоев в работе венозных клапанов. Чаще всего от этого осложнения, вызванного венозной (80% случаев) или артериальной (20% случаев) недостаточностью, страдают пациенты в возрасте 60 лет и старше.
В России проживает 35 миллионов человек с венозной недостаточностью, из которых у 5 миллионов впоследствии развиваются трофические язвы.
Причины развития трофических язв
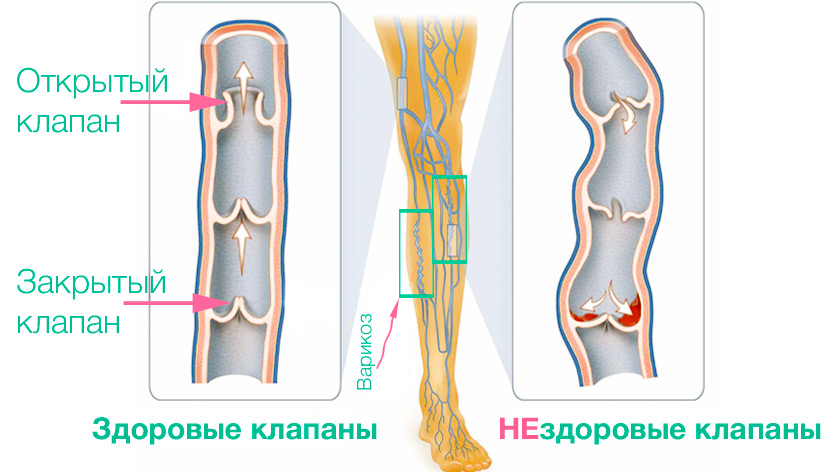
В норме кровь из нижних конечностей гонится по направлению к сердцу с помощью мышечной помпы. Венозные клапаны на этом пути препятствуют обратному кровотоку. Если клапан смыкается не полностью, тогда происходит рефлюкс крови в полость вены, которая начинает увеличиваться, образуя застой, что впоследствии приводит к образованию язвы.
Факторы, повышающие риск появления венозных трофических язв:
- варикоз, флебит, тромбоз глубоких вен,
- травмы или операции,
- наследственность,
- венозная недостаточность.
Определить наличие такого типа недостаточности можно по боли, тяжести, зуду и отеку ноги, пигментации, разрушению и экземе кожи.
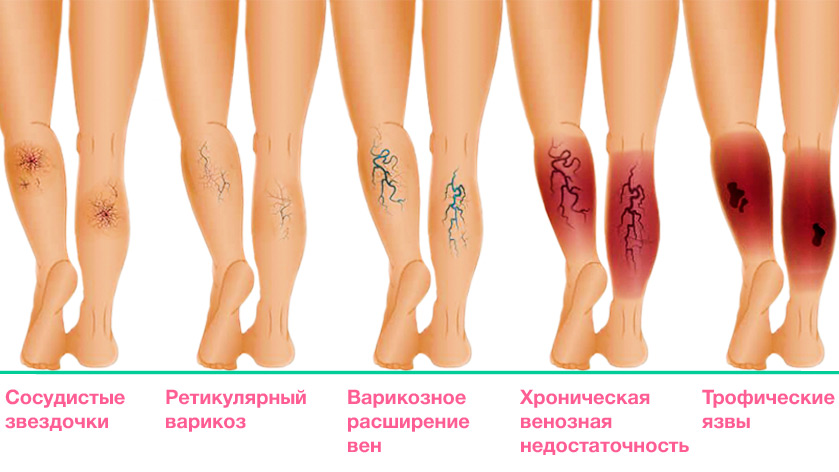
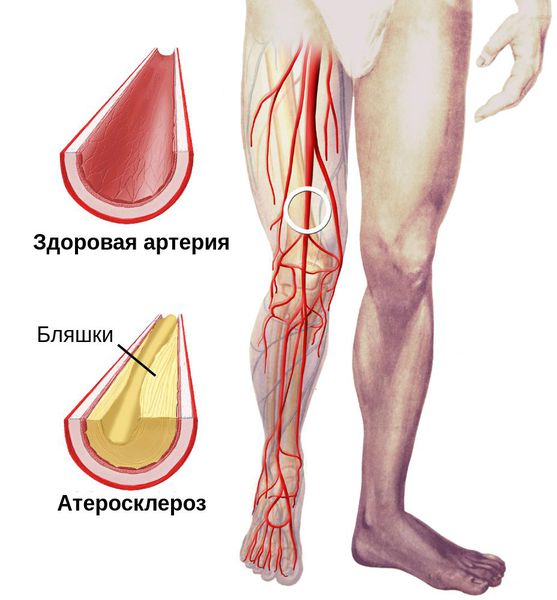
Факторы риска для развития артериальных язв:
- артериосклероз сосудистой стенки – образование бляшки, сужающей просвет сосуда,
- ишемия сердца, инсульт, сахарный диабет,
- ожирение,
- малоподвижный образ жизни.
Артериосклероз внешне проявляется в истончении кожи на ногах, потере волос, а ногти становятся толще. Из-за атрофии мышц и подкожной жировой клетчатки ноги бледные и прохладные, болят при нагрузке.
Чем опасно такое осложнение?
Если пациент игнорирует трофические язвы на ногах и их лечение, тогда ему предстоит столкнуться с рядом негативных последствий:
- сильная боль,
- развитие дерматита вокруг пораженного участка кожи,
- инфицирование раны,
- перетекание заболевания в хроническую стадию, что грозит более частыми рецидивами и более длительной терапией, которая длится от полугода.
Лечение трофических язв нижних конечностей включает 2 аспекта: работу врача и уход пациента за ногами. Как правило, доктор прибегает к консервативному способу лечения, который в каждом случае индивидуальный:
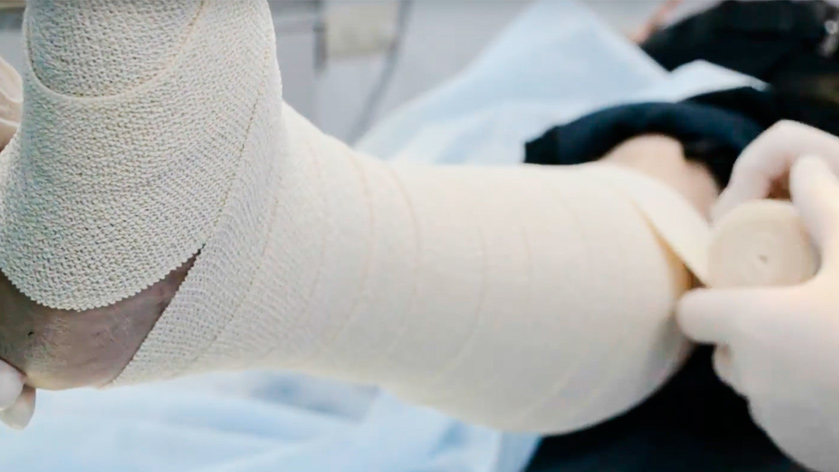
- компрессионная терапия – для возвращения к норме венозного кровотока, что приводит к закрытию язв даже без хирургии:
-
из воздухопроницаемых бинтов и бинтов с окисью цинка,
- специальные компрессионные гольфы,
- промывание и накладывание повязок (сорбционных, интерактивных и т.д.),
- подбор препаратов против воспаления, инфекций, для ускорения заживления тканей.
Домашнее лечение трофических язв, помимо выполнения всех указаний врача, подразумевает:
Что такое сухая гангрена? Причины возникновения, диагностику и методы лечения разберем в статье доктора Манасяна К.В., сосудистого хирурга со стажем в 10 лет.
Над статьей доктора Манасяна К.В. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Гангрена — это некроз (омертвление) тканей живого организма, связанных с внешней средой, например, кожи, лёгких, кишечника и других. С древнегреческого данный термин переводится как "разъедающая язва".
Сухая гангрена — это опасное заболевание, требующее незамедлительного лечения. При этой патологии отмирание ткани происходит без выраженного инфекционного и воспалительного процесса. Иначе такой характер течения заболевания называют мумификацией, т. е. отсыханием органа.
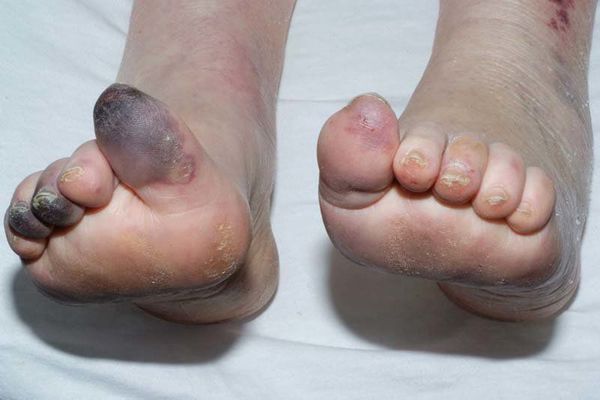
Механизмы возникновения гангрены бывают двух типов:
- прямыми (травматическими и токсическими) — появляются по причине непосредственного повреждения, иногда даже незначительного;
- непрямыми (ишемическими, аллергическими, трофоневрологическими) — происходит опосредованное отмирание тканей через анатомические каналы, в частности, при поражении сосудистой системы.
Исходя из этого факторы риска развития сухой гангрены можно также разделить на две группы:
- Внешние (экзогенные):
- переохлаждение (обмоорожение);
- химический ожог;
- удар током высокого напряжения.
- Внутренние (эндогенные): артерий нижних конечностей; ;
- курение;
- воспалительные заболевания артерий (васкулиты, в частности тромбангиит). [4][5][6]
Зачастую гангрена возникает при совокупности факторов, например, в результате механического повреждения кожи пациента с сахарным диабетом. По статистике, доля людей с мумификацией, развившейся на фоне подобных факторов и приведшей к ампутации конечности, составляет 4,2-6,4 на одну тысячу человек в год. В связи с этим люди с диабетической стопой относятся к группе риска развития гангрены. [10]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сухой гангрены
К симптомам сухой гангрены относятся:
- потемнение кожного покрова (вначале кожа бледнеет, приобретает синюшный оттенок, затем постепенно становится чёрной);
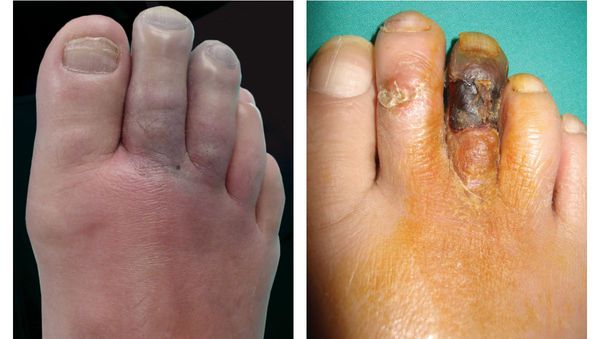
- уменьшение кожи в объёме, её высыхание, сморщивание и уплотнение;
- отслаивание эпидермального слоя кожи;
- снижение температуры конечности (зависимость от температуры окружающей среды);
- снижение чувствительности поражённых тканей (онемение);
- наличие специфического запаха отмирающего участка (хоть и не столь сильного);
- ощущение боли (простреливающие, жгучие и ноющие болевые ощущения, которые могут носить постоянный характер, а также усиливаться при минимальной нагрузке);
- покалывание, жжение или зуд в области поражения;
- нарушение функционирования конечности.
Болевой синдром отражает то, насколько сильно страдают окружающие ткани: чем сильнее боль в зоне некроза, тем больше в этой области живых клеток. Ослабление болезненных ощущений или их исчезновение указывает на прогрессирование заболевания, так как чувствительность отмирающей ткани пропадает в результате гибели нервных окончаний. В это время анатомические области, граничащие с сухой гангреной, остро нуждаются в артериальном кровотоке, которого им не хватает. В итоге в этих тканях вырабатываются продукты метаболизма и болевые импульсы.
Сухая гангрена начинается с появления небольшого очага на конечности (как правило, расположенного на пальце). Далее она распространяется на прилегающие пальцы, подошвенную и тыльную поверхность стопы, захватывая всё больше тканей конечности.
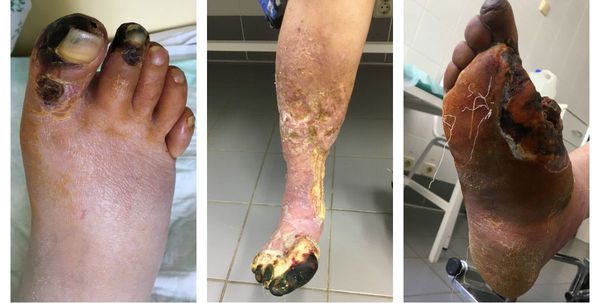
Изменения цвета отмирающих участков кожи связано с накоплением в них гемоглобина и выделением эритроцитарного железа, которое в результате соединения с сероводородом воздуха превращается в сульфид железа.
Зона, которая находится на границе гангрены и здоровой ткани называется демаркацией. Обычно она не оформлена. В исключительно редких случаях при естественном течении болезни она может самостоятельно ограничиться, что приведёт к самоампутации отмирающей конечности. [3] [5] [6]
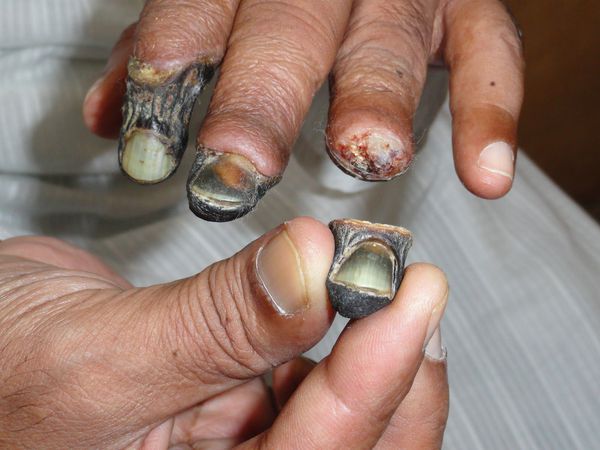
К первым признакам сухой гангрены относятся следующие состояния:
- замерзание конечности даже в тепле;
- боль в ногах и утомляемость после длительной ходьбы;
- наличие долго не заживающих ран и язв на коже конечности.
ВАЖНО: Возникновение одного из этих проявлений при наличии таких предрасполагающих факторов, как сахарный диабет или атеросклероз, — веский повод для скорейшего обращения к врачу-флебологу или хирургу. Промедление как минимум может обернуться для пациента утратой конечности.
Патогенез сухой гангрены
Процесс возникновения и развития сухой гангрены конечностей можно условно разделить на семь этапов:
При естественном течении сухой гангрены признаков инфекции не наблюдается (в отличие от влажной гангрены), однако в омертвевших тканях не исключено наличие возбудителей условно-патогенной инфекции. При этом в зонах некроза не происходит бурного развития инфекции.
Процесс развития сухой гангрены ног и рук может длится от нескольких дней до нескольких месяцев в зависимости от уровня поражения артерий и компенсаторных механизмов саморегуляции. [3] [4] [5] [6] Если некроз уже развился, то заживление без удаления некоторой части конечности невозможно.
Классификация и стадии развития сухой гангрены
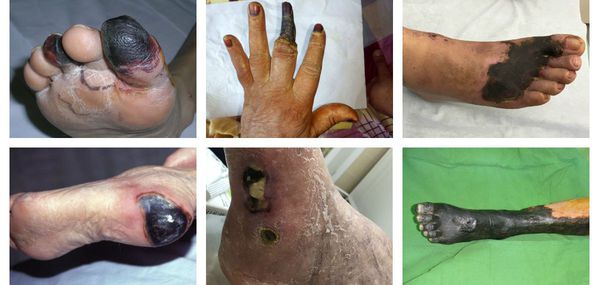
В зависимости от распространения некроза на конечности можно выделить следующие виды заболевания:
- гангрена пальцев;
- гангрена дистального сегмента стопы (кисти);
- гангрена пяточной области;
- тотальная гангрена стопы (кисти) или голени (предплечья);
- гангрена бедра (встречается крайне редко, так как пациенты просто не доживают до столь массивного гангренозного поражения). [3][5][6]
По механизму развития различают два вида гангрены:
- Первичная гангрена — это некроз, развившийся в результате ишемии тканей. Иначе говоря, она связана с нарушением проходимости артериального сосуда, кровоснабжающего определённый участок организма.
- Вторичная гангрена — это некроз тканей, возникающий в результате острого гнойного воспаления клетчаточных пространств и фасциальных футляров. Чаще всего развивается при флегмоне стопы, затрагивая пальцы, а также при или глубоком абсцессе на фоне нейроптической формы синдрома сахарного диабета.
По распространённости выделяют три степени гангрены:
- поверхностную — поражается лишь дерма;
- глубокую — проникает в сухожилия, полости суставов, фасции и кости;
- тотальную — затрагивает все отделы органа или конечности.
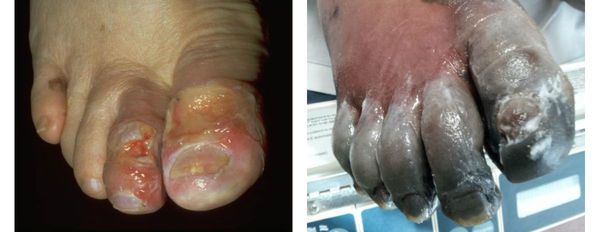
Помимо сухой гангрены существует ещё влажная и газовая.
Влажная гангрена протекает с преобладанием инфекционного компонента, т. е. гнилостного расплавления. В процесс вовлекаются все без исключения ткани — кожа, подкожно-жировая клетчатка, фасции, связки, мышцы, сухожилия и кости. Кожные покровы местами приобретают багрово-синюшный, чёрный или серо-зелёный цвет. Характерно появление эпидермальный пузырей, наполненных вначале бурым, а затем зеленоватым содержимым с выраженным неприятным гнилостным запахом.
В отличие от сухой гангрены при влажной ткани не уплотняются, а распадаются, становятся рыхлыми и разжижаются. Отёк и гиперемия кожи быстро распространяются. Кожа голени может быть напряжена, лосниться. Без активного лечения демаркационная линия не появляется, так как процесс стремится к генерализации.
Газовая гангрена отличается возникновением вокруг очага некроза лёгкой крепитации газа под кожей, т. е. ощущением хруста, которое появляется из-за лопающихся пузырьков газа в тканях. Крепитация не слышна, но осязается пальцами как "скрип" крахмала или снега под ногами. Объективно газ в мягких тканях может быть обнаружен при рентгенографии конечности на достаточно "мягких" снимках. [11]
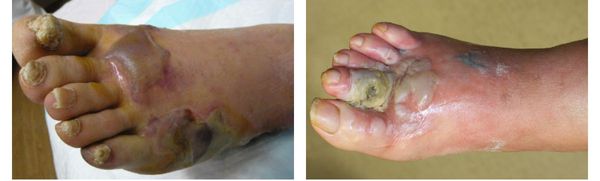
Осложнения сухой гангрены
Само по себе наличие гангрены указывает на полную нежизнеспособность и омертвление тканей, предполагая крайнюю степень патологического процесса. Поэтому отсутствие своевременного лечения может привести к потере поражённой конечности.
Сухая гангрена не может перерасти во влажную или газовую гангрену, как ошибочно утверждают многие источники, потому что изначально при возникновении некроза становится очевиден механизм развития гангрены. [1] [2] [3] [4] [7]
Редкими осложнениями сухой гангрены являются сепсис и септический шок. Они возникают в связи с токсическим действием продуктов распада при проникновении их в системный кровоток. Данные осложнения способны привести к полиорганной недостаточности и, как следствие, летальному исходу.
К проявлениям сепсиса относятся:
- ознобы;
- высокая или очень низкая температура тела (больше 38°C или меньше 36°C);
- одышка (частота дыхания более 20 в минуту);
- артериальная гипотензия (пульс более 90 ударов в минуту);
- аритмия;
- олигурия (объём мочи менее 0,5 мл/кг/ч);
- вялость, заторможенность;
- наличие различных лабораторные показания, не поддающаяся коррекции — низкий уровень белка, тромбоцитов и красных кровяных телец, а также высокий уровень билирубина, остаточного азота, мочевины, сахара в крови и ацетона в моче.
В случае септического шока давление становится крайне низким, даже на фоне интенсивного вливания внутривенных растворов. В связи с этим около 30-40 % пациентов умирает несмотря на оказываемое лечение. [12]
Диагностика сухой гангрены
Диагностика сухой гангрены достаточно проста, так как на некроз указывает внешний вид поражённого органа:
- его сухость;
- уменьшение участка кожи в объёме;
- тёмный, вплоть до чёрного, цвет кожи;
- наличие слабого неприятного запаха и болей непосредственно в мёртвом участке;
- наличие прохладных на ощупь окружающих тканей с выраженным болевым синдромом в них. [1][2][3][4][7]
При осмотре необходимо диагностировать причину сухой гангрены (например, атеросклероз артерий и тромбангиит). Для этого нужно проверить пульсацию артерий как поражённой, так и здоровой ноги на уровне паховых и подколенных областей, позади медиальной лодыжки и на тыле стопы. В дальнейшем необходимо подтвердить причинный диагноз с помощью ультразвукового исследования.
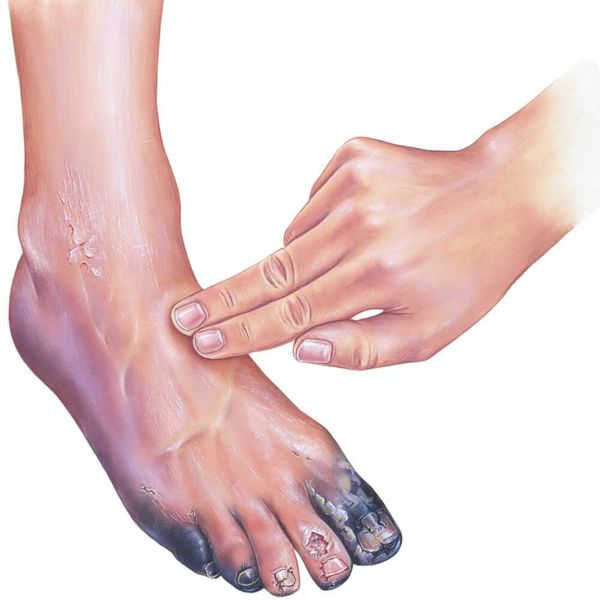
В качестве предоперационной подготовки для определения вида оперативного лечения выполняется ангиография нижних конечностей:
- при протяжённых поражениях артерий выполняется хирургическая операция — аутовенозное шунтирование;
- при коротких поражениях более предпочтительно выполнить эндоваскулярную операцию (наименее травматичное лечение). [1][2]
Для предоперационной подготовки нужно сдавать общий и биохимический анализ крови, а также бактериальный посев. Эти лабораторные исследования помогут выяснить, не является ли причиной сухой гангрены сахарный диабет.
Лечение сухой гангрены
С целью предотвращения гангрены и максимально возможного сохранения конечности требуется восстановить кровоток в тканях, окружающих гангренозный участок.
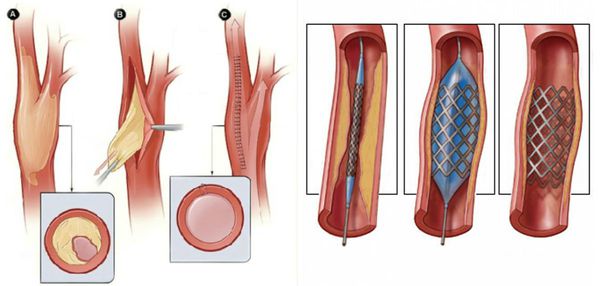
Нормализовать кровообращение в органе можно при помощи оперативного вмешательства:
- Реконструктивные операции на артериях конечности (как правило, руки):
- аутовенозное шунтирование;
- эндартерэктомия (удаление закупорки артерии) с аутовенозной пластикой;
- шунтирование артерий аорто-подвздошно-бедренного сегмента синтетичсекими протезами.
- Рентгенэндоваскулярные операции (не показаны пациентам с тромбангиитом):
- стентирование;
- баллонная ангиопластика артерий.
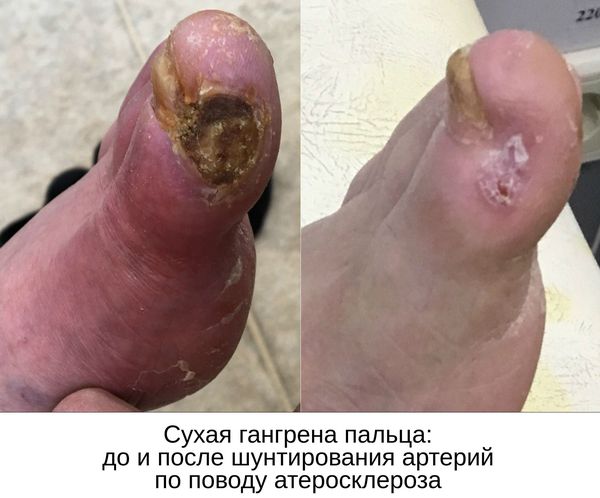
Паллиативные операции (поясничная симпатэктомия и остеотрепанация), проводящиеся для улучшения качества жизни, и другие нехирургические методы лечения (генная и физиотерапия) не способны предотвратить прогрессирование сухой гангрены.
Саму гангренозную ткань необходимо убрать. Для этого проводят:
- малые ампутации — удаление пальцев или части стопы с некрозом;
- некрэктомию — поверхностное удаление некротического струпа до пределов тканей с удовлетворительным кровотоком.
В случаях обширного гангренозного поражения с потерей опороспособной стопы прибегают к ампутации голени либо бедра. Чтобы избежать подобного печального исхода, важно при первых же признаках гангрены без промедления обратиться к врачу: потерять конечность куда страшнее, чем её лечить. Особенно это относится к людям с сахарным диабетом и атеросклерозом: нельзя ждать, когда гангрена начнёт прогрессировать, иначе удаление поражённой конечности будет неизбежным.
Если всё же обширная гангрена стопы привела к потере её опороспособности, то в таких случаях целесообразно выполнение ампутации голени на уровне границы средней и верхней трети. В дальнейшем это позволит подобрать и использовать удобный протез.
Даже после ампутации гангрены, возникшей из-за закупорки артерий ноги, необходимо выполнить реконструктивную (шунтирующую) или рентгенэндоваскулярную операцию на артериях нижней конечности. Делается это с целью обеспечения кровотока для успешного заживления постампутационной культи голени.
При физических причинах гангрены (отморожение) или химических (внутриартериальное введение синтетичсеких наркотиков) лечение заключается в нормализации вязкости крови. Для этого проводится:
- антикоагулянтная и инфузионная терапия;
- профилактика синдрома полиорганной недостаточности;
- хирургическое удаление участка, поражённого сухой гангреной. [1][2][3]
Прогноз. Профилактика
Прогноз зависит от степени гангренозного поражения:
- при гангрене пальцев или небольших участков стопы конечность можно восстановить при реставрации кровотока, удалении омертвевших тканей и создании благоприятных условий для заживления;
- при тотальной сухой гангрене стопы показана ампутация на уровне голени, но с условием, что кровоток в голени достаточен для заживления постампутационной культи;
- при обширной гангрене голени пациенту показана ампутация ноги на уровне бедра.
Пятилетняя выживаемость при сухой гангрене сравнима с выживаемостью при злокачественных новообразованиях (например, раковой опухолью кишечника): к концу первого года после подтверждения диагноза "Критическая ишемия" (критическое снижение кровоснабжения) лишь 45 % пациентов имеют шанс сохранения конечности, а около 30 % продолжают жить после ампутации бедра или голени, а 25 % — умирают.
Тем не менее число больших ампутаций остаётся высоким, а их исходы — крайне тяжёлыми. Риск смертности в течение 30 дней после таких ампутаций составляет 4-30 %, а риск развития осложнений, таких как инфаркт миокарда, инсульт, инфекция, — 20-37 %. [1] [7] [10]
Реабилитация и протезирование
Трудности в реабилитации пациентов после ампутаций и протезирования у многих пожилых пациентов отрицательно влияют на отдалённые результаты и качество их жизни.
Период реабилитации зависит от объёма гангренозного поражения, качества заживления дефекта, сопутствующих соматических заболеваний, возраста пациента и его желания вернуться к полноценной жизни. Как правило, при успешном лечении и соблюдении всех рекомендаций врача длительность реабилитации составляет 3-6 месяцев.
На качество реабилитации также влияет питание. Поэтому в период восстановления рацион должен состоять из белковой и калорийной (но не жирной) пищи: из мяса индейки, рыбы, фасоли, творога и яиц. От жирной пищи во время реабилитации лучше отказаться.
Первичный протез подбирается после заживления раны культи. Затем, когда сформирована мышца культи, пациенту подбирают вторичный протез. Этим занимается врач-реабилитолог совместно с протезистом. [7] [8] [9]
Профилактика
Для предупреждения развития гангрены у предрасположенных к этому людей (например, лиц с сахарным диабетом, атеросклерозом), важно соблюдать меры профилактики:
- отказ от курения — эта пагубная привычка может привести к ухудшению кровообращения и закупорке сосудов;
- контроль уровня сахара в крови;
- проверка тела на наличие повреждений, их лечение и ежедневное наблюдение за их заживлением;
- незлоупотребление алкоголем.
Также для профилактики гангрены нужно избегать обморожений и иных внешних причин образования некроза.
Читайте также:

