При заболевании кишечника может быть дерматит
Обновлено: 04.05.2024
ФГБУ «Федеральный научно-клинический центр» ФМБА России
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
ФГБУ «Федеральный научно-клинический центр» ФМБА России
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Современный взгляд на лечение атопического дерматита с позиции дерматолога и гастроэнтеролога
Журнал: Клиническая дерматология и венерология. 2021;20(1): 104‑108
ФГБУ «Федеральный научно-клинический центр» ФМБА России
Проведен анализ данных литературы, посвященной вопросу ассоциации атопического дерматита (АД) с патологией органов пищеварения. Сопутствующие заболевания желудочно-кишечного тракта (ЖКТ) могут являться одним из пусковых факторов развития АД как у детей, так и у взрослых. Возникновение АД связывают с нарушением микробиоты кишечника, которое проявляется снижением содержания лакто- и бифидобактерий, повышенным ростом золотистого стафилококка, кишечной палочки. В различных исследованиях выявлена прямая корреляция между степенью обсеменения слизистой оболочки желудка бактериями Helicobacter pylori (Hp), активностью хронического гастрита и тяжестью АД. Эти данные обусловливают целесообразность определения инфекции Hp при обследовании больных АД, а при ее выявлении — проведение антихеликобактерной терапии. Приводятся данные о возможности развития у пациентов с АД пищевой толерантности, на формирование которой оказывают влияние наряду с генетической предрасположенностью длительность грудного вскармливания, состав желудочно-кишечной микрофлоры и возраст первого поступления аллергена в организм больного. Согласно международным и российским рекомендациям по ведению и лечению, в схемы терапии пациентов с АД включены топические кортикостероидные препараты. Показана эффективность и безопасность применения в лечении АД препарата, содержащего микронизированный метилпреднизолона ацепонат и церамиды.
ФГБУ «Федеральный научно-клинический центр» ФМБА России
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
ФГБУ «Федеральный научно-клинический центр» ФМБА России
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Дата принятия в печать:
Атопический дерматит (АД) — хроническое рецидивирующее воспалительное заболевание кожи. Актуальность проблемы АД связана с чрезвычайно высокой распространенностью заболевания среди других дерматозов. Заболеваемость АД в 2018 г. в РФ составила 188,2 случая на 100 тыс. населения, а распространенность — 426,3 случая на 100 тыс. населения [1]. Характерной особенностью АД являются значительно более высокие показатели заболеваемости среди детского населения. Раннее начало АД (в возрасте от 2 до 6 мес) отмечается у 45% пациентов, возникновение в течение 1-го года жизни — у 60% [2]. АД часто ассоциируется с пищевой аллергией. Выявлено, что у пациентов с АД и пищевой аллергией впоследствии могут развиваться другие заболевания из группы атопии — аллергический ринит и бронхиальная астма [3, 4].
Как в российской, так и в зарубежной литературе встречаются данные о связи АД с заболеваниями верхних отделов пищеварительного тракта (гастрит, язвенная болезнь), патологией тонкого и толстого кишечника, болезнями печени и желчевыводящих путей. Известно, что у детей и взрослых различные заболевания органов пищеварения могут провоцировать развитие АД.
Возникновение АД связывают с нарушением микроэкологического баланса кишечника, который проявляется снижением количества лакто- и бифидобактерий, повышением содержания золотистого стафилококка и кишечной палочки.
При эзофагогастродуоденоскопии у больных АД в 90% случаев выявляется хронический гастрит, в 82,5% ассоциированный с инфекцией Helicobacter pylori (Hp), которая повреждает слизистую оболочку желудка, способствует выделению токсинов и аллергенов, что приводит к развитию хронического воспаления. Установлена прямая корреляция между степенью обсеменения Hp слизистой оболочки желудка, активностью хронического гастрита и степенью тяжести АД. Эти данные обусловливают целесообразность определения инфекции Hp при обследовании больных АД, а при ее выявлении — проведение антихеликобактерной терапии. Успешная эрадикация Hp приводит к улучшению течения АД и удлинению периода ремиссии заболевания. В связи с существованием орального пути передачи Hp в схемы ведения пациентов с хроническим гастритом и язвенной болезнью, ассоциированными с Hp, включено обследование и лечение членов семьи.
В литературе имеются данные о связи развития АД с заболеваниями поджелудочной железы как воспалительного, так и функционального характера, при которых изменяется активность панкреатического сока, нарушается его отток. В этих условиях происходит массивное всасывание белковых веществ [5]. На этом фоне могут изменяться активность T-супрессоров и содержание IgE — основных участников аллергического процесса [5, 6].
Микробиота регулирует моторику кишечника, участвует в формировании иммунитета, защищает организм от негативного воздействия внешней среды, принимает участие в синтезе и всасывании короткоцепочечных жирных кислот, витаминов, антиоксидантов и др. Одной из основных особенностей кишечной микробиоты является защита от агрессивных факторов внешней среды. Девяносто пять процентов микробиоты составляют бифидобактерии, лактобактерии и кишечная палочка [7].
В настоящее время широко применяется термин «нормофлора», который характеризует качественный и количественный состав микроорганизмов, способствующих иммунологическому балансу организма. Оптимальные условия могут быть нарушены в результате неправильного питания, развития диареи, отравления различными токсическими веществами, к которым относятся свинец и ртуть. Отрицательное действие на микрофлору оказывают также некоторые лекарственные препараты, непереносимость продуктов питания, одностороннее и несбалансированное питание, недостаточность пищеварительных ферментов.
В последние годы внимание врачей привлекает проблема состояния и эффективной коррекции микробной флоры кишечника при заболеваниях кожи [8]. Как показывают исследования, при дисбиозе кишечника наблюдается нарушение электролитного обмена, мембранного транспорта, процессов детоксикации, окислительного фосфорилирования, иммунологических реакций, что в свою очередь оказывает влияние на состояние кожных покровов [9].
Около 1 /4 слизистой оболочки кишечника представляет собой иммунологически активную ткань, содержащую около 1010 лимфоцитов, а также клеточные и структурные элементы, отвечающие за противовирусный и противобактериальный иммунитет [10].
Нарушения состава микрофлоры кишечника являются патогенетическими звеньями ряда различных заболеваний и состояний. К ним относятся онкологические заболевания, воспалительные заболевания тонкого и толстого кишечника, неалкогольная жировая болезнь печени, метаболический синдром, аутоиммунные заболевания, ХОБЛ, бронхиальная астма, АД и др. При всех этих заболеваниях необходимо применение патогенетической терапии, включающей в себя коррекцию нарушенной микробиоты кишечника [7].
С учетом данных об участии нарушений пищеварения в патогенезе заболеваний кожи терапия, направленная на коррекцию микробиоты, способствует повышению эффективности лечения. Коррекция нарушений биоценоза в толстом кишечнике включает в себя 2 этапа. На первом этапе для элиминации избыточного количества условно-патогенных и патогенных микроорганизмов назначают неабсорбируемые антисептики или антибиотики (например, нифуроксазид, рифаксимин), а также бактериальные препараты (Saccharomyces boulardii). На втором этапе применяют препараты, действие которых направлено на восстановление нормальной микрофлоры кишечника (пре-, про- и синбиотики) [11].
Пробиотики — непатогенные для человека микроорганизмы, которые угнетают рост патогенных и условно-патогенных бактерий и восстанавливают присущую для организма (в том числе для кишечника) микрофлору: лакто- и бифидобактерии (L. acidophilus, L. plantarum, L. casei, B. bifidum, B. infantis и др.); непатогенные виды Escherichia coli; дрожжевые грибы.
Пребиотики не всасываются в тонком кишечнике и стимулируют рост нормальной микрофлоры в толстом кишечнике. К ним относят инулин, пищевые волокна (клетчатку), витамины A, E и C, селен и др. Синбиотики содержат как пробиотики, так и пребиотики.
К самым ранним проявлениям аллергии у детей относится пищевая аллергия [12]. Основными условиями ее развития являются генетические факторы, нарушение пищеварения (полостного и внутриклеточного), повреждение целостности слизистой оболочки тонкого и толстого кишечника, что способствует повышению проницаемости эпителиального слоя кишечника, а следовательно, попаданию аллергенов в кровь и сенсибилизации организма [13]. Пищевая аллергия проявляется разнообразными клиническими симптомами, которые снижают качество жизни [14].
К основным методам лечения пищевой аллергии относят диету. Различают такие виды диет, как элиминационная, гипоаллергенная и ротационная [15]. При элиминационной диете исключают продукты, которые вызывают аллергию, и их роль доказана. Для соблюдения гипоаллергенной диеты из рациона питания исключают продукты, являющиеся пусковым механизмом развития аллергических реакций (такие как шоколад, цитрусовые, яйца и др.). При назначении ротационной диеты рекомендуется чередование продуктов в течение 2–4 дней.
К факторам риска развития и высокой распространенности пищевой аллергии относят нарушение микробиоты кишечника у новорожденных вследствие позднего начала грудного вскармливания, докорма молочными смесями в первые часы и дни жизни, раннего перевода на искусственное вскармливание. Это способствует формированию атопического фенотипа, при котором нарушаются иммунный ответ и механизмы становления пищевой толерантности, что является риском развития не только пищевой аллергии, но и тяжелых форм атопических заболеваний в более старшем возрасте.
Позднее введение пищевых продуктов в рацион ребенка препятствует выработке пищевой толерантности, которая зависит от наследственной предрасположенности к возникновению различных аллергических заболеваний. Под пищевой толерантностью подразумевают способность ребенка переносить продукты питания на фоне естественного снижения иммунопатологической реакции на пищу [18]. К факторам, участвующим в развитии пищевой толерантности, относятся состояние микрофлоры ЖКТ, длительность грудного вскармливания, период (возраст) первого «знакомства» с аллергенным продуктом.
Необходимо поддерживать равновесие между исключением белковых веществ и их поступлением в организм, которое имеет большое значение для предотвращения сенсибилизации, с одной стороны, и формирования пищевой толерантности, с другой. Важным является и период введения прикорма (так называемое критическое окно развития), во время которого риск развития аллергии низкий. Такой благоприятный временной отрезок установлен между 4-м и 7-м месяцами жизни ребенка и утвержден экспертным комитетом [19]. Введение «чужеродных» питательных веществ в более поздний период повышает риск развития пищевой аллергии и аутоиммунных заболеваний [18].
Согласно Рекомендациям по лечению АД Европейского форума дерматологов (Консенсусные Европейские рекомендации по лечению атопического дерматита (атопической экземы) у взрослых и детей (EDF), 2018), можно выделить следующие положения:
— пациенты со среднетяжелым и тяжелым течением АД должны придерживаться терапевтической элиминационной диеты с исключением тех продуктов питания, которые вызывали аллергические реакции немедленного или замедленного типа при проведении пищевых провокационных проб (2b, B);
— больным АД, ассоциированным с аллергией к пище, рекомендуется первичная профилактика путем поддержания исключительно грудного вскармливания до 4-месячного возраста (2-3, C);
— детям как с исходно повышенным риском развития атопических заболеваний, так и без такового и независимо от семейного анамнеза атопических заболеваний рекомендуется расширение рациона питания (введение прикорма) в возрасте от 4 до 6 мес (1-2, B);
— при введении прикорма в возрасте от 4 до 6 мес следует обеспечить определенное разнообразие рациона питания (1, D) [2].
В соответствии с российскими и международными рекомендациями наружная терапия является обязательной составляющей схемы лечения АД. Первой линией противовоспалительной терапии у взрослых, детей и беременных являются топические глюкокортикостероидные (ТГКС) препараты [2, 20, 21]. Они имеют преимущество перед другими наружными средствами, так как действуют непосредственно на орган-мишень, таким образом, при их применении отмечается минимизация системных побочных эффектов. Местные побочные эффекты могут возникать при нерациональном и чрезмерном применении ТГКС, при некомплаентном поведении больного. В зависимости от тяжести и степени выраженности симптомов АД ТГКС могут быть использованы в качестве активной или проактивной терапии [22].
Метилпреднизолона ацепонат (МПА) — ТГКС, отвечающий всем современным требованиям, предъявляемым к наружным кортикостероидам. МПА — негалогенизированный стероид последнего поколения, является пролекарством, что обеспечивает активное и прицельное действие его в очаге поражения [23]. МПА имеет оптимальный терапевтический индекс. Минимальная системная абсорбция препарата, быстрая и полная инактивация обеспечивают высокий профиль безопасности [24]. Эффективность и безопасность МПА в топической терапии хронических дерматозов показана во многих исследованиях российских и зарубежных авторов. Результаты исследования МПА в лечении АД продемонстрировали его эффективность на всех стадиях течения заболевания [25—27].
Клинический опыт показывает, что необходим комплексный подход в терапии АД, включающий коррекцию состояния микрофлоры кишечника, регуляцию функции кишечника, печени, желчевыводящей системы и желчного пузыря, что наряду с наружным лечением способствует достижению более выраженного эффекта. Крем Комфодерм К благодаря улучшенной фармакокинетики и комбинации микронизированного ГКС и церамидов обладает как противовоспалительным, так и регенерирующим свойствами. Высокая эффективность и безопасность препарата, а также комплаентность к нему больных позволяют рассматривать Комфодерм К как оптимальное топическое средство лечения АД.
Участие авторов:
Концепция и дизайн статьи; сбор и обработка материала; написание текста; редактирование: Е.В. Матушевская, И.А. Комиссаренко
Сбор и обработка материала и написание текста по патологии органов пищеварения: Ю.В. Конев, С.В. Левченко
Сбор и обработка материала и написание текста по терапии атопического дерматита: Е.В. Владимирова
Атопический дерматит (АД) – хроническое рецидивирующее заболевание кожи, проявляющееся интенсивным зудом, высыпаниями в сочетании другими многочисленными признаками атопии (необычностью) – атопический ринит, бронхиальная астма, мигрень, гастродуоденит и др.
Атопический дерматит — симптомы
АД в мире страдают 5-15 % детей и 2-10 % взрослых, впервые выявленный в детстве АД продолжается у 45- 60 % взрослых пациентов. АД отличается хроническим рецидивирующим течением с возрастной динамикой клинических проявлений. По проявлениям заболевание возможно разделить на три периода.
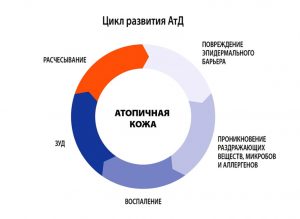
- В младенческом возрасте (до 1.5-2 лет) заболевание носит острый характер, преобладают явления покраснения, отечности, мокнутия и коркообразования.
- В период от 2 лет до полового созревания болезнь носит характер хронического воспаления, на коже на первый план выступают явления гиперемии (эритемы) и шелушения, признаки вегетососудистой дистонии. Кожа в очагах поражения гиперпигментирована, из-за сильного зуда появляются множественные расчесы.
- У детей старшего возраста и взрослых преобладают явления инфильтрации (уплотнения) на фоне гиперемии застойного характера. На коже могут появляться зудящие высыпания, имеющие цвет нормальной кожи, которые сливаются в очаги сплошной папулезной инфильтрации. Обычно к 50 годам заболевание самостоятельно регрессирует.
Атопический дерматит – многофакторное заболевание, характеризующееся аномальным иммунным ответом на аллергены природного происхождения, наследственной предрасположенностью к заболеванию, хроническим рецидивирующим течением. Большое внимание уделяется различным факторам, запускающим процесс в коже и длительно поддерживающим хроническое течение заболевания. К таким факторам относятся бактериальные, вирусные, грибковые, паразитарные и кишечные инфекции, продукты питания и химические вещества (добавки к пище, лекарства), клещи из домашней пыли.
Атопический дерматит и хеликобактер пилори
В последние годы доказана связь атопического дерматита с болезнями органов пищеварения. Установлено, что большинство больных, страдающих АД, имеют хронический гастрит, гастродуоденит, синдром раздраженного кишечника с запорами, заболевания печени и желчного пузыря, нарушение микрофлоры кишечника и др. Нередко существование этих сопутствующих болезней является пусковым фактором атопического дерматита, как у детей, так и у взрослых.
Так, в последние десятилетия в возникновении заболеваний желудка доказана роль специфического микроорганизма – Helicobacter pylori (НР), повреждающего слизистую оболочку желудка. Его наличие способствует активному поступлению токсинов и аллергенов в организм, развитию хронического воспаления слизистой желудка. У больных атопическим дерматитом в 90% случаев при проведении эндоскопического обследования желудка выявляется хронический гастрит и в 82.5% ассоциированный с НР. Отмечена связь между степенью обсеменения бактериями слизистой желудка, активностью хронического гастрита и степенью тяжести АД, что явилось обоснованием к включению в план обследования больных АД на хеликобактериоз и лечебных мероприятий антихеликобактерной терапии. Клинически гастриты у большей части больных АД протекают бессимптомно.
Эрадикация хеликобактера приводит к разрешению заболевания почти у трети больных АД, к улучшению течения АД у остальных пациентов, и самое главное, удлинению периода ремиссии заболевания АД и перехода непрерывного течения заболевания к рецидивирующему.
Обязательным условием профилактики АД у больных хроническим гастритом, ассоциированным с НР, учитывая оральный путь инфицирования, является обследование на хеликобактериоз контактных лиц в семье и вне ее!
Защитная роль кишечника
Здоровье невозможно без нормального функционирования кишечника, которому принадлежит большая роль в детоксикации и иммунологических процессах, которые протекают в организме человека. Слизистая кишечника представляет собой место контакта организма с окружающей средой. Для сравнения: поверхность кожи составляет около 2 квадратных метров, площадь же слизистой оболочки желудочно-кишечного тракта – около 400 квадратных метров. Поэтому слизистую кишечника считают самой большой частью защитной системы организма.
Для надежной защиты от внешнего вмешательства в пищеварительном тракте важнейшим оказался микробиологический барьер.
- Защитная микрофлора кишечника наиболее многочисленная (95%) и представлена в основном бифидобактериями, лактобактериями и кишечной палочкой. Эти микроорганизмы выделяют молочную и уксусную кислоты и другие вещества, которые обладают антимикробным действием и препятствуют проникновению и закреплению на слизистой кишечника вредных микроорганизмов, которые не свойственны человеку. Они стимулируют иммунную систему организма человека, являются сорбентами, которые способны накапливать значительное количество тяжелых металлов и других токсических веществ.
- Сапрофитная микрофлора кишечника представлена стафилококками, энтерококками и другими микроорганизмами, основная роль которых — утилизация конечных продуктов обмена организма человека.
- Оппортунистическая микрофлора представлена различными микроорганизмами (стрептококки, золотистый стафилококк, грамотрицательные энтерококки, грибы рода кандид и др.), которые при определенных условиях вызывают патологический процесс.
Для человеческого организма исключительно важно поддержание требуемого состава и количества кишечных бактерий. Оптимальные условия могут быть нарушены вследствие неправильного питания, возбудителями диареи (бактерии и паразиты), дополнительными отрицательными факторами могут быть токсические вещества, поступающие из окружающей среды, например, тяжелые вещества – кадмий, свинец, ртуть, а также путешествия в другие страны с иными микроорганизмами. Отрицательным действием на флору обладают многие лекарственные средства и методы лечения, непереносимость продуктов питания, вредно одностороннее и несбалансированное питание, недостаточность пищеварительных ферментов.
Атопический дерматит и дисбактериоз
Многие кожные болезни, и в том числе Атопический дерматит, сопровождаются дисбактериозом, и при этом считается, что отягощающим фактором при АД является недостаточное количество лактобактерий. Именно лактобактерии в значительной степени снижают всасывание аллергенов в кишечнике и стимулируют образование иммуноглобулинов класса А, которые, особенно в раннем возрасте, являются основными антителами против пищевых аллергенов.
В настоящее время считают, что возникновение кожных заболеваний в определенной мере связано с нарушением микроэкологического баланса кишечника. У 80-95% больных атопическим дерматитом отмечается дисбактериоз кишечника, при этом наряду с дефицитом лактобактерий и бифидобактерий наблюдается избыточный рост золотистого стафилококка, кишечной палочки с измененными свойствами, грибов роста кандид, выделяющих токсины.
Эти нарушения требуют санации кишечника от вредных бактерий, проведения детоксикационной терапии (энтеросорбции) и создания условий для развития собственной микрофлоры пациента, регуляции работы кишечника (борьба с запорами). Энтеросорбция – неинвазивный метод детоксикации и направлена она на выведение из организма различных эндогенных и экзогенных аллергенов, токсинов, условно-патогенных микроорганизмов и продуктов их жизнедеятельности. Одним из самых эффективных сорбентов являются природные органические на основе пищевых волокон, таких как лигнин, который не усваивается в пищеварительной системе и обладает высокой сорбционной активностью.
Новое направление лечения АД представляет собой применение пребиотиков (лактулоза), полученных из естественных источников и выступающих в качестве питательной среды для развития своей собственной нормальной флоры кишечника. Сочетание сорбента и пребиотика представлено в препарате Лактофильтрум, который производится из компонентов природного происхождения в таблетированной форме, прост в употреблении — по 2 таблетки 3 раза в день в течение 3-4 недель.
В клинической практике выявлена корреляция между степенью выраженности дисбактериоза и проявлений АД. Кроме прямого влияния дисбактериоза на сенсибилизацию организма при АД, в настоящее время доказано опосредованное влияние на состав аутомикрофлоры кожи у больного АД.
Образование токсических веществ в кишечнике в дальнейшем действует не только на иммунную систему, но и нарушает детоксикационную функцию печени, образование и выделение желчи из печени, желчевыводящих путей и желчного пузыря.
Атопический дерматит и желчный пузырь
При обследовании больных, страдающих атопическим дерматитом, в 60% случаев определяется дискинезия желчевыводящих путей, у взрослых по гипотоническому типу, т.е. желчный пузырь плохо сокращается, и не выводятся токсические вещества из организма.
У 31% пациентов в желчном пузыре определяется густая желчь, с хлопьями или мягкими конкрементами (сладж желчи), что свидетельствует о нарушении качественного состава желчи, продуцируемой печенью. Таким образом, нарушается еще одна функция органов пищеварения, осуществляющая детоксикационную функцию организма.
При этом в комплекс лечения больных АД добавляются желчегонные препараты (желчегонные сборы трав, Хофитол, Гепабене, настой шиповника или Холосас, Холит и др.), а также назначаются препараты, улучшающие функцию печени и качество желчи, продуцируемой печенью (Урсофальк, Урсосан, Уролесан), препараты расторопши, гептрал, гепатосан и др., проводятся гуманные тюбажи желчного пузыря (с растительными маслами, медом, минеральной водой).
Клинический опыт показывает, что улучшение состояния микрофлоры кишечника, регуляция работы кишечника без запоров и улучшение работы печени и желчевыводящей системы и желчного пузыря способствует более эффективному лечению больных с атопическим дерматитом.
Питание при атопическом дерматите
Несколько слов о питании у больных АД. Питание для больных АД во многих случаях не играет настолько большой роли, как часто полагают. Существует огромное количество продуктов питания, для которых выявлена взаимосвязь с АД, но в конечном счете реальным фактором является только индивидуальная чувствительность. Существует целый спектр потенциально опасных продуктов, и каждый пациент должен составить индивидуальный рацион питания. Пациентам с АД необходимо соблюдать полноценное питание, избегать строгих диет, особенно в детском возрасте.
Продукты питания, которые могут оказывать негативное воздействие на Атопический дерматит:
- Острые, копченые продукты,
- пряности,
- алкоголь,
- овощи (перец, редис, квашеная капуста, сельдерей, помидоры),
- орехи,
- сладости (мед, сахар, сушеные фрукты, шоколад),
- крепкие мясные бульоны,
- маринады,
- кофе, какао,
- яйца, молоко,
- рыба,
- пищевые добавки, консерванты, пищевые красители.
Пациент и сам должен активно участвовать в процессе оздоровления своего организма. Особенно следует обратить внимание на такие важные мероприятия как:
- полноценное питание,
- отказ от сахара,
- употребление в пищу пищевых волокон (отруби, пектины, сложные углеводы),
- употребление кисломолочных продуктов, заквашенных лактобактериями, или препараты с лактобактериями,
- отказ от свинины.
Атопический дерматит — фитотерапия
Важное место в лечении и профилактике обострений играет фитодиетология. Она включает использование соков из клюквы, черной смородины, красной и черноплодной рябины, свекольный, сливовый, яблочный, черничный, тыквенный, капустный соки.
Лечение Атопического дерматита травяными сборами
Несколько прописей травяных сборов, применяемых при АД.
- Сбор 1. Трава череды 10.0, листья подорожника 10.0, листья крапивы 10.0, трава полыни 5.0, трава тысячелистника 5.0, трава зверобоя 15.0, трава хвоща 10.0, листья толокнянки 20.0. Смешать, приготовить настой из 1 чайной/столовой ложки (в зависимости от возраста). Принимать по 1/3 стакана 3 раза в день до еды, прием 1-2 месяца.
- Сбор 2. Трава трехцветной фиалки 20.0, корень девясила 10.0, трава зверобоя 15.0, трава хвоща 10.0, шишки хмеля 10.0, трава душицы 10.0, цветки ромашки 15.0, трава мяты перечной 5.0. Смешать. Доза и способ приготовления настоя. Принимать по 1/3 стакана 3 раза в день после еды в течение 1-2 месяцев.
- Атопический дерматит с сопутствующими запорами. К 1и 2 настою добавить слабительный сбор, настой плодов фенхеля (5.0:200.0), настой листьев подорожника (10.0:200.0), настой плодов тмина (5.09:200.0) или препараты лактулозы (Дюфалак, Нормаза, лактусан)
- Атопический дерматит при длительном течении процесса, особенно в зимне-весеннем периоде. Используются растительные лекарственные препараты с витаминными свойствами. Это настой листьев крапивы (15.0:200.), плодов шиповника (10.0:200.0), листьев черной смородины и ее плодов.
- Атопический дерматит с выраженными мокнутиями, отечностью и инфильтраций кожных покровов. Полезны настои плодов можжевельника (5.0:200.0), листьев почечного чая (3.5:200.0), травы хвоща полевого (10.0:200.0), мочегонного сбора.
- В целях улучшения показателей неспецифического иммунитета применяют настой цветков черной бузины (5.0:200.0), настой корня солодки (10.0:200.0), экстракт элеутерококка или настойку аралии по 2-3 капли (в зависимости от возраста ребенка) утром и вечером в течение 2 недель.
- Сбор для нормализации углеводного обмена. Настой листьев крапивы (10.0:200.0), отвар корня одуванчика (10.0:200.), настой листьев черники (10.0:200.0), отвар корня лопуха (5.0:200.0). Эти настои обладают противовоспалительным, противозудным свойством, оказывают нормализующее действие на желчевыводящие пути и поджелудочную железу.
Местное лечение Атопического дерматита
Для регенерации кожи используется и наружная терапия, принципом которой является: «влажное наносится на влажное». Рекомендуется использовать проницаемые воздухом влажные повязки. Компрессы накладываются трижды в день, каждая процедура продолжается 1 час. В качестве используемых средств используется черный и зеленый чай, ромашковый чай.
Примеры повязок на мокнущие поверхности:
- Повязка с настоем коры дуба: 2 столовые ложки дубовой коры разводятся в 500 мл воды и кипятятся в течение 15 минут, после чего настой процеживают, остужают, в него опускают ткань для компресса и неплотно накладывают на больное место. Достаточно применять такие компрессы 3-4 дня, но ежедневно нужно готовить свежий отвар.
- С этой же целью можно использовать отвар лапчатки (15г:200.0), настой травы зверобоя или тысячелистника (15г:200.0).
- Компресс из трехцветных фиалок: 2 чайные ложки сухих фиалок настаивают в чашке кипятка, получившийся настой сливают, остужают и используют для компрессов на пораженные места.
- Очень широко используются растворы соли, например ванны с солями Мертвого моря. При правильном комплексном лечении мучительный зуд исчезает быстро, но если он сохраняется, то втирание разведенного яблочного уксуса может в значительной степени облегчить зуд.
- После прекращения мокнутий применяются мази, кремы. Пример мази следующего состава: сок подорожника 15 мл, настойка ландыша 5 мл, настойка валерианы 5 мл, настойка календулы 5 мл, димедрол 1 г, паста цинковая 79 г. Смешать. Наносить на пораженные участки 2-3 раза в день тонким слоем после удаления ранее нанесенной мази растительным маслом.
Для очистки кожи не использовать мыло! Можно использовать масляно-молочную ванну: 1 столовая ложка оливкового масла и 200 мл молока добавляются в ванну.
Следует придерживаться правила: каждые 3-4 дня препараты наружной терапии следует менять между собой для предупреждения развития побочных эффектов.
Д.м.н. Л.С. Круглова
Московский Научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения г. Москвы
Современная медицинская наука дает возможность практикующему врачу рассматривать заболевания не только в узких рамках симптомокомплекса, но и с точки зрения изменения функциональных резервов организма человека в результате нарушения его адаптационных возможностей. Неуклонный рост заболеваемости атопическим дерматитом (АтД), наличие рецидивирующих, хронических форм создают потребность в интеграции лечебно-реабилитационных технологий, направленных на восстановление и сохранение здоровья, нарушенного данной патологией.
По современным представлениям человеческий организм является определенной экологической нишей для множества разнообразных микроорганизмов, которые в норме формируют своего рода различные биотопы, являющиеся достаточно сложными системами, сформировавшимися в процессе эволюции и со временем приобретшие определенную устойчивость применительно к особенностям макроорганизма. Биотопы отличаются не только многокомпонентностью, но и количественным разнообразием входящих в них представителей микрофлоры [1].
Постоянство бактериальной аутомикрофлоры организма человека позволяет рассматривать бактерий, существующих преимущественно в четырех локализациях - на коже и слизистой полости рта, кишечника, половых органов - как своеобразный прокариотический орган. Причем изменения в одном из биотопов могут приводить к нарушениям в других. Формирование микрофлоры биотопов организма, и в первую очередь кожи и кишечника, происходит уже с самого рождения ребенка при прохождении по родовым путям. В дальнейшем на формирование влияет много факторов: состав микрофлоры биотопов матери, вид вскармливания, а затем и характер питания, состояние соматического здоровья ребенка и состояние окружающей среды [2,3].
Из всех биотопов организма наибольшая численность и видовое разнообразие бактерий отмечается в биотопе кишечника: так, на площади в 200 м 2 обитает 10 12 -10 14 бактерий, может встречаться до 450 видов различных микроорганизмов, общая масса которых доходит до 5% массы самого кишечника [4,5]. При этом в разных отделах кишечника количество и состав микроорганизмов биоценоза различен. В тонком кишечнике микробов меньше - это преимущественно лактобациллы, стрептококки и веилонеллы, в толстом кишечнике их больше, причем преобладают кишечные палочки и анаэробные бактерии.
Многочисленные микроорганизмы обеспечивают такие важные функции, как выработка ферментов, участвующих в метаболизме белков, липидов, жиров, нуклеиновых и желчных кислот, формирование механизмов иммунной защиты, поддержание гомеостаза организма, продукция биологически активных веществ и витаминов, детоксикация эндогенных и экзогенных субстратов и многие другие.
Микрофлора кишечника условно подразделяется на защитную, сапрофитную и оппортунистическую (условно-патогенную). Защитная микрофлора наиболее многочисленная (до 95%) и в основном представлена лактобактериями, бифидобактериями и кишечной палочкой с нормальными ферментативными свойствами. Именно они обеспечивают постоянство микрофлоры за счет колониальной резистентности. Так, бифидобактерии, лактобактерии выделяют молочную, уксусную кислоты, другие вещества, обладающие избирательным антимикробным действием. Кислая среда, обусловленная жизнедеятельностью этих микроорганизмов, препятствует проникновению и закреплению на слизистой патологических микробов, не свойственных данному биотопу. Помимо этого, бифидобактерии стимулируют клеточное звено иммунитета и участвуют в синтезе иммуноглобулинов. Данные бактерии являются естественными биосорбентами и способны накапливать значительное количество соединений тяжелых металлов, фенолов, формальдегидов и других токсичных веществ [6,7]. Однако в соответствии с современными воззрениями, скорее всего, недостаточное количество лактобактерии является основным отягчающим фактором при атопическом дерматите.
Именно лактобактерии в значительной степени снижают всасывание аллергенов в кишечнике и стимулируют синтез иммуноглобулинов класса А, которые, особенно в раннем детском возрасте, являются основными антителами против пищевых аллергенов [8,9].
Сапрофитная микрофлора кишечника представлена эпидермальным и сапрофитным стафилококками, энтерококками и другими микроорганизмами, основной функцией которых является утилизация конечных продуктов метаболизма макроорганизма [5].
Оппортунистическая микрофлора может быть представлена различными микроорганизмами (3-гемолитический стрептококк, золотистый стафилококк, спороносные анаэробы, грамотрицательные энтерококки, грибы рода Candida ), которые при определенных условиях вызывают патологический процесс [5].
Таким образом, в кишечном микробиоценозе, как в единой системе, существуют корреляционные связи между различными видами бактерий. Нарушение колонизационной резистентности кишечника, связанное с изменением состава постоянной микрофлоры, способствует колонизации патогенными и условно-патогенными бактериями, нарушению основных функций, что и приводит к формированию дисбиоза [Мельникова, 1997; Билимова, 2000; Белова с соавт., 2004; Cammaro-ta, Ogava, 1998].
Согласно существующему в России медицинскому стандарту оказания специализированной помощи при патологии желудочно-кишечного тракта (ЖКТ) дисбиоз кишечника рассматривается, как своеобразный клинико-лабораторный синдром, который характеризуется изменением качественного и/или количественного состава аутомикрофлоры, с возможной транслокацией микроорганизмов в несвойственные для них биотопы; при этом данные изменения могут сопровождаться клиническими симптомами поражения кишечника. В широком понимании дисбиоз является проявлением общего нарушения в различных микробиотах организма, которое приводит к нарушению функционирования микробиот и сопровождается определенными симптомами, ассоциированными с различными патологическими состояниями [5,10,11].
При развитии дисбиоза защитная микрофлора кишечника перестает выполнять свои функции в достаточной степени, что приводит к формированию патологических состояний либо усугублению течения имеющейся соматической патологии [12,13]. Ассоциированные с дисбиозом заболевания в зависимости от преобладания механизмов, отягчающих течение болезни, условно подразделяются на 4 группы:
- заболевания органов пищеварения,
- гнойно-воспалительные заболевания,
- аллергические заболевания,
- заболевания, связанные с нарушением обмена веществ (метаболизма).
Безусловно, рациональные схемы лечения атопического дерматита должны включать методы детоксикации (в частности, энтеросорбции) и использование препаратов, восстанавливающих и поддерживающих нормальную микрофлору кишечника. Энтеросорбция является неинвазивным методом детоксикации и направлена на выведение из организма различных эндогенных и экзогенных аллергенов, токсинов, патогенных микроорганизмов и продуктов их жизнедеятельности. Известно, что на фоне проведения энтеросорбционных мероприятий происходит повышение функциональной активности клеточного и гуморального иммунитета, ускоряется регресс объективных и субъективных симптомов АтД [17,18].
Существенным является и то, что сорбенты позволяют снизить медикаментозную нагрузку, а в ряде случаев и обходиться без них. Требования к современным энтеросорбентам следующие: высокие сорбционные свойства (емкость); отсутствие токсических свойств и системной фармакокинетики; атравматичность для слизистых оболочек ЖКТ; хорошая эвакуаторная способность; высокая комплаентность [19].
Механизм процесса энтеросорбции зависит от двух факторов - характеристик сорбента и структуры подлежащих сорбции веществ. Сорбенты могут отличаться по ряду признаков: лекарственная форма, физические свойства и химическая структура. Одними из самых эффективных сорбентов являются природные органические на основе пищевых волокон, такие как лигнин, который не усваивается в пищеварительной системе человека и полностью ферментируется кишечными бактериями. Важнейшее свойство лигнина - высокая сорбционная активность.
Вместе с тем большой интерес представляет развитие относительно нового направления в лечении атопического дерматита - включение в комплекс терапевтических мероприятий пребиотиков , выделенных из естественных источников и обладающих определенными регулирующими свойствами в отношении функционирования биотопа кишечника. В отличие от пробиотиков, которые поставляют необходимые бактерии извне, пребиотики выступают в качестве питательной среды для развития собственной нормальной микрофлоры организма, что способствует более быстрому и устойчивому восстановлению нормальной аутомикрофлоры кишечника [20,21]. Как правило, в качестве пребиотиков используют вещества, содержащие бифидогенные факторы, стимулирующие рост и развитие полезных бактерий. Таким веществом, в частности, является лактулоза - синтетический стереоизомер молочного сахара - лактозы.
Таким образом, на сегодняшний день идеальным сочетанием можно считать комбинированные лекарст венные средства, содержащие пребиотик и адсорбент. Таким средством является препарат Лактофильтрум ® , включаюший сорбент и пребиотик. В качестве сорбента препарат содержит растительный компонент - лигнин, который обладает неспецифическим дезинтоксикационным действием. За счет большой площади поверх ности и развитой системы пор обладает высокой сорбционной емкостью и таким образом способен выводить из организма токсины, аллергены и патогенные микро организмы. В качестве пребиотика выступает лактулоза, положительное влияние которой на микрофлору кишечника обусловлено целым рядом фармакологических свойств. Так, продукты бактериального метаболизма лактулозы сдвигают рН среды в толстой кишке в кислую сторону, что при водит к подавлению размножения патогенных микроорганизмов и угнетению процессов гниения. Помимо этого, являясь пищевым субстратом для бактерий, лактулоза стимулирует рост собственных бифидобактерий и лактобактерий в толстом кишечнике, а это, в свою очередь, восстанавливает, нарушенные функции биотопа кишечника.
Активные составляющие препарата не инактивируются в агрессивных средах желудка и двенадцатиперстной кишки, что обеспечивает 100%-ю доставку непосредственно к месту действия.
Лактофильтрум ® производится из компонентов природного происхождения в таблетированной форме и удобен в применении. Препарат зарекомендовал себя как высоко безопасный, который практически не имеет противопоказаний к применению и побочных эффектов [22,23].
В клинических условиях под нашим наблюдением находилось 40 пациентов (средний возраст 18,9±2,3 года, продолжительность заболевания 11,4±2,7лет) с диагностированным по основным критериям атопическим дерматитом в стадии обострения. У большинства пациентов АтД носил распространенный характер - ДИШС (Дерматологический индекс шкалы симптомов) составил 18,2±2,3 балла, что соответствует среднетяжелому течению АтД. В зависимости от проводимого лечения пациенты были разделены на 2 сопоставимые по всем параметрам группы. В основную группу вошли 20 больных, которые получали препарат
Лактофильтрум ® по 2 таблетки 3 раза в сутки на протяжении 21 дня и фармакотерапию, соответствующую стандартам при данной патологии. Пациенты 2 группы (20 человек) получали традиционную медикаментозную терапию.
До лечения у 97,5% пациентов был диагностирован дисбиоз кишечника, причем у 52,5% пациентов он протекал с клиническими симптомами (метеоризм, усиление перистальтики, нарушение стула, дискомфортные субъективные ощущения). После комплексного лечения в основной группе у 95% пациентов отмечалась нормализация содержания лактобактерий, бифидобактрий и Е. coli. Такая же тенденция наблюдалась и в отношении клинических симптомов дисбиоза. В группе сравнения достоверно значимых изменений количественного содержания лактобактерий, бифидобактрий и Е. coli не отмечалось (рис.1).
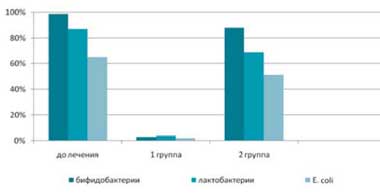
Рис. 1. Число пациентов с нарушением колониальной резистентности
до и после комплексного лечения, включающего применение Лактофильтрума ®
и традиционного медикаментозного лечения
Под влиянием комплексного лечения (1 группа) через 3 недели общие проявления всех объективных симптомов заболевания сохранялись в среднем лишь у 10% больных, в то время как в группе сравнения они были выражены в 54% случаев (рис. 2).
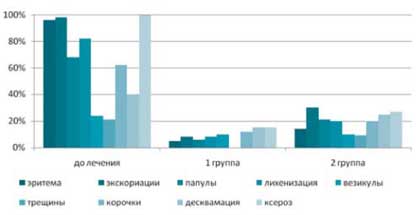
Рис. 2. Динамика регресса клинических симптомов у больных атопическим дерматитом под влиянием различных методов лечения
К концу лечения индекс ДИШС, отражающий тяжесть течения АтД, в основной группе снизился на 84%, в группе сравнения лишь на 53%. Анализ выраженности зуда с использованием опросника Behavioral rating scores (BRS) показал выраженное отрицательное влияние зуда на повседневную деятельность пациентов с АтД. Так, до лечения в 1-й группе значение BRS составило 7,1 ±0,4 баллов, во 2-й группе - 6,8±0,5 баллов. Уже через 1 неделю от начала лечения в 1-й группе отмечался более выраженный регресс субъективной симптоматики: снижение BRS на 55%, во 2-й группе - на 26%. К концу лечения в 1-й группе значение BRS составило 0,4±0,1 балла. В контрольной группе к концу лечения индекс снизился лишь на 58% (рис. 3). Эти данные находились в соответствии с показателями биохимических маркеров зуда (табл. 1).
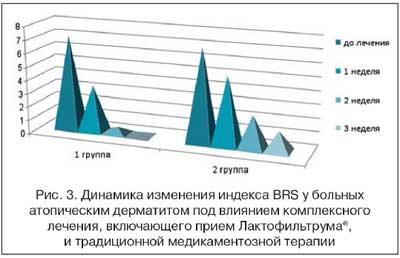
Таблица 1.
Динамика показателей гистамина и серотонина в сыворотке крови у больных АтД под влиянием комплексного лечения, включающего прием Лактофильтрума ® и традиционной медикаментозной терапии
| Изучаемый показатель | Контроль(n=20) | До лечения (n=40) | После лечения | |
|---|---|---|---|---|
| 1 группа (n=20) | 2 группа (n=20) | |||
| Серотонин (мкмоль/л) | 0,6±0,03 | 2,35±0,24Р1** | 0,81±0,32Р2*** | 1,46±0,22РГ**,РЗ* |
| Гистамин (мкмоль/л) | 0,8±0,06 | 2,14±0,62Р1** | 0,87±0,13Р2*** | 1,35±0,25Р1***,Р2** |
| Примечание: Р1 - сравнение с нормой; Р2 - сравнение с показателями до лечения; РЗ - сравнение с основной группой; *- р | ||||
Как видно из приведенных в таблице данных, после комплексной терапии, включающей применение Лактофильтрума ® отмечалось восстановление повышенных в исходном состоянии показателей серотонина и гистамина до нормальных значений - 0,81 ±0,32 и 0,87±0,13 (рВ процессе лечения с улучшением клинической картины заболевания пропорционально улучшались и показатели качества жизни (рис. 4). В результате анализа полученных данных, более выраженная положительная динамика дерматологического индекса качества жизни (ДИКЖ), особенно в первые дни терапии, была отмечена у пациентов 1 группы. Так, в первую неделю параметры ДИКЖ улучшились на 30% в 1 группе и лишь на 8% во 2 группе (рис. 5). К концу курса лечения ДИКЖ улучшился на 87 и 54% соответственно.
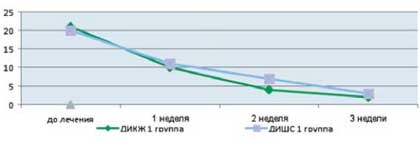
Рис. 4. Динамика изменения показателей, отражающих субъективные и объективные симптомы заболевания
у пациентов с АтД под влиянием комплексного лечения, включающего прием Лактофильтрума ®
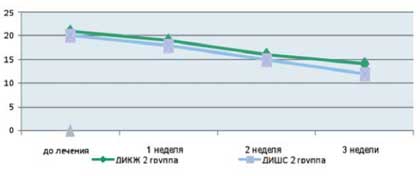
Рис. 5. Динамика изменения показателей, отражающих субъективные и объективные симптомы заболевания
у пациентов с АтД под влиянием традиционной медикаментозной терапии
Таким образом, по оценке самими пациентами эффективности и комфортности проводимого лечения, метод, включающий применение Лактофильтрума ® , является наиболее эффективным.
Выводы
Нарушение колониальной резистентости кишечника, приводящее к повышенной эндотоксинемии, аллергизации и нарушению гомеостаза, может отразиться на состоянии кожи и течении атопического дерматита.
Представители нормальной микрофлоры биоты кишечника выполняют физиологически важную функцию поддержания постоянства внутренней среды организма, принимают участие в формировании иммунобиологической реактивности макроорганизма. Нарушение нормоценозаспособствуетхронизации патологических процессов (в частности, атопического дерматита).
Включение препарата Лактофильтрум ® в комплекс терапии больных АтД приводит к более быстрому и выраженному регрессу кожных высыпаний и субъективных ощущений, нормализации функции биотопа кишечника, что в конечном итоге способствует значитель-номуулучшению качества жизни. Препарат не токсичен, не вызывает побочных эффектов, обладает высокой комплаентностью.
Литература
Клиническая картина многих заболеваний кишечника отягощается появлением внекишечных симптомов и осложнений.
Клиническая картина многих заболеваний кишечника отягощается появлением внекишечных симптомов и осложнений. Нарушенная кишечная флора обладает негативным воздействием на организм: усиливает кишечное брожение, выработку токсинов, канцерогенов, фенолов, аминов (гистамина, тирамина, пиперидина и др.). Высокий уровень экзогенного амина способствует аллергическим заболеваниям.
К внекишечным проявлениям нарушений барьерной функции кишечника относятся атопический дерматит (АД) и атопическая бронхиальная астма.
Нами было обследовано 59 детей в возрасте от 4 месяцев до 14 лет с АД и теми или иными проявлениями кишечной дисфункции. Помимо тщательного клинико-лабораторного обследования, всем детям проводился анализ кала на дисбактериоз до и после лечения, УЗИ органов брюшной полости, а также, по показаниям, ЭГДС и ирригография.
40 детей страдали различными заболеваниями кишечника. У 19 детей органическая патология со стороны кишечника не выявлена. Кишечную симптоматику у этих пациентов мы связывали с функциональными расстройствами и расценивали как синдром раздраженного кишечника (СРК). При этом 40,6% обследованных детей страдали дисбактериозом I степени, 37,2% детей — дисбактериозом II степени и 22,2% детей — дисбактериозом III степени.
В нашей практике для лечения дисбактериоза мы использовали: а) бифи-форм (фирма Ferrosan) — современный комбинированный пробиотик, содержащий натуральные бактерии двух видов: Bifidobacterium longum и Enterococcus faeceum, а также питательную среду для быстрого начального роста бактерий; препарат выпускается в кислотоустойчивых капсулах, благодаря чему без потерь преодолевает кислую среду желудка; б) аципол; в) наринэ в таблетированной форме; г) хилак-форте; д) примадофилус; е) КИП. Содержит иммуноглобулины трех основных классов (IgG, IgM, IgA).
Для оценки эффективности проводимой терапии мы проанализировали динамику клинических симптомов и показателей микрофлоры кишечника до и после лечения в трех группах детей с атопическим дерматитом.
В первую группу вошли 11 детей с СРК и дисбактериозом I-II степени, которые в течение семи дней получали бифи-форм, а затем наринэ от 10 до 14 дней. Вторую группу составили 12 детей с хроническим колитом и энтероколитом с давностью заболевания более года и дисбактериозом II-III степени. Курс бифи-форма у этих детей был продлен до двух недель, а начиная с 5-7 дня в терапию подключался хилак-форте или аципол на срок не менее одного месяца. В третью группу вошли дети с органическими и функциональными изменениями кишечника, дисбактериозом II-III степени и большим сроком заболевания. Первые 5-7 дней они получали комплекс иммунных препаратов, а затем хилак-форте или примадофилус сроком от одного до двух месяцев.
Практически у всех детей первой и второй группы по окончании курса лечения была выявлена отчетливая положительная динамика как со стороны желудочно-кишечной симптоматики, так и со стороны кожных проявлений. Клинический эффект сочетался с полным восстановлением облигатной флоры в 85-90% случаев и вытеснением факультативной флоры у 92% больных.
Сложнее дело обстояло в третьей группе, где нарушения микрофлоры кишечника у детей с атопическим дерматитом выявлялись на фоне длительного хронического воспалительного процесса в кишечнике, порой в сочетании с его аномалией.
Динамика клинических проявлений и показателей микрофлоры кишечника у этих детей имела более торпидный характер и требовала дальнейшего индивидуального подхода к выбору препаратов и сроков их применения.
Таким образом, подводя итоги вышеизложенного, можно сделать следующие выводы.
1. Атопическому дерматиту часто сопутствуют различные заболевания кишечника, сопровождающиеся дисбактериозом.
2. Тактика коррекции нарушений микробиоценоза кишечника зависит от степени дисбактериоза, характера кишечной патологии, возраста, длительности заболевания, выраженности атопических проявлений и сопутствующей патологии.
3. Бифи-форм является эффективным комплексным пробиотиком для лечения кишечных дисбактериозов, хорошо воспринимается, не дает побочных явлений (рвота, запоры, усиление аллергических проявлений), оказывает положительное влияние на баланс кишечной микрофлоры в короткие сроки (от пяти дней до двух недель).
4. Применение КИП при лечении дисбактериоза III степени у детей с АД показало его высокую эффективность как в купировании клинических проявлений, так и в восстановлении нормального состава кишечной флоры.
Читайте также:

