При повреждении кожи наблюдается свертывание крови коагуляция
Обновлено: 27.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гемофилия: причины появления, симптомы, диагностика и способы лечения.
Определение
Гемофилия является редким, но серьезным наследственным заболеванием, связанным с нарушением функции свертывания крови, что приводит к неконтролируемым и часто спонтанным кровотечениям и кровоизлияниям в различные органы и ткани. При гемофилии организм человека не может естественным способом остановить кровотечение, возникшее из-за повреждения кровеносного сосуда в результате травмы, хирургического вмешательства или стресса. Интенсивность кровотечения сопоставима с таковой у здорового человека, однако оно продолжается значительно дольше.
Кровь содержит много белков, называемых факторами свертывания, которые помогают остановить кровотечение. Существует два различных типа гемофилии. Каждый отличается дефицитом определенного фактора свертывания крови. Заболевание появляется в результате мутации гена фактора свертывания крови VIII (гемофилия А) или фактора свертывания IX (гемофилия В). Наиболее распространенным типом заболевания является гемофилия А, которая встречается у 80-85% больных гемофилией. В типичном случае человек с тяжелой формой гемофилии А страдает кровотечением 35 раз в год.
Тяжесть гемофилии определяется количеством фактора свертывания крови — чем он ниже, тем больше вероятность возникновения кровотечения, которое может привести к серьезным проблемам со здоровьем.
Гемофилия известна человечеству более 2000 лет. Первые сведения о заболевании содержатся в Талмуде, согласно которому мальчику не делали обрезание, если двое его старших братьев умерли из-за кровопотери, вызванной этой же манипуляцией.
Еще гемофилию называют «викторианской», или «царской» болезнью. Самой знаменитой носительницей рокового гена была английская королева Виктория. Российская императрица Александра Федоровна, будучи ее внучкой, унаследовала злосчастный ген и передала его единственному сыну императора Николая II – Алексею.
Причины появления гемофилии
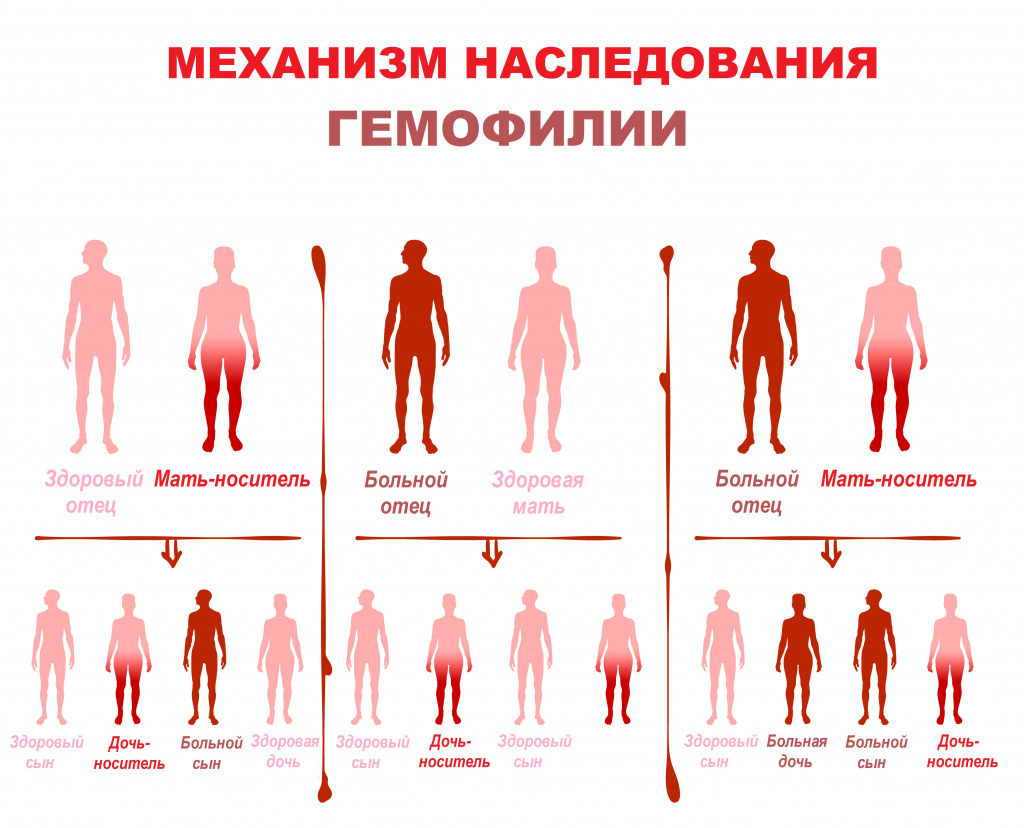
Заболевание передается от родителей к ребенку, хотя примерно в трети случаев вызвано спонтанной мутацией. Гены, кодирующие оба фактора свертывания крови, локализованы в Х-хромосоме. У женщин имеются две половые хромосомы ХХ. Хромосомный набор мужчин — ХY. При рождении девочек одна Х-хромосома наследуется от матери, а другая — от отца. Мужчина, больной гемофилией, имеет одну аномальную Х-хромосому и одну неповрежденную Y-хромосому. В случаях рождения мальчиков Y-хромосома наследуется от отца, а одна из Х-хромосом — от матери.
Сыновья мужчины, больного гемофилией, и здоровой женщины будут со 100% вероятностью здоровыми, а дочери — со 100% вероятностью носительницами гемофилии. В среднем, носительницы гемофилии будут иметь 30-50% от нормального уровня фактора свертывания.
Если женщина — носительница гемофилии имеет одну Х-хромосому здоровую, а другую аномальную, то от здорового мужчины у нее с равной долей вероятности могут родится как здоровые сыновья (50%), так и больные (50%) гемофилией, а дочери также с равной долей вероятности будут или здоровыми (50%), или носительницами (50%) гемофилии. Именно поэтому гемофилией страдают в основном пациенты мужского пола, которые наследуют пораженную X-хромосому от матери.
Дочери могут болеть гемофилией с вероятностью 25%, если она есть у отца, а мать – носительница гена. Но это случается крайне редко.
Классификация заболевания
Кодирование по Международной классификации болезней 10-го пересмотра:
- D66.0 – Наследственный дефицит фактора VIII.
- D67.0 – Наследственный дефицит фактора IХ.
- легкая – активность фактора 5-40% (0,05–0,40 МЕ/мл);
- средняя – активность фактора 1-5% (0,01–0,05 МЕ/мл);
- тяжелая – активность фактора менее 1% (менее 0,01 МЕ/мл).
- Типичные:
- гемартрозы крупных суставов 70-90%,
- гематомы (кровоизлияния в мышцы/мягкие ткани) 20-40%,
- кровотечения из слизистых (носовые, десневые, луночковые) 10%,
- гематурии 5-10%.
- в ЦНС – 5%,
- в ЖКТ – 5%,
- в области шеи/горла – 5%,
- забрюшинные гематомы – 5%.
Гемофилия средней тяжести имеет сходные проявления. Первые признаки, как правило, манифестируют после года. У пациентов с активностью факторов более 2% реже возникают кровоизлияния в суставы, забрюшинные гематомы и гематурии. Наиболее типичны посттравматические гематомы и длительные кровотечения, особенно при травмах слизистых оболочек.
Геморрагический синдром обычно возникает вследствие значительных травм или в результате хирургического лечения. Поражение опорно-двигательного аппарата встречается чрезвычайно редко.
Общие признаки гемофилии:
- длительные кровотечения после травм;
- внутрисуставные кровотечения, вызывающие отек и боль;
- кровоизлияние в кожу (гематомы) или мышцу и мягкие ткани;
- десневые кровотечения, которое трудно остановить после удаления или потери зуба;
- постинъекционные кровотечения;
- кровь в моче или кале;
- частые и трудно останавливаемые носовые кровотечения.
Диагностика гемофилии начинается с выявления наличия геморрагического синдрома в анамнезе у пациента и членов семьи. Сбор жалоб и анамнеза вкупе с физикальным осмотром позволяют определить необходимый объем обследования пациента.
Лабораторная диагностика
Рекомендуется проведение поэтапного лабораторного коагулологического исследования с целью верификации диагноза и исключения приобретенного дефицита фактора VIII или IX, а также исключения дефицита других факторов свертывания крови.
В качестве первого этапа выполняют коагулологический скрининг, в ходе которого определяются следующие показатели:
-
активированное частичное тромбопластиновое время;
АЧТВ – скрининговый тест для оценки внутреннего пути активации свертывания крови (факторы XII, XI, IX, VIII, X, V и II) и мониторинга пациентов, получающих гепариновую терапию. Синонимы: Анализ крови на АЧТВ; Активированное парциальное тромбопластиновое время; Кефалин-каолиново.
Синонимы: Анализ крови на протромбин; Протромбин; Протромбиновое время; Протромбиновый индекс; Международное нормализованное отношение; МНО; Фактор свертывания крови II. Prothrombin; PT; Protime; INR; International normalized ratio; Coagulation Factor II; FII. Краткое описание исследования Прот.
Синонимы: Анализ на тромбиновое время; ТВ; Антитромбин I. Thrombin Clotting Time (TCT); TT; Antithrombin I (AT I). Краткое описание исследования «Тромбиновое время» Тромбиновое время − это время, в течение которого происходит превращение фибриногена в фибрин в.
Фибриноген – белок, предшественник фибрина, составляющего основу сгустка при свертывании крови. Исследование направлено на оценку способности организма к тромбообразованию и выявлению связанных с этим процессом нарушений. Синонимы: Анализ крови на фибриноген; Фибриноген; Фактор I (первый).
Синонимы: Анализ крови на тромбоциты; Тромбоциты, микроскопия (метод Фонио). Manual Platelet Count (PLT count): Indirect Method by Fonio. Краткое описание исследования «Тромбоциты, микроскопия (подсчет в окрашенном мазке по методу Фонио)» Тромбоциты – м.
-
активность факторов VIII, активность факторов IX;
Синонимы: Фактор свертывания VIII; Антигемофилический фактор (АГФ); Антигемофильный глобулин. Factor VIII Coagulant Activity (VIII); Coagulation Factor VIII; Factor VIII Activity Blood Test; Antihemophilia Factor A Test; AHF, Factor VIII; Antihaemophilic globulin. Краткая характери.
Синонимы: Фактор свертывания крови IX; Антигемофильный глобулин B. Factor IX (FIX, Christmas Factor) Activity; Coagulation Factor IX Activity; Blood Clotting Factor 9 Activity; Factor IX Activity; Antihemophilic factor IX. Краткое описание исследования «Фактор свертывания IX.
Синонимы: Фактор фон Виллебранда, антиген; Антиген фактора Виллебранда; von Willebrand Factor (vWF) Antigen Test; VWF Antigen. Краткое описание исследования «Фактор Виллебранда, антиген» Фактор Виллебранда (ФВ) – сложный мультимерный белок, который син.
Синонимы: Аутоантитела (IgG) против фосфолипидов; Lupus anticoagulant panel; Lupus inhibitor; LA sensitive PTT; PTT-LA; Dilute Russell viper venom test; DRVVT; Modified Russell viper venom tes; MRVVT. Краткая характеристика теста «Волчаночный антикоагулянт» Волчано.
Для исключения приобретенных дефицитов факторов VIII или IX требуется молекулярно-генетическая диагностика.
Исследование мутаций фактора IX при гемофилии B. Тип наследования. Х-сцепленный рецессивный. Гены, которые контролируют выработку FVIII или FIX , находятся в Х-хромосоме. Так как мужчины имеют только одну Х-хромосому, при мутациях соответствующего гена буде.
Инструментальная диагностика позволяется визуализировать кровотечения/кровоизлияния различных локализаций, а также выявить осложнения, развившиеся в результате геморрагических проявлений. По показаниям проводятся следующие обследования:
Исследование слизистой оболочки верхнего отдела желудочно-кишечного тракта с возможностью выполнения биопсии или эндоскопического удаления небольших патологических образований.
Ультразвуковое сканирование структуры крупных суставов и определение их функциональной активности.
Сканирование внутренних органов брюшной полости для оценки его функционального состояния и наличия патологии.
Комплексное ультразвуковое сканирование органов мочевыделительной системы, позволяющее обнаружить патологию на ранних стадиях развития.
Безопасное и информативное сканирование структур головного мозга для диагностики его патологий.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
Лечением больных гемофилией занимается врач-гематолог. Для подтверждения наличия геморрагических проявлений или их последствий также рекомендуется проведение консультации специалистов. По показаниям возможны консультации:
- неонатолога или врача-педиатра ;
- врача-генетика;
- травматолога-ортопеда;
- хирурга ;
- уролога ;
- невролога ;
- оториноларинголога ;
- стоматолога.
Гемофилия является неизлечимым заболеванием, поэтому основная цель терапии – купирование симптомов. Главный принцип лечения – специфическая заместительная терапия концентратами факторов свертывания. Концентраты фактора производятся либо из человеческой плазмы (плазматические), либо они генетически модифицированы (рекомбинантные).
Если препараты произведены из плазмы, принимается ряд мер, чтобы убедиться в том, что в продукте отсутствует вирусная инфекция, и что пациенты не заразятся такими вирусами, как гепатит С или ВИЧ. С этой целью применяются строгие критерии к выбору доноров плазмы. Кроме того, производители разработали различные методы по очищению и дезактивации вирусов во время производственного процесса препаратов крови. Тем не менее, пациентам следует знать, что есть теоретическая вероятность заражения через использование препаратов плазмы.
Рекомбинантные препараты создают из живых клеток, таких как моноклональные антитела. Они считаются технологически более продвинутыми и несут меньший риск вирусного заражения.
В настоящее время нет оснований для предпочтительного выбора между плазматическими или рекомбинантными препаратами.
Концентраты факторов свертывания крови вводятся внутривенно. Однако примерно у 30% пациентов с тяжелой гемофилией организм начинает вырабатывать антитела, что крайне затрудняет лечение, а в некоторых случаях делает его невозможным.
Существует два вида специфической терапии – профилактическая и лечение по факту возникновения кровотечений (по требованию). Во всех случаях рекомендовано сразу использовать достаточную дозу и соблюдать кратность введения препарата.
Для лечения гемофилии среди более новых лекарственных средств можно отметить фитусиран (снижает выработку природного антикоагулянтного белка – антитромбина) и концизумаб (увеличивает выработку тромбина). Генная терапия с использованием аденовирусного вектора для доставки гена фактора VIII или IX также подвергается клиническим испытаниям.
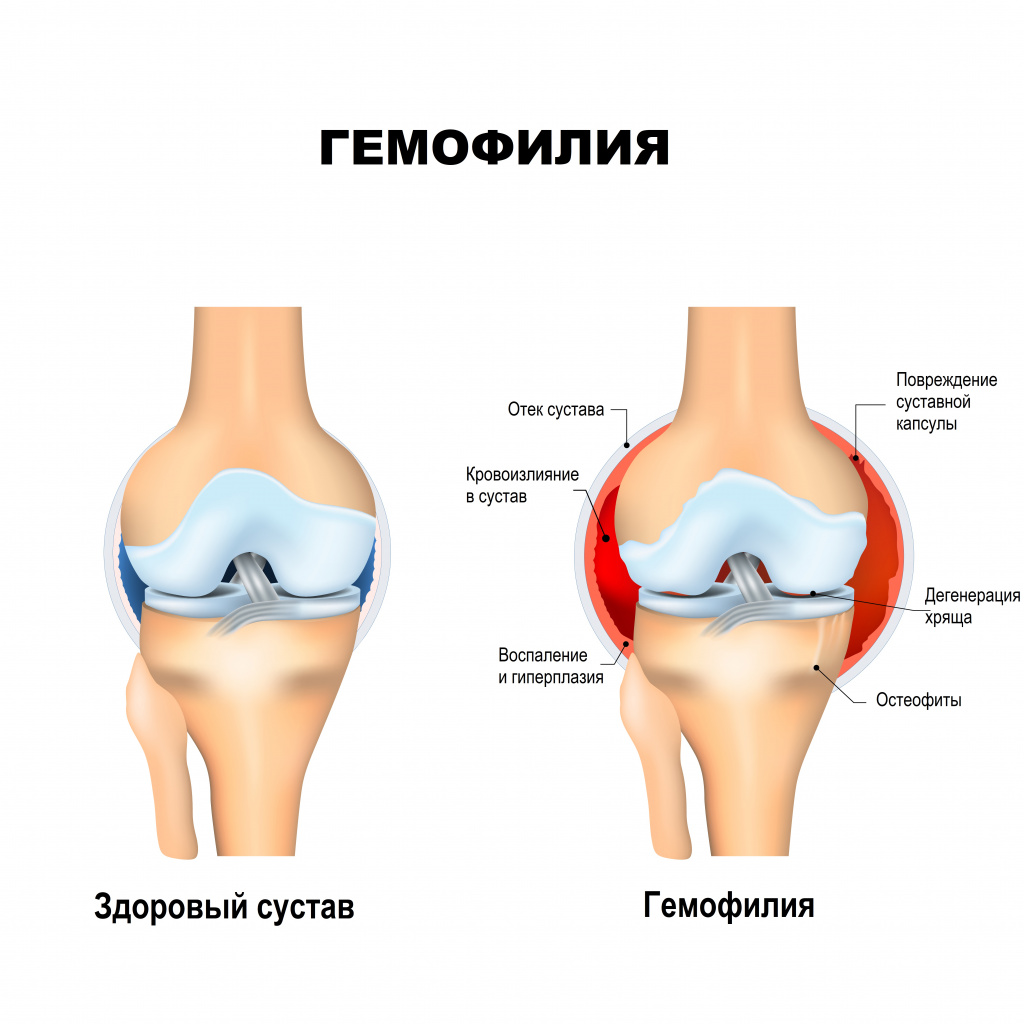
Серьезные осложнения встречаются при тяжелой и умеренной гемофилии и чаще всего проявляются в виде разрушений суставов и развития артрита. Кровотечения в сустав приводят к разрушению его нормальных тканей и развитию хронического артрита, очень болезненного и приводящего к нарушению функции сустава. Кровоизлияния в суставы отмечаются и у детей с 2-3 летнего возраста. Чаще всего поражаются крупные суставы – коленные, локтевые, голеностопные. Если кровотечение продолжается, то крайне высок риск инвалидизации и ограничения движения в суставе (в худшем случае человек может потерять конечность).
![Сустав.jpg]()
Помимо негативного влияния на качество жизни человека, кровоизлияния нередко становятся жизнеугрожающими, если происходят в жизненно важных органах, например, в мозге.
Профилактика гемофилии
Профилактическая заместительная терапия концентратами факторов свертывания крови – необходимое условие сохранения физического и психологического здоровья пациентов с тяжелой и среднетяжелой гемофилией. Профилактическое лечение обычно назначается детям, чтобы снизить риск кровотечений и повреждений суставов. В последнее время с этой же целью профилактику стали назначать и пожилым людям. Профилактика предполагает вливание фактора свертывания крови на регулярной основе (через день), чтобы сохранить нормальное свертывание крови у больного и предотвратить спонтанные кровотечения.
Детей с гемофилией необходимо оберегать от травм, предотвращать удаление зубов путем тщательной санации полости рта и квалифицированной стоматологической помощи.
Пациентам перед оперативным вмешательством или удалением зуба проводят заместительную терапию фактором (предпочтительно с использованием рекомбинантного препарата).
Молодые люди должны осознать, что поддержание физической активности очень важно для укрепления мышц, связок и суставов. Мышечная слабость, плохая координация движений значительно повышают вероятность травмы сустава и последующего развития воспаления (артрита). Хорошая физическая форма, крепкий мышечный каркас снижают риск спорадических кровотечений. Оптимальный вид спорта для людей, страдающих гемофилией, – плавание.
Людям с гемофилией рекомендуется носить на себе медальон с информацией о болезни. Это может спасти жизнь в критической ситуации.
Для профилактики кровотечений больные гемофилией должны избегать применения аспирина и нестероидных противовоспалительных препаратов, поскольку они замедляют тромбоцитарную функцию.
Прививки для больного гемофилией не представляют большой опасности. Более того, в список обязательных входит вакцина против гепатита В. Большинство лекарственных препаратов все же следует принимать перорально из-за опасности кровотечения при внутримышечном введении.
- Клинические рекомендации «Гемофилия». Разраб.: Национальное гематологическое общество, Национальное общество детских гематологов и онкологов. – 2018.
- Румянцев А.Г., Румянцев С.А., Чернов В.М.. Гемофилия в практике врачей различных специальностей // – Москва. – 2012. – 132 с.
- Canadian Hemophilia Society. What is hemophilia? 2016. Last accessed 08 June 2016 .
- WFH. Guidelines for the management of hemophilia. 2012. Last accessed July 2019 .
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Закрытие мелких повреждений в сосудах. Основная теория свертывания крови
а) Важность тромбоцитарного механизма для закрытия мелких повреждений в сосудах. Механизм формирования тромбоцитарной пробки очень важен для закрытия мельчайших разрывов в мелких кровеносных сосудах, которые появляются много тысяч раз ежедневно. Действительно, множество мелких дырочек в самих эндотелиальных клетках часто закрываются тромбоцитами, которые буквально сливаются с эндотелием, формируя дополнительную мембрану эндотелиальной клетки. У человека с низким содержанием тромбоцитов в крови ежедневно появляются буквально тысячи точечных кровоизлияний под кожей и во всех внутренних тканях, но этого не случается у людей с нормальным содержанием тромбоцитов в крови.
б) Свертывание крови в разорванном сосуде. Третьим механизмом гемостаза является формирование кровяного сгустка. Он начинает развиваться через 15-20 сек при серьезной травме сосудистой стенки, и через 1-2 мин — при незначительной. Запускают процесс свертывания покрывающие место повреждения вещества-активаторы, выделяющиеся из стенки травмированного сосуда, кровяных пластинок и белков крови. Физические явления этого процесса показаны на рисунке ниже, а в таблице перечислены наиболее важные факторы свертывания.
Процесс свертывания в травмированном сосуде
Если отверстие в сосудистой стенке не слишком велико, в течение 3-6 мин после повреждения сосуда все отверстие или разорванный конец сосуда заполняются сгустком крови. Через 20-60 мин происходит ретракция (сжатие) сгустка; это способствует дальнейшему закрытию сосуда. В ретракции сгустка важную роль играют также тромбоциты.
в) Фиброзная организация или растворение кровяного сгустка. После формирования кровяного сгустка возможны два пути его дальнейшего развития: (1) заполнение сгустка фибробластами, которые в дальнейшем формируют соединительную ткань на всем протяжении сгустка; (2) растворение сгустка. При небольшом отверстии в сосудистой стенке сгусток обычно заполняется фибробластами через нескольких часов после его формирования (этому способствует, по крайней мере, частично, фактор роста, секретируемый тромбоцитами). Процесс продолжается в течение примерно 1-2 нед вплоть до полной организации сгустка в фиброзную ткань.
Наоборот, если в ткань вытекло много крови и образовались сгустки там, где в них нет необходимости, внутри самого сгустка обычно активируются особые вещества, функционирующие как ферменты, растворяющие сгусток. Подробнее это изложено далее.
Механизм свертывания (коагуляции) крови
Основная теория. В крови и тканях обнаружены более 50 веществ, вызывающих свертывание крови или влияющих на него. Одни из них способствуют свертыванию и их называют прокоагулянтами, другие — тормозят этот процесс и их называют антикоагулянтами. Останется ли кровь жидкой или произойдет ее коагуляция, зависит от баланса между этими группами веществ. В нормальном кровотоке преобладают антикоагулянты, поэтому кровь, циркулирующая в кровеносных сосудах, не свертывается. Но при разрыве сосуда прокоагулянты из области повреждения ткани активируются и перекрывают действие антикоагулянтов, что способствует образованию сгустка.
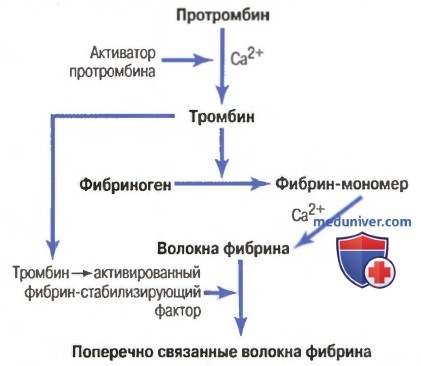
Основные этапы коагуляции крови. Все исследователи, занимающиеся проблемой свертывания крови, согласны с тем, что в основе свертывания лежат три основных процесса: (1) в ответ на разрыв сосуда или повреждение самой ткани в крови происходит сложный каскад химических реакций с участием более дюжины факторов свертывания крови. Итогом этого каскада является образование комплекса активированных веществ, в совокупности называемых активатором протромбина; (2) активатор протромбина катализирует превращение протромбина в тромбин; (3) тромбин действует как фермент, превращающий фибриноген в нити фибрина, формируя сгусток, внутрь которого захватываются кровяные пластинки, клетки крови и плазма.
Начнем с обсуждения механизма формирования самого сгустка крови, а именно: с превращения протромбина в тромбин; затем вернемся к начальным стадиям процесса свертывания, в результате которых образуется активатор протромбина.
![Закрытие мелких повреждений в сосудах. Основная теория свертывания крови]()
Схема превращения протромбина в тромбин и полимеризации фибрина с формированием волокон фибрина
Видео физиология остановки кровотечения (гемостаза) - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Острая кровопотеря при ранениях - причины, механизмы
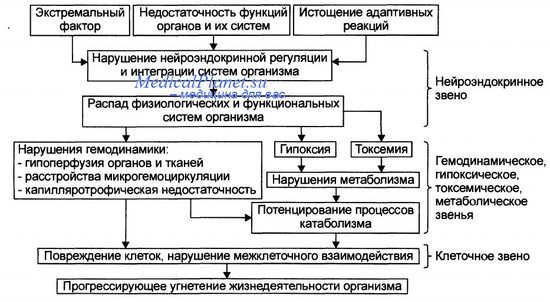
Острая кровопотеря приводит к глубоким изменениям гемодинамики и запускает сложнейшие механизмы компенсации гиповолемии и нарушений гемостаза.
Снижение ОЦК приводит к возбуждению симпатоадреналовой системы. В частности, выброс катехоламинов увеличивается в 300 раз, что приводит к повышению тонуса венозной системы и развитию феномена централизации кровообращения. Механизм централизации кровообращения срабатывает в интересах жизненно важных органов, питание которых в условиях стресса должно поддерживаться в первую очередь (мозг, сердце, легкие).Клинически это выражается в тахикардии и тахипноэ. При кровопотере от 45 до 60% ОЦК частота сердечных сокращений возрастает до 120-130 в минуту, что позволяет поддерживать минутный объем. Однако длительный и выраженный спазм прекапиллярных артериальных сфинктеров и посткапиллярных венул приводит к снижению кровотока в почках, печени, мышцах, накоплению в них недоокисленных продуктов обмена и вазоактивных веществ.
При частоте сердечных сокращений более 150 в минуту вследствие уменьшения длительности диастолы снижается наполнение желудочков и сердечный выброс.Прекапиллярная и посткапиллярная вазоконстрикция приводит к резкому нарушению микроциркуляции и ухудшению реологических свойств крови. Гемоконцентрация в условиях метаболического ацидоза способствует образованию сладжей из форменных элементов крови, что полностью блокирует микроциркуляторное русло, выключая его из кровотока. Такая секвестрация кровотока приводит к еще большему снижению объема циркулирующей крови и прогрессированию гипоксии.
Острая кровопотеря запускает механизм гиперкоагуляции, направленный на формирование тромбов в зоне повреждения сосуда, однако продолжающаяся кровопотеря вскоре приводит к коагулопатии потребления, и как следствие -- развитию синдрома диссеминированного внутрисосудистого свертывания на фоне неуправляемой гипокоагуляции. Циркуляторная и тканевая гипоксия усугубляется вследствие анаэробного гликолиза, а метаболический ацидоз приводит в конечном итоге к параличу микроциркуляторного русла.
На смену централизации кровообращения приходит эффект децентрализации — несмотря на тахикардию, возникает стойкая гипотония, снижается диурез. Наступает следующая стадия компенсации — гемодилюция. Артериальная гипотензия приводит к повышению секреции ренина, действие которого направлено на поддержание артериального давления, а также альдостерона, ответственного за экскрецию электролитов и проницаемость сосудистой стенки. В результате начинается усиленное поступление интерстициальной жидкости в сосудистое русло.
При этом гемодилюция происходит уже в течение 1—1,5 ч от начала кровотечения. Положительное влияние гемодилюции выражается в увеличении объема циркулирующей плазмы, улучшении реологических свойств крови, микроциркуляции и стабилизации центральной гемодинамики.
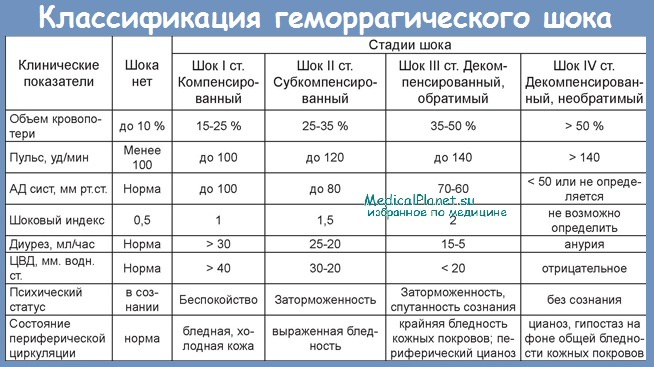
![классификация геморрагического шока]()
Однако при неостановленном кровотечении или при отсутствии восполнения кровопотери прогрессивно уменьшается сердечный выброс, нарастают гипоксия и отек альвеолярной ткани, прекращается продукция сурфактанта, что приводит к развитию острого респираторного дистресс-синдрома.
Снижение общего белка, глобулинов, фибриногена, фибронектина и других плазменных белков уменьшает пластический и репаративный потенциал тканей и снижает устойчивость к бактериальной агрессии.
Нарушения микроциркуляции ведут к повышению проницаемости стенки кишечника и нарушению его барьерной функции, следствием чего является транслокация бактерий вместе с эндотоксинами в кровь.
Объем кровопотери достигает такого уровня, что всеобъемлющий спазм каппиляров и артериол не в состоянии компенсировать возникшую гиповолемию. Исследования гемодинамики в условиях эксперимента показывают, что, несмотря на наличие централизации кровообращения, венозный возврат к сердцу не возрастает, сердечный выброс падает, артериальное давление снижается, напряжение кислорода в миокарде и ткани мозга падает на 50%. Перераспределение циркулирующей крови приводит к резкому снижению кровоснабжения внутренних органов, кожи и скелетной мускулатуры (примером служат неокклюзионные некрозы кишечника), в то же время создать благоприятные условия для деятельности мозга, сердца, печени уже не удается.
Развивается тяжелая гипоксия органов и тканей, а это приводит к накоплению в них вазоактивных веществ (в первую очередь — гистамина), что вызывает паралич микрососудистого русла. Вместо спазма возникает их расширение и переполнение застойной кровью, что резко увеличивает степень гиповолемии.
В условиях декомпенсации кровообращения извращается транскапиллярный обмен — жидкость из капилляров устремляется в ткани. Повышение проницаемости стенок капилляров приводит к выхождению в межклеточное пространство не только жидкости, но и мелкодисперсных белков. Наличие этих белков повышает коллоидно-осмотическое давление в тканях, что приводит к еще более быстрому перемещению жидкости из крови в ткани. В результате уменьшается объем циркулирующей плазмы, повышается вязкость крови с образованием сладжей, а в тканях и органах наблюдается гипергидратация. Нарушение функции почек способствует задержке в организме ионов натрия и еще большей задержке воды.
Механизм естественной гемодилюции в таких условиях не срабатывает, а превращается в свою противоположность.Стадия декомпенсации геморрагического шока
![стадия декомпенсации геморрагического шока]()
Гипергидратация особенно опасна для легких. Дело в том, что в микроциркуляторном русле легких отсутствует эластическая соединительная ткань, как в других органах, и поступление жидкости в интерстиций ничем не сдерживается. Это резко ухудшает диффузию кислорода через альвеолярно-капиллярную мембрану и приводит к гипоксической (а не только циркуляторной)гипоксии.
После полного исчерпания всех возможных компенсаторных механизмов начинает быстро прогрессировать гипоксия мозга с нарушением микроциркуляции и возникновением в ткани мозга вторичных очагов ишемии. При отсутствии лечения наступает смерть.
Изменения центральной гемодинамики при ранениях различной локализации в подавляющем большинстве наблюдений стереотипны и зависят в основном от степени кровопотери. Однако при ранениях груди с повреждением легких, наличием большого гемоторакса, ранении сердца имеются специфические особенности гемодинамических нарушений.
В частности, при ранениях легкого или большом гемотораксе отмечено снижение показателей ударного объема, ударного индекса, увеличение числа сердечных сокращений и периферического сосудистого сопротивления. Сравнение распределения вариантов гемодинамики выявляет различия в степени кардиореспираторных нарушений при ранениях груди без большого гемоторакса и с большим гемотораксом. Гипер- и нормокинетические варианты гемодинамики наблюдаются у пациентов в удовлетворительном состоянии, без большого гемоторакса, в то время как при большом гемотораксе показатели центральной гемодинамики относятся к гипокинетическому варианту.
Исследование центральной гемодинамики, проведенное в НИИ скорой помощи им. Н. В. Склифосовского О.В. Никитиной у 120 пациентов с ранениями сердца, показало, что в первые сутки после ранения и хирургического вмешательства ударный минутный объем и конечный диастолический объем левого желудочка при ранениях правого желудочка сердца был статистически значимо ниже, чем при ранениях левого желудочка. У всех обследованных пациентов отмечалось увеличение конечного диастолического размера правого желудочка, которое было максимальным при ранениях правого предсердия. Конечный диастолический размер правого желудочка при его ранениях составил в среднем 3,1+0,3 см, левого желудочка -2,7+0,2 см, перикарда — 2,9±0,3 см.
В целом у пациентов с ранениями правых отделов сердца увеличение конечного диастолического размера правого желудочка более 3 см встречалось в 2 раза чаще, чем при ранениях левых отделов. Дилатация правого желудочка при его конечном диастолическом размере более 3 см приводила к снижению конечного диастолического объема левого желудочка, ударного и минутного объемов.
Анализ взаимосвязи показателей центральной гемодинамики с объемом кровопотери и объемом инфузионной терапии показал, что инфузионная терапия на догоспитальном и интраоперационном этапах, превосходившая по объему общую кровопотерю в 2-3 раза, является одним из факторов, способствующих развитию острой сердечной недостаточности, в первую очередь правожелудочковой недостаточности. В частности, если у этих пациентов при кровопотере менее 2 л объем интраоперационной инфузии составлял 300-600% от объема кровопотери, то с ростом кровопотери при абсолютном росте объема инфузионной терапии ее относительный рост к объему кровопотери снижался до 100-200%.
В последнем случае увеличение конечного диастолического размера правого желудочка было небольшим, а конечный диастолический объем левого желудочка, ударный и минутный объемы сохранялись на высоком уровне. Чем больше объем инфузии превышал объем кровопотери, тем больше страдала центральная гемодинамика, особенно у пострадавших с ранениями правого желудочка.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гемостаз. Механизмы свертывания крови. Тромбоцитарный гемостаз. Тромбоцитарная реакция. Первичный гемостаз.
Тромбоцитарная реакция, т. е. реакция тромбоцитов на нарушение целостности сосудистой стенки, формируется параллельно реакции самих сосудов на повреждение — их сокращение в месте повреждения, вызывающее шунтирование крови выше поврежденного участка сосуда.
![Гемостаз. Механизмы свертывания крови. Тромбоцитарный гемостаз. Тромбоцитарная реакция.]()
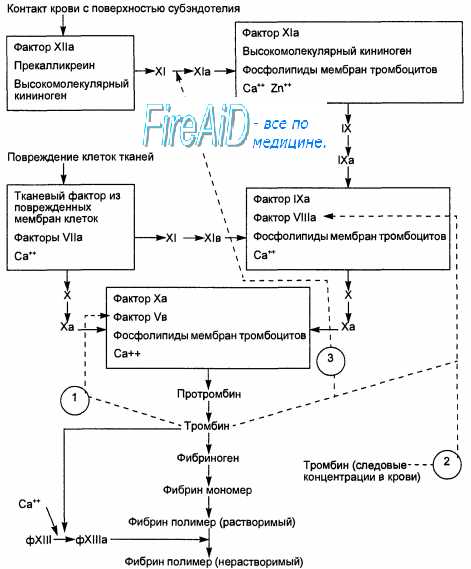
Рис. 7.8. Схема формирования коагуляционного гемостаза. 1 — активация тромбином ф.V; 2 — активация тромбином ф-VIII, высвобождаемого из связи с ф.Вилленбранта; 3 — активация тромбином ф.ХI. Контакт крови с поверхностью субэндотелия активирует «внутренний» путь свертывания крови; контакт крови с поврежденными клетками ткани активирует «внешний» путь активации свертывания крови.
Данная сосудисто-тромбоцитарная реакция на повреждение сосудистой стенки первой останавливает кровотечение из микрососуда и поэтому называется сосуди-сто-тромбоцитарным, или первичным, гемостазом. Формирование и закрепление тромбов с помощью плазменных факторов свертывания называют вторичным коагуляционным гемостазом. Первая волна агрегации тромбоцитов начинается с приклеивания тромбоцитов рецепторами гликопротеинов I и II к фактору Виллебранда, фибронектину и коллагену субэндотелия поврежденных тканей. Вторая волна агрегации тромбоцитов вызвана высвобождением АДФ из плотных гранул тромбоцитов, образованием тромбоксана А2 в их мембране, взаимодействием мембранных гликопротеинов IIb и IIIа с фибриногеном, а V — с тромбином. Но в основном вторую волну агрегации тромбоцитов обеспечивают тромбоксан А2 и тромбин.
Мощным стимулом для образования тромбоксана А2 в мембране тромбоцита являются коллаген и фактор Виллебранда, активирующий фосфолипазу А2. Сильный агрегационный эффект оказывает тромбин, который образуется на мембране тромбоцитов при участии фактора V и гликопротеина V. Ад-гезированные тромбоциты являются основой для агрегации, т. е. приклеивания к ним тромбоцитов, приносимых с кровью к участку поврежденного сосуда. В ходе агрегации тромбоцитарный тромб уплотняется и сокращается. Его формирование усиливается с образованием фибрина (фибринового тромба) вследствие активации плазменной системы свертывания крови (рис. 7.8).
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Тромбоцитопения: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
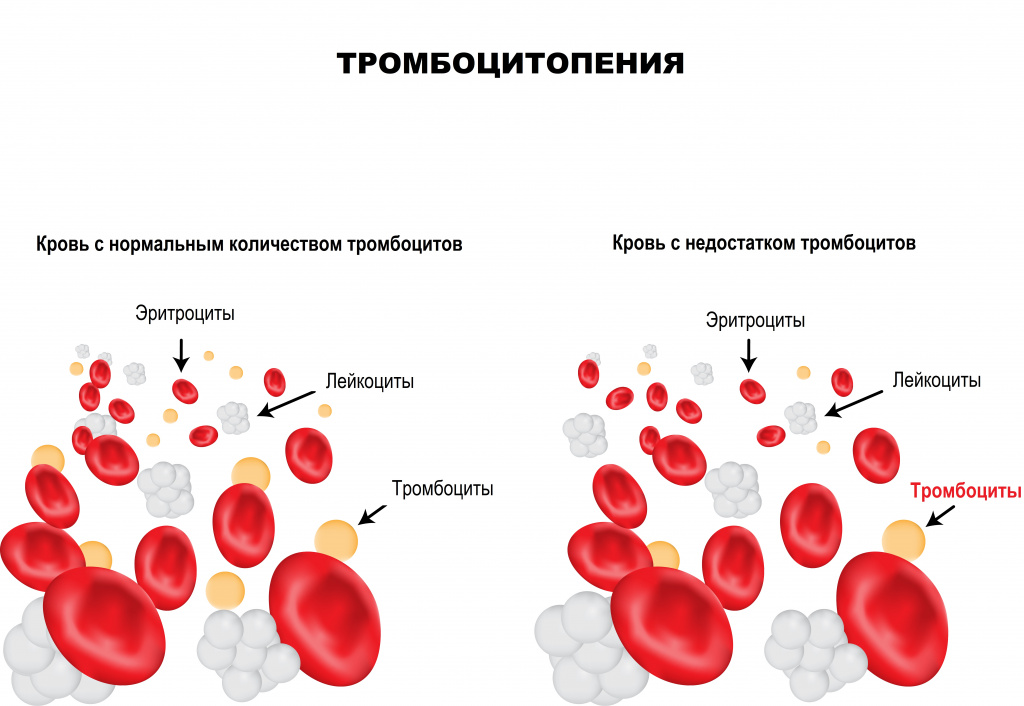
Тромбоциты – клетки крови, имеющие форму пластинки, которые участвуют в процессах свертывания крови. Их основная функция – закрытие раны при кровотечении путем образования тромба, или сгустка крови. Тромбообразование является естественным процессом защиты от массивной кровопотери при любых травмах. Дефицит тромбоцитов в крови называется тромбоцитопенией. Данное состояние достаточно часто протекает бессимптомно, однако может являться опасным для жизни при значительном уменьшении числа тромбоцитов крови.
![Тромбоцитопения.jpg]()
Помимо остановки кровотечения (гемостаза), тромбоциты выполняют ряд важных функций в организме человека: выделение веществ, суживающих сосуды при кровотечении; стимуляция восстановления тканей при любой травме; регулирование процессов местного воспаления и иммунитета.
Эти функции активизируются при любом повреждении эндотелия (внутреннего слоя, покрывающего стенки сосудов). Недостаток тромбоцитов приводит к нарушению системы свертывания крови и, как результат, повышенной кровоточивости, гематомам (синякам) и темно-красной сыпи на коже и слизистых (при надавливании такая сыпь не исчезает).
Продолжительная кровоточивость десен, большой объем кровотечений из маленьких ран и при менструациях – тревожный сигнал, говорящий о возможной проблеме системы свертывания крови.
Разновидности тромбоцитопении
Под тромбоцитопенией понимают уменьшение количества тромбоцитов в периферической крови ниже 150 тыс./мкл. Среди всех тромбоцитопений выделяют следующие состояния:- Тромбоцитопения разведения – возникает при массивных кровотечениях и восполнении объема циркулирующей крови растворами.
- Тромбоцитопения распределения – часто возникает при избыточной патологической утилизации тромбоцитов в увеличенной селезенке.
- Продуктивная тромбоцитопения – возникает при нарушении функции костного мозга в результате различных заболеваниях или лучевой терапии.
- Тромбоцитопения потребления – возникает при ДВС-синдроме (диссеминированном внутрисосудистом свертывании крови – патологическом состоянии, когда образуются тромбы в кровеносном русле многих органов) или при постоянном аутоиммунном повреждении эндотелия сосудов. Происходит патологическая активация тромбоцитов и их быстрое расходование (потребление) организмом.
- Псевдотромбоцитопения – возникает при нарушении техники проведения анализа с развитием агрегации тромбоцитов.
Одной из частых причин тромбоцитопении является избыточное потребление тромбоцитов в организме, например, при ДВС-синдроме.
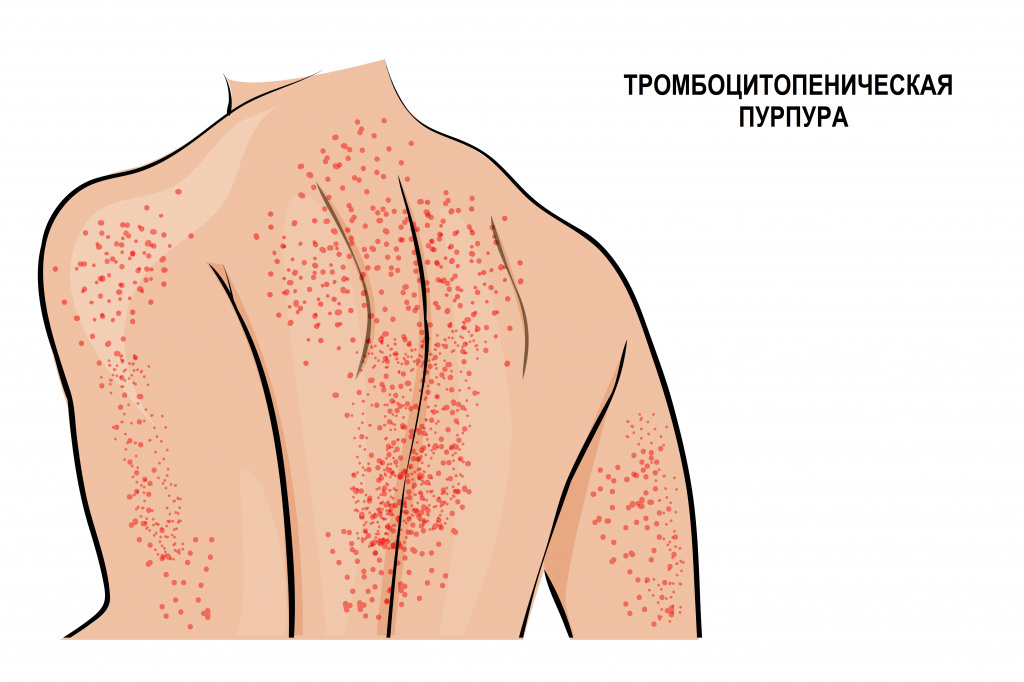
Иммунная форма тромбоцитопении считается самой частой иммунной патологией крови. Развивается быстро, с подъемом температуры тела и появлением обильной сыпи на коже нижних конечностей, ягодиц, вокруг крупных суставов, иногда достигая лица. Сыпь представляет собой мелкие кровоизлияния в кожу, часто сопровождается болью в суставах, отеками и нарушением движения в пораженных суставах. Иногда проявляется схваткообразной болью в животе, тошнотой, рвотой и жидким стулом. Описаны случаи появления крови в моче.
![Пурпура.jpg]()
Аутоиммунная тромбоцитопения (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) вызвана уменьшением продолжительности жизни тромбоцитов из-за воздействия антитромбоцитарных аутоантител. Такая тромбоцитопения может протекать волнообразно – с чередованием периодов обострения и ремиссии. Нередко заболевание дает о себе знать на фоне инфекционных заболеваний: гриппа, вируса иммунодефицита человека (ВИЧ), вируса Эпштейна–Барр (ВЭБ), парвовируса В19, цитомегаловирусной инфекции (ЦМВ), вирусных гепатитов В и С.
Среди продуктивных тромбоцитопений особое место занимают апластические анемии, опухолевые процессы в костном мозге, лучевые поражения.
Для всех перечисленных состояний характерно резкое снижение гемопоэтической (кроветворной) функции костного мозга за счет тех или иных структурных изменений.
Апластическая анемия характеризуется уменьшением продукции всех трех ростков кроветворения: эритроцитов, лейкоцитов и тромбоцитов. Каждый росток отвечает за определенные функции в организме, и уменьшение производимых клеток приводит к появлению соответствующих симптомов. Уменьшение тромбоцитов ведет к повышенной кровоточивости, снижение количества эритроцитов говорит о признаках анемии (бледность, утомляемость, ломкость волос, боль за грудиной), а уменьшение лейкоцитов ведет к инфекционным осложнениям в виде рецидивирующих ангин, пневмоний и др. В некоторых случаях костный мозг замещается жировой тканью, что также нарушает образование клеток крови.
При В12- и фолиеводефицитной анемиях происходит нарушение созревания будущих тромбоцитов, они погибают еще до стадии созревания. Заболевание проявляется бледностью кожи, учащенным сердцебиением, одышкой. При выраженном дефиците витамина В12 возможны нарушение чувствительности, парезы и параличи.
Различные виды лейкозов приводят к появлению опухолевых клеток, которые делятся с огромной скоростью и вскоре замещают собой костный мозг. При этом нарушается функция всех трех ростков кроветворения. В костном мозге и крови появляются незрелые клетки, неспособные выполнять свою функцию.
Медикаментозная тромбоцитопения может развиться в результате приема некоторых лекарственных препаратов, например, цитостатиков, которые угнетают образование тромбоцитов в костном мозге.
Заболевания, сопровождающиеся увеличением размера селезенки (спленомегалией), способны привести к повышенному разрушению тромбоцитов, или гиперспленизму (увеличению утилизации тромбоцитов селезенкой). Помимо тромбоцитов также разрушаются эритроциты, что ведет к развитию не только тромбоцитопенического состояния, но и к гемолитической анемии.
К таким заболеваниям относят цирроз печени, в том числе алкогольной этиологии, хроническую сердечную недостаточность, лимфопролиферативные заболевания.
К каким врачам обращаться при тромбоцитопении
Диагноз «тромбоцитопения» устанавливается с помощью лабораторных исследований. Чаще всего пациенты, у которых впоследствии обнаруживается тромбоцитопения, обращаются к терапевту с жалобами на повышенную кровоточивость, сыпь, недомогание, усталость. При обнаружении снижения количества тромбоцитов терапевт назначит консультацию гематолога. В некоторых случаях требуется консультация онколога , гепатолога, ревматолога.Диагностика и обследования при тромбоцитопении
При выявлении признаков тромбоцитопении врач назначит комплекс лабораторно-инструментальных методов исследования:
-
клинический анализ крови: общий анализ с подсчетом тромбоцитов, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также: