Полиоксидоний уколы при фурункулезе
Обновлено: 27.04.2024
Фурункулы – это болезненные, воспаленные, заполненные гноем полости в коже. Размер фурункула может быть от горошинки до грецкого ореха. Хотя фурункулы могут возникать на любом участке тела, чаще всего они возникают в тех областях, где есть волосяной покров и где происходит трение, например: шея, подмышки, пах, лицо, грудь, ягодицы и т.д.
Карбункулы – это особенно крупные фурункулы или несколько рядом расположенных фурункулов, которые обычно более глубокие и болезненные. При подозрении на карбункул обязательно проконсультируйтесь с врачом, т.к. воспаление может проникнуть в кровоток, и тогда вам могут понадобиться антибиотики.
Причины возникновения фурункула
Фурункулы возникают, когда бактерии проникают в волосяной фолликул. Кожная ткань вздувается и появляется красная, наполненная гноем, болезненная припухлость. Пока фурункул не вскроется и не опорожнится (содержащийся в нем гной не выйдет), фурункул будет болеть, и к нему будет неприятно прикасаться.
Cимптомы
Если у фурункула не формируется головка или не наблюдается улучшения в течение трех дней, или если фурункул очень болезненный, с большим количеством гноя, если возникающая боль мешает движению, или если фурункул возник в области лица, позвоночника или в ректальной зоне, если при этом повышается температура или видны красные полоски, расходящиеся от фурункула (лимфангит), а также при частом появлении (фурункулез) даже небольших фурункулов следует обязательно обратиться к врачу
Осложнения
- распространение фурункулов на другие части тела;
- септицемия (заражение крови).
Что можете сделать Вы
Мойте руки с антибактериальным мылом, прежде чем прикасаться к фурункулу и после контакта с фурункулом (неважно, с ранкой или гнойной головкой).
Мягко нанести на пораженную область антибактериальное средство 3-4 раза в день. Наложите теплый компресс на 15 минут 3-4 раза в день для облегчения боли и ускорения созревания гнойной головки. Затем следует закрыть фурункул толстым слоем марли и держать повязку сухой. Ни в коем случае не царапайте и не ковыряйте фурункул, не выдавливайте и не вскрывайте фурункул самостоятельно, т.к. это может разнести инфекцию. Если фурункул открылся сам, осторожно удалите гной, затем тщательно обработайте это место перекисью водорода. Потом наложите сухую повязку. Повторяйте процедуры каждый день до полного заживления. Примите обезболивающее, чтобы облегчить боль и уменьшить воспаление. Не используйте безрецептурные препараты (кремы, мази), содержащие антибиотики без консультации врача. Никогда не пытайтесь сами вскрыть фурункул без разрешения врача.
Тщательно мойте руки перед приготовлением пищи, т.к. бактерии из фурункула могут вызвать заражение пищи. Диабетикам при возникновении фурункула следует немедленно обратиться к врачу.
Что может сделать врач для лечения фурункула
Ваш врач может вскрыть фурункул, сделав небольшой надрез хирургическим лезвием, так, чтобы гной мог выйти, удалить гной и наложить сухую повязку. При необходимости выписать подходящие антибиотики (в т.ч. и мази). При частых фурункулах (фурункулез) назначить анализы (в т.ч. чтобы убедиться, что у вас нет сахарного диабета).
Профилактические меры
Принимайте ванну или душ хотя бы раз в день. Не царапайте зудящее место на коже, т.к. это может спровоцировать попадание инфекции в поврежденное место.
Наносите антисептический лосьон, чтобы не допустить попадания инфекции.
Р-р д/местн. и наружн. прим. масляный 20%: 5 мл, 10 мл, 15 мл, 20 мл, 30 мл или 50 мл фл., 15 мл, 20 мл или 25 мл фл.-капельн.
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний яв
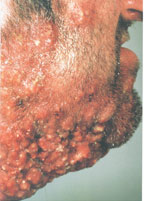
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний является хронический рецидивирующий фурункулез (ХРФ). Фурункул развивается в результате острого гнойно-некротического воспаления волосяного фолликула и окружающих его тканей. Как правило, фурункул является осложнением остеофолликулита стафилококковой этиологии. Фурункулы могут возникать как одиночно, так и множественно (так называемый фурункулез).
В случае рецидивирования фурункулеза диагностируется хронический рецидивирующий фурункулез. Как правило, он характеризуется частыми рецидивами, длительными, вялотекущими обострениями, толерантными к проводимой антибактериальной терапии. В зависимости от количества фурункулов, распространенности и выраженности воспалительного процесса ХРФ классифицируется по степени тяжести (Л. Н. Савицкая, 1987).
Тяжелая степень: диссеминированные, множественные, непрерывно рецидивирующие небольшие очаги со слабой местной воспалительной реакцией, не пальпируемыми или слегка определяющимися регионарными лимфатическими узлами. Тяжелое течение фурункулеза сопровождается симптомами общей интоксикации: слабостью, головной болью, снижением работоспособности, повышением температуры тела, потливостью.
Средняя степень тяжести — одиночные или множественные фурункулы больших размеров, протекающие с бурной воспалительной реакцией, с рецидивами от 1 до 3 раз в год. Иногда сопровождается увеличением регионарных лимфатических узлов, лимфангоитом, кратковременным повышением температуры тела и незначительными признаками интоксикации.
Легкая степень тяжести — одиночные фурункулы, сопровождающиеся умеренной воспалительной реакцией, с рецидивами от 1 до 2 раз в год, хорошо пальпируемыми регионарными лимфатическими узлами, без явлений интоксикации.
Чаще всего пациенты, страдающие фурункулезом, получают лечение у хирургов, в лучшем случае на амбулаторном этапе им проводится исследование крови на сахар, аутогемотерапия, некоторым назначают и иммуномодулирующие препараты без предварительно проведенного обследования, и в большинстве случаев они не получают положительного результата от проведенной терапии. Цель нашей статьи — поделиться опытом ведения больных с ХРФ.
Основным этиологическим фактором ХРФ считается золотистый стафилококк, который встречается, по разным данным, в 60–97% случаев. Реже ХРФ вызывается другими микроорганизмами — эпидермальным стафилококком (ранее считавшимся апатогенным), стрептококками групп А и В и другими видами бактерий. Описана вспышка заболеваемости фурункулезом нижних конечностей у 110 пациентов, являвшихся пациентами одного и того же педикюрного салона. Возбудителем данной вспышки являлся Mycobacterium fortuitium, причем этот микроорганизм был выявлен в ванночках для ног, используемых в салоне. В большинстве случаев ХРФ из гнойных очагов высеваются антибиотикорезистентные штаммы золотистого стафилококка. По данным Н. М. Калининой, St. aureus в 89,5% случаев резистентен к пенициллину и ампициллину, в 18,7% — резистентен к эритромицину и в 93% случаев чувствителен к клоксациллину, цефалексину и котримоксазолу. В последние годы отмечается достаточно широкое распространение метициллин-резистентных штаммов этого микроорганизма (до 25% пациентов). По данным зарубежной литературы, наличие на коже или на слизистой оболочке носа патогенного штамма St. aureus считается важным фактором развития заболевания.
ХРФ имеет сложный и до сих пор недостаточно изученный патогенез. Установлено, что дебют и дальнейшее рецидивирование заболевания обусловлены целым рядом эндо- и экзогенных факторов, среди которых наиболее значимыми считаются нарушение барьерной функции кожных покровов, патология ЖКТ, эндокринной и мочевыделительной систем, наличие очагов хронической инфекции различной локализации. По данным проведенных нами исследований, очаги хронической инфекции различной локализации выявляются у 75–99,7% пациентов, страдающих ХРФ. Наиболее часто встречаются очаги хронической инфекции ЛОР-органов (хронический тонзиллит, хронический гайморит, хронический фарингит), дисбактериоз кишечника с увеличением содержания кокковых форм. У больных хроническим фурункулезом патология ЖКТ (хронический гастродуоденит, эрозивный бульбит, хронический холецистит) определяется в 48–91,7% случаев. У 39,7% пациентов диагностируется патология эндокринной системы, представленная нарушениями обмена углеводов, гормонпродуцирующей функции щитовидной и половых желез. У 39,2% больных с упорно текущим фурункулезом имеется латентная сенсибилизация, у 4,2% — клинические проявления сенсибилизации к аллергенам домашней пыли, пыльцы деревьев и злаковых трав, у 11,1% — повышенная концентрация сывороточного IgE.
Таким образом, для большинства больных ХРФ характерны непрерывно рецидивирующее течение заболевания (41,3%) при тяжелой и средней тяжести течения фурункулеза (88%) и длительные обострения (от 14 до 21 дня — 39,3%). У 99,7% пациентов выявлены хронические очаги инфекции различной локализации. В 39,2% случаев определялась латентная сенсибилизация к различным аллергенам. Основным возбудителем является St. aureus.
В возникновении и развитии хронического фурункулеза, наряду с особенностями возбудителя, его патогенными, вирулентными и инвазивными свойствами, наличием сопутствующей патологии, большая роль отводится нарушениям нормального функционирования и взаимодействия различных звеньев иммунной системы. Иммунная система, призванная обеспечить биологическую индивидуальность организма и, как следствие, выполняющая защитную функцию при контакте с инфекционными, генетически чужеродными агентами, в силу разных причин может давать сбой, что ведет к нарушению защиты организма от микробов и проявляется в повышенной инфекционной заболеваемости.
Иммунная защита от бактерий-патогенов включает два взаимосвязанных компонента — врожденный (носящий преимущественно неспецифический характер) и адаптивный (характеризующийся высокой специфичностью к чужеродным антигенам) иммунитет. Возбудитель ХРФ при попадании в кожу вызывает «каскад» защитных реакций.
У 26–35% больных, страдающих хроническим фурункулезом, снижается количество В-лимфоцитов. При оценке компонентов гуморального иммунитета у больных фурункулезом выявляются различные дисиммуноглобулинемии. Наиболее часто встречаются снижение уровней IgG и IgM. Отмечено снижение аффинности иммуноглобулинов у больных ХРФ, причем выявлена корреляция между частотой встречаемости этого дефекта, стадией и тяжестью заболевания. Тяжесть нарушений лабораторных показателей коррелирует с тяжестью клинических проявлений фурункулеза.
Из вышесказанного следует, что изменения показателей иммунного статуса у больных ХРФ носят разноплановый характер: у 42,9% отмечено изменение субпопуляционного состава лимфоцитов, у 71,1% — фагоцитарного и у 59,5% — гуморального звена иммунной системы. В зависимости от выраженности изменений в показателях иммунного статуса больных ХРФ можно разделить на три группы: легкой тяжести, средней и тяжелого течения, что коррелирует с клиническим течением заболевания. При легком течении фурункулеза у большинства больных (70%) показатели иммунного статуса находятся в пределах нормы. При средней и тяжелой степени преимущественно выявляются изменения фагоцитарного и гуморального звеньев иммунной системы.
Диагностика и лечение ХРФ
Исходя из вышеуказанных патогенетических особенностей ХРФ алгоритм диагностики должен включать в себя выявление очагов хронической инфекции, диагностику сопутствующих заболеваний, оценку лабораторных параметров состояния иммунной системы (рис.).
В нашем институте был разработан план обследования больных ХРФ.
- Обязательное лабораторное исследование:
- клинический анализ крови;
- общий анализ мочи;
- биохимический анализ крови (общий белок, белковые фракции, общий билирубин, мочевина, креатинин, трансаминазы - АСТ, АЛТ);
- RW, ВИЧ;
- анализ крови на наличие гепатита В и С;
- посев содержимого фурункула на флору и чувствительность к антибиотикам;
- гликемический профиль;
- иммунологическое обследование (фагоцитарный индекс, спонтанная и индуцированная хемилюминесценция (ХЛ), индекс стимуляции (ИС) люминолзависимой хемилюминесценции ЛЗХЛ), бактерицидность нейтрофилов, иммуноглобулины A, M, G, аффинность иммуноглобулинов);
- бактериологическое исследование фекалий;
- анализ кала на яйца глистов;
- посев из зева на флору и грибы.
- Дополнительное лабораторное исследование:
- определение уровня гормонов щитовидной железы (Т3,Т4, ТТГ, АТ к ТГ);
- определение уровня половых гормонов (эстрадиол, пролактин, прогестерон);
- посев крови на стерильность трехкратно;
- посев мочи (по показаниям);
- посев желчи (по показаниям);
- определение базальной секреции;
- иммунологическое обследование (субпопуляции Т-лимфоцитов, В-лимфоциты);
- общий IgE.
- Инструментальные методы обследования:
- гастроскопия с определением базальной секреции;
- УЗИ органов брюшной полости;
- УЗИ щитовидной железы (по показаниям);
- УЗИ женских половых органов (по показаниям);
- дуоденальное зондирование;
- функции внешнего дыхания;
- ЭКГ;
- рентгенография органов грудной клетки;
- рентгенография придаточных пазух носа.
- Консультации специалистов: отоларинголога, гинеколога, эндокринолога, хирурга, уролога.
Тактика лечения больных ХРФ определяется стадией заболевания, сопутствующей патологией и иммунологическими нарушениями. В стадии обострения ХРФ требуется проведение местной терапии в виде обработки фурункулов антисептическими растворами, антибактериальными мазями, гипертоническим раствором; в случае локализации фурункулов в области головы и шеи или наличия множественных фурункулов — проведение антибактериальной терапии с учетом чувствительности возбудителя. В любой стадии заболевания необходима коррекция выявленной патологии (санация очагов хронической инфекции, лечение патологии ЖКТ, эндокринной патологии и т. д.). При выявлении у больных ХРФ латентной сенсибилизации или при наличии клинических проявлений аллергии необходимо в период поллинации добавлять к лечению антигистаминные препараты, назначать гипоаллергенную диету, проводить хирургическое вмешательство с премедикацией гормональными и антигистаминными препаратами.
В последнее время в комплексной терапии больных ХРФ все чаще используют препараты, оказывающие корригирующее действие на иммунную систему.
Разработаны показания к назначению иммуномодуляторов в зависимости от доминирующего типа нарушений иммунного статуса и степени заболевания. Так, в стадии обострения ХРФ рекомендовано применение следующих иммуномодуляторов.
- При наличии изменений фагоцитарного звена иммунитета целесообразно назначение полиоксидония по 6-12 мг внутримышечно в течение 6-12 дней.
- При снижении аффинности иммуноглобулинов - галавит 100 мг № 15 внутримышечно.
- При снижении уровня В-лимфоцитов, нарушении соотношения CD4/CD8 в сторону уменьшения показано применение миелопида по 3 мг в течение 5 дней внутримышечно.
- При снижении уровня IgG на фоне тяжелого обострения ХРФ при клинической неэффективности применения галавита используются препараты иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин).
В период ремиссии возможно назначение следующих иммуномодуляторов.
- Полиоксидоний 6-12 мг внутримышечно в течение 6-12 дней - при наличии изменений фагоцитарного звена иммунитета.
- Ликопид 10 мг в течение 10 дней перорально - при наличии дефектов образования активных форм кислорода.
- Галавит 100 мг № 15 внутримышечно - при снижении аффинности иммуноглобулинов.
Применение ликопида целесообразно также при вялотекущем, непрерывно рецидивирующем фурункулезе. При упорном рецидивировании ХРФ на фоне изменений гуморального звена иммунитета показано назначение препаратов иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин). В некоторых случаях целесообразно комбинированное применение иммуномодулирующих препаратов (например, при обострении фурункулеза возможно назначение полиоксидония, в дальнейшем, при выявлении дефекта аффинности иммуноглобулинов, добавляется галавит и т. д.).
Несмотря на значительные успехи, достигнутые в области клинической иммунологии, эффективное лечение ХРФ остается достаточно сложной задачей. В связи с этим требуется дальнейшее изучение патогенетических особенностей этого заболевания, а также разработка новых подходов к терапии ХРФ.
Неоген является синтетическим трипептидом, состоящим из L-аминокислотных остатков изолецитина, глютамина и триптофана. Неоген применялся в составе комплексной терапии, проводимой больным хроническим фурункулезом. Внутримышечные инъекции препарата неогена проводились по 1 мл 0,01% раствора 1 раз в сутки ежедневно, курс — 10 инъекций. Применение неогена в комплексной терапии больных хроническим фурункулезом на стадии ремиссии заболевания вызывает достоверную нормализацию изначально измененных иммунологических показателей (относительного и абсолютного количества лимфоцитов, относительного количества CD3 + , CD8 + , CD19 + , CD16 + -лимфоцитов, поглотительной способности моноцитов по отношению к St. aureus) и увеличение показателей спонтанной ХЛ и аффинности анти-ОАД-антител, количества HLA-DR+-лимфоцитов, а следовательно, позволяет продлить период ремиссии заболевания по сравнению с группой контроля.
Таким образом, из вышеизложенного следует, что ХРФ протекает под воздействием сложного комплекса этиологических и патогенетических факторов и его нельзя рассматривать только как местное воспаление. Больным с ХРФ необходимо проводить всестороннее обследование с целью выявления возможных очагов хронической инфекции, которые являются источником септицемии и при нарушении элиминации микробов в крови в результате снижения иммунологической реактивности организма приводят к возникновению фурункулов. Так как назначение иммунокорригирующих препаратов может вызвать обострение основного заболевания, мы считаем, что лечение больных необходимо начинать с санации выявленных очагов инфекции.
Вопрос о назначении иммунокорригирующих препаратов должен решаться индивидуально, с учетом стадии заболевания, наличия сопутствующей патологии и типа иммунологического дефекта. При выявлении у больного сенсибилизации к различным аллергенам лечение фурункулеза необходимо проводить на фоне противоаллергенной терапии.
Н. Х. Сетдикова, доктор медицинских наук
К. С. Манько
Т. В. Латышева, доктор медицинских наук, профессор
С чем связана высокая эффективность полиоксидония при лечении урогенитальной инфекции? Можно ли назначать полиоксидоний в виде монотерапии? Какова дозировка и схема применения полиоксидония при урогенитальных инфекциях?
Р. В. Петров, академик РАМН, доктор медицинских наук, профессор
Р. М. Хаитов, академик РАМН, доктор медицинских наук, профессор
А. В. Некрасов
Р. И. Аттаулаханов
Б. В. Пинегин, доктор медицинских наук, профессор
А. С. Пучкова
А. С. Иванова
ГНЦ — Институт иммунологии МЗ РФ, Москва
С чем связана высокая эффективность полиоксидония при лечении урогенитальной инфекции?
Можно ли назначать полиоксидоний в виде монотерапии?
Какова дозировка и схема применения полиоксидония при урогенитальных инфекциях?
Одной из центральных проблем современной инфекционной патологии является проблема урогенитальных инфекций, среди возбудителей которых одно из ведущих мест занимает внутриклеточный микроб Chlamydia trachomatis. У мужчин этот микроб вызывает негонорейные/постгонорейные уретриты, эпидидимиты, простатиты; у женщин — уретриты, цервициты, сальпингиты, эндометриты. В результате хламидийной инфекции у женщин могут быть эктопические беременности и преждевременные роды, у мужчин и женщин — бесплодие [10]. Кроме того, хламидии могут быть причинами конъюнктивитов, бронхитов, синуситов, атипичных пневмоний, артритов и т. д. В настоящее время хронической хламидийной инфекции придается определенная роль в развитии атеросклероза и инфаркта миокарда. Помимо Ch.trachomatis в возникновении этих заболеваний этиологическую роль играют и другие виды хламидий, а именно: Ch.pneumoniae и Ch.psitatci.
Ch.trachomatis обнаруживается у 40% мужчин с негонорейным уретритом. Кроме этого микроба возбудителями хронических урогенитальных инфекций могут быть и другие внутриклеточные микробы. К ним относятся Mycoplasma genitalium, Ureaplasma urealyticum, Trichomonas vaginalis [8].
Большой проблемой в диагностике и лечении хронических урогенитальных инфекций является часто бессимптомное или субклиническое, вяло текущее течение заболевания. Нередко первичная инфекция не диагностируется и распознается только по развившимся осложнениям. Поэтому своевременная диагностика и эффективное лечение урогенитальных инфекций является актуальной задачей современной медицины. В данной статье приводится опыт применения отечественного иммуномодулятора полиоксидония в комплексном лечении урогенитальных инфекций. Однако прежде чем говорить об эффективности полиоксидония в лечении этих инфекций, мы сочли целесообразным привести основные данные об этом препарате и механизме его действия [5].
Механизм действия полиоксидония
Иммуномодулятор последнего поколения полиоксидоний (ПО) — это высокомолекулярное физиологически активное соединение, являющееся N-оксидированным производным полиэтиленпиперазина. Препарат создан в ГНЦ — Институте иммунологии Минздрава России Петровым
Р. В., Хаитовым Р. М., Некрасовым А. В. и др. ПО разрешен к медицинскому применению у детей и взрослых в дозе 0,1 мг/кг в двух лекарственных формах: инъекционной и в виде суппозиториев.
ПО является уникальной полимерной молекулой с многогранным положительным воздействием на организм человека, которое заключается в следующих эффектах: иммуностимулирующем, детоксицирующем, антиоксидантном, мембраностабилизирующем.
Иммуностимулирующий эффект связан со способностью ПО активировать клетки моноцитарно-макрофагальной системы. Следствием активации клеток этой системы является повышение функциональной активности практически всех звеньев защиты организма от инфекции:
- факторов естественной резистентности: нейтрофилов, моноцитов, макрофагов, NK-клеток;
- факторов приобретенного иммунитета: гуморального и клеточного.
Активация клеток моноцитарно-макрофагальной системы ведет к повышению миграции нейтрофилов в воспалительный очаг, усилению активности лизосомальных ферментов, повышению способности фагоцитов поглощать и убивать микробы. Поэтому практически сразу после введения ПО происходит резкое усиление антиинфекционной резистентности организма, что хорошо демонстрируется в эксперименте: предварительное введение ПО повышает устойчивость животных к заражению несколькими штаммами патогенных микробов. Другое важное иммуномодулирующее свойство ПО — его способность усиливать образование антител как к тимус-зависимым, так и тимус-независимым антигенам. При совместном введении с данными антигенами ПО усиливает антителообразование в десятки раз. Параллельно с этим происходит и активация клеточного иммунитета. Повышается способность естественных киллеров и антигеннеспецифических Т-киллеров убивать клетки, зараженные внутриклеточными возбудителями: вирусами, хламидиями, микоплазмами и др.
Детоксицирующее действие связано с особенностями химической структуры ПО. Как уже отмечалось, он является высокомолекулярным веществом, содержащим на своей поверхности большое количество активных группировок. В силу этого ПО обладает способностью сорбировать на своей поверхности различные токсические вещества, в том числе микробной природы, и тем самым усиливать их элиминацию из организма. Это является очень важным при острых отравлениях и практически при всех острых и хронических инфекционных заболеваниях.
ПО обладает антиоксидантными и мембраностабилизирующими свойствами. Так же как и детоксицирующие, эти свойства тесно связаны с особенностями химической структуры ПО. Первое свойство проявляется в способности ПО удалять из организма различные кислородные радикалы, что существенно понижает их повреждающее действие на органы и ткани и снижает остроту воспалительного процесса. Поэтому ПО является незаменимым препаратом при различных септических состояниях. Второе свойство — способность стабилизировать мембраны клеток — существенно снижает чувствительность клеток к повреждающему действию некоторых химиотерапевтических лекарственных средств, в частности иммунодепрессантов. Это делает ПО исключительно ценным препаратом в комплексном лечении радио- и химиотерапией онкологических больных.
Клиническая эффективность ПО при лечении урогенитальных инфекций
При урогенитальных инфекциях ПО применяется в инъекционной форме и виде суппозиториев. Инъекционная форма использовалась в трех дозах: 3 мг, 6 мг и 12 мг. Доза в 3 мг оказалась недостаточно эффективной. Дозы в 6 мг и 12 мг дают практически один и тот же результат. Поэтому основной для лечения урогенитальных инфекций с помощью инъекций принята доза в 6 мг. Применение ПО в указанной форме показало высокую эффективность в комплексном лечении хламидийных уретритов, простатитов, цервицитов, сальпингоофоритов, трихомонадного уретрита, генитального герпеса [2, 3, 4, 6]. Эффективность применения ПО заключалась в полном клиническом выздоровлении и исчезновении возбудителей из патологического материала у 95% больных опытной группы; в контрольной группе этот процент составил 70-75%. Кроме того, применение ПО в комплексном лечении позволило в два раза сократить сроки лечения, значительно снизить дозу потребляемых антибиотиков, уменьшить частоту отдаленных рецидивов заболевания.
Приведем конкретные примеры применения ПО для лечения хламидийных уретритов и простатитов. Группа из 17 больных получала ПО в дозе 6 мг внутримышечно, первые две инъекции ежедневно, затем два раза в неделю, на курс 7 инъекций. При контрольном культуральном исследовании больных через месяц после окончания лечения у 15 человек хламидии не выявлялись. У двух больных были обнаружены обычные формы Ch.trachomatis. Поскольку эти формы являются чувствительными к антибиотикам, полученный результат был расценен как положительный. При иммунологическом исследовании было обнаружено повышение уровня естественных киллеров (CD16/56+), играющих, как известно, ведующую роль в защите организма от внутриклеточных возбудителей. Наблюдалось также повышение уровня иммуноглобулинов: IgA и IgM. Напомним, что IgA играет важную роль в защите слизистых оболочек от инфекционных агентов.
Интересным является опыт эндолимфатического применения ПО при хламидийном простатите. Прямое эндолимфатическое введение ПО осуществляли 12 больным через микрокатетер, установленный в периферический лимфатический сосуд нижней конечности. Препарат вводили через день в дозе 6 мг курсом 5-6 инъекций. В этом случае все больные после окончания курса лечения отмечали значительное улучшение. Элиминация хламидий из простаты происходила в 96% случаев. Существенно улучшалась картина ее секрета. В крови происходило увеличение Т-хелперов (CD4+) и IgA. Вероятно, этот способ введения ПО следует иметь в виду при лечении запущенных случаев хронического простатита, трудно поддающихся лечению обычными методами.
Перспективным является применение ПО при хламидийных уретритах и простатитах в виде суппозиториев. В данной лекарственной форме использовались дозы ПО в 3 мг, 6 мг и 12 мг. Так же как и в случае инъекционной формы, дозы 6 мг и 12 мг имели примерно одинаковую эффективность в плане элиминации возбудителя, тогда как доза в 3 мг в сравнении с ними оказывала менее выраженный эффект. При изучении эффективности лечения с помощью прямой иммунофлюоресценции у 30 больных через 2 месяца после завершения курса введения ПО была установлена полная элиминация возбудителя из патологического материала в 96% случаев. При эхографии простаты отмечалось улучшение ее структуры, происходила нормализация микроскопической картины простаты и улучшение показателей эякулята. При иммунологическом исследовании было выявлено увеличение в периферической крови количества Т-хелперов и IgA.
В другом исследовании суппозитории применяли в дозе 6 мг ежедневно в течение 10 дней у 15 больных с хроническим хламидийным простатитом. У всех больных после курса лечения полностью исчезали клинические жалобы: прекратились боли и рези в уретре, боли и дискомфорт в промежности, уретральные выделения, восстанавливалась эрекция. При контрольном исследовании методом полимеразной цепной реакции (ПЦР) через месяц у 14 больных хламидии исчезли и сохранились только в одном случае.
Представленные данные дают основание сделать вывод о высокой эффективности ПО в комплексном лечении хламидийных урогенитальных инфекций. Но отдельные наблюдения практикующих врачей говорят о его клиническом эффекте и в виде монотерапии. Это связано с тем, что ПО является мощным стимулятором клеток моноцитарно-макрофагальной системы и естественных киллеров, от взаимодействия которых в значительной степени и зависит элиминация всех внутриклеточных паразитов из организма. Возможно также и то, что сам ПО оказывает прямое микробоцидное действие на возбудителя. В таком случае этот иммуномодулятор обладает двойным лечебным эффектом, оказывая стимулирующее действие на иммунную систему и ингибирующее действие на возбудителя. Однако в настоящее время говорить о применении ПО при хламидийных инфекциях в виде монотерапии преждевременно, и для этого требуется дальнейшее накопление фактического материала.
Как отмечалось во введении, помимо хламидий частыми возбудителями урогенитальных инфекций оказываются простейшие трихомонады. Имеется опыт применения ПО для лечения трихомонадного уретрита у мужчин без явлений простатита [1]. Под наблюдением было 45 пациентов, диагноз у которых был поставлен на основании морфологического исследования соскоба из уретры микроскопическим методом и с помощью ПЦР. 23 больных получали этиотропные химиопрепараты (метронидазол, орнидазол или ниморазол) в комплексе с ПО (три раза в неделю внутримышечно по 6 мг), 22 больных получали только химиопрепараты без ПО. После окончания курса лечения у всех больных первой группы трихомонады в соскобах из уретры не определялись. Клиническое выздоровление отмечалось у 19 человек. После повторного курса лечения выздоровление было у 3 человек. Во второй группе после проведенного курса лечения клинический эффект был отмечен только у 13 человек. Повторный курс прошли 9 человек, после которого в пяти случаях было достигнуто выздоровление. Таким образом, проведенные клинические наблюдения свидетельствуют об эффективности ПО в комплексном лечении трихомонадных уретритов.
Основные схемы и тактика применения ПО
При различных заболеваниях назначаются различные дозировки и схемы применения ПО, но в основе их лежит нечто общее, что можно примерно сформулировать для взрослых следующим образом: по 6 мг внутримышечно через один-два дня № 7-10. Такая схема рекомендуется для лечения хронических инфекционно-воспалительных процессов различных локализаций, в том числе и урогенитальных инфекций. В зависимости от тяжести патологического процесса число инъекций можно увеличивать до 15. С целью быстрого купирования патологического процесса при острых процессах и септических состояниях первая доза ПО может быть увеличена до 12 мг. В этих случаях допускается также ежедневное введение первых двух доз ПО.
ПО хорошо взаимодействует со всеми антимикробными препаратами, интерферонами и их индукторами. Он обладает способностью оказывать усиливающий эффект на действие основных этиотропных средств базисной терапии. Поэтому при вторичных иммунодефицитных состояниях ПО целесообразно назначать одновременно с химиотерапевтическими препаратами — антибиотиками, противогрибковыми или противовирусными средствами, в случае если они показаны. ПО повышает функциональную активность клеток фагоцитарной системы (усиливая их способность поглощать и убивать внеклеточные возбудители), а также макрофагов, NK-клеток и Т-лимфоцитов, способствуя разрушению клеток, инфицированных внутриклеточными возбудителями. Антимикробные химиотерапевтические препараты, убивая или подавляя функциональную активность возбудителя, делают их более чувствительными к действию защитных сил организма — фагоцитоза, NK-клеток и T-лимфоцитов. Одновременное применение ПО и антимикробного препарата наносит по возбудителю двойной удар, в результате чего и достигается хороший клинический эффект.
Литература
1. Барбашев С. В., Токманов А. М., Некрасов А. В. и др. Использование полиоксидония в лечении трихомонадного хронического уретрита // 5-й Российский съезд врачей-инфекционистов. М., 1998, с. 27.
2. Гончарук А. И., Поляченко А. П., Некрасов А. В. и др. Применение полиоксидония в лечении хламидийного простатита // 2-й Национальный конгресс Российской ассоциации клинических аллергологов и клинических иммунологов (РААКИ). М., 1998, с. 274.
3. Гончарук А. И., Скворцов С. В., Некрасов А. В., Сараф А. С. Иммуномодулирующее действие полиоксидония при лечении хронических урогенитальных инфекций // 6-й Российский национальный конгресс «Человек и лекарство». М., 1999, с. 284.
4. Исаева Н. П., Змызгова А. В., Куликова С. А. и др. Полиоксидоний в комплексной терапии сочетанного течения хронических вирусных гепатитов и урогенитальных инфекций // 2-й Национальный конгресс Российской ассоциации клинических аллергологов и клинических иммунологов (РААКИ). М., 1998, с. 283.
5. Петров Р. В., Хаитов Р. М., Некрасов А. В. и др. Полиоксидоний — иммуномодулятор последнего поколения: итоги трехлетнего клинического применения // Аллергия, астма и клиническая иммунология. 1999. № 3. С. 3-6.
6. Полосин А. В., Некрасов А. В., Пучкова Н. Г. Иммуномодулятор полиоксидоний — перспектива в лечении хронических урогенитальных инфекций // 5-й Российский съезд врачей-инфекционистов. М., 1998, с. 72.
7. Хаитов Р. М., Пинегин Б. В. Иммуномодуляторы и некоторые аспекты их клинического применения // Клиническая медицина. 1996. № 8. С. 7-12.
8. Хей Ф. Хламидийные инфекции // Лечащий Врач. 1999. № 2-3. С. 22-27.
9. Хоменко А. Г. Туберкулез вчера, сегодня и завтра. Проблемы туберкулеза. 1997. № 6. С. 9-11.
10. Hillis S., Black C., Newhall J. et al. New opportunities for chlamydia prevention: application of science for public health practice // Sex. Transm. Dis. 1995. № 22. С. 196-202.
В настоящее время продолжается интенсивное изучение механизма действия и медицинского применения отечественного иммуномодулятора Полиоксидония, являющегося физиологически активным соединением с молекулярной массой 100 kD и обладающего выраженной иммуномодулирующей активностью. По своей химической структуре он являетя сополимером N-окиси 1,4-этиленпиперазина и (N-карбоксиэтил-) 1,4-этиленпиперазиния бромида с молекулярной массой 80 kD.
Полиоксидоний разрешен к медицинскому применению у детей и взрослых в двух лекарственных формах: в виде инъекций и в виде суппозиториев.
Инъекционная форма Полиоксидония нашла широкое применение в комплексном лечении при ряде хронических инфекционно-воспалительных процессов любой локализации и этиологии. Показана высокая клиническая и иммунологическая эффективность этого иммуномодулятора в лечении хирургических инфекций, инфекций урогенитального, желудочно-кишечного и бронхолегочного трактов.
Так, в частности, в нашем институте Т. В. Латышевой с соавторами (2001, 2002 гг.) показана эффективность Полиоксидония в лечении хронического рецидивирующего фурункулеза, проявляющаяся в существенном удлинении продолжительности ремиссии. А. Е. Шульженко с соавторами (2001, 2002 гг.) показана эффективность Полиоксидония в лечении хронического генитального герпеса, которая также проявлялась в существенном удлинении срока ремиссии этого (основного клинического показателя эффективности лечения любой хронической рецидивирующей инфекции). С. С. Аршиновой с соавторами. (1999, 2000, 2002 гг.) показана эффективность Полиоксидония в лечении туберкулеза легких. Это проявлялось в более быстром закрытии полостей распада, элиминации возбудителя, рассасывании инфильтратов и исчезновении интоксикации по сравнению с больными, получавшими традиционное антимикобактериальное лечение.
В подавляющем большинстве случаев целесообразно применение иммуномодуляторов в комплексном лечении при хронических инфекционно-воспалительных процессах, и мы считаем, что препаратом первого выбора в этих случаях является Полиоксидоний. Это утверждение основано на ряде положений.
Полиоксидоний хорошо взаимодействует с антибактериальными, противогрибковыми и противовирусными препаратами, а также с интерферонами и индукторами интерферонов. При совместном применении антибиотика и иммуномодулятора мы говорим о “двойном” ударе по причине заболевания. Полиоксидоний стимулирует функциональную активность клеток иммунной системы: непосредственно – нейтрофилы, моноциты/макрофаги и естественные киллеры, опосредованно – клеточный и гуморальный иммунитет, от которых в конечном итоге зависит элиминация возбудителя из организма, а антимикробный препарат убивает или понижает функциональную активность возбудителя. Но главным преимуществом Полиоксидония по сравнению с другими иммуномодуляторами является многогранность его положительного воздействия на организм человека.
Помимо иммуномодулирующего эффекта Полиоксидоний обладает детоксицирующими, антиоксидантными и мембранопротекторными свойствами, обусловленными особенностями его химической структуры. Именно наличие комплекса этих свойств обуславливает высокий клинический эффект Полиоксидония, его преимущества перед другими иммуномодуляторами и делает его препаратом первого выбора при лечении заболеваний, связанных с нарушениями иммунной системы.
Рассмотрим более подробно детоксикационные свойства инъекционной формы Полиоксидония. Эти свойства препарата хорошо демонстрируются на модели ожоговой болезни и панкреонекроза. Н. А. Гординская с соавторами (2002 г.) применяли Полиоксидоний в комплексном лечении 24 пациентов с термическими ожогами на площади от 30% до 50% поверхности тела. После курса Полиоксидония у пациентов существенно снижался уровень печеночных аминотрансфераз и среднемолекулярных пептидов. Снижалось также количество циркулирующих иммунных комплексов. Анализируя динамику концентрации токсических веществ в плазме ожоговых больных, авторы обнаружили резко повышенное содержание бактериальных липополисахаридов в период токсемии. На фоне традиционной терапии практически не регистрировалось снижение концентрации ЛПС. На фоне иммунотерапии Полиоксидонием уровень бактериальной эндотоксемии достоверно снижался.
В. Л. Аверкиев с соавторами (2002 г.) оценивали у 76 больных острым деструктивным панкреатитом в послеоперационном периоде помимо иммунного статуса состояние перекисного окисления липидов и интоксикационный синдром. У 23 больных в комплексном лечении этого заболевания был применен Полиоксидоний. В послеоперационном периоде в 1-е сутки по сравнению с дооперационным уровнем отмечается прогрессирование липопероксидации, что связано, вероятно, с наркозом, операционной травмой и с реперфузией ткани поджелудочковой железы после рассечения ее капсулы и абдоминизации. При применении Полиоксидония происходит снижение уровня малонового диальдегида и диеновых кислот. В послеоперационный период у больных происходит существенное повышение молекул средней массы (МСМ), свидетельствующее о тяжелом синдроме эндогенной интоксикации вследствие воспалительного процесса и операционной травмы. При применении Полиоксидония отмечается планомерное понижение этого показателя и к 14-м суткам уровень МСМ достигает нормы.
При анализе биохимических показателей выявлено достоверное снижение уровней билирубина, креатинина и мочевины сыворотки крови, уменьшение активности аминотрансфераз у всех больных, особенно выраженное в группе больных, получаших Полиоксидоний. Авторы полагают, что с выраженными детоксикационными свойствами Полиоксидония связано и снижение летальности (52% в контрольной и 23,1% в опытной группе) и частоты гнойно-септических осложнений (92% в контрольной и 43,9% в опытной группах). Высокая клиническая эффективность лечения Полиоксидонием четко связана и с улучшением параметров иммунного статуса.
Наряду с инъекционной формой в клиническую практику широко внедряется Полиоксидоний в виде суппозиториев. Эта форма препарата показана к применению практически при всех тех же нозологиях, что и инъекционная. На наш взгляд, особый интерес представляет применение суппозиториев для лечения хронических заболеваний урогенитального тракта.
М. Н. Шатохин с соавторами (2002 г.) показали эффективность при использовании Полиоксидония в виде суппозиториев в комплексном лечении хронического простатита. После традиционной терапии болевой синдром сохранился у 75% пациентов, дизурические расстройства наблюдались у 70% больных, простаторея и боль или дискомфорт при эякуляции остались в 40% случаев. Качество жизни практически не улучшилось.
После лечения с включением суппозиториев Полиоксидония болевой синдром купировался у всех пациентов, дизурические явления, простатоторея и дискомфорт при эякуляции сохранились лишь у 1 пациента. Качество жизни заметно улучшилось (3 балла по сравнению с 8,8 балла до лечения). При ректальном пальцевом исследовании характеристики предстательной железы улучшились: исчезла болезненность, повысился тонус. В секрете предстательной железы понизились концентрации провоспалительных цитокинов. Особенно интересными, на наш взгляд, являются данные авторов об изменениях местного иммунитета. Оказалось, что при применении суппозиториев Полиоксидония происходило снижение провоспалительных цитокинов (ФНОa, ИЛ-1b, ИЛ-6) при повышении содержания ИЛ-4 и sIgA в секрете предстательной железы.
М. Х. Коджаева с соавторами (2002 г.) применяли Полиокидоний в виде суппозиториев в комплексной терапии у 34 женщин в возрасте от 16 до 39 лет с диагнозом «хронические рецидивирующие урогенитальные инфекции». У этих женщин наблюдалось значительное улучшение клинических и лабораторных показателей. Это выражалось в увеличении количества лактобактерий, увеличении в вагинальном секрете IgA и sIgA, улучшении кольпоскопической картины, уменьшении выделений и т. д.
Л. Е. Смирновой с соавторами (2002 г.) проведена комплексная терапия 58 больных с обострением хронических воспалительных заболеваний внутренних половых органов (ХВЗВПО). Основную группу составили 36 пациенток, получавшие Полиоксидоний в виде суппозиториев на фоне базисной антибактериальной терапии. В контрольную группу вошли 22 больные, которым проводилась только базисная терапия. У больных основной группы отмечена более выраженная динамика исчезновения основных клинических симптомов, более ранняя нормализация УЗ-картины, элиминация возбудителей из слизи цервикального канала в 92% случаев по сравнению с 32% у больных контрольной группы. Также после проведенной терапии у больных основной группы, в отличие от пациенток контрольной группы, нормализовался уровень концентрации иммуноглобулинов в содержимом влагалища. Полученные данные свидетельствуют о высокой эффективности комплексной терапии ХВЗВПО в стадии обострения с применением Полиоксидония.
Полученные данные говорят о целесообразности применения Полиоксидония в гинекологической практике у женщин с длительной хронической бактериальной инфекцией.
Т. Н. Кузина и соавторы, изучали некоторые параметры местного иммунитета слизистой влагалища у 39 женщин в возрасте 19–35 лет, получавшие полиоксидоний ежедневно интравагинально, №10. Больные были разделены на две группы. Первая группа состояла из ВИЧ-серонегативных женщин (14), которые имели в качестве постоянных половых партнеров ВИЧ-инфицированных мужчин. Вторая группа – 25 ВИЧ-инфицированных женщин (стадия В по CDC). В первой группе пациенток, которые были подвергнуты катамнестическому наблюдению в течение года, ВИЧ-инфицирования женщин не регистрировалось несмотря на то, что они имели постоянные половые контакты с ВИЧ-инфицированными мужчинами, которые не пользовались презервативами.
Помимо инъекционной формы и суппозиториев разрабатываются новые перспективные способы применения Полиоксидония. В. П. Вавилова с соавторами (2002 г.) предложили интраназальную терапию Полиоксидонием детей, часто болеющих ОРВИ на фоне хронического аденоидита (40 детей в возрасте 3–6 лет) с учетом характера поражения лимфоглоточного кольца (нейтрофильно-макрофагальный вариант). У детей, страдающих хроническим аденоидитом с гнойным экссудатом, Полиоксидоний применялся местно эндоназально в течение 10 дней. Проспективное наблюдение в течение 3,5 месяцев подтвердило эффективность иммуномодулятора в плане становления местного иммунитета респираторного тракта, нормализации микробного пейзажа носоглотки и улучшения клинической картины с уменьшением размеров гипертрофированной глоточной миндалины. Представленные данные показывают перспективность создания новой лекарственной формы полиоксидония для лечения заболеваний ЛОР-органов и стимуляции местного иммунитета верхних дыхательных путей.
В целом Полиоксидоний является уникальным иммуномодулирующим препаратом, сочетающим в себе множество положительных качеств. Это, без сомнения, выдающееся достижение российских ученых. Полиоксидоний занял достойное место в арсенале отечественных лекарственных средств и среди иммуномодуляторов бесспорно является препаратом первого выбора. Без сомнения, по мере широкого медицинского применения этого препарата клинические показания для его использования будут расширяться, будут уточняться схемы и дозы его назначения, но уже сегодня можно с уверенностью сказать, что применение Полиоксидония позволило существенно повысить эффективность лечения и профилактики ряда заболеваний, связанных с нарушениями иммунной системы.
О. А. Щербакова, Т. В. Латышева, Н. X. Сетдикова
ГНЦ — Институт иммунологии Минздрава РФ, Москва
Проведено клинико-иммунологическое обследование 50 больных хроническим рецидивирующим фурункулезом в возрасте от 20 до 65 лет, находившихся в фазе обострения основного заболевания. При оценке иммунного статуса выявлено снижение показателей аффинности сывороточных антител к общей антигенной детерминанте у 72% пациентов и повышение показателей индуцированной хемилюминесценции у 70% больных. Были сформированы две группы пациентов. У больных 1-й группы проведена терапия иммуномодулятором галавитом по схеме, пациенты 2-й группы служили контролем. Показана хорошая переносимость препарата, выявлено его иммуномодулирующее действие на показатели иммунного статуса пациентов 1-й группы по сравнению с контролем. Отмечены достоверное снижение содержания моноцитов и нормализация показателей индуцированной хемилюминесценции. Кроме того, отмечена нормализация аффинности иммуноглобулинов у 50% больных. Катамнестическое наблюдение за больными в течение 1,5 лет выявило хороший клинический эффект у пациентов, получавших галавит, по сравнению с контролем.
Fifty patients (aged 20 to 65) with chronic relapsing furunculosis underwent the clinical-and-immunological examinations during the main-disease exacerbation. An assessment of the immune status revealed lower indices of affinity of serum antibodies to the total antigenic determinant in 72% of patients; higher parameters of induced chemiluminescence were found in 70% of patients. The patients were shared between two groups: group 1 underwent a scheme-based immunotherapy by galavit; group-2 was control. A good tolerability of the drug was demonstrated and the immune-modeling effect produced by the drug on the immune-status parameters was detected in the patients of group 1 versus the controls. A reliably lower count of monocytes and normalized parameters of induced chemiluminescence were registered. Besides, a normalized affinity of immunoglobulins was noted in 50% of patients. A catamnestic 1.5-year follow-up revealed a good clinical effect in patients who received glatavit versus the controls.
В настоящее время существует тенденция к росту числа хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одну из ведущих ролей в хронизации различных заболеваний играют иммунные нарушения как системного, так и местного характера. Иммунная система, призванная обеспечить биологическую
индивидуальность организма и как следствие выполняющая защитную функцию при контакте с инфекционными, генетически чужеродными агентами, в силу разных причин может давать сбой, что ведет к нарушению защиты организма от микробов и проявляется повышенной инфекционной заболеваемостью.
Одним из таких заболеваний является хронический рецидивирующий фурункулез (ХРФ), характеризующийся частыми рецидивами, длительными, вялотекущими обострениями, торпидными к проводимой антибактериальной терапии. В возникновении и развитии хронического фурункулеза наряду с особенностями возбудителя, его патогенными, вирулентными и инвазивными свойствами большая роль отводится нарушениям нормального функционирования и взаимодействия различных звеньев иммунной системы. Диагностически наиболее значимыми являются изменения в фагоцитарном и гуморальном звеньях иммунной системы, а также их сочетанная патология [7, 10, 11]. При оценке параметров гуморального иммунитета имеет значение не только количество иммуноглобулинов, но и их функциональная активность. Одним из главных показателей функциональной активности является аффинность антител. Способность продуцировать низкоаффинные антитела может привести к состоянию иммунодефицита, которое проявляется частыми инфекционными процессами [2, 9]. Изменения в гуморальном звене у больных ХРФ в основном представлены дисиммуноглобулинемией. Впервые Н. X. Сетдиковой и соавт. [5, 6] было показано, что причиной рецидивирования фурункулеза у таких пациентов является снижение аффинности иммуноглобулинов к общей антигенной детерминанте Staphylococcus aureus, который чаще всего служит причиной возникновения фурункулов и преимущественно высевается при бактериологическом исследовании у больных ХРФ [1].
В последнее время в комплексной терапии больных ХРФ все чаще используют препараты, оказывающие корригирующее действие на иммунную систему [3, 8]. На фармакологическом рынке появляются новые иммуномодулирующие препараты, одним из которых является галавит.
В настоящей работе представлены данные о клинической эффективности и влиянии галавита на показатели иммунного статуса больных ХРФ. Исследование проводилось на базе отделения иммунопатологии Института иммунологии.
Материалы и методы.
Проведено клинико-лабораторное и иммунологическое обследование 50 больных ХРФ, находившихся в фазе обострения основного заболевания. Всем больным проводили обследование, направленное на выявление очагов хронической инфекции и сопутствующей патологии. Иммунный статус оценивали с помощью различных методик:
1) оценку системного иммунитета осуществляли путем определения в крови абсолютного и относительного количества лейкоцитов и лимфоцитов. У последних определяли субпопуляционный состав с помощью моноклональных антител методом проточной цитометрии;
2) уровни иммуноглобулинов классов А, М, G в сыворотке периферической крови исследовали методом радиальной иммунодиффузии в геле по Манчини;
3) функциональную активность фагоцитов периферической крови определяли по величинам фагоцитарного индекса и индекса стимуляции люминолзависимой хемилюминесценции;
4) бактерицидность (внутриклеточный киллинг St. aureus) определяли методом, основанным на использовании проточного цитометра, разработанным в лаборатории клинической иммунологии Института иммунологии [4];
5) относительную аффинность антител определяли по методике В. Luxton и Е. Tompson [9].
У всех пациентов иммунологическое обследование проводили до начала лечения и после окончания курса терапии. Все больные получали местную терапию в виде обработки фурункулов антисептическими растворами, антибактериальными присыпками, кремами, использовали также мазевые повязки. Всем пациентам проводили коррекцию выявленной сопутствующей патологии. Больные были разделены на две группы. В 1-ю группу были включены 30 больных, получавших в дополнение к местной иммунокорригирующую терапию. В качестве иммунокорригирующего препарата применяли галавит (ЗАО ЦСМ "Сэлвим") по 100 мг внутримышечно ежедневно 5 инъекций, а затем по 100 мг через день 15 инъекций. Кроме того, 9 больных этой группы получали системную антибактериальную терапию.
Во 2-ю группу вошли 20 больных, получавших наряду с местной системную антибактериальную терапию.
Результаты и обсуждение.
Нами обследовано 50 больных (26 мужчин и 24 женщины) в возрасте от 20 до 65 лет (табл. 1). У всех больных имелся ХРФ в фазе обострения. Клиника определялась наличием фурункулов, локализованных на разных участках тела. Длительность заболевания составляла от 0,5 года до 18 лет.
У всех больных наблюдалось частое рецидивирование фурункулеза. Данные о количестве обострений в год, длительности обострения (в днях) и тяжести проявлений ХРФ у этих больных представлены в табл. 2—4. Анализируя полученные данные, необходимо отметить, что у 88% больных было тяжелое течение заболевания, у 32% — частое рецидивирование, у 42% — непрерывнотекущий процесс; длительность обострения у 56% пациентов составляла более 14 дней.
Читайте также:

