Пищеводно бронхиальный свищ при раке пищевода
Обновлено: 25.04.2024
В основном спектр пособий, предлагаемый различными авторами, - от симптоматических до паллиативных мер. Удовлетворительный паллиативный эффект удается достичь у ряда больных, используя рентгенологический и эндоскопический способы транстуморальной интубации, установки различных эндопротезов (нитиноловые, металлические с полиуретановым покрытием, поливинилхлоридные и т.д.). Однако при этом сохраняется угроза кровотечения из распадающейся опухоли. Возможна миграция протеза с обтурацией просвета пищевода, а также возникновение пролежня в стенке с формированием вторичного свища.
Сторонники активной хирургической тактики с целью повышения качества жизни пациентов рекомендуют различные варианты шунтирующих операций как альтернативу гастро- и еюностомии.
Крайне сложная проблема - радикальное лечение больных раком пищевода при наличии пищеводно-медиастинальных, пищеводно-легочных, пищеводно-бронхиальных и пищеводно-трахеальных свищей. Тяжесть состояния пациентов и травматичность этих операций объясняют высокую послеоперационную летальность - более 60% Опыт 6 удачных одномоментных эзофагэктомий и резекций легких в различном объеме по поводу злокачественных пищеводных свищей опубликовали китайские хирурги (Zhang D. et al, 1995). Японским коллегам в дополнение к комбинированной операции удалось 2 пациентам успешно провести послеоперационное химиолучевое лечение. Больные пережили 2 года без рецидива заболевания (Saitoh Y. et al, 1995).
Накопленный за многие годы позитивный опыт брюшной и грудной онкохирургии, высокий профессиональный уровень специалистов анестезиологов и реаниматологов позволили в клинике торакоабдоминальной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в начале 90-х годов пересмотреть принципы лечения больных со злокачественной пищеводной фистулой в пользу активной хирургической тактики.
Одномоментная субтотальная резекция пищевода и пластика желудком с формированием пищеводно-желудочного анастомоза в куполе правого гемиторакса (операция типа Льюиса) была выполнена у 19 пациентов. Резекция проксимального отдела желудка и нижнегрудного отдела пищевода левосторонним абдоминоторакальным доступом (операция типа Гарлока) произведена 3 пациентам. В 10 случаях имело место обходное пищеводно-желудочное соустье из различных доступов. В связи с крайне низкими показателями функции дыхания и выраженной сердечной патологией у 3 пациентов была сформирована гастростома. Во всех 19 случаях операция типа Льюиса носила комбинированный характер: у 8 с - резекцией грудного лимфатического протока и магистральных вен на протяжении, у 6 - с клиновидной резекцией нижней доли правого легкого, перикарда и диафрагмы; еще у 2 - с нижней лобэктомией справа; у 1- с нижней билобэктомией; 1 пациенту по поводу пищеводно-бронхиального свища была выполнена резекция пищевода единым блоком с правым легким; у 1 больного резекция пищевода сопровождалась моноблочным удалением 6 полуколец трахеи с формированием внутригрудного циркулярного трахеального анастомоза.
У 10 пациентов операция типа Льюиса по характеру была условно радикальной, и в одном случае - паллиативной (вследствие опухолевой инфильтрации бифуркации трахеи). В одном случае операция типа Гарлока была выполнена в комбинированном варианте с удалением нижней доли левого легкого и в одном- с резекцией нижней доли правого легкого.
Анализ непосредственных результатов хирургического лечения выявил осложнения в 40% случаев (14 из 35) и 14,3% послеоперационной летальности (5 из 35). Летальность после резекций пищевода составила 14,2% (3 из 21).
Резекция пищевода в послеоперационном периоде в 5 случаях осложнилась абсцедирующей пневмонией (у одного из пациентов на третьи сутки после операции развился острый инфаркт миокарда) и в 3 - эмпиемой плевры и медиастинитом. Только у 1 пациента причиной эмпиемы и медиастинита явилась несостоятельность швов пищеводного анастомоза, у 2 других нарушения герметичности пищеварительной трубки отмечено не было.
Осложнения после операций пищеводного шунтирования и гастростомий включали двухстороннюю пневмонию (3 больных), кровотечения из распадающейся опухоли (1 больной), медиастинит (2 больных). Причиной смерти в одном случае было кровотечение из распадающейся опухоли и в другом - абсцедирующая пневмония.
Неблагоприятными факторами прогноза у больных со свищами при раке пищевода, как и при любом опухолевом процессе, являются глубина опухолевой инвазии стенки пищевода и лимфогенное метастазирование.
Все больные, которым были сформированы обходные пищеводные анастомозы, умерли в сроки от 9 до 14 месяцев. У 6 больных, прослеженных после условно радикальных резекций пищевода, в процессе динамического наблюдения были диагностированы метастазы в надключичных и паратрахеальных лимфоузлах. 5 пациентов (83,3%) не пережили 2-х летнего срока наблюдения (в среднем они жили 17 месяцев). Один больной после комбинированной операции Льюиса с нижней лобэктомией по поводу пищеводно-легочного свища прожил 31 мес.
Анализируя непосредственные результаты и выживаемость в этой группе больных, необходимо учитывать, что операция избавила часть из них от ближайших смертельных осложнений. Удалось существенно повысить качество жизни путем устранения дисфагии. Таким образом, хирургическое вмешательство можно рассматривать как первый этап специального противоопухолевого лечения, создающий условия для дальнейшего проведения лучевой и химиотерапии.
Рак пищевода – злокачественное заболевание, исходящее из его слизистой оболочки. Рак является наиболее частым заболеванием пищевода. Болеют преимущественно мужчины (3:1), у женщин рак пищевода не входит в список 10 наиболее распространённых онкологических заболеваний. Учитывая анатомическую структуру пищевода, самой частой формой рака пищевода в мире является плоскоклеточный рак.
На втором месте — аденокарцинома пищевода — рак, исходящий из железистого эпителия.
Анатомия пищевода
Пищевод представляет собой полую мышечную трубку, которая соединяет глотку и ротовую полость с желудком. Стенка пищевода построена из слизистой оболочки, подслизистой основы, мышечной и адвентициальной оболочек. Мышечная оболочка пищевода состоит из двух слоев: наружного продольного и внутреннего циркулярного. В верхней части пищевода мышечная оболочка образована поперечно-мышечными волокнами. Примерно на уровне одной трети пищевода (считая сверху) поперечно-полосатые мышечные волокна постепенно заменяются гладкомышечными. В нижней части мышечная оболочка состоит только из гладкомышечной ткани.
Слизистая оболочка покрыта многослойным плоским эпителием, в подслизистой оболочке находятся слизистые железы, открывающиеся в просвет органа.
В пищеводе слизистая оболочка кожного типа. Эпителий многослойный плоский неороговевающий, лежит на тонковолокнистой соединительной ткани — собственном слое слизистой оболочки, состоящем из тонких пучков коллагеновых волокон; содержит также ретикулиновые волокна, соединительнотканные клетки. Собственный слой слизистой оболочки вдаётся в эпителий в виде сосочков.
Особенностью пищевода является отсутствие у него серозной оболочки, наружной слой представлен адвентицией, рыхлой соединительной тканью. Лишь в нижней трети пищевод, точнее его абдоминальный отдел, покрыт серозой.
Распространенность рака пищевода
Примерно 80% всех случаев рака пищевода диагностируются в развивающихся странах, где доминирующей гистологической формой является плоскоклеточный рак. В то же время аденокарцинома, за редким исключением, встречается только в индустриально развитых странах.
Для заболеваемости раком пищевода характерна выраженная географическая вариабельность со 100- и более кратной разницей между высшими и низшими показателями. Самая высокая заболеваемость (>150) отмечена в Иране и других странах т.н. Каспийского пояса, а именно, в некоторых районах Туркменистана и Казахстана, прилегающих к Каспийскому морю, а также в Каракалпакии, причем в этих эндемических по раку пищевода регионах заболеваемость высока как среди мужчин, так: и среди женщин. Заболеваемость раком пищевода в Муйнакском районе Каракалпакии составляет 126 – среди мужчин и 150 — среди женщин. Другие очаги высокой заболеваемости – некоторые регионы Китая. Высокая заболеваемость отмечается также в Зимбабве среди чернокожих мужчин (19). В развитых странах относительно высокая заболеваемость раком пищевода (>10) регистрируется во Франции (Кальвадос –17) и в США среди чернокожих мужчин (11).
В России заболеваемость раком пищевода относительно невысока и сравнима с аналогичными показателями в других странах Европы. Однако в некоторых регионах, например в Якутии, заболеваемость раком пищевода значительно выше. Очень высокая частота развития рака пищевода (более 150) отмечается среди малочисленных народов Севера и Дальнего Востока России. Смертность от рака пищевода коррелирует с показателями заболеваемости и имеет те же географические особенности.
Заболеваемость раком пищевода снижается в большинстве стран мира, в том числе и в России. Однако в ряде развитых стран за последние годы наметился рост заболеваемости аденокарциномой кардиального отдела пищевода, которая, но данным ряда канцер-регистров, составляет более 50% всех случаев рака пищевода.
При раке пищевода 5-летняя выживаемость колеблется в пределах 5–12% и остается без изменения в течение двух десятилетий.
Причины и факторы риска
Этиология рака пищевода имеет региональные особенности, а также зависит от локализации и гистологического типа опухоли. Основными факторами риска плоскоклеточного рака пищевода в развитых странах являются курение табака и чрезмерное потребление алкогольных напитков. Для аденокарциномы кардии, наряду с этими двумя факторами, важное значение имеет гастроэзофагеальный рефлюкс, который приводит к постоянному раздражению и повреждению слизистой оболочки кардии, ее метаплазии и дисплазии.
Этиология рака пищевода в регионах с очень высокой заболеваемостью до конца не ясна. Скорее всего, очень высокий риск развития рака пищевода в эндемических регионах, а именно в Иране, Центральной Азии и Китае, связан с дефицитом овощей и фруктов и, соответственно, витаминов и других микроэлементов в питании. Кроме того, предполагают, что риск развития рака пищевода повышен в связи с употреблением очень горячих напитков – чая в Иране и Центральной Азии и мате – в Южной Америке. Высказаны предположения о возможной роли орального потребления некоторых форм табака, например бетеля, а также опия. Рассматривается роль ВПЧ и загрязнения продуктов питания канцерогенными грибами.
Развитее плоскоклеточного рака пищевода связано также с другими его заболеваниями, такими как:
- стриктуры (сужение пищевода) на фоне употребления агрессивных жидкостей или длительного пищеводно-желудочного рефлюкса,
- ахалазия кардии,
- склеродермия,
- синдром Пламмера-Вильсона (развитие пищеводных мембран у женщин с железодефицитный анемией).
У пациентов с таким заболеванием как гиперкератоз (ладоней и стоп), имеющего аутосомно-доминантный тип наследования, к 45 годам плосколеточный рак пищевода развивается у 50% больных, а к 55 годам – у 95%.
Рак пищевода симптомы
Ранние формы рака протекают бессимптомно, поскольку для появления затруднения проглатывания пищи (дисфагии) необходимо сужение просвета пищевода менее 15 мм.
К сожалению, более половины пациентов (60%) к моменту установления диагноза имеют распространённую стадию заболевания.
Основными симптомами при раке пищевода являются:
- Дисфагия.
- Боли при проглатывании пищи.
- Спрыгивание съеденной пищей (регургитация).
- Боли и дискомфорт в грудной клетке.
- Чувство инородного тела в пищеводе.
- Осиплость голоса (при вовлечении в процесс возвратного гортанного нерва).
- Появление увеличенных лимфоузлов на шее.
- Снижение массы тела.
Для плоскоклеточного рака характерно развитие местно-распространённого процесса с вовлечением в опухоль прилегающих жизненно-важных анатомических структур, таких как аорта, трахея, главные бронхи, сердце.
Метастазирование плоскоклеточного рака пищевода происходит лимфогенным путём с развитием отдалённых метастазов в печени, легких, костях.
Диагностика
- Основными диагностическими инструментами у больных плоскоклеточным раком пищевода является рентгенография пищевода с барием (выявление злокачественной стриктуры пищевода, ее протяженности и степени сужения пищевода) и эндоскопическое исследование пищевода и желудка с проведением биопсии новообразования.
- С целью установления стадии заболевания, исключения отдалённых метастазов и оценки местной распространенности процесса необходимо проведение МСКТ органов грудной клетки и брюшной полости с внутривенным контрастированием.
- С целью оценки глубины инвазии опухоли проводят эндосонографическое эндоскопическое исследование (одномоментное проведение эндоскопии и ультразвукового исследования).
- У больных с раком пищевода средней трети необходимо проведение фибробронхоскопиидля исключения вовлечения в опухолевый процесс трахеи и главных бронхов.
- ПЭТ/КТ (с 18F-дезоксиглюкозой) мало информативна для определения состояния первичной опухоли (Т) и регионарных лимфатических узлов (N), но по сравнению с КТ демонстрирует более высокую чувствительность и специфичность в обнаружении отдаленных метастазов; ПЭТ/КТ рекомендуется выполнять в том случае, если у пациента нет отдаленных метастазов по данным КТ.
Классификация
Система стадирования рака пищевода по TNM (UICC, 8‐е издание)
Первичная опухоль
Тх Первичная опухоль не может быть оценена;
Т0 Нет признаков первичной опухоли;
Tis Карцинома in situ/дисплазия высокой степени;
Т1 Прорастание опухоли в собственную пластинку или подслизистый слой;
Т1а Опухоль вовлекает собственную пластинку или мышечную пластинку слизистой оболочки Т1b Опухоль прорастает подслизистый слой;
Т2 Прорастание мышечного слоя;
Т3 Прорастание адвентиции;
Т4 Прорастание прилегающих структур;
Т4а Плевра, брюшина, перикард, диафрагма, вена azygos;
Т4b Прилежащие анатомические структуры: аорта, позвонки, или трахея.
Регионарные лимфатические узлы
Nx Регионарные лимфатические узлы не могут быть оценены;
N0 Нет метастазов в регионарных лимфатических узлах;
N1 Поражение 1–2 регионарных лимфатических узлов;
N2 Поражение 3–6 регионарных лимфатических узлов;
N3 Поражение 7 и более регионарных лимфатических узлов.
Отдаленные метастазы
М0 Отдаленных метастазов нет;
М1 Отдаленные метастазы есть.
Регионарными являются следующие группы лимфатических узлов:
- прескаленные;
- внутренние яремные;
- верхние и нижние шейные;
- шейные околопищеводные;
- претрахеальные (билатеральные);
- лимфатические узлы корня легкого (билатеральные);
- верхние параэзофагеальные (выше v. azygos);
- бифуркационные;
- нижние параэзофагеальные (ниже v. azygos);
- задние медиастинальные;
- диафрагмальные;
- перигастральные (правые и левые кардиальные, лимфатические узлы, вдоль малой кривизны, вдоль большой кривизны, супрапилорические, инфрапилорические, лимфатические узлы вдоль левой желудочной артерии).
Категория pN0 может быть установлена только после лимфодиссекции с патоморфологическим изучением не менее 7 удаленных лимфоузлов (при отсутствии в них метастазов).
Рак пищевода лечение
Основным методом лечения является хирургический. Лишь при невозможности хирургического лечения (отказ пациента или функциональные противопоказания) проводится химиолучевая терапия в самостоятельном варианте.
При росте опухоли в пределах слизистой оболочки (T1) возможно выполнение эндоскопической резекции в пределах слизистой оболочки или подслизистого слоя. Эндоскопическая резекция является методом выбора при РП in situ и при тяжелой дисплазии. Кроме того, метод успешно применяется при опухолях пищевода, не выходящих за пределы слизистой оболочки, у больных, имеющих значительный риск хирургических осложнений. При этом 5-летняя выживаемость достигает 85–100%.
Виды операций
- Основным видом операции при РП является трансторакальная субтотальная резекция пищевода с одномоментной внутриплевральной пластикой стеблем желудка или сегментом толстой кишки с билатеральной двухзональной медиастинальной лимфодиссекцией из комбинированного лапаротомного и правостороннего торакотомного доступов (операция типа Льюиса).
- При локализации опухоли в верхнегрудном или шейном отделах возможно выполнение трансторакальной резекции пищевода с анастомозом на шее (операция типа Мак Кейна).
- В некоторых клиниках в качестве альтернативы выполняются трансхиатальные резекции пищевода, которые не могут претендовать на радикальность. Они не должны применяться у пациентов раком грудного отдела пищевода, поскольку из лапаротомного доступа невозможна адекватная медиастинальная лимфодиссекция выше бифуркации трахеи.
- Другим путем уменьшения частоты хирургических осложнений является минимально инвазивная (торако-лапароскопическая) или гибридная (торакотомия + лапароскопия или торакоскопия + лапаротомия) эзофагэктомия или роботассистированная резекция пищевода.
Выбор метода хирургического лечения при опухоли пищеводно-желудочного перехода определяется ее локализацией согласно классификации Зиверта:
- при I типе выполняется операция Льюиса или операция Гэрлока в зависимости от размеров опухоли, в исключительных случаях (при невозможности торакотомии) – трансхиатальная резекция пищевода;
- при II типе выполняется чресплевральная проксимальная резекция (операция Гэрлока) либо чрезбрюшинная проксимальная резекция с широкой диафрагмотомией и высоким анастомозом в средостении (у соматически отягощенных больных);
- при III типе выполняется чрезбрюшинная проксимальная резекция или гастрэктомия.
При клинической стадии II-III вариантами лечения являются:
- предоперационная ХТ + хирургическое лечение;
- предоперационная химиолучевая терапия + хирургическое лечение;
- хирургическое лечение;
- самостоятельная химиолучевая терапия.
Химио и лучевая терапия
Результаты хирургического лечения РП данных стадий остаются неудовлетворительными, 5 лет переживают лишь около 20% больных. В целях улучшения результатов лечения используются различные сочетания лекарственной и лучевой терапий (предоперационная ХТ, предоперационная химиолучевая терапия, самостоятельная химиолучевая терапия).
При клинической стадии IVa (Т4 или множественные метастазы в регионарных лимфатических узлах средостения) основным методом лечения является самостоятельная химиолучевая терапия. Однако вовлечение перикарда, плевры, легкого и диафрагмы не исключает возможности хирургического лечения в случае объективного ответа на предоперационную терапию.
Основными задачами лечения больных РП с отдаленными метастазами являются улучшение качества жизни путем устранения симптомов, обусловленных ростом опухоли, и увеличение продолжительности жизни. Оценка эффективности различных режимов ХТ этой категории больных затруднена в связи с отсутствием рандомизированных исследований, особенно при плоскоклеточном раке. По этой же причине сложно оценить и тот выигрыш, который дает ХТ по сравнению с симптоматической терапией.
Химиотерапия рекомендуется пациентам в удовлетворительном общем состоянии (по шкале ECOG 0–2 балла) при отсутствии выраженной (III–IV степени) дисфагии, затрудняющей адекватное питание пациента. В последнем случае на первом этапе показано восстановление проходимости пищевода (стентирование, реканализация). При дисфагии I–II степени ХТ позволяет добиться уменьшения степени ее выраженности у ряда больных уже к концу первого курса.
Наиболее эффективными препаратами при обоих гистологических вариантах являются цисплатин, фторпиримидины, таксаны.
При плоскоклеточных раках стандартным режимом ХТ остается комбинация цисплатина с инфузией 5‐фторурацила или капецитабином, частота объективных эффектов при использовании подобных режимов составляется около 35%, а продолжительность жизни не превышает 6–8 мес. Карбоплатин уступает цисплатину по непосредственной эффективности, что ограничивает его применение вне программ химиолучевой терапии.
Применение таксанов возможно в составе двухкомпонентных схем с цисплатином или трехкомпонентных комбинаций (с цисплатином и фторпиримидинами). В последнем случае ценой большей токсичности удается повысить объективный эффект до 48%, однако к удлинению продолжительности жизни это, по-видимому, не приводит.
Паллиативное лечение
Наиболее частым симптомом РП является дисфагия. Необходимость в ее устранении может возникать на всех этапах лечения. Для устранения дисфагии используются различные методы:
- эндоскопические процедуры (баллонная дилатация, электро-, аргонно-плазменная или лазерная деструкция, фотодинамическая терапия),
- лучевая терапия (дистанционная или брахитерапия),
- постановка внутрипросветных стентов.
Эндоскопические процедуры дают быстрый, но кратковременный эффект и подходят в тех случаях, когда в ближайшее время будет начато лечение с предполагаемой высокой эффективностью (хирургическое, лекарственное, лучевое).
В том случаях, когда излечение больного невозможно, оптимальными вариантами коррекции дисфагии является брахитерапия, стентирование пищевода или дистанционная лучевая терапия.
Паллиативная химиолучевая терапия не имеет явных преимуществ по сравнению с ЛТ (без ХТ) и сопряжено с большей токсичностью. По результатам исследования стентирование пищевода позволяет быстрее достичь желаемых эффектов, однако при большем сроке наблюдения в сравнении с брахитерапией частота осложнений (миграция стента, боли, перфорация, желудочно-пищеводный рефлюкс) оказалась выше, а частота полного купирования дисфагии – несколько ниже. При развитии пищеводно-бронхиальных или медиастинальных свищей постановка покрытых стентов позволяет купировать данные осложнения у 70–100% больных.
Наблюдение
Активное наблюдение показано больным для раннего выявления рецидива в пищеводе с целью выполнения хирургического вмешательства либо рецидива в средостении с целью проведения химиолучевой терапии. Объем обследования зависит от стадии болезни и предшествующего лечения:
Стадия I (после эндоскопических резекций слизистого/подслизистого слоя) и стадии II–III (после химиолучевой терапии, имеется перспектива для эзофагэктомии в случае рецидива):
- ЭГДС – каждые 3–4 мес. в течение первых двух лет, каждые 6 мес. – в течение третьего года, далее ежегодно до общей продолжительности наблюдения 5 лет.
- КТ органов грудной клетки и органов брюшной полости – каждые 6 мес. в течение первых 2 лет, далее – ежегодно до общей продолжительности наблюдения 5 лет;
Стадия I–III (после хирургического лечения):
- КТ органов грудной клетки и органов брюшной полости – каждые 6 мес. в течение первых 2 лет, далее – ежегодно до общей продолжительности 5 лет.
Другие методы обследований у остальных категорий пациентов рекомендуется выполнять при наличии клинических показаний. Выполнение ПЭТ/КТ и определение маркеров в сыворотке крови для наблюдения за пациентами не рекомендуется.
Хирургическое лечение в отделении торакоабдоминальной хирургии и онкологии РНЦХ
Лечение в отделении проводится по программам ОМС, ДМС, ВМП, а также на коммерческой основе.
Читайте, как попасть на лечение в отделение торакоабдоминальной хирургии и онкологии РНЦХ.
Для записи на консультацию позвоните по телефонам:
Отправьте заявку на консультацию, заполнив форму на нашем сайте и прикрепив необходимые документы.

Свищ пищевода – это появление соединения между пищеводом и окружающими его органами и тканями. Наиболее часто свищи формируются между пищеводом и трахеей, бронхами (пищеводно-трахеальные и пищеводно-бронхиальные), либо с плеврой и средостением (пищеводно-плевральные и пищеводно-медиастинальные).
Приобретенные свищи пищевода являются тяжелым заболеванием и требуют в своем лечении комплексного и персонифицированного подхода.
Причины появления свищей
Частой причиной развития приобретенных свищей являются гнойно-воспалительные осложнения после операций на пищеводе, легких и средостении.
Другими причинами могут служить:
- прорастание злокачественной опухоли,
- перфорация дивертикула пищевода и пептической язвы пищевода,
- туберкулез,
- абсцесс легкого,
- актиномикоз,
- перфорация при эзофагоскопии и бужировании пищевода,
- открытые и закрытые повреждения шеи, груди и живота.
Известны свищи опухолевого происхождения, травматические, а также свищи, возникающие при специфическом и неспецифическом воспалении.
Наиболее часто образуются свищи при злокачественных опухолях. Как правило, они возникают при распаде раковой опухоли пищевода, прорастающей в трахею и бронхи.
Чем опасны свищи
При формирования свищей пищевода возникает контакт внутренней среды организма с внешней. Бактерии извне проникают внутрь, запуская инфекционный процесс в грудной клетке. Это может приводить к развитию пневмонии, эмпиемы плевры, медиастинита.
Свищи пищевода являются относительно редким заболеванием, и настороженность врачей в плане их выявления снижена, что приводит к поздней диагностике, неправильной тактике лечения, несвоевременной специализированной помощи и нередко – к летальному исходу.
Виды свищей
Свищ пищевода может возникать в любом его отделе. Различают наружные и внутренние свищи пищевода в зависимости от того, куда именно происходит «открытие» свища.
- Наружные свищи открываются непосредственно в окружающую среду, на кожу (например, наружный свищ в шейном отделе).
- Внутренние свищи сообщаются, соответственно, с внутренними органами.
В результате появления «соединения» или канала между пищеводом и внешней или внутренней средой происходит поступление содержимого пищевода (съеденной пищи и слюны) в соответствующий орган или полость.
Наиболее тяжело протекающими являются пищеводно-респираторные свищи, при которых происходит попадание содержимого пищевода в легкие через трахеобронхиальное дерево. Это приводит к развитию хронического аспирационного синдрома и, зачастую, к рецидивирующей аспирационной пневмонии.
Симптомы
Симптоматика свищей пищевода зависит от его локализации, длительности заболевания, характера свища, размера, степени вовлечения окружающих структур.
Клинические проявления свищей пищевода значительно варьируют и во многом зависят от основного заболевания/состояния, которое привело к формированию свища у данного пациента.
К пищеводным симптомам при свищах относятся:
- затруднение при проглатывании пищи (дисфагия),
- боли при проглатывании,
- срыгивание съеденной пищей.
При наружном свище на коже отмечается появление свищевого хода (отверстия), из которого поступает содержимое, обычно, гноевидного характера с развитием воспалительных изменений в области свища.
Более сложным является диагностика внутренних свищей.
У большинства пациентов развиваются гнойно-вопалительные осложнения со стороны респираторной системы:
- гнойный бронхит,
- пневмония,
- бронхообструктивный синдром,
- абсцесс и гангрена легких,
- сепсис.
При отсутствии связи с трахеобронхиальным деревом такой яркой клинической картины может не быть. Заподозрить развитие пищеводного свища возможно по неспецифическим симптомам. К ним относятся:
- повышение температуры тела (от субфебрильных цифр до лихорадки),
- немотивированная слабость,
- одышка,
- снижение массы тела,
- серый или цианотичный оттенок кожных покровов.
Диагностика
Диагностика свищей пищевода должна носить комплексный характер.
- Обязательным является проведение рентгенографии и рентгеноскопии пищевода с водорастворимым контрастным веществом (барий использовать не рекомендуется, рисунок 1, 2).

Рисунок 1. Пищеводно-респираторный свищ при рентгенографии/рентгеноскопии пищевода

Рисунок 2. Остатки бария сульфата в бронхах у пациентки с пищеводно-бронхиальными свищами
- Эзофагогастродуоденоскопия для оценки состояния пищевода и верхних отделов желудочно-кишечного-тракта.
- Фибробронхоскопия для оценки состояния трахеобронхиального дерева и возможной верификации зоны свища.
- Сочетанная фибробронхоскопия и эзофагоскопия в том числе с применением красителей (метиленового синего).
- Мультиспиральная компьютерная томография шеи, органов грудной клетки и/или брюшной полости для обнаружения зоны свища, скоплений жидкости, оценки степени поражения легочной паренхимы, плевральной полости и средостения (рисунок 3).

Рисунок 3. Вторичные бронхоэктазы и пневмофиброз нижней доли правого легкого у пациента с пищеводно-бронхиальным свищом и тотальной ожоговой стриктурой пищевода.
Лечение свища пищевода
Лечение может быть консервативным и хирургическим.
Первой задачей является исключение поступления пищи и жидкости в пищевод, что достигается за счет отказа от перорального питания (через рот). Для обеспечения питания пациента в этом случае может быть применено:
- парентеральное питание,
- назоинтестинальный зонд с установкой последнего за связку Трейтца,
- формирование гастростомы или энтеростомы.
С целью предотвращения рефлюкса содержимого желудка в пищевод в отдельных случаях может быть рекомендовано проведение фундопликации.
Обязательным является проведение нутритивной поддержки и антибактериальной терапии. В зависимости от тяжести состояния больного и вовлечения органов грудной клетки и брюшной полости в инфекционный процесс может быть проведено дренирование скоплений жидкости в области свища.
При бесперспективности консервативного лечения, прогрессировании признаков инфекционного процесса показано проведение радикального хирургического лечения.
Хирургический доступ зависит от локализации свища (на шее, в грудной клетке, в брюшной полости).
В зависимости от состояния болезни, операция может проводиться с сохранением или удалением пищевода.
При возможности выполнения органосохраняющей операции:
- Свищевой ход выделяют и иссекают.
- Дефекты стенки пищевода и другого органа поочередно ушивают.
- Линию швов дополнительно укрепляют местными тканями (плеврой, перикардом, мышцей, диафрагмой, сальником и т.п.).
В большинстве случаев при запущенных состояниях: хирургическое лечение может закончиться удалением пищевода с формированием эзофагостомы (для дренирования слюны) и гастро-энтеростомы для обеспечения энтерального питания.
После стабилизации состояния пациента, купирования инфекционного процесса, стабилизации массы тела пациенту будет предложено проведение реконструктивного вмешательства на пищеводе, которое включает проведение загрудинной пластики пищевода (рисунок 4).

Рисунок 4. Пациент с этапным лечение пищеводно-бронхиального свища на фоне тотальной ожоговой стриктуры пищевода и ожоговым стенозом желудка. 1-м этапом пациенту была выполнена эзофагогастрэктмоия с формиованием эзофагостомы м энтеростомы для питания, лобэктомия нижней доли правого легкого. Через 3 месяца пациент поступил для проведения реконструктивного вмешательства на пищеводе. Стрелкой указана эзофагостома на шее (согласие пациента на публикацию фото получено).
Лечение в отделении торакоабдоминальной хирургии и онкологии
Приобретенные свищи пищевода являются грозным потенциально жизне-угрожающим заболеванием!
При подозрении на возникновение свища необходимо консультация в специализированном хирургическом отделении, имеющем опыт лечения пациентов со свищами пищевода и реконструктивных вмешательств.
Целесообразным представляется проведение этапного лечения данного заболевания. Положительный результат лечения можно получить при своевременной диагностике этой патологии, правильном планировании лечения и выполнения хирургического вмешательства в высокоспециализированном хирургическом стационаре.
Наше отделение имеет большой опыт лечения пациентов с приобретенными свищами различной локализации, как с проведение консервативного лечения, так и различных вариантов хирургических вмешательств (органосохраняющих, эзофагэктомии с последующим реконструктивным вмешательством и т.д.).
Лечение в отделении проводится по программам ОМС, ДМС, ВМП, а также на коммерческой основе.
Читайте, как попасть на лечение в отделение торакоабдоминальной хирургии и онкологии РНЦХ.
Для записи на консультацию позвоните по телефонам:
Отправьте заявку на консультацию, заполнив форму на нашем сайте и прикрепив необходимые документы.
МКБ-10
Общие сведения
Причины
Формирование врожденных бронхиальных свищей происходит внутриутробно. Возникновение бронхопищеводных и трахеопищеводных свищей обусловлено неполным разделением дыхательной и пищеварительной систем на определенном этапе эмбриогенеза под влиянием различных факторов, воздействующих на плод (авитаминоза, внутриутробных инфекций, травм, радиации и пр.). В большинстве случаев при таком пороке развития имеется свищевой ход между главным бронхом (обычно правым) и пищеводом. Этиология приобретенных бронхиальных свищей может быть различной:
- Послеоперационные дефекты. Наиболее часто встречаются послеоперационные свищи, обусловленные несостоятельностью культи бронха или ее некрозом, эмпиемой плевры, распространенностью опухолевого процесса по стенке бронха и пр. Как показывают статистические данные, послеоперационные бронхиальные свищи в 2 раза чаще формируются после пневмонэктомий, выполненных по поводу рака легкого, чем после других резекционных вмешательств (лобэктомии, билобэктомии и др.).
- Инфекции легких и бронхов. На втором месте среди причин приобретенных бронхиальных свищей стоят специфические и неспецифические гнойно-деструктивные процессы легких: актиномикоз, туберкулез, абсцесс легкого, бактериальные деструкции легких. Реже к образованию дефекта в стенке бронха приводят спонтанный пневмоторакс, распад раковой опухоли, эхинококкоз легкого, перфорация в бронхиальное дерево дивертикулов пищевода, кисты или абсцесса печени.
- Травматические повреждения. Третья группа факторов, приводящих к формированию бронхиальных свищей, связана с закрытыми травмами грудной клетки, ранением легкого и пр.
Патогенез
Классификация
Кроме деления на врожденные и приобретенные, бронхиальные свищи подразделяются на единичные (62%) и множественные (38%, в т. ч. «решетчатое легкое»). С учетом этиологического фактора они могут иметь посттравматическое, постинфекционное, послеоперационное происхождение. В зависимости от уровня локализации различают свищи главных, долевых, сегментарных, субсегментарных бронхов и альвеолярные фистулы. В клинической практике наибольшую ценность представляет анатомическая классификация, в рамках которой выделяют:
Наружные (торакобронхиальные) свищи
Внутренние свищи
Симптомы бронхиальных свищей
Критериями, определяющими симптоматику бронхиальных свищей, выступают их анатомические особенности, диаметр, сроки образования дефекта, наличие или отсутствие инфекционного процесса. К числу общих симптомов, сопровождающих развитие патологии, относятся признаки интоксикации (лихорадка с ознобами, слабость, разбитость, головная боль, плохой аппетит) и дыхательной недостаточности (цианоз, одышка, боли в грудной клетке). Кроме этого, для различных видов бронхиальных свищей характерны свои специфические проявления.
Наружные (бронхокожные, бронхоплеврокожные) свищи характеризуются наличием видимого дефекта на коже грудной стенки, из которого периодически отходит слизистое или слизисто-гнойное отделяемое, а при кашле и натуживании может выделяться воздух. Попадание в свищевой ход воды провоцирует возникновение резкого приступообразного кашля и приступа удушья. Иногда снятие окклюзионной повязки вызывает усиление кашля, одышки и цианоза, нарушение голоса вплоть до афонии.
Бронхиальные свищи, сообщающиеся с «сухой» плевральной полостью, проявляются сухим кашлем или откашливанием незначительного количества слизистой мокроты. При бронхоплевральных свищах, развившихся на фоне гнойного плеврита, общее состояние больных отягощается гнойно-резорбтивной лихорадкой, интоксикацией, истощением. Отмечается отхождение большого объема гнойной, зловонной мокроты при кашле, выраженная одышка, выделение воздуха из плеврального дренажа, подкожная эмфизема. Клинику бронхолегочных свищей определяют субфебрилитет, кашель с выделением слизисто-гнойной мокроты, потливость, слабость.
Основным признаком бронхоорганных свищей служит откашливание больным содержимого того органа, с которым сообщается бронх: съеденной пищи, желчи, желудочного или кишечного содержимого. Врожденные трахео- и бронхопищеводные свищи могут быть заподозрены вскоре после рождения ребенка на основании поперхивания при кормлении, вздутия желудка, развития аспирационной пневмонии. Основным проявлением приобретенных свищей служит кашель, связанный с приемом жидкости и пищи, иногда – удушье.
Осложнения
Длительное течение бронхиальных свищей может привести к возникновению пневмонии и хронической эмпиемы плевры. Возможны осложнения в виде кровохарканья или легочного кровотечения, аспирационной пневмонии другого легкого. Системные последствия представлены сепсисом, массивным внутренним кровотечением, висцеральным амилоидозом.
Диагностика
При осмотре пациента с предполагаемым диагнозом «бронхиальный свищ» обращает внимание цианоз кожи и слизистых, одышка, тахикардия, характерная деформация концевых фаланг пальцев («барабанные палочки», «часовые стекла»). Аускультация выявляет рассеянные разнокалиберные хрипы.
Бронхокожные свищи, открывающиеся на поверхности грудной стенки, обнаруживаются визуально. С диагностической целью может быть проведено зондирование свища с введением водного раствора метиленового синего. Возникновение кашля с выделением окрашенной мокроты подтверждает наличие бронхиального свища. Для получения информации о протяженности и конфигурации свищевого хода производится фистулография с контрастными веществами. В ряде случаев уточнить локализацию, количество, размеры свищевых ходов позволяет диагностическая торакоскопия, выполняемая через свищевое отверстие в грудной стенке.
Лечение бронхиальных свищей
В большинстве случаев бронхиальные свищи требуют оперативного лечения. Вместе с тем, в отношении некоторых фистул бронхов может быть применена консервативная тактика. Лечением данной патологии должны заниматься торакальные хирурги, владеющие всем арсеналом методов ведения больных с бронхиальными свищами. Консервативное лечение бронхиальных свищей предполагает проведение мероприятий по санации гнойных полостей: дренирование плевральной полости, промывание антисептическими растворами, введение протеолитических ферментов и антибиотиков, удаление инородных тел, наложение аппарата активной аспирации и т. п. После облитерации остаточных полостей возможно самострельное закрытие небольших бронхиальных свищей.
Имеется положительный опыт ликвидации свищей с помощью химического прижигания или электрокоагуляции фистулы, позволяющих разрушить эпителиальную выстилку и стимулировать рост соединительной ткани в канале. При крупных фистулах может применяться временное эндоскопическое закрытие свищнесущего бронха специальной поролоновой пломбой – такая тактика позволяет осуществить лаваж гнойной полости и создать благоприятные условия для оперативной ликвидации бронхиального свища.
Консервативное лечение бронхиальных свищей оказывается успешным лишь в 10-12% случаев, поэтому большинству пациентов показано оперативное закрытие дефекта. Для оперативного устранения торакобронхиального свища может выполняться его иссечение с последующим ушиванием, мышечная пластика лоскутом на ножке. При послеоперационных свищах показано выполнение реампутации культи бронха. Устранение пищеводно-бронхиальных свищей требует ушивания дефектов со стороны пищевода и бронха, возможно – резекции измененной части легкого. Закрытие бронхоплеврального свища может производиться с помощью интраплевральной торакопластики или декортикации легкого.
Прогноз и профилактика
Исход и перспективы выздоровления зависят от причины, приведшей к формированию бронхиального свища, полноты, адекватности и своевременности лечебных мероприятий. Наиболее серьезный прогноз и высокая летальность (30-70%) отмечается при послеоперационных свищах, осложненных эмпиемой плевры. При возникновении бронхиального свища выжидательная тактика недопустима; необходимо как можно более раннее начало консервативных мероприятий, проведение хирургического вмешательства после необходимой подготовки. Профилактика приобретенных бронхиальных свищей заключается в соблюдении техники обработки культи бронха, своевременной терапии гнойно-деструктивных заболеваний легких, предупреждении травм грудной клетки.
1. Лечение постпневмонэктомических бронхиальных свищей в торакальной онкохирургии: обзор литературы и собственный опыт/ Душко Н.Е.// Клиническая онкология. - 2015 - №2 (18).
2. Хирургическая тактика при бронхиальных свищах после пневмонэктомии/ Худайбергенов Ш.Н., Ирисов О.Т., Хаялиев Р.Я., Эшонходжаев О.Д.// Клиническая медицина Казахстана. - 2013 - №2 (28).
3. Трахеофибробронхоскопия в лечении бронхиальных свищей/ Худайбергенов Ш.Н., Ирисов О.Т., Хаялиев Р.Я., Эшонходжаев О.Д.// Клиническая медицина Казахстана. - 2013 - №2 (28).
Трахеопищеводный свищ – это патологическое соустье, соединяющее просвет дыхательного горла с пищеводом. Может являться аномалией развития или приобретенной патологией. Трахеопищеводный свищ проявляется приступами кашля во время приема пищи, которые сопровождаются удушьем, цианозом, выделением пенистой мокроты с кусочками пищи. Часто развивается аспирационная пневмония. Подтверждающая диагностика проводится с помощью эндоскопических методов (эзофагоскопии, трахеобронхоскопии), рентгенографии пищевода. Лечение исключительно оперативное – закрытие трахеопищеводного свища, нередко с одномоментной трахеопластикой, циркулярной резекцией трахеи, эзофагопластикой.
МКБ-10
Общие сведения

Причины
Врожденный трахеопищеводный свищ образуется к 4-6-й неделе эмбриогенеза при неполном разделении первичной кишки и дыхательной трубки. При рождении дети с данной аномалией обычно имеют массу тела менее 2500 г.
Природа происхождения приобретенных трахеоэзофагеальных фистул может быть различной. Чаще всего с такой патологией приходится сталкиваться онкологам, а сами свищи возникают в результате далеко зашедшего рака пищевода или трахеи, лимфом, лимфогранулематоза. Второй по распространенности причиной служат травмы пищеварительной и дыхательной трубки (в том числе их ятрогенные повреждения), полученные при проведении эзофагоскопии, бужировании пищевода, перфорации пищевода или трахеи инородными телами, вследствие химических ожогов пищевода, при закрытых и проникающих ранениях шеи и груди. Возможно непреднамеренное повреждение трахеи и пищевода при операционных вмешательствах в этой области.
В анестезиолого-реанимационной практике отмечены случаи образования пролежней от трахеостомической или интубационной трубки, приводящие к формированию трахеопищеводного свища. К числу редких причин относят перфорацию дивертикула пищевода в трахею. Трахеопищеводный свищ может явиться осложнением неспецифической бактериальной инфекции (эмпиемы плевры, абсцесса легкого, гнойного медиастинита) или специфических воспалительных процессов (туберкулеза внутригрудных лимфатических узлов, сифилиса, актиномикоза).
Классификация
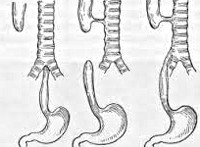
По своему происхождению трахеопищеводные свищи могут быть врожденными или приобретенными в процессе жизни. Различают 5 типов врожденных трахеопищеводных свищей, обозначаемых римскими знаками:
По наличию/отсутствию клапанного механизма трахеопищеводные свищи подразделяются на клапанные и бесклапанные. При единственном дефекте говорят об изолированном свище, при сочетании с другими патологическими процессами трахеи или пищевода – о сочетанном. Клиническое течение трахеопищеводных свищей может быть неосложненным, гладким или осложненным различными состояниями (аспирационной пневмонией, нутритивной недостаточностью и кахексией, бактериальной деструкцией легких, пневмогенным сепсисом и т. д.).
Симптомы трахеопищеводного свища
Клиническая картина, ее выраженность и особенности зависят от времени возникновения, размеров, типа, направления хода свища. Большинство детей с данной аномалией рождаются недоношенными, а доношенные новорожденные имеют признаки внутриутробной гипотрофии. Во время гестации у беременных отмечается многоводие.
Признаки врожденного трахеопищеводного свища с атрезией пищевода появляются уже через несколько часов после рождения. Возникает кашель, приступы удушья, вздутие живота. Во время первого же кормления диагноз становится очевиден. Каждый глоток молока или воды сопровождается приступом кашля, выделением пенистой слизи из носа и рта ребенка. Дыхание затрудняется, развивается резкий цианоз и аритмия, в легких выслушиваются обильные крупнопузырчатые хрипы. Рано присоединяется аспирационная пневмония и ателектазы легких. Состояние ребенка прогрессивно ухудшается.
Наиболее выражены перечисленные признаки при широком и коротком трахеопищеводном свище. При наличии узкого и длинного свищевого хода аномалия долгое время нередко остается нераспознанной. Изредка при кормлении возникает поперхивание и несильный кашель, однако изменение позы кормления избавляет ребенка от приступов, поэтому родители не придает этому факту должного значения. Такие дети страдают частыми пневмониями.
У 40% новорожденных с трахеопищеводным свищом выявляются сопутствующие врожденные пороки сердца, аномалии развития кишечника и мочевыводящих путей. В литературе описан синдром VATER, включающий в себя аномалии развития позвоночника (клиновидные позвонки), атрезию заднего прохода, трахеопищеводный свищ, гипоплазию лучевой кости и дисплазию почек.
Приобретенный трахеопищеводный свищ манифестирует кашлем, удушьем, цианозом, связанными с приемом пищи. В откашливаемом секрете можно обнаружить кусочки еды. При клапанной трахеоэзофагеальной фистуле кашель может отсутствовать. Нередко у больных отмечаются боли в груди и эпигастрии, кровохарканье, рвота с примесью крови, одышка, нарушение фонации, снижение массы тела. Во всех случаях трахеопищеводный свищ сопровождается периодическими подъемами температуры, рецидивирующими легочными инфекциями.
Диагностика
При подозрении на трахеопищеводный свищ пациент нуждается в консультации торакального хирурга, гастроэнтеролога, детского хирурга, эндоскописта, рентгенолога. На первичном этапе используется зондирования пищевода с помощью резинового катетера: если продвижению катетера мешает сопротивление слепого конца пищевода, а при введении в катетер жидкости, окрашенной метиленовым синим, она при кашле выделяется через рот или нос, вероятность трахеопищеводного свища оценивается как очень высокая.
Лучевое исследование включает выполнение рентгеноскопии и рентгенографии легких, эзофагографии, МСКТ грудной клетки. Контрастное исследование пищевода проводят очень осторожно, используя водорастворимые или масляные вещества, которые вводятся через зонд (применение сульфата бария в этих случаях недопустимо). Трахеопищеводный свищ требует проведения тщательной дифференциальной диагностики с изолированной атрезией и стенозом пищевода, гастроэзофагеальным рефлюксом, ахалазией кардии, дисфагией различного генеза.
Эндоскопическая диагностика трахеопищеводного свища остается основной. Для лучшей визуализации патологического соустья и получения максимальной информации о его особенностях, выполняется эзофагоскопия и трахеобронхоскопия. При критическом стенозе трахеи диагностическая трахеоскопия может быть трансформирована в лечебную процедуру путем эндоскопического восстановления просвета трахеи или стентирования стенозированного участка.
Лечение трахеопищеводного свища
Лечение проводится хирургическим путем, консервативная терапия малоперспективна и используется только на этапе подготовки к оперативному вмешательству. С целью удаления скапливающегося секрета производится установка катетера в слепо заканчивающийся конец пищевода, выполняются санационные бронхоскопии. В рамках лечения аспирационной пневмонии назначается оксигенотерапия, антибактериальная и инфузионная терапия, УВЧ на грудную клетку. Для предотвращения попадания пищи в трахеобронхиальное дерево полностью прекращается кормление через рот, осуществляется гастростомия, нутритивная поддержка, витаминотерапия.
Варианты радикального хирургического устранения трахеопищеводного свища могут быть различны. Операция обычно производится из шейного доступа или заднебоковой торакотомии. Длинный свищевой ход выделяют и пересекают между двумя наложенными лигатурами. Дефекты в стенках пищевода и трахеи ушивают погружными швами. При коротком и широком свищевом ходе трахею отсекают от пищевода, после чего на оба дефекта накладывают непрерывный двухрядный шов. Для закрытия дефекта могут использоваться аутоткани (сальник или стенка желудка).
В тех случаях, когда трахеопищеводный свищ сочетается со стенозом трахеи либо атрезией пищевода, производится разобщение свища с одномоментной циркулярной резекцией или пластикой трахеи и/или одномоментной пластикой пищевода. Если имеется большой диастаз между проксимальным и дистальным сегментами пищевода, не позволяющий наложить анастомоз «конец-в конец», верхний отдел пищевода выводят на шею, свищ разобщают и на этом операцию заканчивают.
В межоперационный период питание больного осуществляют через гастростому. На втором этапе производят пластику пищевода желудочным или тонкокишечным трансплантатом. При трахеопищеводных свищах, обусловленных распадом раковой опухоли, ограничиваются паллиативной гастростомией. В послеоперационном периоде продолжается активная противопневмоническая терапия. В первые сутки осуществляется парентеральное питание, затем – кормление через зонд, который оставляют на 7-10 суток.
Прогноз
Из послеоперационных осложнений возможны стенозы в области пищеводных анастомозов, которые подлежат бужированию, и рецидивы свища, требующие повторной операции. Летальность при оперативном лечении трахеопищеводного свища составляет 10-15% и связана, главным образом, с исходно тяжелым состоянием пациента. В то же время при отказе от операции показатели летальности возрастают до 80-90%.
Читайте также:

