Неопластические изменения кожи что это
Обновлено: 25.04.2024

На коже произошли тревожные изменения? А может на глаза попала новая родинка? Или родинка, которая была с детства, увеличилась в размерах, изменила форму или цвет? Не паникуйте, просто покажитесь дерматологу.
Изменения на коже — что такое пигментные пятна?
У большинства людей есть пигментные родинки, которые представляют собой симметричные, плоские или слегка выпуклые пятна с правильными чертами и однородного цвета. У человека около 15–25 пигментных отметин. Их количество генетически определено и у людей со светлой кожей обычно больше.
У детей родинки имеют тенденцию постепенно увеличиваться в размерах по мере роста. Однако у взрослых старше 35 лет количество родинок не должно увеличиваться или менять форму. Поэтому каждое новое и увеличивающееся образование следует подвергать дерматологическому наблюдению из-за риска рака кожи.
Неопластические изменения на коже — меланома
Некоторые пигментные изменения со временем могут стать злокачественными и трансформироваться в раковые изменения. В этом случае развивается меланома. Эта опухоль может метастазировать во внутренние органы и является одним из самых злокачественных онкологических образований.
До сих пор меланома была раком, характерным для пожилых людей после 60 лет. За последние двадцать лет заболеваемость этим видом рака увеличилась на 300% и связана с изменением образа жизни, моды на солнечные ванны. Это также относится и к молодежи в возрасте 20–30 лет.
Ежегодно регистрируется примерно 2 500–3 000 случаев меланомы. Важно раннее выявление для снижения риска смерти от этого вида рака.
Как распознать кожные изменения?
Обнаружение злокачественных изменений кожи на самой ранней стадии возможно благодаря самоконтролю. Не мешает сделать дерматоскопическое или видеодерматоскопическое обследование.
- Дерматоскопическое обследование позволяет наблюдать структуру и цвет эпидермиса и верхних слоев кожи с 10–20-кратным увеличением.
- Видеодерматоскопия помогает контролировать «серую зону». Это безболезненное обследование, которое позволяет оцифровывать изображение, архивировать его и сравнивать изменения с течением времени. Продолжительность исследования составляет примерно 15–20 минут.
Использование передовых методов диагностики, таких как видеодерматоскопия, не только способствует более раннему выявлению и удалению злокачественных образований, но также позволяет более точно подтвердить доброкачественный характер поражений и отсутствие необходимости их удаления, что связано с избежанием небольшого, но неприятного хирургического вмешательства и стресса
Изменения кожи и эстетическая медицина
Эстетическая медицина обладает необычайной силой, которая без помощи скальпеля лечит комплексы и добавляет уверенности, улучшает самочувствие и тем самым влияет на качество жизни. Поэтому неудивительно, что интерес к этой отрасли медицины с каждым годом растет все больше.
Эстетическая медицина — одна из самых молодых областей медицины. Ее отцом считается французский эндокринолог Жан Жак Легран, который первым основал Французское общество эстетической медицины в Париже в 1973 году.
Лечение кожных поражений
Интерес к эстетической медицине растет с каждым годом. Этот раздел медицины фокусируется на выявлении естественной красоты, а не на искусственном увеличении красоты. Обладает необычайной силой излечивать комплексы без скальпеля, улучшать самочувствие пациентов и останавливать время.
В кабинетах эстетической медицины проводятся процедуры для замедления процессов старения, ухода за здоровой кожей, придания упругости, объема, эластичности и устранения морщин.
Эстетическая медицина также:
- диагностирует и лечит больную кожу,
- борется с прыщами, обесцвечиванием, рубцами, эритемой,
- закрывает капилляры.
Эстетическая медицина — процедуры для исправления дефектов красоты, которые являются серьезной проблемой для пациента и проблемой в повседневной жизни. Эстетическая медицина способна улучшить качество жизни и повысить уверенность в себе.
В кабинетах эстетической медицины проводятся процедуры различной степени инвазивности с использованием различных препаратов. Самыми популярными являются процедуры для лица.
Процедуры эстетической медицины для лица включают:
- пилинги,
- мезотерапию;
- микродермабразиЮ.
Мезотерапия — один из самых эффективных методов замедления процесса старения лица, шеи и декольте. Он заключается в доставке целебных, регенерирующих и питательных веществ непосредственно на кожу.
Мезотерапия работает лучше, чем самый дорогой и технологичный крем, потому что доставляет активные вещества прямо в дерму, то есть на глубину 4-6 мм. Благодаря мезотерапии кожа выглядит моложе, лучше увлажненной и упругой.
Еще одна популярная процедура для лица, проводимая в клиниках эстетической медицины, — это микродермабразия, то есть механический пилинг. Заключается в растирании эпидермиса или дермы. Он изготавливается с помощью кристаллов корунда или специальной алмазной головки.
Микродермабразия особенно рекомендуется людям, которые хотят бороться со следующими патологиями:
- угревая сыпь,
- шрамы от прыщей,
- черные точки,
- изменение цвета,
- пятна,
- дефицит коллагена,
- признаки усталости, неглубокие морщинки.
После процедуры кожа становится более свежей, молодой и эластичной.
Процедуры при кожных изменениях на лице
Очень популярны процедуры, проводимые в кабинетах эстетической медицины, с использованием ботулотоксина и гиалуроновой кислоты.
Ботулинический токсин, широко известный как ботулин, используется для лечения мимических морщин. Вводят с помощью одноразового шприца с очень тонкой иглой. Процедура короткая, обычно не более 15-20 минут.
Ботулинический токсин начинает действовать уже через два-три дня после инъекции. Полный эффект виден примерно через неделю и длится в среднем шесть месяцев. В результате морщины полностью или частично разглаживаются, не влияя на общую мимику.
При статических морщинах, появляющихся с возрастом, обычно используется гиалуроновая кислота. Это вещество, которое содержится в нашем организме поэтому реакции отторжения возникают редко.
Гиалуроновая кислота используется в следующих случаях:
- заполнение борозд и морщин,
- моделирование лица, носа, рта, подбородка,
- поднятие линии бровей,
- устранение теней под глазами.
Эффект от лечения гиалуроновой кислотой сохраняется до двух лет.
Изменения кожи — консультация дерматолога
Каждой процедуре, проводимой в кабинетах эстетической медицины, должна предшествовать консультация врача хотя бы потому, что не все процедуры можно проводить в любое время года.
В период высокой инсоляции, то есть весной, летом до начала осени, нельзя проводить фотосенсибилизирующие процедуры: механические пилинги, ферментные пилинги, лазерные процедуры. Воздействие солнца после выполнения этих процедур может вызвать всевозможные осложнения.
В период сильного пребывания на солнце выбрать лечение ботулотоксином, гиалуроновой кислотой или другими продуктами, которые можно вводить с помощью мезотерапии или инъекций. В этот период можете выполнять целый ряд фотосенсибилизирующих физиотерапевтических процедур.
Изменения на коже — осложнения после процедуры
Консультация врача важна и по другой причине. Процедуры эстетической медицины несут в себе высокий риск побочных эффектов, особенно аллергических реакций. В большинстве случаев их можно избежать благодаря хорошо составленному анамнезу.
Во время консультации врач определяет ожидания пациента. Проводит медицинское собеседование, то есть квалификацию для процедуры. Проверяет, можно ли выполнить процедуру при текущем состоянии здоровья пациента, оценивает эффект от лечения и возможно ли оно вообще. В интервью спрашивает, какие лекарства принимает пациент. Существует целый список исключений, которые могут лишить пациента права выполнять определенные процедуры.
Поэтому очень важно, чтобы перед тем, как принять решение о конкретной процедуре, сначала ознакомились с персоналом, работающим в том или ином кабинете эстетической медицины.
Иногда методы лечения относительно просты в исполнении. Их с одинаковым успехом могут проводить косметолог и врач. Разница в том, что при возникновении осложнений, а это может произойти при любой процедуре, врач может принять соответствующие лечебные меры: предложить лекарственный препарат, выписать рецептурный препарат.
Каждая процедура в области эстетической медицины сопряжена с определенным риском осложнений, которые часто возникают не из-за техники процедуры, а из-за реакции организма или обстоятельств, влияющих на ход процедуры, а также послеоперационного восстановления.
Врач может сделать больше, чем косметолог — соответствующую медицинскую помощь или терапию. Следует также помнить, что для многих процедур эстетической медицины существуют очень специфические медицинские противопоказания, которые необходимо определить, признать, нужно знать, что спросить у пациента, дабы выявить подходит ли процедура для кожи.
Также стоит помнить, что косметолог без высшего медицинского образования не имеет права проводить все процедуры. Такие препараты, как гиалуроновая кислота или ботулотоксин, из-за возможных нежелательных побочных эффектов должны использоваться и вводиться только врачами, занимающимися эстетической медициной.

Дисплазия шейки матки — CIN — цервикальная интраэпителиальная неоплазия — SIL (плоскоклеточное интраэпителиальное поражение) — предраковое состояние. Этот диагноз ставится примерно 10 тысячам женщин в год, при этом от рака шейки матки в итоге погибает 6000 пациенток. Причина — позднее обращение к гинекологу, когда хорошо излечимые стадии CIN1 и CIN2 перешли в трудноизлечимую CIN3.
Консультация гинеколога, уролога — 1000 руб, консультация по результатам УЗИ, анализов — 500 руб. (по желанию).
Что такое дисплазия шейки матки, причины
Рак шейки матки не начинается внезапно, ему предшествую 3 предраковых стадии дисплазии, когда несколько слоев клеток плоского эпителия (выстилающей кожицы) шейки претерпевают изменения. Постепенно нормальные эпителиальные клетки заменяют атипичные — видоизмененные. Они имеют другое строение, размер и меняют свое расположение. В результате эпителий из многослойного, легко обновляющегося, преобразуется в однослойный.
Установлено, что главная причина дисплазии — вирус папилломы человека, вернее его онкогенные типы — 16 и 18 серотипы, передающиеся половым путем. При этом дисплазия не начинается на пустом месте — ей предшествует эрозия шейки матки, которую женщины часто игнорируют, не желая лечить. Иными словами дисплазия — осложнение эрозии. Нелеченная эрозия переходит в дисплазию в 90% случаев.
Это связано с тем, что вирус беспрепятственно поражает незрелые ростковые плоскоэпителиальные клетки, расположенные в зоне эрозии. Такие зоны называют зонами трансформации, поэтому важнейший этап лечения эрозии — обработка (закрытие) этих зон различными методами. В современных клиниках применяются лазерная и радио методика. После обработки радионожом или лазером все пораженные клетки удаляются, закрывая путь для дисплазии
Стадии и симптомы дисплазии шейки матки: CIN 1, CIN 2, CIN 3 — что это?
Дисплазия чаще встречается у женщин старше 25 лет, когда иммунитет ослабляется вследствии смены половых партнеров, что вынуждает постоянно перестраиваться флору влагалища, родов и других причин. Пик заболеваемости приходится на 35 лет. В то же время риск развития раковой опухоли существует и после 65 лет. Английские ученые из Кильского университета доказали, что ВПЧ, попавший в организм ещё в юном возрасте, может годами и десятилетиями не проявляться, активизируясь после климакса.
Болезнь долго протекает бессимптомно, обнаруживаясь случайно на гинекологическом осмотре .
В редких случаях в стадии предрака могут проявляться следующие симптомы:
- выделения из влагалища (мазня);
- выделения после полового акта;
- межменструальные кровотечения;
- боли внизу живота.
Отсутствие ярких типичных признаков делает патологию особенно опасной. Очень рискуют женщины, пренебрегающие профилактическими осмотрами у гинеколога .
Стадии дисплазии обозначают аббревиатурой CIN. Чтобы понять суть процесса по стадиям, рассмотрим таблицу.
Стадия дисплазии шейки матки CIN (Cervical Intraepithelial neoplasia)
Протекающий процесс
Прогноз излечения
CIN 1 (ЦИН 1) — первая стадия патологии, легкая, начальная степень
Изменения слабо выражены, захватывают менее трети толщины эпителия, в рассмотрении от базальной мембраны
Дисплазия 1 степени редко приводит к малигнизации (озлокачествлению). Болезнь уходит после лечения от ВПЧ. Полностью излечима.
CIN 2 (ЦИН 2) — вторая стадия патологии, средняя степень тяжести
Строение эпителиальных клеток изменяется значительно и хорошо выражено. Изменения затрагивают половину толщины слоя
CIN 3 (ЦИН 3) — третья стадия патологии, тяжелая степень
Изменяется более ⅔ клеток плоского эпителия, выстилающего шейку матки
Дисплазия 3 степени трансформируется в рак практически в 100% случаев в течении всего года. Лечится сложно, часто не излечима полностью
Дисплазия требует немедленного лечения, без него она легко меняет стадии, достигая этапа CIN 3, который уже можно считать раком. Более точное название — местный рак, «рак на месте», т.е. ещё на давший метастаз, что оставляет надежду на излечение. Первые стадии предрака СИН 1 и СИН 2 при правильной терапии полностью излечимы.
Что означают термины CIN и SIL
В медицине диагноз дисплазия шейки матки называется по-разному. Чтобы сделать расшифровку диагноза понятной во всем мире была введена единая классификация стадий процесса. Изначально дисплазию обозначали как CIN, что расшифровывалось, как цервикальная интраэпителиальная неоплазия. Более доступно — развитие опухоли в рамках эпителиального пласта.
Когда СИН переходит в рак шейки матки, процесс принимает другой оборот — атипичные клетки прорастают внутрь тканей, выходя за пределы эпителия. Также опухоль дает метастазы, этим CIN отличается рака.
В 2012 г. ВОЗ ввела другую терминологию — CIN заменили на SIL — плоскоклеточное интраэпителиальное поражение — (squamous intraepithelial lesion). Понятие неоплазия изменилось на более объективный термин «поражение». Степеней оставили всего 2 — легкая степень поражения — LSIL (Low grade SIL) и тяжелая степень поражения — HSIL (Hight grade SIL). LSIL приравнена к дисплазии 1 (CIN 1), а HSIL к дисплазии 2-3 (CIN 2 и 3), Многие специалисты до сих пор пользуются первой классификацией, так как она более точно характеризует рамки процесса и позволяет выбрать максимально щадящее лечение.
Обследование при дисплазии шейки матки: как выявить CIN 1, CIN 2, CIN 3
Диагностика дисплазии шейки матки во всем мире осуществляется по стандартам, рекомендованным Всемирной организацией здравоохранения. В России в хороших клиниках используется следующая схема обследования на дисплазию:
- Осмотр гинеколога с применением кольпоскопа (исследование шейки под гинекологическим микроскопом с большим увеличением).
- Цитологический мазок — ПАП-тест (берет гинеколог во время осмотра). Мазок включает клетки эпителия, которые затем изучаются в лаборатории под микроскопом. Выявляются атипичные клетки: количество, качество.
- Биопсия шейки матки . Это дополнительное уточняющее обследование, проводится при плохих показателях мазка на цитологию и кольпоскопии.
- Кровь на онкомаркеры . Если рак уже есть, это будет видно по результатам анализов крови на онкологию.
Первые два обследования на син1, син2 и син3 входят в обязательную программу профилактики онкологических заболеваний в гинекологии. Кольпоскопию и цитологический мазок нужно проходить минимум раз в три года, начиная с 25 лет. Эта программа носит название — скрининг на рак.
Оценка результатов биопсии при СИН 1, 2 и 3
Диагноз дисплазия ставится на наличии в мазке на цитологию атипичных клеток и выявленной потери возможности нормального созревания клеток многослойного плоского эпителия из-за повышенной пролиферации (ускоренное деление) клеток.
Дисплазия первая степень (LSIL, CIN 1)
При дисплазии 1 степени ВПЧ внедряется в клетки, постепенно изменяя строение клеток, вызывая ускорение их роста. При этом это касается не только эрози, аналогичный процесс приводит к образованию остроконечных и плоских кондилом. При крепком клеточном иммунитете, после удаления кондилом, процесс затормаживается. Так как папилломавирус внедряется в геном клеток, вылечить его невозможно, именно поэтому эрозию и папилломы удаляют разными методами, стараясь не оставить пораженных клеток.
Дисплазия вторая — третья степень (HSIL, CIN 2-3)
Развитие диспластического процесса напрямую зависит от иммунитета пациента. И даже при лечении, начатом в этих стадиях, инфекция остается и прогрессирует у 10% женщин, что гарантирует развитие рака. При этом скорость развития процесса может быть разной и доходить до 15 лет. По этой причине, если женщине хотя бы раз был поставлен диагноз CIN 1, контролировать состояние шейки матки ей придется всю жизнь.
Изменения клеток в стадиях CIN 2-3 носят только неопластический характер — т.е. они полностью трансформируются, а границы процесса расширяются. Количество атипичных клеток превалирует, они быстро размножаются, замещая нормальный эпителиальный слой цервикальных желез и даже канала.
Как лечат дисплазию шейки матки в разных стадиях
Как будет проходить лечение, зависит от степени дисплазии.
Стадия дисплазии шейки
Диагностика для подтверждения и контроля динамики
Варианты лечения
Результат анализа — CIN 1
Мазок на цитологию каждые 3 месяца. Кольпоскопия. Анализ на ВПЧ — онкогенные типы.
Дополнительные обследования на воспаление, гормональные нарушения и инфекции половой сферы.
Выжидательная тактика. Противовирусная терапия. Стимуляция иммунитета. Лечение всех сопутствующих заболеваний. Удаление кондилом.
Если анализ CIN 1 плохой более полутора лет, требуется удаление пораженных тканей.
Результат анализа — CIN 2
Углубленное обследование: биопсия, проба Шиллера, эндоцервикальный кюретаж
Назначаются: криотерапия, ФДТ, прижигание током или же более современные щадящие, но очень эффективные методики — лазеротерапия или радиолечение, при значительном поражении эксцизия петлей или же конизация шейки матки. При CIN 2 и 3 должны использоваться вышеперечисленные методы, удаление матки проводится только при эх неэффективности.
Результат анализа — CIN 3
Углубленное обследование каждые 3 месяца: биопсия шейки, расширенная кольпоскопия, эндоцервикальный кюретаж
Лазеротерапия, радиолечение, эксцизия, конизация шейки матки. Если начался рак шейки матки и лечение не помогает, придется удалить матку.
Зависит от многих факторов: состояния организма, степени поражения, применяемой ранее и в настоящее время тактики лечения и т.д.
Для беременных или нерожавших женщин возможна выжидательная тактика при CIN 2 и 3, при условии небольшой площади охвата. Но весь период беременности нужно регулярно сдавать анализы на цитологию и проходить кольпоскопическое обследование.
Где сдать анализы и вылечить CIN 1, CIN 2, CIN 3 в СПБ, цены
Лечение всех стадий предрака требует качественной диагностики и лечения с применением профессионального современного оборудования. Клиника Диана в Санкт-Петербурге приглашает всех женщин — жительниц и гостей города пройти обследование и лечение дисплазии в любой стадии. Гинекологи клиники используют новые аппараты — кольпоскоп и радионож «Фотек» — это лучшее оборудование, рекомендованное Минздравом.
В нашем медцентре можно сдать анализы, пройти кольпоскопию, без боли и осложнений удалить кондиломы, вылечить эрозию и дисплазию (лазер, радионож). Мы делаем любые гинекологические малотравматичные операции, например, конизацию шейки матки, эксцизию электропетлей.
Прием гинеколога стоит всего 1000 руб., прием по результатам анализов — 500 руб. Прием онколога — 1000 руб. На сегодняшний день это практически самая низкая и самая адекватная цена в Санкт-Петербурге.
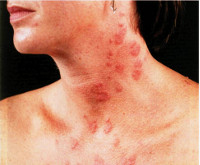
Паранеопластические дерматозы – это группа заболеваний и симптомов поражения кожи, которые возникают под влиянием злокачественных новообразований внутренних органов. По своим проявлениями дерматозы, ассоциированные с раком, имеют много общего с обычными дерматологическими заболеваниями: зуд, экскориации, эритематозные, везикуло-буллезные высыпания, лихенификация, пигментация. Однако они отличаются большей распространенностью поражения и торпидным течением. Диагностика включает выявление характерных симптомов при общем осмотре и дерматоскопии, гистологическое исследование кожи. Достичь ремиссии удается только при условии полного удаления раковой опухоли.
МКБ-10
L99.8 Другие уточненные изменения кожи и подкожной клетчатки при болезнях, классифицированных в других рубриках
Общие сведения
В научной литературе для обозначения этой группы заболеваний также применяется термин «параонкологические дерматозы». Первым, кто обратил внимание на связь доброкачественных дерматозов и онкологического заболевания был французский врач А. Трюссо в 1865 году. Ж. Дарье, прозванный «отцом современной дерматологии» впервые установил связь черного акантоза с раком желудочно-кишечного тракта. Паранеопластические дерматозы развиваются у 27% пациентов с онкологическими заболеваниями. В трети случаев поражение кожи является первым, а порой и единственным признаком, свидетельствующим о развитии рака. Кожные симптомы наблюдаются у 75% онкологических больных с запущенными формами рака.

Причины
Развитие паранеопластических дерматозов определяется растущей раковой опухолью, которая изменяет функционирование всего организма в целом и кожи в частности. Разные виды малигнизированных клеток обладают целым спектром приспособительных реакций, что объясняет многообразие форм паранеопластических процессов. К числу основных механизмов опосредованного влияния опухоли на состояние и функционирование кожи как органа относятся:
- Секреция биологически активных веществ. Раковые клетки синтезируют и выделяют в кровь повышенное количество факторов роста, цитокинов, простагландинов, иммуноглобулинов, энзимов, эмбриональных протеинов, которые изменяют скорость и характер обменных процессов.
- Нарушение работы иммунной системы. Иммуносупрессия – это один из ведущих механизмов сохранения злокачественного новообразования в организме, так как иммунная система в норме распознает перерожденные клетки и уничтожает их. На втором месте по значимости ‒ образование иммунных комплексов, которые взаимодействуют с тканями дермы и вызывают выраженную воспалительную реакцию.
- Нарушение передачи регуляторных сигналов. Изменение физиологического ответа клетки на стимулирующее воздействие происходит в результате образования эктопических рецепторов клеточной мембраны, блокирования нормальных рецепторов биологически неактивными аналогами гормонов, которые синтезируются опухолью.
- Высвобождение биоактивных белков и пептидов. В условиях патологической васкуляризации опухолевого узла при массивном разрушении клеток высвобождается большое количество энзимов и других белковых молекул, присутствие которых в крови и тканевой жидкости не характерно. Они изменяют обменные процессы, провоцируют развитие воспаления, некроза тканей и других патологических реакций.
Патогенез
Значение в развитии параонкологического дерматоза имеет не прямое воздействие опухоли на ткани, а опосредованное ее влияние на обменные, иммунные и биохимические реакции, протекающие в организме. В процессе раковой трансформации нормальные клетки утрачивают специализированные функции и строение, начинают синтезировать и выделять в кровь биологически активные вещества, обеспечивающие рост сосудов, кровоснабжение и питание ракового узла. Следствием этих нарушений становится появление разнообразных клинических симптомов: зуда, сыпи, некроза, воспаления и проч.
Иммунные сдвиги могут возникать на стадии трансформации нормальных клеток в раковые, то есть задолго до формирования опухоли, которую можно выявить с помощью инструментальных и лабораторных диагностических методов. На этом этапе клетки утрачивают способность к дифференциации, синтезируют совершенно несвойственный им в норме спектр продуктов. Развитие паранеопластического процесса в этот период обусловлено распознаванием иммунной системой трансформированных клеток как чужеродных. Иммунными и аутоиммунными комплексами одновременно с раковыми могут повреждаться нормальные клетки.
Классификация
Единой общепринятой классификации паранеопластических дерматозов в клинической дерматологии настоящее время нет. Большинство исследователей сходится во мнении, согласно которому целесообразно разделять все поражения кожных покровов на группы в зависимости от частоты их выявления при злокачественных заболеваниях внутренних органов. Согласно этой классификации все параонкологические дерматозы делятся на:
- Облигатные. Появление паранеопластических кожных симптомов, как правило, обусловлено раком внутренних органов. По клинической картине дерматоза часто можно судить о локализации опухолевого узла и характере протекания онкологического процесса. К этой группе относятся злокачественная форма черного акантоза, круговидная эритема Гаммела, акрокератоз Базекса и проч.
- Факультативные. Связь доброкачественных кожных проявлений и висцерального рака статистически достоверна, однако вероятность одновременного протекания дух процессов ниже, чем для группы облигатных паранеопластических дерматозов. Сюда относят карциноидный синдром, ретикулогистиоцитому, приобретенные пахидермопериостоз и кератодермию ладоней и подошв, буллезный пемфигоид и др.
- Вероятные. Дерматозы из данной группы могут ассоциироваться со злокачественными новообразованиями при прогредиентном течении дерматологического заболевания, устойчивости к проводимой терапии, частом рецидивировании. К группе вероятных паранеопластических дерматозов относят первичный системный амилоидоз, эксфолиативную эритродермию, позднюю кожную порфирию и некоторые другие.
Факультативные паранеопластические дерматозы выявляются в 54% случаев, вероятные в 32%. На долю облигатных паранеоплазий приходится 14%. В 85% случаев облигатные паранеопластические изменения кожных покровов выявляются при запущенных формах рака.
Ряд клиницистов в своей работе использует классификацию паранеопластических дерматозов, которая учитывает морфологические особенности кожных поражений. По этому принципу все параонкологические дерматологические изменения у больных с экстракутанными опухолями, можно разделить на три группы:
- Эритематозные. Сюда относят круговидную ползучую эритему Гаммела, центробежную эритему Дарье, многоформную экссудативную эритему, которые объединяются в группу на основании преобладающего симптома – интенсивного ограниченного покраснения кожных покровов. По статистике, паранеопластические эритематозные дерматозы чаще развиваются у женщин.
- Пруригинозные. Ведущим симптомом паранеопластических пруригинозных дерматозов является интенсивный упорный кожный зуд. Его возникновение связывают с аутоиммунной реакцией, которая вызвана цитолизом тканей. К ним относятся хроническая рецидивирующая крапивница, хроническая почесуха взрослых и узловатое пруриго.
- Везикулобуллезные. Отличительной чертой везикулобуллезных дерматозов является образование пузырей разного размера. К данной группе можно отнести себорейную и вульгарную пузырчатку, буллезный пемфигоид, герпетиформный дерматит Дюринга.
Симптомы паранеопластических дерматозов
По внешним проявлениям поражения кожи напоминают известные дерматозы. Заподозрить связь выявленной кожной патологии со скрыто протекающим онкологическим процессом можно в случаях, когда дерматоз развивается у пациента старшего или пожилого возраста, отличается значительной распространенностью и устойчивостью к терапии. Так, например, при герпетиформном дерматите Дюринга кожный зуд, экзематозные и эритематозные высыпания не поддаются специфической терапии. Часто дерматоз, связанный с висцеральным раком, протекает с нарастанием общих симптомов, таких как слабость, утомляемость, потеря веса.
Первые признаки паранеопластического кожного заболевания появляются одновременно или почти одновременно с раковой опухолью. При этом период между началом дерматоза и выявлением рака может составлять от нескольких месяцев до нескольких лет. Максимальная степень онкологического риска (80%) существует в первые три года после первичной манифестации неспецифических изменений кожи. На фоне успешного хирургического лечения, химио- или лучевой терапии наблюдается быстрый регресс паранеопластических кожных проявлений. При рецидиве рака и метастазировании дерматоз возобновляет свое течение.
Исключением являются злокачественные новообразования, обусловленные наследственными синдромами (нейрофиброматоз, болезнь Кауден, синдромы Гарднера, Мюир-Торре, Пейтса-Егерса). В этих случаях параллелизм течения онкологического заболевания и дерматоза отсутствует, что связано с взаимной генетической детерминированностью опухолевых и неопухолевых элементов.
Осложнения
Поражение кожи на фоне иммуносупрессии создает благоприятные условия для беспрепятственного проникновения в ткани бактерий и грибков, активации дремлющей в организме инфекции. Так, например, частота встречаемости опоясывающего лишая, который вызывается вирусом простого герпеса, значительно выше у пациентов с солидными злокачественными опухолями по сравнению со здоровыми лицами и пациентами, страдающими неонкологическими заболеваниями.
Воспалительный процесс, который развивается при присоединении инфекции, значительно усугубляет состояние пациента, осложняет лечение. Нарушение общего состояния приводит к снижению трудоспособности. Резко снижает качество жизни больных кожный зуд, который изматывает больного, делает сон поверхностным, затрудняет засыпание.
Диагностика
Комплексное обследование пациента с подозрением на паранеопластический дерматоз преследует две основные цели: первая – постановка точного дерматологического диагноза, вторая – онкопоиск. Перечень исследований в каждом конкретном случае определяется клинической картиной и местом предполагаемой локализации первичного ракового узла. Комплексное обследование больного может включать в себя:
- Общий осмотр. Определить вид дерматоза в большинстве случаев можно по данным общего осмотра с дерматоскопией. Дерматозы при неоплазиях необходимо дифференцировать с метастатическим поражением дермы и прорастанием ее опухолью, осложнений терапии, последствий дефицита питания. У женщин на приеме дерматолога проводится пальпация молочных желез при подозрении на рак данной локализации.
- Анализы крови. Выполняются рутинные исследования (общий и биохимический анализы крови), проводятся исследования с помощью иммунных и биохимических методов с целью выявления веществ, синтезируемых опухолью. Количественные показатели исследований позволяют судить о стадии онкологического процесса и степени дифференцировки опухоли.
- Визуализация опухоли. Установить локализацию ракового узла, его размеры, стадию онкологического процесса позволяют методы медицинской визуализации: УЗИ мягких тканей, компьютерная томография и магнитно-резонансная томография. Исследование полых органов проводится с помощью эндоскопии.
- Гистологическое исследование. Образцы кожи получают при проведении биопсии. Микроскопическое изучение биоптата в случае паранеопластического дерматоза проводится с целью постановки правильного диагноза дерматологического заболевания и определения вида опухоли.
Лечение паранеопластического дерматоза
Устранить кожные проявления возможно только в случае излечения основного злокачественного новообразования. Однако дерматологические симптомы могут появиться задолго до выявления рака внутренних органов. Больной может в течение длительного времени нуждаться в симптоматической терапии, которая включает в себя:
- Общее лечение. Назначаются антигистаминные, противовоспалительные препараты, антибиотики, антимикотики в виде таблеток, внутримышечных и внутривенных инъекций. Лечение проводится до тех пор, пока не исчезнут кожные проявления дерматоза и не наступит ремиссия. В ходе терапии дерматолог может менять препараты на более эффективные, если улучшения не наступает.
- Местное лечение. Играет вспомогательную роль при проведении общей терапии. Предполагает локальное нанесение на кожу и слизистые растворов, кремов и мазей с антисептическим, обезболивающим, противозудным, подсушивающим действием. Способствует быстрому облегчению симптомов, предотвращает инфицирование.
Прогноз и профилактика
Особого внимания требуют случаи развития дерматозов у людей старшего и пожилого возраста. У этой категории пациентов риск возникновения онкологического заболевания по сравнению с молодыми людьми повышается многократно. Наличие паранеопластического кожного поражения требует проведения комплексного обследования для выявления рака. Своевременно проведенная диагностика и устранение рака способно продлить жизнь больного на несколько лет. Способы профилактики параонкологических дерматозов не разработаны. Снизить вероятность развития онкологии позволяет здоровый образ жизни, отказ от вредных привычек, устранение вредных производственных и средовых факторов (работа с асбестом и др.).
1. Паранеопластические дерматозы. Сведения об этиологии, патогенезе, клинических проявлениях наиболее часто встречающихся паранеопластических дерматозов/ Болотная Л.А., Сербина И.М.// Международный медицинский журнал. – 2008 - №3.
3. Паранеопластические дерматозы (клиническая лекция)/ Федотов В.П.// Дерматовенерология. Косметология. Сексопатология. - 2013.
4. Паранеопластические дерматозы/ Кузнецова Н. П., Цыренова С. А.// Сибирский медицинский журнал (Иркутск). – 1994.
Паранеопластический синдром – комплекс клинических и лабораторных признаков онкологического заболевания, не связанных с ростом первичного новообразования и появлением метастазов. Обусловлен неспецифической реакцией организма и выделением опухолью биологически активных соединений. Проявляется эндокринными, дерматологическими, сердечно-сосудистыми, нейромышечными, нефрологическими, гастроэнтерологическими, гематологическими или смешанными расстройствами. Диагностируется на основании анамнеза, симптомов и данных дополнительных исследований. Лечение – удаление либо консервативная терапия первичной опухоли.
Общие сведения
Паранеопластический синдром – неметастатические системные клинико-лабораторные проявления онкологического заболевания. Страдают преимущественно больные пожилого и среднего возраста. Паранеопластический синдром чаще возникает при лимфоме, раке легких, раке яичников и раке молочной железы. Иногда становится первым признаком ранее недиагностированного онкологического поражения. Играет как положительную, так и отрицательную роль в процессе диагностики онкологических заболеваний.
При отсутствии клинических проявлений первичного онкологического процесса становится неспецифическим маркером новообразования. Вместе с тем, одновременное появление паранеопластического синдрома и локальных симптомов злокачественной опухоли может усложнять клиническую картину и затруднять распознавание онкологического заболевания. Лечение осуществляют специалисты в области онкологии, эндокринологии, кардиологии, гастроэнтерологии, дерматологии и врачи других специальностей.

Причины паранеопластического синдрома
Основными причинами развития паранеопластического синдрома являются активность злокачественной опухоли и реакции организма на эту активность. Клетки новообразования выделяют биологически активные белки, энзимы, иммуноглобулины, простагландины, цитокины, интерлейкины, факторы роста, активные и неактивные гормоны, влияющие на деятельность различных органов и систем. Контакт нормальных тканей организма с тканью опухоли и выделяемыми ею соединениями провоцирует нормальные иммунные реакции и вызывает развитие аутоиммунных нарушений.
Вероятность возникновения, интенсивность проявлений и характер паранеопластического синдрома зависят от локализации и вида новообразования, способности опухоли выделять различные активные вещества и генетически обусловленной склонности к аутоиммунным нарушениям. Чаще всего паранеопластический синдром развивается при раке легкого. В числе других онкологических заболеваний, часто провоцирующих этот синдром – рак молочной железы, рак яичников, рак почки, лимфомы, лейкозы, гепатоцеллюлярная карцинома, рак желудка, рак поджелудочной железы и опухоли ЦНС.
Характеристика паранеопластических синдромов
Паранеопластические синдромы – обширная группа синдромов, возникающих при злокачественных опухолях. Кроме того, паранеопластические синдромы выявляются при некоторых доброкачественных новообразованиях и заболеваниях неопухолевой природы, в том числе – при ревматических болезнях, хронических неспецифических заболеваниях легких, болезнях сердца, эндокринных заболеваниях и поражении паренхиматозных органов. Возможность вовлечения любых органов и систем, а также разнообразие клинических проявлений паранеопластических синдромов затрудняют создание единой классификации.
Существует несколько вариантов упорядочивания таких синдромов, наиболее распространенным из которых является группировка по органно-системному принципу (с учетом поражения тех или иных органов). Согласно этому варианту, различают эндокринные/метаболические, дерматологические, почечные, нервно-мышечные/неврологические и некоторые другие виды паранеопластических синдромов. Отличительными особенностями всех синдромов являются:
- общие патогенетические механизмы;
- возникновение при онкологических заболеваниях;
- неспецифичность клинической симптоматики и лабораторных показателей;
- возможность развития паранеопластического синдрома до появления локальных признаков опухоли, одновременно с локальными признаками опухоли либо на заключительных стадиях болезни;
- неэффективность терапии, исчезновение синдрома после радикального лечения новообразования и его повторное возникновение во время рецидива.
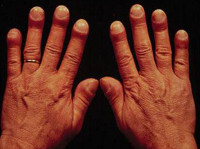
Развитие паранеопластического синдрома до появления местных признаков опухоли может, как облегчать, так и затруднять диагностику основной патологии. Например, синдром Мари-Бамбергера (оссифицирующий системный периостоз, при котором пальцы приобретают вид барабанных палочек) чаще наблюдается при злокачественных поражениях плевры и легких, но не является их специфическим проявлением, поскольку может обнаруживаться и при других заболеваниях, например, при хроническом обструктивном бронхите, циррозе печени или пороках сердца.
Тем не менее, наличие этого паранеопластического синдрома указывает на высокую вероятность патологии дыхательной системы и позволяет достаточно точно определить перечень необходимых обследований. Другие паранеопластические синдромы, например, лихорадка, тромбофлебит или дерматологические поражения могут трактоваться как самостоятельные заболевания, что ведет к недообследованию, назначению неправильного лечения и запоздалому выявлению онкологических поражений, ставших причиной развития данной патологии. Своевременная диагностика и дифференциальная диагностика этой группы патологических состояний остается актуальной проблемой современной онкологии.
Виды паранеопластических синдромов
Гастроинтестинальные паранеопластические синдромы (потеря аппетита, похудание) – самые распространенные синдромы при онкологических заболеваниях. На определенных этапах злокачественного процесса выявляются практически у всех больных. Основными проявлениями паранеопластического синдрома являются потеря аппетита, изменение вкуса, возникновение отвращения к некоторым пищевым вкусам и запахам. После постановки диагноза, прогрессирования локальной симптоматики и начала химиотерапии гастроинтестинальные расстройства могут усугубляться депрессией, страхом перед тошнотой и рвотой, нарушениями проходимости кишечника и другими обстоятельствами.
Гематогенные паранеопластические синдромы выявляются у большинства онкологических больных. Самой распространенной разновидностью этого паранеопластического синдрома является умеренная или нерезко выраженная нормохромная анемия. В анализе периферической крови нередко обнаруживаются другие признаки основного заболевания: повышение СОЭ, лейкоцитоз и сдвиг лейкоцитарной формулы влево. При В-клеточных лимфоидных новообразованиях паранеопластический синдром может проявляться аутоиммунной гемолитической анемией, при меланоме и лимфоме Ходжкина – гранулоцитозом, при лейкозах – тромбоцитопенией, при раке печени и почек – эритроцитозом.
Эндокринные и метаболические паранеопластические синдромы включают в себя разнообразные гормональные и обменные нарушения. При медуллярном раке щитовидной железы может развиваться гипокальциемия, протекающая бессимптомно или сопровождающаяся повышением нервно-мышечной возбудимости. При мелкоклеточном раке легкого паранеопластический синдром проявляется синдромом Кушинга и водно-электролитными нарушениями. Для феохромоцитом характерно повышение артериального давления, для лимфомы Ходжкина – гипоурикемия, для гематосаркомы и острых лейкозов – гиперурикемия.
Сосудистые паранеопластические синдромы обычно проявляются тромбофлебитами. Могут возникать за несколько месяцев до появления первых признаков онкологического заболевания. Чаще всего выявляются при раке молочной железы, опухолях ЖКТ, раке легких и раке яичников. Половина тробмофлебитов у пациентов в возрасте старше 65 лет связаны с развитием злокачественных новообразований. Сосудистые паранеопластические синдромы плохо поддаются антиагрегантной терапии. После оперативных вмешательств развиваются более чем у половины больных онкологическими заболеваниями. Являются третьей по распространенности причиной летальности в послеоперационном периоде.
Дерматологические паранеопластические синдромы отличаются большим разнообразием. Включают в себя преходящую эритему, приобретенный ихтиоз, паранеопластическую пузырчатку и другие расстройства. Выявляются при лейкозах, медуллярном раке щитовидной железы и некоторых других онкологических заболеваниях.
Неврологические/нервномышечные паранеопластические синдромы сопровождаются поражением центральной и периферической нервной системы. Могут проявляться энцефалитом, деменцией, психозами, синдромом Ламберта-Итона (слабость мышц конечностей, напоминающая миастению, при сохранении тонуса глазных мышц; обычно возникает при опухолях в области грудной клетке, чаще всего при раке легкого), синдромом Гийена-Барре (периферическая нейропатия, выявляется у некоторых больных лимфомой Ходжкина) и другими периферическими нейропатиями.
Ревматологические паранеопластические синдромы встречаются как при ревматоидных заболеваниях, так и при злокачественных новообразованиях. Системный склероз, полимиалгия и ревматоидный артрит характерны для гемобластозов и опухолей толстого кишечника. Паранеопластический синдром в виде вторичного амилоидоза выявляется при почечно-клеточном раке, лимфомах и миеломе. Гипертрофическая остеопатия может наблюдаться при некоторых разновидностях рака легкого.
Простатическая интраэпителиальная неоплазия – патологическое состояние, сопровождающееся образованием очагов роста клеток предстательной железы с признаками их атипичного перерождения. Протекает бессимптомно. Рассматривается специалистами в качестве морфологического предшественника рака предстательной железы с высокой вероятностью злокачественной трансформации. Диагноз выставляется с учетом данных пальцевого ректального исследования, УЗИ, определения уровня простат-специфичного антигена и результатов гистологического исследования. Показано динамическое наблюдение. Может применяться диетотерапия, гормональная терапия и лучевая терапия.

Общие сведения

Причины ПИН
Причины развития точно не выяснены. Специалисты указывают, что определенную роль играет неблагоприятная наследственность. У пациентов нередко выявляются гены BRCA1 и BRCA2, при которых наблюдается повышение вероятности развития аденокарциномы предстательной железы. Риск возникновения ПИН также повышается при хроническом простатите и наличии в анамнезе инфекций, передающихся половым путем.
В качестве факторов риска простатической интраэпителиальной неоплазии указывают ионизирующее излучение, длительный контакт с кадмием при выполнении профессиональных обязанностей, употребление большого количества животных жиров, недостаток ультрафиолетовых лучей, обусловленный продолжительным пребыванием в северных регионах, пожилой возраст, иммунные нарушения, нехватку некоторых витаминов и микроэлементов.
Классификация ПИН
Классификация данного патологического состояния претерпевала неоднократные изменения. Вначале специалисты выделяли три степени ПИН: легкую умеренную и выраженную. Затем из-за затруднений при определении степеней поражения в 1989 году приняли упрощенную классификацию с двумя группами ПИН: низкой и высокой степени. Низкая (первая) степень характеризовалась незначительными изменениями клеток, могла свидетельствовать о низком риске злокачественной трансформации, наблюдаться при доброкачественной гиперплазии (аденоме) или хроническом воспалении предстательной железы. При высокой (второй) степени простатической интраэпителиальной неоплазии в ткани простаты выявлялись клетки с выраженными признаками атипии.
В последующем эта классификация перестала быть общепринятой, хотя некоторые специалисты продолжают применять данное разделение на группы в клинической практике. В наши дни большинство онкологов и урологов пользуются следующей классификацией неопластических изменений тканей предстательной железы:
- Атипическая гиперплазия (устаревшее – ПИН первой степени). Вероятность злокачественной трансформации при этом состоянии колеблется от 15 до 20%.
- Простатическая интраэпителиальная неоплазия (устаревшее – ПИН второй степени). Риск злокачественного перерождения при данном поражении составляет более 85%.
- Рак или клеточная атипия. Не рассматривается в качестве варианта ПИН, но может выявляться одновременно с этим заболеванием.
Основными признаками простатической интраэпителиальной неоплазии являются: нарушение структуры эпителиальной выстилки протоков с утратой четкого разделения на клеточные слои, а также характерные изменения клеток эпителия с увеличением ядер и появлением крупных везикулярных включений. Реже выявляются клетки с мелкими гиперхроматичными ядрами. В центральной или периферической части ядер может обнаруживаться несколько ядрышек однородной либо неоднородной структуры. С учетом особенностей гистологического строения различают 4 формы простатической интраэпителиальной неоплазии: пучковую, плоскую, крибриформную и микропапиллярную. Пучковая форма наблюдается в 97% случаев. Обычно при изучении препарата обнаруживается сочетание нескольких форм.
Диагностика и лечение ПИН
Диагноз ПИН выставляют после проведения пункционной биопсии и последующего гистологического исследования в связи с подозрением на аденокарциному предстательной железы. Наряду с биопсией в процессе обследования осуществляют пальцевое ректальное исследование простаты, трансректальное УЗИ предстательной железы и определение уровня простат-специфичного антигена (ПСА) в плазме крови. При выявлении атипической гиперплазии (ПИН первой степени) решение о проведении последующих диагностических мероприятий принимается индивидуально. В зависимости от возраста больного и результатов других исследований возможны как динамическое наблюдение, так и повторная биопсия. При обнаружении простатической интраэпителиальной неоплазии (ПИН второй степени) через 1-3 месяца показана расширенная биопсия с забором материала из 12 или более участков предстательной железы.
Тактику ведения больных также определяют индивидуально. Всем пациентам с гистологически подтвержденной ПИН показано диспансерное наблюдение у уролога. Анализы на определение ПСА назначают ежемесячно. Трансректальное УЗИ предстательной железы осуществляют раз в полгода. Повторную биопсию выполняют не реже, чем раз в год, при настораживающих результатах других диагностических процедур необходимо внеплановое исследование. Показанием к лучевой терапии является наличие ПИН высокой степени в сочетании с прогрессирующим увеличением уровня ПСА в крови.
Кроме того, пациентам с простатической интраэпителиальной неоплазией назначают гормональную терапию для нейтрализации влияния тестостерона на измененные эпителиальные клетки. Используют бусерелин, лейпрорелин, нилутамид, флутамид, финастерид и другие препараты. Больным рекомендуют отказаться от вредных привычек, соблюдать диету с пониженным содержанием животных жиров, большим количеством витаминов и микроэлементов. Специалисты отмечают, что тактика лечения простатической интраэпителиальной неоплазии в данное время находится на стадии разработки, в последующем возможно изменение подходов к терапии данного состояния.
Читайте также:

