Не могут поставить диагноз склеродермия
Обновлено: 02.05.2024
Диагностика склеродермии у детей
Склеродермию следует подозревать в случаях развития синдрома Рейно с последующей склеродактилией. Если синдром Рейно сохраняется многие годы без классических проявлений болезни, необходимо проверить наличие в сыворотке кровиантинуклеарных антител (особенно к антигену SCL-70). Снижение диффузионной способности легких для СО позволяет предположить субклинический фиброз легочной ткани, что можно подтвердить данными КТ высокого разрешения.
Капилляроскопия ногтевых валиков при синдроме Рейно выявляет потерю капилляров или их патологическое расширение (ангиопатию) задолго до появления других признаков заболевания.
Согласно критериям диагностики склеродермии у взрослых, для диагноза этого заболевания необходимо присутствие единственного главного признака (склеротического поражения кожи выше пястно-фаланговых или плюснефаланговых суставов) или двух из трех второстепенных признаков. У таких больных нужно исследовать функцию внешнего дыхания, проверить подвижность пищевода (с контрастом) и провести ЭхоКГ для выявления легочной гипертензии.
Дифференциальная диагностика склеродермии у детей
Проявления, сходные со склеродермией, характерны и для ряда других заболеваний. Акроцианоз без бледности или рефлекторной гиперемии наблюдается при легочной гипертензии, нервной анорексии или обморожении. Диффузный отек пальцев, распространяющийся на тыльную поверхность кисти, может иметь место при геморрагическом васкулите или аллергических реакциях. У больных с ювенильным ревматоидным артритом опухают только суставы пальцев. Сгибательные контрактуры в этих случаях обусловлены хроническим тендинитом, кожа остается интактной.
РТПХ после трансплантации костного мозга проявляется покраснением лица и дистальных отделов конечностей, склеротическими изменениями кожи, гепатитом и поносом.
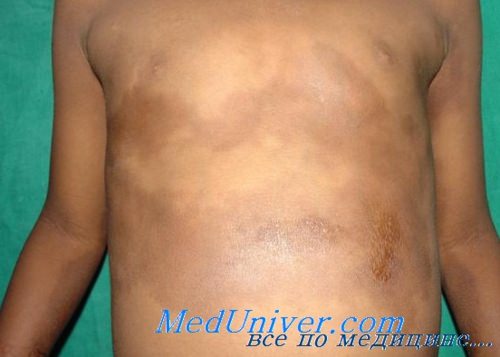
При болезни Рейно одноименный синдром не сменяется склеротическими изменениями кожи или внутренних органов. В этих случаях антитела к антигену SCL-70 и другие аутоантитела обычно отсутствуют, тяжесть симптомов со временем не меняется. Мышечная слабость (иногда в сочетании со сгибательными контрактурами) у больных с кожными проявлениями, сходными с ранними признаками склеродермии, может указывать на ювенильный дерматомиозит или перекрестные синдромы, при которых выявляются отдельные элементы сразу нескольких диффузных болезней соединительной ткани (например, СКВ, дерматомиозит, артрит и склеродермия).
Проявления эозинофильного фасциита напоминают признаки ограниченной склеродермии. Однако для этой формы заболевания характерны выраженная эозинофилия, повышенная СОЭ и, иногда, гипергаммаглобулинемия. Диагноз подтверждается данными биопсии всей толщи кожи с захватом мышечных фасций: обнаруживается преимущественно эозинофильная воспалительная инфильтрация дермы и фасций. Эозинофильный фасциит редко прогрессирует до системной склеродермии. Кортикостероидная терапия обычно ослабляет проявления фасциита и препятствует их дальнейшему развитию. В некоторых случаях все же отмечается выраженный фиброз, поражающий конечности по всей их длине. Имеются отдельные данные, свидетельствующие о возможности предотвращения этого осложнения с помощью метотрексата.
Термин «псевдосклеродермия» объединяет различные состояния, характеризующиеся очаговым или диффузным фиброзом кожи в отсутствие других проявлений склеродермии. Такие изменения, равно как и экзематозные высыпания, могут наблюдаться при фенилкетонурии. Склередема (болезнь Бушке) представляет собой остро возникающее транзиторное состояние, обычно после инфекционных заболеваний (особенно стрептококковой этиологии), при котором очаговые склеротические изменения кожи появляются на шее и плечах и часто распространяются на лицо, туловище и руки. Через несколько месяцев они обычно исчезают самопроизвольно.
Лабораторные исследования при склеродермии у детей
Отражением воспаления на ранних стадиях системной склеродермии является анемия и (иногда) эозинофилия. Неспецифическим признаком воспаления может быть и повышенный уровень иммуноглобулинов в сыворотке крови. Часто обнаруживаются антинуклеарные антитела (к ядрышкам или белковым компонентам клеточных ядер). Особенно характерны для склеродермии антитела к антигену SCL-70 (топоизомеразе I) и к центромерам. Присутствие антител, типичных для СКВ (антитела к ДНК) или для смешанного заболевания соединительной ткани (антитела к рибонуклеопротеиду), позволяет предполагать перекрестный» синдром. На ранних стадиях болезни может возрастать уровень антигена vWF (маркера повреждения эндотелия сосудов).
При ограниченной склеродермии обычно находят лишь антинуклеарные антитела (антитела к антигену SCL-70 и к центромерам обнаруживаются гораздо реже, чем при системной форме заболевания) и иногда эозинофилию.
Очаговая склеродермия – это хроническое заболевание соединительной ткани, характеризующееся преимущественным поражением кожных покровов. Клинически проявляется уплотнением (индурацией) различных участков кожи с последующей атрофией и изменением пигментации, образованием контрактур. Диагноз ставится на основании симптоматики, обнаружения в крови антинуклеарного фактора и антицентромерных антител. В сомнительных случаях проводится гистологическое исследование кожи. Лечение заключается в применении глюкокортикостероидов, иммунодепрессантов, антифиброзных средств, блокаторов кальциевых каналов и проведении ПУВА-терапии. В ряде случаев выполняются хирургические операции.
МКБ-10
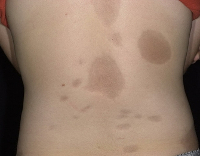
Общие сведения
Очаговая (локализованная, ограниченная) склеродермия – хроническое аутоиммунное заболевание из группы диффузных болезней соединительной ткани. Патология встречается повсеместно, распространенность составляет от 0,3 до 3 случаев на 100 000 человек. Чаще страдают женщины европеоидной расы. Возраст манифестации очаговой склеродермии зависит от формы. Бляшечная склеродермия чаще встречается у взрослых (30-40 лет), линейная - у детей от 2 до 14 лет, склероатрофический лихен – у женщин старше 50 лет. При локализованной форме, в отличие от системной, поражение внутренних органов в большинстве случаев либо минимально, либо отсутствует. Имеется ассоциация склеродермии с патологиями щитовидной железы (тиреоидитом Хашимото, болезнью де Кервена).

Причины
Точная причина заболевания неизвестна. Предполагается этиологическая роль бактерии Borrelia burgdorferi, вызывающей лайм-боррелиоз, однако убедительных данных за эту теорию на сегодняшний день нет. В развитии склеродермии важную роль играет наследственная предрасположенность. Были выявлены более частые случаи очаговой склеродермии среди близких родственников. При проведении генетических исследований обнаружена взаимосвязь между определенными генами гистосовместимости (HLA – DR1, DR4) и локализованной формой заболевания. Провоцирующими факторами, способствующими возникновению склеродермии, являются переохлаждения, травмы, постоянные вибрационные воздействия на кожу, прием лекарственных препаратов (блеомицина). Триггерными эффектами также обладают различные химические соединения (хлорвинил, кремний, нефтепродукты, сицилий, эпоксидная смола, пестициды, органические растворители).
Патогенез
Выделяют три основных патогенетических механизма склеродермии – фиброз (разрастание соединительной ткани), аутоиммунное повреждение и сосудистые нарушения. Иммунная аутоагрессия заключается в выработке лимфоцитами антител к соединительной ткани и ее компонентам. Также лимфоциты синтезируют интерлейкины, которые стимулируют пролиферацию фибробластов, гладкомышечных клеток и образование коллагена. Разрастающаяся при этом соединительная ткань замещает нормально функционирующую ткань. В результате повреждения эндотелия сосудов антителами и пролиферирующими гладкомышечными клетками снижается уровень простациклина (вещества, обладающего антиагрегантными и вазодилатирующими свойствами). Это приводит к спазму микрососудов, повышению адгезии и агрегации форменных элементов крови, внутрисосудистой коагуляции и микротромбозу.
Классификация
Очаговая склеродермия подразделяется на множество форм. Наиболее распространенными являются бляшечная и линейная. У ряда пациентов могут наблюдаться одновременно несколько вариантов заболевания. Существует целый ряд классификаций, но наиболее оптимальной и широко используемой считается классификация клиники Мэйо, включающей следующие разновидности очаговой склеродермии:
- Бляшечная. Данная форма в свою очередь подразделяется на поверхностную (морфеа) и узловатую (келоидоподобную). Характерны типичные участки уплотнения кожи с атрофией и нарушением пигментации.
- Линейная. К ней относятся полосовидная, саблевидная формы, а также прогрессирующая гемиатрофия лица Парри-Ромберга. Очаги располагаются в виде линий по ходу сосудисто-нервного пучка.
- Генерализованная (многоочаговая). Проявляется сочетанием бляшечного и линейного вариантов. Очаги распространены по всему телу.
- Буллезная. При данной разновидности на коже возникают пузыри с жидкостным содержимым, оставляющие после себя эрозии.
- Пансклеротическая инвалидизирующая. Наиболее неблагоприятная форма очаговой склеродермии. Характеризуется тяжелым, прогрессирующим течением, плохо поддается лечению. Поражаются все слои кожи и ткани, лежащие под ней. Развиваются грубые контрактуры суставов и длительно незаживающие язвы на коже.
- Склероатрофический лихен Цумбуша (болезнь белых пятен). Характерно образование пятен белого цвета, сопровождающихся нестерпимым зудом. Преимущественная локализация пятен – половые органы.
Симптомы
Для клинической картины типично образование на коже очагов, которые проходят три последовательных стадий развития – отек, индурацию (уплотнение) и атрофию. В начале заболевания на коже конечностей, шеи или туловища появляются пятна сиреневого или лилового цвета, имеющие нечеткие края. Размер пятен может сильно варьировать – от просяного зерна до размеров ладони и больше. На этом этапе пациент не испытывает каких-либо неприятных ощущений или боли. Затем пятна начинают отекать, кожа в центре очага уплотняется, становится блестящей, приобретает цвет слоновой кости. Пациент начинает ощущать зуд, покалывания, стянутость кожи, болезненность. Далее наступает стадия атрофии. Кожа в очагах истончается, прекращается рост волос, нарушается потоотделение, возникает стойкая дисхромия (гипер- или депигментация) и телеангиэктазии. Иногда развивается атрофодермия (участки западения кожи).
При линейной склеродермии очаги расположены по ходу нервов и сосудов. В случае локализации на коже лица очаги по внешнему виду напоминают рубец от удара саблей (саблевидная форма). Прогрессирующая гемиатрофия представляет собой глубокий процесс с поражением всех тканей половины лица - кожи, подкожной клетчатки, мышц и костей лицевого скелета, что приводит к выраженной деформации лица, обезображивающей внешний вид пациента. Также происходит атрофия половины языка и снижение вкусовой чувствительности.
Из внекожных признаков очаговой склеродермии стоит отметить офтальмологические и неврологические проявления при гемиатрофии Парри-Ромберга. Они включают выпадение ресниц и бровей на стороне поражения, западение глазного яблока из-за атрофии глазных мышц и орбитальной клетчатки, нейропаралитический кератит, головокружения, когнитивные нарушения, мигренозные головные боли, эпилептические припадки. Также возможно развитие феномена Рейно. Симптомы синдрома Рейно следующие – стадийное изменение окраски кожи пальцев рук вследствие вазоспазма и последующей гиперемии (бледность, цианоз, покраснение), сопровождающееся онемением, болью и покалыванием в пальцах рук. Остальные экстрадермальные проявления, характерные для системной склеродермии, встречаются крайне редко.
Осложнения
Наиболее распространенная проблема рассматриваемого заболевания – косметические дефекты. Серьезные осложнения, представляющие угрозу для жизни больного, возникают редко. К ним относятся нарушение мозгового кровообращения при гемиатрофии лица, ишемия и гангрена пальцев рук при феномене Рейно, выраженные контрактуры суставов, инвалидизирующие пациента. Через несколько лет после дебюта болезни могут развиться тяжелые поражения внутренних органов – фиброз легких, легочная гипертензия, фиброз миокарда, перикардит, стриктуры пищевода, острая нефропатия, почечная недостаточность.
Диагностика
Пациентов с очаговой склеродермией курируют врачи ревматологи и дерматологи. При постановке диагноза учитывается клиническая картина, семейный анамнез. Все методы диагностики направлены в первую очередь на определение степени вовлечения внутренних органов и исключение системной склеродермии. С этой целью применяются следующие исследования:
- Лабораторные. В анализах крови выявляются эозинофилия, повышение уровня ревматоидного фактора, гаммаглобулинов, высокие титры антицентромерных антител и антинуклеарного фактора (АНФ). Наличие антител к топоизомеразе (анти-Scl 70) свидетельствует в пользу системного процесса. При развитии «склеродермической почки» в моче появляются белок и эритроциты.
- Инструментальные. При капилляроскопии наблюдается дилатация капилляров без участков некроза. По данным ФЭГДС могут встречаться признаки эзофагита, стриктуры пищевода. При фиброзе миокарда на ЭКГ иногда обнаруживаются нарушения ритма сердца, на ЭхоКГ – зоны гипокинеза, выпот в перикардиальную полость. На рентгенографии или компьютерной томографии легких отмечаются интерстициальные изменения.
- Гистологическое исследование биоптата кожи. Заключительный этап, позволяющий достоверно поставить диагноз. Проводится при сомнительных результатах предыдущих исследований. Характерны следующие признаки - инфильтрация лимфоцитами, плазмоцитами и эозинофилами в ретикулярном слое дермы, утолщенные коллагеновые пучки, набухание и склероз сосудистой стенки, атрофия эпидермиса, сальных и потовых желез.
Очаговую склеродермию дифференцируют с другими формами склеродермии (системной, склеродермой Бушке), дерматологическим заболеваниями (саркоидозом кожи, липонекробиозом, склеродермоподобной формы поздней кожной порфирии, базально-клеточным раком), поражением мягких тканей (панникулитом, липодерматосклерозом, эозинофильным фасциитом). В дифференциальной диагностике принимают участие онкологи, гематологи.
Лечение
Этиотропной терапии не существует. Метод лечения и вид лекарственного средства необходимо подбирать с учетом формы заболевания, тяжести течения и локализации очагов. При линейной и бляшечной формах используются топические глюкокортикостероиды высокой и сверхвысокой активности (бетаметазон, триамцинолон), синтетические аналоги витамина Д. При выраженной индурации кожи эффективны аппликации с диметилсульфоксидом. В случае поражений внутренних органов с целью уменьшения фиброзообразования назначаются пеницилламин и инъекции гиалуронидазы.
При неглубоких процессах хорошим терапевтическим действием обладает ПУВА-терапия, которая включает облучение кожи ультрафиолетовыми волнами длинного спектра с одновременным пероральным или наружным применением фотосенсибилизаторов. Тяжелое поражение кожи служит показанием к применению иммунодепрессантов (метотрексата, такролимуса, микофенолата), синдром Рейно - блокаторов кальциевых каналов (нифедипина) и препаратов, улучшающих микроциркуляцию (пентоксифиллина, ксантинола никотината). При склероатрофическом лихене проводится низкоинтенсивная лазеротерапия. В случае развития контрактур суставов, значительно затрудняющих движения, или грубых деформаций скелета и косметических дефектов лица требуется хирургическая операция.
Профилактика и прогноз
В подавляющем большинстве случаев очаговая склеродермия имеет доброкачественное течение. Правильно подобранная терапия позволяет добиться регресса симптомов. Иногда наступают спонтанные ремиссии заболевания. Неблагоприятные исходы возникают при тяжелых формах (прогрессирующей гемиатрофии лица, пансклеротической инвалидизирующей склеродермии), а также поражении внутренних органов. Эффективных методов профилактики не разработано. Рекомендуется избегать или максимально ограничить контакт кожи с химическими соединениями (кремнием, сицилием, хлорвинилом, нефтепродуктами, органическими растворителями, пестицидами, эпоксидной смолой).
2. Ревматические заболевания/ Под ред. Дж.Х. Клиппела, Дж.Х. Стоуна, Л.Дж. Кроффорд, П.Х. Уайт – 2012.
3. Диффузные болезни соединительной ткани: руководство для врачей/ под ред. проф. Мазурова В.И. –2009.
Шевцова Т.П. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва , Надточеева В.Б. Факультет фундамен- тальной медицины, МГУ им. М.В. Ломоносова , Нимирицкая С.В. Факультет фундамен- тальной медицины, МГУ им. М.В. Ломоносова , Акулкина Л.А. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва , Буланов Н.М. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва , Новиков П.И. Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
Оценка влияния ритуксимаба на течение интерстициального поражения легких, фиброз кожи и суставной синдром у пациентов с системной склеродермией (ССД).
Материалы и методы
В ретроспективное исследование включали всех пациентов с ССД, которые получали лечение ритуксимабом. Диагноз ССД устанавливали в соответствии с классификационными критериями ACR-EULAR 2013 г. Эффективность ритуксимаба оценивали через 1 год, а также в конце наблюдения на основании динамики форсированной жизненной емкости легких (ФЖЕЛ) и диффузионной способности легких по оксиду углерода (DLCO), счета DAS-28 ESR/CRP и модифицированного кожного счета по Роднану.
Ритуксимаб применяли у 14 больных ССД в возрасте в среднем 50,5 лет (от 29 до 66 лет), в том числе 12 женщин. У 13 из них имелось интерстициальное поражение легких. Все пациенты ранее получали глюкокортикостероиды и/или различные иммуносупрессивные препараты, в том числе циклофосфамид и микофенолата мофетил. Медиана ФЖЕЛ после лечения ритуксимабом достоверно не изменилась, а медиана DLCO достоверно увеличилась. Снижения этих показателей ни у одного пациента отмечено не было. У 10 (71,4%) пациентов, получавших лечение ритуксимабом, через год выявлено уменьшение модифицированного кожного счета по Роднану, а у 4 пациентов этот показатель не изменился. Медианы счета DAS28/CRP и DAS-28/ESR достоверно снизились через год после начала лечения ритуксимабом (p=0,007 и р=0,017, соответственно). У пациентов, получавших глюкокортикостероиды, средняя суточная доза преднизолона через год была достоверно ниже исходной (p=0,043). Переносимость ритуксимаба (медиана длительности лечения 2 года; от 1 до 6 лет) в целом была хорошей.
Полученные данные свидетельствуют о том, что ритуксимаб оказывает стабилизирующее влияние на показатели функции легких, вызывает уменьшение фиброза кожи и суставного синдрома у части больных ССД, не ответивших на другие иммуносупрессивные препараты.
Системная склеродермия (ССД) – аутоиммунное заболевание, сопровождающееся вовлечением в воспалительный процесс соединительной ткани и проявляющееся изменениями кожи, поражением внутренних органов, сосудов и суставов [1]. ССД характеризуется одним из наиболее высоких уровней смертности среди системных заболеваний соединительной ткани [2]. Прогрессирующее интерстициальное поражение легких является ведущей причиной смерти при ССД [3], при этом возможности терапии до сих пор ограничены [4]. Патогенез ССД изучен недостаточно, однако полагают, что ключевую роль в развитии данного системного заболевания играют иммунологические нарушения, в том числе активация В-клеточного звена иммунитета 6. Результаты опубликованных ранее серий наблюдений и неконтролируемых исследований продемонстрировали возможную эффективность ритуксимаба (химерное моноклональное антитело мыши/человека, которое специфически связывается с трансмембранным антигеном CD20 на поверхности В-лимфоцитов) в лечении поражения кожи и легких у пациентов с ССД 21. В исследовании European Scleroderma Trials and Research group (EUSTAR) и в проспективном когортном исследовании было отмечено, что у пациентов, получавших лечение ритуксимабом, наблюдались положительная динамика поражения кожи, особенно у пациентов с диффузной формой, а также стабилизация показателей функции внешнего дыхания [23,24]. Ритуксимаб характеризовался хорошим профилем безопасности у пациентов с ССД [23].
Целью ретроспективного исследования была оценка влияния ритуксимаба на течение интерстициального поражения легких, ние интерстициального поражения легких, фиброз кожи и суставной синдром у пациентов с ССД.
Материал и методы
В ретроспективное исследование включали всех пациентов с ССД, которые получали лечение ритуксимабом в клинике им. Е.М. Тареева с 2010 по 2020 г. Диагноз системной склеродермии устанавливали в соответствии с классификационными критериями ACR-EULAR 2013 года [25].
Регистрировали демографические показатели, длительность заболевания от возникновения первого “не-Рейно" симптома, клиническую форму, данные о предшествующем лечении другими препаратами и их дозировки, модифицированный кожный счет по Роднану, наличие/отсутствие легочного фиброза, форсированную жизненную емкость легких (ФЖЕЛ) в % от должной, диффузионную способность легких по оксиду углерода (DLCO) в % от должной, число болезненных и припухших суставов, DAS-28 ESR/CRP, уровень С-реактивного белка (СРБ), число инфузий и дозировку ритуксимаба, данные о сопутствующем лечении иммуносупрессивными средствами и глюкокортикостероидами.
Эффективность ритуксимаба оценивали через 1 год, а также в конце наблюдения на основании динамики показателей функции легких, суставного синдрома и кожного счета. Критерием прогрессирования легочного фиброза считали снижение ФЖЕЛ по крайней мере на 10% и/или DLCO по крайней мене на 15% [26]. Критерием прогрессирования кожного фиброза считали нарастание кожного счета более чем на 5 баллов или увеличение кожного счета по крайней мере на 25% [27]. Динамику суставного синдрома оценивали на основании индекса активности DAS-28 ESR/CRP.
Безопасность ритуксимаба оценивали на основании нежелательных явлений, в том числе гипогаммаглобулинемии [28] и инфекций.
Статистический анализ. Нормальность распределения данных оценивали с помощью теста Шапиро-Уилка. Демографические и исходные клинические характеристики представлены в виде медианы и межквартильного интервала для непрерывных переменных и в виде процентов для категориальных переменных. Сравнение непрерывных переменных проводилось с использованием U-критерия Манна-Уитни. Категориальные переменные между группами сравнивали при помощи точного теста Фишера или критерия χ2 Пирсона. Различия считали статистически значимыми при p менее 0,05. Статистическая обработка данных осуществлялась с использованием программного обеспечения STATISTICA 13.
Результаты
Характеристика пациентов. Ритуксимаб применяли у 14 больных ССД в возрасте в среднем 50,5 лет (от 29 до 66 лет), в том числе 12 женщин. Медиана продолжительности болезни с момента появления первого “не-Рейно" симптома составила 5,7 лет (от 2 до 19 лет). У большинства больных была диагностирована лимитированная форма ССД (табл. 1) и определялся антинуклеарный фактор (АНФ) в титре выше 1:160. Антитела к топоизомеразе были выявлены у 3 (21,4%) пациентов, антицентромерные антитела – у 4 (28,5%). Пред шествующее лечение циклофосфамидом проводилось 5 (35,7%) пациентам, микофенолата мофетилом – 6 (42,8%), азатиоприном – 4 (28,5%), гидроксихлорохином – 6 (42,8%), колхицином – 1 (11,1%), D-пеницилламином – 1 (%).
| Значения | |
|---|---|
| Женщины, n (%) | 12 (85,7) |
| Возраст, годы | 50,5 (36; 64) |
| Клиническая форма, n (%) | |
| диффузная | 4 (28,6) |
| лимитированная | 10 (71,4) |
| Давность болезни, годы | 5,3 (2,4; 8.1) |
| Давность болезни, n (%) | |
| (%)≤5 лет | 7 (50) |
| >5 лет | 7 (50) |
| Синдром Рейно, n (%) | 14 (100) |
| Дигитальные рубчики, n (%) | 5 (35,7) |
| Интерстицальное поражение легких, n (%) | 13 (92,8) |
| Снижение ФЖЕЛ ≤80% от должной, n (%) | 4 (28,6) |
| Снижение DLCO ≤80% от должной, n (%) | 10 (71,4) |
| Мышечно-скелетные проявления, n (%) | 10 (71,4) |
| АНФ в титре >1:160, n (%) | 13 (92,8) |
| антитела к топоизомеразе (anti-Scl-70) | 3 (21,4) |
| антицентромерные антитела (АСА) | 4 (28,6) |
| Перекрестный синдром, n (%) | |
| 5 (35,7) | полимиозит |
| 2 (14,3) | синдром Шегрена |
| системная красная волчанка | 1 (7,1) |
| Медиана дозы преднизолона, мг/сут | 8,8 (3,3; 13,7) |
У 13 из 14 больных показанием к лечению ритуксимабом было сохранение или прогрессирование интерстициального поражения легких на фоне предшествующей терапии. У одного пациента с перекрестным синдромом (ССД + системная красная волчанка) ритуксимаб был назначен в связи с наличием суставного синдрома и гематологических нарушений. Всем больным ритуксимаб вводили внутривенно в дозе 500 или 1000 мг после премедикации метилпреднизолоном (250-500 мг внутривенно). При этом трое больных получили 2 г (2 инфузии по 1000 мг с интервалом в 6 месяцев), двое – 3 г (3 инфузии по 1000 мг с интервалом в 6 месяцев), одна – 4 г (4 инфузии по 1000 мг с интервалом в 6 месяцев), семь – 5 г (5 инфузий по 1000 мг с интервалом в 6 месяцев), одна – 9,5 г (8 инфузий по 1000 мг с интервалом в 6 месяцев, далее 3 инфузии по 500 мг с интервалом в 6 месяцев), одна – 14 г (2 г –индукционная доза, затем 12 инфузий по 1000 мг каждые 6 месяцев).
Во время лечения ритуксимабом 10 (71,4%) пациентов получали лечение глюкокортикостероидами, при этом медиана дозы преднизолона составила 8,8 мг/сут (от 5 до 25 мг/сут). У 6 (42,8%) пациентов ритуксимаб применяли в комбинации с микофенолата мофетилом (у 4) или азатиоприном (у 2). Гидроксихлорохин получали 5 пациентов, колхицин – 1.
Поражение легких. Медиана ФЖЕЛ после лечения ритуксимабом достоверно не изменилась, а медиана DLCO достоверно увеличилась (табл. 2). Снижения ФЖЕЛ или DLCO ни у одного пациента отмечено не было. Увеличение ФЖЕЛ наблюдалось у 7 (50,0%) из 14 больных, а увеличение DLCO – у 8 (57,1%).
| Параметры | Исходно | Через год | р |
|---|---|---|---|
| ФЖЕЛ, % от должной | 79 (63; 81) | 83 (76; 86) | 0,111 |
| DLCO, % от должной | 66 (42; 81) | 75 (49; 85) | 0,004 |
| Кожный счет, баллы | 9,3 (5,5; 12,3) | 8,3 (5,0; 11,2) | 0,024 |
| DAS-28/CRP | 3,7 (2,8; 4,1) | 2,8 (2,2; 3,3) | 0,007 |
| DAS-28/ESR | 3,2 (2,1; 4,1) | 2,6 (2,0; 3,0) | 0,017 |
| СРБ, мг/л | 8,9 (3,5; 13,9) | 4,1 (2,2; 6,9) | 0,051 |
| Преднизолон, мг/сут | 10,8 (4,5; 15,6) | 6,5 (2,4; 12,0) | 0,043 |
Фиброз кожи. У 10 (71,4%) пациентов, получавших лечение ритуксимабом, через год выявлено уменьшение кожного счета по Роднану, у а 4 пациентов этот показатель не изменился. Наиболее выраженное снижение кожного счета (на 4-5 баллов) наблюдалось у трех пациентов с диффузной формой ССД (двое из них получали дополнительно микофенолата мофетил в дозе 1000 мг/сут) и у одной пациентки с лимитированной формой ССД и исходным кожным счетом, составлявшим 13 баллов (помимо ритуксимаба она получала терапию азатиоприном).
Суставной синдром. Медианы счета DAS-28/CRP и DAS-28/ESR достоверно снизились через год после начала лечения (p=0,007 и р=0,017). Случаев усиления суставного синдрома на фоне лечения ритуксимабом не было.
Показатели воспаления и сопутствующее лечение. Уровень СРБ во время лечения достоверно не изменился (р=0,051), однако у двух пациентов с исходно повышенным значением этого показателя он значительно снизился. У пациентов, получавших глюкокортикостероиды, средняя суточная доза преднизолона через год была достоверно ниже исходной (p=0,043) (табл. 2).
В нашем ретроспективном исследовании лечение ритуксимабом (медиана дозы 2 г за 12 мес) оказывало благоприятное влияние на показатели функции легких, кожный счет по Роднану и суставной синдром у 14 больных ССД. В исследование были включены пациенты с развернутой формой заболевания, медиана длительности которого составляла около 6 лет. Все больные ранее получали глюкокортикостероиды и/или различные иммуносупрессивные препараты, включая циклофосфамид и микофенолата мофетил. Более чем у 70% пациентов до назначения ритуксимаба отмечалось снижение DLCO менее 80% от должного, хотя ФЖЕЛ была снижена только у 28% больных. При лечении ритуксимабом ни у одного больного не было отмечено ухудшения этих показателей. Медиана ФЖЕЛ существенно не изменилась, в то время как медиана DLCO достоверно увеличилась, хотя клинически значимого нарастания DLCO мы не наблюдали ни в одном случае. Приведенные данные свидетельствуют о том, что лечение ритуксимабом может затормозить прогрессирование интерстициальной болезни легких по крайней мере у части пациентов с ССД.
Сходные результаты были получены в других исследованиях [10,14-17,21,22]. В клиническом исследовании у 63 больных ССД с поражением легких, включенных в базу данных EUSTAR, лечение ритуксимабом предупреждало дальнейшее снижение ФЖЕЛ по сравнению с контролем [24]. Л.П. Ананьева и соавт. в неконтролируемом исследовании у 27 пациентов с ССД выявили статистически значимое увеличение ФЖЕЛ через год после начала лечения ритуксимабом в 59% случаев, а клинически значимое – в 11% [29]. А Daoussis и соавт. наблюдали достоверное нарастание ФЖЕЛ в течение 2 лет наблюдения у 33 больных, получавших ритуксимаб, и отсутствие прироста ФЖЕЛ в контрольной группе у 18 больных, которым проводилась терапия азатиоприном, микофенолата мофетилом или метотрексатом [15]. В то же время польза ритуксимаба не была подтверждена в самом крупном проспективном клиническом исследовании, в котором было сопоставлено течение поражения легких и кожи у 254 больных ССД, получавших ритуксимаб, и 9575 подобранных пациентов, которым не назначали моноклональные антитела к В-лимфоцитам [23]. В этом исследовании у 146 больных с интерстициальным поражением легких как ФЖЕЛ, так и DLCO оставались стабильными во время лечения ритуксимабом. Тем не менее, применение этого препарата не привело к снижению частоты клинически значимого ухудшения функции легких (снижение ФЖЕЛ более чем на 10%) по сравнению с контролем
Следует отметить, что все опубликованные исследования были нерандомизированными, что затрудняет интерпретацию полученных результатов. Интерсти циальное поражение легких при ССД характеризуется постепенным ухудшением показателей функции легких, однако темпы прогрессирования варьируются в широких пределах. В одном исследовании было показано, что при отсутствии лечения иммуносупрессивными препаратами ФЖЕЛ у больных ССД с поражением легких снижается примерно на 4% за год [30], однако при естественном течении ССД могут наблюдаться периоды длительной стабилизации и даже улучшения ее отдельных проявлений. Для подтверждения возможности стабилизации интерстициального поражения легких под влиянием ритуксимаба необходимы рандомизированные клинические исследования. Тем не менее, применение этого препарата представляется оправданным у пациентов с прогрессирующим поражением легких, которые не отвечают на другие иммуносупрессивные средства, в частности циклофосфамид. Однако необходимо учитывать, что прогрессирование легочного фиброза на фоне иммуносупрессивной терапии может быть основанием для назначения антифиброзных препаратов, таких как нинтеданиб.
В нашей серии наблюдений лечение ритуксимабом привело к достоверному снижению медианы кожного счета по Роднану. Уменьшение кожного счета на 4-5 баллов наблюдалось у пациентов с наиболее выраженным фиброзом кожи. В проспективном исследовании Elhai и соавт. 32% из 254 больных получали ритуксимаб в связи с прогрессирующим фиброзом кожи. Авторы выявили достоверное снижение кожного счета при лечении ритуксимабом, а также двукратное увеличение вероятности улучшения кожного фиброза по сравнению с контролем [23]. Достоверное снижение кожного счета, особенно у пациентов с диффузной формой ССД, было выявлено и в исследовании Jordan и соавт. [24], а также в других небольших сериях наблюдений (от 5 до 20 пациентов) 17. Следует отметить, что при ССД установить истинную эффективность препарата в отношении фиброза кожи при отсутствии контрольной группы сложно, учитывая возможность спонтанного улучшения в течение первых нескольких лет.
В нашем исследовании лечение ритуксимабом сопровождалось некоторым улучшением суставного синдрома, а также снижением повышенного уровня СРБ. Сходные данные были получены в исследовании Elhai и соавт. [23]. Концентрация СРБ у больных ССД коррелирует с активностью и тяжестью заболевания [31]. Кроме того, у пациентов, получавших глюкокортикостероиды в дозе 12,5-25 мг/сут в пересчете на преднизолон, на фоне лечения ритуксимабом удалось снизить их дозы. В исследовании Elhai и соавт. также было показано, что терапия ритуксимабом у пациентов с ССД вдвое увеличивает вероятность отмены или снижения доз глюкортикостероидов [23], что имеет важное значение для снижения риска развития субклинического или клинического атеросклероза [32], а также почечного криза [33].
Эффективность ритуксимаба, который вызывает быструю деплецию CD20+ B-лимфоцитов в периферической крови, подтверждает роль В-лимфоцитов в патогенезе ССД [34], хотя действие ритуксимаба может объясняться не только подавлением выработки аутоантител [35], но и другими механизмами. Например, при идиопатической тромбоцитопенической пурпуре и реакции трансплантат против хозяина ритуксимаб оказывал действие на аутореактивные Т-лимфоциты [36, 37]. Обсуждается также возможность “перезагрузки" иммунной системы как о терапевтическом эффекте ритуксимаба [38].
Заключение
Основными ограничениями нашего исследования являются небольшое число пациентов, ретроспективный дизайн и отсутствие контрольной группы. Однако ССД относится к редким заболеваниям, а для ее лечения могут быть использованы различные иммуносупрессивные средства, а также антифиброзные средства (нинтеданиб) при наличии прогрессирующего интерстициального поражения легких. Эффективность ритуксимаба у пациентов с ССД в рандомизированных контролируемых исследованиях не изучалась. Тем не менее, наши данные, как и результаты других исследований, свидетельствуют о том, что этот препарат может оказать стабилизирующее влияние на показатели функции легких и вызывает уменьшение фиброза кожи у части больных ССД, не ответивших на другие иммуносупрессивные средства.
Склеродермия – это болезнь соединительной ткани, которая характеризуется фиброзом кожи и внутренних органов с прогрессирующим течением.
Причины склеродермии

На сегодняшний день точного этиологического фактора развития склеродермии не обнаружено, однако предполагается вирусная и наследственная теория ее возникновения. Считается, что факторами, способствующими заболеванию, могут выступать: охлаждение, контакт с химическими веществами, аллергии, нейроэндокринные нарушения, вибрация.
Симптомы склеродермии
- Ограниченная (линейная или бляшечная);
- Генерализованная (диффузная или системная);
- Смешанная.
Диффузная форма является тяжелой и прогрессирующей. Характеризуется поражением кожи кистей, лица, следом туловища и конечностей. Появившиеся элементы увеличиваются, плотнеют, кожа фиксируется к тканям и становится неподвижной. По мере прогрессирования склеродермии поражаются слизистые оболочки глаза, полости рта, гортани, глотки. В патологический процесс вовлекаются практически все органы и системы организма: мышцы, кости, ЖКТ, органы дыхания, почки, нервная и сердечно-сосудистая системы.
Методы диагностики

- склеродермичекие очаги на коже;
- синдром Рейно;
- мышечно-суставной синдром;
- укорочение и деформации пальцев;
- капилляроскопические изменения.
- в общем анализе крови – гипохромная анемия, лейкоцитоз(иногда лейкопения), ускорение СОЭ.
- в общем анализе мочи повышенная экскреция оксипролина и протеинурия.
- в биохимическом исследовании крови: гиперпротеинемия, повышения гаммаглобулинов, фибрина, оксипролина и серомукоидов.
- при иммунологическом исследовании крови выявляют: ревматоидный фактор, волчаночные клетки.
Лечение
Этиологическое лечение отсутствует. Применяется симптоматическое лечение для улучшения качества жизни. Препараты гиалуронидазы вводятся внутримышечно или в очаги поражения при ограниченном процессе. Назначаются препараты, улучшающие микроциркуляцию, витамины Е, А, С, В 15.
В некоторых случаях применяют противомалярийные препараты, при длительном приеме они снижают выраженность кожных проявлений.

Склеродермия относится к системным аутоиммунным заболеваниям с высоким уровнем рисков. В данном случае речь идет о болезни соединительной ткани. Маленькие сосуды, капилляры поражаются собственными иммунными клетками организма, в результате чего обменные процессы в тканях значительно ухудшаются. Кожа, а также подкожная клетчатка сильно уплотняются, как бы становятся однородными, похожими на сплошную рубцовую ткань. Заболевание прогрессирует, захватывает суставы, внутренние органы и в результате может привести к смерти пациента.
Чаще всего склеродермией заболевают женщины, а с возрастом риски такой патологии повышаются.
Классификации заболевания по нескольким признакам
Если говорить о клинической форме, то классификация склеродермии включает такие варианты:
- диффузный. Быстро развивается и в течение полугода обнаруживает себя массой симптомов. Поражает лицо, голову, туловище, конечности;
- лимитированный. В основном поражает лицо, кисти рук и стопы, развивается гораздо медленнее;
- перекрестный. Сочетается с другими аутоиммунными заболеваниями, например, красной волчанкой или ревматоидным артритом;
- висцеральный (без склеродермы). То есть кожные покровы при таком типе болезни не уплотняются, зато проявляется синдром Рейно (побеление, онемение, посинение пальцев рук или ног). Основной удар приходится на внутренние органы – ЖКТ, легкие, почки;
- индуцированный. Может сочетаться с сосудистыми поражениями, обычно обусловлен факторами внешней среды, например, воздействием холода или химикатов;
- ювенильный. Этот тип характерен для раннего возраста, до 16 лет. Как правило, внутренние органы он затрагивает меньше, но может обуславливать аномалии развития конечностей и другие серьезные проблемы.
А еще склеродермия бывает быстро прогрессирующей (острой), умеренно прогрессирующей (подострой) и медленно прогрессирующей (хронической).
Прогнозы
Наиболее благоприятные прогнозы наблюдаются при хронической форме заболевания. В этом случае выживаемость в течение 15 лет составляет до 80%. Острая форма наиболее опасная, прогноз неблагоприятный: в течение пяти лет выживают только 4% пациентов, а в течение 2 лет – не более 20%.
Симптомы
Поскольку заболевание бывает разных видов и имеет массу особенностей, с симптомами тоже нет никакой однозначной картины. По этой причине принято выделять общие тенденции, а уже дальше, в нюансах, врачи разбираются в процессе диагностики.
Итак, общими признаками склеродермии являются:
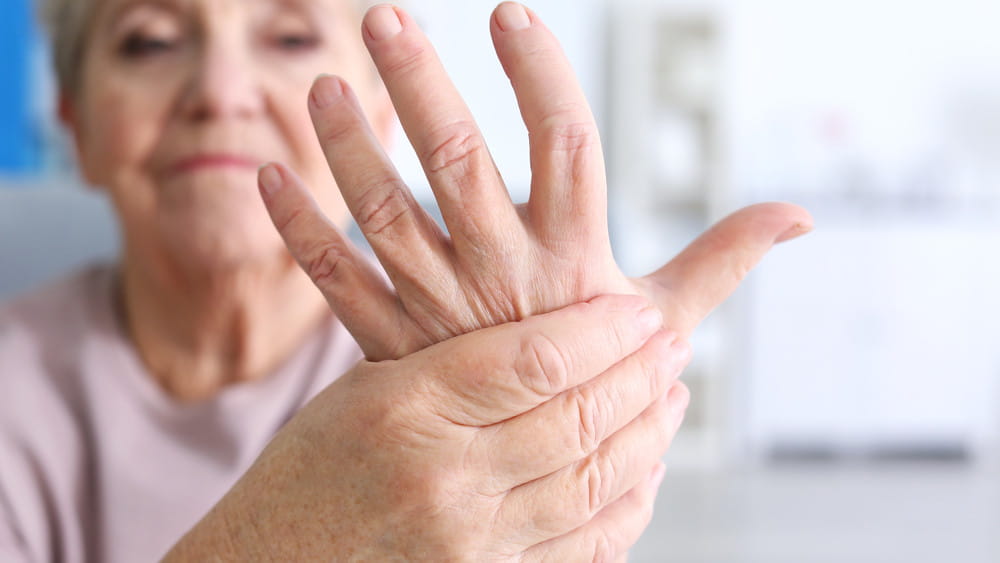
- изменения кожных покровов, которые характеризуются либо синдромом Рейно, либо его наличием и уплотнением отдельных участков по типу рубцовой ткани. Причем размеры этих уплотнений могут быть довольно внушительными. Если склеродермия развивается на лице, она может давать так называемый эффект маски – когда мимика затруднена, а кожа выглядит неживой, кукольной;
- сосудистые нарушения. Синдром Рейно тоже сюда относится, но поскольку он дает и визуальный эффект (белые, красные или уже синеватые пальцы), мы включили его и в пункт, связанный с кожными изменениями;
- нарушения опорно-двигательного аппарата из-за поражения соединительной ткани.
- самые разные изменения внутренних органов – от малозаметных до фатальных.
Поскольку патогенез склеродермии часто предполагает вовлечение в процесс слизистых тканей, есть признаки, которые характерны конкретно для этих участков. Например, у пациентов развиваются ринит, стоматит и другие подобные проблемы.
Что касается костей и суставов, то человек может наблюдать скованность движений, невозможность быстро согнуть и разогнуть конечность, а также отечность. Доходит до того, что в некоторых областях кости небольшого размера могут даже рассасываться, вызывая искривления и другие неприятные последствия. Из-за нарушений суставной подвижности некоторые мышцы могут атрофироваться или значительно ослабевать.
Признаки, связанные с внутренними органами
Поскольку заболевание захватывает соединительную ткань и сильно влияет на внутренние органы, у пациентов может быть весь спектр проблем с ЖКТ, сердцем, почками и другими системами. Они проявляются любыми признаками соответствующих болезней. Очень часто (в 70% случаев) поражаются легкие – именно болезни легких нередко становятся причиной смерти больного. В данном случае склеродермия может вызывать пневмонии, абсцессы и даже рак легких, который у людей с таким заболеванием встречается в 3-5 раз чаще, чем у других представителей тех же возрастных групп.
Важно понимать, что четкого списка симптомов в данном случае нет – иначе он был бы огромным. Заболевание тем и опасно, что затрагивает практически весь организм и может проявить себя как угодно.
Диагностика
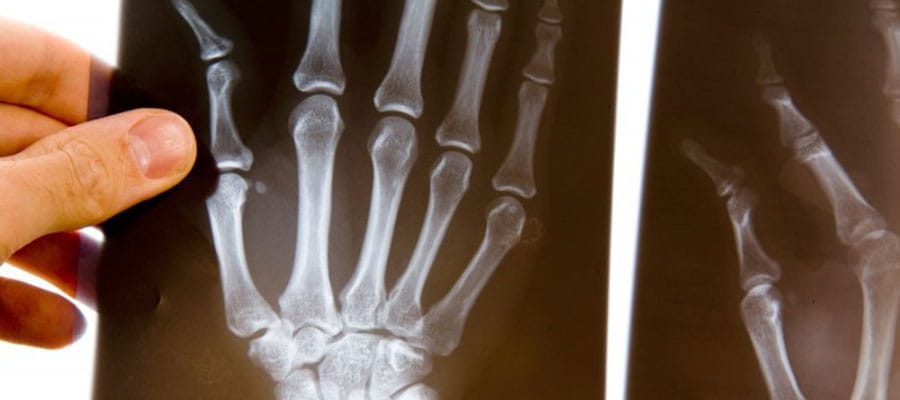
Для диагностики склеродермии используют комплекс методов:
- анализы крови, в том числе и биохимический;
- рентген стоп и кистей, КТ, МРТ, а также УЗИ других органов;
- функциональные пробы. Это и тесты на определение переносимости физической нагрузки, и тесты на нарушение дыхательной функции;
- исследование небольших образцов кожи под микроскопом.
Комплексный подход и тщательный визуальный осмотр пациента помогают поставить диагноз максимально точно.
Лечение
Эта аутоиммунная патология пока не устраняется – такого лекарства на данный момент не существует. Все действия сводятся к тому, чтобы стабилизировать состояние больного и продлить ему жизнь. Лечение склеродермии с такой целью включает:
- прием разных медикаментов: антифиброзные, противовоспалительные средства, ферменты и т.д.;
- хирургическое вмешательство. Оно необходимо для восстановления подвижности конечностей, для устранения синдрома Рейно, а также для коррекции косметических недостатков (в основном на лице);
- физиотерапию. Сюда относят лазерное облучение крови (низкоинтенсивное), а также сеансы ПУВА-терапии;
- коррекцию питания. Диета при склеродермии предполагает выбор в пользу здоровой пищи, максимально богатой витаминами, микроэлементами.
Пациентам, страдающим такой патологией, рекомендуется и отказ от вредных привычек, движение в сторону здорового образа жизни.
Вопросы-ответы
Можно ли вылечить склеродермию полностью?
К сожалению, сейчас это невозможно, такого лекарства пока не существует. Это хронический патологический процесс, который рано или поздно ведет к серьезным негативным последствиям.
Сколько живут с таким диагнозом?
Продолжительность жизни сильно зависит от формы болезни. При хронической, то есть вялотекущей форме и соблюдении всех клинических рекомендаций при склеродермии, большая часть пациентов может прожить 15 и более лет. Если формы более острые, продолжительность жизни, как правило, снижается до 2-5 лет.
В каком возрасте и кто чаще всего более склеродермией?
Чаще всего диагноз ставится женщинам в возрасте от 20 до 40 лет, но и другие возрастные рамки тоже захватываются, в том числе страдают заболеванием и мужчины, они от него тоже не застрахованы.
Существует ли специфическая профилактика при склеродермии?
Как и в случае с другими аутоиммунными заболеваниями, специфической профилактики склеродермии не существует. Но врачи говорят о том, что здоровый образ жизни, внимание к своему самочувствию и отсутствие сильных стрессов могут снизить риски заболевания.
Заразна ли склеродермия?
Нет. Это заболевание вызывается особенностями работы иммунитета самого пациента. Оно не может передаваться при прикосновениях, половых контактах, через воздух и т.д. Для окружающих пациент с такой патологией безопасен.
Читайте также:

