Наружная терапия при атопическом дерматите у детей
Обновлено: 26.04.2024
Н.Н. Мурашкин (1, 2, 3), А.А. Савелова (2), Р.А. Иванов (1), Д.В. Федоров (1), Л.А. Опрятин (1), В. Ахмад (4)
1) Национальный научно-практический центр здоровья детей, Москва, Россия; 2) Центральная государственная медицинская академия, Москва, Россия; 3) Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва, Россия; 4) Кабардино-Балкарский государственный университет, Нальчик, Россия
Обоснование. Атопический дерматит (АтД) – мультифакторный, наиболее распространенный воспалительный дерматоз. Особенности строения кожи детей первого года жизни обусловливают ряд клинических характеристик, вызванных дисфункцией эпидермального барьера с повышенной трансэпидермальной потерей воды и выраженной гидрофобностью поверхности кожи детей в этом возрастном периоде, что во многом ограничивает эпидермальное поглощение жидкости. Предложен этапный алгоритм наружной терапии АтД у детей первого года жизни в зависимости от выраженности кожного патологического процесса, включающий дифференцированное применение топических глюкокортикостероидов, методики влажных обертываний и топических ингибиторов кальциневрина – пимекролимуса в сочетании с эмолентами.
Заключение. Согласно современным рекомендациям по уходу за кожей детей первого года жизни, важно обеспечить регулярное увлажнение и очищение кожи. Наиболее эффективным способом восстановления защитной функции кожного барьера служит применение средств, направленных на восстановление рогового слоя и предотвращающих избыточную трансэпидермальную потерю воды.
Ключевые слова: атопический дерматит, трансэпидермальная потеря воды, роговой слой, pH кожи новорожденного, увлажняющий фактор, увлажняющие средства, пимекролимус, влажные обертывания, тГКС, эмоленты
Актуальность
Атопический дерматит (АтД) – это хроническое рецидивирующее воспалительное заболевание кожи, связанное с гиперреактивностью иммунного ответа в результате нарушения эпидермального барьера в отношении триггеров окружающей среды, которое обычно развивается в раннем детском возрасте.
Патогенез АтД объясняется в основном нарушениями в адаптивной системе иммунного ответа, причем ключевую роль играют дисрегуляция T-хелперов 1 (Th1)/Th2-клеток, усиление экспрессии иммуноглобулина Е (IgE), передача сигналов дендритными клетками и гиперреактивность тучных клеток, что влечет за собой зуд и воспаление. Именно поэтому терапия при АтД первых лет жизни направлена на улучшение состояния эпидермального барьера [2]. В последнее время появляются доказательства того, что воспаление при АтД возникает в результате наследственных и приобретенных факторов, которые приводят к изменению структуры и функции эпидермиса, после чего активируется иммунная система, что в свою очередь имеет негативные последствия для гомеостаза эпидермального барьера. Этот цикл представляет собой модель патогенеза АтД «снаружи–внутри–снаружи» [3, 4].
Кожный барьер у детей первых лет жизни не до конца сформирован, его зрелость прямо пропорциональна гестационному возрасту. Роговой слой у новорожденных в отличие от взрослых состоит из 2–3 слоев ороговевшего эпителия. Зернистый слой тоньше, в его клетках наблюдается отсутствие кератина. Существует много клинических данных, подчеркивающих важность рогового слоя и его барьерной функции для младенцев и особенно для новорожденных [5]. Младенцы, рожденные недоношенными (гестационный возраст менее 34 недель), имеют недостаточно развитую барьерную функцию кожи, и многие исследования были сосредоточены на определении влияния гестационного возраста на развитие эпидермального барьера. Учитывая резкий переход от водной к сухой окружающей среде при рождении, исследования касались адаптации кожного барьера в течение первых нескольких дней или первого месяца жизни. Английские ученые доказали, что пик значения трансэпидермальной потери воды (ТЭПВ) наблюдался в группе детей в возрасте 1–2 лет, их показатель был значительно выше, чем ТЭПВ у взрослых. Это объясняет процесс продолжающейся адаптации кожи к внешним условиям окружающей среды [6].
Известно, что кожа доношенных младенцев имеет большую склонность к развитию АтД, а также способна к более высокому транскутанному всасыванию. Известно, что естественный увлажняющий фактор (NMF – natural moisturizing factor) в роговом слое участвует в барьерной функции и служит эффективным увлажнителем [7]. Показано, что концентрация NMF с возрастом снижается, зависит от проявления кожных заболеваний и факторов окружающей среды [8]. Измерение ТЭПВ обычно считается надежным инструментом, объективно оценивающим барьерную функцию эпидермиса, особенно при его нарушении.
Ключевой особенностью АтД детей первого года жизни является ксероз кожи, вызванный дисфункцией кожного барьера с повышенной трансэпидермальной потерей воды. Следует помнить, что поверхность кожи новорожденного достаточно гидрофобна, это ограничивает эпидермальное поглощение воды. Связано это с тем, что наиболее важные липиды, необходимые для барьерной функции, такие как керамиды, холестерин и свободные жирные кислоты, синтезируются в ламеллярных гранулах или кератиносомах, а также внутри зернистого слоя.
Изменения уровня pH рогового слоя были обнаружены у пациентов с АтД, что может нарушать липидный обмен в коже. Важно помнить, что у детей при рождении рН поверхности кожи нейтральный или щелочной (6,2–7,5), что приводит к значительному ухудшению защитных механизмов, направленных на подавление роста патогенных микроорганизмов. Регулярное использование смягчающих средств имеет большое значение для решения этой проблемы, и одновременно с увлажнением кожи это является основой общего управления АтД. Увлажняющие средства следует применять непрерывно, по потребности и постоянно, даже в отсутствие признаков активного воспаления. Поскольку существуют различные формы увлажняющих средств, необходим индивидуальный подбор в зависимости от потребности, клинической картины, времени года. Эти факторы должны учитываться при выборе подходящей наружной терапии [9]. В зависимости от индивидуального статуса кожи, сезонных и климатических условий рекомендуется подбирать соответствующий уход. Зимой и при наличии сильного ксероза более оправданно применение безводных средств или окклюзивных формул «вода-в-масле», а для ухода за сухой кожей в летний период рекомендуются легкие кремы-эмульсии «масло-в-воде» с высоким содержанием влагоудерживающих компонентов [10].
Наиболее эффективным способом восстановления защитной функции эпидермиса служит применение средств, направленных на восстановление рогового слоя и предотвращающих избыточную ТЭПВ. Для ухода за кожей детей раннего возраста разрабатываются специализированные косметические средства. Общее правило рецептур специализированной косметики заключается в использовании гипоаллергенных активных компонентов с подтвержденной эффективностью и безопасных консервантов, имеющих набор микроэлементов и нейтральный рН, которые эффективно успокаивают и смягчают кожу детей, снимают воспаление и не содержат сенсибилизирующих компонентов (отдушек, красителей). Средства, имеющие в своем составе мочевину и салициловую кислоту, для детей первого года жизни не рекомендуются, т.к. могут вызывать раздражение кожного покрова. Смягчающие средства, имеющие в своем составе ментол, а также содержащие анестетик, эффективны в уменьшении симптомов зуда.
Согласно современным рекомендациям по уходу за кожей детей первого года жизни, важно обеспечить регулярное увлажнение и очищение кожи. Масла для ванн являются отличным дополнением для ухода за кожей, особенно у детей первого года жизни, но следует избегать тех, которые содержат аллергенные белки, такие как арахис или коллоидный овес (в наиболее уязвимой возрастной группе до 2 лет).
Смягчающие средства – безопасный и эффективный метод укрепления эпидермального барьера, поскольку они обеспечивают его источником экзогенных липидов, улучшая барьерные свойства. Увлажняющие средства, содержащие дубильные вещества и битуминосульфонат аммония (Ихтиол), могут быть полезным дополнением к основному методу лечения АтД, особенно при легкой степени тяжести или если лечение топическими глюкокортикостероидами (тГКС) невозможно, например, при кортикофобии (стероидная фобия).
Дети первого года жизни, имеющие острые клинические проявления в виде мокнутия и эрозивных поражений, не всегда хорошо переносят местную терапию. С целью наискорейшего купирования выраженности клинических проявлений заболевания таким пациентам необходимо назначать лечение с использованием методики влажных обертываний «Wet wrap therapy» – (WWT) с тГКС III класса, фиксирующими бинтами Peha – crepp и легкими эластичными трубчатыми бинтами Tubifast [13]. WWT хорошо переносится при лечении экземы благодаря охлаждающим, противовоспалительным и противозудным свойствам. Зуд уменьшается при охлаждении посредством вазоконстрикции. WWT увеличивает увлажнение кожи и уменьшает ТЭПВ, а также защищает кожу как барьер от внешних раздражителей и аллергенов (рис. 1). Исследование показало положительное действие WWT на эпидермальный барьер, который сохраняется даже после прекращения этого метода терапии [14].
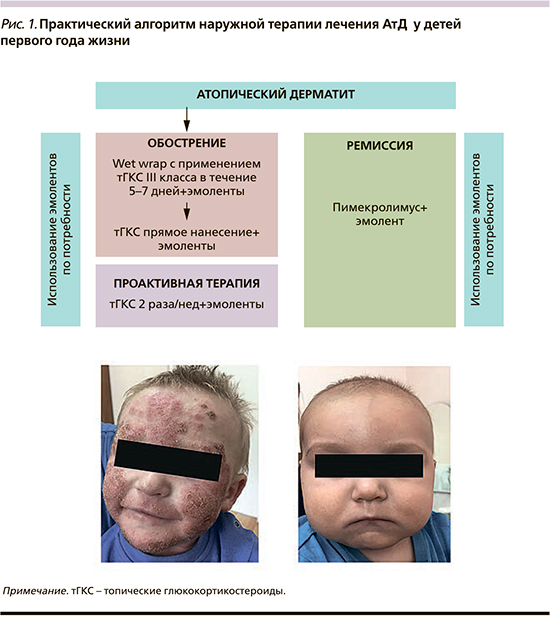
При лечении АтД детей первого года жизни нужно с осторожностью использовать тГКС в связи с возрастными анатомо-физиологическими особенностями кожи: нейтральной, а затем слабощелочной средой, рыхлым эпидермисом с тонкой базальной мембраной, богатой васкуляризацией, с большим количеством поверхностно расположенных кровеносных сосудов, большим соотношением площади кожи к массе тела пациентов раннего возраста [15, 16].
Эффективным и безопасным современным тГКС для детей первого года жизни является препарат, который в своем составе имеет гидрокортизон. Это синтетический негалогенизированный ГКС наружного применения, оказывает противовоспалительное и сосудосуживающее действия. В связи с мягким действием (относится к слабым тГКС – I класс по Европейской классификации) гидрокортизон разрешен к применению в отношении новорожденных. Кроме того, его можно использовать на чувствительных участках кожи [17].
Метилпреднизолона ацепонат (МПА) – также негалогенированный кортикостероид с метильной группой у С6, которая усиливает его эффект. MПA входит в группу сильнодействующих ГКС (класс активности III по Европейской классификации). Многократные двойные слепые плацебо-контролируемые исследования показали высокую клиническую эффективность МПА при лечении АтД через 1–4 недели применения раз в сутки, а также несколько клинических исследований подтверждают использование МПА детьми без локальных или системных побочных эффектов (8 испытаний на детях в возрасте от 4 месяцев до 15 лет действия мази 0,1% MПA 1 раз в сутки в течение 21 дня) [18].
Клинический случай
Пациентка Н. 9 месяцев. Семейный анамнез отягощен по линии отца (бронхиальная астма, АтД). В возрасте 3 месяцев появилась мелкоточечная сыпь на щеках. Лечение не проводилось. Затем высыпания распространились по всему кожному покрову, были представлены полигональными папулами, эритематозными пятнами, экскориациями. Наблюдались у педиатра по месту жительства, назначенная терапия была без эффекта. В связи с обострением и неэффективным системным и физиотерапевтическим лечением госпитализирована в стационар.
При поступлении кожный патологический процесс носил распространенный симметричный характер. На лице в области щек и подбородка наблюдались экзематозные бляшки со скудным мокнутием, чешуйками и корками на поверхности. Кожа туловища и конечностей была сухой, отмечалось явление мелкопластинчатого шелушения, высыпания в этой области были представлены множеством полигональных папул на фоне эритематозных пятен, расположенных хаотично, без склонности к слиянию и резких границ. Кожа кистей была инфильтрирована, отмечался выраженный эритематозный компонент. Также присутствовало множество линейных экскориаций с геморрагическими корочками на поверхности (рис. 2).

На лице отмечалось наличие эритематозных бляшек с мокнутием, на коже туловища мелкопластинчатое шелушение, распространенные высыпания, эритематозные пятна.
Проведено лечение: наружно на оча-ги наносился комбинированный крем (ГКС+антиботик+противогрибковое средство)+WWT 2 раза в сутки (утром и на ночь), а днем наносились увлажняющие средства (эмоленты) 3 раза в сутки. Также на область лица после стихания активного воспалительного процесса и уменьшения явлений мокнутия была назначена иммуносупрессивная терапия в виде крема пимекролимус (рис. 3).
Лечение АтД должно быть начато как можно раньше, чтобы предотвратить внутреннюю и внешнюю потерю воды (которая приводит к ксерозу, трещинам, зуду и боли) и проникновение чужеродных веществ внутрь (что приводит к раздражению и сенсибилизации). Последние данные свидетельствуют о том, что здоровая кожа без повреждений также имеет признаки субклинического воспаления, которые необходимо полностью купировать, чтобы вызвать ремиссию заболевания. Поскольку АтД является хроническим заболеванием, требующим лечения в течение многих лет или даже десятилетий, такое лечение должно быть безопасным и хорошо переносимым.
Заключение
Изменение барьерных функций кожи у детей раннего возраста при АтД связано с увеличением проницаемости эпидермального барьера, характеризуется изменением структуры и состава липидного матрикса рогового слоя, уменьшением концентрации компонентов NMF, что приводит к снижению гидратации кожи и увеличение ТЭПВ. Поэтому крайне важно обеспечить правильный уход и лечение с использованием увлажняющих средств. Использование эмолентов не только необходимо с целью стероидсберегающего эффекта, уменьшения зуда, воспаления, но и направлено на восстановление структуры и защитной функции эпидермального барьера, дисфункция которого влечет за собой формирование различных аллергических реакций (бронхиальная астма, пищевая аллергия, аллергический ринит) в результате чрескожного пути проникновения аллергенов и развития транскутанной сенсибилизации.
Литература
1. Page S.S., Weston S., Loh Rd. Atopic dermatitis in children. Aust Fam Physician. 2016;45(5)293–96.
2. Thomsen S.F. Atopic dermatitis: Natural history, diagnosis, and treatment. ISRN Allergy. 2014. Doi: 10.1155/2014/354250.
3. Leung D.Y., Boguniewicz M., Howell M.D., Nomura I., Hamid Q.A. New insights into atopic. Dermatitis. J Clin Invest. 2004;113(5):651–57. Doi: 10.1172/JCI21060.
4. Elias P.M., Hatano Y., Williams M.L. Basis for the barrier abnormality in atopic dermatitis. J Allergy Clin Immunol. 2008;121(6):1337–43. Doi: 10.1016/j.jaci.2008.01.022.
5. Haydont V., Bernard B.A., Fortunel N.O. Age-related evolutions of the dermis: Clinical signs, fibroblast and extracellular matrix dynamics. Mech. Ageing Dev. 2019;177:150–156. Doi: 10.1016/j.mad.2018.03.006.
6. Caspers P.J., Lucassen G.W., Carter E.A., et al. In vivo confocal Raman microspectroscopy of the skin: noninvasive determination of molecular concentration profiles. J Invest Dermatol. 2001;116:434–42. Doi: 10.1046/j.1523-1747.2001.01258.x.
8. Rutter N. Clinical consequences of an immature barrier. Semin Neonatol. 2000;5(4):281–87. Doi: 10.1053/siny.2000.0014.
9. McHenry P.M., Williams H.C., Bingham E.A. Management of atopic eczema: Joint Workshop of the British Association of Dermatologists and the Research Unit of the Royal College of Physicians of London. BMJ. 1995;310:843–47.
10. Seidenari S., Giusti G. Objective assessment of the skin of children affected by atopic dermatitis: a study of pH, capacitance and TEWL in eczematous and clinically uninvolved skin. Acta Derm. Venereol. 1996;75:429–33. Doi: 10.2340/0001555575429433.
11. Mandelin J.M., Rubins A., Remitz A., et al. Long-term efficacy and tolerability of tacrolimus 0.03% ointment in infants: a two-year open-label study. Int J Dermatol. 2012;51(1):104–10. Doi: 10.1111/j.1365-4632.2011.05015.x.
12. Sigurgeirsson B., Boznanski A., Todd G., et al. Safety and efficacy of pimecrolimus in atopic dermatitis: a 5-year randomized trial. Pediatr. 2015;135(4):597–606. Doi: 10.1542/peds.2014-1990.
13. Boguniewicz M., Nicol N.H. Wet Wrap Therapy in Moderate to Severe Atopic Dermatitis. Immunol Allergy Clin North Am. 2017;37(1):123–39.
14. Park H.A., Song T.W. The efficacy of wet wrap therapy in children with atopic dermatitis in a single center. Allergy Asthma Resp Dis. 2019;7:13–21.
16. Brascb J., Hautkr Z. Das atrophogene potential von mometason-furoat in clinischen langzeitversuch. Z. Hautkr. 1991;66(9):785–87.
18. Ruzicka T. Methylprednisolone aceponate in eczema and other inflammatory skin disorders – a clinical update. Int J Clin Pract. 2006;60:85–92.
Об авторах / Для корреспонденции
The practice of application of new topical agents to the treatment of atopic dermatitis in children
N.G. Korotky, B.N. Gamayunov, A.A. Tikhomirov State federal facility "Russian State Medical University", Moscow
Ключевые слова: атопический лерматит, наружная терапия, пелиатрическая практика, крем унилерм. Key words: atopic dermatitis, external therapy, pediatric practice, uniderm cream.
Среди всего многообразия средств для наружной терапии кортикостероидные препараты являются наиболее востребованными в силу быстроты развития и выраженности противовоспалительного действия. Можно отметить, что топические препараты глюкокортикостероиды (ГКС) являются одними из самых часто назначаемых пациентам с аллергодерматозами [1].
Доля аллергических поражений кожи в структуре детских заболеваний неуклонно увеличивается. Особенно тревожным является значительный рост аллергических болезней кожи с хроническим и рецидивирующим течением, торпидных к традиционной, в том числе наружной терапии. Среди аллергодерматозов у детей наиболее часто встречается атопический дерматит (АД) [2].
Проблема АД приобретает в последние годы все большее медико-социальное значение, распространенность заболевания неуклонно растет, составляя по некоторым данным в различных странах мира от 6 до 25%, а в России — до 35%. Кроме того, АД является фактором риска развития бронхиальной астмы у детей, поскольку поливалентная сенсибилизация, формирующаяся при АД, сопровождается не только локальным воспалением кожи, но и системным иммунным ответом с вовлечением в процесс различных разделов респираторного тракта [2, 3].
В настоящее время общепризнанна иммунологическая концепция патогенеза АД, основанная на понятии атопии как генетически обусловленной способности организма к выработке высокой концентрации общего и специфических антител класса IgE в ответ на действие аллергенов окружающей среды. Клинически АД характеризуется кожным зудом, возрастным полиморфизмом высыпаний, определенной локализацией, стадийностью и хроническим течением [2,4].
Ведущим механизмом развития АД является изменение соотношения между Т-хелперами первого (Thl) и Т-хелперами второго (Тп2) порядка в пользу последних, что приводит к изменению профиля их цитокиновой секреции и повышенной продукции общего и специфических антител класса IgE, которые фиксируются при помощи Fc-фрагментов к специфическим рецепторам на мембранах тучных клеток и базофилов. При повторном поступлении антиген распознается фиксированными на тучной клетке антителами, происходит активация тучной клетки с высвобождением преформированных медиаторов аллергии — гистамина, серотонина, кининов, которые обусловливают развитие ранней фазы аллергического ответа, проявляющейся у больных АД интенсивным зудом и гиперемией [4].
Затем воспалительный процесс приобретает хроническое течение, что определяется следующими механизмами. Т-клетки памяти способны мигрировать в кожу с последующей экспрессией на кератиноцитах, клетках Лангерганса и эндотелиоцитах, что поддерживает местную активацию Т-клеток. Повторное или постоянное воздействие аллергена вызывает как немедленную, так и позднюю фазы аллергического ответа, а также клеточную пролиферацию по Th-2 типу. В свою очередь клетки Th-2 продуцируют цитокины, которые, с одной стороны, обеспечивают постоянное повышение уровня IgE, а с другой, стимулируют эозинофилы, тучные клетки и макрофаги к высвобождению различных медиаторов воспаления [4].
Поддерживает хроническое течение АД и так называемый зудорасчесный цикл, поскольку зуд является его постоянным симптомом. Кератиноциты, повреждаемые при расчесывании кожи, высвобождают цитокины и медиаторы, которые привлекают клетки в места воспаления в коже. Все это вместе приводит к реализации аллергического воспаления с преимущественной локализацией в коже [4].
Однако воспалительные поражения кожи при АД могут развиваться без участия IgE, тем более что, по данным литературы, приблизительно у 25% больных АД уровень IgE не превышает норму. Безусловно, важную роль играют нейропептиды и лейкотриены, тучные клетки, эозинофилы, кератиноциты, нарушение барьерной функции эпидермиса. Тучные клетки, выделяющие при дегрануляции гистамин, протеазы, простагландины, лейкотриены, серотонин, расположены вблизи окончаний чувствительных нервов в коже и стимулируются не только интерлейкином (ИЛ-) 4, но и нейропептидами, при этом прослеживается возможность психического влияния на манифестацию АД. Эти факторы рассматриваются как особо важные неспецифические механизмы в патогенезе АД [4].
Таким образом, в развитии атопического дерматита участвуют не только иммунные, но и неспецифические (неиммунные) механизмы. Они вместе и определяют своеобразие реакции кожи на действие причинных факторов, выражающееся в особенностях иммунного ответа и гиперреактивности [5].
Секрет успешного применения топических ГКС в лечении АД заключается в их многообразном влиянии на процессы воспаления в коже [6].
Наиболее важными эффектами ГКС являются:
— увеличение связывания гистамина и серотонина в коже и уменьшение чувствительности нервных окончаний к нейропептидам и гистамину;
— угнетение синтеза ИЛ-4, ИЛ-5, ИЛ-13, у-интерферона и других цитокинов;
— уменьшение активности фосфолипазы А2 и продукции эйкозаноидов, а также снижение экспрессии молекул клеточной адгезии и чувствительности эндотелия к медиаторам аллергии;
— торможение миграции эозинофилов и пролиферации Т-лимфоцитов; снижение сосудистой проницаемости и нарушений микроциркуляции.
Однако, несмотря на все положительные эффекты топических ГКС, не следует забывать, что при неправильном их применении велика возможность развития как местных, так и системных побочных эффектов. К числу местных побочных эффектов, встречающихся при использовании наружных ГКС, относятся атрофия кожи; акнеформная сыпь, фолликулиты; периоральный дерматит; телеангиэктазии; стрии; гипертрихоз; присоединение вторичной инфекции.
Возможны также и системные побочные эффекты, такие как подавление функции коркового вещества надпочечников, задержка роста, синдром Иценко—Кушинга и др., которые, однако возникают очень редко.
В педиатрической практике при назначении отдается предпочтение негалогенизированным препаратам ГКС последнего поколения. Они обладают высокой эффективностью и безопасностью, возможностью применения 1 раз в сутки, в том числе у детей раннего возраста.
С целью оценки клинической эффективности, переносимости и безопасности мы изучали результаты применения крема Унидерм («Акрихин», Россия) в наружной терапии АД различной степени тяжести у детей в возрасте от 6 мес. до 17 лет. Нами были поставлены следующие задачи исследования:
1. Оценить безопасность, переносимость и терапевтический эффект крема Унидерм при лечении 30 детей с АД.
2. На ограниченной группе пациентов (п=10) изучить влияние крема Унидерм (мометазона фуроат) на функцию гипоталамо-гипофизарно-надпочечниковой системы (определение уровня кортизола в плазме крови до, через 1 и 2 нед. ежедневного применения крема Унидерм). В данное исследование были включены 30 детей с различными клиническими формами АД (эритематозная,эритематозно-сквамознаяиэритематозно-сквамозная с лихенификацией) легкой, средней и тяжелой степени тяжести в возрасте от 6 мес. до 17 лет — 14 девочек и 16 мальчиков (табл. 1).
У всех детей был подтвержденный АД в состоянии обострения кожного процесса с легкой, средней или тяжелой степенью тяжести заболевания. Длительность заболевания у наблюдаемых детей колебалась от 5 мес до 16 лет.
В исследование не включали пациентов, не соответствующих указанному возрасту, а также пациентов, соответствующих критериям включения, но получающие системную и местную терапию основного заболевания следующими препаратами: ГКС (преднизолон, дексаметазон и др.); цитостатиками (циклоспорин); любыми топическими ГКС и их комбинациями, а также увлажняющими местными средствами менее чем за 7 дней до момента включения в исследование.
Крем Унидерм наносили на пораженные участки кожи 1 раз в день. Допускалось прекращение использования препарата в сроки после окончания 1-й или 2-й нед. от начала лечения при достижении у больного полной клинической ремиссии.
Таблица 1. Характеристика обследованных больных
Возраст
Девочки
Мальчики
Всего
От 6 мес. до 5 лет
От 11 до 17 лет
Таблица 2. Распределение больных АД на группы
в зависимости от значения коэффициента SCORAD (kS) при первичном осмотре
Группы больных
Степень тяжести заболевания (kS)
Среднее значение (kS)
Число больных
У 10 пациентов с тяжелой степенью тяжести АД крем Унидерм применяли ежедневно в течение 2 нед. До начала исследования, через 1 и 2 нед. наружной терапии у этих же больных брали кровь (определение уровня кортизона в плазме) для оценки влияния крема Унидерм на функцию гипоталамо-гипофизарно-надпочечниковой системы (системная безопасность).
Общая продолжительность исследования составила 3 нед. и включала первичный клинический осмотр с контрольными осмотрами через 1,2 и 3 нед. от начала лечения.
Кроме того, в процессе терапии больные по показаниям получали антигистаминные препараты, седативную микстуру, туширование расчесов 5% раствором перманганата калия или 1% раствором метиленового синего. В наружной терапии применялся только крем Унидерм.
Для объективной оценки степени тяжести течения заболевания и эффективности проводимой терапии у наблюдаемых детей мы использовали коэффициент SCORAD (kS). Этот коэффициент объединяет площадь поражения кожи, степень выраженности объективных (эритема, образование папул/ везикул, мокнутие, экскориации, лихенификация, сухость кожи) и субъективных (зуд кожи и/или нарушение сна) симптомов. При максимальной распространенности процесса и выраженности объективных и субъективных симптомов SCORAD= 103, а в их полное отсутствие SCORAD=0.
Используя коэффициент SCORAD (kS), объективно оценивали степень тяжести кожного процесса у каждого обследуемого ребенка: 0 < kS < 20 — легкая степень, 20 < kS < 40 — средняя степень, kS >40 — тяжелая степень заболевания.
Для определения коэффициента SCORAD (kS) применяли специально разработанную компьютерную программу Калькулятор SCORAD.
На каждого больного была заведена индивидуальная карта, в которой оценивалась динамика кожного процесса в ходе исследования (kS до и после применения крема Унидерм).
Эффективность терапии оценивали по следующим параметрам: клиническая ремиссия, значительное улучшение, улучшение, без эффекта, ухудшение и отражали в виде графика изменения среднего значения SCORAD во времени на 8, 15 и 22-й дни от начала исследования для каждой степени тяжести заболевания. По горизонтали отмечали время лечения в днях, а по вертикали — среднее значение SCORAD (рис. 1).
Рис. 1. Динамика среднего значения kS у детей, страдающих атопическим дерматитом, в процессе 3-недельного исследования крема Унидерм.

В соответствии с полученными значениями коэффициента SCORAD на первичном осмотре до начала лечения кремом Унидерм мы разделили всех участвовавших в исследовании детей (п=30) на 3 группы по степени тяжести течения кожного процесса (табл. 2).
В 1-ю группу — с легкой степенью тяжести течения заболевания (kS до 20) — вошли 9 больных со средним значением kS в целом по группе 17,4.
Во 2-ю группу вошли 11 пациентов со средней степенью тяжести кожного процесса. Среднее значение kS в целом по группе равно 27,2.
В 3-ю группу объединили 10 детей с тяжелым течением заболевания (kS > 40). Среднее значение kS в этой группе равнялось 64,5.
Клиническая картина АД у больных 1-й группы характеризовалась ограниченной площадью поражения кожных покровов. Патологический процесс локализовался в локтевых сгибах, подколенных ямках, периоральной области и был представлен слабо выраженной эритемой, единичными мелко папулезными элементами, экскориациями, умеренно выраженной сухостью кожи и мелко пластинчатым шелушением. Кроме того, отмечался незначительный зуд кожи и лихенификация в очагах поражения.
Среди преобладающих симптомов у пациентов 2-й группы мы выделили более интенсивный зуд кожи по сравнению с таковым в предыдущей группе больных, в ряде случаев сопровождающийся нарушением сна. Кожный процесс носил распространенный характер и локализовался на коже лица (периорбитальная и периоральная области), передней поверхности шеи, локтевых сгибах, сгибательной и разгибательной поверхностях лучезапястных суставов, подколенных ямках. Отмечалась более выраженная острота воспалительной реакции: умеренно выраженные эритема и отек, папулезные элементы ярко-красного цвета, серозно-геморрагические корочки, экскориации, трещины на фоне очагов лихенефикации, выраженной сухости кожи и значительного шелушения, как в очагах АД, так и на не пораженной коже.
У 10 детей, составивших 3-ю группу, патологический процесс локализовался на коже лица, передне- и заднебоковых поверхностей шеи, туловища, верхних и нижних конечностей, где на фоне значительно выраженной отечной эритемы отмечались многочисленные папулезные элементы, серозногеморрагические корочки, экскориации, трещины. При слиянии папулезных элементов отмечалась выраженная лихенификация кожи. Больные жаловались на интенсивный зуд кожи, который у 2 пациентов сопровождался выраженным нарушением сна.
Рис. 2. Динамика распространенности, объективных и субъективных симптомов у больных с тяжелой степенью тяжести атопического дерматита в процессе исследования.

Рис. 3. Динамика распространенности, объективных и субъективных симптомов у больных со средней степенью тяжести атопического дерматита в процессе исследования.

Рис. 4. Динамика распространенности, объективных и субъективных симптомов у больных с легкой степенью тяжести атопического дерматита в процессе исследования.

Обобщая результаты 3-недельного исследования крема Унидерм в терапии детей, больных АД легкой, средней и тяжелой степени тяжести, мы констатировали клиническую ремиссию у 15 детей (50,0%), значительное улучшение — у 11 (36,7%), улучшение — у 4 (13,3%) (табл. 3). Случаев развития побочных эффектов, осложнений, а также отсутствия клинического эффекта и/или ухудшения в течении заболевания на фоне наружной терапии кремом Унидерм не наблюдали.
Таблица 3. Клиническая эффективность применения крема Унидермв терапии детей, больных АД
В.Р. Воронина, врач-дерматовенеролог, к. м. н., ГБОУ ВПО «Российский национальный исследовательский университет им. Н.И. Пирогова», Обособленное структурное подразделение - Научно-исследовательский клинический институт педиатрии им. академика Ю.Е. Вельтищева
Сокращения: ТГКС - топические глюкокортикостероиды, ТИК - топические ингибиторы кальциневрина, АтД - атопический дерматит
Ключевые слова: атопический дерматит, наружная терапия, базовая терапия, топические глюкокортикостероиды, топические ингибиторы кальциневрина
Key words: atopic dermatitis, topical treatment, basic treatment, topical corticosteroids, topical calcineurin inhibitors
Атопический дерматит (АтД) - мультифакторное заболевание кожи, возникающее, как правило, в раннем детском возрасте у лиц с наследственной предрасположенностью к атопическим заболеваниям, имеющее хроническое рецидивирующее течение, возрастные особенности локализации и морфологии очагов воспаления, характеризующееся кожным зудом, обусловленное гиперчувствительностью как к аллергенам, так и к неспецифическим раздражителям [1, 2]. Заболевание в типичных случаях начинается в раннем детском возрасте и значительно нарушает качество жизни больного и членов его семьи. Распространенность среди детского населения составляет до 20%, тогда как у взрослых достигает только 1-3% [2]. Лечение АтД должно быть комплексным и патогенетически обоснованным, включающим элиминационные мероприятия, диету, гипоаллергенный режим, местную и системную фармакотерапию, обучение больного и членов его семьи [3]. Наружная терапия является абсолютно необходимой для достижения улучшения состояния и должна проводиться дифференцированно с учетом изменений кожи, мультифакторного генеза заболевания (интегральный подход) [4, 5].
При назначении терапии следует включать:
Всем больным АтД вне зависимости от тяжести, распространенности, остроты кожного процесса, наличия или отсутствия осложнений назначаются средства базового ухода за кожей. Базовая терапия должна включать рациональный уход за кожей, направленный на восстановление нарушенной функции кожного барьера путем использования смягчающих и увлажняющих средств, средств для очищения кожи, а также выявление и устранение контакта со специфическими и неспецифическими триггерами [5].
Купание ребенка с АтД является необходимой процедурой, позволяющей очистить кожу от нанесенных ранее слоев препаратов, слущивающихся чешуек эпидермиса, корок. Очищение кожи позволяет достигнуть непосредственного контакта лекарственного средства с кожей. Исключением является наличие очагов выраженного мокнутия, вторичного инфицирования кожи. В этот период целесообразно воздержаться от принятия ванной, общего душа в течение нескольких дней, для того, чтобы избежать диссеминации инфекции. Далее купание можно проводить ежедневно, соблюдая комфортную для малыша температуру воды. Вода для купания должна быть 35-36 градусов и желательно дехлорированной (отстаивание воды в течение 1-2 часов). Один-два раза в неделю используются не щелочные моющие средства (так называемые синдеты), без использования жестких мочалок. Высушивание кожи проводится промокающими движениями, без травмирующего растирания кожи. После очищения кожи необходимо обработать расчесы, трещины раствором антисептика (фукорцин, зеленка, мирамистин или др.). Это позволяет свести к минимуму риск вторичного инфицирования и возникновения инфекционно-зависимых обострений дерматита, избежать попадания компонентов наружных средств на участки с нарушенной целостностью кожных покровов, ведущее к возникновению неприятных субъективных ощущений в виде жжения и зуда.
Сразу после купания необходимо использование увлажняющих, релипидирующих средств по уходу за кожей. Это позволяет удержать влагу в эпидермисе, исключить пересыхание кожи [6, 7]. Следует избегать нанесения средств косметического ухода за кожей на очаги острого и подострого воспаления. Конкретный препарат и его лекарственная форма подбираются индивидуально на основании предпочтений пациента, индивидуальных особенностей кожи, сезона, климатических условий, а также времени суток.
Общие рекомендации по применению увлажняющих и смягчающих средств согласно федеральным клиническим рекомендациям по лечению атопического дерматита [2]:
Средства с противовоспалительной активностью выбираются в соответствии со стадией воспалительного процесса (табл.) [7,11].
Таблица.
Применение лекарственных форм при различных стадиях атопического дерматита
| Характер воспалительного процесса | Лекарственная форма |
Острое воспаление с мокнутием (фото 1, 2) | Примочка Аэрозоль Лосьон Раствор |
Острое воспаление без мокнутия (фото 3) | Водные болтушки Крем Липокрем Паста Аэрозоль |
Подострое воспаление (фото 4, 5) | Крем Липокрем Паста |
Хроническое воспаление (фото 6) | Мазь Паста Компресс |
Количество топического препарата для наружного применения измеряется согласно правила «длины кончика пальца» (FTU, FingerTipUnit), при этом одна 1 FTU соответствует столбику мази диаметром 5 мм и длиной, равной дистальной фаланге указательного пальца, что соответствует массе около 0,5 г. Этой дозы топического средства достаточно для нанесения на кожу двух ладоней взрослого человека, что составляет около 2% всей площади поверхности тела. Наружные противовоспалительные лекарственные средства необходимо наносить на увлажненную кожу, непосредственно на очаги поражения кожи. Их применение прекращают при разрешении процесса и переходят на базовую терапию. В последнее время рекомендуют метод проактивного лечения: длительное использование малых доз топических противовоспалительных препаратов на пораженные участки кожи в сочетании с применением эмолиентов на весь кожный покров и регулярное посещение дерматолога для оценки состояния кожного процесса [2,12]. Эффективность наружной терапии зависит от трех основных принципов: достаточная сила препарата, достаточная доза и правильное нанесение. При атопическом дерматите с противовоспалительной целью используются топические глюкокортикостероиды, топические ингибиторы кальциневрина, активированный пиритоин цинка. Также возможно использование экстемпоральных мазей, паст, примочек, имеющих в своем составе салициловую кислоту, вазелин, вазелиновое масло, метилурацил, ланолин, нафталан, ихтиол, дерматол, цинк, крахмал, висмут, тальк, борную кислоту, йод, масло оливковое, они обладают комплексным противовоспалительным, кератолитическим, кератопластическим, дезинфицирующим, высушивающим действием.
На сегодняшний день основой местной терапии при обострениях АтД являются топические глюкокортикостероиды (ТГКС). Выбор ТГКС определяется тяжестью течения и обострения. Согласно Европейской классификации (Miller J., Munro D., 1980), выделяют четыре класса данных препаратов в зависимости от их активности. Основные глюкокортикостероидные препараты, рекомендуемые для лечения АтД у детей: гидрокортизон, флутиказона пропионат, мометазона фуроат, гидрокортизона бутират, метилпреднизолона ацепонат. Наружные глюкокортикостероидные препараты наносят на пораженные участки кожи от 1 до 3 раз в сутки, в зависимости от выбранного препарата и тяжести воспалительного процесса. Не рекомендуется разведение официнальных топических препаратов индифферентными мазями, так как такое разведение изменяет концентрацию действующего вещества, но не снижает частоту появления побочных эффектов. Необходимо избегать использования ТГКС высокой активности на кожу лица, область гениталий и интертригинозные участки. Для этих областей обычно рекомендуются ТГКС с минимальным атрофогенным эффектом (мометазона фуроат, метилпреднизолона ацепонат, гидрокортизона-17-бутират). Во избежание резкого обострения заболевания дозу ТГКС следует снижать постепенно. Это возможно путем перехода к ТГКС средствам меньшей степени активности с сохранением ежедневного использования или путем продолжения использования сильного ТГКС, но со снижением частоты аппликаций (интермиттирующий режим) [2, 13]. В ряде клинических исследований было показано, что использование топических ТГКС совместно со смягчающими/увлажняющими средствами позволяет уменьшить курсовую дозу ТГКС [14].
При наличии или подозрении на инфекционное осложнение показано назначение ТГКС, комбинированных с антибиотиками и противогрибковыми средствами (фото 2, 5). Следует учитывать. Что многие комбинированные препараты содержат высокоактивный бетаметазона дипропионат, применение которого у детей нежелательно.
Группа топических ингибиторов кальциневрина (ТИК) включает такролимус и пимекролимус. Фармакологическое действие ТИК обусловлено ингибированием кальциневрина и дальнейшего выделения Т-лимфоцитами и тучными клетками воспалительных цитокинов и медиаторов.
Общие рекомендации по применению ТИК [13]:
Такролимус - наиболее активный представитель топических ингибиторов кальциневрина. Предназначен для лечения АД средней тяжести и тяжелого течения, в том числе стероидрезистентных форм. Многочисленные клинические исследования продемонстрировали, что такролимус обладает эффективностью, сравнимой с таковой сильных ГКС, при этом лишен присущих ГКС побочных эффектов (в частности, не вызывает атрофии кожи) [5]. Показаниями к назначению такролимуса являются среднетяжелое и тяжелое течение АтД в случае резистентности к стандартной терапии. У детей применяется 0,03%-я мазь таролимус. Режим применения - 2 раза в день ежедневно до достижения очищения кожи. Двухкратный режим дозирования должен использоваться не дольше 3 недель, далее мазь наносится однократно. Клинический эффект достигается как правило в течение первой недели. У пациентов, подверженных частым рецидивам заболевания, такролимус необходимо наносить на все обычно поражаемые при обострениях участки кожи 1-2 раза в неделю (перерыв между нанесениями должен составлять 2-3 дня). При возникновении обострения - вновь перейти на режим применения 2 раза в день. Если в течение 6 недель не удается достигнуть улучшения, при переходе на поддерживающий режим дозирования препарата возникает обострение - дальнейшее использование препарата нецелесообразно. Длительность профилактического использования такролимуса - 12 месяцев, затем необходимо провести освидетельствование пациента для принятия решения, продолжать или отменить терапию такролимусом. Во время курса лечения необходимо избегать инсоляции, использовать фотозащитный крем на открытые участки кожи, обрабатываемые мазью такролимус.
Наиболее частые побочные эффекты - покраснение, чувство жжения, усиление зуда на участках обрабатываемых такролимусом. Эти симптомы беспокоят, как правило, в первые дни лечения и разрешаются к концу первой недели. Тяжесть их коррелирует с остротой атопического дерматита. Охлаждение мази в холодильнике перед нанесением и использование увлажняющего средства за 10-15 минут до мази ТИК уменьшает выраженность реакции. Эффекты раздражения кожи можно уменьшить, применяя ацетилсалициловую кислоту внутрь.
Вакцинацию необходимо провести до начала применения мази или спустя 14 дней после последнего использования мази такролимус. В случае применения живой аттенуированной вакцины этот период должен быть увеличен до 28 дней.
Пимекролимус 1%-й крем показан при атопическом дерматите легкого и среднетяжелого течения и может применяться у детей старше 3 месяцев. Однако в ряде стран Европы, США и Канаде пимекролимус разрешен к применению у детей старше 3 лет. Препарат обладает выраженным действием на большинство штаммов Malazessia, что может быть полезно в случаях сенсибилизации к этому грибу [3]. В 2013 году рядом авторов предложен новый алгоритм терапии атопического дерматита легкой и средней тяжести с применением 1%-го крема пимекролимус [13]. При длительно существующем АтД легкой степени тяжести препарат используется дважды в день при появлении первых признаков обострения. Острый АтД легкой и средней тяжести: на протяжении 3-4 дней использование ТКС, с дальнейшим назначением пимекролимуса дважды в день на все пораженные участки до исчезновения симптомов. Предложено проведение поддерживающей терапии длительностью до 3 месяцев 1 раз в день или реже, по усмотрению лечащего врача, на ранее пораженных участках кожи для предотвращения обострений заболевания.
Активированный пиритион цинка (аэрозоль 0,2%, крем 0,2% и шампунь 1%) является нестероидным препаратом, обладающим широким спектром фармакологических эффектов. Может применяться у детей от 1 года, допускается использование на всех участках тела без ограничений по площади. Препарат снижает колонизацию кожи Malassezia furfur, другими грибами, а также S. aureus, участвующими в патогенезе атопического дерматита. Его применение сопровождается уменьшением выраженности кожного зуда, уменьшением степени тяжести и активности кожного процесса, снижением потребности в использовании топических и антигистаминных препаратов. Крем наносят 2 раза в сутки, возможно применение под окклюзионную повязку. Аэрозоль используют в случаях выраженного мокнутия, распыляют с расстояния 15 см 2-3 раза в сутки [2].
Таким образом, современный интегральный подход к терапии АтД включает ступенчатое использование ТГКС, ТИК или других противовоспалительных средств, постоянное использование базовой терапии эмолиентами, бережное очищение кожи, своевременное назначение наружных антисептиков, антибактериальных, противогрибковых препаратов.
ЛИТЕРАТУРА
Для цитирования: Смирнова Г.И. Cовременные технологии наружной терапии атопического дерматита у детей с использованием средств дерматологической косметики. РМЖ. 2005;1:76.
Атопический дерматит (АД) – самое раннее и частое клиническое проявление атопии у детей, представляет собой хроническое генетически обусловленное аллергическое воспаление кожи, в основе которого лежат иммунные механизмы, приводящее к повреждению всех слоев эпидермиса и характеризующееся возрастной морфологией высыпаний, локализацией, стадийностью и склонностью к рецидивирующему течению [1,2].
АД – важная медико–социальная проблема, так как его распространенность неуклонно растет, изменился патоморфоз АД у детей: отмечено более раннее появление первых признаков заболевания у детей c 1–2 месячного возраста (по нашим данным в 47% случаев); увеличилась частота тяжелых форм АД с расширением площади поражения кожи; возросла доля больных с хроническим рецидивирующим течением, торпидным к традиционной терапии; значительно снижается качество жизни больных АД, что связано с психосоматическими нарушениями и косметическими дефектами [3].
При АД в результате аллергического воспаления кожи у детей формируется повреждение рогового и водно–липидного слоев эпидермиса, что снижает его барьерные функции, одновременно повышая склонность к вторичному инфицированию, существенно увеличивает трансэпидермальные потери воды, что приводит к патологической сухости кожи, усилению зуда, нарушениям физиологической десквамации, утолщению рогового слоя с развитием гиперкератоза и выраженного шелушения [2,3,6]
В связи с этим наружная терапия является неотемлемой частью лечения АД и должна проводиться с учетом патологических изменений в коже и возрастом.
Целью наружной терапии АД у детей является: купировать воспаление и зуд; повысить барьерную функцию кожи и восстановить водно–липидный слой; обеспечить правильный ежедневный уход за кожей.
В зависимости от остроты воспалительного процесса при АД у детей мы рекомендуем использовать различные лекарственные формы: лосьоны, болтушки, кремы, гели, липогели, мази. В остром периоде АД при наличии экссудации и мокнутия целесообразно использование дерматологических примочек, влажных повязок, лосьонов, содержащих противовоспалительные средства; в остром периоде без экссудации и мокнутия рекомендуются болтушки, кремы и гели с противовоспалительным действием; при хроническом воспалении кожи с лихенизацией и сухостью целесообразно применение жирных мазей и кремов, содержащих противовоспалительные и кератопластические средства. В период ремиссии АД необходим правильный уход за кожей с использованием очищающих и увлажняющих средств.
Для купирования воспаления и зуда необходимо назначение наружных противовоспалительных средств, содержащих топические глюкокортикостероиды (ГКС) [7] или нестероидные противовоспалительные препараты.
Наиболее выраженным противовоспалительным эффектом обладают топические ГКС – это современный стандарт противовоспалительной терапии. Они назначаются в острый период АД при выраженных проявлениях и при его тяжелом течении, короткими курсами 5–7 дней по интермиттирующей методике [7].
Однако при длительном, нерациональном и неконтролируемом применении ГКС (особенно фторсодержащих), а также при неправильной методике нанесения этих средств возможно развитие побочных эффектов ГКС:
местных – атрофия кожи, стрии, телеангиэктазии, нарушения пигментации, снижение местного иммунитета с развитием инфекционных осложнений, тахифилаксия, синдром отмены, эритема, розацеа;
системных – угнетение гипоталамо–гипофизарно–надпочечниковой системы, нарушения роста, развитие синдрома Кушинга, особенно при раннем и длительном применении у детей с 2–х лет.
В связи с этим созданы современные безопасные топические кортикостероиды с выраженным противовоспалительным действием и минимальными побочными эффектами – Элоком, Адвантан, Локоид. Однако в последние годы отмечается более тяжелое течение АД, требующее длительной противовоспалительной терапии. Поэтому при использовании даже современных безопасных ГКС, необходим взвешенный подход к их назначению и соблюдение следующих принципов [7]: не применять топические ГКС у детей в возрасте до 6 мес. и не использовать фторсодержащие кортикостероиды; назначать топические ГКС с учетом суточного ритма гормональной секреции – 1 раз в сутки, в утренние часы, короткими курсами – 7 дней по интермиттирующей методике. Не наносить на чувствительные участки кожи, под окклюзионную повязку, на поверхности более 20% общей площади кожных покровов. Не применять для топических ГКС метод разведения.
В связи с этим при легком и средне–тяжелом течении АД особенно у маленьких детей наружную терапию следует начинать с применения противовоспалительных средств, не содержащих топические ГКС. К ним относятся традиционные и современные средства. Традиционные противовоспалительные средства (Нафталан, Деготь, Дерматол, АСД III фракция) из–за низкой эффективности и побочных эффектов имеют ограниченное применение. Поэтому возникла необходимость создания современных противовоспалительных средств, не содержащих кортикостероиды для наружной терапии атопического дерматита. К ним относятся пимекролимус 1% крем и средства лечебной дерматологической косметики.
Наряду с этим особое внимание в настоящее время привлекают средства лечебной дермокосметики, которые предназначены как для лечения, так и для постоянного ухода за кожей при АД. Особенное распространение и признание врачей получила линия Биодерма. При легком течении АД особенно у маленьких детей в качестве противовоспалительного средства, не содержащего ГКС, можно использовать крем Атодерм Р.О.цинк®, который содержит b–ситостерол 0,50% (экстракт пальмового масла), глюконат цинка 0,50% и пироктон оламина 0,23%, которые обеспечивают его противовоспалительное и противозудное действие, восстанавливает гидролипидный баланс кожи, ограничивая проникновение аллергенов.
С целью определения эффективности и переносимости при наружной терапии АД мы использовали крем Атодерм Р.О.цинк® у 48 больных в возрасте от 2 месяцев до 14 лет с различными формами АД в период обострения. Крем наносили на очищенные участки кожи два раза в день, курсом от 3–х до 6–х недель. При легком и средне–тяжелом течении АД крем использовали как монотерапию (рис. 1). При этом средняя площадь пораженной кожи уменьшалась в среднем в 2,2 раза при легком и средне–тяжелом течении АД и в 1,6 раза при тяжелом течении АД. Эффективность лечения составила в среднем 82%, отличные результаты получены в 40%, хорошие – в 42%, средние – в 18% наблюдений, отсутствие эффекта – в 3,5% случаев. Наступление ремиссии АД ускорялось в 2,3 раза. Наши данные свидетельствуют, что крем Атодерм Р.О.цинк® оказывает противовоспалительное, антибактериальное, противозудное, смягчающее, и успокаивающее действие, что позволяет рекомендовать его для лечения АД преимущественно при легком и средне–тяжелом его течении. При тяжелом течении АД применение крема ускоряет наступление ремиссии в 1,7 раза и позволяет уменьшить потребность в топических ГКС. Крем целесообразно использовать при обострении АД как монотерапию, особенно эффективно его длительное применение при подостром течении АД, а при тяжелом течении АД – в сочетании с топическими кортикостероидами.
После купирования воспаления кожи следующим важным этапом местного лечения АД является восстановление рогового слоя эпидермиса и вводно–липидной пленки кожи с помощью смягчающих и питательных средств. Это базисная вспомогательная терапия, которая совершенно необходима при наружном лечении АД. Эти средства наносятся регулярно, ежедневно, не менее 2 раз в день, в том числе после каждого купания, на фоне топических ГКС или элидела и даже в период, когда симптомы АД отсутствуют. Среди них особый интерес вызывает крем Атодерм. Крем Атодерм действует патогенетически, встраивается в липиды клеточных мембран, восстанавливает гидро–липидную пленку кожи, увлажняет, смягчает и питает кожу, что способствует продлению ремиссии АД.
Обязательным звеном местной терапии является правильный ежедневный уход за кожей больных детей. В качестве очищающих средств следует использовать специально разработанные для сухой кожи средства лечебной дерматологической косметики с мягкой моющей основой, рН 5,5, не содержащей щелочи (дерматологические шампуни, мыло и муссы). Хороший эффект получен нами при использовании таких дерматологических очищающих средств как Атодерм–мусс® и Атодерм–мыло®, которые мягко очищают кожу, восстанавливают физиологическое значение рН и не нарушают целостность гидролипидного слоя эпидермиса. Причем Атодерм мыло лучше использовать при экссудативной форме АД, а Атодерм–мусс – при лихеноидной форме АД [12].
После ванны или душа необходимо обязательное увлажнение кожи с помощью увлажняющих кремов (крем Атодерм, Гидрабис), которые наносятся на кожу в первые минуты после ванны или душа. Для обеспечения ежедневного ухода и коррекции сухости кожи у 63 детей в возрасте от 2 месяцев до 14 лет нами был использован Атодерм–мусс и Атодерм–крем. Атодерм–мусс применяли как очищающий гель, содержащий нейтральную основу, преимущественно для очистки кожи лица и тела. За счет содержания сульфата меди и сульфата цинка Атодерм–мусс обладает дополнительно антисептическими свойствами. Атодерм–мусс использовали для ухода за кожей с применением непродолжительной ванны или душа с последующим нанесением увлажняющего крема Атодерм. В результате использования указанного комплекса Атодерм–мусс + Атодерм–крем нами было установлено значительное улучшение состояния кожи детей, страдающих АД [12] (рис 2.). Эффективность применения указанного комплекса у обследованных нами детей составила в среднем 84%, при этом отличные результаты были получены в 38%, хорошие – в 46%, удовлетворительные – в 14% наблюдений, отсутствие эффекта – в 4,0% случаев. Длительность ремиссии АД увеличилась в 1,8 раза.
Кроме того, Атодерм–мусс и Атодерм–крем обладают выраженными релипидирующими свойствами, увлажняющим и противовоспалительным эффектами, повышают барьерную функцию кожи, что позволяет разорвать порочный круг: сухость Ґ зуд кожи Ґ снижение барьерной функции Ґ воспаление. Полученные нами данные позволяют рекомендовать использование мусса и крема Атодерм для ежедневного ухода за кожей особенно при ее выраженной сухости у детей с АД.
Таким образом, патогенетическая терапия АД и адекватное использование местного лечения с применением современных дерматологических технологий обеспечивают стойкую ремиссию заболевания, предупреждают его рецидивирование и значительно улучшают качество жизни больных атопическим дерматитом.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

