Можно ли потерять ребенка из-за герпеса
Обновлено: 29.04.2024
Санталова Г.В., Гасилина Е.С., Валеева Г.Р., Шарыпова М.А., Ефимова И.Л., Плахотникова С.В., Сошникова Л.Н.
ГБОУ ВПО «Самарский государственный медицинский университет Министерства здравоохранения и социального развития России», г. Самара
В последнее время вследствие высокой инфицированности населения вирусными инфекциями растет интерес к их возбудителям, в частности к вирусам семейства Herpes, под влиянием которых часто происходят внутриутробное инфицирование плода и повреждение плаценты. При хронических и рецидивирующих инфекциях частота внутриутробного инфицирования невелика, однако фетоплацентарная недостаточность и потери плода встречаются примерно с той же частотой, что и при острых формах. Исследования последних лет позволяют говорить о значимости внутриутробной инфекции в патогенезе патологических состояний, формирующихся в последующие годы жизни. Крайне важной остается проблема ранней диагностики внутриутробной инфекции и исхода её развития. В связи с этим не вызывает сомнения необходимость разработки комплексного подхода к решению вопроса о прогнозировании инфекции у новорожденного путем своевременной диагностики и проведения соответствующих лечебно–профилактических мероприятий с целью предупреждения формирования тяжелой соматической патологии и инвалидизации у детей.
Целью исследования явилось изучение состояния новорожденных детей, родившихся от герпес-инфицированных матерей.
Обследовано 216 новорожденных. Проведен анализ состояния здоровья детей; оценивалось состояние фетоплацентарной системы беременных. Новорожденные дети были распределены на 3 группы: в 1-ю вошли 73 ребенка от матерей с фетоплацентарной недостаточностью (ФПН) и латентным течением герпетической инфекции; 2-ю составили 68 детей от матерей с латентной герпетической инфекцией без признаков ФПН, 3-ю – 75 новорожденных от матерей, не имевших в анамнезе герпеса и с отрицательными результатами обследования на герпетическую инфекцию (ГИ).
У матерей с герпетической инфекцией недоношенными родились 28 (13,0%) детей, у неинфицированных – 8 (3,7%). Гестационный возраст во всех группах колебался от 29 до 42 недель; масса тела при рождении – от 1850 до 4300 граммов. Среди родившихся выявлено значительное число детей с синдромом внутриутробной задержки развития плода (ВЗРП): 44 (20,4%) – из I группы (чаще встречались дети с ВЗРП II и III степеней) и 10 (4,6%) – из III (преобладали дети с ВЗРП I степени). У большинства новорожденных были диагностированы перинатальное поражение ЦНС, синдром пролонгированной желтухи, синдром дыхательных расстройств, гипотрофия, анемия, дисбиоз кишечника, аномалии и пороки развития. У детей I и II групп эти изменения встречались чаще. Следует отметить, что такая патология, как кисты сосудистых сплетений головного мозга, кальцинаты вещества головного мозга, герпетическая экзема, врожденный хориоретинит, герпетический гепатит, нефрит, встречалась только у детей с подтвержденной на 2-8 день жизни герпетической инфекцией. Из I группы таких случаев было 44 (20,4%), из II – 9 (4,2%).
Таким образом, оценивая состояние здоровья новорожденных детей, родившихся от герпес-инфицированных матерей, важно учитывать состояние фетоплацентарного комплекса.
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Доказано, что повреждение нейрональных структур начинается перед появлением кожной сыпи. При этом VZV по ходу чувствительных нервных волокон проникает в кожу, «ускользая» от факторов врожденного и приобретенного иммунитета, что в конечном итоге обусловливает возникновение односторонней везикулярной кожной сыпи, характерной для опоясывающего лишая.
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Л.А.МАРЧЕНКО, доктор медицинских наук, ведущий научный сотрудник отделения гинекологической эндокринологии. Герпетическая инфекция нередко является причиной гибели зародыша. Ее последствия могут привести к возникновению у плода пороков развития.
Вагинальные инфекции относятся к разряду наиболее часто встречающихся заболеваний нижнего отдела полового тракта. Патологические выделения из влагалища являются симптомом более 20 заболеваний, поэтому первоначально правильно установленный этиологический диагноз во многом не только определяет успех лечения, но и является гарантом отсроченных осложнений.
В последние годы наряду с общеизвестными микроорганизмами, вызывающими специфические и неспецифические инфекционные заболевания половых путей, все чаще диагностируются поражения, обусловленные вирусной инвазией гениталий, среди которых, несомненно, важная роль принадлежит вирусу простого герпеса (ВПГ).
Различают два типа ВПГ. Большинство вирусов составляет 2-ю, антигенную группу - ВПГ-2, которые преимущественно вызывают генитальную патологию, ВПМ вызывают экстрагенитальные поражения.
Пути передачи. Эпидемиология
Генитальный герпес (ГГ) относится к заболеваниям, передающимся половым путем (ЗППП).
Заражение может происходить в случае, когда у партнера, являющегося источником инфекции, на половых органах имеются типичные герпетические высыпания (рецидив заболевания) или, что особенно важно, когда он выделяет вирус, не имея при этом клинических симптомов заболевания (атипичная форма, или бессимптомное вирусоносительство).
Инфицирование возможно также при орогенитальных контактах. Бытовой путь переноса инфекции встречается крайне редко и полностью исключается, если секрет, содержащий вирус, высыхает.
Генитальный герпес может вызываться вирусом и 1-го и 2-го типа.
Известно, что степень распространенности ВПГ-2 инфекции зависит от пола обследуемых, числа их сексуальных партнеров, возраста, низкого образовательного уровня и этнической принадлежности. Исследования в 10 развитых странах показали, что серопозитивными на ВПГ-2 являются 107 млн. человек, при этом частота инфицирования в США составляет от 22 до 33%, в Европе - от 7 до 24%, в странах Индокитая - до 6%. Ситуация с инфицированием ГГ в России остается во многом крайне неясной, так как, хотя ГГ и отнесен в группу ЗППП, учет заболеваемости ведется плохо. Согласно проведенным в 1994 г. эпидемиологическим исследованиям на примере закрытой популяции в Москве, частота инфицирования генитальным герпесом составляет 19,7%. Выявлено два ее возрастных пика - 16-24 года и 35-40 лет. Женщины в 1,7 раза чаще инфицируются ВПГ-2, чем мужчины, подобных половых различий в инфицировании экстрагенитальным герпесом не выявлено.
Многие исследователи считают, что истинная ситуация в мире в отношении роста заболеваемости ГГ в достаточной мере не контролируется в связи со значительным процентом его асимптомных форм. Частота последних составляет 40-74%.
Нередко психосоциальные последствия ГГ бывают более выраженными и значимыми, чем физические страдания, связанные с частыми обострениями заболевания. ГГ, безусловно, влияет на качество жизни пациентов, т.к. уже с момента обращения к врачу перед ними возникает ряд психологических и медицинских проблем, среди которых ведущая роль принадлежит следующим: страх обнаружения вируса, депрессия; влияние на сексуальную и интимную жизнь; снижение социальной активности и изменение образа жизни; отношение к ГГ, как к болезни, передающейся половым путем; страх заразиться или быть зараженным; страх быть отвергнутым обществом; боязнь быть неизлеченным и т.д.
Клиника. Диагностические критерии
По особенностям клинических проявлений инфекции ГГ разделяют на типичный и атипичный.
Инкубационный период в среднем составляет 3-9 дней, в течение которых экспрессия вируса минимальна.
Острый период заболевания при типичной форме инфекции характеризуется обширными эрозивно-язвенными высыпаниями на слизистой больших и малых половых губ, промежности, влагалища, шейки матки. Ему всегда предшествует продромальный период, сопровождающийся субъективными ощущениями в виде боли, зуда, жжения, парестезий в области гениталий, а также общей симптоматикой - недомогание, озноб, лихорадка и т.д. При этом в 13-35% случаев наблюдается асептический менингит с тошнотой, рвотой, онемением затылка, головной болью. Все эти симптомы самостоятельно проходят с появлением высыпаний, в 10-15% отмечается фарингостоматит.
Довольно часто при первичном эпизоде заболевания отмечается поражение мочевой системы, проявляющееся от незначительной дизурии до стойкой задержки мочеиспускания, обусловленной отеком и резкой болезненностью в области уретры в результате обширных герпетических язв или вовлечения в воспалительный процесс слизистой оболочки мочевого пузыря и уретры.
Для ГГ характерна фиксированность очагов высыпания. В зависимости от локализации последних выделяют следующие стадии поражения:
I - наружные гениталии;
II - влагалище и шейка матки;
III - матка и область придатков.
Однако подобная стадийность весьма условна. После первичного эпизода заболевания под влиянием провоцирующих факторов периодически возникают рецидивы инфекции.
Анализ провоцирующих факторов показал, что наиболее часто обострение возникает на фоне стресса (78%); переутомления (56%); менструации (50%), перенесенной простуды (24%), в то время как ультрафиолетовое облучение, физические нагрузки и употребление алкоголя встречаются, соответственно, в 12, 10 и 6% случаев.
При ГГ рецидивы возникают в 50-75% случаев, что значительно выше показателей обострения при экстрагенитальной инфекции. Это объясняется особенностями антигенной структуры вируса 2-го типа.
Частота рецидивов у многих пациентов с годами снижается. Однако довольно часто после длительной ремиссии возникает период учащения рецидивов.
В зависимости от частоты обострений выделяют три степени тяжести ГГ:
тяжелое течение - ремиссии от нескольких дней до 6 недель;
средней тяжести - ремиссии от 2 до 3 месяцев;
легкое - ремиссии не менее 4 месяцев.
Клиническая картина рецидивов хронической генитальной герпетической инфекции разнообразна. В 50-85% случаев ей сопутствует продромальный период в виде чувства жжения, зуда, болезненности в очаге поражения. В 25% случаев выявляется болевой синдром - боль иррадиирует в ногу, пах, ягодицу. В 10% случаев появляются лимфаденит, общее недомогание, озноб.
В 70% случаев во время рецидива визуализируются микроскопические везикулезно-язвенные очаги, при рецидиве не обнаруживаются какие-либо патологические изменения, и обострение бывает трудно диагностировать без дополнительных лабораторных методов исследования. Рецидив протекает, как правило, легко, продолжительность высыпаний не превышает 3-5 дней, после чего слизистые или кожные покровы полностью эпителизируются.
Диссеминация ГГ наблюдается крайне редко, только в случаях тяжелой сопутствующей инфекции либо у больных с выраженным наследственным или приобретенным иммунодефицитом.
Диагностическим критерием наличия ГГ во многом являются местные проявления заболевания. Однако при атипичных формах отсутствует манифестный признак инфекции - сгруппированные везикулы, наполненные серозной жидкостью, трансформирующиеся в эрозии и язвы, что в значительной степени затрудняет постановку диагноза. Отдует особо подчеркнуть, часто подобный тип течения ГГ характерен в значительном проценте случаев с самого начала заболевания, поэтому первичный эпизод инфекции ретроспективно выявить бывает крайне трудно.
В настоящее время в 40-75% случаев ГГ протекает атипично - без появления характерных герпетических высыпаний, включая первичный эпизод заболевания.
На основании многолетних наблюдений и соотношения жалоб с данными вирусологических исследований нами были разработаны клинические критерии, позволяющие в большинстве случаев подтвердить герпетическую природу заболевания при атипичных формах инфекции. Ведущими среди них являются стойкий зуд и жжение вульвы и влагалища; кольпиты, не поддающиеся традиционной антибактериальной терапии; рецидивирующие эрозии и лейкоплакии шейки матки; привычное невынашивание беременности; стойкий вегетативный тазовый ганглионеврит (см. рис.).
СЕМИОТИКА АТИПИЧНОЙ ФОРМЫ ГЕНИТАЛЬНОГО ГЕРПЕСА
Значение этих критериев чрезвычайно важно для выявления групп инфицированных. Необходимо информирование больных о часто встречающихся атипичных симптомах заболевания в связи с возможностью бессимптомной передачи инфекции. Согласно данным отдельных исследователей, только 20% инфицированных ВПГ имеют диагностированный симптоматический герпес, 60% - нераспознанный симптоматический ГГ (атипичную форму) и 20% - бессимптомный герпес.
К четвертому, относительно редко встречающемуся варианту течения инфекции относят бессимптомный герпес, или вирусоносительство, при котором нет никаких клинических проявлений инфекции, однако в образцах слизи из цервикального канала или в мазках-отпечатках с половых органов выявляется вирус герпеса.
Знание этих вариантов течения инфекции важно для разработки тактики ведения беременных, страдающих ГГ.
Существует три основных механизма инфицирования плода ВПГ-2:
- вирусы из влагалища и шейки матки могут проникать к плодному яйцу восходящим путем или эмбрион может быть инфицирован во время имплантации инфицированной спермой;
- трансплацентарный переход вирусов к плоду при наличии их в крови беременных;
- заражение плода при прохождении через инфицированные родовые пути.
Последствиями герпетической инфекции являются гибель зародыша, пороки развития (микроцефалия, хориоретинит, дисплазия сетчатки, микрофтальмия, помутнение хрусталика, пороки сердца, гепатоспленомегалия, поражение отдельных органов и систем).
При ведении пациенток с генитальным герпесом врачу необходимо ставить перед собой следующие цели:
- купирование симптомов;
- проведение профилактики последствии инфекции и ее передачи половому партнеру и новорожденному.
Риск внутриутробного заражения плода ВПГ определяется совокупностью факторов - вариантом клинического течения ГГ (первичный эпизод заболевания или рецидив), особенностями клинической картины (типичное, атипичное или бессимптомное течение инфекции), продолжительностью контакта плода с инфицированными родовыми путями матери и стадией герпетических высыпаний.
При совпадении первичного эпизода заболевания ГГ с I или III триместром беременности в 40-50% случаев наблюдается либо мертворождение, либо рождение ребенка с врожденным поражением мозга (микроцефалия и другие аномалии). Поэтому, согласно рекомендациям ВОЗ, при первичном эпизоде заболевания, особенно в случае первичной инфекции в I триместре, целесообразно беременность прервать.
При рецидивирующем герпесе риск инфицирования плода составляет всего О-8%, что объясняется пассивной передачей материнских антител, более низкими титрами вируса и более коротким периодом его воздействия. В этих случаях беременность следует сохранить.
Наибольшую значимость в плане возможного инфицирования плода имеют атипично протекающие формы хронической ге-нитальной герпетической инфекции. В 70% случаев дети с неонатальным герпесом рождаются именно от матерей с атипичными или бессимптомными формами ГГ, при том, что частота бессимптомного носительства ВПГ-2 составляет в различных популяциях 0,5-8%. Смертность новорожденных от неонатального герпеса в этой группе составляет 50-70%; из выживших новорожденных здоровыми остаются только 15%.
Таким образом, становятся понятны социальная значимость для нашей страны проблемы генитальной герпетической инфекции и ее неблагоприятный вклад в заболеваемость и перинатальные потери.
Для установления нормального контакта между врачом и пациентом необходимо:
- неосуждение со стороны врача;
- вовлечение пациента в управление своей болезнью;
- возможность больного получить лучшее из доступного на текущий момент лечение.
Принципы современной терапии
К базисному виду терапии относится прежде всего комплекс противовирусного лечения - длительная блокада репродукции вируса современными химиопрепаратами, на фоне которых следует проводить стимуляцию неспецифической и специфической резистентности организма. Необходимо подчеркнуть, что лечение всегда целесообразно подбирать индивидуально и в каждом конкретном случае выбор медикаментозного комплекса определяется клинической формой инфекции, фазой заболевания (рецидив или ремиссия), иммунологическим состоянием пациента, предшествующим лечением и его эффективностью, наличием сопутствующих заболеваний (особое внимание необходимо уделять аллергоанамнезу).
Идеальный противовирусный препарат должен обладать селективным и специфическим механизмом действия, не быть токсичным (мутагенным, тератогенным, канцерогенным), не иметь побочных эффектов, не вызывать резистентность. Препарат должен характеризоваться хорошей биодоступностью, не взаимодействовать с другими лекарствами и иметь удобный режим дозирования.
Наиболее безопасным вариантом химиотерапии оказалось создание синтетических аналогов какого-либо структурного компонента (нуклеозид) герпес-вирусной ДНК, который избирательно фосфорилируется не клеткой, а вирусспецифическим ферментом - тимидинкиназой.
К наиболее широко используемым в мировой клинической практике аномальным нуклеозидам относятся ацикловир (зовиракс, виролекс), валацикловир (валтрекс), фамцикловир (пенцикловир), ганцикловир и т.д. К аналогам пирофосфата относится триаптен. К препаратам с другим механизмом действия (специфические ингибиторы) - бонафтон, алпизарин, флакозид, хелипин, флореналь.
Чаще всего для лечения генитального герпеса используют ацикловир (АЦ), обладающий высокой степенью сродства и селективности в отношении герпес-вирусов.
Ацикловир проникает преимущественно в зараженные ВПГ клетки, однако в неизмененном виде инертен и малотоксичен, прежде чем стать активным, он должен фосфорилироваться.
Существует две методики лечения рецидивирующей герпетической инфекции АЦ: эпизодическое лечение каждого обострения и продолжительная супрессивная терапия с целью предотвращения рецидивов. Выбор режима терапии определяется клиническим вариантом инфекции (первичный эпизод или рецидив) и степенью ее тяжести, а также проблемой передачи инфекции в случае, если один из партнеров серонегативен, и при планировании беременности.
В последние годы в России в качестве химиопрепарата широко использовался алпизарин. Проведенное сравнительное исследование лечебного и профилактического эффекта алпизарина и зовиракса при тяжелом течении ГГ показало, что прием зовиракса в режиме супрессивной терапии по 800 мг в сутки способствовал стойкой ремиссии у 73% больных, в то время как прием алпизарина вызывал подобный эффект только в 19% случаев. Профилактический эффект зовиракса более чем в 5 раз превосходит эффект алпизарина по восстановлению качества жизни больных.
Однако биодоступность перорально вводимого ацикловира составляет всего 15-21 %, поэтому в течение последних 10 лет с целью повышения его эффективности разрабатывались различные аминокислотные эфиры ацикловира.
Всего было синтезировано более 18 аминокислотных эфиров. Валацикловир (L-валиловый эфир) показал биодоступность, равную 63%. В отличие от ацикловира валацикловир (валтреке) под влиянием фермента валацикловиргидролазы хорошо всасывается в кишечнике и быстро метаболизируется в печени, полностью превращаясь в ацикловир. Фармакокинетика и токсические свойства валацикловира идентичны таковым для ацикловира.
В клинической практике (особенно при лечении привычного невынашивания беременности) нередко возникает необходимость одновременно проводить профилактику как генитального герпеса, так и ЦМВ-инфекции. Использование в этих случаях валтрекса в значительной степени облегчает задачу врача, так как наиболее специфичный для ЦМВ-инфекции химиопрепарат ганцикловир оказывает выраженный гепатотоксический эффект и вызывает гипоплазию костного мозга.
Более высокие концентрации ацикловира в плазме как конечного продукта введения валацикловира позволяют также использовать его в случаях инфицирования больных резистентными штаммами герпес-вируса. Поддержание высоких уровней ацикловира в плазме при лечении валацикловиром позволяет уменьшить кратность приема препарата и способствует лучшему его усвоению.
В режиме эпизодической терапии валтрекс следует назначать по 500 мг 2 раза в день в течение 5 дней. Для профилактики рецидивов инфекции - по 100 мг один раз в сутки в течение 4-6 месяцев. За безопасностью применения ацикловира и его аналогов наблюдают с 1982 года. Подобная программа принята и для валацикловира. Наиболее частыми побочными эффектами являются головная боль, тошнота, диарея. Однако они не выражены.
Высокой биодоступностью (77%) обладает и фамцикловир (диацетил-6 - дезоксипроизводное пенцикловира). Пенцикловир имеет сходный, но не аналогичный ацикловиру спектр действия, включающий вирус ветряной оспы, ВПГ-1, ВПГ-2, а также вирус гепатита В. Фамцикловир превращается в пенцикловир при всасывании и пассаже через печень, последний активируется вирусной тимидинкиназой. Фамцикловир хорошо переносится, однако в дозе в 50 мг раз выше, чем терапевтическая повышает риск развития аденокарциномы груди у мышей.
Однако ни ацикловир, ни другие противовирусные агенты - фамцикловир, валацикловир - не предотвращают ни перехода вируса в латентное состояние, ни возникновения рецидивов после их отмены, ни передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции в плане полного излечения. Поэтому на протяжении последних 20 лет ученые изыскивают методы непосредственного воздействия на иммунную систему больных ГГ с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса. Одним из перспективных подходов профилактики и лечения герпес-вирусных заболеваний являются применение препаратов иммуноглобулинов человека и вакцинотерапия.
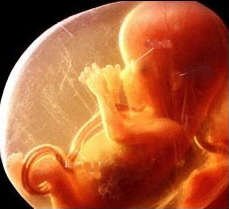
Вирусные инфекции приобретают особую актуальность в период беременности, так как могут влиять на здоровье не только будущей мамы, но и плода. Герпес среди них занимает одно из главных мест, поскольку это заболевание очень часто встречается у беременных женщин.
Герпетическая инфекция - это большая группа инфекционных заболеваний, вызываемых вирусами герпеса человека. Это одно из наиболее распространенных заболеваний человека. По данным многочисленных исследований, к 18 годам более 90% населения планеты инфицируются одним или несколькими штаммами вирусов герпеса. Среди инфекций, передающихся половым путем, генитальный герпес занимает второе место после трихомониаза.
Особенностью герпеса является его рецидивирующее течение. Находящийся в спящем состоянии вирус пробуждается при снижении иммунитета, а беременность сама по себе обладает свойством ослабления иммунных сил организма, так как организм женщины вынашивает наполовину чужеродный с иммунологической точки зрения плод, что невозможно без снижения интенсивности работы ряда звеньев иммунитета. Именно поэтому обострения герпеса во время беременности происходят довольно часто.
Многие беременные, обнаружив у себя пузырьковые высыпания, впадают в панику, тревожась о том, не повредит ли инфекция малышу. Чаще всего о наличии герпеса женщины знают еще до наступления беременности, и появление зудящих пузырьков, наполненных прозрачной жидкостью, говорит о «возрождении» заболевания. Но, к счастью, опасное влияние герпеса несколько преувеличено, и существует не так много ситуаций, когда герпес может стать причиной проблем при беременности.
Проявления заболевания
Клинические проявления герпеса зависят от многих факторов - типа вируса, локализации поражения, возраста и иммунного статуса человека. Классическая симптоматика - это появление группы мелких пузырьков, наполненных прозрачной жидкостью. Для герпеса характерно появление пузырьков при очередном рецидиве всегда в одном и том же месте.
При локализации в верхней половине туловища высыпания возникают преимущественно на губах (так называемая «простуда»), а также на слизистой носа, рта, конъюнктиве глаз, в области слухового прохода и на веках.
При генитальном варианте герпеса высыпания локализуются на половых губах, на коже промежности, внутренней поверхности бедер, лобке или вокруг заднего прохода.
За нес¬колько дней до появления сыпи может быть ощущение зуда и дискомфорта в месте будущих высыпаний (герпетический «звоночек»).
Сыпь сопровождается неприятными ощущениями, зудом, жжением, болью. Затем пузырьки лопаются, на их месте образуются сначала язвочки, затем корочки. Герпетические язвочки характерно болезненны, а образующиеся на их месте корочки исчезают бесследно через 2—3 дня, не оставляя на коже ни пигментации, ни рубцов.
Общая симптоматика заболевания весьма разнообразна: повышение температуры тела, увеличение лимфатических узлов (чаще – паховых), суставная и мышечная боли, упорные мигрени, раздражительность, отсутствие аппетита и т.д.
Типичная клиническая картина проявляется не более чем в трети случаях носительства генитального герпеса. Нередко генитальный герпес протекает бессимптомно или без характерных высыпаний.
Атипичное течение герпеса более коварно: отсутствие пузырьковых высыпаний с лихвой компенсируется многообразием общих проявлений, что часто создает трудности в постановке верного диагноза. Симптомы атипичного герпеса - жжение, трещины промежности, поло¬вых губ или заднего прохода, отек, покраснение слизистых оболочек. В таких случаях часто диагноз ставится неверно либо женщины, уверенные в наличии кандидоза (молочницы) или бактериального вагиноза, безрезультатно занимаются самолечением.
Тяжесть любых проявлений герпетической инфекции определяется состоянием иммунитета.
Разновидности вируса
Наиболее распространенными являются ВПГ 1 и 2 - вирус простого герпеса первого и второго типов. ВПГ 1 чаще всего проявляется в виде пузырьковых высыпаний на губах, возможны поражения глаз, ротовой полости, носа. Классическая локализация ВПГ 2 (генитального герпеса) - слизистая оболочка мочеполового тракта. В некоторых случаях наблюдается следующий феномен перекрестного инфицирования: виновником герпетических высыпаний верхней половины туловища является ВПГ 2 (генитальный) и наоборот - ВПГ 1 вызывает развитие инфекции нижней половины. Как правило, это связано с двумя причинами: нарушением элементарных правил гигиены, когда происходит самозаражение - перенос вируса через кожу и слизистые оболочки, и орально-генитальными контактами.
Заражение герпесом половых путей происходит в основном только через незащищенный половой контакт. В редких случаях возможна передача инфекции через поцелуй, использование общей посуды и белья. Это так называемый горизонтальный путь передачи. При вертикальном пути передачи происходит передача вируса от матери плоду во время беременности (при прохождении ребенка через родовые пути при условии наличия в слизистой вируса герпеса, то есть при родах в момент обострения герпес-вирусной инфекции). При локализации очагов на губах можно заразиться через общую посуду, полотенца и поцелуи. Надо отметить, что риск внутриутробного инфицирования плода при первичном герпесе составляет 50%, при рецидиве – не более 4%, во время родов при наличии высыпаний на шейке матки и наружных половых органов – 90%.
Как действует вирус?
Рассмотрим некоторые особенности взаимодействия вируса с организмом человека.
- Попадая в клетку, вирус герпеса (впрочем, как и любой другой вирус) проникает в ее ядро и заставляет клетку человека производить вирусы герпеса. Таким образом, клетка человека «собственноручно» производит новые поколения вирусов.
- Вирус простого герпеса (ВПГ) распространяется по организму по нервным волокнам. Для проведения периода простоя (ремиссии), когда человек никак не ощущает наличия вируса в организме, вирус выбирает нервные сплетения - ганглии. И проводит там время в ожидании снижения иммунитета хозяина. В этот период носительство герпеса никак не проявляется и обнаружить его практически невозможно. ВПГ первого типа депонирует в тройничном ганглии (это особое сплетение нервных волокон, находящееся в полости черепа), а ВПГ второго типа - в крестцовых ганглиях (нервных сплетениях органов малого таза).
При наступлении благоприятных для вируса условий (переохлаждение, стресс, беременность) происходит его выход и дальнейшее распространение по коже и слизистым оболочкам. - Под влиянием различных факторов, повреждающих иммунную систему, возможно ослабление контролирующих механизмов «хозяина» (организма человека) и переход к активному размножению вируса – так развивается рецидив, что проявляется обострением герпеса.
Обострения герпеса могут быть связаны с двумя факторами:
- уже имеющимся иммунодефицитом, что является пусковым механизмом для рецидива герпетической инфекции;
- влиянием вируса на сам иммунитет. Длительное нахождение герпеса в организме обладает прямым повреждающим действием на клетки иммунной системы. Таким образом, развивается порочный круг: ослабленный иммунитет запускает рецидив герпетической инфекции, а вирус герпеса еще более усугубляет имеющийся иммунодефицит.
Диагностика
Диагностика герпеса при типичной картине не представляет сложности для врача (да и для пациента тоже). Клинические проявления герпетической инфекции весьма яркие: характерные пузырьковые высыпания, рецидивирующее течение говорят сами за себя.
В случаях атипичного герпеса, вирусоносительства и при профилактическом обследовании методы лабораторной диагностики приобретают особое значение.
Основные направления лабораторных методов исследований:
- Определение непосредственно самих вирусных частиц. Для этого используются методы электронной микроскопии с использованием специальных методов окрашивания мазков, ИФА (иммуноферментный ана¬лиз) и ПЦР. Последний метод (полимеразная цепная реакция) широко распространен и дает достаточно точные результаты - он доступен, высокочувствителен, специфичен. Как правило, материал для анализа ПЦР берут путем соскоба (мазка) с шейки матки, влагалища, уретры, также исследуют соскоб со дна ранки или содержимое пузырька. При подозрении на скрытое течение инфекции исследуют еще мочу и слюну.
- Исследование крови на антитела к вирусу простого герпеса, при котором выявляется иммуноглобулины классов М и G. Если заражение человека произошло впервые (первичное инфицирование) или в момент диагностики соответствует острой фазе заболевания (рецидив), то в крови обнаруживают ранние антитела класса М.
Определение поздних иммуноглобулинов класса G свидетельствует о том, что встреча организма с вирусом уже произошла много ранее.
Особое внимание уделяется лабораторной диагностике в случае впервые выявленных симптомов герпеса при беременности. Такая ситуация может отвечать как первичному эпизоду, так и первому рецидиву (т.е. ранее организм уже встречался с вирусом, но проявлений не давал).
Если в крови есть IgG (поздние иммуноглобулины), значит, герпес рецидивирующий и угрозы для плода или эмбриона практически нет. Если в крови нет Ig, а есть IgМ, то необходимо проявить крайнюю степень настороженности, поскольку это является лабораторным подтверждением первичного эпизода.
Генитальный герпес и беременность
Особую же актуальность в период беременности приобретает именно генитальный герпес.
Во время беременности происходит мощная перестройка всех систем, в том числе и иммунитета. Беременность сама по себе является физиологическим иммуносупрессивным фактором, т.е. происходит закономерное снижение защитных свойств организма с целью предотвращения выкидыша. Обратной стороной такого иммунологического отступления является манифестация ранее «дремлющих» инфекций, в том числе генитального герпеса.
Очевидно, что при возникновении проблемы герпеса у будущей мамы появляется масса волнений. К счастью, в большинстве случаев эти тревоги безосновательны.
Когда же действительно есть повод для волнений? Наибольшую опасность представляет ситуация, когда заражение герпесом происходит у женщины во время беременности - первичный эпизод генитального герпеса. Такая ситуация характеризуется выраженными проявлениями, т.к. в организме матери нет защищающих от герпеса антител. Для плода риск особенно высок при заражении генитальным герпесом в первом и третьих триместрах. Инфицирование плода в первом триместре беременности приводит к возникновению гидроцефалии (накоплению жидкости в головном мозге), пороков сердца, аномалий развития желудочно-кишечного тракта и др. Такие случаи чрезвычайно редки, так как при первичном эпизоде герпеса, как правило, происходит самопроизвольное прерывание беременности до срока 10 недель.
Лечение герпеса во время беременности
При доказанном первичном инфицировании на ранних сроках беременности обсуждается вопрос о ее прерывании.
Лечение рецидивов герпеса во время беременности и вне ее не имеет принципиальных различий. В любом случае преследуются одинаковые цели: снижение выраженности симптомов (боль, зуд, лихорадка и т.д.), сокращение сроков заживления ран, предотвращение новых обострений. Следует помнить, что чем скорее начато лечение, тем больший эффект оно будет иметь. Если лечение начато в продромальный период (когда появляются начальные признаки заболевания – покалывание или легкий зуд на месте будущих пузырьков, озноб, недомогание), то это достоверно поможет снизить выраженность проявлений герпеса.
Особенностью лечения герпетической инфекции является точное соблюдение назначенной дозы и режима приема препаратов. Если пропущена очередная доза противовирусного препарата, то вирус герпеса может успеть в этот период размножиться, что приведет к неэффективности лечения.
Единственными препаратами, обладающими доказанной эффективностью в лечении герпетической инфекции, являются специфические виростатики – аналоги нуклеозидов (АЦИКЛОВИР, ВАЛАЦИКЛОВИР, ПЕНЦИКЛОВИР, ФАМЦИКЛОВИР).
Лечение герпетической инфекции при беременности подразумевает использование разрешенных противовирусных препаратов (ацикловир ЗОВИРАКС и валацикловир ВАЛТРЕКС) в виде мазей, кремов и таблеток.
Одновременно с противовирусными препаратами в комплексном лечении используют иммуномодуляторы (ВИФЕРОН), витамины, физиотерапевтические методы, местные антисептики для более быстрого заживления ранок.
Безусловно, целесообразность и курс лечения определяются в каждом индивидуальном случае. Ситуация сочетание беременности и герпеса должна находится под бдительным контролем врача и самолечение в этих случаях просто недопустимо.
Герпес новорожденных
В каких же случаях коварный вирус все-таки достигает своей цели и вызывает заболевание у новорожденных? В подавляющем большинстве случаев (90%) заражение происходит контактным путем при прохождении через родовые пути. Внутриутробное заражение новорожденного отмечается только в 5% случаев герпеса новорожденных. Причем важным условием является наличие у мамы именно первичного эпизода гениального герпеса, в случаях бессимптомного носительства или рецидивирующего герпеса инфицирование плода в родах случается не чаще, чем в 4% случаев.
Симптомы и признаки герпеса у младенцев появляются уже на 2-й неделе после рождения. Для герпеса новорожденного характерно наличие пузырьков на коже, слизистых оболочках (полости рта, половых органов) и конъюнктиве глаз. Чем более недоношенными рождаются дети, тем более сложнее протекает инфекция; в таких случаях часто встречается поражение головного мозга (герпетический энцефалит).
Профилактика
Специфических методов профилактики герпеса, к сожалению, не существует. Профилактика инфекции на этапе планирования, при беременности и после родов носит исключительно предупредительный характер. Применяются следующие меры:
Читайте также:

