Метод родоразрешения при герпесе
Обновлено: 01.05.2024
Для цитирования: Тютюнник В.Л., Зайдиева З.С., Алиева С.А. Подготовка и планирование беременности при герпетической инфекции. РМЖ. 2005;1:28.
В настоящее время во многих странах мира, в том числе и в России, отмечен рост инфекций, передаваемых половым путем, которые прочно занимают ведущее место в структуре акушерско–гинекологической заболеваемости. Чаще всего половая инфекция бывает обусловлена несколькими патогенными факторами – вирусами, микробами, грибами, простейшими, которые вызывают похожие по клиническому течению, но различные по патогенезу и методам лечения заболевания.
Среди вирусных поражений урогенитального тракта женщин наиболее распространены герпетическая, цитомегало– и папилломавирусная инфекции, в связи с чем Европейским региональным бюро ВОЗ они внесены в группу болезней, которые определяют будущее инфекционной патологии.
В возникновении герпетических заболеваний половых органов основная роль принадлежит вирусу простого герпеса, единственным резервуаром которого являются зараженные им люди, которые распространяют его среди населения. Попав в организм человека, вирус простого герпеса сохраняется в нем на протяжении всей жизни, периодически вызывая заболевания различной степени тяжести.
Учитывая, что генитальный герпес относится к пожизненно персистирующим инфекциям, существует несколько видов клинических проявлений. Рецидивы заболевания наступают в результате периодически возникающего иммунодефицита у практически здоровых людей под влиянием провоцирующих факторов. Рецидивирующий характер генитальный герпес приобретает у трети инфицированных людей. Заражение вирусом простого герпеса возможно не только в острой стадии заболевания, но и в стадии глубокой ремиссии.
Генитальный герпес относится к заболеваниям, передаваемых половым путем (в 99,9% случаев). Аутоинокуляция может наблюдаться в тех случаях, когда больной сам переносит вирус из очага инфекции на незараженные части тела. Вертикальный путь передачи возможен в случае трансплацентарного инфицирования плода. Возбудителю этой инфекции отводится определенная роль в этиологии спонтанных абортов и преждевременных родов, а также в нарушении эмбриогенеза и врожденной патологии новорожденных и др., что считается результатом внутриутробной вирусной инфекции.
Знание принципов отбора пациентов, нуждающихся в углубленном обследовании с целью верификации диагноза генитального герпеса, позволяет в значительной мере повысить эффективность профилактических мероприятий, направленных на предупреждение осложненного течения беременности, а также внутриутробной инфекции.
Работы, посвященные вопросам подготовки к беременности женщин с хронической рецидивирующей герпетической инфекцией, крайне малочисленны и направлены, как правило, на коррекцию отдельных звеньев патологического состояния.
Исходя из вышеизложенного, важнейшим и неотъемлемым этапом является правильная предгравидарная подготовка этих женщин. Поэтому проведение мероприятий по борьбе с инфекцией необходимо начинать до наступления беременности.
Общеизвестно, что лечение герпетической инфекции должно быть своевременным, этиотропным и комплексным. При выявлении генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисных видов терапии (комплекс противовирусного лечения), так и лечение сопутствующих герпесу заболеваний.
Основными задачами противогерпетической терапии являются:
• уменьшение клинических проявлений инфекции;
• предупреждение рецидивов;
• предупреждение передачи инфекции половому партнеру или новорожденному.
Стратегия лечения больных с рецидивирующим герпесом определяется рядом факторов: частотой рецидивов и тяжестью клинических симптомов (на основании субъективной оценки больного), состоянием иммунной системы, психосоциальными особенностями, наличием риска передачи инфекции половому партнеру или новорожденному, а также экономическими аспектами терапии. В настоящее время существует два варианта терапии генитального герпеса с использованием аналогов нуклеазидов: эпизодическая и превентивная (супрессивная) терапия.
Накопленный нами опыт подготовки к беременности женщин с генитальным герпесом показывает, что одним из современных и самых эффективных противовирусных препаратов является Алпизарин – противовирусное средство, получаемое из травы копеечника. Препарат активен в отношении ДНК–содержащих вирусов (Herpes simplex I и II типа, Varicella zoster, в меньшей степени – цитомегаловируса и вируса иммунодефицита человека). Алпизарин ингибирует репродукцию вируса простого герпеса на ранних этапах его развития, подавляет бактериальную нуклеазу без выраженного ингибирующего действия на вирусную нейраминидазу, оказывает умеренное бактериостатическое действие в отношении грамположительных и грамотрицательных бактерий, простейших и микобактерий туберкулеза. Препарат обладает иммуностимулирующим действием в отношении клеточного и гуморального иммунитета, индуцирует продукцию g–интерферона в клетках крови.
Абсорбция Алпизарина – высокая, время наступления Cmax – 1–3 ч, препарат хорошо проникает в органы и ткани печени, почек, сердца, селезенки; через 12 ч обнаруживается в небольшом количестве в тканях мозга, выводится почками и через желудочно–кишечный тракт.
Показаниями к применению препарата являются: инфекции кожи и слизистых оболочек, вызванные вирусами Herpes simplex и Varicella zoster.
Алпизарин назначают внутрь (независимо от приема пищи) по 0,1–0,2 г 3–4 раза в сутки в течение 5–10 дней. Одновременно назначают местные аппликации 5% мази на кожу и 2% мази – на слизистые оболочки. Мазь наносят на пораженные участки кожи без повязки 2–6 раз в сутки. Терапевтическое действие более выражено при его использовании в ранние сроки заболевания. Длительность лечения – 10–30 дней. При рецидиве курс повторяют. При острых и рецидивирующих формах простого герпеса экстрагенитальной локализации при единичных высыпаниях мазь наносят на очаг поражения 2–3 раза в день в течение 3–5 сут. В случае распространенных высыпаний, а также при наличии лихорадки, лимфаденопатии назначают одновременно внутрь и в виде мази в течение 5–14 дней. При генитальном герпесе 2% мазь наносят на пораженные участки 4–6 раз в день в течение 7–10 сут, при рецидивирующем течении заболевания – дополнительно внутрь в течение 5–14 сут. Для профилактики рецидивов простого герпеса назначают пероральный курс через 1 мес после окончания лечения и затем в межрецидивные периоды курсами по 10–14 дней.
Эпизодическая терапия подразумевает пероральный прием препаратов в момент обострения инфекции. Такой метод терапии показан больным с редкими, клинически невыраженными обострениями и при наличии четко определяемого продромального синдрома, во время которого следует начинать прием препаратов. Применение во время рецидива генитального герпеса Алпизарина по 0,2 г 4 раза в сутки в течение 5 дней значительно уменьшает болевые ощущения и дискомфорт в зоне поражения, сокращает время заживления герпетических высыпаний на 1–2 дня и период вирусовыделения.
Супрессивная терапия показана больным с редкими, но тяжелыми рецидивами, в дискордантных по генитальному герпесу парах с целью профилактики передачи инфекции, при наличии выраженных психосоциальных и психосексуальных реакций на рецидивы, а также при значительном влиянии инфекции на качество жизни больного. Препараты применяют ежедневно в непрерывном режиме в течение длительного времени. При проведении превентивной (супрессивной) терапии Алпизарин назначают по 0,2 г 4 раза в сутки.
Важным условием правильной подготовки к беременности является нормализация иммунного и интерферонового статуса больной. Поэтому на фоне блокады репликации вируса перспективным направлением профилактики и лечения герпетической инфекции является стимуляция неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.).
Так как наличие очагов хронической инфекции сопровождается нарушением процессов энергетики и метаболизма на клеточном, тканевом и органном уровнях, предгравидарная подготовка должна обязательно включать метаболическую терапию. С этой целью назначают комплекс препаратов, стимулирующих биоэнергетические процессы в клетках и тканях – метаболическую терапию, состоящую из 2–х комплексов лечения:
I комплекс (с 8–9–го дня по 13–14–й день менструального цикла):
1. Кокарбоксилаза по 0,1 г 1 раз внутримышечно или бенфотиамин по 0,01 г 3 раза в сут.
2. Рибофлавин мононуклеотид по 1–2 (0,005–0,01 г) табл. 3 раза в сут. или 1 мл внутримышечно 1 раз в сут.
3. Пантетонат кальция по 1 табл. 3 раза в сут. или 20% раствор 2 мл внутримышечно 1 раз в сут.
4. Липоевая кислота по 1 (0,025 г) табл. 3 раза в сут. или 0,5% раствор 4 мл внутримышечно 1 раз в сут.
5. a–токоферола ацетат по 1–2 (0,05–0,1 г) капсуле 3 раза в сут. или 1 мл внутримышечно.
II комплекс (с 15–го дня по 22–й день менструального цикла):
1. Рибоксин по 0,2 г 3 раза в сут.
2. Пиридоксин по 1 (0,02 г) табл. 3 раза в сут.
3. Фолиевая кислота по 1 (0,001 г) табл. 3 раза в сут.
4. Оротат калия по 1 (0,5 г) табл. 3 раза в сут.
5. a–токоферола ацетат по 1–2 (0,05–0,1 г) капсуле 3 раза в сут. или 1 мл внутримышечно.
Метаболическую терапию назначают в течение 3 месяцев подряд до наступления беременности.
Иммуно– и интерферонокорригирующую и антибактериальную терапию целесообразно проводить на фоне приема энзимопрепаратов. Основанием для применения системной энзимотерапии является ее иммуномодулирующий и противовоспалительный эффект, способность ограничивать проявления аутоиммунных процессов, нормализация микроциркуляции. Кроме того, применение ферментативного комплекса способствует более глубокому проникновению антибиотиков в очаг воспаления.
При проведении вышеизложенной терапии возможно одновременное или последовательное использование пассивной иммунизации специфическими противогерпетическими иммуноглобулинами в титре 1:320 или 1:640. Пациентам с острыми проявлениями генитального герпеса специфический противогерпетический иммуноглобулин назначали по 2 дозы с интервалом в 3–4 дня на курс 5 внутримышечных инъекций.
Для профилактики рецидивов герпетической инфекции может также применяться вакцинотерапия. В настоящее время все существующие вакцины подразделяются на живые, инактивированные (цельновирусные и субъединичные) и рекомбинантные. Теоретической предпосылкой для использования вакцинотерапии при генитальном герпесе явилось предположение о возможности усиления специфического противогерпетического иммунитета на фоне повторного введения вирусного антигена. Вакцина представляет собой выращенный на культуре клеток куриного эмбриона и инактивированный формалином вирус простого герпеса 1–го и 2–го антигенного типа. Важной методологической особенностью использования вакцины является ее применение с целью профилактики рецидивов заболевания только в периоде затухания острых его явлений, что позволяет получить стойкий противорецидивный эффект. Поэтому вакцину следует назначать сразу после курса химиопрепаратов и иммуноглобулинов.
Помимо лечения герпетической инфекции, показано проведение дополнительной терапии. Лечение скрыто протекающего хронического воспалительного процесса в эндометрии (вирусно–бактериальной этиологии) должно проводиться на фоне базисной терапии и быть этиотропным и патогенетически обоснованным. Учитывая превалирование анаэробно–аэробных ассоциаций, а также мико– уреаплазменной и хламидийной инфекций, показано использование антибиотиков широкого спектра действия.
Таким образом, планирование и подготовка к беременности возможны только при стойкой и длительной (более 6 месяцев) ремиссии герпетической инфекции, а также после устранения нарушений в репродуктивной системе с учетом основных факторов прерывания беременности. Проведение ранней диагностики, профилактики и лечения инфекционной патологии репродуктивной системы женщин до наступления беременности, предгравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, тяжелые формы неонатальной инфекции, перинатальную заболеваемость и смертность.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Для цитирования: Михайлова О.И., Карапетян Т.Э. Прегравидарная подготовка и профилактика рецидивов у женщин с герпетической инфекцией. РМЖ. Мать и дитя. 2014;22(19):1402.
Анализ медицинской литературы последних лет показывает неослабевающий интерес акушеров-гинекологов к проблеме вирусной инфекции вообще и герпетической инфекции в частности. По данным различных авторов, вирус простого герпеса (ВПГ) является одной из основных причин осложненного течения беременности, внутриутробной и перинатальной инфекции [2, 8, 13]. Несмотря на неоднозначное мнение различных исследователей относительно роли этого вируса в частоте перинатальных осложнений, бесспорным является тот факт, что в современных условиях ВПГ представляет весьма многогранную медико-социальную проблему [1, 3, 6].
По-прежнему у практикующих врачей часто возникают определенные сложности при ведении беременности и родов у женщин с герпетической инфекцией [4, 12]. Одним из решающих этапов в комплексе профилактических мероприятий у данного контингента пациенток является их адекватная прегравидарная подготовка с правильным подбором всех современных методов медикаментозной коррекции.
Возбудителем герпетических заболеваний половых органов является ВПГ – облигатный внутриклеточный паразит, принадлежащий к подсемейству α-вирусов в семействе герпес-вирусов. Идентифицировано два серотипа данного вируса: первый тип (ВПГ-1) поражает преимущественно кожу и слизистую оболочку губ, глаз, носа и др.; второй тип (ВПГ-2) является возбудителем генитального герпеса. Развитие последнего возможно также и при возникновении смешанной инфекции ВПГ первого и второго типов [2, 3, 23].
Единственным резервуаром ВПГ являются зараженные им люди, которые распространяют его среди населения. Генитальный герпес относится к заболеваниям, в 99,9% случаев передаваемых половым путем. Это так называемый горизонтальный путь передачи инфекции от носителей вируса к здоровым людям. Вертикальный путь передачи возможен в случае трансплацентарного инфицирования плода [3, 9].
По данным литературы, частота встречаемости генитального герпеса варьирует от 7 до 40%. Причиной большинства случаев генитального и, соответственно, неонатального герпеса является ВПГ-2 (70–80%), однако в 20–30% случаев эта инфекция может быть вызвана ВПГ-1 [2, 19].
Попав в организм человека, ВПГ сохраняется в нем на протяжении всей жизни, периодически вызывая рецидивы заболевания различной степени тяжести. Прослеживается определенная тенденция к фиксированности очагов высыпания, что объясняется поражением только нескольких ганглиев, которые иннервируют ограниченную зону кожи и слизистых. Первичное заражение сопровождается репликацией (размножением) вируса в месте инвазии с последующим его перемещением либо по нервному стволу, либо гематогенным путем. При гематогенном пути распространения инфекции вирусемия является обязательным этапом как первичного, так и рецидивирующего генитального герпеса. Установлено, что ВПГ оседает в виде элементарных телец в строме эритроцитов, он также обнаруживается в лейкоцитах, тромбоцитах и лимфоцитах [2, 7, 11]. Вирус герпеса может находиться и в лимфатической системе, в свободном состоянии или связанном с лимфоцитами, при определенных условиях размножается в Т- и В-лимфоцитах. При персистенции инфекции данный вирус может длительно находиться в коже, слизистых и половых секретах.
К особенностям герпетической инфекции следует относить:
• высокий уровень инфицированности населения;
• пожизненную персистенцию возбудителя в организме человека;
• системность процесса, а также полиморфизм клинических проявлений;
• трудности лабораторной диагностики атипичных и стертых форм заболевания;
• торпидность к имеющимся методам терапии (ни один из противогерпетических препаратов не приводит к полной элиминации вируса из организма, а только подавляет его репликацию).
При определении формы генитального герпеса выделяют первичную инфекцию или первичный эпизод инфекции и рецидивирующее ее течение. Первично инфицированными считаются пациентки с серонегативными результатами, которые ранее не сталкивались с ВПГ и не имеют к нему антител. Инкубационный период колеблется в широких пределах и составляет в среднем 3–9 дней, в течение которых экспрессия вируса минимальна. В 50–80% случаев появлению типичных повреждений предшествуют локальные продромальные симптомы в виде парестезии, зуда или боли, локального лимфаденита, невралгии в ягодичной, паховой, бедренной областях, дизурии, а также нарушения общего состояния пациенток. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением. Как правило, первичный эпизод заболевания характеризуется обширными высыпаниями, тяжелой общей симптоматикой и длительной экспрессией вируса [1, 3].
Рецидивирующий характер герпес приобретает приблизительно у трети инфицированных людей. Рецидивы наступают в результате периодически возникающего иммунодефицита под влиянием провоцирующих факторов (стресс, менструация, переохлаждение, употребление спиртных напитков, ультрафиолетовое облучение, переутомление и т. д.). На частоту рецидивов также влияет тип вируса и его локализация. Достоверно чаще рецидивы заболевания встречаются при инфицировании ВПГ-2 и поражении половых органов, что, по-видимому, связано с особенностями местного иммунитета [3, 11].
В настоящее время предложены две альтернативные гипотезы для объяснения персистирования вируса и возникновения рецидива заболевания: статическая и динамическая. Ряд авторов [3, 13] придерживаются статической теории, согласно которой вирус находится в клетках паравертебральных сенсорных ганглиев в интегрированном или свободном непродуктивном состоянии. Под влиянием «пускового» фактора вирус из ганглия центробежно мигрирует по аксону периферического нерва и активно репродуцируется в эпителиальных клетках. Другие исследователи [2, 24] являются сторонниками динамической теории, которая предполагает, что репродукция и выделение из ганглия небольшого количества вируса происходят постоянно. Если количество размножающихся вирусных частиц превышает определенный порог, то они по периферическим нервам возвращаются из сакральных ганглиев к половым органам, где размножаются в эпидермисе, что и приводит к характерным рецидивам или бессимптомному выделению вируса.
С нашей точки зрения, следует допустить существование обоих механизмов возникновения рецидивов. Кроме того, важная роль в реактивации инфекции отводится состоянию местного иммунитета, при угнетении которого возникают условия для репродукции вируса [3].
Существует несколько подходов к диагностике герпетической инфекции. Алгоритмы обследования основаны на клинических симптомах и лабораторных тестах. Наиболее распространенным в клинической практике является метод быстрой диагностики герпетической инфекции – полимеразная цепная реакция [2, 21]. Также для постановки диагноза герпетической инфекции часто используется иммуноферментный анализ.
Анализ литературных данных показал, что беременность, как правило, не влияет на частоту возникновения и тяжесть герпетической инфекции. В то же время имеется и противоположное мнение, указывающее на изменение клиники генитального герпеса на фоне физиологического иммунодефицита, имеющего место при беременности [1, 6].
Следует отметить, что пути проникновения вируса к эмбриону и плоду могут быть различными. Первый путь – трансплацентарный, возникает при наличии вирусемии у беременной, когда вирус из межворсинчатого пространства плаценты проникает в сосудистую систему плода с дальнейшей диссеминацией в его органах [3, 9, 13].
Резко увеличивает потенциальную опасность трансплацентарной передачи ВПГ плоду первичное инфицирование женщины во время беременности. Риск увеличивается и при активации латентной герпетической инфекции, однако он значительно ниже, чем при первой встрече организма с вирусом. Возможность трансплацентарной передачи инфекции значительно возрастает на фоне снижения иммунологической реактивности организма и при всех сопутствующих состояниях, увеличивающих проницаемость плаценты. Однако, по мнению ряда авторов [1, 13], вирусы могут проникать в организм плода даже через неповрежденную плаценту.
При восходящем инфицировании основными факторами, повышающими риск заражения плода, являются патологические изменения шейки матки, снижение защитных свойств цервикальной слизи, а также акушерские вмешательства и манипуляции, возможность проникновения вируса в околоплодные воды через плодные оболочки [3].
Бесспорно, как отечественными [1, 6], так и зарубежными авторами [9, 13] лидирующее место (до 90% случаев) отводится контактному механизму заражения плода, возникающему при прохождении ребенка через инфицированные родовые пути матери. При этом передача инфекции возможна как при наличии очагов повреждения в области шейки матки и вульвы, так и при бессимптомном выделении вируса.
В I триместре гестации риск инфицирования плода ВПГ резко возрастает при наличии первичного эпизода инфекции или стадии обострения хронической рецидивирующей формы заболевания, что может явиться причиной возникновения пороков развития плода, неразвивающейся беременности, спонтанных абортов и др. [2, 23]. Эмбриональные ткани с их высоким уровнем метаболизма и энергетики являются идеальной средой для репликации вирусов. При этом вирусная нуклеиновая кислота может включаться в состав клеточного генома, передающего генетическую информацию в аппарат, воспроизводящий клеточный белок, что в конечном итоге приводит к гибели зародыша или нарушению процессов органогенеза и возникновению пороков развития [3].
По данным литературы, при инфицировании беременной после 20 нед. гестации возрастает частота поздних самопроизвольных выкидышей, преждевременных родов, внутриутробного инфицирования плода. В этот период у плода могут развиться воспалительные заболевания головного мозга, глаз, легких, анемия, гепатоспленомегалия и т. д. Генитальная герпетическая инфекция, ввиду частых воспалительных изменений последа, может явиться причиной преждевременного или раннего излития околоплодных вод (с высоким риском восходящего инфицирования плода), нарушений сократительной активности матки с развитием первичной и/или вторичной слабости родовой деятельности, аномалий прикрепления и отделения плаценты с кровотечением в последовом и раннем послеродовом периодах [2, 3, 13].
Внедрение в практику противовирусной терапии привело к значительному снижению заболеваемости и смертности, однако до настоящего времени проблема герпетической инфекции во время беременности и ее влияние на организм ребенка являются одной из наиболее острых проблем в перинатологии [5, 14, 16, 17].
В работах зарубежных авторов было показано, что среди женщин с рецидивирующим генитальным герпесом примерно в 75% случаев следует ожидать по крайней мере один рецидив ВПГ во время беременности и в 14% – клинические проявления на момент родоразрешения [22, 25]. Данные систематического обзора 7 рандомизированных контролируемых испытаний с 1249 участниками выявили, что женщины с первичным эпизодом или рецидивом ВПГ-инфекции, которые получали антивирусную профилактику ацикловиром (400 мг 3 р./сут) или валацикловиром (500 мг 2 р./сут) начиная с 36 нед. беременности, значительно реже имели рецидивы инфекции к моменту родоразрешения (OR=0,28; CI=0,18–0,43), а проведение супрессивной терапии данными препаратами привело к снижению частоты выполнения кесарева сечения в связи с обострением ВПГ-инфекции (OR=0,30; CI=0,20–0,45) [15].
Как известно, во время родоразрешения при рецидивирующей генитальной ВПГ-инфекции происходит заражение плода. В крупном проспективном исследовании (58 362 беременные женщины), проведенном с целью оценки влияния метода родоразрешения на частоту передачи ВПГ-инфекции новорожденным, было показано, что инфицирование новорожденных практически в 6 раз ниже при операции кесарева сечения, чем при самопроизвольных родах (1,2% по сравнению 7,7% соответственно; ОR=0,14; CI=0,02–1,08) [10].
Также в исследованиях было показано, что у беременных с рецидивирующим генитальным герпесом проведение антивирусной профилактики ацикловиром после 36 нед. гестации для снижения риска передачи инфекции новорожденному является более экономически выгодной мерой, чем проведение кесарева сечения в связи с активацией ВПГ-инфекции на момент родоразрешения. Однако в настоящий момент недостаточно исследований, оценивающих экономическую эффективность противовирусной профилактики валацикловиром [18].
С учетом полученных данных, Американский колледж акушеров и гинекологов (AGOG) и общество акушеров и гинекологов Канады (SOGC) рекомендуют женщинам с рецидивирующей генитальной ВПГ-инфекцией проводить супрессивную терапию ацикловиром или валацикловиром после 36 нед. гестации, а также осуществлять родоразрешение путем операции кесарева сечения пациенткам с наличием активных герпетических высыпаний на половых органах и продромальных симптомов инфекции к моменту родов. SOGC предлагает пациенткам с первичной генитальной ВПГ-инфекцией в третьем триместре проводить кесарево сечение вне зависимости от наличия или отсутствия поражения кожных покровов половых органов в связи с высоким риском (до 60%) вертикальной передачи [8, 20].
Осложненное течение гестационного периода у женщин с герпетической инфекцией, тяжесть неонатального герпеса и неблагоприятный прогноз для новорожденного делают весьма актуальной разработку рациональных подходов к диагностике, профилактике и лечению этого заболевания. В профилактике неонатального герпеса большое значение приобретает правильная тактика ведения беременности и родов, однако реальным малоиспользуемым до настоящего времени резервом в решении проблемы рождения здорового ребенка является правильная прегравидарная подготовка пациенток с герпетической инфекцией, которая включает ее лечение с последующей профилактикой рецидивов. При генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисной (противовирусной) терапии, так и лечение сопутствующих заболеваний.
К базисным видам лечения относится:
• Блокада репродукции ВПГ в режиме эпизодической или супрессивной терапии. Применяют ацикловир по 0,2 г 5 р./сут в течение 5 дней при легком течении инфекции (обострения 1 раз в 6–8 мес.) и по 0,2 г 4 р./сут в непрерывном режиме в течение 3–6 мес. и более – при ее частых рецидивах (обострения 1 раз в 30–90 дней).
• Проведение стимуляции неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.).
• Местное применение специфических мазей.
В настоящее время наиболее широко используемыми для купирования обострения различных форм герпеса являются препараты из группы ациклических нуклеотидов. Многочисленными наблюдениями показано, что применение ацикловира в дозе 200 мг 5 р./сут или валацикловира – 500 мг 2 р./сут в течение 5 дней значительно уменьшает клинические проявления заболевания, сокращает время рецидива и период вирусовыделения. Были отмечены абсолютная безопасность, хорошая переносимость препаратов и отсутствие значимых побочных эффектов [6, 14, 16].
Наиболее современным и эффективным противовирусным препаратом является валацикловир, являющийся активным действующим веществом препарата Валцикон (ЗАО «Вертекс», Россия). Валацикловир представляет собой пролекарство – L-валиновый эфир ацикловира. Валацикловир имеет ряд преимуществ в сравнении с ацикловиром (более высокая биодоступность при приеме препаратов внутрь, возможность двух-, трехкратного приема). При ВПГ-инфекции этот препарат применяют у пациентов с резистентностью вируса к ацикловиру. После всасывания в кровь валацикловир почти полностью превращается в ацикловир под влиянием печеночного фермента валацикловир-гидролазы. Образовавшийся ацикловир проникает в пораженные вирусом клетки, где под влиянием вирусного фермента тимидинкиназы превращается в монофосфат, затем – в дифосфат и активный трифосфат. Трифосфат ацикловира угнетает ДНК-полимеразу и тем самым нарушает репликацию ДНК ВПГ. Следовательно, высокая избирательность валацикловира в отношении тканей, пораженных вирусом, объясняется тем, что первый этап цепи реакций фосфорилирования опосредуется ферментом, вырабатываемым самим вирусом. Валацикловир назначают по 0,5 г 2–3 р./сут в течение 5–10 дней. Длительность и дозу препарата подбирают индивидуально с учетом формы и тяжести вирусного заболевания.
Как показывает клиническая практика, эффективность ациклических нуклеозидов зависит от биодоступности препарата, чувствительности герпес-вируса к конкретному препарату, адекватности применяемой дозы, продолжительности и кратности лечения, сроков начала лечения. Назначение валацикловира в дозе 500 мг 2 р./сут в течение 5 дней в продромальном периоде или сразу после появления симптомов рецидива заболевания способствует быстрому купированию проявлений вирусной инфекции. Препарат для системного лечения герпетической инфекции Валцикон сочетает в себе эффективность и безопасность ацикловира при отсутствии его недостатков – таких как ограниченная биодоступность, связанная с недостаточно эффективным всасыванием препарата при пероральном применении. Применение Валцикона дает возможность снизить количество приемов лекарства до 2 р./сут в отличие от 5 р./сут – при назначении ацикловира и повысить приверженность пациентов к проводимой терапии.
В ряде случаев среди пациентов, получавших хотя бы короткие курсы валацикловира в момент рецидива, тенденция к нарастанию частоты клинических проявлений ВПГ-инфекции ниже, чем среди пациентов, получавших только местное лечение, что во многом зависит от исходного состояния противовирусной защиты и продолжительности вторичного иммунодефицита у больных с ВПГ-инфекцией. Супрессивную терапию рекомендуют людям с частыми рецидивами. Для пациентов с сохраненным иммунитетом назначают препарат в дозе 500 мг 1 р./сут, с иммунодефицитом – 500 мг 2 р./сут. Прием препаратов ежедневно в течение 12 и более месяцев в 80% случаев предотвращает рецидивы герпеса и обеспечивает психологическое преимущество над лечением, проводимым во время обострений; при такой терапии рецидивы заболевания становятся достаточно редкими, а у некоторых пациентов возможна ремиссия в течение нескольких лет. Анализ рандомизированного исследования [26] подтвердил высокую клиническую эффективность применения валацикловира в профилактике рецидивирующей ВПГ-инфекции. Супрессивная терапия в прегравидарном периоде и перед родоразрешением может снизить частоту рецидивов ВПГ, риск бессимптомного выделения вируса и частоту кесарева сечения вследствие активации герпетической инфекции. Валцикон с фармакоэкономической точки зрения наиболее оптимально подходит для супрессивной терапии. Учитывая наличие большой упаковки (42 капсулы), доступную стоимость и 2–кратное применение в сутки, препарат Валцикон позволяет достичь очень высокой комплаентности лечения.
Таким образом, следует подчеркнуть, что проведение ранней диагностики, профилактики и лечения ВПГ-инфекции у женщин до наступления беременности, прегравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, предупредить тяжелые формы неонатальной инфекции, уменьшить перинатальную заболеваемость и смертность.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

Основным местом локализации первичной генитальной инфекции ВПГ у женщин является шейка матки. Чаще всего, герпетические поражения у женщин локализуются на больших и малых половых губах (68,6%), в области вульвы (41,8%), клитора (35,7%), влагалища и шейки матки (84,4%).
ВПГ был изолирован из шейки матки во время первичного заражения у 88—90 % женщин с первичной инфекцией ВПГ-2, которые имели везикулезную сыпь на наружных гениталиях, у 65 % — с повторным эпизодом инфекции ВПГ-2, и у 80 % женщин с ВПГ-1. Большинство (89 %) женщин, выделяющих вирус при первичном эпизоде заболевания, имели изменения на шейке матки.
Особенностью генитального герпеса (Herpes genitalis) женских половых органов является многоочаговость. В патологический процесс нередко вовлекаются нижний отдел мочеиспускательного канала, слизистая оболочка ануса и прямой кишки. Вовлечение в инфекционный процесс этих органов может происходить вторично, вслед за возникновением герпеса наружных гениталий, но может протекать и как изолированное поражение.
Рецидивирующая герпетическая инфекция (РГИ) может проявляться клиникой вульвовагинита и цервицита, вызывать поражения слизистой матки, труб и придатков. В 83,6 % случаев при стойких, не поддающихся терапии кольпитах, лейкоплакиях шейки матки выделяют вирус простого герпеса (ВПГ) как один из ведущих этиологических факторов заболевания.
По некоторым данным, в 66 % случаев у женщин герпетическая инфекция (ГИ) протекает атипично. Об имеющейся длительно текущей хронической ГИ можно говорить на основании особенностей клинического течения, наличия герпетического антигена в эпителиальных клетках вульвы, влагалища и периферической крови.
д) хронических часто рецидивирующих сальпингоофоритах (воспаление маточных труб и яичников) и эндометритах, не поддающихся стандартной антибактериальной терапии;
У 1–2% женщин, поступающих в гинекологическую клинику, независимо от основного заболевания, обнаруживают цитологические доказательства ВПГ-инфекции.
Герпес наружных половых органов у женщин
При рецидивирующем герпесе (РГ) наружных половых органов у женщин, очаг поражения находится в области наружных гениталий и перианальной области. Герпетические высыпания у женщин возникают на больших и малых половых губах, области лобка и промежности.
Типичная форма РГ наружных гениталий характеризуется ярко выраженными симптомами болезни, классическим развитием очага поражения (эритема, образование везикул, развитие эрозивно-язвенных элементов, эпителизация) и субъективными ощущениями (зуд, чувство жжения, болезненность, недомогание). проявляется повторяющимися пузырьковыми высыпаниями. Выраженная симптоматика позволяет врачам визуально поставить диагноз РГГ, своевременно назначить лечение и информировать больного об инфекционном характере заболевания и опасности заражения полового партнера.
Герпес нижнего отдела урогенитального тракта, анальной области и ампулы прямой кишки
Поражение слизистых оболочек входа во влагалище, влагалища, влагалищной части шейки матки, цервикального канала, уретры, мочевого пузыря, анальной области и ампулы прямой кишки проявляется в двух клинических формах:
- очаговой, характеризующейся появлением типичных для простого герпеса слизистых оболочек везикулезно-эрозивных элементов,
- диффузной, при которой патологический процесс протекает по типу неспецифического воспаления.
Герпес верхнего отдела полового тракта (поражение матки, маточных труб).
Типичная клиническая картина герпетических поражений органов верхнего отдела мочеполового тракта проявляется симптомами неспецифического воспаления. Неспецифические герпетические поражения внутренних половых органов проявляются эндоцервицитом, эрозией шейки матки, вагинитом. Ряд авторов цервициты без наружных язв также относят к атипичным проявлениям ГГ.
Клинические проявления герпетических поражений внутренних половых органов не имеют специфических особенностей по сравнению с воспалительными процессами невирусной этиологии. Обычно больные предъявляют жалобы на выделения из влагалища, периодически появляющиеся боли в малом тазу, области проекции матки, яичников.
Герпетические поражения шейки матки
Герпетические поражения шейки матки могут носить типичный и нетипичный характер. В типичном варианте генитального герпеса – это всегда хорошо заметные множественные, довольно мелкие, с четкими границами округлые эрозии; высыпные элементы быстро минуют везикулярную стадию, в которой, кстати, эти элементы плохо различимы без применения кольпоскопии. Проблема причастности ВПГ к развитию нетипичных герпетических изменений слизистой шейки матки в настоящее время находится в стадии исследований.
При кольпоскопии в острый период герпетической инфекции шейки матки определяют изъязвление с неровными краями с сукровицей в области дна. Эволюция этого поражения идет от изъязвления с красным дном к простой эрозии до полного исчезновения в течение 3-х недель. К предшествующим изменениям относят маленькие буллезные образования, затем округлые микроэрозии с последующим формированием простых красных пятен, которые похожи на местный пятнистый кольпит.
Исследования показали, что выделение ДНК ВПГ с поверхности эрозии шейки матки в 60 % случаев сопровождается репликативной фазой ГИ (репликация и сборка вирусных частиц в инфицированных клетках). При эрозии и дисплазии шейки матки ВПГ-2 выявляется в 27,2% случаев непосредственно в соскобах со слизистой цервикального канала и сопровождается повышением титра специфических иммуноглобулинов в крови до диагностических уровней.
Особое значение влияние герпетической инфекции на состояние эпителия шейки матки имеет у женщин, длительно принимающих оральные гормональные контрацептивы. Известно, что длительный прием комбинированных стероидов в той или иной мере усиливает процессы плоскоклеточной метаплазии, а также может вызывать эффект эндоцервикальной гиперплазии, причем этот эффект в случае его развития наблюдается как в эпителии цервикального канала, так и в участках псевдоэрозии на фоне эктропиона, в полипах слизистой цервикального канала. В связи с этим прием оральных комбинированных контрацептивов может являться кофактором в развитии рака шейки матки, особенно в сочетании с герпетической инфекцией.
Герпетический цервицит
В настоящее время под термином экзоцервицит (эктоцервицит) понимают воспаление влагалищной части шейки матки. Эндоцервицит - воспаление слизистой оболочки канала шейки матки (цервикального канала). Понятие «цервицит» объединяет эти два термина.
Герпетический цервицит – это воспалительный процесс, вызванный ВПГ. Для клинических проявлений герпетического цервицита характерно разнообразие проявлений — от легкой гиперемии с небольшим количеством эрозий до тяжелого некротического поражения (под эрозией шейки матки понимают дефект эпителия в результате воспаления). Цервицит диагностируется у 70-90% женщин с герпетическим поражением половых органов. Шейка матки при герпетическом эндоцервиците отечна, часто имеет эрозии, легко кровоточит при манипуляциях.
Герпетический эндометрит
Эндометрит — это воспаление внутренней (слизистой) оболочки матки (эндометрия) с поражением как функционального, так и базального слоя. Эндометрит, вызванный вирусом простого герпеса, является следствием длительной персистенции (существования) вируса в эндометрии. Герпетический эндометрит, как правило, возникает при атипичном или бессимптомном течении ГГ, типичная форма отмечается редко (~20% случаев). Клинические симптомы при вирусном поражении эндометрия чаще всего отсутствуют или проявляются нетипично, что приводит к ошибкам в диагностике и позднему началу лечения.
При герпетическомпоражении ткани нарушаются факторы местного и общего иммунитета, целостность поверхности эпителия, что приводит к созданию благоприятных условий для развития других инфекционных процессов .
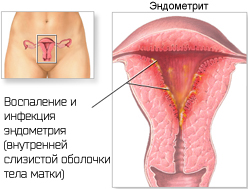
Клинически герпетический эндометрит чаще проявляется во второй фазе менструального цикла или во время беременности, что, возможно, обусловлено повышением уровня простагландинов в этот период или супрессией Т-клеточного звена иммунитета, способствующих реактивации ВПГ, персистирующего в эндометрии. Субклиническая латентная внутриматочная герпетическая инфекция является важным фактором невынашивания беременности. Эндометриты ВПГ-этиологии встречаются нечасто, но эти заболевания очень опасны и могут вызвать гибель женщины и плода.
Герпес уретры и мочевого пузыря (герпетический уретрит)
Герпетический уретрит у женщин субъективно проявляется болями и резями в начале мочеиспускания, частыми позывами к мочеиспусканию. У 4,8% женщин имеет место очень болезненное мочеиспускание, или задержка мочеиспускания в результате инфекции уретры и слизистой оболочки мочевого пузыря. Нормализация функции мочевого пузыря у больных с задержкой мочеиспускания обычно происходит в течение 6–10 дней.
При осмотре наблюдаются гиперемия наружного отверстия уретры, наличие скудных слизистых выделений; при уретроскопии в передней части уретры иногда удается обнаружить мелкие поверхностные эрозии, катаральное воспаление.
Герпетический цистит
Ведущими симптомами герпетического цистита являются цисталгия, появление болей в конце мочеиспускания, дизурические явления. При герпетическом цистите появляются гематурия (кровь в моче), появление болей в конце мочеиспускания, боли в области мочевого пузыря. У женщины это может быть первым и единственным признаком ВПГ-инфицирования мочеполовой сферы. Он нередко возникает в первые 1-3 месяца после начала половой жизни или после смены полового партнера.
Герпес анальной области и прямой кишки
Очаг поражения в анальной области обычно представляет собой рецидивирующую трещину, что нередко является поводом для диагностических ошибок. Такие больные с ошибочным диагнозом "трещина заднего прохода" попадают к хирургам. Зудящая форма герпеса ануса и герпетическое поражение геморроидальных узлов, также трудны для диагностики.
Поражение анальной области может возникнуть первично как самостоятельное заболевание или вторично – в результате затекания отделяемого влагалища и мацерации слизистой оболочки ануса при наличии у пациентки герпетического кольпита, сопровождающегося обильной экссудацией.
При поражении сфинктера и слизистой оболочки ампулы прямой кишки (герпетический проктит) больных беспокоят зуд, чувство жжения и болезненность в очаге поражения, возникают мелкие эрозии в виде поверхностных трещин с фиксированной локализацией, кровоточащие при дефекации. При ректоскопии определяется катаральное воспаление, иногда эрозии.
Герпес внутренних гениталий - субклиническая и бессимптомная формы.
Для субклинической формы герпеса внутренних гениталий (влагалища, матки, яичников и т.д.) типично отсутствие у пациентки жалоб, иногда имеются указания на периодически появляющиеся необильные слизистые выделения из влагалища. При гинекологическом осмотре симптомы воспаления не выявляются. При динамическом лабораторном исследовании мазков отделяемого канала шейки матки, влагалища и уретры периодически выявляется повышенное количество лейкоцитов (до 200–250 и выше в поле зрения), свидетельствующее о наличии воспалительного процесса. При вирусологическом исследовании мазков методом иммунофлюоресценции в лейкоцитах определяется антиген ВПГ.
Бессимптомная форма герпеса внутренних гениталий характеризуется отсутствием у больных каких-либо жалоб на половую сферу, объективных клинических данных, подтверждающих воспаление. При лабораторном исследовании отделяемого урогенитального тракта выделяется ВПГ, в то время как в мазках признаков воспаления (лейкоцитоза) нет. Бессимптомная форма герпеса внутренних гениталий выявляется у 20–40% женщин, страдающих РГГ ягодицы и бедра. Это важное обстоятельство необходимо учитывать при планировании беременности у женщин с этой формой РГГ в связи с существующей вероятностью развития во время беременности осложнений ВПГ-инфекции.
Согласно данным литературы, у 83,6% женщин, страдающих не поддающимися терапии кольпитами и лейкоплакией шейки матки, ВПГ является одним из факторов заболевания. Доказано, что ВПГ может быть причиной развития эндометрита и сальпингоофорита.
Герпетический вульвовагинит
У женщин часто встречаются герпетический вульвовагинит, особенностью течения которого является нередкое присоединение отека пораженной области. Вирус герпеса могут изолированно поражать вульву и влагалище. Заражение происходит от больных. Герпетический вульвовагинит проявляется мелкими пузырьками на гиперемированной вульве. Пузырьки содержат прозрачную, а при присоединении вторичной инфекции — гнойную жидкость. Через 5—7 дней пузырьки вскрываются с образованием эрозий и язвочек, которые покрываются струпом. В начале заболевания выражены жжение, боли и зуд в области вульвы. Общие симптомы включают головную боль, озноб, повышение температуры тела.
У женщин диагноз «атипичная форма генитального герпеса» ставится гинекологами для обозначения хронического воспалительного процесса вульвы при наличии лабораторно подтвержденной герпетической природы заболевания, в отличие от типичной картины болезни, при которой на слизистой оболочке этих органов имеются очаги поражения с везикулезно-эрозивными элементами.
Генитальный герпес во время беременности
Заболевание ВПГ женщин во время беременности может явиться причиной гибели плода, мертворождения, преждевременных родов. Герпесвирусы вызывают до 30% спонтанных абортов на ранних сроках беременности и свыше 50% поздних выкидышей, занимают второе место после вируса краснухи по тератогенности (развитие уродств плода).
Тяжелейшие формы неонатального герпеса развиваются при инфицировании новорожденного вирусом простого герпеса в родах. При первичном ГГ у матери инфицируется от 30% до 80% детей, при рецидивирующем герпесе – 3–5%. Инфицирование плода во время родоразрешения, если у матери в конце беременности имели место герпетические высыпания, происходит у 50% женщин, больных РГГ; при этом у 60–80% инфицированных детей развивается энцефалит.
Герпес менструальный
Менструальный герпес — это генитальный герпес (ГГ) с монотонным типом рецидивирования и тяжелым течением, характеризующийся ежемесячными обострениями инфекционного процесса до, во время или после менструации. Такое течение заболевания может стать для женщины сильнейшим психотравмирующим фактором, ограничивающим ее социальную активность и снижающим качество жизни.
Этот вариант ГИ является сложным для лечения. Поэтому разработка адекватных и эффективных способов лечения и профилактики рецидивов у больных с данными формами ГГ остается актуальной. Европейские стандарты лечения пациенток предусматривают длительную (годами) супрессивную терапию противовирусными препаратами , что не исключает повторного рецидирования ГГ и бессимптомного вирусовыделения, появления побочных эффектов и резистентности вирусов герпеса к лекарственной терапии.
Вирус простого герпеса (ВПГ) способен оказывать неблагоприятное, а в некоторых случаях фатальное влияние на течение беременности и родов, состояние матери и плода, а также вызывать различные патологии у новорожденных.
Генитальный герпес у беременных может приводить к ряду осложнений, особенно при рецидивирующих генитальных формах инфекции. Урогенитальная герпетическая инфекция может проявляться в виде патологии беременности. Среди беременных, инфицированных ВПГ-2, многоводие, невынашивание, угроза прерывания беременности регистрируется в 5–10 раз чаще, чем среди серонегативных женщин.
Неонатальный герпес
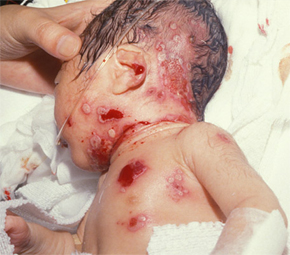
Одним из наиболее серьезных последствий генитального герпеса является неонатальный герпес, возникающий у новорожденного после передачи вируса от матери ребенку.
При развитии первичного генитального герпеса во время беременности до 6 недель перед родами, риск инфицирования плода может достигнуть 50%. При рецидивах генитального герпеса только 5% детей рождаются с признаками очагового или генерализованного герпеса.
Основная роль в возникновении неонатальных герпетических поражений принадлежит ВПГ 2-го типа (ВПГ-2), однако в 30% случаев возбудителем инфекции является ВПГ-1.
Проявления неонатального герпеса
Проявления неонатального герпеса выражены в различной степени. Чаще всего поражается кожа, глаза и рот новорожденных; в более серьёзных случаях - ЦНС и внутренние органы. У большинства детей внутриутробная инфекция проявляется после рождения и характеризуется триадой клинических проявлений: герпетические пузырьки или рубцы на коже, заболевание глаз (микрофтальмия, хориоретинит) и микроцефалия.
1. Самая низкая степень классифицируется как локализованная форма с поражением кожи, глаз и рта (20-40 % случаев неонатального герпеса). Если не лечить эту форму герпеса, то без лечения у 50-70% новорожденных она может перейти в генерализованную форму или в энцефалит. Кроме того, часто возможно рецидивирующее течение на 1-м году жизни.
2. Более отягощенной формой является поражение ЦНС - герпетический энцефалит (около 30% неонатального герпеса). Начало клинических признаков - на 2-3-й неделе жизни, у 40-60% больных отсутствуют специфические высыпания на коже и слизистых оболочках. При развитии энцефалита летальность составляет 50%, у выживших детей велик риск развития дальнейших нарушений со стороны ЦНС. Наилучший прогноз наблюдается при локализованной форме, только 7% детей страдают в дальнейшем от неврологических и других осложнений.
3. И третья, самая тяжелая форма - диссеминированное заболевание с вовлечением многих органов, таких как печень, легкие, различные железы и головной мозг (составляет около 20-50% случаев неонатального герпеса). Начало - на 5 - 10-й день жизни, клинические симптомы неспецифичны и напоминают неонатальный сепсис. При этой степени тяжести заболевания смертность повышается до 90%, а выжившие дети имеют те или иные осложнения.
При наличии ВПГ-1 прогноз для жизни и здоровья лучше, чем при ВПГ-2-инфекции. ВПГ-1-инфекция обычно проявляется в виде локализованной формы неонатального герпеса. ВПГ-2 чаще вызывает развитие диссеминированной формы инфекции и герпетического энцефалита.
Пути инфицирования плода при урогенитальном герпесе
Новорожденные могут инфицироваться ВПГ внутриутробно, во время родов (75–80%) и постнатально. Клинические проявления генитальной инфекции у плода зависят от срока беременности, на котором произошло инфицирование, и путем попадания вируса в организм.
1) Трансцервикальный или восходящий, когда ВПГ со слизистой оболочки влагалища или цервикального канала попадает через плодные оболочки в околоплодные воды и далее к плоду. Излитие околоплодных вод увеличивает риск инфицирования. Структурные изменения в шейке матки (деформация, старые рубцы), снижение показателей местного иммунитета слизистых цервикального канала, неоправданные влагалищные вмешательства и манипуляций способствуют инфицированию. Рассматриваемый путь проникновения ВПГ к плоду характерен для различных клинических проявлений герпеса гениталий: вульвовагинита, кольпита, эндоцервицита, типичных герпетических высыпаний в области наружных половых органов.
2) Гематогенный, или трансплацентарный, когда ВПГ, находящийся в крови матери, попадает через плаценту непосредственно к плоду по пупочной вене, а при наличии условий для размножения в плаценте, сначала в околоплодные воды, а затем к плоду. Возможность трансплацентарной передачи инфекции значительно возрастает при экстрагенитальных заболеваниях (пороки сердца, гипертоническая болезнь, сахарный диабет и др.) и осложнениях беременности (токсикозы, анемия и др.), увеличивающих проницаемость плаценты за счет происходящих в ней дегенеративных изменений.
4) Интранатальный - наиболее часто заражение плода ВПГ происходит во время родов при прохождении плода через инфицированный родовой канал.
Активация латентной герпетической инфекции в организме беременных способствует увеличению потенциальной опасности трансплацентарной передачи ВПГ плоду.
Риск интранатального инфицирования плода
Риск герпеса новорожденных наиболее высок при первичном герпесе половых органов у матери в третьем триместре беременности (до 75%), потому что именно в этот период происходят наиболее существенные изменения практически во всех органах и системах организма беременной женщины. Наличие ВПГ в нижних отелах генитального тракта, особенно в последнем триместре беременности, сопряжено с высокой степенью риска заражения ребенка во время родов, при прохождении плода через родовые пути матери.
Риск инфицирования плода возрастает при преждевременных родах, длительных затяжных родах, при преждевременном разрыве плодных оболочек и длительном безводном периоде (более 6 часов), применении щипцов.
Определение антител к ВПГ у беременных и их половых партнеров снижает риск герпеса новорожденных. Если у беременной нет антител к ВПГ, а у полового партнера есть, им рекомендуют воздержаться от половых контактов в 3-м триместре беременности. При появлении симптомов герпеса половых органов непосредственно перед родами необходимо кесарево сечение.
Кесарево сечение в качестве профилактики неонатального герпеса необходимо планировать всем беременным, у которых первичный эпизод возник после 34-й недели беременности, т.к. в этом случае существует значительный риск вирусовыделения во время родов. Если родоразрешение через естественные родовые пути неизбежно, необходимо проводить лечение у матери и ребенка.
Лечение беременных с герпетической инфекцией
Лечение назначают при манифестной, бессимптомной (первичной или реактивации) герпетической инфекции с целью исключения интранатального инфицирования плода, вертикальной передачи вируса, предупреждения осложнения беремености (многоводия, угрозы выкидыша, спонтанного аборта), осложнения родов (затяжные, преждевременные роды).
Госпитализация женщин с генитальной герпетической инфекцией на роды должна осуществляться заблаговременно (за 2–3 недели) в обсервационное отделение. При этом должно быть проведено тщательное исследование состояния матери (включая вирусологические методы экспресс-диагностики) и плода для выбора способа родоразрешения и подготовки к родам.
Читайте также:

