Масло зародышей пшеницы при розацеа
Обновлено: 30.04.2024
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
Азелаиновая кислота в терапии акне и розацеа
Журнал: Клиническая дерматология и венерология. 2018;17(2): 87‑91
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
Представлены данные зарубежных и отечественных клинических исследований по изучению эффективности и безопасности применения топических препаратов азелаиновой кислоты (АК) для лечения акне и розацеа. Показаны преимущества АК (комплаентность, эффективность, безопасность) по сравнению с другими наружными лекарственными средствами. АК характеризует широкий спектр активности: противовоспалительный, антиоксидантный, противомикробный, антикератинизирующий и антитирозиназный. Это позволяет считать АК препаратом выбора в лечении акне и средством первой линии в лечении папулопустолезной розацеа.
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
Акне и розацеа — наиболее распространенные заболевания в практике дерматолога и косметолога. Диагностика и выбор алгоритма терапии представляют определенные трудности. Высокая распространенность, хроническое рецидивирующее течение, выраженные психоэмоциональные расстройства, снижение качества жизни пациентов с акне и розацеа объясняют важность задачи дальнейшего совершенствования терапии.
Розацеа
Механизмы, вызывающие патологический процесс при розацеа и акне, изучены не конца. Розацеа является хроническим заболеванием кожи с участками покраснения (преимущественно в лицевой области), образованием гнойничковых и других высыпаний. При исследовании RISE, проведенном в России и Германии и включившем соответственно 3013 и 3052 лиц в возрасте 18—65 лет, выявлено 5% больных с розацеа в России и 12% — в Германии [1]. Среди больных розацеа в обеих странах женщины составляли 75% (средний возраст 40 лет), для больных была характерна светлая кожа (фототипы II и III по шкале Фитцпатрика) [2]. Распространенность розацеа коррелирует с фототипом кожи и общей солнечной активностью в регионе проживания, что демонстрирует ключевую роль инсоляции в провоцировании заболевания [3].
Розацеа классифицируют четырьмя подтипами и одним вариантом заболевания:
— эритемато-телеангиэктатическая (подтип 1);
— папуло-пустулезная (подип 2);
— фиматозная (подтип 3);
— офтальмическая розацеа (подтип 4).
Выделяют вариант гранулематозной розацеа, которую чаще регистрируют у людей с IV и V фототипом кожи. В исследовании RISE основным подтипом был эритемато-телеангиэктатический (подтип 1), что подтверждается результатами и других исследований [4, 5].
Розацеа характеризуется формированием эритемы, эдемы, ощущения жгучей боли. Гистологически обнаруживают расширенные кровеносные сосуды без признаков неоангиогенеза. При всех формах заболевания наблюдается накопление тучных клеток и фибробластов в зоне поражения, что свидетельствует о синтезе хемокинов и ростовых факторов, вызывающих миграцию этих клеток в дерму. При эритематозной форме (наиболее распространенной) повышено число сенсорных нейронов, непосредственно вовлеченных в патогенез заболевания. Поскольку при розацеа наблюдается расширение сосудов, приводящее к локальному обогащению питательными веществами тканей, это может быть причиной присоединения вторичной инфекции. У части больных в очагах воспаления выявляют клещей рода демодекс. Роль клещей в патогенезе розацеа остается дискуссионной. Показано, что розацеа ассоциирована с патологией пищеварительного тракта, дисфункцией эндокринной системы, изменениями в сально-волосяном аппарате и соединительной ткани дермы, иммунными нарушениями, психовегетативными расстройствами, повышением количества микроорганизмов на кожном покрове [6—9]. Причиной соматических заболеваний может быть повышенная реактивность сосудов не только кожи, но и других органов.
Акне является заболеванием кожи, характеризующимся гиперплазией сальных желез, гиперкератозом и образованием комедонов — сально-роговых пробок в протоках сальных желез с частичной или полной их закупоркой. Заболевание чаще всего начинается в пубертатном периоде при адренархе и характеризуется повышенной продукцией сала, что приводит к снижению локального иммунитета в сальных железах и присоединению вторичной инфекции, наиболее часто вызванной Propionibacterium acnes — анаэробной грамположительной бактерией. Бактерия P. acnes использует жирные кислоты кожного сала, в том числе пропионовую, стимулирующую размножение микроорганизма. При избыточной продукции меняется состав кожного сала, снижается уровень линолевых кислот, увеличивается уровень сквалена и перекисных липидов, повышается уровень насыщенных жиров [3, 10, 11]. Комедоны развиваются в местах, богатых сальными железами: на лице (99%), спине (60%) и груди (15%) [12].
В отличие от розацеа акне является распространенным кожным заболеванием, составляя 20—30% всех случаев дерматологических заболеваний [12]. Прогрессирующее течение акне, толерантность к проводимой терапии, косметические недостатки снижают качество жизни пациентов, вызывают значительный дискомфорт и психоэмоциональные расстройства преимущественно депрессивного характера [13, 14].
Патогенез акне связан с увеличенной продукцией кожного сала и дисбалансом липидов секрета сальных желез. Колонизация P. acnes является следствием снижения местного иммунитета и дополнительным стимулом его активации. В норме P. acnes составляют до 50% микроорганизмов, колонизирующих кожу с большим количеством сальных желез и только 5—10% в остальных участках тела [15]. Воспалительный процесс в области сально-волосяного фолликула приводит к развитию фолликулярного гиперкератоза и обтурации протоков сальных желез (микрокомедон, комедон).
Общие характеристики розацеа и акне
Анализ полиморфизма генов показывает наличие генетической предрасположенности к обоим заболеваниям, по крайней мере, у половины больных [16—25]. Однако распространенность акне свидетельствует о том, что патогенез заболевания ассоциирован с полиморфностью многих генов [3].
Общим для обоих заболеваний является преимущественная локализация процесса на коже лица. В эффекторной фазе розацеа и акне принимает активное участие врожденный иммунитет. Роговой слой кожи представляет основную преграду для патогенов. Большое значение имеет поддержание определенной кислотности кожи, так называемой «кислотной мантии Маркионини», состоящей из компонентов потового и сального секретов, в состав которой входят молочная кислота, свободные жирные кислоты, уроканиновая кислота и другие компоненты, обеспечивающие коже кислый рН (5,3—5,6). Показано, что при акне рН кожи повышается, что поддерживает пролиферацию в кожном сале основных комменсалов — бактерии P. acnes и, как результат, способствует активации механизмов врожденного иммунитета, в частности синтеза клетками, выстилающими потовые и сальные железы, антимикробных пептидов (АМП) [26].
АМП — это низкомолекулярные соединения, состоящие из аминокислот (пептиды) и обладающие антимикробной активностью против широкого спектра микроорганизмов: грамотрицательных и грамположительных бактерий, вирусов, простейших и грибов [27]. АМП относятся к первой линии защиты и присутствуют конституционально; их уровень увеличивается при воспалении или травме. К АМП относят α-, β-и θ-дефензины, кателицидины, S100-белки, РНКазы.
В патогенезе розацеа показана роль антимикробных пептидов, синтез которых осуществляется нейтрофилами, тучными клетками, макрофагами, находящимися в периваскулярном пространстве [28—32]. Активация тучных клеток является результатом расширения сосудов и связана с противомикробной и репаративной функциями этих клеток. Особую роль в патогенезе розацеа играет кателицидин, из которого в результате протеолитического гидролиза в клетках образуется пептид LL-37, играющего одну из главных ролей в патогенезе розацеа [32].
Врожденная иммунная система также принимает участие в развитии акне. Изменение количества и состава кожного сала активирует иммунную систему задолго до появления комедонов [33]. Основными АМП, вовлеченными в патогенез акне, являются β-дефензины 1 и 2 [34—36]. Также, как и при розацеа, в патогенез акне вовлечены нервные окончания сосудов кожи; доказана роль повышенной продукции нейропептида кортикотропин-рилизинг-гормона и повышения экспрессии рецептора меланокортина 1 [37—39]. При акне показана также активация toll-подобных рецепторов на клетках врожденной системы [40].
Таким образом, при акне и розацеа по разным причинам нарушается нормальный гомеостаз кожного покрова лица, что обусловливает активацию врожденного иммунитета, нарушение кислотности кожи, присоединение специфической инфекции, дополнительно стимулирующей врожденный иммунитет.
Азелаиновая кислота в терапии акне и розацеа
Одним из широко применяемых топических средств в дерматологии и косметологии является азелаиновая кислота (АК). АК — конечный продукт окисления линолевой кислоты, который образуется естественным путем в нормальной коже. После нанесения на кожу препараты АК легко проникают в эпидермис и дерму. В системный кровоток попадает до 4% от общей дозы. АК восстанавливает кислотность кожи, что само по себе оказывает лечебное действие. Так, терапевтическим эффектом обладают и другие кислоты, например ретиноевая, ацетилсалициловая, фруктовые [41, 42]. Кроме влияния на рН кожи, АК, в частности, подавляет синтез реактивных форм кислорода нейтрофилами, усиливает экспрессию гена p53 в себоцитах, что ведет к их гибели; оказывает местное антиандрогенное действие за счет снижения активности 5a-редуктазы I типа и, соответственно, уменьшает концентрацию дигидротестостерона в себоцитах, тем самым нормализуя процессы кератинизации и салоотделения [43, 44]. Показано, что АК оказывает антиоксидантное действие, снижает продукцию супероксидных и гидроксильных радикалов и уменьшает воспаление [45]. При длительном использовании АК наблюдается нормализация процесса дифференцировки клеток эпидермиса, снижается поствоспалительная гиперпигментация [46].
По данным клинических исследований [47] АК эффективна как в виде монотерапии, так и в сочетании с антибиотиками. АК в виде монотерапии может быть рекомендована для лечения комедонального акне, папулопустулезного акне легкой и средней степеней тяжести, для поддерживающей терапии [48, 49]. При тяжелом папулопустулезном и конглобатном акне рекомендована комбинация АК с системными антибиотиками. Монотерапия А.К., бензоил пероксидом (БПО) и местными ретиноидами оказывает сопоставимый эффект [48]. Так, в работе H. Gollnick и соавт. [48] приведены данные двух клинических исследований, включивших 351 и 229 больных акне, по сравнительной эффективности 15% геля АК с 5% гелем БПО и 1% гелем клиндамицина. Авторы показали, что применение препаратов в течение 4 нед обеспечивало равную во всех группах 70% эффективность по снижению числа воспалительных элементов. Побочные эффекты в виде локального жжения и раздражения больше были выражены в группе пациентов, применявших БПО, чем в группе лиц, использовавших АК [48]. Минимальные побочные эффекты наблюдались в группе больных, пролеченных гелем клиндамицина. В исследовании G. Stinco и соавт. [49] изучали себостатическое действие АК, адапалена и БПО при лечении 65 больных акне средней тяжести. С помощью себуметрии оценивали уровень секреции кожного сала в области лица. Все используемые препараты оказывали сравнимый терапевтический эффект, однако только АК и БПО обеспечивали снижение продукции кожного сала. По отзывам больных, АК переносится лучше, чем местные ретиноиды или БПО. В косметологии АК активно используют в виде пилинга для проблемной, пористой кожи и для лечения поствоспалительной гиперпигментации. В российских рекомендациях по ведению больных акне АК (25% крем или 15% гель) указан как препарат первой линии для монотерапии комедональных и воспалительных акне. Для лечения акне у женщин в качестве базисной терапии рекомендованы ретиноиды в комбинации с АК.
Для наружного лечения розацеа 2-го типа (папуло-пустулезной) Российское общество дерматовенерологов и косметологов, а также Американское общество по акне и розацеа рекомендуют метронидазол, АК, клиндамицин и другие препараты [50, 51]. Данные ряда клинических исследований показали эффективность монотерапии розацеа 15% гелем АК [52—55]. В ходе метаанализа 2016 г., включившего 57 рандомизированных клинических исследований с общим числом участников 13 630 (больные розацеа 1-го и 2-го подтипов), сравнили эффективность топических препаратов метронидазола, АК, ивермектина, бримонидина и других, а также системных антибиотиков или их сочетаний с топическими ретиноидами. Лучшие результаты были показаны при использовании топического метронидазола и АК [56, 57]. При длительной терапии для поддержания контроля папулопустулезной розацеа в качестве поддерживающей терапии рекомендовано применение АК до 6 мес [58].
Микронизация
АК слаборастворима в водных растворах, соответственно эффективная концентрация пропорциональна растворенной доле А.К. Для увеличения эффективности плохо растворимых веществ используют микронизацию и нанонизацию препаратов. Нанонизированные и микронизированные формы лекарственных средств позволяют повысить биодоступность, растворимость и стабильность препаратов, лучшее проникновение коллоидов через барьеры тканей и клеточные мембраны. С точки зрения биофармацевтики наноразмер является идеальным, однако с точки зрения производства лекарств получение наночастиц проблематично, что связано с имеющимися методами их получения. По этим причинам микронизация труднорастворимых препаратов является наиболее подходящим решением. Микронизация может включать измельчение активного вещества различными методами с последующим введением в различные носители (гидрогели, кремы, пенки).
Российские врачи в арсенале сегодня имеют несколько препаратов, содержащих АК, один из них микронизированный препарат — 15% гель Азелик (АО «Акрихин»). Для повышения эффективности действия высоких концентраций АК требуется повышение растворимости кислоты в основе в виде геля. Гель Азелик 15% (АО «Акрихин», Россия) является единственным отечественным микронизированным препаратом, размер частиц АК составляет менее 100 мкм [59]. Микронизированная форма обеспечивает легкое проникновение препарата через роговой слой кожи, что способствует реализации антибактериального, кератолитического и депигментирующего эффектов АК [59]. Это позволяет считать гель Азелик препаратом выбора для лечения акне, а также препаратом первой линии в терапии папулопустулезной розацеа.

В поликлинику № 12 г. Краснодар обратилась пациентка 45 лет с жалобами на высыпания и красноту кожи лица, не проходящие полностью в течение 1,5 лет.
Жалобы
Высыпания и стойкая краснота кожи лица сопровождалась неприятными ощущениями зуда, покалывания, "горения", которые проявлялись преимущественно днём, а также во время работы.
Пациентка замечала увеличение интенсивности и количества высыпаний после приёма алкоголя, длительного пребывания на работе (работает поваром), появление неприятных ощущений, чувства жжения и покалывания кожи лица при длительном пребывании на улице.
Анамнез
Впервые высыпания и краснота лица возникли 1,5 года назад летом после отдыха на море. Самостоятельно не лечилась, к врачам не обращалась. Через месяц после выхода на работу отметила повторное появление высыпаний на коже лица, уже сопровождающееся покалыванием и жжением. Использовала наружно крем "Бепантен", улучшений не отмечала. Со слов пациентки к врачу не обращалась за неимением времени. Высыпания приобрели постоянный характер, с течением времени появилась тенденция увеличения их количества, а также интенсивности красноты кожи лица. Субъективно ощущала зуд, жжение, покалывание в области кожи щёк.
Росла и развивалась соответственно возрасту. Жилищно-бытовые условия удовлетворительные. Семейный анамнез по заболеванию Розацеа не отягощён.
Обследование
Кожный патологический процесс носит ограниченный характер, расположен на коже центральной области лица, лба, щёк, подбородка, представлен стойкой эритемой, многочисленными телеангиэктазиями, единичными папулопустулами. Комедоны отсутствуют. Субъективно: чувство жжения, "горения кожи" лица.
ОАК: лимфоциты 38 %. БАК: норма. Соскоб с кожи на Demodex folliculorum: abs. ИФА крови на АТ к Helicobacter pylory: > 1,3 ЕД/мл — положительно.
Диагноз
Лечение
Избегание инсоляции, перепадов температуры, посещения бань, саун и соляриев, тепловых процедур, стрессовых ситуаций, приёма острой, горячей пищи и напитков, алкоголя, ванили, агрессивных косметологических процедур (глубоких пилингов, скрабов,УЗ чисток). Внутрь: "Гинкго билоба" (аскорутин) по 1 таблетке в день в течение одного месяца; "Лактофильтрум" по 2 пакетика 3 раза в день на протяжении 14 дней (за час до еды). Наружно: крем "Солантра" 1 раз в день на чистую сухую кожу до 3-4 месяцев; гель-пенка "Setaphil dermacontrol" вечером — длительно; лосьон "Setaphil" физиологический 1-2 раза в день — длительно; спрей "Laroshe Posay Anthelios XL" SPF с 50+ — ежедневно в дневные часы перед выходом на улицу, длительно.
Динамика кожного патологического процесса через 1,5 месяца лечения положительная. Новых высыпаний пациентка не отмечала, старые регрессируют, на коже щёк и лба сохранялась эритема и многочисленные телеангиэктазии. Иногда отмечала ощущение покалывания кожи в области щёк. При явке к врачу на контроль через 3,5 месяца лечения динамика кожного патологического процесса оставалась положительной, новых высыпаний не было, старые регрессировали, остались телеангиэктазии. Субъективных ощущений пациентка не предъявила. Принято решение продолжить поддерживающую наружную терапию в виде 1% крема "Солантра" 1 раз в 3-4 дня. Ежедневное применение фотозащитного крема с SPF 50+ ("Bioderma") днём.
Курс лечения ивермектином 1% (крем "Солантра") комплексно с системными ангипротекторами и наружной уходовой терапией позволил через 3,5 месяца добиться полного регресса высыпаний, неприятных ощущений и, следовательно, ремиссии "капризного" заболевания Розацеа.
Заключение
Приверженность к терапии адекватная (тандем врач-пациент): системная наружная терапия дали возможность пациентке улыбаться, видя своё отражение в зеркале. Женщина довольна результатом, терапию перенесла без осложнений. Так как Розацеа — заболевание хроническое, склонное к рецидивам, рекомендовано наблюдение в динамике: посещение дерматолога 1 раз в 2 месяца, продолжение использования рекомендованных врачом наружных средств.
Что такое купероз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Тюлис Галины Геннадьевны, дерматолога со стажем в 27 лет.
Над статьей доктора Тюлис Галины Геннадьевны работали литературный редактор Маргарита Тихонова , научный редактор Динар Сафин и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Купероз — это заболевание кожи, которое развивается из-за хрупкости капиллярных стенок и локального нарушения кровообращения. Сопровождается нарушением цвета кожи, потерей её эластичности и появлением телеангиэктазий — сосудистых звёздочек или сеточек [1] .
Как правило, купероз не является самостоятельной болезнью. Это симптом, который сопутствует основному заболеванию.
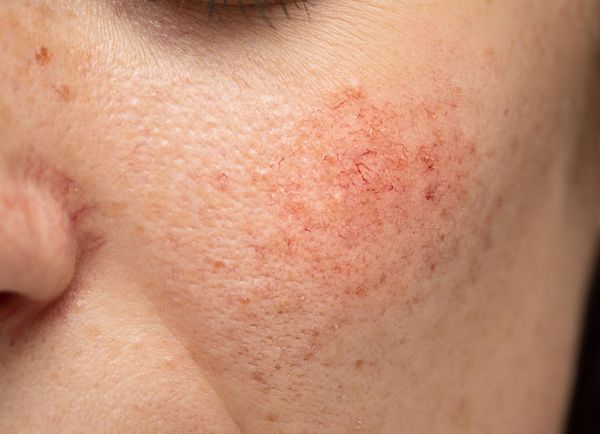
Расширение и ломкость сосудов сосудов происходят по ряду причин. Ими могут быть как внутренние, так и внешние факторы.
Внутренние факторы:
-
— основная причина развития купероза;
- физиологические гормональные изменения — в подростковом возрасте, во время беременности, климакса или при приёме гормональных контрацептивов;
- заболевания яичников, щитовидной и поджелудочной железы;
- заместительная терапия эндокринной патологии [5] ;
- сердечно-сосудистые заболевания ( артериальная гипертензия и атеросклероз );
- заболевания пищеварительной системы (гастрит, дисбактериоз кишечника , болезни печени и поджелудочной железы); и наследственные аутоиммунные заболевания (болезнь Стерджа — Вебера, синдром Луи — Бар, болезнь Рандю — Ослера).
При гормональных нарушениях обособленные частички гормонов вступают во взаимодействие с рецепторными клетками, образуя биологически активные биологические соединения. Эти соединения влияют на стенки сосудов, уменьшают их упругость и эластичность, делая их ломкими.
Во время беременности происходит серьёзная гормональная перестройка организма. Сосуды могут не выдержать такую нагрузку и расшириться. Так как такая перестройка временная, в течение 2-3 месяцев после родов сосуды обычно восстанавливаются. Но из-за развития других заболеваний (например, гипертонии) сужение сосудов после родов может и не произойти.
При наследственных аутоиммунных заболеваниях количество нитевидного белка, придающего упругость и эластичность сосудистым стенкам, уменьшается и сосуды становятся ломкими. Склеродермия сопровождается отторжением соединительной ткани. Это также сказывается на сосудах.
При розацеа поражаются сальные железы, волосяные луковицы и капилляры кожи лица. За счёт стойкого расширения сосудов и прилива крови появляются телеангиэктазии.
Внешние факторы :
- вредные привычки ( курение , злоупотребление алкоголем);
- неправильное питание (употребление большого количества кофе, шоколада, острой и горячей пищи);
- перепады температуры;
- ультрафиолетовое облучение.
Курение влияет на сосуды, разрушая баланс липидов в крови. Липиды — это жиры, которые влияют на обмен веществ у человека. Разрушенные частицы из липидного баланса оседают на сосудистых стенках, закупоривая их просвет. Сердце с возросшей нагрузкой проталкивает кровь по сосудам, в результате в сосудах с венозной и артериальной кровью образуется разное давление, что приводит к расширению капиллярной сети.
Чрезмерное употребление алкоголя также способствует скоплению жиров в сосудистых стенках, а этанол расширяет капилляры. Он снижает давление крови за счёт расслабления сосудистых стенок, тем самым эластичность сосудов теряется и они остаются расширенными.
Люди с чувствительной и светлой кожей наиболее подвержены развитию купероза, особенно под влиянием перепадов температуры и ультрафиолетового излучения. Такая кожа быстро реагирует на внешние факторы, что способствует повреждению стенок сосудов.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы купероза
Купероз может проявляться на любых участках кожи, например на ногах, спине или грудной клетке, но чаще — на лице: в области крыльев носа, лба, подбородка и щёк [9] . Это обусловлено эластичностью и небольшой толщиной кожи.
Из-за нарушения целостности сосудистой стенки образуются небольшие кровоизлияния, которые становятся заметны невооружённым глазом. Вначале появляются розово-красные или тёмно-фиолетовые сосудистые звёздочки и сеточки. Их цвет зависит от степени поражения и диаметра сосудов (от 1-2 мм до 4-5 см).
Боль не характерна, но может возникнуть чувство жжения или зуда. При расширении вен на ногах появляется мышечная слабость, тяжесть в конечностях при ходьбе.
На фоне поражения печени может появится зуд. Такой печёночный зуд возникает под влиянием желчных кислот. Они формируются из холестерина в печёночных клетках, после транспортируются вместе с током желчи в желчный пузырь и двенадцатиперстную кишку. При нарушении транспортировки желчных кислот они попадают в кровоток. Кислоты накапливаются в организме, что и приводит к зуду кожи.
При наследственных аутоиммунных заболеваниях соединительной ткани расширение капилляров сопровождается поражением сосудов и неспецифическим воспалительным процессом, который возникает под влиянием множества внешних и внутренних факторов.
Если не заняться лечением, симптомы купероза начинают прогрессировать. Капилляры значительно расширяются, кровь в них застаивается, из-за чего сосуды становятся синюшно-фиолетового цвета. На других участках кожи нарушается приток крови и выработка коллагена, кожа тускнеет, теряет эластичность, становится более дряблой.
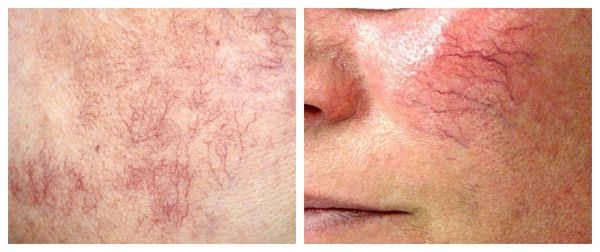
Патогенез купероза
Кожу кровоснабжают поверхностные и глубокие сосудистые сплетения: капилляры, прекапиллярные сосуды, артерии и вены. Поверхностная сосудистая сеть находится в сосочковом слое дермы, глубокая — в нижних слоях дермы и гиподерме (подкожно-жировой клетчатке). Сообщаются эти сплетения при помощи анастомозов — соединений между кровеносными сосудами [2] .
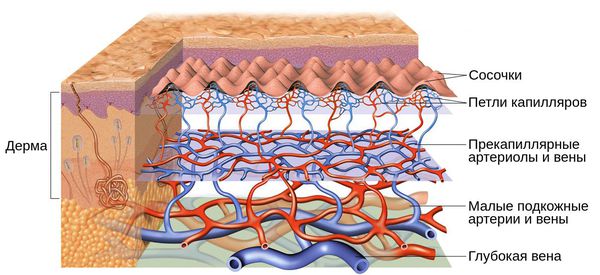
Под влиянием различных факторов образуется большое количество вазоактивных веществ, влияющих на тонус и диаметр сосудов. Среди них эндотелин, простагландины, простациклины и оксид азота [2] . Процесс сужения и процесс расширения сосудов находятся в своеобразном балансе и уравновешивают друг друга. Однако при постоянном воздействии провоцирующих факторов этот баланс нарушается и смещается в сторону расширения сосудов. Вначале развивается временный, а затем постоянный эритроз — покраснение кожи в области щёк и носа. В дальнейшем стойкий эритроз приводит к появлению телеангиэктазий. Если в среднем диаметр нормальных мелких сосудов составлял 5-10 микрон, то при куперозе они расширяются до 100 микрон — их диаметр увеличивается в 10 раз.
Телеангиэктазии могут быть единичными и множественными, локальными или распространёнными, мелкими и крупными, бледно-розовыми и синюшно-фиолетовыми. Красные тонкие сосудистые звёздочки, не выступающие над поверхностью кожи, развиваются из капилляров и артериол. Более широкие, синеватые телеангиэктазии, выступающие над поверхностью кожи, формируются из венул.
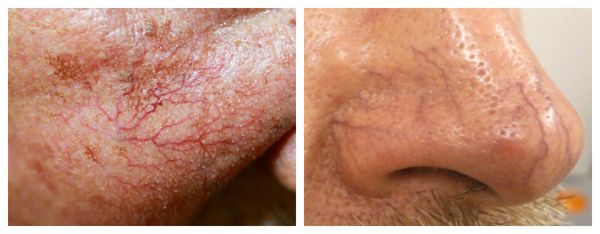
Внешний вид повреждённого капилляра может меняться: если первоначально он был тонким и красным, то затем становится синим. Это происходит из-за хронически повышенного гидростатического давления в капиллярах со стороны венозной крови. Гидростатическое давление — это явление, при котором на артериальном конце капилляра давление больше, чем на венозном. Приток крови становится больше, чем надо, и стенки венозных капилляров расширяются.

Классификация и стадии развития купероза
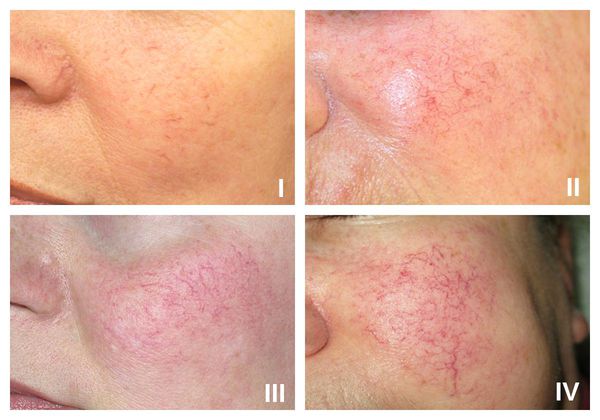
В рамках розацеа выделяют четыре стадии купероза:
- I стадия — начало болезни. Отмечается периодические ощущения "приливов". Кожа краснеет на щеках, иногда на туловище, руках и кистях [6] . На этой стадии сосуды ещё эластичны, могут полностью сократиться. Поэтому интенсивность красноты постепенно уменьшается и исчезает самостоятельно, не оставляя никаких следов. На фоне покраснения наблюдается сухость кожи и не больше 2-3 расширенных капилляров.
- II стадия. Наблюдается более стойкое покраснение в области щёк при любом прикосновении к коже лица, даже во время умывания. Появляется сосудистый рисунок в виде сосудистых звездочек, жжение, покалывание, незначительный зуд.
- III стадия. Также отмечается стойкое покраснение и сосудистая сеточка. Сосуды расширились, потеряли тонус и эластичность, не сокращаются. Усиливается сухость кожи, что приводит к развитию воспалительной реакции.
- IV стадия. В процесс вовлекаются почти все сосуды лица. Из-за спазмирования сосудов появляются бледные участки кожи.
Осложнения купероза
Единственное осложнение купероза — преждевременное старение кожи. Из-за нарушенного кровоснабжения она недополучает кислорода и питательных веществ [8] . В результате становится тусклой, дряблой, сухой, а видимые сосуды кожи вызывают эстетический дискомфорт.
Однако не стоит забывать, что купероз может быть проявлением сердечно-сосудистых, эндокринных, гастроэнтерологических или наследственных аутоиммунных заболеваний. Поэтому чтобы не допустить развития осложнений основной болезни, важно обратиться к врачу при первых признаках купероза.
Диагностика купероза
Распознать купероз по клиническим проявлениям не оставляет труда. Однако самостоятельно поставить правильный диагноз невозможно: купероз может быть проявлением начальной стадии наследственного аутоиммунного заболевания, патологии соединительной ткани и других болезней. Поэтому за помощью необходимо обратиться к врачу. Только доктор сможет установит причину купероза и подобрать правильное лечение.
При сборе анамнеза врач уточняет, какие факторы могли повлиять на развитие болезни: есть ли у пациента жалобы на щитовидную железу или яичники, были ли у него заболевания, связанные с нарушением гормонального фона [3] .
Для лучшей визуализации поражения кожи во время осмотра используют дерматоскоп. Он позволяет разглядеть тонкие паутинки расширенных сосудов, которые не видны невооружённым глазом.
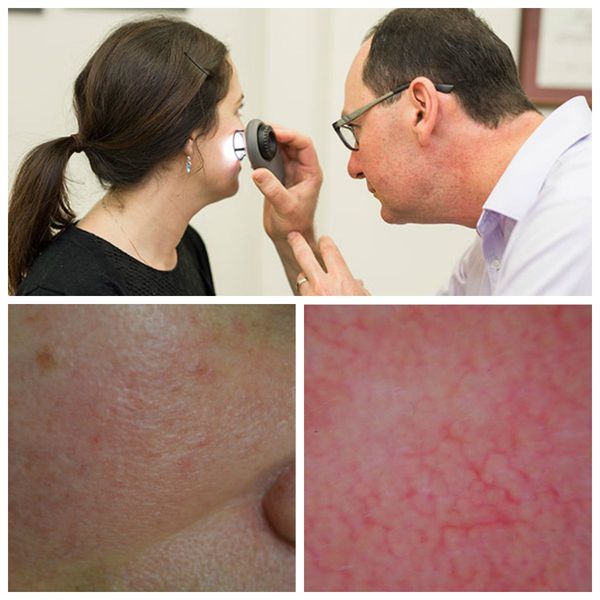
Далее врач назначает необходимые лабораторные и инструментальные исследования, чтобы выявить основное заболевание, ставшее причиной развития купероза :
- общий анализ мочи (ОАМ) — делается для определения функции почек;
- общий анализ крови (ОАК) с лейкоцитарной формулой — позволяет выяснить, какие нарушения есть в организме;
- биохимический анализ крови — также позволяет выявить изменения в организме, например в пищеварительном тракте или печени;
- анализы на свободный тироксин (Т4), тиреотропный гормон (ТТГ), прогестерон, тестостерон — обнаруживает гормональные нарушения;
- УЗИ щитовидной железы;
- УЗИ органов брюшной полости.
Все эти анализы обязательны, особенно для пациентов с тонкой чувствительной кожей. Они дают полную картину и позволяют назначить правильное лечение.
Лечение купероза
Лечение купероза должно быть направлено не только на устранение косметического дефекта, но и на борьбу с основным заболеванием, которое привело к поражению капилляров. Поэтому оно может потребовать участия не только дерматолога, но и других специалистов: эндокринолога, кардиолога, гастроэнтеролога или ревматолога.
В настоящее время существует много методов, которые помогают избавиться от купероза. Только врач может назначить то, что непосредственно подойдёт пациенту.
На ранних стадиях заболевания (I и II стадии) возможно амбулаторное лечение в виде мазей с флавоноидами (например, Троксевазин ), таблеток Аскорутин , а также витаминов группы С, Р. Они укрепляют стенки сосудов и препятствуют развитию рецидива [5] .
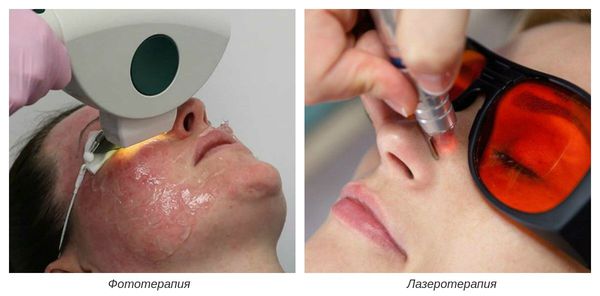
На III-IV стадиях болезни показано удаление расширенных сосудов при помощи аппаратных методов лечения. К ним относятся: электрокоагуляция, фототерапия, лазеротерапия и озонотерапия [10] .
- Электрокоагуляция — удаление повреждённых сосудов под воздействием электрического тока. Процедура безболезненная, её повторяют от 3 до 5 раз.
- Фототерапия — восстановление сосудов при помощи фотовспышек. Процедура выполняется с помощью аппарата, излучающего интенсивный импульсный свет (IPL).
- Лазеротерапия — сужение сосудов под воздействием лазерного луча [4] . Наиболее эффективным при куперозе является неодимовый лазер. Не повреждая кожу, он нагревает гемоглобин крови, тем самым как бы "запаивает" сосуд, и сосудистые звёздочки буквально исчезают.
- Озонотерапия — введение озоно-кислородной смеси в просвет повреждённого сосуда. Данная смесь обладает выраженным лечебным действием, улучшает кровообращение и ускоряет восстановление тканей.
Во время беременности лечение купероза проводят при необходимости, но только после 12-й недели, так как до 12-й недели идёт формирование плода [1] . Опасность связана с внешним и психологическим состоянием будущей мамы. Из-за постоянных стрессов понижается и без того ослабленный иммунитет. На этом фоне обостряются хронические нарушения, которые могут повлиять на формирование и развитие плода.
Беременным и кормящим противопоказана электрокоагуляция, фото- и лазеротерапия. Если во время беременности купероз возник на фоне розацеа, то не рекомендуется принимать изотретиноин и тетрациклин, так как эти препараты негативно влияют на плод [11] .
Прогноз. Профилактика
Обращая внимание на кожу, зная симптомы заболевания, можно на ранних стадиях обратиться к специалисту и вовремя устранить купероз.
Прогноз зависит от причин, вызвавших расширение и ломкость сосудов. Если развитие купероза связано с хроническими заболеваниями, особенно розацеа, лечение будет наиболее длительным. Оно требует постоянного наблюдения у специалиста. При прекращении лечения или воздействии любого фактора риска возможны периоды обострения.
Чтобы не допустить развитие купероза, необходимо придерживаться несложных правил:
- отказаться от вредных привычек;
- придерживаться правильного питания;
- пересмотреть свой образ жизни;
- правильно ухаживать за кожей;
- избегать прямых солнечных лучей;
- использовать кремы с солнцезащитным фактором;
- летом с 12:00 до 17:00 не находиться на солнце;
- зимой использовать питательные кремы, которые противостоят воздействию внешних неблагоприятных факторов [5] .
При очищении кожи лица рекомендуется использовать специальные мягкие очищающие средства, которые предохраняют кожу от обезвоживания. Пользоваться мыльными пенками и мылом не желательно, так как они разрушают липидный слой, который защищает кожу от испарения молекул воды. Также нужно отказаться от использования губки, спонжа, щёточек, кисточек, пилингов, скрабов и средств, содержащих спирт. Они будут раздражать и сушить кожу [10] .
Умываться нужно только тёплой водой. Для снятия декоративной косметики с сухой кожи желательно использовать специальные сливки или молочко. В их составе содержатся масла, которые питают и увлажняют кожу.
Крема, в которых есть ланолиновая кислота, витамины группы С, К, Е, также питают кожу и укрепляют стенки кровеносных сосудов. Перед сном можно обработать кожу успокаивающей сывороткой.
Немаловажную роль в профилактике купероза играет питание. Еда должна быть богата витаминами:
- витамин Р содержится в моркови, гречке, красном болгарском перце, спарже и петрушке;
- витамин К — в шпинате, белокочанной капусте, петрушке, спарже, брокколи, сушеных специях, водорослях и листьях одуванчика;
- витамин С — в луке, цитрусовых, чёрной смородине и квашеной капусте;
- витамин D — в молочных продуктах;
- Омега-3 — в рыбных продуктах, особенно в рыбьем жире.
Пищу желательно готовить на пару или запекать. Также рекомендуется соблюдать водный режим: выпивать 1,5-2,0 литра воды в день. Можно пить зеленый чай. Вода должна быть негазированной, так как газированная вода усиливает кислотность слизистой желудка и рефлекторное расширение сосудов лица. То же самое происходит и при употреблении острой, солёной пищи, кофе и шоколада [10] .
Описаны подходы к лечению розацеа с использованием различных лекарственных средств и методов терапии, эффективность которых находится в прямой зависимости от длительности терапии и степени выраженности побочных эффектов. В этой связи лазеры и устройства с
Approaches to rosacea treatment were described, using different medications and therapeutic methods, whose efficiency directly depends on the therapy duration and degree of side effects intensity. In this connection lasers and devices with sources of light is the best choice.
.jpg)
Многочисленные способы лечения розацеа определяются разнообразием этиологических и патогенетических факторов, стадией, многообразием клинических форм заболевания. Терапия больных розацеа представляет трудную задачу, так как использование любого из предлагаемых в настоящее время методов лечения в виде монотерапии не приводит к полному выздоровлению, а оказывает лишь временный эффект. Наличие неясных до настоящего времени многих сторон этиологии и патогенеза розацеа, отсутствие надежных методов лечения делают проблему разработки новых подходов к терапии данной патологии крайне актуальной для современной дерматологии.
Терапевтическое действие одних средств направлено на редукцию воспалительных явлений, других — на коррекцию различных соматических нарушений со стороны пищеварительного тракта, центральной нервной системы, сосудистых реакций и т. д. [1]. Основное лечение предполагает устранение предрасполагающих и провоцирующих факторов, соблюдение диеты, фотопротекцию [2].
Классическая общая терапия розацеа включает антибиотики, метронидазол и наружную терапию. В период выраженного обострения присоединяют антигистаминные препараты. Однако до сих пор базисной терапией розацеа являются антибиотики, при этом тетрациклины остаются самыми эффективными антибактериальными препаратами в терапии данного дерматоза [3–6]. Лечение тетрациклинами, как правило, длительное — до 12 недель [3], что, несомненно, влечет за собой формирование побочных эффектов, таких как развитие кандидоза, нарушения пигментации кожи и зубов. В настоящее время используют антибиотики из группы макролидов — эритромицин, кларитромицин, джозамицин и т. д. [3, 7, 8].
Несмотря на спорный вопрос об этиологической роли Demodex folliculorum в патогенезе розацеа, прием метронидазола внутрь является неотъемлемой частью терапии розацеа [9]. Пероральное лечение метронидазолом составляет 4–6 недель, у некоторых больных до 8 недель, что также провоцирует побочные явления: тошноту, головные боли, сухость во рту, рвоту, крапивницу и т. д. Эффективной альтернативой является метронидазол в виде 1% геля, применяемого наружно [3, 4, 7, 10]. Хотя в отечественной дерматологии эти препараты широко назначаются в терапии розацеа, Управление по контролю качества пищевых продуктов и лекарственных средств (FDA, the Food and Drug Administration) в США их применение не санкционировало. Считается, что Demodex spp. выживают в условиях даже высоких концентраций метронидазола [11].
Развитие устойчивости бактериально-паразитарной флоры к препаратам имидазольной группы и антибиотикам тетрациклинового ряда приводит к необходимости совершенствования методов лечения и поиска новых лекарственных средств. В последнее время для лечения тяжелых форм розацеа применяют синтетические ретиноиды. Высокая терапевтическая эффективность препарата связана с влиянием на процессы дифференцировки и кератинизации клеток эпидермиса и сальных желез. Длительность лечения изотретиноином в среднем составляет 4–6 месяцев [12]. Данный препарат обладает побочными эффектами, главный из которых — тератогенное действие. Местное использование синтетических ретиноидов исключает развитие их системных побочных явлений, однако также вызывает сухость кожного покрова, шелушение, зуд [3–7, 11, 13]. Последние исследования указали на увеличение длительности ремиссии на 20% у пациентов с розацеа, принимавших изотретиноин, по сравнению с пациентами, получавших комплексное лечение (метронидазол и доксициклин) [14].
Традиционно местная терапия розацеа состоит из холодных примочек с антисептическими растворами (1–2% раствор борной кислоты, 1–2% раствор резорцина, отвар ромашки и т. д.), мазей, паст или кремов с противодемодекозным эффектом [1, 3].
Современные топические препараты используются в основном в виде кремов, содержащих азелаиновую кислоту, метронидазол 0,75% и 1%, адапален 0,1% и гель с метронидазолом 1% [1, 3, 4]. Некоторые авторы настаивают на особой эффективности азалаиновой кислоты в лечении розацеа [10]. Однако данное заявление также оспаривается. По мнению A. Parodi et al. (2011) и B. A. Yentzer et al. (2010), монотерапия азелаиновой кислотой без применения пероральных антибиотиков ведет к хронизации процесса и отсутствию видимого эффекта [8, 15]. Наиболее оптимальным является комплексное применение азелаиновой кислоты, доксициклина (или клиндамицина) и метронидазола [8, 11, 16].
Как показывают различные исследования отечественных и зарубежных ученых, значительного повышения эффективности терапии можно ожидать при использовании комбинированных методов терапии, сочетающих медикаментозные и физиотерапевтические методы лечения.
Физиотерапевтическими методами, используемыми в терапии розацеа, являются криотерапия, электрофорез, деструктивные методики.
Криотерапию проводят через день или ежедневно до глубокого отшелушивания. Метод показан больным независимо от стадии заболевания. Криотерапия оказывает противовоспалительное, сосудосуживающее, антипаразитарное действие [4, 7]. Клинические рекомендации также включают электрофорез (10–30% раствором ихтиола 2–3 раза в неделю, с лидазой 2–3 раза в неделю, 10–15 сеансов) [4].
В лечении папулопустулезной, кистозной и узловатой форм розацеа показаны деструктивные методики, такие как электрокоагуляция, дермабразия. Данные методы, к сожалению, имеют ряд недостатков: послеоперационное инфицирование, лейкодерма, формирование эпидермальных кист и рубцов [3, 4, 7].
В последние годы наиболее успешными считаются комбинированные методы лечения. Например, некоторые исследователи с успехом применили сочетание изотретиноина и дермабразии с хорошим результатом [5]. Эффективным является совмещение различных наружных препаратов, таких как азалаиновой кислоты, метронидазола и клиндамицина [11].
Однако все эти методы постепенно теряют свою актуальность не только в связи с имеющимися побочными эффектами, но с низкой эффективностью по сравнению с лазерным излучением [19].
Одним из наиболее значимых научных достижений практической медицины ХХ века стало образование самостоятельного направления — лазерной медицины. Первые исследования по практическому применению лазерного излучения посвящены различным областям хирургии, где лазерные устройства использовались как универсальные деструкторы и коагулянты. Открытие биохемилюминесценции дало предпосылку для развития нового направления лазерной медицины — терапевтического влияния низко- и высокоэнергетического лазерного излучения на клеточные и внутриклеточные процессы. Достижения науки позволили обосновать не только симптоматическое, но и патогенетическое применение лазера в терапии кожных заболеваний [2]. До появления лазерной терапии возможность улучшить состояние кожи лица у больных с розацеа была весьма ограничена. Так, для лечения телеангиэктазий лица применялись в основном электрокоагуляция и криотерапия. Однако эти методы характеризуются риском развития различных осложнений (гиперпигментаций, атрофий) и высокой частотой рецидивов [10, 19, 20]. Поэтому на сегодняшний день, по мнению большинства авторов, лазеротерапия — метод, обеспечивающий наиболее эффективный и продолжительный результат лечения розацеа [2–5, 7, 11, 19, 20].
В зависимости от энергетических характеристик лазера выделяют низкоэнергетические с плотностью мощности менее 100 мВт/см 2 и высокоэнергетические лазеры с плотностью мощности более 10 Вт/см 2 . От мощности лазера напрямую зависят фотобиологические эффекты, которые он вызывает. Низкоинтенсивное лазерное излучение (НЛИ) сопряжено с фотохимическими реакциями.
Фототермические эффекты высокоинтенсивного лазерного излучения (ВЛИ) вызывают локальную деструкцию ткани в виде фотодинамического действия, фотокоагуляции или фотоабляции [2].
Избирательное фототермическое или фотоакустическое действие ВЛИ объясняется теорией селективного фототермолиза (СФТ), согласно которой для повреждения или разрушения целевого хромофора необходимо, чтобы коэффициент поглощения мишени и окружающей ткани максимально различался, а продолжительность импульса была меньше или равна времени термической релаксации [2].
Открытие СФТ обосновало воздействие на специфические хромофоры кожи без повреждения окружающих структур путем подбора соответствующей длины волны, длительности импульса и плотности энергии. Таким образом, параметры лазерного излучения могут быть оптимизированы таким образом, чтобы точно воздействовать на ткань-мишень с минимальным сопутствующим повреждением других тканей. Хромофором, на который направлено воздействие при лечении сосудистых образований, является оксигемоглобин [19]. Наибольшее поглощение излучения оксигемоглобином происходит при длине волны 18, 542, 577 нм. В результате поглощения оксигемоглобином лазерного излучения сосуд подвергается воздействию энергии и коагулируется [19].
Для лечения сосудистой патологии кожи применялись с той или иной степенью эффективности и безопасности различные виды лазеров. Первым большим достижением лазеротерапии сосудистых образований было создание в 1970 году аргонового лазера с длиной волны 488 и 514 нм. К сожалению, использование лазерной установки, генерирующей непрерывное излучение, вызывало коагуляционный некроз поверхностных слоев кожи, что часто вело к последующему образованию рубцов и депигментации [19].
Современные авторы для лечения телеангиэктазий лица предлагают использовать в основном длинноволновые (577 и 585 нм) лучи [3, 4, 7] и импульсный лазер на красителях (ИЛК) (585 нм) с низкой плотностью энергии 1,5 Дж/см 2 или 3,0 Дж/см 2 . За один сеанс осуществляют один проход, процедуры проводят один раз в неделю, на курс 3–4 сеанса [2, 5, 21]. Несмотря на то, что длина волны 595 нм лучше проникает в ткани по сравнению с 585 нм, степень поглощения излучения оксигемоглобином уменьшается после 585 нм. Поэтому для увеличения глубины проникновения ИЛК с длиной волны 595–600 нм требуется дополнительное повышение плотности потока излучения на 20–50% по сравнению с ИЛК с длиной волны 585 нм [19]. Улучшение очищения кожи лица от телеангиэктазий и уменьшение выраженности эритемы могут быть достигнуты наложением импульсов с меньшей плотностью светового потока, но с большей длительностью, что позволяет также избежать появления пурпуры после лечения. По данным Голдберга Дж. (2010) степень очищения кожи после одного сеанса лечения увеличилась с 67% при использовании неперекрывающихся импульсов до 87% после применения методики наложения импульсов [19]. Осложнения после лечения ИЛК, такие как гиперпигментация, атрофия, гипертрофический рубец, экзематозный дерматит, встречаются крайне редко [19]. Последние исследования доказали терапевтическую результативность ВЛИ с длиной волны 578 нм, которая составляет при эритематозно-телеангиэктатической форме 88%, при папулезной — 83,7%, при пустулезной — 76,3%, при инфильтративно-пролиферативной — 62,7%. Отдаленные результаты данного исследования показали, что спустя три года достигнутый эффект в среднем сохраняется у 21% пациентов [22].
Однако, как считают Потекаев Н. Н. и Круглова Л. С. (2012), при преобладании в клинической картине телеангиэктазий показан метод лазерной бесконтактной коагуляции с помощью диодного или неодимового лазера [2, 23]. По мнению авторов, в лечении розацеа также эффективны генераторы интенсивного импульсного света (Intense Pulsed Light, IPL) c длиной волны 500–1200 нм и максимумом эмиссии в диапазоне 530–700 нм. При поверхностных телеангиэктазиях диаметром до 0,3 см действенный эффект отмечен при длине волны 530–600 нм (желто-зеленый спектр) [2, 21]. Имея широкий диапазон длины волны, излучение способно достигать сосуды-мишени, расположенные на различной глубине от поверхности кожи. Несмотря на то, что излучение с большой длиной волны проникает глубже, уровень поглощения энергии оксигемоглобином уменьшается. Поэтому для компенсации снижения абсорбции энергии требуется увеличение плотности потока излучения, что и применяется в данном типе устройств. Таким образом, эффективно нагреваются как поверхностные, так и глубоко расположенные сосуды, размер пятна, образуемого излучением, также достаточно велик. Другим вероятным преимуществом IPL является то, что энергия лазерного излучения доставляется к ткани-мишени с помощью импульса большей длительности. Это ведет к более равномерному нагреванию, коагуляции всего патологически измененного сосуда [19, 21, 23].
Лазеры на парах тяжелых металлов также успешно использовались для лечения телеангиэктазий, однако в данном случае энергия лазерного излучения поглощается не только оксигемоглобином, но и меланином, содержащимся в эпидермисе и дерме. Поэтому лазеры на парах металлов применяются для лечения пациентов только со светлой кожей (тип I и II по Фитцпатрику). У пациентов с темной кожей высок риск нарушений пигментации, появляющихся вслед за воспалительной реакцией, как правило, это образование пузырей и струпа [19, 23].
Другие системы, использующиеся для лечения сосудистых образований, это калий-титанил-фосфатный (КТФ) лазер, длинноимпульсный лазер на алюмоиттриевом гранате с неодимом (Nd: YAG), длинноимпульсные лазеры на александрите (755 нм) и диодные лазеры (800, 810, 930 нм). КТФ-лазер — это Nd: YAG-лазер с удвоением частоты, генерирующей излучение в диапазоне 532 нм (зеленый свет). Длина волны 532 нм приближается к одному из пиков поглощения излучения гемоглобином, поэтому хорошо подходит для лечения поверхностно расположенных кровеносных сосудов [19, 21]. На длине волны 1064 нм Nd: YAG-лазер позволяет намного глубже проникнуть в дерму. При этом может быть достигнута коагуляция кровеносных сосудов на глубине 2–3 мм от дермоэпидермального соединения. Это позволяет иметь в качестве цели более глубокую сосудистую сеть, которую ИЛК может быть не в состоянии достигнуть. Эти глубокие крупные кровеносные сосуды обычно требуют продолжительности импульса между 3 и 15 мс. Так как абсолютное поглощение гемоглобина на 1064 нм ниже, чем на 585 нм, с этой длиной волны должны использоваться значительно более высокие плотности потока. Вследствие этого для данного лазера охлаждение стоит на первом месте [20, 23].
Длинноимпульсные лазеры на александрите (755 нм) и диодные лазеры (800, 810, 930 нм) генерируют излучение с большей длиной волны, которое соответствует области минимального поглощения гемоглобином, что делает их теоретически более подходящими для лечения крупных, глубоко расположенных сосудов диаметром 0,4 мм [19].
По мнению Дж. Голдберг (2010) в терапии лазером розацеа определенные трудности представляют сосудистые образования крыльев носа. Для удаления телеангиэктазий в этой области необходимо многократное проведение лечебных сеансов и, возможно, повторного курса лечения в будущем [19]. Эритема лица поддается лечению одинаково хорошо как с использованием ИЛК, так и c IPL [10, 20].
Современная лазерная терапия стоит на пороге комбинаций различных лазерных методов в лечении дерматозов. Оптимизировать клинический результат и уменьшить риск побочных эффектов возможно при сочетанном применении фракционного неселективного лазера и IPL; углекислотного (СО2) лазера и радиочастотной (Radio Frequency, RF) технологии, лазера и фотодинамической терапии (ФДТ) [24, 25].
На сегодняшний день одним из самых дискутируемых вопросов является применение лазерной ФДТ. Прежде всего это обусловлено ограниченным числом исследований с достаточной доказательной базой эффективности ФДТ в лечении злокачественных и доброкачественных новообразований кожи. Терапевтическое действие ФДТ основывается на фотохимических реакциях, происходящих при взаимодействии порфиринов, лазерного излучения и кислорода. В данном случае лазер является активатором фотохимических процессов в клетках и не вызывает фототермического повреждения. Для ФДТ может применяться любой лазер с длиной волны 400–800 нм [2]. Однако данный метод тоже не лишен недостатков. Побочные эффекты проявляются в виде фототоксических реакций в виде эритемы, отека, корочек, эрозий, везикул, что, как правило, наблюдается у большинства пациентов и носит проходящий характер. Из отдаленных последствий терапии отмечают возможное возникновение гиперпигментаций на месте проведения ФДТ [2].
При инфильтративно-продуктивной стадии розацеа показаны деструктивные методы, поскольку имеющиеся ультраструктурные изменения в системе микроциркуляторного русла кожи лица носят необратимый характер. В этой ситуации назначают лазерную абляцию с целью удаления гипертрофированной ткани, например при ринофиме [5]. Абляцию проводят до достижения уровня сальных желез. При этом возможно использование импульсного СО2-лазера или фракционного эрбиевого (Er: YAG) лазера с модулированным импульсным режимом [2]. Применение данных типов лазеров остается «золотым» стандартом аблятивных процедур, являясь альтернативой традиционному хирургическому подходу к этой проблеме [5, 7]. Однако при лечении СО2- или Er: YAG-лазером наблюдается длительное заживление раневого дефекта и повышается риск развития таких явлений, как замедленная реэпитализация, стойкая эритема, гипопигментация кожи, а в некоторых случаях — формирование гипертрофических и келоидных рубцов [26].
При всех формах розацеа показаны курсы низкоэнергетического лазерного воздействия, которое проводят через день (6 процедур), среднее время воздействия составляет 25 минут [2].
Таким образом, несмотря на некоторые ограничения, лазеры и устройства с источниками света остаются наилучшим выбором в лечении сосудистых поражений кожи [10, 20].
Несмотря на то, что в настоящее время существует обширный арсенал лекарственных средств и методов терапии розацеа, эффективность лечения находится в прямой зависимости от длительности терапии и степени выраженности побочных эффектов. Постоянный поиск оптимального подхода к терапии данного дерматоза привел к достижениям в области лазерных технологий, позволивших сделать огромный шаг в этом направлении.
Литература
И. Я. Пинсон*, доктор медицинских наук, профессор
И. В. Верхогляд**, доктор медицинских наук, доцент
А. В. Семочкин***
*ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России,
**ГБОУ ДПО РМАПО Минздравсоцразвития России,
***Клиника «Президентмед», Москва
Читайте также:

