Лучевая терапия при папилломе
Обновлено: 27.04.2024
Папилломатоз — общее название для патологического процесса, характеризующегося образованием множественных папиллом на участке кожи или слизистых оболочек различных органов. Папиллома являет собой доброкачественное новообразование, развивающееся из плоского или переходного эпителия, возвышающееся над ним и имеющее форму сосочка.
Причины развития папилломатоза
В большинстве случаев папилломы имеют вирусную этиологию. Возбудитель заболевания — ДНК-содержащий вирус папилломы человека (ВПЧ) семейства паповавирусов. К настоящему времени определено около 100 типов этого вируса, многие из которых обладают различным по степени риска потенциалом к онкогенности.
Вирус может передаваться от человека к человеку контактным (в том числе половым) путём; установлено, что один из путей заражения вирусом — передача от матери плоду в течение беременности или во время родов, что обуславливает появление папилломатоза и у детей младшего возраста.
Чаще всего инфицирование ВПЧ приводит к бессимптомному носительству, но в ситуациях, когда иммунитет снижается (после длительной болезни, в стрессовых ситуациях, при авитаминозе, при беременности, в случае приёма определенных лекарств, например, глюкокортикостероидов), возникает непосредственное клиническое проявление в виде папиллом.
Помимо вирусной причины, папилломатоз может быть следствием хронических воспалительных процессов. Интересно отметить, что в отдельных ситуациях при выявлении папилломатоза не выявляется признаков вирусного инфицирования, что побуждает к поиску иных причин развития данного заболевания.
Отдельные виды папилломатоза
Папилломы могут поражать кожу и слизистую оболочку практически любого внутреннего органа. Ниже приведены описания отдельных видов папилломатоза в зависимости от того, какая часть тела поражена.
Папилломатоз гортани
Вызывается преимущественно ВПЧ 6 и 11 типов, менее распространены типы 16, 18. Частота встречаемости паппиломатоза гортани в популяции — 2 на 100 000 среди взрослых и 4 на 100 000 среди детей.
Характерными симптомами являются охриплость голоса и нарушения дыхания. Несмотря на то, что папилломатоз гортани является доброкачественным заболеванием, возможны такие серьезные осложнения, как стеноз гортани, распространение папиллом на трахею и бронхи с последующим развитием лёгочной недостаточности, а также перерождение в злокачественную опухоль, особенно если папилломатоз вызван вирусом ВПЧ 16 или 18 типа, у которых высокий уровень потенциальной онкогенности.
Кроме того, папилломатоз гортани может рецидивировать; выделяют «агрессивный» и «неагрессивный» типы рецидивирования. К агрессивному типу относится папилломатоз, по поводу которого проведено 10 и более операций, или более трех операций за год, или при распространении процесса на подголосовой отдел гортани.
Вестибулярный папилломатоз
Этот термин применяется для обозначения мелких паппиломовидных образований преддверия влагалища. Встречается довольно часто у женщин в возрасте до 30 лет и становится показанием к обследованию слизистых влагалища и шейки матки, в том числе и на предмет наличия вируса папилломы человека, так как может сочетаться с поражением шайки матки, хотя сам по себе вестибулярный папилломатоз может и не иметь вирусной природы.
Вестибулярный папилломатоз часто может развиваться без клинических симптомов и обнаруживается при осмотре у гинеколога с профилактической целью или по поводу иных жалоб, но может и проявляться белями, болями и жжением в области вульвы, явлениями диспареунии, сочетаться с локальным воспалительным процессом.
Вестибулярный папилломатоз, в отличие от поражений шейки матки, склонен к рецидивированию — по данным литературы, частота рецидивов составляет до 17%. Обычно рецидивы характерны при инфицировании папилломавирусном низкого онкогенного риска.
Папилломатоз кожи
Папилломатозом кожи называют разрастания многочисленных кожных новообразований на ограниченном участке. Папиллома образуется при разрастании верхнего слоя кожи — эпидермиса. Обычно кожные папилломы имеют размер 5–7 миллиметров, реже до 2 сантиметров. Форма варьирует от точечного или немного свисающего выроста кожи до горошины. Цвет папилломы чаще неотличим от цвета окружающего кожного покрова, но может быть и белого или коричневого цвета. Обыкновенные папилломы чаще всего локализуются на коже спины, ладоней и пальцев рук, подошв и стоп, нитевидные папилломы — в местах с тонкой кожей (веки, шея, подмышечные и паховые области).
Обычно имеет бессимптомное течение и являет собой преимущественно косметический дефект, однако папилломы кожи могут часто травмироваться, что может привести к развитию воспаления или быть фактором риска их озлокачествления.
Особого внимания заслуживает карциноидный папилломатоз кожи Готтрона — редкое предраковое заболевание, характеризующееся специфическими разрастаниями эпидермиса. Основным фактором его возникновения является предрасположенность к развитию множественного поражения кожи папилломами; среди прочих факторов риска следует упомянуть регулярную травматизацию кожных покровов, хронические заболевания кожи, нарушения кровообращения. При данном заболевании очаги расположены симметрично на голенях, чаще на передней поверхности, на фоне длительно существовавшего поражения кожи, имеют вид выступающих над поверхностью на 1–1,5 см папилломатозных бородавчатых разрастаний и вегетаций в виде бляшек значительного размера. Бороздки между очагами заполнены желтовато-белыми липкими массами с неприятным запахом, на некоторых участках они ссыхаются в желтовато-серые корки. Иногда возникают эрозии, поверхностные язвы, легко кровоточащие грануляции. В силу высокого риска озлокачествления (стоит отметить, что ряд авторов приравнивает карциноидный папилломатоз к высокодифференцированному плоскоклеточному раку кожи) данное заболевание требует консультации и лечения у онколога.
Папилломатоз пищевода
Является редкой патологией — согласно данным литературы, его частота составляет всего 4,5%. Папилломы имеют вид полиповидного или листовидного образования белесоватого цвета, размером обычно до 1 см. Характерна локализация поражений в дистальных отделах пищевода. Хотя основной причиной развития данной патологии считается наличие папилломовирусной инфекции, по данным ряда авторов, папилломатоз пищевода встречается и при отсутствии вирусной контаминации. Кроме того, отмечается связь между развитием папилломатоза и гастроэзофагеальным рефлюксом, который в силу длительного воздействия соляной кислоты, содержащейся в желудочном соке, приводит к повреждению и хроническому воспалению слизистой пищевода.
Папилломы пищевода могут долгое время не проявлять себя никакой симптоматикой, но по мере их роста могут появляться следующие жалобы: затрудненное глотание, легкая или умеренная боль за грудиной, отрыжка, тошнота.
В настоящее время считается, что папилломы пищевода являются предраковым заболеванием, и именно папилломатоз в силу распространённости поражения слизистой оболочки пищевода обладает наибольшим риском малигнизации, поэтому выявление папиллом пищевода — это показание к хирургическому лечению.
Внутрипротоковый папилломатоз
Под данным термином понимают папилломы, расположенные в млечных протоках молочной железы. Папилломы могут возникать как в периферических протоках любого квадранта молочной железы, так и в протоках, расположенных сразу за соском. Периферический папилломатоз представлен обычно мелкими, до 1 см, образованиями. В отдельных случаях внутрипротоковые папилломы могут иметь гигантский (более 5 см) размер, в этом случае они значительно деформируют молочную железу. По мере роста папилломы в просвете возникает механическое расширение протока, что может являться причиной развития болевого синдрома.
Внутрипротоковые папилломы могут развиваться в любом возрасте, но чаще возникают в возрасте 35–55 лет. Факторами риска их образования считаются приём оральных контрацептивов и препаратов заместительной гормональной терапии, семейный анамнез, эндокринологические нарушения, наличие хронических воспалительных процессов придатков. Наиболее частым симптомом является появление выделений из соска, не связанных с лактацией, янтарного цвета или с примесью крови. Кроме того, в связи с ростом папиллом может появиться болезненность, становится возможным пропальпировать уплотнения в молочной железе.
Внутрипротоковый папилломатоз требует хирургического лечения в объёме резекции поражённого квадранта или же, в случае значительной распространённости процесса, радикальной мастэктомии, так как обладает значительным потенциалом к перерождению в протоковый рак.
Диагностика папилломатоза
Установить диагноз «папилломатоз» возможно даже при первичном осмотре поражённой области из-за типичного вида новообразований. Папилломы представляют собой мягкую плотную опухоль на ножке (реже на широком основании) размером около одного-двух сантиметров с неровной внешней поверхностью, цвет варьируется от белого до коричневого. В некоторых случаях папиллома может разрастаться и приобретать вид, напоминающий цветную капусту.
Применяемые инструментальные методы диагностики зависят от локализации папилломатоза. Так, при папилломатозе гортани показано проведение ларингоскопии, при поражении пищевода — ЭГДС, при локализации папиллом в протоках молочной железы — дуктография.
Для подтверждения вирусной природы папиллом и определения конкретного типа вируса используются лабораторные методики, позволяющие идентифицировать ДНК вируса — полимеразная цепная реакция (ПЦР), гибридизационные методы.
Наконец, в рамках комплексного лечения целесообразно оценить иммунный статус пациента с целью назначения медикаментозной терапии для профилактики рецидивирования папилломатоза.
Лечение папилломатоза
Основной метод лечения – хирургический. При всей эффективности традиционного хирургического иссечения папиллом существует риск рубцевания слизистой оболочки, поэтому в настоящее время широкое распространение получили не менее эффективные, но более щадящие методы лечения папилломатоза:
- Лазерное удаление
- Ультразвуковая дезинтеграция
- Радиочастотная холодная аблация
- Фотодинамическая терапия
- Электродеструкция
- Криодеструкция
- Диатермокоагуляция
- Удаление химическими агентами (солкодерм, подофиллин)
К сожалению, ни одна из вышеуказанных методик даже при условии полного и тщательного удаления папилломатоза не гарантирует отсутствия рецидива.
Поэтому при наличии факторов риска развития рецидива в послеоперационном периоде может быть назначена адъювантная лекарственная терапия, в рамках которой могут быть назначены следующие препараты:
- Препараты α-интерферона,
- Противовирусные препараты (ацикловир, рибавирин, цидофовир)
- Иммуностимуляторы (ликопид, галавит, циклоферон)
Также в настоящее время проводятся клинические исследования вакцины против вирусов папилломы человека в качестве противорецидивного средства.
Несмотря на обнадеживающие результаты, на данный момент применение вакцины для профилактики рецидивов у больных с уже выявленным папилломатозом стандартом лечения не является.
Профилактика
До недавнего времени наиболее эффективной профилактикой папилломатоза считалось предотвращение заражения папилломавирусной инфекцией, а также лечение сопутствующих хронических инфекционных заболеваний и скрининг, направленный на раннее выявление болезни. Сейчас возможно выполнение профилактической вакцинации. Вакцина направлена против четырех типов папилломавируса, которые имеют наибольшее клиническое значение и наибольший онкогенный риск. Вакцинация возможна как у детей для профилактики заражения этими типами вируса, так и у взрослых. Перед вакцинацией обследование на наличие вирусов папилломы не требуется, так как даже если человек уже заражен один из тех типов, на которые направлена вакцина, иммунопрофилактика убережет его от заражения остальными тремя.
Если папилломатоз уже диагностирован и подвергнут лечению, пациенты подлежат динамическому контролю. Так, больные папилломатозом гортани подлежат обязательной диспансеризации в зависимости от частоты рецидивирования заболевания, но не менее чем раз в три месяца. В случае вестибулярного папилломатоза, даже если доказано отсутствие связи его возникновения с папилломавирусной инфекцией, также требуется активное динамическое наблюдение.
Существует мнение, что практически все живущие ныне люди заражены минимум одним из типов вируса папилломы человека. Большинство являются здоровыми носителями, но проявления инфекции в виде папилломатоза может развиться у любого человека, неся с собой проблемы — от безобидного косметического дефекта до грозного риска развития злокачественной опухоли. Своевременное обращение к врачам «Евроонко» гарантирует решение этих проблем и предотвращение их дальнейшего усугубления.
Проблема лечения генитальных вирусных инфекций стоит в настоящее время наиболее остро. Исходя из биологии вирусов, эти инфекции наиболее трудно поддаются эпидемиологическому контролю и лечению. Среди вирусных инфекций, поражающих аногенитальную область,
Проблема лечения генитальных вирусных инфекций стоит в настоящее время наиболее остро. Исходя из биологии вирусов, эти инфекции наиболее трудно поддаются эпидемиологическому контролю и лечению. Среди вирусных инфекций, поражающих аногенитальную область, наиболее распространены герпетическая и папилломавирусная инфекция. Целью данной статьи является обзор современных консервативных методов лечения больных с аногенитальными поражениями, вызванными вирусом папилломы человека (ВПЧ-поражений).
К ВПЧ-поражениям относят (по J. Handley [1]): клинические формы — аногентальные бородавки (остроконечные кондиломы, вульгарные бородавки), симптоматические внутриэпителиальные неоплазии на ранних стадиях при отсутствии дисплазии (плоские кондиломы); субклинические формы — бессимптомные внутриэпителиальные неоплазии при отсутствии дисплазии; латентные формы (отсутствие морфологических или гистологических изменений при обнаружении ДНК ВПЧ).
Принципиально лечение аногенитальных ВПЧ-поражений направлено либо на разрушение папилломатозных очагов тем или иным методом, либо на стимуляцию противовирусного иммунного ответа, либо на сочетание этих подходов. Оптимальной представляется следующая классификация методов лечения аногенитальных бородавок.
I. Деструктивные методы
II. Цитотоксические препараты:
- подофиллин (ПФ);
- подофиллотоксин (ПФТ);
- 5-фторурацил.
III. Иммунологические методы:
IV. Комбинированные методы:
При выборе оптимальной лечебной тактики врач все чаще вынужден учитывать мнение представителей страховой медицины как в обязательном, так и в добровольном ее вариантах, поскольку оплата за диагностику и лечение зависит от тех стандартов, которые принимаются во внимание страховыми компаниями.
В связи с этим особую роль приобретают справочные руководства, в которых представлена официальная тактика лечения, одобренная Министерством здравоохранения. Сегодня одним из самых авторитетных справочных изданий такого типа является «Федеральное руководство по использованию лекарственных средств» (ФР), последнее, 4-е издание которого датируется 2003 г. К сожалению, этот справочник пока не содержит раздела, посвященного терапии папилломавирусной инфекции. Такая информация, по-видимому, будет присутствовать в российских стандартах по лечению ИППП, но они пока не изданы. Единственными руководствами для практикующих врачей, работающих в этой области, могут являться различные методические материалы, выпускаемые авторитетными учреждениями и организациями. К таким пособиям можно отнести «Методические материалы по диагностике и лечению наиболее распространенных инфекций, передаваемых половым путем (ИППП), и заболеваний кожи», изданные ГУ ЦНИКВИ в 2001 г. и «Методические материалы по диагностике и лечению наиболее распространенных инфекций, передаваемых половым путем (ИППП), и ассоциированных с ними заболеваний» Российской ассоциации акушеров и гинекологов, утвержденные в 2000 г. В этих руководствах для лечения ВПЧ-поражений рекомендуются физические и химические деструктивные методы, использование подофиллотоксина, а также комбинированные методы, основанные на сочетании деструкции поражений с системной и местной иммунотерапией.
Кроме упомянутых руководств при выборе наиболее оптимального метода в каждом конкретном случае врачу необходимо руководствоваться четырьмя основными характеристиками:
- эффективностью при данной патологии;
- частотой рецидивов после лечения;
- переносимостью (минимум побочных эффектов);
- простотой выполнения процедур.
Физические деструктивные методы
Основным отличием этих методов от остальных является то, что при их применении происходит быстрое, как правило, одномоментное разрушение поражений. При использовании других методов очаг поражения подвергается воздействию, и необходимо время — от нескольких часов до нескольких недель, — чтобы поражения ликвидировались. Как правило, этот период сопоставим со временем заживления очагов после воздействия физических методов. Частота рецидивов, по данным литературы, не зависит от выбора метода лечения. Таким образом, очевидные, казалось бы, преимущества физических методов нивелируются. Для применения физических деструктивных методов необходимы специальные помещения, дорогостоящее оборудование, обученный персонал, имеющий сертификаты на данный вид медицинской деятельности. Все это ограничивает использование данных видов лечения в широкой практике, особенно в условиях небольших медицинских центров или в районах, где имеются лишь дерматовенерологический, гинекологический или урологический кабинет в поликлинике. Поэтому особый интерес представляют консервативные методы лечения, доступные для применения любому практикующему врачу.
Химические деструктивные методы
Применяются концентрированные растворы кислот, щелочей, солей и др. Среди таких препаратов можно упомянуть ферезол, перекись водорода, растворы акрихина и хингамина, препараты на основе салициловой и молочной кислот, уксусную и азотную кислоту, соки туи и чистотела. Все эти лекарственные средства обладают невысокой, плохо прогнозируемой эффективностью, многочисленными побочными эффектами. Упорядоченных данных относительно действенности этих препаратов немного. Среди применяемых в нашей стране и за рубежом химических препаратов, обладающих деструктивным действием, о которых достаточно данных в литературе, можно выделить трихлоруксусную (ТХУ) кислоту и азотную кислоту, а также комбинированный кислотный препарат — солкодерм.
Трихлоруксусная и азотная кислоты
ТХУ кислота применяется в концентрации 80—90% и вызывает образование локального коагуляционного некроза. Таким же действием обладает раствор азотной кислоты. Из-за своей дешевизны и доступности метод применяется довольно широко. Кислоты эффективны для лечения кондилом вульвы, крайней плоти, венечной борозды и головки полового члена, особенно в случаях, когда противопоказано применение цитотоксических методов и лазера (например, во время беременности). Препараты обычно не рекомендуются для лечения вагинальных и уретральных бородавок. Прижигания проводят один раз в неделю в течение пяти-шести недель. Эффективность ТХУ и азотной кислот составляет примерно 70–80%. У 1/3 больных может развиваться местная реакция в виде мокнутия и изъязвлений.
Солкодерм
Солкодерм — это водный раствор, в качестве активной составляющей которого выступают продукты взаимодействия органических кислот (уксусной, щавелевой и молочной) и ионов металлов с азотной кислотой.
Представленные ниже свой-ства и механизм действия солкодерма выделяют его среди других деструктивных методов: при местном применении солкодерм вызывает немедленную прижизненную фиксацию ткани, на которую он наносится; действие препарата строго ограничивается местом применения; признаком немедленного эффекта является изменение окраски обрабатываемого участка; девитализированная ткань высыхает и темнеет (мумифицируется); «мумифицированный» струп отторгается самостоятельно; процесс заживления непродолжителен, а осложнения (вторичная инфекция или рубцевание) редки. Лечение практически безболезненно и проводится амбулаторно, так как не требует специальной аппаратуры.
Солкодерм высокоэффективен для лечения остроконечных кондилом любой локализации, в большинстве случаев достаточно однократного применения.
Цитотоксические препараты
Подофиллин
Подофиллотоксин
Для ПФТ показатель эффективности составляет 26—87% у мужчин и 50—77% у женщин. Столь большой разброс в показателе эффективности связан с различным сроком наблюдения за больными, а также с тем, что в некоторых работах авторы не учитывают рецидивы. По данным Hendley, полное исчезновение бородавок наблюдается только в 30—40% случаев, по данным Bonnez — только у 29% больных, по данным Wang — у 86,5%, по данным Kinghorn et al. — у 86% мужчин и 72% женщин. По данным Syed, рецидивы наблюдаются в 5,5% случаев при применении раствора 0,3% и крема и в 51% — при использовании кремов 0,3% или 0,5%, по данным von Krogh, при использовании раствора 0,5% — в 38% случаев, по данным Wang — у 17% больных, по данным Hellberg — у 23% (при использовании крема 0,5%).
Наиболее частыми побочными эффектами ПФТ являются местные воспалительные реакции (у 57% пациентов), эритема, жжение (у 48%), болезненность (у 47%), зуд (у 44%), незначительное мокнутие и эрозии в области аппликации (у 39%). Хотя и не было описано системных побочных эффектов, рекомендуется ограничивать применение ПФТ в количестве 0,2 мл за одну процедуру.
Handley считает ПФТ препаратом выбора для самостоятельного применения больными с небольшим количеством неороговевающих кондилом, располагающихся на крайней плоти, головке полового члена, в венечной борозде и вульве. Препарат малоэффективен при лечении бородавок перианальной области, влагалища и уретры.
Недостатками ПФТ являются его высокая стоимость, большая длительность лечения при не самой высокой эффективности.
5-фторурацил
5-фторурацил (5-ФУ) является антагонистом пиримидина и способен нарушать синтез как клеточной, так и вирусной ДНК. Для лечения бородавок аногенитальной области его назначают в виде крема 5%. По мнению Handley, 5-ФУ — это эффективный метод лечения интравагинальных бородавок и кондилом терминальной части уретры. При лечении интравагинальных бородавок препарат назначается один раз на ночь в течение недели или один раз в неделю в течение 10 недель. Хотя препарат при такой схеме лечения обладает достаточно высокой эффективностью (85—90%), при его применении могут возникать мокнущие эрозии на слизистой влагалища, вплоть до развития тяжелого мокнущего контактного дерматита.
При лечении бородавок терминальной части уретры крем вводится сразу после мочеиспускания, на ночь, в течение трех—восьми дней. Полное излечение внутриуретральных бородавок наблюдается у 90—95% мужчин. Однако так же, как в случае с женщинами, при лечении мужчин наблюдается множество побочных эффектов: стеноз и стриктуры уретры, дизурия, изъязвления.
Несмотря на достаточно высокую эффективность 5-ФУ, доступность и дешевизну, его применение ограничено в широкой практике из-за высокой частоты побочных эффектов. Препарат противопоказан при беременности.
Одним из основных показателей эффективности любого метода является отсутствие рецидивов. Так как частота рецидивов ВПЧ-инфекции не зависит от метода деструкции поражений (физическая, химическая или цитотоксическая), то представляет интерес еще одна группа консервативных методов — это терапия иммунными препаратами, которые могут применяться самостоятельно или в комбинации с деструктивными методами.
Иммунологические методы
Интерфероны (ИФ)
Так как ВПЧ сохраняется в эпителиальных клетках и использование деструктивных методов не гарантирует от рецидивов, перспективным в этом плане является применение интерферонов как в качестве монотерапии, так и в комплексе с другими методами лечения.
ИФ представляют собой эндогенные цитокины, обладающие противовирусным, антипролиферативным и иммуномодулирующим действием. Существует три основных класса интерферонов: α-ИФ (лейкоцитарный), β-ИФ (фибробластный) и γ-ИФ (Т-лимфоцитарный). ИФ можно применять местно, внутриочагово и системно (подкожно, внутримышечно или внутривенно). Установлено, что при применении ИФ у пациентов в очагах поражения снижается количество вирусной ДНК (по данным ПЦР), что коррелирует с клиническим улучшением или исчезновением поражений.
В большинстве исследований была показана невысокая эффективность наружного применения ИФ. Некоторые авторы считают, что важным показанием для наружного применения ИФ является наличие субклинических очагов ВПЧ-инфекции и цервикальных внутриэпителиальных неоплазий (ЦВН), особенно вызванных типами ВПЧ высокого онкогенного риска.
По данным различных авторов, при системном применении α-ИФ в дозе от 1,5 до 3 млн МЕ внутримышечно или подкожно через день в течение четырех недель полное исчезновение бородавок наблюдается у 11—100% пациентов.
Из побочных эффектов при системном применении ИФ обычно наблюдаются гриппоподобные явления, выраженность которых зависит от полученной дозы. Эти побочные воздействия можно ослабить приемом нестероидных противовоспалительных препаратов.
Учитывая, что эффективность системной монотерапии ИФ все-таки недостаточно предсказуема и не очень высока, а также принимая во внимание высокую стоимость такого лечения, этот метод не получил широкого распространения в клинической практике.
На российском рынке сегодня представлен широкий выбор интерферонов различных производителей, как отечественных, так и зарубежных, — виферон, кипферон, реаферон, роферон-А, интрон А, реальдирон и т. д. Предпочтительнее сегодня использовать рекомбинантные, а не человеческие интерфероны.
Комбинированные методы
Более предпочтительным является применение ИФ или его индукторов, а также других активаторов противовирусного иммунитета, в качестве адъювантной терапии в комбинации с различными деструктивными методами. Иммунные препараты повышают эффективность лечения и позволяют снизить частоту рецидивов. Определенное значение комбинированная иммунотерапия имеет при лечении упорных, плохо поддающихся лечению бородавок. Для лечения предложены различные методики, основанные на применении иммунных препаратов в сочетании с криотерапией, лазеротерапией, электрокоагуляцией, солкодермом и т. д.
Так, например, выявлено, что сочетание ИФ с лазеротерапией более эффективно, чем только лазеротерапия: полное исчезновение бородавок наблюдается у 52–81,5% и 19–61% пациентов соответственно. СО2-лазерное иссечение в сочетании с терапией низкими дозами α-ИФ (по 1—3 млн МЕ в сутки в течение пяти—семи дней, затем перерыв три-четыре недели, таких три-четыре цикла) повышает эффективность лечения и позволяет снизить процент рецидивов, наблюдающихся после применения только лазеротерапии. При небольших остроконечных кондиломах дополнение лазерной терапии или электрокоагуляции местным применением геля, содержащего β-ИФ 0,1 млн МЕ/г пять раз в день в течение четырех недель эффективно предотвращает рецидивы.
Однако, по данным The Condylomata International Collaborative Study Group, применение α-ИФ (три раза в неделю в течение четырех недель) после удаления всех видимых кондилом СО2-лазером не дает каких-либо положительных результатов в сравнении с плацебо (полное излечение у 18%, рецидивы у 35% больных). Согласно M. R. Hopel соавт., сочетание α-ИФ (3—6 пятидневных курсов с интервалом в две недели) с деструктивными и/или хирургическими методами, несмотря на повышение эффективности лечения упорных, не поддающихся терапии кондилом, не предотвращает развитие рецидивов (они возникают у 50% больных).
При лечении кондилом заднего прохода предлагается сначала хирургическое удаление крупных образований, затем прижигание очагов эл/током и одна инъекция α-ИФ в дозе 500 тыс. МЕ в прямую кишку. Применение ИФ таким способом позволяет сократить число рецидивов (12% при применении ИФ, 39% — без ИФ).
Повысить эффективность лечения, воздействуя на противовирусный иммунитет, можно благодаря применению индукторов эндогенного интерферона и других активаторов иммунитета. На российском аптечном рынке представлено множество индукторов интерферона, в основном отечественных производителей; наиболее известные из них — гепон, ридостин, циклоферон, неовир — при системном и/или местном применении позволяют повысить эффективность лечения, воздействуя на частоту рецидивов. Так, например, аппликации гепона на очаги ВПЧ-поражений после их удаления каким-либо деструктивным методом (от трех до шести аппликаций через день) позволяют ускорить процесс заживления и снижают уровень рецидивирования.
Комбинированные методы терапии, основанные на сочетании деструкции видимых поражений с назначением активаторов противовирусного иммунитета (интерферонов, их индукторов, иммуномакса), наиболее соответствуют критериям выбора оптимального способа лечения — высокая эффективность и низкая частота рецидивов.
Таким образом, существует множество различных консервативных методов удаления аногенитальных бородавок. Эффективность методов, по данным разных авторов, варьирует от 50% до 94%. Ни один из способов лечения не может быть признан панацеей, так как частота рецидивов, являющаяся очень важным показателем любого метода, достаточно высока при любом способе лечения. Врач выбирает терапию в зависимости от сопутствующих обстоятельств, включая пожелания самого больного. Лечение должно быть индивидуальным: в каждом конкретном случае необходимо подбирать наиболее оптимальный метод. Проблема рецидивов не зависит от выбора терапии. Уровень рецидивирования составляет в среднем 25—30% в течение трех месяцев после лечения. Рецидивы аногенитальных бородавок чаще всего связаны с реактивацией инфекции, а не с реинфекцией от полового партнера. При отсутствии терапии существуют три варианта развития событий: бородавки могут разрешаться самостоятельно, оставаться без изменений или прогрессировать. При этом всегда нужно принимать во внимание возможность персистенции вируса при отсутствии каких-либо клинических проявлений.
При лечении аногенитальных бородавок кроме удаления самих очагов следует решать следующие важные задачи:
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисовой Элины Вячеславовны, гинеколога со стажем в 35 лет.
Над статьей доктора Борисовой Элины Вячеславовны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
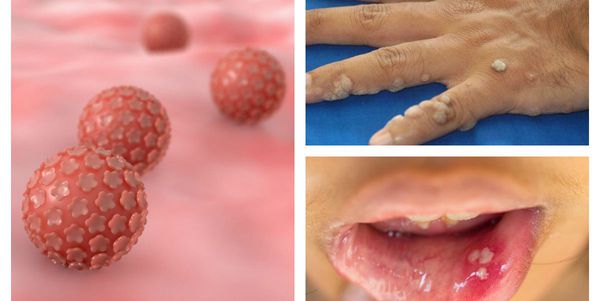
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
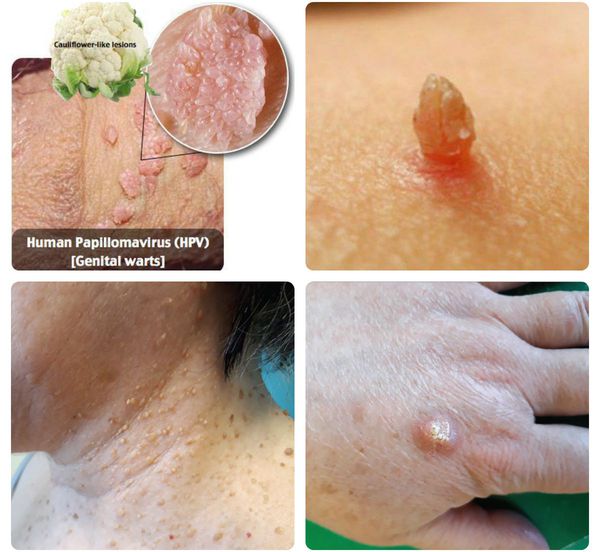
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
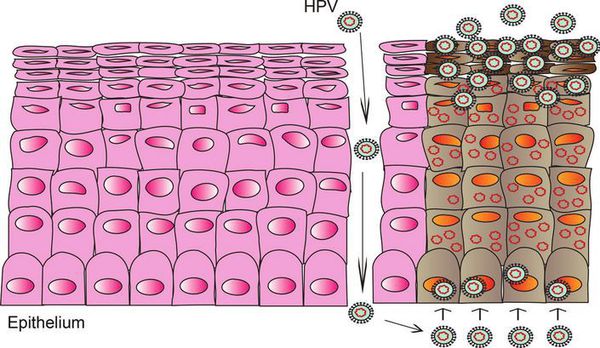
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
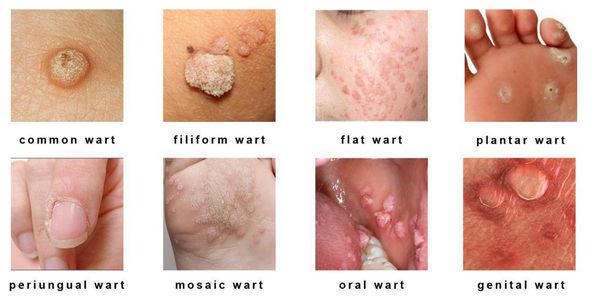
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
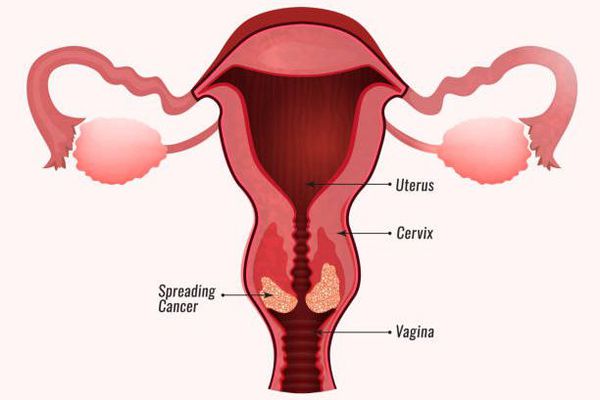
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
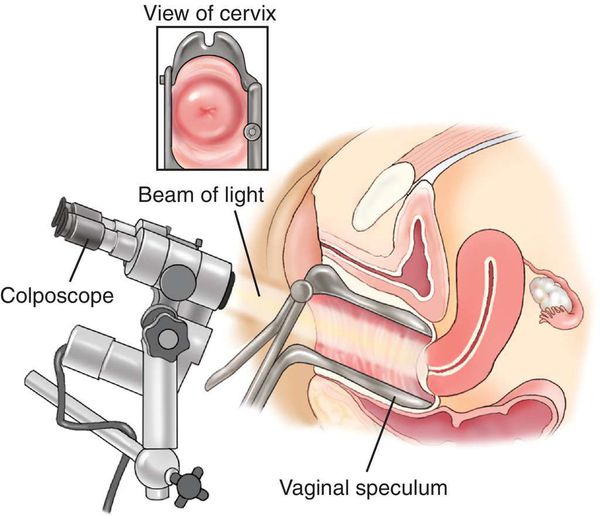
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Лучевая терапия — это один из ведущих методов противоопухолевого лечения, основанный на использовании ионизирующего излучения. Может применяться как самостоятельный вид терапии, так и в рамках комбинированного/комплексного лечения (совместно с другими методами), в качестве радикальной, нео- и адъювантной, консолидирующей, профилактической и паллиативной терапии.
Эффективность данного метода основана на повреждении ДНК. Существуют различные механизмы, позволяющие более эффективно разрушать опухолевые клетки в сравнении с нормальными. Во-первых, опухолевые клетки более активно делятся, соответственно, их ДНК чаще находится в «рабочем» режиме, когда она менее устойчива к воздействию ионизирующего излучения. По той же причине большая часть острых лучевых реакций представлена мукозитами, то есть воспалением слизистых, которым также свойственно активное деление. Во-вторых, окружающие здоровые клетки способствуют восстановлению поврежденных, подвергшихся лучевому воздействию. Поэтому важно сделать так, чтобы в объём облучения попало как можно меньше здоровой ткани. В-третьих, современное оборудование для лучевой терапии, управляемое командой грамотных специалистов, позволяет подвести максимально высокие дозы прямо в мишень, существенно снижая дозу ионизирующего излучения, приходящуюся к окружающим здоровым органам и тканям.

Виды лучевой терапии
Уже несколько десятилетий человечество изучает воздействие ионизирующего излучение на организм человека. При этом акцентируется внимание как на положительном, так и отрицательном эффекте, возникающем при его применении. Разрабатываются новые методы, которые позволяют добиваться максимального лечебного эффекта при снижении отрицательного действия на организм. Улучшается оборудование для проведения лучевой терапии, появляются новые технологии облучения.
Сейчас классификация методов лучевой терапии довольно обширна. Мы остановимся только на самых распространенных методиках.
Контактная лучевая терапия
При контактной лучевой терапии источник излучения вводится непосредственно в опухоль или прилегает к ее поверхности. Это позволяет прицельно облучать новообразование с минимумом воздействия на окружающие его ткани.
К контактным видам лучевой терапии относятся:
- Аппликационная лучевая терапия. Применяется при лечении поверхностно расположенных опухолей, например, новообразований кожи, слизистых оболочек гениталий. В этом случае используются индивидуально изготовленные аппликаторы, которые накладываются непосредственно на поверхность новообразования.
- Внутриполостная лучевая терапия. Источник ионизирующего излучения вводится в просвет полого органа, например, в пищевод, мочевой пузырь, прямую кишку, полость матки или влагалища. Для облучения используются специальные аппликаторы (их называют эндостатами), которые заполняются радионуклидами.
- Внутритканевое облучение. Источник ионизирующего излучения вводится непосредственно в ткань опухоли. Для этого используются интростаты, которые могут иметь вид игл, шариков, трубочек, заполненных источником излучения.
Кроме того, существует такой вид лечения, как радионуклидная терапия. В этом случае используются открытые источники излучения в виде растворов радионуклидов (радиофармацевтический препарат — РФП), которые при попадании в организм прицельно накапливаются в опухолевых очагах и уничтожают их. Чаще всего РФП вводится внутривенно. Наибольшее распространение получили следующие виды радионуклидной терапии:
- Терапия радиоактивным йодом. Используется для лечения ряда видов рака щитовидной железы, поскольку йод избирательно накапливается в тиреоидной ткани.
- Применение остеотропных РФП используется для лечения метастазов в костях или костных опухолей.
- Радиоиммунотерапия — радионуклиды присоединяют на моноклональные антитела, чтобы добиться прицельного воздействия на опухолевую ткань.
Дистанционная лучевая терапия
При дистанционной лучевой терапии источник излучения находится на расстоянии от тела пациента, при этом на пути его прохождения могут лежать здоровые ткани, которые в процессе проведения терапии также подвергаются облучению, что приводит к развитию осложнений разной степени выраженности. Чтобы их минимизировать, разрабатываются различные технологии, позволяющие сконцентрировать максимальную дозу ионизирующего излучения непосредственно на в мишени (опухоли). С данной целью используются:
- Короткофокусная рентгенотерапия. При облучении используется рентгеновское излучение малой и средней мощности, которое способно проникать в ткани на глубину до 12 мм. Метод назван так из-за того, что источник располагается на коротком расстоянии от облучаемой поверхности. Таким способом лечат неглубокие опухоли кожи, вульвы, конъюнктивы и век, ротовой полости.
- Гамма-терапия. Этот вид излучения имеет большую проникающую способность, поэтому может использоваться для лечения более глубоко расположенных опухолей, нежели рентген-терапия. Однако сохраняющаяся большая нагрузка на окружающие органы и ткани приводят к ограничению возможности использования данного метода в современной онкологии.
- Фотонная терапия. Именно этим видом излучения проводится лучевое лечение большинства онкологических пациентов в современном мире. Достаточно высокая проникающая способность в сочетании с высокотехнологичными способами подведения дозы (IMRT и VMAT), достаточно совершенные системы планирования позволяют очень эффективно использовать этот вид излучения для лечения пациентов с приемлемыми показателями токсичности.
- Применение корпускулярного излучения (электроны, протоны, нейтроны). Эти элементарные ядерные частицы получают на циклотронах или линейных ускорителях. Электронное излучение используют для лечения неглубоких опухолей. Большие надежды возлагаются на протонную терапию, с помощью которой можно максимально прицельно подводить высокие дозы излучения к глубоко расположенным опухолям при минимальном повреждении здоровых тканей за счет выделения радиационной дозы на определённом отрезке пробега частиц, однако пока эти виды излучения играют сравнительно небольшую роль в лечении онкологических заболевания из-за своей высокой стоимости и ряда не до конца решённых технологических аспектов реализации метода.
Этапы лучевой терапии
Весь процесс проведения лучевой терапии делят на три этапа:
- Предлучевая подготовка (КТ-симуляция), этап выбора объёмов облучения и критических структур, этап дозиметрического планирования, верификации плана лучевой терапии.
- Этап облучения.
- Постлучевой этап.
Этап планирования
Как правило, этап планирования занимает несколько дней. В это время проводятся дополнительные исследования, которые призваны дать возможность врачу более точно оценить границы опухоли, а также состояние окружающих ее тканей. Это может повлиять на выбор вида лучевой терапии, режима фракционирования, разовой и суммарной очаговых доз. Основой же данного этапа является выполнение так называемой КТ-симуляции, то есть компьютерной томографии необходимого объёма с определёнными параметрами и в определённом положении тела пациента. Во время КТ-симуляции на кожу пациента и/или его индивидуальные фиксирующие устройства наносятся специальные метки, призванные помочь правильно укладывать пациента в дальнейшем, а также облегчить задачу навигации по время проведения сеансов облучения.
Затем врач-радиотерапевт рисует объёмы облучения и критических структур (тех, на которые будет предписано ограничение дозы) на полученных срезах КТ с учётом данных других диагностических модальностей (МРТ, ПЭТ). Далее формируется задача для медицинского физика, включающая определение доз, которые должны быть подведены к мишени, мишеням или отдельным её частям, а также тех, которые не должны быть превышены в объёмах здоровых органов и тканей. Медицинский физик разрабатывает дозиметрический план в соответствии с заданными параметрами, при соблюдении которых и успешной верификации данного плана на фантоме, можно считать пациента готовым к лучевой терапии.
На этапе подготовки к лучевой терапии пациенту рекомендуется придерживаться нескольких правил:
- Отказаться от средств, раздражающих кожу.
- Если на коже в месте воздействия имеются повреждения или элементы сыпи, следует проконсультироваться с врачом.
- Если предполагается лучевая терапия в челюстно-лицевой области, требуется санация полости рта.
- Воздержаться от загара.
- Главное правило на любом этапе: обсудить все нюансы предстоящих подготовки и лечения с лечащим врачом-радиотерапевтом и строго придерживаться полученных рекомендаций!
Этап облучения
Проведение этапа облучения будет зависеть от выбранного метода лучевой терапии.
Проведение дистанционной лучевой терапии
Продолжительность курса дистанционной лучевой терапии зависит от выбранного режима фракционирования, а также цели лечения. Паллиативные курсы, как правило, короче неоадъювантных и адъювантных, а те, в свою очередь, менее продолжительны, чем радикальные. Однако подведение радикальной дозы возможно и за один-несколько сеансов в зависимости от клинической ситуации. В таком случае курс дистанционной лучевой терапии называется стереотаксической радиотерапией или радиохирургией. Варьирует и кратность сеансов в день и в неделю: чаще всего используются схемы с пятью сеансами в неделю, однако могут быть предложены и 2-3 сеанса в день (гиперфракционирование) и схемы с 1-4 и 6 сеансами в неделю.
Во время облучения пациент в подавляющем большинстве случаев располагается лежа на столе специальной установки. Крайне необходимо соблюдать полную неподвижность во время сеанса облучения. Для достижения этого могут использоваться специальные фиксирующие устройства и системы иммобилизации.
Перед тем как включить установку, медперсонал покидает помещение, и дальнейшее наблюдение осуществляется через мониторы или окно. Общение с пациентом осуществляется по громкой связи. Во время выполнения сеанса, части аппарата и стол с пациентом совершают движения по заданной траектории. Это может создавать шум и беспокойство у больного. Однако бояться этого не стоит, поскольку вся процедура контролируется.
Сам сеанс лучевой терапии может длиться как 5-10, так и 60-120 минут, чаще — 15-30 минут. Само воздействие ионизирующего излучения не вызывает никаких физических ощущений. Однако в случае ухудшения самочувствия пациента во время сеанса (выраженной боли, судороги, приступа тошноты, паники), следует позвать медицинский персонал заранее оговоренным способом; установку сразу отключат и окажут необходимую помощь.
Контактная лучевая терапия (брахитерапия)
Брахитерапия проводится в несколько этапов:
- Введение в облучаемую зону неактивных проводников — устройств, в которые затем имплантируют источник ионизирующего излучения. При внутриполостной лучевой терапии используются приспособления, называемые эндостатами. Их устанавливают непосредственно в полость облучаемого органа и рядом с ним. При внутритканевой лучевой терапии используются интростаты, которые устанавливаются непосредственно в ткань опухоли по заранее просчитанной схеме. Для контроля их установки, как правило, используются рентгенологические снимки.
- Перемещение источника излучения из хранилища в интро- и эндостаты, которые будут облучать опухолевую ткань. Время облучения и особенности поведения пациента будут зависеть от вида брахитерапии и используемого оборудования. Например, при внутритканевой терапии, после установки источника ионизирующего излучения пациент может покинуть клинику и прийти на повторную процедуру через рекомендуемый промежуток времени. Весь этот период в его организме будет находиться интростат с радионуклидами, которые будут облучать опухоль.
Проведение внутриполостной брахитерапии будет зависеть от используемых установок, которые бывают двух типов:
- Установки низкой мощности дозы. В этом случае один сеанс облучения длится около 2-х суток. Под наркозом имплантируются эндостаты. После контроля правильности их установки и введения радионуклидов, пациент переводится в специальное помещение, где должен будет находиться все время, пока длится процедура, соблюдая строгий постельный режим. Разрешается только немного поворачиваться на бок. Вставать категорически запрещено.
- Установки высокой мощности дозы. Время облучения составляет несколько минут. Для установки эндостатов наркоза не требуется. Но во время процедуры все равно необходимо лежать абсолютно неподвижно. Внутриполостная лучевая терапия установкой высокой мощности проводится несколькими сеансами с интервалами от одного дня до одной недели.
Радионуклидная терапия
При радионуклидной терапии пациент принимает радиофармпрепараты внутрь в виде жидкого раствора, капсул или инъекций. После этого он помещается в специальную палату, имеющую изолированную канализацию и вентиляцию. По истечении определенного срока, когда мощность дозы снизится до приемлемого уровня, проводится радиологический контроль, пациент принимает душ и переодевается в чистую одежду. Для контроля результатов лечения проводится сцинтиграфия, после чего можно покинуть клинику.
Как вести себя во время лучевой терапии
Лучевая терапия является серьезным стрессом для организма. У многих пациентов в этот период ухудшается самочувствие. Чтобы его минимизировать рекомендуется придерживаться следующих правил:
- Больше отдыхать. Минимизируйте физическую и интеллектуальную нагрузку. Ложитесь спать, когда почувствуете в этом необходимость, даже если она возникла в течение дня.
- Постарайтесь сбалансировано и полноценно питаться.
- Откажитесь на время проведения терапии от вредных привычек.
- Избегайте плотной обтягивающей одежды, которая бы могла травмировать кожу.
- Следите за состоянием кожи в месте облучения. Не трите и не расчесывайте ее, используйте средства гигиены, которые вам порекомендует врач.
- Защищайте кожу от воздействия солнечных лучей — используйте одежду и головные уборы с широкими полями.

Побочные эффекты лучевой терапии
Лучевая терапия, как и другие методы противоопухолевого лечения, вызывает ряд осложнений. Они могут быть общими или местными, острыми или хроническими.
Острые (ранние) побочные эффекты развиваются во время проведения радиотерапии и в ближайшие недели после неё, а поздние (хронические) лучевые повреждения — через несколько месяцев и даже лет после ее окончания.
Общие реакции
Угнетенное эмоциональное состояние
Подавляющее большинство пациентов, проходящих лечение по поводу злокачественного новообразования, испытывают тревожность, страх, эмоциональное напряжение, тоску и даже депрессию. По мере улучшения общего состояния, эти симптомы стихают. Чтобы облегчить их, рекомендуется чаще общаться с близкими людьми, принимать участие в жизни окружающих. При необходимости рекомендуется обратиться к психологу.
Чувство усталости
Чувство усталости начинает нарастать через 2-3 недели от начала терапии. На это время рекомендуется оптимизировать свой режим дня, чтобы не подвергаться ненужным нагрузкам. В то же время нельзя полностью отстраняться от дел, чтобы не впасть в депрессию.
Изменение крови
При необходимости облучения больших зон, под воздействие радиации попадает костный мозг. Это в свою очередь приводит к снижению уровня форменных элементов крови и развитию анемии, повышению риска кровотечения и развития инфекций. Если изменения выражены сильно, может потребоваться перерыв в облучении. В ряде случаев могут назначать препараты, стимулирующие гемопоэз (кроветворение).
Снижение аппетита
Обычно лучевая терапия не приводит к развитию тошноты или рвоты, но снижение аппетита наблюдается довольно часто. Вместе с тем, для скорейшего выздоровления требуется полноценное высококалорийное питание с высоким содержанием белка.
Локальные осложнения
Побочные реакции со стороны кожи
Вероятность развития кожных реакций и их интенсивность зависят от индивидуальных особенностей пациента. В большинстве случаев через 2-3 недели в области воздействия возникает покраснение. После окончания лечения оно сменяется пигментированием, напоминающим загар. Чтобы предотвратить чрезмерные реакции, могут назначаться специальные кремы и мази, которые наносятся после окончания сеанса. Перед началом следующего их необходимо смыть теплой водой. Если реакция выражена сильно, делают перерыв в лечении.
Реакции со стороны полости рта и горла
Если облучают область головы и шеи, могут развиться лучевой стоматит, который сопровождается болью, сухостью во рту, воспалением слизистых, а также ксеростомия вследствие нарушения функции слюнных желез. В норме эти реакции проходят самостоятельно в течение месяца после окончания лучевой терапии. Ксеростомия может беспокоить пациента в течение года и более.
Осложнения со стороны молочной железы
При прохождении лучевой терапии по поводу рака молочной железы могут возникать следующие реакции и осложнения:
- Покраснение кожи груди.
- Отек груди.
- Боль.
- Изменение размера и формы железы из-за фиброза (в некоторых случаях эти изменения остаются на всю жизнь).
- Уменьшение объема движения в плечевом суставе.
- Отек руки на стороне поражения (лимфедема).
Побочное действие на органы грудной клетки
- Воспаление слизистой пищевода, которое приводит к нарушению глотания.
- Кашель.
- Образование мокроты.
- Одышка.
Последние симптомы могут свидетельствовать о развитии лучевого пневмонита, поэтому при их возникновении следует немедленно обратиться к вашему врачу.
Побочные реакции со стороны прямой кишки/петель кишечника
- Расстройство стула — диарея или наоборот, запоры.
- Боли.
- Кровянистые выделения из заднего прохода.
Побочные действия со стороны мочевого пузыря
- Учащенное болезненное мочеиспускание.
- Наличие примеси крови в моче иногда может быть настолько выраженным, что моча приобретает кроваво-красный цвет.
- Наличие патологических примесей в моче — кристаллы, хлопья, гнойное отделяемое, слизь.
- Уменьшение емкости мочевого пузыря.
- Недержание мочи.
- Развитие везиковагинальных или везикоректальных свищей.
Побочные эффекты при облучении опухолей забрюшинного пространства, печени, поджелудочной железы
- Тошнота и рвота.
- Ознобы после сеансов.
- Боли в эпигастрии.
Химиолучевая терапия
Лучевая терапия довольно редко проводится в качестве самостоятельного лечения. Чаще всего она сочетается с каким-либо другим видом лечения: хирургическим, а чаще всего — с лекарственным. Это может быть как вариант одновременной химиолучевой терапии, так и последовательной, а также варианты сочетания лучевой терапии с иммунотерапией, таргетной и гормональной терапии. Такие виды лечения могут иметь ощутимо более высокую противоопухолевую эффективность, однако необходимо тщательно оценить риски совместных побочных эффектов, поэтому принятие решения о любом объёме лечения с онкологической патологией должен принимать мультидисциплинарный онкологический консилиум.
Читайте также:

