Линоленовая кислота при акне
Обновлено: 27.04.2024
Определения уровня перекисного окисления липидов (малоновыйдиальдегид, диеновые конъюгаты) и антиокислительный системы (каталаза, глутатионпероксидаза) сыворотки при различных клинических формах акне. Проведена оценка клинической эффективности приема полиненасыщенных жирных кислот (ПНЖК) в комплексной терапии вульгарных угрей.
Введение
Акне (вульгарные угри) – полиморфное мультифакториальное заболевание волосяных фолликулов и сальных желез, которое в возрасте до 16 лет в той или иной форме встречается практически у всех: у лиц молодого возраста – в 80–85% и только в возрасте старше 24 лет этот показатель снижается до 10% [1, 2]. При этом даже легкие формы акне могут вызывать значительные эмоциональные и психологические изменения [3, 4].
Патогенез акне сложен, ключевыми факторами развития патологического процесса являются:
- дисбаланс липидов;
- возрастание патогенности Propioni-bacterium acne и активности сальных желез;
- нарушение циркуляции некоторых гормонов;
- наследственная предрасположенность;
- фолликулярный гиперкератоз;
- нарушение процессов кератинизации.
У больных акне снижен уровень линолевой кислоты, которая играет важную роль в развитии фолликулярного ретенционного гиперкератоза и формировании комедонов [5, 6].
По своему химическому составу кожное сало представляет собой смесь липидов. В увеличенном объеме кожного сала снижается концентрация незаменимой α-линоленовой (цис-9,12,15-октадекатриеновой) кислоты (ЛК). Ее недостаток может быть обусловлен как дефицитом в пище, так и недостаточностью ферментативных систем, обеспечивающих поступление ЛК в организм и распределение в нем. Подавляя экспрессию фермента трансглутаминазы, ЛК является основным регулятором дифференцировки кератиноцитов. Трансглутаминаза участвует в синтезе кератина 1-й и 10-й фракций, белков инволюкрина, лорикрина и филлагрина – основных компонентов цементирующей межклеточной субстанции корнеоцитов. Повышенная активность трансглутаминазы вызывает ретенционный гиперкератоз в infrainfundibulum сально-волосяных фолликулов. Преобладание процессов пролиферации и дискератоза над десквамацией эпителия в конечном счете приводит к закрытию протока сально-волосяных фолликулов [7]. Снижение количества линолевой кислоты приводит к повышению pH кожного сала и изменению проницаемости эпителия фолликулов. В итоге значительно нарушается барьерная функция эпителия и создаются условия для роста микроорганизмов, повышается трансэпидермальная водопроницаемость [8–10]. Таким образом, ретенционный гиперкератоз акроворонки сальных фолликулов и дисбаланс липидов являются основным звеном в патогенезе акне [11].
Линолевая кислота незаменима, т. е. поступает в организм только с пищей, поэтому дополнительное поступление ЛК, по нашему мнению, может спос.
Авторитетное издание Jama Dermatology 10 июня опубликовало статью французских ученых из института Парижа Association Between Adult Acne and Dietary Behaviors. Findings From the NutriNet-Santé Prospective Cohort Study 1 . Ученые проанализировали данные 24 тысяч участников и подтвердили – жирное и сладкое, напитки и молоко – компоненты западной диеты – провоцируют высыпания.
Читаем и рассказываем терапевтические истории системного подхода к терапии, на очереди научное разоблачение мифов про глютен и лактозу у пациентов с акне.
Метаболизм жиров и акне
Кожное сало (себум) называют одним из главных факторов в патогенезе акне. На его состав и секрецию влияют генетически обусловленные механизмы, на которые в свою очередь влияет пища.
Себум состоит из триглицеридов и свободных жирных кислот (57,5 %), восковых эфиров (26 %), сквалена (12 %), холестерина и его эфиров (4,5 %). Он отвечает за смазку, увлажнение, фото- и антиоксидантную защиту кожи и волос.
Изменения состава себума (например, повышение ненасыщенности свободных жирных кислот, сквалена и пероксида сквалена, понижение содержания линолевой кислоты) доказано приводит к фолликулярной гиперкорнификации, запуская цепочку механизмов, которые в итоге приводят к тому, что пациенты видят в зеркале. Сальные железы и липиды в свою очередь предоставляют среду для размножения Propionibacterium acnes, которые стимулируют продукцию антимикробных пептидов и воспалительных цитокинов 2 .
Это лишь одна часть в сложном и запутанном механизме патогенеза акне. Многое в нем до сих пор вызывает дискуссии. Но ученые схожи во мнении, что воспалительные реакции возникают под действием следующих иммунных компонентов, связанных с производством кожного сала 3 :
- 5-липоксигеназа (5-LOX). Фермент, активируется с помощью окисленных скваленов и способствует превращению арахидоновой кислоты в лейкотриен В4. Увеличивает количество воспалительных клеток через путь PPARα.
- Рецепторы активаторов пролиферации пероксисом (PPARs). Группа белков ядерных рецепторов. Регулируют выработку кожного сала и дифференцировку кератиноцитов.
- Стерол-ответный элемент, связывающий белок-1 (SREBP-1). Транскрипционный фактор. Стимулирует липогенез в сальных железах.
- Толл-подобные рецепторы (TLRs). При акне в основном опосредуются через TLR2 и TLR4.
- Лейкотриен B4. Медиатор воспаления. Присутствует в волосяном фолликуле.

Как происходит себообразование и воспаление
Некоторые исследования связывают тяжесть высыпаний с изменением доли мононенасыщенных жирных кислот. При акне соотношение триглицеридов и восковых эфиров поверхности кожи повышается, что приводит к нарушению состава себума и к его перевыработке 4 . Изменения в составе себума происходят и из-за неправильного синтеза липидов в сальной железе. Среди липидов, предположительно участвующих в формировании комедонов, под пристальным вниманием находятся продукты их перекисного окисления.
Недавнее исследование показало, что накопление перекисей липидов может быть причиной перехода невоспалительного комедона в воспалительный 5 . В частности, было отмечено, что степень липопероксидации, а также содержание интерлейкина IL-1-альфа и NF-каппа-B в воспалительных комедонах выше, чем невоспалительных.
В процессе себогенеза участвует еще один компонент – сквален 6 . Он рассматривается как маркер дифференцировки себоцитов. Накопление сквалена обусловлено специфической средой сальных желез – анаэробным состоянием, которое влияет на активность ферментов в клетках. Так, сквален-2,3-эпоксидазе нужен кислород для протекания своей реакции. Если в себоцитах повышается активность этого фермента, возрастает и количество сквалена 7 . Было установлено, что перекись сквалена – побочный продукт перекисного окисления липидов – играет решающую роль в развитии комедогенеза и воспаления.
Она увеличивает количество воспалительных цитокинов (IL-1-альфа) и активируют рецепторы PPARs (PPARα) в кератиноцитах, клетках Лангерганса и меланоцитах. Окисленные сквалены также повышают активность 5-LOX и индуцируют сигнальный путь COX-2. Это приводит к повышенному выделению провоспалительных цитокинов и повышению липопероксидации. Клетки буквально начинают сходить с ума, провоцируя воспалительную реакцию 8 .
Недавние открытия показали важность Toll-подобных рецепторов и медиатора воспаления лейкотриена B4 LTB4 в модуляции иммунного ответа. Они присутствуют у кератиноцитов, моноцитов и себоцитов 9 .
Через кожное сало опосредуется пролиферация Propionibacterium acnes. Сальные железы и липиды предоставляют анаэробную среду для их роста. Когда кожное сало проходит через фолликулярный проток, липазы, продуцируемые Propionibacterium acnes, гидролизуют триглицериды в провоспалительные свободные жирные кислоты 10 . Propionibacterium acnes также связывают Toll-подобные рецепторы (TLR2 и TLR4) на сальных железах, чтобы стимулировать продукцию себоцитов антимикробных пептидов (HβD1 и HβD2) и воспалительных цитокинов (FHO-альфа, IL-1-альфа; IL-8) 11 .
Роль андрогенов и гормонов стресса в себорегуляции
Продукция кожного сала частично регулируется андрогенами. Андрогенные рецепторы расположены в пределах базального слоя сальных желез и кератиноцитов и способствуют росту сальных желез и секреции кожного сала 12 .
Новые данные свидетельствуют о том, что сальные железы также участвуют в нейроэндокринной функции и реакции на стресс. Например, меланокортины (меланоцит-стимулирующий гормон и адренокортикотропный гормон) и кортикотропин-рилизинг-гормон (в ответ на физиологический стресс) связываются с соответствующими рецепторами внутри сальных желез, стимулируя продукцию кожного сала 13 . Инсулиноподобный фактор роста-1 может индуцировать стерол-ответный элемент, связывающий белок-1 (SREBP-1), который стимулирует липогенез в сальных железах 14 .
Акне – болезнь западной цивилизации
В ряде исследований было установлено, что инуиты, жители острова Окинава и другие коренные народы крайне редко сталкиваются с акне 15 . Ученые предположили, что это связано с их рационом питания и привычками. Эти народы традиционно потребляют множество морепродуктов, и когда эти группы населения стали переходить к современному образу жизни с его соблазнами, переселились, изменив привычной пище, количество комедонов и воспалительных элементов на их лице возросло.
В 1961 году в Северной Каролине (США) провели исследование среди тысячи подростков. Оно показало, что те из них, кто потреблял много рыбы и морепродуктов, реже страдали акне 16 . Похожие данные получили и у азиатов. Jung JJ et al., исследуя корейских пациентов, обнаружили, что участники, страдавшие акне, потребляли меньше рыбы и больше западной пищи, считающейся вредной 17 . Пользу морепродуктов доказали и итальянцы 18 .
Западная пища отличается низким соотношением омега-3 к омега-6 жирным кислотам 19 . В стандартной западной диете содержание омега-6 почти в десять раз превышает содержание омега-3 20 .
Почему исследователи полагают, что омега-3 и 6 нужно включать в рацион страдающим акне пациентам?
Было установлено, что омега-3 профилактируют многие заболевания, среди которых воспалительные реакции на коже 21 . Они сдерживают действие нескольких цитокинов.
Омега-6 обладают противоположными омега-3 свойствами и изменяют физиологическое состояние на провоспалительное с повышенной продукцией воспалительных LT, PG и цитокинов.
Но ученые не максималисты, и не могут разделить омега-3 и на «хороших» и «плохих». Главное – их правильное соотношение.
Существуют многообещающие исследования в пользу комбинированных добавок, которые показывают наибольший потенциал в ослаблении воспалительных процессов при таких заболеваниях кожи, как атопический дерматит, псориаз, акне 22 .
Хорошо сбалансированное соотношение омега-3 / омега-6 – в средиземноморской диете.
Дополнительные добавки на основе полиненасыщенных жирных кислот в некоторых случаях улучшали общее состояние кожи.
В правильном соотношении омега-3 способны ингибировать воспаление и подавлять гены, связанные с липидным обменом 23 . Они взаимодействуют с продуктами перекисного окисления липидов и воспалительными цитокинами и Толл-подобными рецепторами – компонентами иммунного ответа организма, которые активируются у пациентов с акне.
Рубин и соавт. в исследовании давали пациентам с акне пищевые добавки четыре раза в день, состоящие из 250 мг EPA, полученного из сардин и анчоусов, 3,75 мг глюконата цинка, 50 мкг селена, 50 мкг хрома и 50 мг EGCG из экстракта зеленого чая. Через два месяца у четырех из пяти пациентов наблюдалось уменьшение воспалительных поражений 24 .
Khayef et al. обследовали 13 мужчин с акне, которые потребляли три капсулы рыбьего жира ежедневно в течение 12 недель (930 мг EPA, 720 мг DHA и 174 мг DPA). У восьми пациентов наблюдалось улучшение клинической картины 25 .
Jung JY в al. провел рандомизированное двойное слепое проспективное исследование, в котором приняли участие 45 пациентов. Пациенты были распределены на три группы, включая группу омега-3 (2000 мг в день) и группу ГЛК (масло огуречника, 400 мг в день) и контроль без лечения. После десяти недель в группах омега-3 и в группе ГЛК наблюдалось значительное снижение среднего числа воспалительных и невоспалительных элементов 26 .

Источники омега-3 и омега-6 в рационе: памятка косметологу
Важно соблюсти баланс (табл. 1).
Современные знания патогенеза акне достаточны, чтобы давать врачам основание для рекомендаций пациентам с акне избегать пищи с высоким гликемическим индексом и включать в рацион блюда средиземноморской кухни.
Западная диета уже содержит высокие уровни омега-6. Семена и растительные масла (сафлор, виноград, рапс, мак, подсолнечник, пальма, конопля, кукуруза, зародыши пшеницы, хлопковое семя, соя), которые используются для приготовления пищи, являются хорошим источником омега-6 с низким содержанием омега-3, в первую очередь – АЛК.
В отличие от омега-6, потребление омега-3 обычно недостаточно.
α-линоленовая кислота (АЛК) содержится в зеленых листовых овощах, льняном семени, грецких орехах, соевом и рапсовом маслах. Производные эйкозапентаеновая кислота (EPA) и докозагексаеновая кислота (DHA) получаются из молока и рыбьего жира, таких как лосось, скумбрия, сардины, анчоусы, сельдь и радужная форель, водоросли 27 . В морской (дикой) рыбе в изобилии присутствуют омега-3, поскольку они питаются фитопланктоном и зоопланктоном. В последнее время популярность приобретает масло из антарктического криля (Euphausia superba), как богатый источник омега-3.
Таблица 1. Содержание омега-3 и омега-6 жирных кислот в некоторых растительных и животных продуктах питания (цит. с сокр. по: Balić et al. 2020 28 )
| Источник | Омега-3 | Омега-6 | ||||
| Альфа-линоленовая | Эйкозапентаеновая | Докозагексаеновая | Арахидоновая | Докозапентаеновая | ||
| Масла | Кукурузное Подсолнух Зародыш пшеницы | 0,6 0,33 5,3 | — — — | — — — | — — — | — — — |
| Рыбий жир | Лосось Сардины Сельдь | — — — | 13,3 10,15 6,28 | 18,23 10,66 4,21 | — — — | 2,99 1,97 0,62 |
| Овощи (сырые) | Салат, листья Брокколи Брюссельская капуста | 0,15 0,11 0,17 | — — — | — — — | — — — | — — — |
| Рыба (сырая) | Лосось Сельдь Сардина Форель | 0,09 0,19 — 0,1 | 0,89 1,09 0,51 0,15 | 1,19 1,01 1,16 0,5 | 0,05 0,1 0,04 0,05 | — — — |
Выводы
Хотя за последние 10 000 лет в рационе человека произошли изменения, гены не сильно изменились. Люди привыкли к пище, с которой эволюционировали. Привыкли к этому и гены. Поэтому неудивительно, что современные западные диеты с дефицитом омега-3 и богатством омега-6 способствуют патогенезу многих воспалительных процессов. И акне – один из таких процессов.

Обладателям кожи, склонной к появлению комедонов, известно, что для ухода за проблемной кожей рекомендуется использовать очищающие муссы, лосьоны и увлажняющие средства Oil-Free (без масла). Однако в последнее время, в связи с изменениями в представлениях о роли сальных желез в функционировании кожи, существенно изменился и подход к лечению такой кожи. В результате возникло пока малоизученное, но интересное и перспективное направление патогенеза и коррекции акне.
Как известно, акне – яркий пример локальной патологии сальных желез с четкой зональной принадлежностью. Юношеские угри всегда располагаются именно в области лица, спины и груди, хотя высокая активность 5 α-редуктазы 1 типа отмечается и в пилосебацеарных комплексах андрогензависимых зон волосистой части головы. Тем не менее, в этой области при одинаковых патогенетических факторах, клиническая картина совершенно иная: мы наблюдаем выпадение волос и отсутствие высыпаний, свойственных угревой болезни [Thiboutot D, Harris G, Iles V, Cimis G, Gilliland K, Hagari S. Activity of the type 1 5α- reductase exhibits regional differences in isolated sebaceous glands and whole skin. //J Invest Dermatol 1995; 105: 209-14].
Роль сальной железы и себума
Несмотря на различные провоцирующие факторы и индивидуальную клиническую картину, основные патогенетические механизмы развития акне у всех пациентов одинаковы: гиперсеборея, фолликулярный и ретенционный гиперкератоз, воспаление. Именно сальная железа и ее себум являются определяющим фактором при этом заболевании. Количественные изменения себума как причины акне ни у кого сегодня не вызывают сомнений [European recommendations on the use of oral antibiotics for acne. European Journal of Dermatology. Volume 14, Number 6, 391-9, November-December 2004, Therapy], а вот роль качественных изменений активно обсуждается.
Благодаря последним исследованиям изменились представления о роли сальной железы в функционировании кожи и организма в целом. Из придатка кожи, продуцирующего кожное сало, она превратилась в «мозг кожи», ей приписывают роль главной дермальной эндокринной железы. Себоциты обеспечивают продукцию foetal vernix caseosa, способствуют транспорту жирорастворимых антиоксидантов через кожную поверхность и внутрь кожи, обеспечивают натуральную фотопротекцию, про- и антивоспалительные свойства кожи, ее природную антимикробную активность. Себум влияет на трехмерную организацию поверхностных липидов кожного барьера, на фолликулярную дифференцировку, сохранение эпидермального барьера, обеспечение терморегуляции и отталкивающих свойств кожи. Именно сальные железы в основном ответственны за гормонально индуцированное старение кожи и ее периферический стероидогенез, обеспечивают формирование индивидуального запаха. Интересно также, что себоциты, в исследованиях in vitro, проявляли свойства стволовых клеток, несмотря на их запрограммированную терминальную дифференцировку [Zouboulis CC, Baron JM, Böhm M. et oth. Frontiers in sebaceous gland biology and pathology.//Exp Dermatol. 2008 Jun;17(6):542-51.].

Линолевая кислота и комедоны
Известно, что себоциты продуцируют свободные жирные кислоты независимо от липолиза, инициируемого Propionibacterium acnes, поэтому в сальных железах теоретически возможно развитие асептического воспаления. В случае повышенной сальной секреции, свойственной акне, в составе себума резко снижается количество линолевой жирной кислоты за счет эффекта разбавления [Cunliffe WJ, Simpson NB. Disorders of the sebaceous glands. In Textbook of Dermatology Champion RN, Burton JL, Burns DA. Eds 6th Ed Oxford Blackwell Science 1998: 1927-84]. Локальный дефицит линолевой кислоты в фолликулярном эпителии опасен развитием фолликулярного гиперкератоза и образованием комедонов. Поэтому любые способы снижения выработки кожного сала обречены на успех в лечении акне. В подтверждение этому более раннее исследование показало резкое снижение линолевой кислоты в составе эпидермальных церамидов комедонов (6 %) по сравнению с нормальными участками (41 %). Эти данные также поддерживают концепцию о ведущей роли дефицита линолевой кислоты в развитии комедогенеза [Wertz PW, Miethke MC, Long SA et oth. The Composition of the Ceramides from Human Stratum Corneum and from Comedones// Journal of Investigative Dermatology (1985) 84, 410–412].
Более того, одно из базовых исследований метаболизма линолевой кислоты в коже продемонстрировало не только ее местный дефицит при гиперсеборее, но и последующее нарушение эпидермального барьера вокруг гиперактивных себоцитов. Это происходило из-за замещения линолеата в ацилцерамидах эпидермального барьера на сапиенат, основную жирную кислоту человеческого себума. Таким образом, не только жирнокислотный спектр себума может меняться с изменением активности сальных желез, но и структура эпидермального барьера, поскольку жирные кислоты себума могут входить в эпидермис и внедряться в эпидермальные липиды [Stewart ME, Grahek MO, Cambier LS et oth. Dilutional effect of increased sebaceous gland activity on the proportion of linoleic acid in sebaceous wax esters and in epidermal acylceramides.// J Invest Dermatol. 1986 Dec;87(6):733-6]. Это является причиной дисбиоза и состояния гиперчувствительности кожи, может ухудшать течение акне и поддерживать воспаление. На основании этих данных и была сформулирована новая концепция косметического ухода за кожей с акне, исключающая любое механическое и химическое агрессивное воздействие.

Противоугревые средства с линолеатом
Светлана Ткаченко, кандидат медицинских наук, доцент кафедры дерматологии, венерологии и медицинской косметологии Харьковского национального медицинского университета (Харьков).
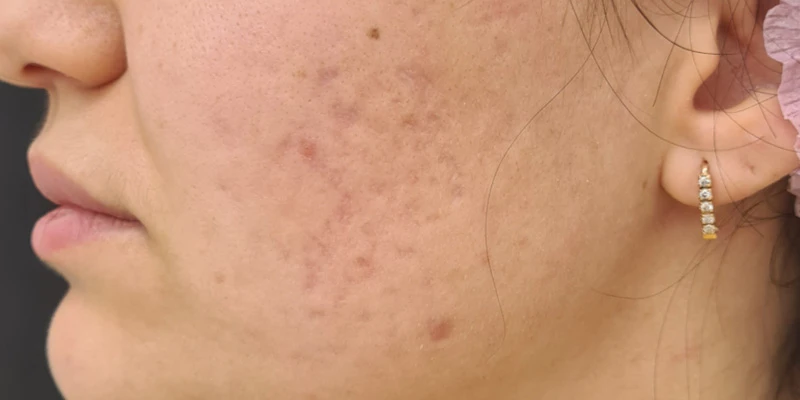
Пациентка Ш., 25 лет, обратилась в клинику в мае 2020 года с жалобами на высыпания, локализованные на лице, преимущественно на коже щек, симптомокомплексом постакне (рис. 1).
Со слов пациентки высыпания стали появляться примерно 2 года назад, сначала это были единичные небольшие воспалительные элементы в области лба, потом они распространились на кожу щек. Пациентка обратилась в клинику, где ей выполнялись разнообразные пилинги (названия не помнит), маски, а также были назначены препараты для наружной терапии с антибиотиками. Но лечение не приносило должного эффекта. В мае 2020 года состояние пациентки значительно ухудшилось: высыпания распространились по всему лицу, приняли характер крупных воспалительных элементов. Пациентка пришла на прием в состоянии психоэмоциональной нестабильности со словами: «Очень устала, ничего не помогает, у меня никогда раньше не было такой кожи».
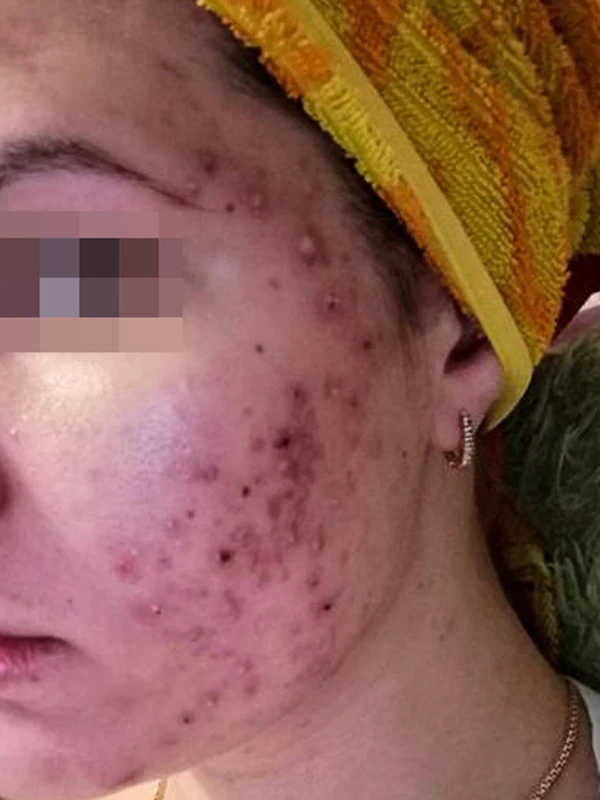
Рис. 1. До начала лечения.
Из анамнеза: ветряная оспа в детстве, ОРЗ, ОРВИ. Наследственный анамнез не отягощен, аллергические реакции отрицает. Хронические заболевания: перегиб желчного пузыря. Другой патологии внутренних органов не выявлено.
Объективный осмотр: общее состояние удовлетворительное, температура тела 36,7 °С. Миндалины не увеличены, язык чистый, дыхание везикулярное, хрипов нет, ЧДД – 19.
Локальный статус: кожа физиологической окраски, с повышенным салоотделением. На коже лица множественные папуло-пустулезные элементы, очаги поствоспалительной застойной эритемы, атрофические рубцы (постакне), открытые и закрытые комедоны. Подчелюстные, шейные, над- и подключичные, подмышечные лимфоузлы не увеличены, мягкоэластической консистенции, безболезненные при пальпации, не спаяны между собой и с окружающими тканями, кожа над ними не изменена.
Общий анализ мочи, анализ кала – без особенностей, анализ крови на сифилис и ВИЧ-инфекцию отрицательный. При бактериоскопическом исследовании выделен Staphylococcus aureus, устойчивый к амоксициллину, кларитромицину, но чувствительный к гентамицину, цефтриаксону, доксициклину. В соскобе Demodex folliculorum не обнаружен. УЗИ органов брюшной полости и почек: перегиб желчного пузыря.
На основании клинико-лабораторного обследования пациентке был поставлен диагноз – вульгарные акне средней степени тяжести (Код МКБ-X: L.70.0). Назначено следующее лечение: изотретиноин 8 мг утром, 16 мг вечером.
Местное лечение и для ухода за кожей лица в период лечения рекомендовано: гель бензоила пероксид утром, матирующая пенка для умывания Cetaphil PRO утром и вечером, себорегулирующий увлажняющий крем Cetaphil PRO утром.
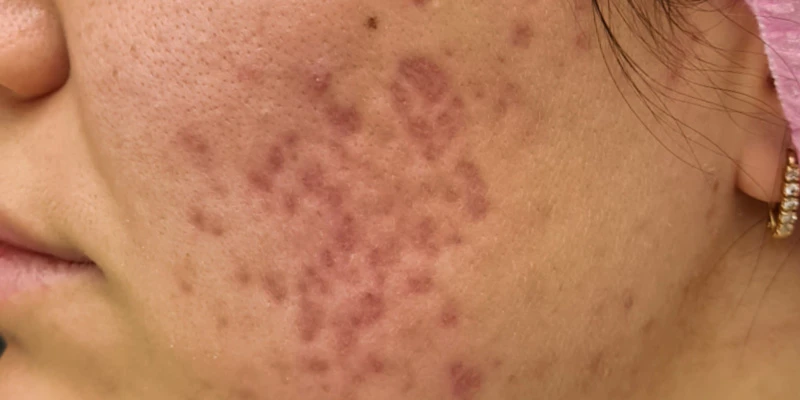
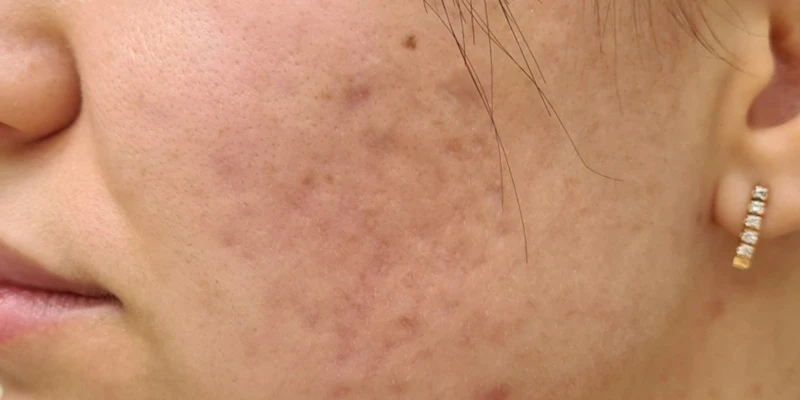
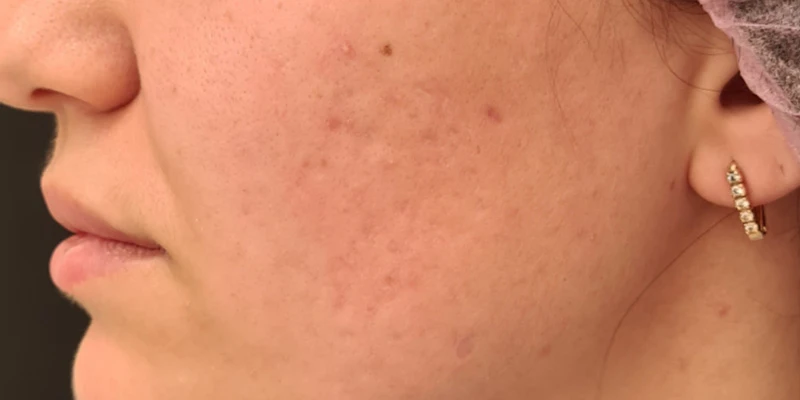
При осмотре через 4 недели терапии была отмечена положительная динамика с разрешением большинства воспалительных элементов, единичными новыми высыпаниями. Пациентка отмечает умеренную сухость в области губ, общее самочувствие удовлетворительное, биохимический анализ крови без изменений. Рекомендовано продолжить лечение и косметический уход за кожей лица еще в течение двух месяцев. При осмотре через 8 недель воспалительные элементы на коже щек отсутствуют, новых высыпаний за этот период не появлялось. Биохимический анализ крови в норме. С учетом отсутствия воспалительных элементов принято решение о подключении к терапии лазерных процедур для коррекции поствоспалительной застойной эритемы курсом из 5 процедур с интервалом 2 недели (рис. 2). Далее курс из 3–5 процедур лазерной коррекции атрофических рубцов постакне с интервалом 1 месяц в сочетании с введением скинбустера Restylane ® Vital 1 мл на 7-й день после каждой лазерной процедуры. Решение начать курс лазерных процедур с лазерного удаления сосудистого компонента было связано с тем, что в 83 % случаев новые атрофические рубцы появляются именно на местах застойной эритемы и только в 16 % случаев на местах папул и пустул 1 .
До
После
Рис. 2. До и после курса из пяти лазерных процедур по коррекции поствоспалительной застойной эритемы постакне с интервалом 2 недели.
Для коррекции поствоспалительной эритемы постакне применялся излучатель Nd:YAP Q-sw/KTP 1079/540 нм, энергия 17 Дж/см кв., частота 2 Гц. Обработка проводилась до потемнения очагов застойной эритемы, при этом окружающая кожа не изменялась. Процедуры с интервалом 2 недели. После каждой процедуры пациентке было рекомендовано не мочить зону обработки в течение суток, не травмировать область обработки, исключить посещение соляриев, бани, сауны на весь период лечения. Использовать средства с SPF50+.
Для коррекции атрофических рубцов постакне в своей практике используем Er: YAG лазер (2936 нм) с модулем SMA (6 мм). Для обработки рубцов применялась «стимулирующая» энергетика 2,21 Дж/см кв., частота 3 Гц. Обработка проводилась в один проход с наложением пятен по типу «олимпийских» колец. После обработки пациентке было рекомендовано применять водный раствор хлоргексидина и крем с декспантенолом 2 раза в сутки на протяжении 5 дней. Поскольку в ряде случаев у пациента с атрофическими рубцами постакне достичь эффекта полного сглаживания рельефа рубца с помощью лазера не представляется возможным, на 7-й день после каждой лазерной процедуры применялся скинбустер Restylane ® Vital 1 мл в технике микропроколов. Препарат содержит стабилизированную гиалуроновую кислоту в концентрации 20 мг/мл с минимальной модификацией и специфическим контролируемым размером частиц, что позволяет получить длительный эффект без вероятности миграции препарата [Dierickx et al., 2015]. Гиалуроновая кислота оказывает мощное стимулирующее действие на фибробласты и благодаря этому наблюдается синергия действия лазерной и инъекционной процедуры [Frank Wang et al. 2007]. Под действие лазера гиалуроновая кислота не подвергается разрушению, что было показано в работах американских исследователей, которые оценивали гистологические срезы кожи абдоминальной области свиней, которым предварительно вводилась стабилизированная гиалуроновая кислота, а через 2 недели проводилась обработка этих зон различными методиками (фотосистемы, абляционные фракционные методики СО2, эрбий). В ходе наблюдения было установлено, что ни при одном из методов аппаратного воздействия не произошло изменения структуры гиалуроновой кислоты [Alam M., Levy R., Pajvani U. et al., 2006]. Многие ученые считают, что это связано с тем, что стабилизированная гиалуроновая кислота является термостабильной, так как проходит в процессе производства обработку на этапе стерилизации при температуре выше 120 °С [Geronemus R. G., 2006].
В итоге пациентке было проведено 5 процедур с интервалом 2 недели для коррекции застойной эритемы постакне (рис. 2), 4 процедуры лазерной коррекции рубцов с интервалом 1 месяц и введением скинбустера Restylane ® Vital 1 мл на 7-й день после каждой лазерной процедуры (рис. 3).
До
После
Рис. 3. До и после курса лазерных процедур по коррекции атрофических рубцов постакне с интервалом 1 месяц и введением скинбустера Restylane ® Vital 1 мл на 7-й день после лазерной процедуры.
Приведенное клиническое наблюдение представляет значительный интерес в связи с особенностями проводимой комбинированной терапии. В настоящее время проведение лазерных и инъекционных процедур на фоне системного приема стандартных доз ретиноидов (не менее 0,5 мг на кг веса) запрещено или разрешено, но не ранее, чем через 6 месяцев после последнего приема препарата. Это связано с рисками формирования гипертрофических или келоидных рубцов [Spring, L. K., Krakowski, A. C., Alam M., 2017]. Однако стоит отметить, что клинические наблюдения, в которых было отмечено появление рубцов при одновременном проведении лазерных процедур на фоне приема ретиноидов внутрь, датируются 1986 годом [Roenigk et al. 1985]. Лазерные методики, применяемые в то время, были довольно агрессивными. Современные лазерные аппараты оказывают более деликатное воздействие на ткани, и, после анализа современной литературы, было установлено, что ни в одном из исследований не было описано формирования гипертрофических или келоидных рубцов [Chandrashekar et al. 2014; Yoon et al. 2014; Kim et al. 2014; Khatri et al. 2015].
Выводы
Комбинированное лечение, которое получила пациентка с акне среднетяжелой степени, привело к значительному уменьшению воспалительных проявлений на коже и улучшению психологического самочувствия пациентки.
А.Ю. Родин (1), Т.Н.Заклякова (2)
(1) Волгоградский государственный медицинский университет, Волгоград; (2) ГБУЗ«Волгоградский областной клинический кожно-венерологический диспансер», Волгоград
Определения уровня перекисного окисления липидов (малоновыйдиальдегид, диеновые конъюгаты) и антиокислительный системы (каталаза, глутатионпероксидаза) сыворотки при различных клинических формах акне. Проведена оценка клинической эффективности приема полиненасыщенных жирных кислот (ПНЖК) в комплексной терапии вульгарных угрей.
Введение
Акне (вульгарные угри) – полиморфное мультифакториальное заболевание волосяных фолликулов и сальных желез, которое в возрасте до 16 лет в той или иной форме встречается практически у всех: у лиц молодого возраста – в 80–85% и только в возрасте старше 24 лет этот показатель снижается до 10% [1, 2]. При этом даже легкие формы акне могут вызывать значительные эмоциональные и психологические изменения [3, 4].
Патогенез акне сложен, ключевыми факторами развития патологического процесса являются:
- дисбаланс липидов;
- возрастание патогенности Propioni-bacterium acne и активности сальных желез;
- нарушение циркуляции некоторых гормонов;
- наследственная предрасположенность;
- фолликулярный гиперкератоз;
- нарушение процессов кератинизации.
У больных акне снижен уровень линолевой кислоты, которая играет важную роль в развитии фолликулярного ретенционного гиперкератоза и формировании комедонов [5, 6].
По своему химическому составу кожное сало представляет собой смесь липидов. В увеличенном объеме кожного сала снижается концентрация незаменимой α-линоленовой (цис-9,12,15-октадекатриеновой) кислоты (ЛК). Ее недостаток может быть обусловлен как дефицитом в пище, так и недостаточностью ферментативных систем, обеспечивающих поступление ЛК в организм и распределение в нем. Подавляя экспрессию фермента трансглутаминазы, ЛК является основным регулятором дифференцировки кератиноцитов. Трансглутаминаза участвует в синтезе кератина 1-й и 10-й фракций, белков инволюкрина, лорикрина и филлагрина – основных компонентов цементирующей межклеточной субстанции корнеоцитов. Повышенная активность трансглутаминазы вызывает ретенционный гиперкератоз в infrainfundibulum сально-волосяных фолликулов. Преобладание процессов пролиферации и дискератоза над десквамацией эпителия в конечном счете приводит к закрытию протока сально-волосяных фолликулов [7]. Снижение количества линолевой кислоты приводит к повышению pH кожного сала и изменению проницаемости эпителия фолликулов. В итоге значительно нарушается барьерная функция эпителия и создаются условия для роста микроорганизмов, повышается трансэпидермальная водопроницаемость [8–10]. Таким образом, ретенционный гиперкератоз акроворонки сальных фолликулов и дисбаланс липидов являются основным звеном в патогенезе акне [11].

Линолевая кислота незаменима, т. е. поступает в организм только с пищей, поэтому дополнительное поступление ЛК, по нашему мнению, может способствовать нормализации липидного обмена и следовательно, улучшать клиническую картину заболевания.
Цель исследования: Оценка перспективы применения полиненасыщенных незаменимых жирных кислот в терапии акне.
- Определение уровня перекисного окисления липидов при различных клинических формах акне.
- Оценка клинической эффективности полиненасыщенных жирных кислот (ПНЖК) в комплексной терапии вульгарных угрей.
Материал и методы. О наличии или отсутствии «окислительного стресса» судили по уровню малонового диальдегида и диеновых конъюгатов, о состоянии антиоксидантного потенциала сыворотки – по показателям каталазы и глутатионпероксидазы (выявляемых методом спектрофотометрии).
Было сформировано 4 группы, в каждой по 40 человек. В состав первой группы вошли пациенты с легкой формой акне, второй – со среднетяжелой, третьей – с тяжелой. Четвертая группа (контрольная) – 40 человек без признаков угревой болезни. Распределение по тяжести течения – по G. Plewig, F. Kligman (2001).
Критерии включения в исследование:
- Пациенты обоего пола в возрасте от 15 до 35 лет с установленным клиническим диагнозом: папуло-пустулезная форма акне легкой, средней, тяжелой степеней тяжести с локализацией высыпаний преимущественно на коже лица.
- Пациенты, соответствующие критериям исследования, способные принять в нем участие и выразившие свое согласие на участие в данном исследовании в письменной форме.
Критерии исключения из исследования:
- возраст до 15 лет;
- прием системных кортикостероидов в течение последнего года (стероидные акне);
- прием ароматических ретиноидов в течение последнего года;
- акне при эндокринопатиях (консультация эндокринолога).
Метод лечения: льняное масло с селеном 1 десертная ложка (10 мл) 1 раз в день+витамин Е 100 мг×2 раза в течение месяца. Льняное масло выбрано нами как источник максимального содержания ПНЖК (особенно линолевой кислоты) среди растительных масел.
Методы назначения терапии: первый режим лечения (во всех трех группах) – монотерапия ПНЖК, второй режим – терапия ПНЖК+стандартное комплексное лечение, третий режим – только комплексная терапия.
В стандартную комплексную терапию мы включили наружно 2,5–5,0%-ный гель бензоилпероксида в течение до 12 недель, при папулопустулезной форме (более 20 элементов) – антибиотикотерапия с учетом чувствительности в течение 14–21 суок и ретинол 100 000 МЕ/сут 3–4 месяца. Оценка эффективности терапии проведена через месяц, далее ежеквартально в течение года по традиционным критериям:
- клиническое выздоровление (полный регресс воспалительных акне-элементов);
- значительное улучшение (разрешение акне-элементов более чем на 75%);
- улучшение (регресс менее чем на 50%);
- без эффекта (отсутствие динамики кожного процесса к концу лечения или возникновение рецидива);
Результаты исследования
Представлены в табл. 1–4.
Уровень малонового диальдегида до лечения в плазме больных легким течением акне выше показателей контрольной группы на 33,6 %, при среднетяжелом течении – на 68,6%, при тяжелом – на 69,4%. В процессе лечения во всех трех группах при легком и среднетяжлом течении происходило снижение концентрации малонового диальдегида до показателей контрольной группы. При тяжелом течении уровень малонового диальдегида в процессе лечения во всех трех группах не имел статистически значимых различий по сравнению с показателем до лечения.
Уровень диеновых конъюгатов до лечения превышал контрольные показатели в 7,9–8,3 раза при всех типах лечения. Концентрация диеновых конъюгатов снижалась до уровня контрольной группы при легком течении при применении нутрицевтиков и антиоксидантов в составе моно- и комплексной терапии, оставаясь без изменений при использовании комплексного лечения. При среднетяжелом течении концентрация диеновых конъюгатов существенно снижалась также при использовании схемы: нутрицевтики+антиоксиданты+комп-лексное лечение (р<0,05) и статистически незначимо при комплексном лечении. При тяжелом течении показатели диеновых конъюгатов не изменялись в ответ на проводимое лечение.
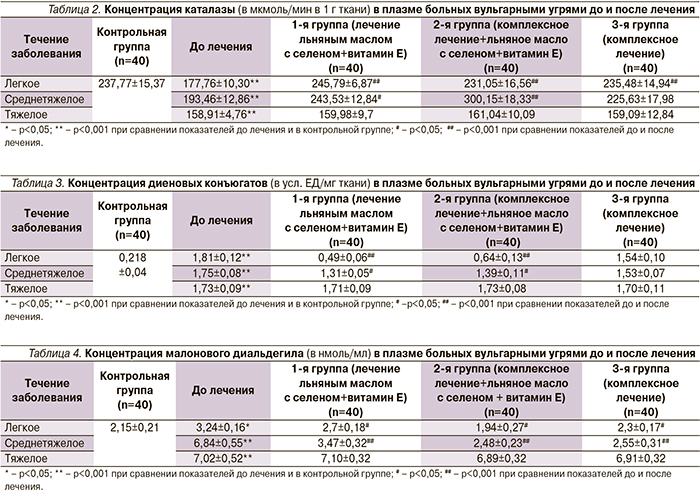
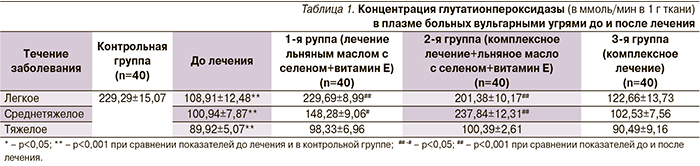
Концентрация глутатионпероксидазы до лечения была ниже, чем в контрольной группе: при легком течении – в 2,1 раза, среднетяжелом – в 2,3, тяжелом – в 2,5 раза.
В первой группе (лечение ПНЖК+ антиоксиданты) произошло повышение концентрации глутатион-пероксидазы при легком течении в 2,1 раза, при среднетяжелом – в 1,47, при тяжелом течении изменения статистически недостоверны.
Во второй группе соответствующий рост: при легком течении – в 1,85 раза, при среднетяжелом – в 2,36, при тяжелом течении тенденция к повышению статистически недостоверна.
В третьей группе: различий в уровне содержания глутатионпероксидазы вне зависимости от вида терапии не выявлено ни в одной группе.
Концентрация каталазы до лечения была снижена при легком течении на 25,2 %, при среднетяжелом – на 18,6, при тяжелом – на 33,2%.
Концентрация глутатионпероксидазы при легком течении достигала контрольных показателей при использовании монотерапии и сочетания нутрицевтиков и антиоксидантов с комплексной терапией. При проведении комплексной терапии тенденция к повышению оказалась статистически незначимой.
При среднетяжелом течении акне концентрация глутатионпероксидазы достигла контрольных показателей только при использовании сочетания комплексной терапии и нутрицевтиков.
При тяжелом течении уровень каталазы был статистически значимо ниже показателей контрольной группы, однако в процессе лечения во всех трех группах показатели не изменились.
В целом при легком течении эффективность комплексной терапии с применением полиненасыщенных незаменимых жирных кислот была на 37% выше, чем при применении только комплексной терапии, среднетяжелом течении – на 22, тяжелом – на 0,5%.
На основании исследования уровня ферментов системы перекисного окисления липидов (ПОЛ) при различных типах течения акне можно сделать вывод, что имеют место значительные отклонения по сравнению с контрольной группой. Повышение уровня диеновых конъюгатов и малонового диальдегида у больных на фоне снижения антиоксидантной активности плазмы (снижение уровня каталазы и глутатионпероксидазы) свидетельствует, по нашему мнению, о наличии «окислительного стресса».
Это диктует необходимость коррекции ПОЛ в составе комплексного лечения акне. Предложенный нами метод использования ПНЖК и антиоксидантов в составе комплексной терапии [12] позволяет нормализовывать уровень ферментов ПОЛ при легком и среднетяжелом течении акне, что коррелирует с клиническим улучшением течения заболевания. Тенденция улучшения показателей при тяжелом течении акне была статистически незначимой.
Таким образом, введение в комплексную терапию акне ПНЖК и антиоксидантов патогенетически, лабораторно и клинически обосновано и может быть рекомендовано для практического применения.
Литература
Об авторах / Для корреспонденции
Читайте также:

