Ламинин в коже что это
Обновлено: 02.05.2024
Строение и функции базальной ламины (мембраны)
• Базальная ламина представляет собой тонкий слой внеклеточного матрикса, который располагается на базальной стороне эпителиального слоя и в области нейромышечных контактов и состоит, по крайней мере, из двух различных слоев
• Базальная мембрана состоит из базальной ламины связанной с сетью коллагеновых волокон
• Базальная мембрана функционирует в качестве опорной структуры, поддерживающей эпителиальную ткань, служит диффузионным барьером и местом сбора таких растворимых белков, как факторы роста, а также сигналом, направляющим миграцию нейронов
• В разных тканях компоненты базальной ламины отличаются друг от друга, однако для большинства характерно наличие четырех основных компонентов внеклеточного матрикса: слои коллагена IV и ламинина, скрепленные вместе гепарансульфат протеогликанами и линкерным белком, нидогеном
Термином базальная ламина обозначается тонкий слой (или ламина) внеклеточного матрикса, который непосредственно примыкает ко многим типам клеток, контактируя с ними. Базальная ламина представляет собой самостоятельную форму внеклеточного матрикса, поскольку она содержит такие характерные белки, как коллаген IV, обнаруженный только в базальной ламине, а также имеет слоистую структуру.
Вначале этот термин применялся только для обозначения слоя внеклеточного матрикса, находящегося в контакте с базальной поверхностью клеток эпителия (отсюда название базальная), где впервые с помощью электронного микроскопа удалось наблюдать базальную ламину. В настоящее время, когда идентифицированы основные компоненты базальной ламины, мы также используем этот термин для обозначения слоя, находящегося в месте контакта между мышечными и нервными клетками, что связано с тем, что этот слой содержит много таких же белков, что и базальная ламина, расположенная под клетками эпителия.
В течение многих лет этот слой внеклеточного матрикса назывался по-разному. В сканирующем электронном микроскопе базальная ламина выглядит как хорошо видимый слой, разделяющий две группы клеток. В трансмиссионном электронном микроскопе базальная ламина имеет вид двух слоев, ширина каждого из которых составляет 40-60 нм. Область, примыкающая к плазматической мембране эпителиальных клеток, кажется практически пустой и называется прозрачной ламиной (lamina lucida, от лат слова lucidus, яркий, прозрачный). Область, расположенная дальше всего от плазматической мембраны, интенсивно окрашивается электронно-плотными красителями и называется плотной ламиной (lamina densa).
За плотной ламиной лежит сеть коллагеновых волокон, которая иногда называется ретикулярной ламиной; в световом микроскопе базальная и ретикулярная ламины выглядят как один слой, который часто называется базальной мембраной. Часто термины базальная ламина и базальная мембрана используются для обозначения одних и тех же структур.
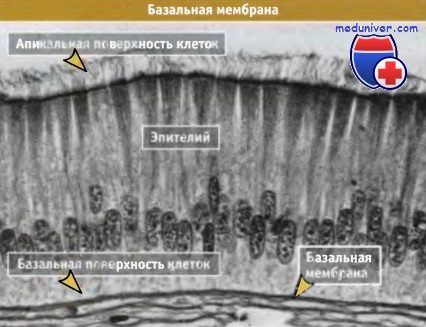
Базальная мембрана имеет вид тонкого слоя,
состоящего из белков и расположенного непосредственно под клетками эпителия.
Базальная ламина выполняет четыре основные функции:
• Она служит структурным основанием слоя эпителиальных клеток. Клетки присоединяются к ламининовым и коллагеновым волокнам базальной ламины посредством специальных структур, которые называются полудесмосомы и которые также скрепляются с сетью промежуточных филаментов. Таким образом, базальная ламина связывает сети промежуточных филаментов нескольких клеток, что укрепляет ткань. Это особенно характерно для кожи, которая представляет собой очень упругий орган!
• Базальная ламина представляет собой барьер между компартментами эпителия, который обладает селективной проницаемостью. Содержащиеся в ней про-теогликаны задерживают нерастворимые частицы (погибшие клетки, бактерии и т. д.), тем самым устраняя инфекции и способствуя деятельности иммунной системы.
• Протеогликаны базальной ламины связывают, иммобилизуют и концентрируют растворимые лиганды (например, факторы роста), находящиеся в жидкой среде тканей. Это способствует доступности факторов роста для клеток и в ряде случаев облегчает их связывание с рецепторами.
• Присутствующие в базальной ламине ламининовые белки служат сигналом, направляющим конусы роста развивающихся нейронов. Это один из путей, который используется данными отростками нейронов для обнаружения своих клеток- мишеней.
Учитывая столь широкий набор функций, неудивительно, что молекулярные компоненты базальной ламины варьируют в зависимости от вида ткани, а для одной и той же ткани даже изменяются во времени. Выделение этих компонентов представляет собой трудную задачу, поскольку в большинстве тканей на долю базальной ламины приходится крайне незначительная часть внеклеточного матрикса. К счастью для исследователей, идентификация у мышей хондросаркомы, опухоли, секрети-рующей большие количества белков «базальной мембраны», позволила выполнить детальный анализ компонентов базальной ламины. Сейчас в составе базальной ламины идентифицировано около 20 разных белков.
Почти во всех тканях в базальной ламине обнаружено четыре основных компонента. Это коллаген типа IV, ламинин, гепарансульфат-протеогликаны, и энтактин (также известный под названием нидоген). Предложена модель, объясняющая, каким образом эти компоненты встроены в слоистую конфигурацию базальной ламины.
Согласно этой модели, коллаген типа IV и ламинин полимеризуются, образуя разветвленные сетеобразные структуры. Эти структуры расположены одна поверх другой и образуют слои, которые скрепляются вместе мостиками, состоящими из таких белков, как гепарансульфат-протеогликан перлекан и энтактин, связывающиеся с обеими сетевыми структурами. Остальные компоненты, такие как ламинин-5 и филаменты коллагена типа VII, которые связываются с белками полудесмосом, вплетаются между слоями.
Каким образом эти дополнительные белки связываются с основными компонентами, неизвестно. Правда существуют данные о том, что за правильную сборку интактной базальной ламины отвечает клеточный контакт, который обеспечивается интегриновыми рецепторами. После сборки базальная ламина образует прочно связанную сложную сеть белков, которая обеспечивает необходимую структурную устойчивость эпителиальной ткани и в то же время остается достаточно пористой для того, чтобы функционировать как селективный фильтр внеклеточных жидкостей.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Кожа состоит из эпидермиса и дермы, они отделены эпидермальной базальной мембраной. Слово «отделены» отражает только структурное разделение слоёв кожи. Но, правильнее пользоваться термином «дермо-эпидермальное соединение», которое отражает механическую и физиологическую взаимосвязь между двумя слоями, обеспечивая их жизнеспособность и целостность.
Дермо-эпидермальное соединение, или базальная мембрана, состоит из около 20 типов различных молекул и толщиной около 100 нанометров. Оно играет важную роль в поддержании структуры кожи, скрепляя эпидермис и дерму с помощью якорных комплексов. Контролирует пролиферацию и дифференцировку базальных клеток в эпидермисе, являясь проводником, как различных сигналов, так и всех питательных веществ в эпидермис из дермы.
Разрушение данного соединения приводит к появлению морщин, это происходит не только в коже пожилых людей. Дегенеративные изменения в структуре поверхности кожи также отмечаются на коже лица людей в возрасте от 20 до 30 лет. Считается, что такие повреждения и изменения являются признаками преждевременного старения кожи и приводят к образованию морщин и провисанию. Значит, ранний уход за базальной мембраной – необходимый и эффективный метод предотвращения старения кожи.
Основные причины возрастных изменений кожи:
- УФ-излучение.
- Обезвоживание.
- Стресс.
- Преждевременное старение:
- нарушение барьерных функций кожи;
- атака свободных радикалов;
- старение кожи, связанное с генетическими изменениями;
- -чувствительность, гиперчувствительность, мнимая чувствительность кожи.
Базальная мембрана - важнейшая структурная единица кожи, тонкий бесклеточный слой, отделяющий соединительную ткань от эпителия или эндотелия, представляет собой своеобразную границу между соединительной тканью и эпителием.
Состоит из двух пластинок: светлой (лат. lamina lucida) содержащей элементы, подобные протеинам, протеогликанам и антигену пузырчатки; тёмной (lamina densa), содержащей элементы, подобные коллагену, энтактину, гепарансульфату. Иногда к тёмной пластинке прилегает образование, называемое фиброретикулярной пластинкой (lamina fibroreticularis) , состоящей из коллагеновых фибрилл. Ретикулярная пластинка соединена с базальной пластинкой с помощью якорных фибрилл (коллаген типа VII) и микрофибрилл (фибриллин).
Светлая пластинка (lamina lucida/lamina rara) - толщина 20-30 нм, светлый мелкозернистый слой, прилежит к плазмалемме базальной поверхности эпителиоцитов. От полудесмосом эпителиоцитов вглубь этой пластинки, пересекая её, направляются тонкие якорные филаменты. Содержит протеины, протеогликаны и антиген пузырчатки.
Темная (плотная) пластинка (lamina densa) - толщина 50-60 нм, мелкозернистый или фибриллярный слой, расположен под светлой пластинкой, обращен в сторону соединительной ткани. В пластинку вплетаются якорные фибриллы, имеющие вид петель (образованы коллагеном VII типа), в который продеты коллагеновые фибриллы подлежащей соединительной ткани. Состав: коллаген IV, энтактин, гепарансульфат.
Ретикулярная (фиброретикулярная) пластинка (lamina reticularis) — состоит из коллагеновых фибрилл и микроокружения соединительной ткани, связанных с якорными фибриллами.
К функциям базальной мембраны относят:
- структурную;
- фильтрационную;
- миграционную (базальная мембрана формирует направление клеточных миграций);
- детерминирующую (базальная мембрана обеспечивает детерминацию полярности клеток);
- метаболизирующую;
- регенерирующую;
- морфогенетическую.
Состав:
- Коллаген IV типа - образует опорный каркас базальной мембраны. В случае, если коллаген IV типа находится в здоровом состоянии, то и мембрана функционирует правильно, держа оба слоя кожи вместе (соединительную ткань и эпидермис).
- Коллаген VII типа - представляет собой якорьки-скрепочки, плотно держащий и скрепляющий коллагеновые фибриллы (пучки) базальной мембраны с коллагеновыми фибриллами из дермы, т.е. коллаген VII-го типа «скрепляет» и удерживает коллагеновые пучки IV-го типа (базальная мембрана, которая «держит в тонусе» эпидермис), и коллагеновые волокна I и III типов (основное пространство дермы). В итоге, если всё функционирует и синтезируется вовремя, получаем плотно-сотканную кожную ткань, которую можно охарактеризовать, как «молодую»;
- гепарансульфат-протеогликан — компонент, участвующий в процессах клеточной адгезии, демонстрирующий ангигенные свойства;
- димеры — ключевой компонент фибрилл, обеспечивающий особую прочность мембраны;
- энтактин — компонент, связывающий коллаген в мембране с гликопротеинами;
- гликопротеины — адгезивный субстрат, посредством которого эпителиоциты фиксируются к мембране.
Функции:
- Именно от качества и целостности базальной мембраны зависит упругость и эластичность кожи.
- Базальная мембрана - это плотное бесклеточное образование, на котором располагаются клетки базального слоя эпидермиса, кератиноциты, имеющие с ней прочную связь.
- В ней протекают активные процессы внутриклеточного синтеза коллагена.
- Фильтр, не пропускающий крупные молекулы в глубокие слои кожи. Она выполняет механические, барьерные и обменные функции для эпидермиса, играет важную роль в контролировании клеточного поведения.
- Через нее осуществляется питание клеток базального слоя эпидермиса, а значит, улучшается его структура, укрепляется местный иммунитет.
- Через ее активизацию происходит улучшение обменных процессов в дерме, стимуляция выработки коллагена, что является основой для улучшения общего вида кожи.
- «Связной» между эпидермисом и дермой. Базальная мембрана связана с эпидермисом и дермой при помощи специализированных фибрилл-якорей, состоящих из молекул коллагена типа VII. Он играет роль «якоря» и осуществляет взаимосвязь структур дермы и эпидермиса.
К основному гликопротеину базальной мембраны относится ламинин-5. Находится в межклеточном материале, который связывает все внутренние органы в единый организм. Это, своего рода, основа, фундамент. Своими тремя короткими «веточками» она держится за другие такие же молекулы, создавая эту основу, а длинной присоединяется к клеткам, фактически прикрепляя органы к «основе». Ламинин жизненно необходим, потому что он практически «склеивает» все ткани, препятствует нашим телам разваливаться.
Ламинин 5 – это также пептид, передающий сигналы и активно участвующий в восстановлении кожи. При повреждении кожи он способствует ускоренной миграции и адгезии кератиноцитов для скорейшего закрытия дефекта, а значит, является незаменимым участником регенерации эпидермиса.
В современной эстетической медицине и косметологии есть много средств, действие которых направлено на восстановление эпидермиса, его ускоренное обновление и питание. Целые комплексы процедур нацелены на улучшение качеств дермы - усиление её упругости за счёт увеличения синтеза коллагена, эластина, гиалуроновой кислоты и др. Дермо-эпидермальное соединение (базальная мембрана), как отдельная важная структура кожи, должна награждаться особым вниманием специалистов при выборе процедур для омоложения кожи.
Внеклеточный матрикс (ВМК, англ. extracellular matrix, ECM) — внеклеточные структуры ткани (интерстициальный матрикс и базальные мембраны). Многокомпонентная субстанция, в которую погружены все клетки нашего организма. В последнее десятилетие интерес к внеклеточному матриксу значительно возрос. Это связано с установлением его роли в старении, клеточной дифференцировке, успешной терапии рака и лечении некоторых наследственных заболеваний.
Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, но формировать ВКМ умеют и другие клетки: в хрящах, это хондроциты, а в костях — остеобласты. Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Разрушители ВКМ. Порядок в ВКМ наводят белки — разрушители его компонентов. Наиболее важные из них, металлопротеиназы, «расчищают путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
Основное вещество ВКМ. Основу матрикса формируют гиалуроновая кислота и особые белки: гликопротеины и протеогликаны. В состав ВКМ входит и множество других белков со специфической функциональной нагрузкой.
В гликопротеинах доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот. Это структурные белки, как коллаген и эластин. За счет самого распространенного структурного белка в организме — коллагена — ВКМ приобретает прочность, а за счет эластина — гибкость и эластичность.
Протеогликаны — сложные белки с высокой степенью гликозилирования, часто имеющие в своем составе уроновые кислоты. 90–95% массы такой молекулы составляют длинные углеводные цепи регулярного строения, а на белки приходится лишь 5–10%. Такое строение обуславливает высокую молекулярную массу протеогликанов. Протеогликаны запасают воду и полезные вещества. Выполняют функцию наполнителя (основного вещества). Благодаря полярной природе и сильному отрицательному заряду, они связывают катионы и основную часть воды. Играют роль межтканевых прослоек и смазочного материала в суставах.
Интегрины — трансмембранные клеточные рецепторы, которые взаимодействуют с матриксом и участвуют в межклеточной коммуникации. Благодаря этим контактам в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз.
Межклеточный матрикс выполняет разнообразные функции:
- является основой соединительной ткани, её клетки образуют с веществами матрикса межклеточные контакты (гемидесмосомы, адгезивные контакты и др.), которые могут выполнять сигнальные функции и участвовать в локомоции клеток;
- обеспечивает механические контакты между клетками, образует механически прочные структуры (кости, хрящ, сухожилия и суставы) и транспорт химических веществ;
- составляет основу фильтрующих мембран (например, в почках);
- изолирует клетки и ткани друг от друга (например, обеспечивает скольжение в суставах и движение клеток);
- формирует пути миграции клеток, вдоль которых они могут перемещаться, например, при эмбриональном развитии.
Межклеточный матрикс имеет различные составные вариации и выполняет множество функций.
![]()
Клеточная мембана - это двойной слой липидов, большинство из которых – фосфолипиды. Интегрины, дистрогликаны и рецепторы домена дискоидина (DDR) – белки, пронизывающие мемрану клетки. Являются клеточными рецепторами, взаимодействуют с внешней средой и передают межклеточные сигналы.
Базальная мембрана разделяет клетку и соединительную ткань (матрикс). Значит, практически все клетки вступают в контакт с матриксом напрямую. Базальная мембрана сформирована ламинином (светлая пластинка) и коллагеном 4 типа (темная пластинка), они объединены белком нидогеном (энтактином), из этих компонентов создана пространственная структура, обеспечены механическая поддержка и защита клеток.
Фибронектин – белок клеточной адгезии, гликопротеин, также отвечающий за структуру ткани, может формировать мультимерные цепочки. Участвует в адгезии, то есть сцеплении клеток. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ.
Также в базальной мембране содержатся молекулы протеина перлекана, занимающегося поддержкой физиологического (эндотелиального) барьера между кровеносной системой и центральной нервной системой. Участвует в нейромышечном соединении, отвечая за доставку нервных импульсов к мышечным клеткам. Обеспечивает защиту нервной ткани от находящихся в крови микроорганизмов, токсинов, клеточных и гуморальных факторов иммунной системы, которые воспринимают нервную ткань как чужеродную.
Далее располагается межклеточный матрикс или соединительная ткань. Его составляющие:
Коллагены - белки, состоящие из остатков аминокислот (или пептидов). Молекула коллагена - это спираль из трёх закрученных аминокислотных (пептидных) цепочек. Эти цепочки объединяются в «жгуты» из цепочек — фибриллы, а из пучков фибрилл состоят как раз коллагеновые волокна. Фибриллярные белки, составляющие основу соединительной ткани организма (сухожилия, кости, хрящи, дерма и т.д.), их волокнами пронизан ВМК. Характерные свойства - прочность на разрыв, эластичность и гибкость. Эластичным белком с аналогичными свойствами является эластин.
Эластин формирует трехмерную сеть белковых волокон. Она обеспечивает механическую прочность ткани, обеспечивает контакты между клетками, формирует пути миграции клеток, вдоль которых они могут перемещаться, изолирует разные клетки и ткани друг от друга.
Аггрекан (протеогликановый хондроитинсульфат) – хрящевой специфичный протеогликановый ядерный белок. Связывает фибриллы коллагена II типа, удерживает и связывает воду, ГК и белки, формируя осмос, а значит, делает соединительную ткань устойчивой к большим нагрузкам. Области высокого содержания аггрекана и глюкозаминогликана способствуют осмосу, необходимому для нормального функционирования хрящевой ткани, создают «разбухание» ткани, которое препятствуют внешнему давлению на неё.
Гиалуроновая кислота (ГК) синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и дает клеткам возможность закрепляться на различных поверхностях. Она участвует в регенерации ткани. Содержится во многих биологических жидкостях, в том числе синовиальной, отвечает за вязкость соединительной ткани. В связке с аггреканом формирует устойчивость к компрессии. Это основной компонент биологической смазки и суставного хряща, в котором присутствует в виде оболочки каждой клетки (хондроцита).
Коллаген 7 типа - связующий структурный компонент. Например, в коже это якорные фибриллы в связке дермы (собственно кожи) и эпидермиса. То есть он «скрепляет» и удерживает коллагеновые пучки IV-го типа (базальная мембрана, «держит в тонусе» эпидермис) и коллагеновые волокна I и III типов (основное пространство дермы).
• Ламинины представляют собой семейство белков внеклеточного матрикса, которые находятся практически во всех тканях позвоночных и беспозвоночных
• Основная функция ламининов заключается в создании адгезивного субстрата для клеток и в обеспечении устойчивости тканей к растяжению
• Ламинины являются гетеротримерами, состоящими из трех различных субъединиц, которые закручены вокруг друг друга и находятся в суперспиральной конфигурации
• Гетеротримеры ламинина не образуют фибрилл; они связываются с линкерными белками, которые дают им возможность образовывать во внеклеточном матриксе сложные переплетения
• С ламининами связано много белков, включая более 20 различных поверхностных рецепторов
Ламинины представляют собой обширное семейство больших (> 100 кДа) белков внеклеточного матрикса, находящихся в базальной ламине (отсюда их название) и в других местах локализации внеклеточного матрикса во многих тканях. Ламинины экспрессируются в клетках позвоночных и беспозвоночных, и степень гомологии между разными представителями семейства этих белков довольно низкая. Это позволяет предполагать, что ламинины представляют собой эволюционно древние белки.
Так же как и коллагены, ламинины состоят из трех полипептидных субъединиц, обернутых вокруг друг друга и образующих тройную суперспирализованную структуру. Последовательность, обеспечивающая формирование этой витой структуры у ламининов, составляет семь аминокислот, и в каждой из трех субъединиц находится в многочисленных повторах.
Благодаря образованию витой структуры между субъединицами образуется максимальное количество нековалентных связей и обеспечивается устойчивость образующегося тримера. Когда сформировалась витая структура, происходит ковалентное связывание субъединиц посредством дисульфидных связей. В витую структуру организуется только часть каждой субъединицы; при этом каждая субъединица также формирует выступающие из спирали «отростки», с помощью которых, как показано на рисунке ниже, образуется переплетенная структура.
Ламинины представляют собой гетеротримеры: три субъединицы, содержащиеся в одном белке, являются продуктами различных генов и подразделяются на три группы: а, β и γ. Пока обнаружено пять а, три β и три γ, и некоторые из них за счет дифференциального сплайсинга могут давать дополнительные варианты. Теоретически эти субъединицы могут объединяться, образуя более 100 различных гетеротримерных сочетаний, однако пока их идентифицировано только 15 (они называются изоформы и нумеруются с 1 по 15).
Тем не менее это количество изоформ позволяет образовываться в одном организме множеству сетеобразных структур, состоящих из различных ламининов.
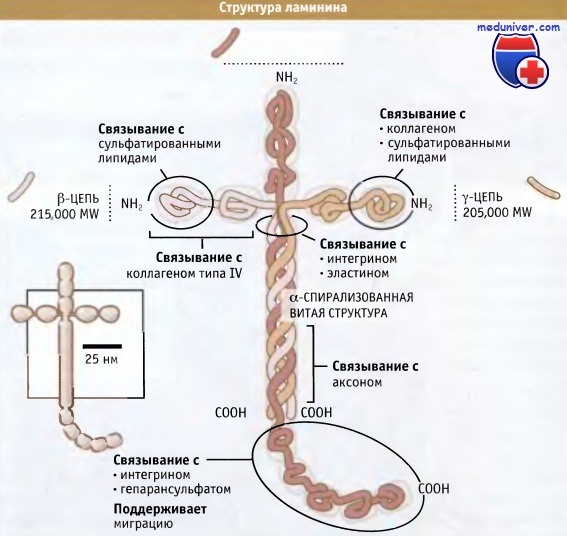
![Структура ламинина]()
Три цепи, составляющие молекулу ламинина, обернуты вокруг друг друга, образуя центральный кор (ядро или сердцевину).
От него крестообразно отходят N-концевые области каждой цепи.
Карбоксильный участок а цепи выходит из центрального кора, образуя пять глобулярных доменов.
Отмечены основные связывающие сайты.В отличие от основных классов гликопротеинов, присутствующих во внеклеточном матриксе, ламинины не образуют фибрилл. Они организованы в переплетенные сетеобразные структуры, которые способны противостоять силам растяжения, приложенным к тканям одновременно в нескольких направлениях.
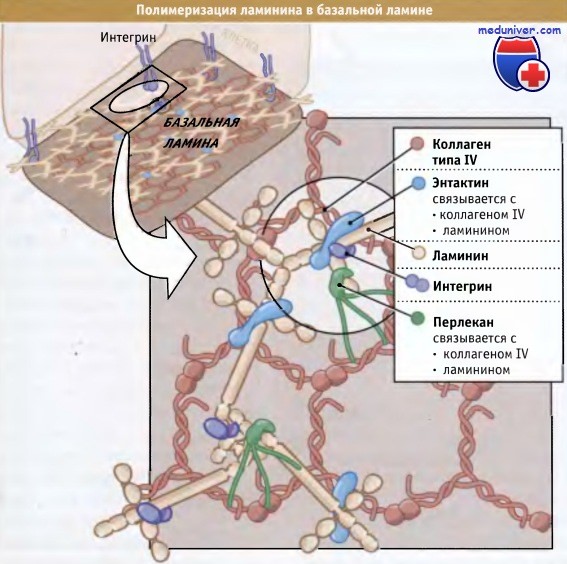
Короткие отростки гетеротримера ламинина, представляющие собой N-концевой участок каждой субъединицы, содержат домены, которые связываются с другими компонентами внеклеточного матрикса, образуя переплетенную паутинообразную структуру. На рисунке ниже представлен показательный пример структуры, образованной ламинином-1 в базальной ламине, где он взаимодействует с такими компонентами внеклеточного матрикса, как энтактин (также называмый нидоген), перлекан и коллаген IV. У некоторых субъединиц ламинина эти домены отсутствуют, и механизм полимеризации таких ламининов остается неизвестным.
Каковы функции ламининов? На основании ранних морфологических и биохимических исследований было установлено, что ламинин-1 в большом количестве присутствует в базальной ламине и поддерживает прикрепление и распространение по ней эпителиальных клеток многих типов, происходящее с участием интегриновых рецепторов. Распространение клеток по ламининовой структуре предполагает, что она должна быть достаточно прочной, чтобы противостоять растяжениям, возникающим при реструктурировании цитоскелета. Многие связанные с ламинином-1 белки (особенно энтактин), играют критическую роль в сборке сетей из этого белка.
В дальнейших исследованиях были идентифицированы участки молекулы ламинина, ответственные за адгезию и миграцию клеток, а также были выяснены роли ламининов в процессах развития. Так же как и в случае фибронектинов, частичное переваривание ламининов протеазами было использовано для расщепления интактной молекулы на небольшие функциональные единицы, которые использовались для изучения их связывания с другими белками.
Пока в результате этих исследований удалось построить функциональную карту доменов ламинина, которая не выглядит столь подробной, как, например, для фибронектина. Затруднение изучения связано с тем, что ламинин образует непрерывную витую структуру, и отдельные участки разрушаются даже при ограниченном протеолизе.
Известно, что с различными областями молекулы ламининов связано большое количество функций и участков связывания с другими белками. Например, для ламинина-1 идентифицировано более 20 разных рецепторов. Кроме того, как показано на рисунке ниже, такие множественные сайты, как глобулярные домены, расположенные на С-концевом участке а-цепи, играют важную роль в регуляции миграции клеток.
Из основных рецепторов ламинина три относятся к интегринам, наряду с неинтегриновым рецептором с мол. массой 67 кДа. В свою очередь, эти рецепторы ассоциированы с различными элементами цитоскелета и связываются с различными сочетаниями сигнальных белков, так что каждый ламининовый рецептор по-разному влияет на поведение клеток. Механизмы регуляции клеточного ответа на связывание ламинина исследованы недостаточно.
В клетках организмов с нарушениями базальной мембраны и образования специфического адгезивного комплекса, называемого полудесмосома, обнаружены мутации в субъединицах ламинина-1 и -5. Эти мутации служат причиной развития многих наследственных кожных заболеваний. В экспериментах с использованием методов обратной генетики, когда в организмах экспрессировались мутантные рекомбинантные ламининовые гены, было показано, что мутации в субъединицах ламинина-2 приводят к нарушениям базальной ламины мышечных клеток, характерной для большинства тяжелых случаев наследственной формы мышечной дистрофии.
Исследования на мышах с нокаутом ламининовых генов продемонстрировали роль этих белков в адресовании нейронов к их специфическим клеточным партнерам, а также в образовании базальной ламины в почках.
![Полимеризация ламинина]()
Ламинин связан по меньшей мере с тремя другими белками внеклеточного матрикса, образуя сеть в базальной ламине.
Ламинины также связываются с интегриновыми рецепторами, которые вытягиваются от поверхности клеток, прикрепленных к базальной ламине.Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Веретеноклеточная гемангиоэндотелиома. Гломусная опухоль.
Веретеноклеточная гемангиоэндотелиома впервые описана S.W. Weiss и F.M. Enzinger в 1986 г. как ангиосаркома низкой степени злокачественности. К 1998 г. было описано 183 случая этой опухоли. Ее доброкачественное течение при отсутствии метастазирования послужило поводом к предположению о том, что она является реакцией на повторные эпизоды внутрисосудистого тромбоза и реканализации, а не опухолью. Однако такая точка зрения не была поддержана другими авторами, считающими ее или доброкачественной сосудистой опухолью, или мальформацией, в которой произошел сосудистый тромбоз.
Веретеноклеточная гемангиоэндотелиома встречается у детей и подростков. Ее частота не зависит от пола. Поражаются дистальные отделы конечностей. Опухоль описана в связи с синдромом Маффуччи, Клиппеля—Тренонея, врожденным лимфостазом, эпителиоидной гемангиоэндотелиомой.
Хотя нередко вначале возникает солитарный узел веретеноклеточной гемангиоэндотелиомы, в большинстве случае опухоль развивается как многофокусный процесс, имеющий тенденцию к местному росту в пределах определенного анатомического участка. Отдельные элементы выглядят как синие узлы плотной консистенции.
Гистологически веретеноклеточная гемангиоэндотелиома состоит из хорошо очерченных, но неинкапсулированных узлов с комбинацией признаков гемангиомы и саркомы Капоши. Расширенные кровеносные сосуды выглядят как тонкие вены, содержащие в своем просвете организованные тромбы и флеболиты. Между расширенными кровеносными сосудами имеются пучки клеток, напоминающих веретенообразные клетки при саркоме Капоши. Однако эти пучки содержат округлые клетки с вакуолизированной цитоплазмой. Иногда вакуоли ация цитоплазмы круглых клеток так выражена, что их можно ошибочно принять за жировую ткань; более половины очагов частично или исключительно внутрисосудистые.
Иммуногистохимически эндотелиальные клетки веретеноклеточной гемангиоэндотелиомы, выстилающие расширенные кровеносные сосуды, и отечные округлые клетки с вакуолизированной цитоплазмой экспрессируют антиген, связанный с фактором VIII, Ulex Europeus l lectin и CD34, но веретенообразные клетки не окрашиваются на эти маркеры. Исследование ДНК веретенообразных клеток этой опухоли методом проточной цитометрии показало, что в 13 из 14 случаев они были диплоидными с низким пролиферативным индексом, что свидетельствует о доброкачественном течении опухоли.
При электронной микроскопии округлые клетки веретеноклеточной гемангиоэндотелиомы имели ультраструктурные характеристики эндотелиальных клеток, а веретенообразные клетки — менее Дифференцированных мезенхимальных клеток, напоминающих фибробласты.
Дифференциальный диагноз веретеноклеточной гемангиоэндотелиомы проводится с узлами при саркоме Капоши, не имеющими расширенных кровеносных сосудов с гемангиомоподобным видом и эпителиоидных округлых клеток с вакуолизированной цитоплазмой.
![ангиома]()
Гломусная опухоль
Гломусная опухоль (син.: гломус-ангиома, гломангиома, ангионевромиома, опухоль Барре — Массона) — доброкачественная опухоль артериовенозного клубочкового анастомоза, или гломуса. Она развивается из стенок канала Одке—Гойера, соединяющего напрямую артериолу и собирательный сегмент венулы. Встречается относительно редко. Обычно локализуется в акральных, реже в других участках кожи. Иногда может поражать экстракутанные области: слизистые оболочки, кость, желудок, кишечник, трахею, средостение, где нормальные гломусные тельца редки или даже отсутствуют.
Выделяют два типа гломусных опухолей: солитарные и множественные.
Солитарная гломусная опухоль — наиболее частая гломусная опухоль. Возникает после травмы. Представляет собой маленькую (около 5 мм в диаметре) куполообразную папулу или узел синевато-красного или сине-фиолетового цвета, мягкой или плотной консистенции. Типичная локализация — ногтевое ложе, нередко с эрозированием дистальной фаланги. Довольно часто пораженный ноготь приобретает сине-красный оттенок. Характерны приступы интенсивной боли, особенно при переохлаждении или небольшом давлении. Солитарные гломусные опухоли могут также локализоваться на шее, голове, половых органах.
Гистологически солитарная гломусная опухоль в основном солидная. Она выглядит как хорошо отграниченный узел, состоящий и гроздьев округлых или полигональных мономорфных гломусных клеток с крупным круглым или овальным ядром и скудной эозинофильной цитоплазмой. В центре некоторых гроздьев имеются выстланные эндотелием сосудистые пространства. Характерно отсутствие плеоморфизма опухолевых клеток. В некоторых опухолях муцинозная строма содержит тучные клетки, большое количество нервных волокон.
Редкие гистологические варианты солитарной гломусной опухоли — гломусные опухоли с большими гиперхромными ядрами, гломусные опухоли, состоящие из гломусных клеток с большим выбором зернистой цитоплазмы, названные онкоцитарными гломусными опухолями, внутрисосудистая гломусная опухоль, интраневральная гломусная опухоль, эпителиоидная гломусная опухоль и инфильтративная гломусная опухоль, состоящая из большого глубоко расположенного узла.
Множественные гломусные опухоли встречаются значительно реже, чем солитарные, и носят название «гломангиомы» из-за ангиоматозного вида опухоли. Они, как правило, встречаются у детей, нередко наследуются аутосомно-доминантным путем и локализуются на любых участках кожи, слизистых оболочках и во внутренних органах. Представлены отдельными папулами или бляшками, не столь болезненными, как солитарные гломусные опухоли. Иногда опухоли достигают больших размеров и имеют мягкую консистенцию. У больных с генерализованными опухолями могут быть признаки синдрома Казабаха—Меритта.
Гистологически в гломангиомах менее выражена пролиферация гломусных клеток и больше сосудистых полостей. При иммуногистохимическом исследовании было установлено, что гломусные клетки экспрессируют виментин и мышечно-специфический актин. Ряд авторов отмечали положительное окрашивание на десмин, но эти данные не были подтверждены другими исследователями. В оболочке гломусных клеток обнаружены ламинин и IV тип коллагена.
Диагноз гломусной опухоли устанавливается гистологически. Дифференциальный диагноз проводится с гемангиомой, лейомиомой, эккринной спираденомой, фибромой, меланомой, синим невусом.
Солитарные гломусные опухоли удаляют хирургически или с помощью лучей лазера. При множественных гломангиомах удалению подлежат только болезненные опухоли.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.Читайте также: