Кожа тампонато что это
Обновлено: 28.04.2024
Приобретенная кератодермия ладоней и подошв. Приобретенный ихтиоз. Дерматомиозит у взрослых.
Приобретенная кератодермия ладоней и подошв — приобретенный точечный кератоз ладоней и подошв, который может ассоциироваться со злокачественными новообразованиями внутренних органов. Это заболевание, в частности, часто ассоциируется с раком мочевого пузыря (87% случаев) и бронхов (71%), хотя нередко встречается и у здоровых лиц старше 50 лет (36%). Дифференциальный диагноз проводится с точечным кератозом ладоней — встречающимся наследственным заболеванием, ассоциированным с аденокарциномой толстой кишки.
Приобретенный ихтиоз — редкое заболевание, развивающееся после 20 лет и являющееся как паранеопластическим заболеванием, так и результатом нарушения функции пищеварительного тракта, применения холестеринснижающих препаратов (никотиновой кислоты, трипаранола, бутирафенона), саркоидоза, лепры, гипотиреоза, пеллагры СПИДа, системной красной волчанки, гиповитаминозов.
По данным литературы, ихтиоформные изменения кожи отмечаются при 2-50% неоплазий. При этом приобретенный ихтиоз чаше всего ассоциируется с болезнью Ходжкина, реже — с лейкозом, лимфосаркомой, саркомой Капоши, грибовидным микозом, раком молочной железы, опухолями яичка. Он может возникать одновременно с выявлением злокачественного новообразования, а также до или после этого. В частности, он обычно появляется спустя несколько недель или месяцев после манифестации болезни Ходжкина, хотя может быть и ее первым симптомом.
Приобретенный ихтиоз
Приобретенный ихтиоз, как паранеопластический процесс, нередко клинически и гистологически не отличается от вульгарного ихтиоза.
Гистологически при приобретенном ихтиозе выявляют ретенционный гиперкератоз (с истончением или полным отсутствием зернистого слоя), обусловленный дефектом синтеза кератогиалина. При ихтиозе, ассоциированном с болезнью Ходжкина, тотальный ангидроз обусловлен вакуольной дегенерацией эккринных секреторных клеток.
Клиническая картина приобретенного ихтиоза характеризуется диффузным, различной степени выраженности поражением кожи туловища и конечностей в виде наслоений чешуек разных размеров и цвета (от белесоватых до серо-черных), в результате чего кожа становится сухой, шершавой на ощупь. Наиболее сильно поражение выражено на разгибательных поверхностях конечностей, особенно локтей и коленей, в то время как шея и сгибательные поверхности локтевых и коленных суставов и подмышечные ямки не поражены. Характерен фолликулярный кератоз в виде мелких суховатых узелков с локализацией в устье волосяных фолликулов диссеминированного характера. Кожа лица шелушится в области лба и щек, на ладонях и подошвах выражен сетевидный кожный рисунок с изменением дерматоглифики и небольшим муковидным шелушением. В очагах поражения также может встречаться эритема. При болезни Ходжкина ихтиоз нередко сопровождается интенсивным и неукротимым зудом.
Диагноз приобретенного ихтиоза является показанием к обследованию больного для исключения у него злокачественного новообразования.
В дифференциально-диагностическом отношении следует учитывать, что начало доминантной формы вульгарного ихтиоза может быть отложено до середины жизни, а приобретенный ихтиоз, ассоциирующийся с болезнью Ходжкина, может встречаться в детстве.
При паранеопластическом ихтиозе показано лечение лежащего в его основе злокачественного новообразования.
Дерматомиозит у взрослых
Дерматомиозит у взрослых — заболевание из группы диффузных болезней соединительной ткани (коллагенозов). которое протекает с преимущественным поражением кожи и скелетной мускулатуры. Этиология неизвестна. Патогенез связан с острым и хроническим воспалением поперечнополосатых мышц, сопровождающимся некрозом мышечных волокон и нарастаюшей мышечной слабостью. Развивается в любом возрасте, чаще между 40 и 50 годами. Связь со злокачественными новообразованиями внутренних органов может иметь место как у взрослых, так и детей . Частота зависит от возраста больных и варьирует от 6 до 60%. Типы злокачественных новообразований внутренних органов при дерматомиозите обычно соответствуют таковым в общей популяции и представлены раками молочной железы, легких, яичников, желудка и т.д. Они обнаруживаются до, во время или после установления диагноза дерматомиозита. Данные литературы свидетельствуют о том, что от 15 до 40% больных дерматомиозитом будут иметь злокачественные опухоли внутренних органов. Частота их появления в течение двух первых лет после установления диагноза дерматомиозита в 4-5 раз выше, чем в общей популяции.
Клинически дерматомиозит проявляется симметричной проксимальной мышечной слабостью, характерными кожными высыпаниями, которые могут включать пери орбитальный отек и эритему век с лиловым оттенком (симптом «очков»), эритему лица, груди, шеи и верхней половины туловища (симптом «декольте»), плоские фиолетовые папулы над суставами пальцев (папулы Готтрона), шелушение, эрозии, язвы, атрофию кожи, околоногтевые телеангиэктазии, пойкилодермию. При пальпации могут обнаруживаться атрофия и болезненность мышц. Эритематозные и эрозивные высыпания могут быть и на слизистых оболочках. Кальциноз кожи часто выявляется у детей, но редко у взрослых. Больные жалуются на слабость, затруднение глотания, заболевание сопровождается интерстициальной пневмонией, нарушением сердечного ритма, васкулитом. Частота злокачественных новообразований внутренних органов выше у больных с эрозивными, изъязвленными или некротическими элементами, а также при наличии высыпаний, устойчивых к проводимой терапии.
Гистологически при дерматомиозите выявляют атрофию эпидермиса и гидропическую дистрофию базального слоя, отек сосочкового слоя дермы, гипертрофию, склероз, гомогенизацию коллагеновых волокон, тяжелую дегенерацию, расщепление, атрофию мышечных волокон, воспалительный периваскулярный и диффузный лимфоцитарный инфильтрат; снижение резистентности капилляров.
Диагноз дерматомиозита устанавливается на основании наличия слабости проксимальных мышц конечностей и двух из трех других признаков, таких как повышенная активность мышечных ферментов в сыворотке (креатинфосфокиназы, фруктозобифосфат-альдолазы, аминотрансфераз), характерные изменения на электромиограмме с признаками нарушения нервной проводимости, характерная гистологическая картина при биопсии мышц. Дифференциальный диагноз проводится с красной волчанкой, трихинеллезом, токсоплазмозом.
Больные с признаками дерматомиозита должны подвергаться обследованию с проведением общего и биохимического анализа крови, рентгенографии грудной клетки, маммографии и других исследований, необходимых для выявления злокачественного новообразования внутренних органов.
Удаление опухоли приводит к излечению дерматомиозита.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Многие из анатомии знают, что кожа выступает как «защитная оболочка» организмов людей и животных. Она состоит из двух частей – эпидермиса (верхняя многослойная поверхность эпителия) и дермы (соединительнотканная часть, которая объединяет эпидермис и мышечные ткани организма). Кожа занимает большую площадь на теле человека. У взрослых людей она достигает 1,5-2,3 м 2 . Её главная задача - в защите тела от широкого спектра внешних воздействий. Клетки кожи, как и органы дыхания, принимают внутрь кислород, которым обогащают свою деятельность в организме. При различных травмоопасных ситуациях (например, ожогах и крупных порезах) человек может лишатся своей «защитной оболочки». На заживление и восстановление кожного покрова требуется большое количество времени. Поэтому, чтобы облегчить этот процесс и помочь коже приобрести здоровый вид, учёными были разработаны варианты искусственной человеческой кожи, которая ускорит заживления на теле.
Построение искусственной кожи выглядит следующим образом – на коллагеновый гель (основу искусственной кожи), который содержит дермальные клетки – фибробласты (это аналог дермы, имеющий большое количество коллагена и фибробластов), выкладывают верхним слоем эпителиальные клетки – кератиноциты, которые точь-в-точь похожи на эпидермис – верхний слой кожи. Таким образом, искусственная кожа состоит из двух слоёв, как и настоящая человеческая кожа. На рану накладывается готовое изделие той же структуры, что и кожа пациента, и начинается процесс заживления.
Хотя сама искусственная кожа приживается лишь на время, входящие в ее состав клетки активно секретируют различные ростовые факторы, которые стимулируют собственные клетки пациента к делению и миграции в область раны. Благодаря этому рана начинает быстрее затягиваться по краям. Кожа восстанавливается. Клетки донора постепенно замещаются вновь образованными клетками самого больного. Конечно, в качестве источника кожи можно использовать и собственную кожу пациента с неповреждённых участков, но при ожогах большой площади этого, как правило, не хватает. Так как искусственная кожа по своей структуре напоминает настоящую человеческую кожу, то её также используют и для бионических протезов с сохранением чувствительности.
В России новый материал был разработан в ходе получения смеси из латекса и биоактивных растительных компонентов. Искусственная ткань плотно прилегает к ране, защищает её в дальнейшем от внешних воздействий и выполняет лечебный процесс. Учёные отмечают, что самые сложные повреждения с новой «кожей» затягиваются в течение двух дней. В Институте теоретической и экспериментальной биофизики РАН было создано идеальное раневое покрытие, которое защищает больное место от механических повреждений и вредоносных инфекций. Кроме того, искусственная кожа создает оптимальные условия для роста клеток, пропускает воздух и водные пары, чтобы рана под таким покрытием не высыхала и не мокла. Когда тончайшая пленка накладывается на рану, клетки начинают переходить в нее, смешиваясь с клетками пациента, и активизируют выработку коллагена для зарастания раны и образования рубца. Латексная «подложка» после этого просто отсоединяется, и медикам нет необходимости мучить пациентов бесконечными перевязками. Причем после выписки пациент может самостоятельно использовать лечебные мази, нанося их на латексную пленку, которая имеет микропоры, как обычная кожа.

Эксперимент с использованием 3D-биопринтера на животном
В 2019 году ученые впервые создали 3D-биопринтер, который печатает кожу в два слоя собственной кожи пациента прямо на ране. Над этим исследованием работали специалисты из Института регенеративной медицины (США). Принтер использует «чернила», которые состоят из клеток пациента, чтобы минимизировать риск отторжения. Вначале делается биопсия здоровой кожи пациента и выращивается большое количество клеток, после чего их смешивают с гидрогелем для образования "чернил" 3D-биопринтера. Точнее создаются два типа "чернил" – для внутреннего слоя (из клеток-фибропластов) и внешнего (из клеток-кератиноцитов). После удачных экспериментов, проведенных на мышах, был получен отличный результат, который в дальнейшем позволит проводить клинические испытания на людях.


3D-принтер печатает искусственную кожу с сосудами (Living Skin Can Now be 3D-Printed With Blood Vessels Included/ Теперь живую кожу можно напечатать на 3D-принтере, включая кровеносные сосуды)
После изобретения 3D-биопринтера, печатающего искусственную кожу, идентичную коже пациента, было принято решение усовершенствовать разработку, так как просто полученная кожа могла подойти не каждому пациенту. Основная причина в этом - отсутствие кровеносных сосудов, которые нужны для коммуникации трансплантированного участка с окружающими тканями. Ученые из Политехнического института Ренсселера (Нью Йорк, США) выяснили, что если в биочернила добавить эндотелиальные клетки человека, которые выстраиваются внутри кровеносных сосудов, и клетки перицита человека, обволакивающих вокруг эндотелиальных клеток, вместе с животным коллагеном и другими структурными клетками, то в течение нескольких недель они начинают формировать сосуд. Так, в ходе исследований ученые пересадили участок искусственной кожи мышке. Он удачно прижился на животном и не вызвал отторжения. Кроме того, его сосуды благополучно соединились с кровеносной системой мыши и начали снабжать клетки ткани кровью.

Искусственная кожа с эффектом чувствительности
В сентябре прошлого года исследователи Университета RMIT в Мельбурне представили электронную искусственную кожу, которая чувствует боль и прикосновения. Считается, что новая технология успешно найдет своё применение в протезировании, робототехнике и кожной трансплантации. Данное изобретение может показывать ощущение боли. Устройство имитирует почти мгновенную обратную связь и способно реагировать на боль с той же скоростью, с какой нервные сигналы поступают в мозг. Учёные отмечают, что эта разработка стала значительным прогрессом в области биомедицинских технологий и интеллектуальной робототехники следующего поколения. В будущем такая искусственная кожа может стать вариантом неинвазивных кожных трансплантатов, особенно в случаях, когда традиционный подход нежизнеспособен или не работает.
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
Роль липидов в барьерных свойствах кожи
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
Кожа обеспечивает защиту от механических, тепловых, химических повреждений; имеет собственную иммунную систему; регулирует количество воды в организме; помогает вырабатывать витамин D и ряд гормонов. Все эти функции обеспечиваются различными механизмами, ключевым из которых является целостность барьера, в значительной степени опосредованная структурой рогового слоя эпидермиса. Кожа состоит из слоев эпидермиса, дермы и подкожной жировой клетчатки и пронизана потовыми и жировыми железами и порами, сосудами, нервными волокнами и волосяными мешочками. Верхний слой формируют мертвые клетки (корнеоциты), что обеспечивается дифференцировкой и гибелью кератиноцитов зернистого слоя. В процессе ороговения в кератиноцитах включается синтез ряда белков, уплотняется мембрана клеток, агрегируют промежуточные кератиновые филаменты, высвобождаются во внеклеточное пространство липиды и белки в составе ламеллярных телец (тельца Одланда), выбрасываются органеллы, что обусловливает уплощение клеток, связанных между собой прослойкой липидов, как клеем, и обеспечивает дополнительный непроницаемый для воды барьер. В норме липидная прослойка состоит на 50% из церамидов, на 30% — из холестерина, 20% составляют свободные жирные кислоты (в том числе омега-3, -6 и -9), а также ферменты и белки. При различных заболеваниях нарушается баланс липидов ламеллярных телец, что сопровождается повышенной потерей воды, нарушением процесса ороговения, воспалением. Топические препараты, содержащие аналоги природных липидов, такие как сенсодерм, не только восстанавливают гомеостаз кожи, но и снижают побочные эффекты, вызванные терапевтическими кортикостероидными препаратами.
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
В настоящее время имеются научные доказательства о генетически детерминированных нарушениях барьерных свойств кожи, что облегчает проникновение аллергенов в глубь кожи, повышает склонность к воздействию раздражающих факторов и, в конечном итоге, способствует воспалению. Дефицит филаггрина — наиболее изученная аномалия, в результате которой возрастает трансэпидермальная потеря воды (ТЭПВ). Помимо этого, дефицит межклеточных липидов в роговом слое и нарушенное соотношение между холестерином, незаменимыми жирными кислотами и церамидами усиливает ТЭПВ, что обусловливает образование эпидермальных микротрещин. Нарушение целостности барьерного слоя кожи ведет к нарушению метаболизма кожи и воспалению, что является ключевым промежуточным звеном патогенеза атопического дерматита (АтД) и ряда других дерматологических заболеваний. Базовым элементом терапии АтД, помимо устранения контакта со специфическими и неспецифическими провоцирующими факторами, является восстановление нарушенной барьерной функции кожи путем применения топических гидратирующих и защитных средств. Наружное применение смягчающих средств — одна из важных стратегий лечения АтД и многих других дерматозов для восстановления барьерной функции кожи.
Структура и свойства кожи
Кожа — самый большой орган человека; ее масса составляет 11—15% от массы тела. Кожа обеспечивает несколько важнейших функций: является барьером, отделяющим окружающую среду от внутренней; защищает от механических, тепловых, химических повреждений; регулирует количество воды в организме; обеспечивает осязание; защищает от инвазии патогенов, обеспечивает персистенцию симбиотических микроорганизмов; помогает вырабатывать витамин D и ряд гормонов.

Кожа состоит из слоев эпидермиса, дермы и подкожной жировой клетчатки (см. рисунок, Структура кожи. а — тонкий слой кератиноцитов (эпидермис), дерма и подкожная жировая клетчатка, составляющие основную массу кожи; б, в — кератиноциты в процессе дифференцировки уплощаются и формируют роговой слой, состоящий из мертвых клеток; г — слущивание верхнего слоя; д, е, ж — кератиноциты шиповатого слоя вырабатывают липидную смазку, состоящую из молекул церамидов, холестерина и СЖК (в том числе омега-3, -6, -9), для удержания клеток рогового слоя. Примечание. Церамиды в области полярной части, прикрепленной к мертвым кератиноцитам, формируют малоподвижную псевдокристаллическую решетку; средняя часть липидной прослойки формируется хвостами жирных кислот и холестерином и имеет текучесть (зона текучести отмечена линиями), что обеспечивает эластичность рогового слоя. а). Дерма пронизана потовыми и жировыми железами и порами, сосудами, нервными волокнами и волосяными мешочками. Эпидермис состоит из многослойного ороговевающего эпителия, представленного кератиноцитами. Верхний слой формируют «мертвые» клетки (роговой слой), называемые корнеоцитами. Формирование рогового слоя обеспечивается дифференцировкой и гибелью кератиноцитов верхнего слоя по типу апоптоза, называемой ороговением (cornification). В процессе ороговения в кератиноцитах включается синтез ряда белков (кератины, лорикрин, инволюкрин, филаггрин); уплотняется мембрана клеток; агрегируют промежуточные кератиновые филаменты; высвобождаются во внеклеточное пространство липиды и белки в составе ламеллярных телец (тельца Одланда); выбрасываются органеллы, что в результате обусловливает уплощение клеток, связанных между собой прослойкой липидов, обеспечивающей дополнительный не проницаемый для воды барьер (см. рисунок, б, в) [1, 2].
Одним из наиболее важных белков, участвующих и регулирующих ороговение, является филаггрин. В процессе дифференцировки кератиноцитов в корнеоциты филаггрин формируется из предшественника белка — профилаггрина, который сохраняется в кератогиалиновых гранулах. Высвобождение и модификация профилаггрина в филаггрин вызывают агрегацию кератиновых филаментов и гибель клеток. Мутации в гене филаггрина часто выявляют у больных при АтД, астме и других дерматологических заболеваниях [3, 4].
Поверхностный слой эпидермиса состоит уже из частиц, которые постепенно отшелушиваются (см. рисунок, г). Для удержания чешуек вместе и сохранения целостности барьера кожа вырабатывает липидный клей, состоящий преимущественно из церамидов.
Церамиды и другие липиды рогового слоя
Липидная прослойка между «мертвыми» клетками состоит на 50% из молекул, называемых церамидами, на 30% из холестерина, 20% составляют свободные жирные кислоты (СЖК; в том числе омега-3, -6, -9), а также ферменты (протеазы, фосфатазы, глюкозидазы, липазы), а также белки (корнеодесмозин, катепсин D). Мембрана ламеллярных телец имеет контакт с аппаратом Гольджи [5]. Липиды ламеллярных телец (ЛТ) рогового слоя значительно отличаются от липидов мембран живых клеток. В них содержатся фосфолипиды и сфинголипиды, из которых под действием фосфолипазы А2 и бета-глюкоцереброзидазы синтезируются церамиды.
Структурно церамид состоит из двух молекул: сфингозидного полярного основания и жирной гидрофобной кислоты, соединенных амидной связью (см. рисунок, д).
Сфингозид через систему мембран аппарата Гольджи связан с клетками рогового слоя; жирные кислоты заполняют межклеточное пространство перпендикулярно пластам клеток (см. рисунок, е, ж). Красной линией отмечено расположение липидов между слоями клеток. Церамиды в области полярной части, прикрепленной к «мертвым» кератиноцитам, формируют малоподвижную псевдокристаллическую решетку; средняя часть липидной прослойки образована хвостами жирных кислот, имеющих меньший объем, чем сфингозиды, что обеспечивает их большую подвижность. Между ними пространство заполняется холестерином и СЖК, не связанными с церамидами, что обеспечивает текучесть (см. рисунок, е, ж) среднего пласта липидов. Таким образом, церамиды обеспечивают плотность рогового слоя, а средняя зона обеспечивает его эластичность.

Анализ структуры церамидов методом обращенно-фазовой жидкостной хроматографии в сочетании с квадрупольной времяпролетной масс-спектрометрией высокого разрешения показал, что вариантов комбинаций сфингозинов с жирными кислотами может быть более 1000 [6, 7]. В целом церамиды получаются комбинацией вариантов сфингозиновой полярной части и жирных кислот с разным числом атомов углерода (см. таблицу). Строительные блоки церамидов рогового слоя кожи млекопитающих В настоящий момент используют буквенную номенклатуру церамидов, где сфингозин обозначается S, фитосфингозин — Р, 6-гидроксисфингозин — Н и дигидросфингозин — dS (см. таблицу). Жирные кислоты, выявленные в составе церамидов, также представлены четырьмя типами: кислоты, не содержащие гидроксил в α позиции (N), содержащие гидроксил в положении α или ω атома углерода (А и О соответственно) и этерифицированный гидроксил в положении ω (ЕО), что в сумме дает 16 классов церамидов. В каждом классе длина хвоста жирной кислоты может быть различной.
Синтез церамидов
В состав церамидов чаще всего входят длинноцепочечные насыщенные жирные кислоты, содержащие от 14 до 26 атомов углерода. Церамиды в организме образуются тремя различными путями, а именно синтезируются de novo в эндоплазматическом ретикулуме клеток из серина и пальмитата в результате гидролиза сфингомиелинидазой сфингомиелина, являющегося составной частью клеточных мембран, и из остаточного сфингозина [8]. Синтез церамидов прямо зависит от количества жировых отложений в организме. Так, уровень сывороточных церамидов С16:0, С18:0, С24:0 и С24:1 достоверно повышен у людей с ожирением [8].
Характеристика липидного состава при заболеваниях
Впервые церамиды были открыты в головном мозге, откуда и получили свое название (cerebrum). Церамиды также являются компонентами липопротеидов крови. Концентрация церамидов в мозге и крови значительно ниже, чем в коже. Изменение количества церамидов в крови часто имеет диагностическое значение, например при болезни Альцгеймера [8—11].
В норме соотношение церамидов, холестерина и СЖК составляет 3:1:1. С возрастом снижается продукция липидов кожи, но соотношение не меняется [12]. При различных метаболических нарушениях концентрация липидов кожи, а также церамидов крови может служить прогностическим и диагностическим маркерами сердечно-сосудистых заболеваний, ожирения, сахарного диабета, инсулинорезистентности и неалкогольной жировой болезни печени [13—16].
При АтД нарушение состава липидов кожи ассоциировано с расстройством синтеза как церамидов, так и СЖК. M. Danso и соавт. [17] показали, что при АтД снижаются количество насыщенных и доля длинноцепочечных (С22—С28) СЖК, а также изменяется баланс церамидов разных классов. Так, повышается доля AS и NS церамидов и снижается доля ЕОН и ОН церамидов. Изменения в составе СЖК и церамидов ассоциированы с нарушением функциональной активности ферментов стеарол CoA десатуразы (церамиды) и элонгазы 1 (СЖК). Аналогичное повышение доли AS и NS церамидов выявляют также у детей с АтД [18].
Нарушение в составе и количестве церамидов кожи наблюдается также при акне. В целом разнообразие церамидов в коже больных не нарушено. Так, Pappas и соавт. идентифицировали 283 типа церамидов при снижении общего количества липидов и доли NH, AH, EOS и EOH церамидов [19]. При акне (так же, как и при АтД) наблюдают снижение количества длинноцепочечных (>С18) СЖК. Авторы заключили, что NH и AH церамиды наиболее важны для формирования нормального барьера кожи [19].
Имеются ограниченные данные по изменению состава и количества церамидов при псориазе. Показано снижение церамида EOS [20]. В то же время состав церамидов на не пораженных псориазом и АтД участках кожи не отличается от такового у здоровых доноров [21]. Данных по составу и количеству церамидов в коже больных розацеа нет. По-видимому, при розацеа липиды кожи находятся в пределах нормы. В большинстве случаев нарушение состава липидов кожи ассоциировано с повышенной ТЭПВ. Имеются ограниченные сведения, что при розацеа ТЭПВ повышается только в области лица, что может являться в большей степени результатом патологического процесса, чем генерализованного дисбаланса липидов кожи [22]. Этими же авторами показано, что при АтД повышенная ТЭПВ является генерализованной.
Компенсаторные механизмы при нарушении барьерной функции эпидермиса
При нарушении эпидермального барьера (травмы, воспаление, аутоиммунные процессы) в течение минут начинаются репаративные процессы. В первую очередь высвобождаются ЛТ из клеточных депо и начинается синтез de novo СЖК, а затем церамидов [23]. При наложении непроницаемой мембраны наблюдается подавление синтеза ЛТ, что препятствует восстановлению эпидермального барьера [24]. Процесс репарации стимулируется изменением градиента кальция в эпидермисе, вызванного локальной потерей воды [25]. Нанесение на кожу топических препаратов, содержащих СЖК, ускоряет восстановление барьерных свойств кожи за счет включения экзогенных СЖК в липидный слой эпидермиса [26]. Аналогичное действие оказывают и синтетические церамиды [27]. Однако в состав топических средств входит несколько компонентов, создающих на коже пленку. В большей степени они служат окклюзивным барьером, помогающим удерживать воду и снижать ТЭПВ, уменьшать зуд и обеспечивать экзогенными липидами и церамидами [28].
Терапия кожи увлажняющими средствами
Известно, что увлажняющие кожу средства оказывают положительный эффект при АтД, акне, псориазе, розацеа и многих других дерматологических заболеваниях. Ряд топических средств оказывает терапевтическое действие, снижая потерю воды, что приводит к частичному восстановлению барьерных свойств эпидермиса [29]. Включение в топические средства аналогов или природных церамидов, холестерина, омега-3, -6, -9, СЖК позволит ускорить репарацию кожи. Показано, что экзогенные компоненты ЛТ проникают через роговой слой в клетки зернистого слоя эпидермиса; проходят через эндоплазматический ретикулум в сеть аппарата Гольджи, где формируются ЛТ.
Показано, что использование увлажняющих препаратов замедляет прогрессию АтД и снижает тяжесть заболевания [30, 31]. K. Mori и соавт. [30] оценивали эффект геля на основе синтетических церамидов и экстракта эвкалипта в слепом клиническом исследовании 27 больных из Японии с умеренным АтД. Авторы показали, что в сухой летний период использование геля значительно улучшало состояние кожи, снижало покраснение, зуд, улучшало самочувствие больных по сравнению с больными, не использовавшими гель. Аналогичные данные были получены у больных себорейным дерматитом [31]. Этот же состав увлажняющего средства в сочетании с умеренной очисткой лица оказывал достоверный протективный эффект при акне средней тяжести у подростков с сухой и чувствительной кожей [32]. Авторы показали увеличение общего количества церамидов кожи, доли длинноцепочечных церамидов NS и NP в результате обработки кожи.
Использование топических средств, содержащих компоненты ЛТ, позволяет снизить побочные эффекты кортикостероидных препаратов. Так, короткий курс 0,05% клобетазола замедлял регенерацию эпидермального барьера; при одновременном нанесении крема, содержащего СЖК, холестерол и церамиды, снижались побочные эффекты кортикостероида и ускорялась репарация кожи [33]. Аналогичные данные были получены S. Ahn и соавт. [34] в модели на мышах.
Иммуносупрессивные препараты, влияющие на физиологические процессы кожи, подавляют репарацию: так, ингибиторы кальциневрина пимекролимус и такролимус задерживают восстановление барьерной функции и снижают количество липидов в эпидермисе [35]. Использование топических препаратов, включающих физиологические липиды в сочетании с пимекролимусом, улучшает репарацию кожи и состав липидов эпидермиса.
Применение в качестве наружной терапии воспалительных дерматозов комбинации топических кортикостероидов или ингибиторов кальциневрина с препаратами, содержащими физиологические липиды, позволяет улучшить восстановление эпидермального барьера и снизить побочные эффекты противовоспалительных агентов на барьерную функцию кожи.
В России разработан комбинированный препарат, содержащий 0,1% метилпреднизолона ацепонат и керамиды (Комфодерм К крем, патент 2011120522.15), который позволяет расширить возможности терапии стероидчувствительных дерматозов у взрослых и детей.
На рынке имеется большое количество кремов, содержащих церамиды. Чаще всего в косметические кремы вводятся церамиды NP и EOS, что способствует снижению ТЭПВ. В увлажняющие препараты и терапевтические кремы для лечения псориаза могут добавляться церамиды AP, AS и EOS. В настоящее время в основном используют синтетические церамиды, которые по действию идентичны природным. Несмотря на известное соотношение церамидов, холестерина и СЖК в нормальной коже, применение увлажняющих кремов, содержащих большое количество церамидов разных классов, может быть нецелесообразным. Так, значительный клинический эффект при умеренном АтД получен при использовании крема РС-104 на основе смеси амидов пальмитиновой кислоты, глицирретиновой кислоты и экстракта виноградных косточек [36]. Раннее начало использования эмолиентов с церамидами значительно снижает частоту заболеваемости АтД у младенцев из группы риска [37, 38]. Синтетические фитоцерамиды NP и EOP эффективны также при псориазе [39].
Практикующим врачам будет интересна новая косметическая линия эмолентной дерматологической косметики Сенсодерм на основе физиологических липидов омега-3, -6, -9, а также препарат комбинированного действия Комфодерм К. Сенсодерм может применяться для увлажнения сухой и атопической кожи взрослых и детей с рождения, обладает благоприятным соотношением цена/качество. С помощью средств линии Сенсодерм можно подобрать оптимальную программу ухода за сухой кожей с учетом индивидуальных потребностей пациента.
Заключение
Эффективная стратегия лечения и профилактики дерматологических заболеваний с помощью кремов, гелей, сывороток с церамидами и физиологическими липидами имеет социоэкономическое значение. Применение смягчающих и увлажняющих средств с физиологическими липидами омега-3, -6, -9 позволит уменьшить явления ксероза, зуда и воспаления, что в свою очередь будет способствовать удлинению продолжительности ремиссии и профилактике обострений у пациентов с дерматологическими заболеваниями.
Сведения об авторах
Атопический дерматит (АД) – хроническое рецидивирующее заболевание кожи, в основе которого лежит реакция воспаления. Патогистологически она характеризуется пролиферативным гиперкератозом (усилением пролиферации и дифференцировки кератиноцитов, подавлением их апоптоза) и акантозом (увеличением толщины эпидермиса).
Гиперплазия эпидермиса, особенно его рогового слоя, приводит к повышению трансэпидермальной потери влаги. Этот процесс усугубляется при длительном течении заболевания и появлении очагов лихенификации, сопровождается еще большим утолщением кожи, усилением кожного рисунка (гистологически определяется гиперкератоз и акантоз с удлинением эпидермальных отростков, иногда – паракератоз и спонгиоз) [1]. Следовательно, основным патогенетическим способом лечения АД является грамотное и своевременное использование современных противовоспалительных средств – топических глюкокортикостероидов и ингибиторов кальциневрина.
АД возникает, как правило, в раннем детском возрасте у лиц с наследственной предрасположенностью к атопическим заболеваниям и обусловлен гиперчувствительностью к аллергенам и неспецифическим раздражителям [2]. Для достижения стойкой ремиссии заболевания и профилактики его обострений необходимо строгое соблюдение элиминационных мероприятий в зависимости от этиологии процесса и ограничение действия триггеров (агрессивных моющих средств, грубой одежды из синтетических и шерстяных тканей, низкой и высокой температуры, травматизации кожи расчесыванием).
При АД нарушен обмен жирных кислот в коже. В результате дефицита керамидов в роговом слое эпидермиса формируется неполноценный защитный гидролипидный слой, что приводит к транскутанной потере воды и облегчает проникновение аллергенов и ирритантов.
Клинически эти процессы проявляются сухостью кожи, которая усугубляется при действии различных неблагоприятных факторов. Сухость наряду с воспалением и рядом других факторов приводит к возникновению и усилению зуда. Ребенок, пытаясь прекратить это мучительное ощущение, расчесывает кожу, травмирует ее, что в свою очередь лишь усиливает воспаление и зуд, способствует инфицированию патологических очагов. Таким образом, формируется «замкнутый круг», который безусловно, необходимо прервать. Поэтому наряду с мерами по профилактике аллергических реакций, неспецифического раздражения и лечению воспаления важную роль играет увлажнение кожи и насыщение ее липидами. Достаточная гидратация кожи уменьшает сухость и интенсивность воспаления [3, 4, 5]. Поэтому следует:
- поддерживать достаточную влажность воздуха (около 60%) в жилом помещении;
- ежедневно купать ребенка – это не только насыщает кожу водой, но и улучшает самочувствие, способствует хорошему проникновению наружных средств терапии, предотвращает инфицирование (купание запрещается при распространенной гнойничковой и герпетической инфекции-);
- соблюдать оптимальное для насыщения рогового слоя кожи водой время купания, составляющее 15–20 минут;
- использовать для купания воду 35–37°С с учетом индивидуальной чувствительности ребенка (горячая вода обычно переносится плохо и нередко приводит к обострению заболевания);
- отстаивать воду для купания 1–2 часа с целью удаления хлора или фильтровать;
- добавлять в ванну специальные увлажняющие и липидовосполняющие средства;
- при плохой переносимости купания в ванне использовать душ;
- при невозможности купания очищать кожу специальными мицелловыми растворами, содержащими липиды, а для гидратации использовать влажные компрессы с хорошо очищенной водой либо водой из термальных источников;
- в течение дня орошать кожу ребенка термальной водой.
Очень важно правильно подобрать средство для очищения кожи при купании. Оно не должно содержать спирта и вяжущих средств, которые вызывают сухость кожи и оказывают липидоразрушающее действие, а также парфюмерных отдушек и консервантов, нередко провоцирующих аллергические реакции. Средство для мытья должно иметь нейтральный рН (5,5), не нарушать водно-липидный баланс эпидермиса и его барьерные функции. Всем этим требованиям отвечают очищающий увлажняющий гель для лица и тела ЛИПИКАР СИНДЭТ и очищающее средство для лица и тела ЛИПИКАР СЮРГА. В их состав входят масло каритэ, глицерин и смягчающие компоненты, которые позволяют не только мягко очистить кожу, не раздражая ее, но и смягчают и увлажняют ее. Содержащиеся в этих средствах противоизвестковые компоненты нейтрализуют действие жесткой воды.
ЛИПИКАР СИНДЭТ предназначен для ежедневного очищения сухой, раздраженной, склонной к атопии кожи детей и взрослых во время приема ванны или душа. Он наносится на мокрую кожу лица и/или тела легкими массирующими движениями, а затем тщательно смывается водой.
ЛИПИКАР СЮРГРА – очищающее средство для лица и тела можно использовать ежедневно вместо обыкновенного мыла. Оно также не сушит и не раздражает кожу, восстанавливает физиологическое значение рН и естественную гидролипидную пленку на ее поверхности.
Для одновременной гидратации и восстановления липидного слоя очень удобны средства, обладающие как увлажняющим, так и липидовосстанавливающим действием [6, 7, 8]. Их следует наносить на кожу несколько раз в течение дня так, чтобы кожа не была сухой ни одной минуты. Как правило, первое время требуется многократное применение средства, а затем потребность в нем сокращается до 1–2 раз в сутки. Очень важно использовать выбранное средство сразу после купания. Для этого кожу ребенка следует промокнуть мягким полотенцем (ни в коем случае не растирать-) и в течение трех минут, не выходя из ванной, нанести эмульсию или бальзам.
ЛИПИКАР БАЛЬЗАМ АР – инновационное липидовосполняющее, увлажняющее средство, обладающее противозудным действием. В его состав входит масло каритэ, масло канолы, свободные стеролы, глицерин и ниацинамид. Масло каритэ содержит жирные кислоты, сходные по составу с жирными кислотами кожи. Масло канолы – источник омега-3 и омега-6 жирных кислот. Свободные стеролы восстанавливают барьерную функцию кожи и обладают специфической противовоспалительной активностью. Глицерин способствует увлажнению кожи. Ниацинамид, влияя на высвобождение предшественников медиаторов воспаления, регулируя выработку гистамина, повышая синтез жирных кислот и керамидов в роговом слое, снижая трансэпидермальные потери воды, купирует воспаленние кожи, восстанавливает ее защитный барьер и, самое главное, устраняет зуд. Используется 1 раз в день.
АД – заболевание, значительно снижающее качество жизни ребенка и его семьи. Добиться стойкой ремиссии и полноценной активной жизни для каждого конкретного ребенка можно, лишь используя весь современный арсенал медикаментозных и немедикаментозных средств, устраняющих воспаление, зуд и косметические дефекты кожи. Это возможно в том случае, если ребенок и его родители становятся активными союзниками врача в процессе борьбы с этим непростым заболеваниям. Этой цели в первую очередь служат образовательные программы для детей, больных АД, и их родителей.
Так, в Центре восстановительной медицины и реабилитации № 1 Ростовской области в течение пяти лет функционирует школа для детей, страдающих АД, и их родителей «Здоровая кожа». На ее занятиях слушатели знакомятся с основными причинами возникновения АД, способами его лечения и профилактики обострений. Большое внимание уделяется уходу за кожей больных детей. В 2009–2010 годах в рамках школы «Здоровая кожа» и проведения реабилитации детей, страдающих АД, использовалось современное липидовосполняющее средство Липикар Бальзам АР. Он наносился 2 раза в день – утром и вечером после купания – на всю поверхность кожи ребенка. В период обострения Липикар Бальзам АР назначался вместе с топическими препаратами. В период неполной ремиссии Липикар Бальзам АР применялся в качестве монотерапии. Все дети и их родители отмечали хорошую переносимость, приятную текстуру и легкость нанесения бальзама.
Под нашим наблюдением находилось 59 детей в возрасте от 1 года до 15 лет, страдающих АД. У 20 человек имело место среднетяжелое течение заболевания, у 39 пациентов – легкое течение. В исследование были включены больные, кожный процесс у которых находился в стадии обострения (29 детей) и неполной ремиссии (30 человек). Системная терапия проводилась в соответствии с тяжестью течения заболевания и включала диетотерапию, использование энтеральных сорбентов, антигистаминных препаратов II поколения и симптоматических средств. Местно в области очагов острого воспаления использовались топические стероиды в течение 5–7 дней.
До начала лечения индекс тяжести по шкале SCORAD составлял в среднем 58,4 ± 3,6 балла, дерматологический индекс качества жизни (ДИКЖ) – 18,2 ± 2,4 балла. Через один месяц после начала лечения у всех детей значительно уменьшилась сухость кожных покровов, отмечался регресс высыпаний и выраженное снижение интенсивности зуда, уменьшились раздражительность и беспокойство. Через два месяца после начала наблюдения сохранялась положительная динамика клинической симптоматики, индекс тяжести по шкале SCORAD составил 18,8 ± 2,4, ДИКЖ – 6 ±1,1 балла. Обострений заболевания не наблюдалось, кожа вне очагов поражения была эластичной и умеренно влажной, площадь высыпаний и участков гиперемии сократилась в 2,5–3 раза, зуд беспокоил детей эпизодически (10% детей), иногда сопровождался повышенным беспокойством, раздражительностью (10%).
Таким образом, использование современных увлажняющих и липидовосполняющих средств ухода за кожей детей с АД позволяет добиться стойкой ремиссии заболевания и повысить качество жизни больного и его семьи. Липикар Бальзам АР является высокоэффективным средством ухода за кожей, позволяющим не только увлажнять кожу и нормализовывать ее липидный состав, но и обладающим выраженным противозудным действием благодаря входящему в его состав ниацинамиду в достаточно высокой концентрации (4%).
Список литературы:
- Мяделец О.Д., Адаскевич В.П. Функциональная морфология и общая патология кожи. Витебск: Изд-во Витебского медицинского института, 1997. – 269 с.
- Атопический дерматит: рекомендации для практических врачей. Российский национальный согласительный документ по атопическому дерматиту / под ред. Р.М. Хаитова, А.А. Кубановой. М., 2002. – 192 с.
- Атопический дерматит. Новые подходы к профилактике и наружной терапии / под ред. Ю.В. Сергеева. М.: Медицина для всех, 2005. – 64 с.
- Hara, J., Higuchi, K., Okamoto, R., et al. (2000), High-expression of sphingomyelin deacylase in an important determinant of ceramide deficiency leading to barrier disruption in atopic dermatitis, J. Invest. Dermatol., 115(3) (2000) 406–413.
- Chamlin, S. L., Frieden, E.J., Fowler, A., et al. (2001), Ceramidedominant, barrier-repair lipids improve childhood atopic dermatitis, Arch. Dermatol., 137 (2001) 1110–1112.
- Монахов К.Н., Соколовский Е.В., Мельникова Т.В. «Базовый» уход за кожей больных атопическим дерматитом // Вестник дерматологии и венерологии. 2002. № 6. С. 27–28.
- Короткий Н.Г., Тихомиров А.А. Применение современных негормональных увлажняющих средств в наружной терапии атопического дерматита у детей // Журнал дерматовенерологии и косметологии. 2002. № 2. С. 35–36.
- Монахов С.А. Термальные источники и их использование в дерматологии и косметологии // Российский журнал кожных и венерических болезней. 2004. № 1. С. 66–70.
Сведения об авторах:
Сергей Владимирович Ходарев, д.м.н., главный врач ГУЗ «Центр восстановительной медицины и реабилитации № 1» Ростовской области
Татьяна Михайловна Поддубная, к.м.н., заведующая детского реабилитационного отделения ГУЗ «Центр восстановительной медицины и реабилитации № 1» Ростовской области
Татьяна Юрьевна Яновская, врач аллергологиммунолог высшей категории Practika-December.
Дерматофития (грибок) стоп. Диагностика и лечение
Везикулезная дерматофития стоп с пузырями, которые являются следствием воспалительной реакции на дерматофитию Реакция аутосенсибилизации при воспалительной дерматофитии стоп на коже кисти. Для реакции аутосенсибилизации, которая известна также как ID-реакция, характерны везикулы между пальцами
б) Распространенность (эпидемиология):
• Дерматофития стоп считается самым распространеннным в мире дерматофитозом.
• 70% населения в различные периоды жизни инфицируются возбудителем дерматофитии стоп.
• Мужчины болеют чаще, чем женщины.
• До подросткового периода заболевание встречается редко, с возрастом распространенность инфекции увеличивается.
в) Этиология (причины), патогенез (патология):
• Данную кожную грибковую инфекцию чаще всего вызывает Trichophyton rubrum.
• Следующими по частоте возбудителями являются Trichophyton mentagrophytes и Epiderrnophyton floccosum.
• Большинство случаев дерматофитии стоп и онихомикоза вызвано T. rubrum.
Выделяют три клинических формы дерматофитии стоп:
• Межпальцевая - наиболее распространенная.
• Мокасиновая.
• Воспалительная/везикулезная - наиболее редкая.
Некоторые авторы описывают также язвенную форму.
Дерматофития стоп в промежутке между 4 и 5 пальцами стопы. Это самый распространенный участок локализации дерматофитии на стопах Дерматофития стоп с локализацией по типу мокасин Мокасиновый вид дерматофитии стоп с распространением кверху Язвенная дерматофития стоп с распространяющимися везикулами - результат бактериальной суперинфекции. Пациенту были назначены противогрибковые препараты и антибиотики Микроскопия соскобов со ступни пациента с нераспознанной дерматофитией. После пролиферации гифы хорошо заметны при 40-кратном увеличении и окрашивании по Swartz-Lamkins
г) Клиника грибка стоп:
• Межпальцевая форма: в межпальцевых промежутках наблюдается рост грибов, проявляющийся белым или зеленоватым цветом кожи, эритродермой, мацерацией, мелкими и глубокими трещинами, особенно между 4 и 5 пальцами стоп. При сухом типе заболевания преобладает шелушение, а при влажном - мацерация.
• Мокасиновая форма: чешуйки располагаются на боковых поверхностях и подошвах стоп.
• Везикулезная форма проявляется везикулами и пузырями на стопах.
• Для язвенной дерматофитии стоп характерно быстрое распространение везикулезно-пустулезных очагов, язв и эрозий, в типичных случаях расположенных в межпальцевых промежутках. Заболевание сопровождается вторичной бактериальной инфекцией. Это может привести к целлюлиту или лимфангиту.
• Аутосенцибилизация (или ID-реакция) представляет собой гиперчувствительный ответ па грибковую инфекцию, в результате которого возникают папулы на кистях.
• Необходимо осмотреть ноги на наличие онихомикоза. Грибковая инфекция ногтей может включать подногтевой кератоз, желтую или белую пигментацию и деформацию ногтей.
• Пациента необходимо осмотреть для исключения целлюлита, который может проявляться эритемой, отеком, болезненностью и красными полосами, идущими от стопы вверх по голени.
д) Типичная локализация на теле. Между пальцами ног, на подошвах и боковых поверхностях стоп.
е) Анализы при заболевании. Диагноз часто устанавливается на основании клинической картины, при этом помогает микроскопическое исследование кожных соскобов, обработанных КОН и грибковым красителем.
В случае нераспознанной дерматофитии на стопе и голени пациента врачи были введены в заблуждение признаками системной красной волчанки. Исследование кожных соскобов показало наличие дерматофитии, а не волчанки, и пациент получил необходимое лечение.
Кожные соскобы с культуральным анализом помогают установить окончательный диагноз, но эта процедура дорогостоящая, а для выращивания культуры может потребоваться до двух недель.
Нераспознанная дерматофития на стопе 63-летнего темнокожего пациента с красной волчанкой. Пациент применял местные стероиды, не мешающих дерматофиту расти и распространяться Точечный кератолиз с неприятным запахом на ступне, который иногда принимают за дерматофитию стоп. При внимательном осмотре выявляются мелкие точечные углубления на подъеме свода стопы Контактный дерматит, вызванный теннисными туфлями, с типичной локализацией, переходящей на дорсальную поверхность стопы Климактерическая кератодермия, которая началась у пациентки в менопаузе Дисгидротическая экзема с везикулами на стопе, напоминающими зерна тапиоки, и шелушением кожи на втором пальце. Такие же везикулы наблюдаются у пациента в межпальцевых промежутках Подошвенный псориаз у пациента с очагами псориаза на других участках туловища
ж) Дифференциальный диагноз грибка стоп:
• Точечный кератолиз проявляется четко отграниченными углублениями или эрозиями на подошвах стоп, которые вызываются бактериями.
• Контактный дерматит обычно локализуется на дорсальной стороне и боковых поверхностях стопы.
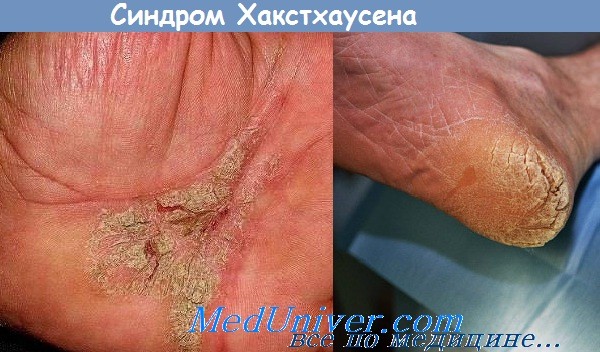
• Для кератодермии характерно утолщение кожи по дошв, которое может быть вызвано целым рядом причин, включая менопаузу. Эти заболевания похожи на мокасиновую форму дерматофитии стоп.
• Для дисгидротической экземы характерно шелушение и мелкие везикулы по типу шариков тапиоки на кистях и стопах.
• Пузыри от трения возникают па стопах у людей, занимающихся легкоатлетическими видами спорта.
• Псориаз может имитировать дерматофитию стоп, но при этом очаги псориаза могут отмечаться и на других участках тела.
з) Лечение дерматофитии (грибка) стоп:
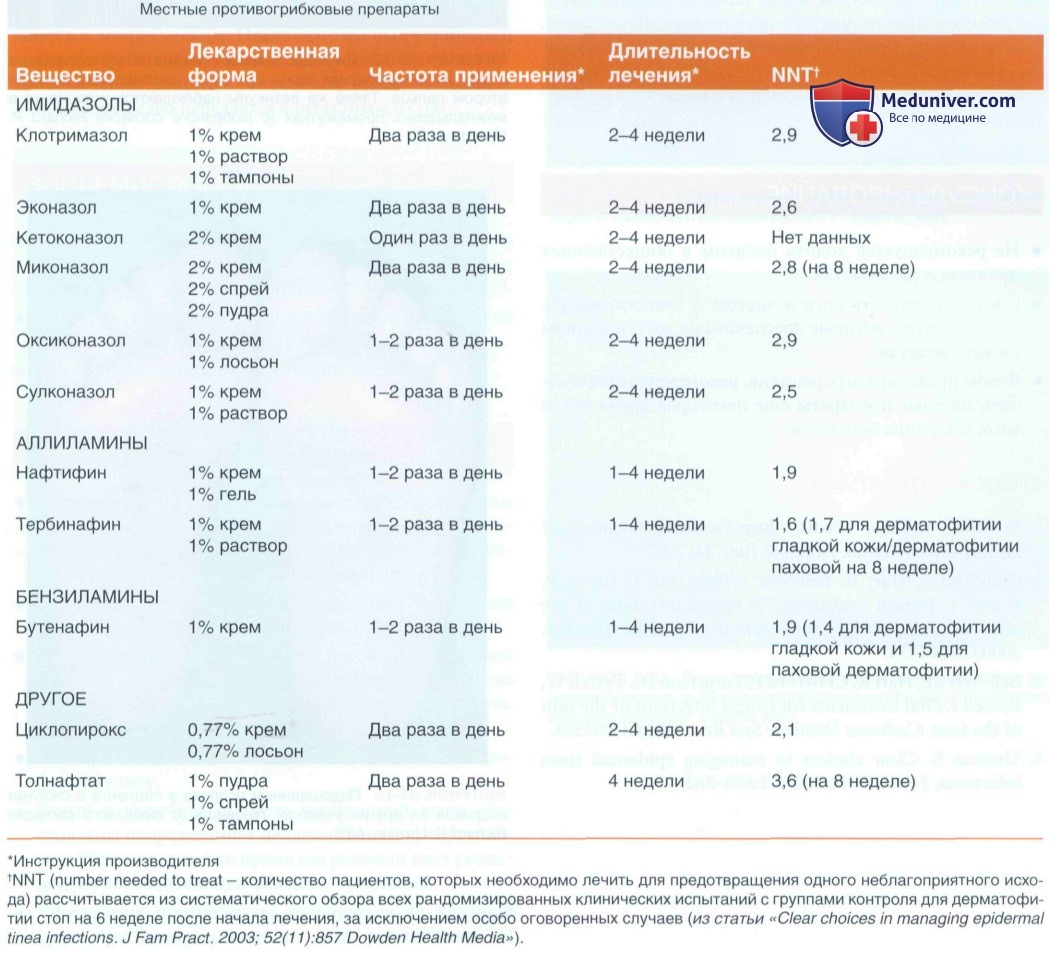
1. Местное лечение:
• Систематический обзор 70 клинических испытаний местных противогрибковых препаратов показал хо ротную эффективность (в сравнении с плацебо) следующих препаратаов:
- Аллиламинов (нафтифина, тербинафина, бутенафина).
- Азолов (клотримазола, миконазола, эконазола).
- Аллиламины немного эффективнее, чем азолы, но более дорогие.
- Разницы в эффективности между отдельными препаратами внутри группы аллиламинов и группы азолов не выявлено.

2. Системное лечение:
• Систематический обзор 12 клинических испытаний с участием 700 человек: системный тербенафин в течение двух недель излечивал на 52% больше пациентов, чем системный гризеофульвин.
• Тербинафин и итраканазол равны по клинической эффективности.
• Не обнаружено существенной разницы при сравнении ряда системных противогрибковых препаратов.
3. Дозировка при дерматофитии стоп, требующая системной терапии:
• Итраконазол две таблетки по 100 мг ежедневно в течение недели.
• Тербинафин 250 мг перорально ежедневно в течение 1-2 недель.
У пациентов с онихомикозом возможны рецидивы кожной инфекции в связи с грибком, оставшимся в ногтях, поэтому для достижения лучшего результата может потребоваться системная терапия в течение трех месяцев.
Местные препараты мочевины (кармол, кералак) могут помочь в уменьшении шелушения у пациентов с гиперкератозом подошв. Препараты имеются в концентрациях 30% и 40%.
и) Консультирование врачом пациента:
• Не рекомендуется ходить босиком в общественных душевых и раздевалках.
• Следует содержать ноги в чистоте и сухости, носить носки и обувь, которые обеспечивают доступ к ногам свежего воздуха.
• Чтобы предотвратить рецидив, рекомендуется применять местные препараты еще некоторое время после того, как стопы очистятся.
Редактор: Искандер Милевски. Дата обновления публикации: 1.4.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

