Кератинизированный эпителий что это
Обновлено: 25.04.2024
Соединение зуба с соединительным эпителием. Слизистая пародонта
Особый интерес представляет характер соединения поверхности зуба с соединительным эпителием. Некоторые исследователи находят, что эта связь имеет физико-химическую сущность и осуществляется посредством липких макромолекул десневой жидкости. Другие утверждают, что эта связь биологическая и реализуется с помощью гемодесмосом. Межклеточные пространства эпителия десневого желобка более широкие, и его проницаемость в несколько раз превышает проницаемость эпителия других отделов слизистой оболочки полости рта.
Этим объясняется присутствие подэпителиальных лимфоплазмоцитарных инфильтраций, которые выполняют защитную функцию против проникновения микробов и их токсинов. Более того, установлено, что соединительный эпителий обладает двусторонней проницаемостью. Митотическая активность клеток соединительного эпителия также в несколько раз выше, чем в других участках слизистой оболочки. Кроме того, обычно не ороговевающий соединительный эпителий в определенных условиях проявляет свои способности к ороговению.
В норме соединительный эпителий находится полностью на эмали. Ширина соединительного эпителия варьирует от 0,71 до 1,35 мм. Протяженность соединительнотканного фиброзного соединения колеблется в пределах 1,0-1,07 мм. Поэтому считают, что десневое прикрепление при нормальном состоянии пародонта должно быть не менее 2 мм. Этот размер определяют как биологическую ширину или подбороздковый физиологический размер.
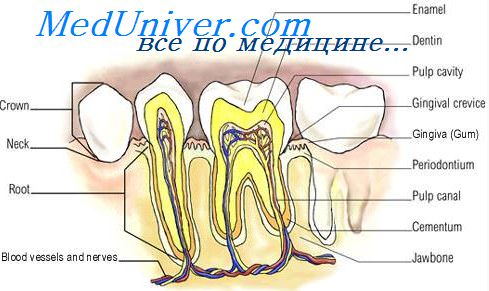
Слизистая оболочка полости рта, в том числе и десна, состоит из трех слоев: многослойный плоский эпителий, собственно слизистая оболочка и подслизистая основа. Многослойный плоский эпителий состоит из клеточных слоев, соединенных межклеточными мостиками. В зависимости от формы этих клеток в эпителии различают базальный, шиповидный, зернистый и ороговевающий слои. Первые два слоя иногда называют основными клеточными слоями многослойного эпителия, а присутствие зернистого и ороговевающего слоев зависит от ороговения слизистой оболочки.
Между эпителиальным покровом и соединительнотканной собственно слизистой оболочкой расположена базальная мембрана, которая состоит из коллагеновых волокон и полисахаридных комплексов. В мембране различают проницаемые и плотные участки, она обладает избирательной проницаемостью.
Собственно слизистая оболочка состоит из волокнистых структур, межклеточного вещества и клеток. Обычно различают сосочковый (подэпителиальный) и сетчатый (надальвеолярный) слои собственно слизистой оболочки. Первый слой представляет собой рыхлую соединительную ткань, богатую эластиновыми волокнами. Сетчатый слой собственно слизистой оболочки состоит из сети коллагеновых волокон, которые имеют различную направленность и составляют десневую группу основных коллагеновых волокон пародонта.
В клеточных элементах собственно слизистой оболочки преобладают фибробласты, которые распределены как в основном веществе, так и в стенках сосудов и нервов. В соединительной ткани десны обнаруживаются также тучные клетки (лаброциты), макрофаги, нейтрофильные гранулоциты, лимфоциты, моноциты.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Современная клиническая стоматология располагает определенным спектром диагностических методов (люминесцентный, микробиологический, морфологический), позволяющих выявить изменения мукозального эпителия на ранних стадиях развития многих заболеваний слизистой оболочки полости рта (СОПР), в том числе и красного плоского лишая (КПЛ). Клинические признаки манифестации этого дерматокератоза могут проявляться только в полости рта и в течение длительного времени не вызывать жалоб пациента. На этапе определения глубины поражения слизистой оболочки представляет трудность дифференциация очагов гиперкератоза на кератинизированном и некератинизированном эпителии.
Различные проявления очагов поражения КПЛ в зависимости от типа эпителия СОПР связаны с гистологическими особенностями эпителия. Кератинизированный эпителий, который покрывает поверхность жевательной слизистой оболочки (твердого неба, десны), а также некоторых участков выстилающей слизистой оболочки (щеки по линии смыкания зубов) и специализированной слизистой оболочки (на дорсальной поверхности языка в области нитевидных сосочков), состоит из базального, шиповатого, зернистого и рогового слоев. Роговой слой в эпителии полости рта может содержать до 20 слоев роговых чешуек. В некоторых участках эпителия СОПР, например на твердом небе и десне, помимо ортокератоза встречается и паракератоз. В эпителии, подвергающемся паракератозу, на поверхности пласта находятся плоские клетки, содержащие кератин, однако в них сохраняются ядра, обычно пикнотизированные. В подлежащем зернистом слое могут присутствовать кератогиалиновые гранулы.
Некератинизированный эпителий покрывает поверхность выстилающей слизистой оболочки — дна полости рта, вентральной поверхности языка, щеки, большей части губы. Как правило, пласт некератинизированного эпителия СОПР значительно толще, чем пласт кератинизированного эпителия. Он представлен базальным, шиповатым и поверхностным слоями. Поверхностный слой в некератинизированном эпителии нерезко отделен от шиповатого. Он образован уплощенными клетками, содержащими рыхло распределенные цитокератиновые филаменты, которые в глубоких участках слоя занимают до 40 % объема цитоплазмы, а в поверхностных — до 70—75 %.
По химическому составу они отличаются от филаментов, заполняющих роговые чешуйки. Содержание органелл снижено по сравнению с таковым в клетках шиповатого слоя, внешняя клеточная мембрана утолщена, межклеточные пространства могут быть редуцированными.
Роговой слой в эпителии полости рта может содержать до 20 слоев роговых чешуек. В некоторых участках эпителия СОПР, например на твердом небе и десне, помимо ортокератоза встречается и паракератоз
По степени выраженности процессов кератинизации можно судить о глубине поражения СОПР при красном плоском лишае.
Целью настоящего исследования явилась оценка глубины поражения кератинизированного и некератинизированного эпителия СОПР у пациентов с различными формами красного плоского лишая.
Для выполнения поставленной цели нами было обследовано 55 пациентов с КПЛ СОПР — 45 женщин и 10 мужчин в возрасте 39—72 лет. У 5 пациентов была выявлена типичная форма КПЛ, у 7 — экссудативно-гиперемическая, у 18 — эрозивно-язвенная форма, у 12 — атипичная форма, у 13 пациентов эрозивно-язвенная форма КПЛ сочеталась с атипичной формой. Группа сравнения представлена 39 пациентами, не отягощенными заболеваниями СОПР, сопоставимыми по гендерно-возрастному составу с пациентами исследуемой группы.
Методы обследования пациентов включали в себя сбор анамнеза, клинический осмотр, определение площади и скорости эпителизации очагов поражения, индекса кератинизации мукозального эпителия.
Площадь очагов поражения КПЛ удобно определять с помощью палетки — полиэтиленовой пленки с 5-миллиметровыми делениями. Площадь очага поражения необходимо периодически исследовать и в процессе лечения заболевания, чтобы определить скорость эпителизации. Для этого площадь очага поражения измеряется с помощью палетки на 3, 5, 7, 10 и 15-е сутки курации пациента. Затем количество мм, на которое уменьшилась площадь эрозии, делится на количество дней и рассчитывается средняя скорость эпителизации (мм/сутки).
Индекс кератинизации эпителия определяется в эксфолиированном материале путем подсчета общего количества ороговевших и неороговевших клеток, а также клеток базального и парабазального слоев. Число изучаемых клеток умножают на 100 и делят на общее количество клеток в поле зрения. Материалом исследования служили соскобы с очагов поражения СОПР, а также со слизистой оболочки на границе неповрежденной СОПР.
Соскобы проводили стерильным стоматологическим (металлическим) шпателем, полученный материал наносили на предметное стекло, высушивали в течение 1 часа, фиксировали в смеси 96%-ного этилового спирта и медицинского эфира в соотношении 1:1 в течение 10 минут, окрашивали по Романовскому — Гимзе и изучали в световом микроскопе под иммерсионной системой при увеличении объектива ?40 и ?90, окуляра ?7. Статистический анализ полученных результатов проводили при помощи программы «SPSS-14 for Windows» с вычислением средней арифметической М, ошибки средней арифметической m. Достоверность полученных данных оценивали с помощью критерия Стьюдента. Результаты считали достоверными при р
Результаты проведенных исследований свидетельствуют о том, что площадь очагов поражения (табл. № 1), локализующихся на некератинизированном эпителии, всегда обширнее, чем на кератинизированном, и в среднем на начальных этапах курации составляет 25—32 мм2, на кератинизированном эпителии средняя площадь очагов поражения составляет 15—18 мм2.
Таблица № 1. Площадь поражения и индекс кератинизации мукозального эпителия у пациентов с КПЛ.
Согласно пародонтологической терминологии, прикрепленная десна – эта та часть мягких тканей, которая крепко и плотно соединена с низлежащими периостом, зубами и костью. Кератинизированная часть десен обеспечивает стабилизацию десневого края, способствует распределению сил в мышечных волокнах во время жевания, а также защищает другие ткани от каких-либо повреждений и травматичных воздействий.
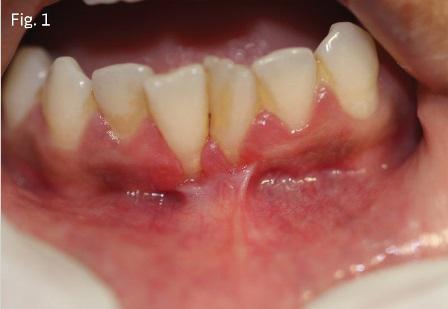
Niklaus Lang and Harald пришли к выводу, что 2 мм ороговевших десен и менее чем 1 мм прикрепленных вполне достаточно для поддержания адекватного их состояния. Jan Wennström, в свою очередь, заключил, что прикрепленная десна, кроме всего прочего, влияет и на состояние общего пародонтологического статуса пациента. Согласно данным Mehdi Adibrad, отсутствие адекватной ороговевшей слизистой вокруг имплантатов с сопутствующими супраконструкциями повышает риск аккумуляции зубного налета, возникновения воспалительных изменений десен, кровотечения, и конечно же, рецессии. Ingvar Eriksson считает, что адекватная ширина прикрепленной десны – это та, количества которой достаточно для превенции риска возникновения рецессии, исходя из индивидуальных клинических характеристик пациента. Роль ороговевшей десны до сих пор остается до конца недостаточно изученной, но для сохранения таковой врачи пользуются свободными десневыми трансплантатами, выполняют апикальную репозицию лоскутов и мягкотканую аугментацию.
В двух клинических случаях, приведенных ниже, описано эффективное использование свободных десневых трансплантатов для увеличения объема прикрепленной десны.
Клинический случай 1
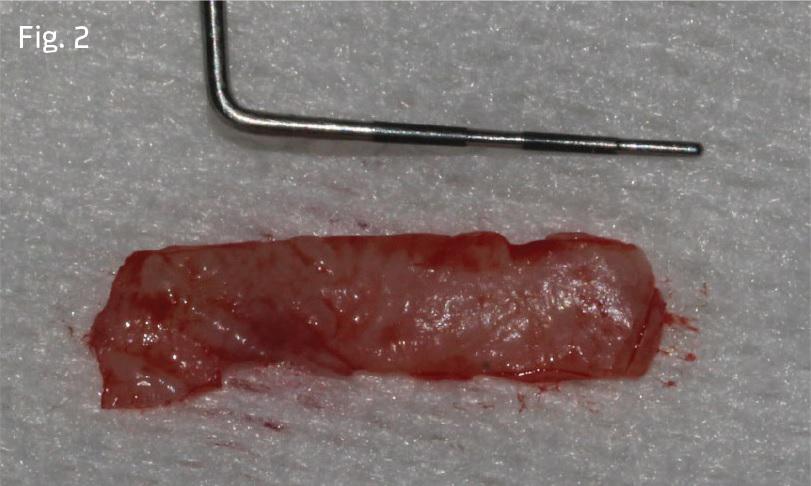
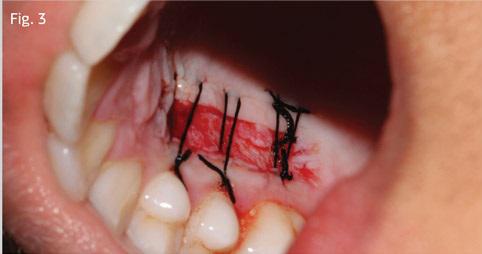
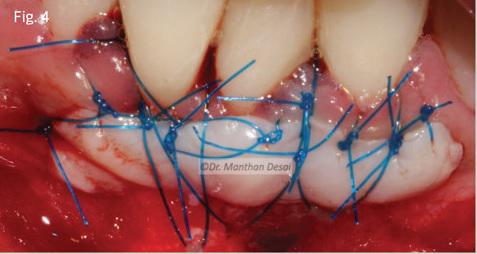
Рану в области неба ушивали посредством 3-0 шелковых швов (фото 3). Фиксацию трансплантата в области десен проводили с использованием швов из мононитей 5-0 (фото 4).
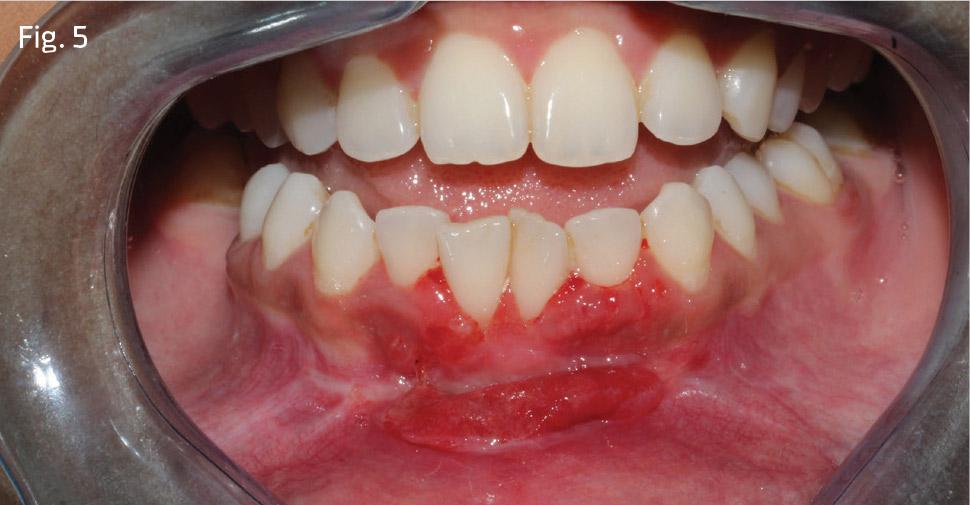
Реципиентную область покрыли пародонтальной повязкой (фото 5), и через 2 недели были отмечены признаки адекватного заживления раны с восстановлением соединительнотканного прикрепления. Для профилактики рецидива рецессии больной был направлен к ортодонту, но позже, к сожалению, отказался от его помощи.
Клинический случай 2
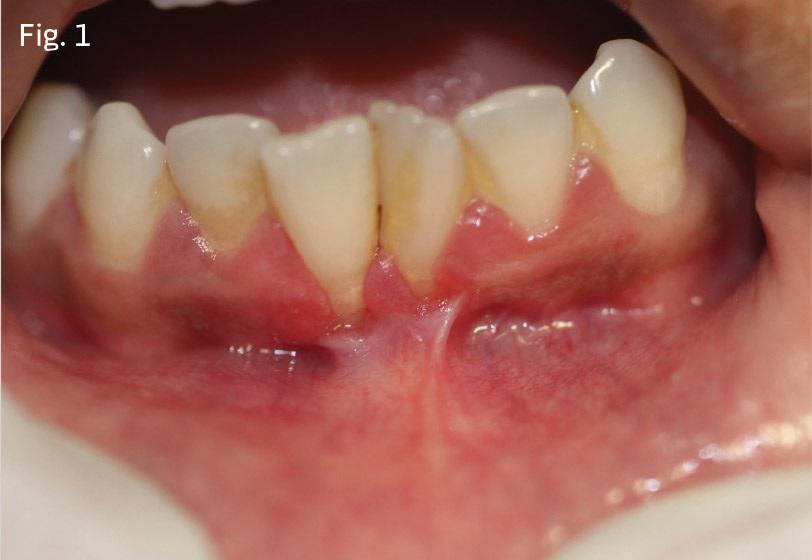
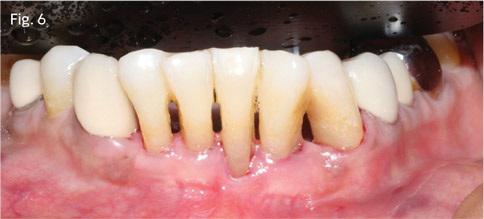
55-летняя женщина обратилась за стоматологической помощью с основной жалобой на упадок десен в области нижних фронтальных зубов. В ходе клинического осмотра были обнаружены дефицит прикрепленной десны, симптомы рецессии, горизонтальная потеря кости и подвижность нижних зубов І степени (фото 6).
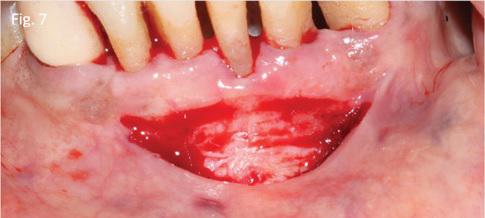
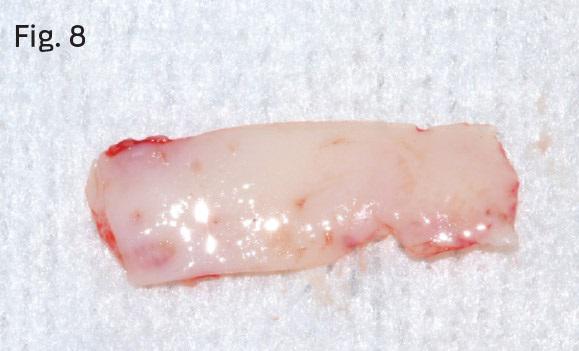
Область препарировали таким образом, чтобы максимально сохранить хорошее периостальное ложе для последующей реваскуляризации материала трансплантата. Трансплантат сформировали из области неба (фото 8), после чего рану ушили с помощью Surgicel и 3-0 шелковых нитей (фото 9). Аутографт фиксировали в реципиентном участке при помощи 4-0 монофиламентных швов (фото 10).
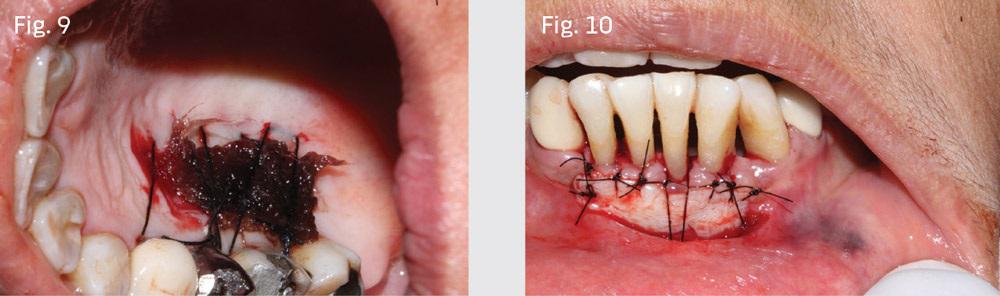
Реципиентный участок покрыли пародонтальной повязкой, а через 2 недели как донорская так и реципиентная области демонстрировали признаки адекватного заживления (фото 11-12).
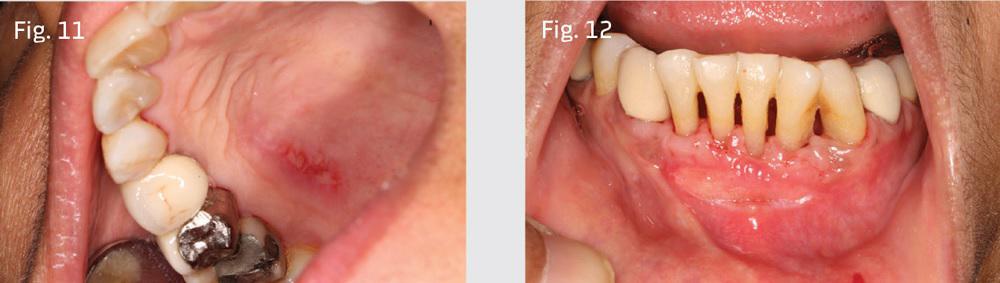
Аугментация области кератинизированных десен помогает минимизировать риск возникновения рецессии, поскольку реконструктивные процедуры обеспечивают восстановление соединительнотканевого прикрепления. Новая кератинизированная ткань может вполне адекватно противостоять действию негативных факторов при условии, что оперативные вмешательства по ее восстановлению были выполнены согласно строгому хирургическому алгоритму.
Автор: Dr. Manthan Desai
Согласно пародонтологической терминологии, прикрепленная десна – эта та часть мягких тканей, которая крепко и плотно соединена с низлежащими периостом, зубами и костью. Кератинизированная часть десен обеспечивает стабилизацию десневого края, способствует распределению сил в мышечных волокнах во время жевания, а также защищает другие ткани от каких-либо повреждений и травматичных воздействий.

Niklaus Lang and Harald пришли к выводу, что 2 мм ороговевших десен и менее чем 1 мм прикрепленных вполне достаточно для поддержания адекватного их состояния. Jan Wennström, в свою очередь, заключил, что прикрепленная десна, кроме всего прочего, влияет и на состояние общего пародонтологического статуса пациента. Согласно данным Mehdi Adibrad, отсутствие адекватной ороговевшей слизистой вокруг имплантатов с сопутствующими супраконструкциями повышает риск аккумуляции зубного налета, возникновения воспалительных изменений десен, кровотечения, и конечно же, рецессии. Ingvar Eriksson считает, что адекватная ширина прикрепленной десны – это та, количества которой достаточно для превенции риска возникновения рецессии, исходя из индивидуальных клинических характеристик пациента. Роль ороговевшей десны до сих пор остается до конца недостаточно изученной, но для сохранения таковой врачи пользуются свободными десневыми трансплантатами, выполняют апикальную репозицию лоскутов и мягкотканую аугментацию.
В двух клинических случаях, приведенных ниже, описано эффективное использование свободных десневых трансплантатов для увеличения объема прикрепленной десны.
Клинический случай 1


Рану в области неба ушивали посредством 3-0 шелковых швов (фото 3). Фиксацию трансплантата в области десен проводили с использованием швов из мононитей 5-0 (фото 4).


Реципиентную область покрыли пародонтальной повязкой (фото 5), и через 2 недели были отмечены признаки адекватного заживления раны с восстановлением соединительнотканного прикрепления. Для профилактики рецидива рецессии больной был направлен к ортодонту, но позже, к сожалению, отказался от его помощи.

Клинический случай 2
55-летняя женщина обратилась за стоматологической помощью с основной жалобой на упадок десен в области нижних фронтальных зубов. В ходе клинического осмотра были обнаружены дефицит прикрепленной десны, симптомы рецессии, горизонтальная потеря кости и подвижность нижних зубов І степени (фото 6).


Область препарировали таким образом, чтобы максимально сохранить хорошее периостальное ложе для последующей реваскуляризации материала трансплантата. Трансплантат сформировали из области неба (фото 8), после чего рану ушили с помощью Surgicel и 3-0 шелковых нитей (фото 9). Аутографт фиксировали в реципиентном участке при помощи 4-0 монофиламентных швов (фото 10).


Реципиентный участок покрыли пародонтальной повязкой, а через 2 недели как донорская так и реципиентная области демонстрировали признаки адекватного заживления (фото 11-12).

Аугментация области кератинизированных десен помогает минимизировать риск возникновения рецессии, поскольку реконструктивные процедуры обеспечивают восстановление соединительнотканевого прикрепления. Новая кератинизированная ткань может вполне адекватно противостоять действию негативных факторов при условии, что оперативные вмешательства по ее восстановлению были выполнены согласно строгому хирургическому алгоритму.
Городская клиническая больница скорой медицинской помощи, Рязань
Первый МГМУ им. И.М.Сеченова
Кафедра факультетской хирургической стоматологии стоматологического факультета ГБОУ ВПО «Первый Московский государственный университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Кафедра факультетской хирургической стоматологии стоматологического факультета ГБОУ ВПО «Первый Московский государственный университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Кафедра факультетской хирургической стоматологии стоматологического факультета ГБОУ ВПО «Первый Московский государственный университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Гистологические результаты использования коллагенового матрикса для увеличения ширины кератинизированной прикрепленной десны в области дентальных имплантатов
Городская клиническая больница скорой медицинской помощи, Рязань
Цель исследования — сравнительная оценка эффективности методов формирования кератинизированной десны по данным гистологического исследования. Материалом для исследования служил биоптат слизистой оболочки, полученный при помощи мукотома на этапе раскрытия имплантатов. Исследовали микротомные срезы толщиной 4—6 мкм с помощью светового микроскопа. Результаты исследования свидетельствуют о формировании многослойного плоского ороговевающего эпителия после проведения всех методов. Однако наилучшие результаты были получены при использовании коллагенового матрикса. Метод может быть рекомендован как альтернатива пересадке свободного десневого трансплантата.
Городская клиническая больница скорой медицинской помощи, Рязань
Первый МГМУ им. И.М.Сеченова
Кафедра факультетской хирургической стоматологии стоматологического факультета ГБОУ ВПО «Первый Московский государственный университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Кафедра факультетской хирургической стоматологии стоматологического факультета ГБОУ ВПО «Первый Московский государственный университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Кафедра факультетской хирургической стоматологии стоматологического факультета ГБОУ ВПО «Первый Московский государственный университет им. И.М. Сеченова» Минздрава России, Москва, Россия
В последние годы, в связи с активным развитием имплантологии, все больше внимания уделяется вопросам профилактики развития воспалительных осложнений вокруг имплантатов.
Одним из факторов, способствующих развитию мукозита и периимплантита является отсутствие достаточной ширины кератинизированной прикрепленной десны [6, 9] (рис. 1).

Рис. 1. Отсутствие прикрепленной кератинизированной десны вокруг имплантата в области отсутствующего 4.4 зуба. Явления мукозита.
Хотя данный тезис до сих пор вызывает дискуссии, большинство исследователей соглашаются с тем, что наличие плотного валика прикрепленной кератинизированной десны является клинически предпочтительным, поскольку он обеспечивает защиту тканей, окружающих имплантаты от механической травмы, бактериальной инфекции и способствует улучшению условий для проведения самостоятельной гигиены полости рта [1, 3].
На сегодняшний день универсальным методом, позволяющим увеличить зону кератинизированной прикрепленной десны, является пересадка свободного десневого трансплантата. Метод впервые был описан H. Bjorn в 1963 г. [4] и по настоящее время не претерпел значительных изменений. Несмотря на то что метод пересадки свободного десневого трансплантата по сей день считается «золотым стандартом», в последнее десятилетие были предприняты попытки разработать методы, позволяющие избежать необходимости использования аутогенных трансплантатов.
Один из таких методов — использование коллагенового матрикса ксеногенного происхождения [2, 5, 10]. Современные коллагеновые матриксы изготавливаются из свиного коллагена I и III типов. Как правило, коллагеновый матрикс состоит из двух слоев: плотного, который служит преградой для клеток и обеспечивает фиксацию к тканям, и губчатого, который служит для обеспечения организации кровяного сгустка (рис. 2).

Рис. 2. Внешний вид коллагенового матрикса Mucograft.
По мнению многих исследователей, использование коллагеновых матриксов демонстрирует хорошее заживление мягких тканей и рост кератинизированного эпителия [7, 8, 10]. Предполагается, что применение таких мембран позволяет получить прирост кератинизированной слизистой оболочки, сравнимый с пересадкой свободного соединительнотканного трансплантата, однако меньший, чем при использовании свободного десневого трансплантата.
Таким образом, представляет интерес проведение сравнительного анализа гистологического исследования тканей, полученных различными методами увеличения кератинизированной прикрепленной десны.
Материал и методы
На кафедре факультетской хирургической стоматологии Первого МГМУ им. И.М. Сеченова с сентября 2012 г. по настоящее время проводилось клиническое обследование и лечение 54 больных в возрасте от 22 до 65 лет с диагнозом частичного отсутствия зубов, у которых после проведения дентальной имплантации определялась недостаточная ширина кератинизированной прикрепленной десны.
Для увеличения ширины кератинизированной прикрепленной десны использовались три метода: апикально смещенный лоскут, апикально смещенный лоскут в сочетании с свободным десневым трансплантатом, апикально смещенный лоскут в сочетании с коллагеновой мембраной.
В зависимости от используемого метода пациенты были разделены на три группы. Распределение проводилось случайным образом. Критериями включения в исследование являлись: отсутствие супраструктур на установленных имплантатах, наличие ширины кератинизированной прикрепленной десны менее 2 мм с вестибулярной и оральной сторон, удовлетворительное состояние гигиены полости рта. Не включали в исследование активных курильщиков (более 10 сигарет в день), лиц с сопутствующими заболеваниями в стадии декомпенсации, беременных женщин.
В 1-й группе проводили увеличение ширины кератинизированной десны при помощи апикального смещения слизистой оболочки. Лезвием № 15с выполняли разрез по слизисто-десневому соединению до надкостницы, затем острым путем проводили расщепление и апикальное смещение слизистого лоскута. Слизистый лоскут фиксировали резорбируемой нитью VICRIL 6−0 на новой глубине преддверия (рис. 3).

Рис. 3. Расщепление и апикальное смещение слизистого лоскута. Надкостница раневой поверхности.
Во 2-й группе проводили апикальное смещение слизистой оболочки по вышеописанной схеме. Затем проводили забор свободного десневого трансплантата в области твердого неба (рис. 4).

Рис. 4. Свободный десневой трансплантат, полученный из области твердого неба.
Острым путем на предметном стекле от трансплантата отделяли жировые и железистые включения, после чего трансплантат фиксировали по периметру к надкостнице реципиентного ложа нерезорбируемой монофиламентной нитью PROLEN 6−0 (рис. 5).

Рис. 5. Свободный десневой трансплантат фиксирован к надкостнице реципиентного ложа.
В 3-й группе подготовка реципиентного ложа также была проведена по вышеописанной схеме. В качестве трансплантата использовали коллагеновый матрикс Mucograft. Матрикс обрезали стерильными ножницами по форме реципиентного ложа и фиксировали по периметру нерезорбируемой нитью PROLEN 6−0 (рис. 6).

Рис. 6. Фиксация коллагенового матрикса Mucograft монофиламентной нитью PROLEN 6−0.
Оценка ширины кератинизированной прикрепленной десны проводилась при помощи пародонтологического градуированного зонда перед операцией, на 7-е и 24-е сутки.
На 24-е сутки всем пациентам устанавливали формирователи десны. Проводили разрез на всю толщину слизистой оболочки по границе между собственной слизистой и зоной аугментации. Затем при помощи мукотома удаляли обе половинки слизистой оболочки над заглушкой имплантата (интактная слизистая: контроль) и фиксировали их для гистологического исследования в 10% растворе нейтрального формалина (рис. 7, 8).

Рис. 7. Этап раскрытия имплантатов. Забор биопсийного материала.

Рис. 8. Материал для гистологического исследования.
В лаборатории экспериментальной морфологии НИИ молекулярной медицины Первого МГМУ им. И.М. Сеченова микротомные срезы толщиной 4—6 мкм окрашивались гематоксилином и эозином, орсеином (на эластические волокна) и толуидиновым синим (на кислые гликозаминогликаны). Изучение и анализ гистологических препаратов проводили с использованием светового микроскопа OlympusBX51, оснащенного цифровой видеокамерой SDU (Россия). Микрофотографирование препаратов проводили с помощью этой камеры и программы Launch Cam_View.
Результаты исследования
1-я группа — апикальное смещение слизистой оболочки без трансплантата.
Во всех наблюдениях этой группы отмечали выраженную гиперплазию многослойного плоского эпителия со слабой кератинизацией и заметными проявлениями акантоза (рис. 9).

Рис. 9. Биоптат слизистой оболочки после проведения апикального смещения лоскута без трансплантации. Резкая, но неравномерная гиперплазия многослойного плоского эпителия с сильным акантозом. В подэпителиальной слизистой пролиферация фибробластов, лимфомакрофагальная инфильтрация. Здесь и на рис. 11—15: окраска гематоксилином и эозином, ×100.
Особенно утолщен базальный слой. Больше всего выражена гиперплазия в краевом участке препаратов, по-видимому, на границе с интактной слизистой. В базальном слое эпителия увеличено количество клеток, находящихся в состоянии митоза.
В подэпителиальном слое слизистой отмечали пролиферацию фибробластов, новообразование капилляров, диффузную и периваскулярную инфильтрацию (рис. 10).

Рис. 10. Фрагмент рис. 9. Пролиферация фибробластов, лимфомакрофагальная инфильтрация вокруг сосудов, новообразование капилляров, ×400.
Кроме того, в некоторых образцах отмечали выраженное с различной степенью разрыхление коллагеновых пучков и эластических волокон с деструкцией части коллагеновых волокон (рис. 11).

Рис. 11. Биоптат слизистой оболочки после проведения апикального смещения лоскута без трансплантации. В слизистой оболочке очаги разрыхления коллагеновых волокон, небольшие участки деструкции волокон, пролиферация фибробластов, лимфомакрофагальная инфильтрация, ×400.
В участках выраженной дезорганизации стромы отмечалась наибольшая лимфомакрофагальная инфильтрация с примесью тучных клеток.
2-я группа — апикальное смещение слизистой оболочки с пересадкой свободного десневого трансплантата.
В этой группе отметили умеренно выраженные участки гиперплазии эпителия с умеренным акантозом. В краевом участке, напротив, отмечается истончение основного слоя эпителия и выраженный акантоз (рис. 12).

Рис. 12. Биоптат слизистой оболочки после пересадки свободного десневого трансплантата. Слева внизу: гиперплазированная часть эпителия, вверху — эпителий атрофичен, но с выраженным акантозом. Коллагеновая структура слизистой изменена мало, слабая клеточная инфильтрация, ×200.
Содержание клеток с фигурами митоза в базальном слое эпителия значительно меньше, чем в предыдущей группе. Видны малочисленные и небольшие по размеру участки разрыхления коллагеновой стромы, эластические волокна не изменены. Незначительно увеличено количество новообразованных сосудов и имеется слабая очаговая лимфомакрофагальная инфильтрация.
3-я группа — апикальное смещение слизистой оболочки с пересадкой коллагенового матрикса.
В большинстве образцов слизистая оболочка имела такую же структуру, как и в интактной слизистой оболочке в контроле: плотные коллагеновые пучки и эластические волокна между ними. Содержание сосудов и фибробластов также близко к контролю. Практически отсутствует лимфомакрофагальная инфильтрация. Таким образом, имеется полная регенерация слизистой оболочки (рис. 13).

Рис. 13. Биоптат слизистой оболочки после использования коллагенового матрикса. Нормальная структура эпителия и всей слизистой оболочки, вверху лимфомакрофагальная инфильтрация, ×200.
В одном образце в толще слизистой оболочки обнаружено инородное тело, имеющее плохо выявляемую фибриллярную структуру и окруженное фиброзной капсулой (рис. 14).

Рис. 14. Биоптат слизистой оболочки после использования коллагенового матрикса. Инородное тело (Mucograft?) в регенерированной слизистой оболочке, ×200.
По-видимому, это остаточный фрагмент материала.
У одной пациентки в биоптате отмечали неполную регенерацию дефекта: эпителий не закрывал всю поверхность, он относительно тонкий и плохо дифференцирован. Под эпителием слизистая оболочка, также недостаточно зрелая. Фактически здесь сохраняется грануляционная ткань в стадии фиброзирования. В ткани много сосудов, пролиферирующих фибробластов, а также макрофагов и лимфоцитов (рис. 15).

Рис. 15. Биоптат слизистой оболочки после использования коллагенового матрикса. Справа: неполная регенерация дефекта, незрелый эпителий. Слева внизу фрагмент разрушающегося инородного тела. Между ними грануляционная ткань в стадии фиброзирования, ×200.
Заключение
Наилучшие результаты получены при использовании препарата Mucograft. Восстановленный многослойный плоский эпителий у большинства больных не отличался по структуре от контрольных (интактных) образцов биоптатов десны.
Однако в части биоптатов обнаруживались слабые дистрофические изменения в эпителии (очаговый акантоз и незначительное снижение толщины рогового слоя).
В собственной пластинке слизистой в некоторых биоптатах обнаруживались небольшие лимфомакрофагальные инфильтраты. В двух биоптатах выявлены инородные тела с фуксинофильной окраской и тонкой капсулой вокруг них. По-видимому, это остатки имплантата.
При пересадке свободного десневого трансплантата, полученного из тканей неба, регенерация слизистой происходила удовлетворительно. Дистрофия эпителия и воспалительно-дистрофические изменения собственной пластинки слизистой были выражены больше, чем при использовании Mucograft, но меньше, чем при апикальном смещении слизистой оболочки без трансплантата.
Таким образом, гистологическое изучение биоптатов слизистой оболочки десны при использовании различных методов увеличения кератинизированной прикрепленной десны показало, что при всех способах пластики на слизистой оболочке происходит регенерация многослойного плоского ороговевающего эпителия и подэпителиальной собственной пластинки слизистой.
Кафедра акушерства и гинекологии Российской медицинской академии последипломного образования, Москва
кафедра акушерства и гинекологии Российской медицинской академии последипломного образования, Москва
Кафедра акушерства, гинекологии, перинатологии и репродуктологии факультета послевузовского профессионального образования врачей Первого Московского государственного медицинского университета им. И.М. Сеченова;
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Новые международные стандарты и классификации в кольпоскопии
Журнал: Российский вестник акушера-гинеколога. 2011;11(6): 79‑83
Подзолкова Н.М., Роговская С.И., Акопова Е.С. Новые международные стандарты и классификации в кольпоскопии. Российский вестник акушера-гинеколога. 2011;11(6):79‑83.
Podzolkova NM, Rogovskaia SI, Akopova ES. New international standards and classifications in colposcopy. Russian Bulletin of Obstetrician-Gynecologist. 2011;11(6):79‑83. (In Russ.).
Кафедра акушерства и гинекологии Российской медицинской академии последипломного образования, Москва
Статья основана на материалах Всемирного конгресса по кольпоскопии и патологии шейки матки в Бразилии, на котором в июле 2011 г. были пересмотрены и изменены многие вопросы номенклатуры кольпоскопии. В связи с новыми научными данными о роли вируса папилломы в генезе рака шейки матки современные подходы к диагностике и лечению женщин с патологией шейки матки во всем мире значительно изменились, оптимизировались и стандартизировались, что обусловливает необходимость обучения врачей новым подходам к ведению пациенток. В статье представлены современные аспекты диагностики и лечения патологии шейки матки, современные характеристики критериев кольпоскопии, а также последние классификации, одобренные на Всемирном конгрессе по кольпоскопии.
Кафедра акушерства и гинекологии Российской медицинской академии последипломного образования, Москва
кафедра акушерства и гинекологии Российской медицинской академии последипломного образования, Москва
Кафедра акушерства, гинекологии, перинатологии и репродуктологии факультета послевузовского профессионального образования врачей Первого Московского государственного медицинского университета им. И.М. Сеченова;
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
Кольпоскопия (КС) - высокоинформативный, широко доступный и недорогой метод диагностики заболеваний шейки матки (ШМ), влагалища, вульвы, который существенно повышает эффективность обследования женщин с гинекологической патологией. Наряду с другими современными методами обследования КС позволяет выбрать оптимальные способы ведения пациенток и контролировать состояние эпителия шейки матки, влагалища и вульвы в различные физиологические периоды жизни женщины, может использоваться неоднократно. Актуальными остаются вопросы техники биопсии, методов и показаний к петлевой электроэксцизии, целесообразности применения индексов градации картин, новых классификаций и терминологии. Внедрение новых классификаций и появление новых знаний о генезе рака шейки матки требует переподготовки врачей.
Главная задача КС - выявить предраковые состояния эпителия ШМ, к которым относят дисплазию многослойного плоского эпителия (МПЭ) и эндоцервикального железистого эпителия, которая инициируется вирусом папилломы человека (ВПЧ).
Морфологические классификации
Термин «дисплазия» является морфологическим и одновременно клиническим понятием и включает в себя процесс пролиферации клеток с появлением в них атипии, особенно ядерной, с последующим изменением всей структуры эпителия, утратой нормального слоистого строения. В зависимости от интенсивности пролиферации клеток и выраженности структурной и клеточной атипии в эпителиальном пласте различают 3 степени дисплазии: легкой, умеренной и тяжелой степени, характеризующиеся появлением атипических клеток сначала в нижней трети, затем в нижних двух третях и, наконец, во всей толщине МПЭ, включая более поверхностные отделы. Состояние, при котором экспансия атипических клеток продолжается за пределы базальной мембраны, называют инвазивным раком.
Терминология и классификации в отношении предраковых состояний шейки матки меняются вместе с результатами новых исследований в этой области. Так, на 11-м Международном конгрессе по патологии шейки матки и КС (1975 г.) вместо наименования «дисплазия и карцинома iп situ» был предложен термин «цервикальная интраэпителиальная неоплазия» (CIN) с выделением 3 степеней тяжести: CIN I и CIN II степени соответствуют дисплазии легкой и умеренной степени, CIN III - включает одновременно дисплазию тяжелой степени и преинвазивную карциному. Объединение в ClN III дисплазии тяжелой степени и карциномы iп situ было связано со сходством их ультраструктурных и цитогенетических особенностей, а также биологической потенции.
Однако в конце XX века было установлено, что изменения эпителия, характерные для дисплазии, наблюдаются при инфицировании ВПЧ. В отношении подобных структурных изменений использовали наименования «койлоцитотическая атипия», «койлоцитоз», «плоская кондилома», которые стали объединять с терминами «легкая дисплазия», CIN I ввиду сходства их морфологических особенностей и трудностей дифференцировки.
Поэтому с целью лучшего понимания сущности предраковых процессов в шейке матки Национальным институтом по изучению рака (США) разработана их новая цитологическая классификация (Bethesda system, 1988 г., с последующим пересмотром в 1991 г. в классификации по терминологии Бетезда-системы ТБС). В ТБС группа дисплазии легкой степени объединена с группой цитологических изменений при папилломе вирусной инфекции (ПВИ) (койлоцитотическая атипия, плоская кондилома) в группу плоскоклеточных интраэпителиальных поражений низкой степени (LSIL), а CIN II-III объединены в группу плоскоклеточных интраэпителиальных поражений высокой степени (HSIL).
Термины LSIL и HSIL постепенно экстраполируются на гистологические критерии предрака и клинико-кольпоскопическую практику. ТБС в экономически развитых странах применяется для обозначения клинико-кольпоскопических ситуаций, так как при проведении скрининговых программ важно придерживаться одинаковых классификаций и терминологии, что гарантирует преемственность среди смежных специалистов.
Кольпоскопия как метод исследования
Расширенная КС - наиболее эффективная и распространенная методика - осмотр эпителия с применением различных эпителиальных и сосудистых тестов, при которых оценивается реакция тканей в ответ на обработку медикаментозными составами. В технологическую цепь КС включены осмотр тканей под разным увеличением, с использованием фильтра, после обработки растворами уксусной кислоты и Люголя. Каждый этап позволяет уточнить кольпоскопические данные, так как метод является в известной мере субъективным и требует достаточной подготовки и квалификации.
Кольпоскоп представляет собой укрепленную на штативе оптическую систему (бинокулярную лупу) с системой направленного освещения. Рекомендуется применять бинокулярный кольпоскоп, так как монокулярные приборы и цифровые устройства без окуляров имеют низкую эффективность исследования ввиду невозможности получить объемную трехмерную картину.
Чтобы быть удобным при ежедневном использовании в поликлинической практике, кольпоскоп должен быть надежен, иметь качественную оптику и мощный источник света, легко перемещаться по осям, без больших усилий врача. Прибор должен иметь градуированное трех- и пятикратное увеличение (наиболее часто используется увеличение в 4, 6, 9, 12, 14 раз), при котором возможна более эффективная диагностика изменений в эпителии или в сосудах шейки матки, влагалища и вульвы.
Весьма удобным для практики является испанский кольпоскоп «Оптомик», недавно появившийся в России, преимуществами которого являются европейская сборка, сертифицированное производство по стандартом ЕЭС, международный сертификат качества, долгий срок службы, высокое качество линз производства Германии, которое дает объемное и качественное изображение.
Так называемая параллельная оптика данного прибора позволяет долго на нем работать, уменьшает нагрузку на глаза врача, при этом исключается частичная потеря изображения при подключении светоделителя с видеокамерой для передачи данных на монитор или персональный компьютер (ПК). Программное обеспечение позволяет вести базу данных пациенток, делать отборы по разным параметрам, фиксировать результаты осмотров и манипуляций. Прибор имеет легкую механическую регулировку межзрачкового расстояния, диоптрий, точной фокусировки для получения качественного изображения. Максимальная подвижность шарнирной стойки, жесткость фиксации в заданном положении обеспечивают удобное расположение кольпоскопа по отношению к пациентке и облегчает работу врача. Имеется возможность выбора варианта освещения - галогеновое, светодиодное, ксеноновое. Ксеноновое освещение дает яркое, контрастное и естественное изображение исследуемой области, что особенно важно для проведения хирургических вмешательств. Данный вид освещения возможен только на кольпоскопе «Оптомик».
Крепления кольпоскопа можно модифицировать: на пятиколесное основание, к стене, к креслу, что позволяет экономить пространство кабинета. Имеется возможность подключить к источнику света кольпоскопа эндоскопическую видеокамеру для проведения диагностической гистероскопии, при этом нет затрат на дополнительный источник света. Имеется возможность подключения лазера через специальный манипулятор.
Терминология и классификации в кольпоскопии
Наиболее признанной в последние годы является международная терминология кольпоскопических терминов, принятая в 1990 г. на Всемирном конгрессе по патологии шейки матки и КС в Риме, пересмотренная в 2002 г., когда термин «лейкоплакия» был заменен на «кератоз», с чем тоже не совсем можно было согласиться.
Номенклатурный комитет Международной Федерации по КС и патологии шейки матки в течение последних лет подверг серьезной ревизии данную классификацию, была предложена новая номенклатура с учетом современных знаний; она длительное время была размещена на сайте Федерации и многие кольпоскописты, в том числе российские, приняли участие в обсуждении. Классификация была пересмотрена и модифицирована на конгрессе в Рио-де-Жанейро в июле 2011 г.

В соответствии с новой классификацией, предложенной Номенклатурным комитетом Международной Федерации по КС и патологии шейки матки (IFCPC), одобренной на 14-м Всемирном конгрессе IFCPC в июле 2011 г. в Бразилии, в группу аномальных картин снова возвращена лейкоплакия, а многие другие признаки представлены в более детальном виде. Новая классификация, которая представляется авторам более удобной для практикующего врача, отражена в табл. 1.
Как известно, кольпоскопическая картина зоны трансформации (ЗТ) зависит от степени замещения цилиндрического эпителия (ЦЭ) плоским и от характера метаплазии. Плоский метапластический эпителий ЗТ долгое время остается тонким, и поэтому участок на месте бывшей эктопии, уже покрытый плоским эпителием, долго выглядит красным, после обработки уксусной кислотой слегка белеет. Чем ниже степень зрелости эпителия, тем более неблагоприятно он выглядит при КС.
Закрытые железы белесовато-желтоватого цвета полусферически выступают над окружающей тканью, на их поверхности выявляется равномерный сосудистый рисунок с радиально расположенными сосудами, идущими от периферии к центру. Кроме того, здесь часто можно наблюдать многочисленные разветвленные, похожие на дерево, сосуды.
Так называемые открытые железы (ОЖ) определяются в виде темных точечных отверстий различной величины. Из-за давления секрета при внимательном кольпоскопическом осмотре можно наблюдать выделение слизи через отверстия. Вокруг протоков часто наблюдается нежный светлый ободок многослойного плоского эпителия. Это признак нормы. Плотный валикообразный светлый ободок вокруг ОЖ расценивается как неблагоприятный признак атипии. При наличии сосудов в нормальной ЗТ под действием уксусной кислоты они сужаются и сокращаются, вся ЗТ становится равномерно бледной.
Аномальные кольпоскопические картины включают в себя различные признаки, подозрительные в отношении интраэпителиальных неоплазий. Раньше их называли атипическими, однако от этого термина пришлось отказаться, поскольку большинство из них неспецифичны и, кроме CIN, могут быть характерны и для некоторых других состояний, в частности, хронических цервицитов, незрелой метаплазии и т.п.
Одним из важнейших критериев оценки кольпоскопической картины является наличие или отсутствие визуализации зоны стыка эпителиев (удовлетворительная/неудовлетворительная или адекватная/неадекватная кольпоскопическая картина). В новой номенклатуре предпочтение отдается разделению ЗТ на 3 типа.

По соотношению экзоцервикального и эндоцервикального компонентов ЗТ принято разделять на 1-й, 2-й и 3-й типы, которые представлены на рисунке. Рисунок 1. Типы зоны трансформации в зависимости от соотношения экзо- и эндоцервикального компонента. a - ЗТ 1-го типа: полностью на экзоцервиксе, полностью визуализируется, любых размеров; б - ЗТ 2-го типа: не полностью на экзоцервиксе, имеет эндоцервикальный компонент, полностью визуализируется, любых размеров; в - ЗТ 3-го типа: полностью не визуализируется, не полностью на экзоцервиксе, имеет больной эндоцервикальный компонент, любых размеров, КС неудовлетворительная, стык в эндоцервиксе не виден.
Ацетобелый эпителий (АБЭ) считается наиболее важным кольпоскопическим признаком. По интенсивности выделяют беловатый, белый, густой белый эпителий; при этом он бывает плоским или папиллярным. Первые два могут быть показателями как LSIL, так и других состояний: воспалений, цервицита и т.п. Последние более характерны для HSIL. Согласно классификации, АБЭ может быть тонким или плотным (нежный и грубый). Главная кольпоскопическая характеристика этого признака в том, что чем интенсивнее белеет ткань после обработки уксусной кислотой и чем дольше сохраняет этот эффект, тем серьезнее и глубже поражение. Четкие контуры белого эпителия, быстро проявляющаяся реакция, ярко выраженная интенсивность цвета и способность длительно сохранять бело-серый цвет свидетельствуют о высокой вероятности атипии. АБЭ может появиться и вне ЗТ на фоне неизмененного многослойного плоского эпителия.
Термин «йод-негативная зона» (ЙНЗ), в отличие от терминов «кератоз» или «лейкоплакия», характеризует изменение многослойного плоского эпителия, которое можно заметить только после нанесения раствора Люголя. ЙНЗ представляет собой, как правило, кератинизированный эпителий, однако прогнозировать качество тканей под ороговевшим слоем кольпоскопически невозможно, поэтому большинство авторов считают необходимым производить прицельную биопсию с этих участков. ЙНЗ может соответствовать незрелой метаплазии, CIN, локальной атрофии МПЭ при низком уровне эстрогенов. Мелкие очаги ЙНЗ эпителия особой тревоги не вызывают. Поэтому этот признак отнесен в группу аномальных неспецифических картин.
Пунктация (П), или точечность, соответствует старому термину «основа» и представляет собой одно из проявлений атипической васкуляризации эпителия. Гистологически пунктация представляет собой зону эпителия с удлиненными стромальными папиллами (выростами), в каждой из которых имеется сосудистая петля, доходящая почти до поверхности, пенетрирующая эпителий.
Мозаика (М) соответствует старому термину «поля». Гистологически это разветвленные в эпителии стромальные папиллы (выросты) с сосудами внутри. Практически М представляет собой островки МПЭ или атипического эпителия, окруженные сосудистыми линиями. При этом массивные тяжи плоского эпителия могут глубоко внедряться в подлежащую ткань. Невооруженным глазом мозаика и пунктация обычно не видны.
В практике чаще встречаются нежные М и П и напоминают сетчатую мраморность и точечность. После обработки уксусной кислотой рисунок и границы М становятся более определенными в виде сети бледных красных линий. Аномальная М обычно йоднегативна. Йодпозитивными становятся М и П, свойственные воспалению и папилломавирусной инфекции. Нежные М и П - очень светлые, проявляются ненадолго, неинтенсивные, часто сопровождают процессы метаплазии. Грубые М и П напоминают булыжную мостовую.
Атипия сосудов проявляется в виде хаотически расположенных, не анастомозирующих сосудов причудливой формы. Они могут быть сильно извитыми или резко обрывающимися, иметь штопорообразную или шпилькообразную форму, иногда вид запятых или петель. После обработки раствором уксусной кислоты сокращения атипических сосудов не происходит из-за отсутствия в них нормального мышечного слоя. Отсутствие такой реакции - важный признак атипии.
Иногда инвазивный рак может быть клинически очевиден и без проведения КС, представляя собой значительные топографические изменения, когда уже можно применить термин «распадающаяся опухоль». Клинические формы рака легко диагностируются при обычном гинекологическом исследовании невооруженным глазом и пальпации. Экзофитная опухоль или кратерообразная язва с некротическим налетом хорошо видны на фоне резко деформированной и гипертрофированной шейки деревянной плотности. Обычно развитая раковая опухоль лучше просматривается при макроскопическом обследовании. Клиническая картина начальных форм рака неспецифична.
Другие кольпоскопические картины
При кольпоскопии можно определить еще целый ряд других доброкачественных образований: эрозии, полипы, кондиломы, эндометриоз и т.п.
Новая классификация предложена также и в отношении петлевой электроэксцизионной процедуры - иссечения аномальной ткани тонкой проволочной электропетлей различных размеров и формы с захватом нижней части цервикального канала.

В соответствии с новой классификацией, предложенной IFCPC, одобренной на 14-м Всемирном конгрессе IFCPC в июле 2011 г. в Бразилии, целесообразно внедрять в практику новые характеристики метода, представленные в табл. 2.
Таким образом, в настоящее время международным сообществом предпринимаются попытки оптимизировать подходы к раннему выявлению предраковых состояний шейки матки, внедрение которых в практику должно способствовать усилению преемственности между специалистами, упрощению оформления медицинской документации, повышению эффективности диагностики и лечения, что будет снижать заболеваемость раком шейки матки.
Читайте также:

