Какое свойство придает нашей коже эластин
Обновлено: 28.04.2024
В организме человека присутствует два вида белков: коллаген и эластин, которые отвечают за целостность, структуру и динамическое движение всех тканей. В данной статье обсудим именно эластин, его формирование и роль в организме.
Как и коллаген, эластин находится только во внеклеточном матриксе, наибольшую его концентрацию регистрируют в глубокой дерме - 2%. Он является необходимым компонентном таких жизненноважных структур организма человека, как артерии, легкие, соединительная ткань сердца, мочевой пузырь, сухожилии, то есть тех структур, которые постоянно растягиваются и сжимаются. Именно это свойство отличает эластин от коллагена - возвращаться в исходное состояние после растяжения. Жизнь волокон эластина, избежавших деградацию, может достигать до 75 лет.
Образование эластина происходит в межклеточном матриксе в несколько этапов.
Данный процесс называется эластогенез. Сначала формируются мономерные молекулы тропоэластина, далее они подвергаются продольной сшивке лизилоксидазой (LOX). При связывании с фибулином, молекулы тропоэластина образовывают водонерастворимый клубок. Процесс связывания десятков таких аморфных клубков приводит к образованию волокон полимерных молекул эластина, в которых хаотичным образом создаются поперечные сшивки лизин-пролина и лизин-аланина, благодаря которым волокна зрелого эластина легко подвергаются растяжению, а затем способны быстро принимать прежнюю форму.
Активный синтез эластина у млекопитающих происходит в период формирования плода в утробе матери, с рождением синтез эластина начинает постепенно замедляться и к 50 годам полностью прекращает свою активность. Локальная активация синтеза эластина обнаружена при повреждении соединительной ткани или кожи, а также при патологиях, например, при онкологии. Важнейшую роль в синтезе эластина играют цитокины, которые способоны, как активировать, так и подавлять данный процесс. Доказано, что стимулирующее воздействие на формирование эластина оказывают факторы: TGFβ1 и IGF-I. Одновременно им противодействуют bFGF/FGF-2, HBEGF,EGF, PDGF-BB, TGFα, TNF-α и IL-1β факторы.
Говоря о деградации волокон эластина, данный процесс осуществляется под действием трех ферментов эластазы:
- Фермент ММР-12 “отщипывает” молекулу тропоэластина в 89 местах
- Фермент ММР-7 “откусывает” молекулу тропоэластина в 58 местах
- Фермент ММР-9 в 63 местах
При этом в случае повреждения глубокой дермы происходит стимуляция синтеза эластаза ММР-12, который при нормальных условия производится макрофагами.
Огромное влияние на состояние и изменение внеклеточного матрикса оказывает ультрафиолет. Было выявлено, что УФ-излучение снижает содержание гомолога 1 лизилоксидазы (LOXL1) и активирует элафин. Как результат, накапливается нефункциональный эластин, который представляет собой агрегаты с элафином, при этом количество полноценных фибрилл значительно снижается. Кроме этого, с возрастом активируется эластаза неприлизин, производимый фибробластами. Он разрушает волокна эластина, которые уже ранее пострадали от эластаз ММР-7,9 и 12, что в итоге приводит к упадку эластиновых структур и общему ухудшению показателей кожи: упругости и эластичности.
Эластокины
Пептиды эластина, способные быть триггерами внутриклеточных молекулярных реакций. С помощью эксперимента были выявлены следующие активные пептиды эластина: GVYPG, GFGPG, GVLPG, YGARPGVGVGGIP и PGFGAVPGA. Самый изученный эластокин у человека - VGVAPG, VG-6, который входит в состав домена 24. Данный пептид оказывает стимулирующее воздействие на различные процессы, происходящие в фибробластах: меланогенез, деление прораковых, синовиальных, дендритных клеток и плателетов. В астроцитах пептид VGVAPG спобоствует снижению окиси азота и увеличивает концентрацию свободных радикалов кислорода. В фиброзной соединительной ткани присутствуют лишь фрагменты полимеров тропоэластина и эластина, чем обуславливается жесткость, например, шрамов. В раковых клетках VGVAPG приводит в действие эластазы ММР-2 и ММР-14, которые в итоге способствуют распространению раковых клеток из первичного очага в другие ткани.
Информация о способности фибрилл эластина взаимодействовать с клетками, дала возможность определить рецепторы эластина. Было установлено, что контакт производится через белок-медиатор эластонектин. Формирование эластонектина стимулируется фрагментами волокон эластина.
Главным рецептором для VGVAPG и других пептидов эластина является белок ЕВР.
Выявлено, что продолжительная активация данного белка приводит, например, к утолщению сосудистой ткани и пролиферации мускольной ткани.
У белка ЕВР отсутствует ферментативная функция, но он обладает двумя функциональными областями:
- для связывания с эластокинами или с интактным эластином
- для связывания сахаров
Среди ученых есть предположение, что до сих пор не выявлены все белки, с которыми происходит контакт эластокинов. При некоторых видах онкологии связывание VGVAPG с рецепторами коррелируется с активностью протеинкиназы С, но пока эмпирически выявлено этого не было. Также на сегодняшний день нет данных о «странствующих» рецепторах эластина, несмотря на то, что фрагменты эластины были найдены в кровотоке и эластин может влиять на эндотелий.
В заключении необходимо добавить, что сегодня эластин является крайне популярным объектом для изучения. Уже сейчас были выделены эластиноподобные полипептиды (ЭПП), которые по своим характеристикам не устапают естественному эластину. Однако, для выведения их в повсеместное использование они должны зарекомендовать себя, как безопасные и не вызывающие воспалительные реакции субстанции.
• Основная функция эластина состоит в обеспечении эластических свойств тканей
• Мономеры эластина (известные как тропоэластиновые субъединицы) организованы в волокна, настолько прочные и устойчивые, что функционируют в течение всей жизни организмов
• Прочность этих волокон обусловлена образованием ковалентных сшивок между боковыми цепями лизина, находящегося в соседних мономерах эластина
• Эластичность волокон связана с наличием гидрофобных областей, которые при приложении силы растягиваются, а при снятии нагрузки спонтанно сокращаются
• Сборка волокон тропоэластина происходит во внеклеточном пространстве и находится под контролем трехступенчатого процесса
• Мутации в гене эластина являются причиной развития разнообразных патологических состояний, начиная от образования морщин на коже и заканчивая ранней детской смертностью
Как следует из названия, эластин представляет собой белок внеклеточного матрикса, главным образом, обеспечивающий эластические свойства тканей. Благодаря эластину, ткань может растягиваться и возвращаться к исходному размеру, дополнительно не расходуя энергию. Эластина особенного много в таких тканях, как кровеносные сосуды, кожа и легкие, где эластичность является критическим фактором, обеспечивающим правильное функционирование органа.
Например, эластичность кровеносных сосудов играет важную роль в поддержании надлежащего уровня кровяного давления, а эластичность легких с каждым вдохом обеспечивает их заполнение воздухом и последующее опорожнение.
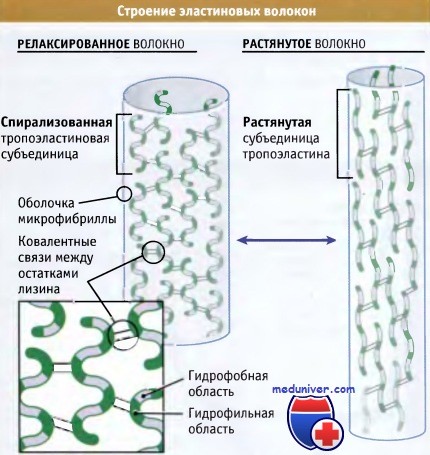
Схематическое строение релаксированных и растянутых эластиновых волокон.
Отметьте выраженные различия в структуре эластиновых субъединиц в каждом случае.
Детали строения субъединиц пока неизвестны.
Эластин синтезируется и секретируется фибробластами, представляющими собой один из наиболее распространенных типов клеток у животных, а также клетками гладкой мускулатуры. Эти клетки также секретируют коллагены, которые противостоят растяжению. В результате внеклеточный матрикс каждого органа характеризуется комбинацией свойств эластичности и прочности. Изменяя соотношение эластина и коллагена во внеклеточном матриксе, клетки могут регулировать эластические свойства органов.
Как следует из рисунка ниже, эластин организован в волокна, которые состоят из основной области эластиновых белков, окруженной оболочкой микрофибриллярных белков диаметром 10-12 нм. Основным компонентом этой оболочки является гликопротеин, связанный с микрофибриллами, который ассоциирован с мономером эластина и способствует его включению в более крупные эластиновые волокна. Эти волокна настолько прочны и стабильны, что функционируют на протяжении всей жизни организмов (т. е. не деградируя и не замещаясь). Присутствующий в этих волокнах эластин является наименее растворимым белком позвоночных.
Каким образом, эластин, обладая высокой прочностью и стабильностью, тем не менее, проявляет высокую эластичность? Ответ лежит в особенностях его структуры. Ген эластина содержит 36 экзонов, которые кодируют две совершенно разных последовательности аминокислот: некоторые из них проявляют гидрофильные свойства и содержат много остатков лизина, в то время, как другие обогащены гидрофобными аминокислотами, особенно глицином, пролином, аланином и валином.
Гидрофобные последовательности вкраплены среди гидрофильных областей, что обусловливает существование большого по размеру белка, обладающего двумя различными свойствами. Прочность эластиновых волокон, в основном определяется ковалентными связями, возникающими между боковыми цепями лизина в примыкающих друг к другу белках, подобно тому как это имеет место в коллагене. Наоборот, гидрофобные области обеспечивают эластичность за счет сворачивания молекулы в спираль в нерастянутом состоянии, и ее растяжения при приложении силы. При снятии напряжения эти области снова спонтанно сворачиваются. Даже после многолетних исследований биологи не пришли к заключению о точной конформации эластиновых белков в волокнах.
Сборка таких нерастворимых белков ставит перед клеткой особые проблемы. Если эти белки, до момента их секреции из клетки, спонтанно агрегируют, они могут повлиять на секрецию других белков, «закупоривая» секреторные пути, а также вызывать разрыв органелл или плазматической мембраны. Клетки синтезируют и секретируют эластиновые белки в виде мономеров, однако собирают волокна только во внеклеточном пространстве, после того как белки вышли из клетки, не нарушив ее внутреннюю среду.
Как иллюстрирует рисунок ниже, образование эластина включает три основных этапа:
• Вскоре после образования эластиновых мономеров (известных под названием тропоэластина) они связываются в ЭПР с белком-шапероном мол. массы 67 кДа. В течение всего процесса секреции этот шаперон остается связанным с тропоэластином и предотвращает агрегацию эластина в клетке.
• После завершения секреции комплекс с помощью шаперона удерживается на поверхности клетки до тех пор, пока он не вступит в контакт с оболочкой эластинового волокна. После этого вновь секрети-рованный тропоэластин встраивается в эластиновое волокно с участием сахарных компонентов его оболочки, которые замещают шапероны.
• Большая часть боковых цепей лизина, присутствующего в мономере тропоэластина, дезаминируется при действии фермента лизилоксидазы. При этом образуются аллизины, которые ковалентно связываются с аллизинами или немодифицированными лизинами, присутствующими в других эластиновых белках волокна. Название зрелый эластин используют для обозначения эластиновых белков, которые были модифицированы лизилоксидазой и образовали полимер.
Таким образом, трехэтапный метод обеспечивает полную сборку эластина только в тех местах клетки, где это является необходимым.
Как можно ожидать, изменения, наступающие в процессе сборки или функционировании эластина и эластиновых волокон, могут иметь серьезные последствия для клетки. Дряблость кожи, заболевание, которое выражается в утрате эластиновых волокон в коже и соединительной ткани, по тяжести проявления может варьировать от незначительного разрушения волокон и возникновения морщин до практически полной утраты волокон. У больных, в клетках которых мало эластиновых волокон или они вообще отсутствуют, не поддерживается целостность тканей, и они умирают в раннем детстве.
У больных с синдромом Вильямса образуются укороченные формы эластина, в которых отсутствуют некоторые домены связывания, и нарушен процесс организации в волокна. У этих больных развивается сильное сужение крупных артерий, по-видимому, обусловленное аномальным ростом вокруг артерий клеток гладкой мускулатуры. Это служит компенсаторной реакцией в ответ на утрату эластиновых волокон, обычно присутствующих в стенке артерий.
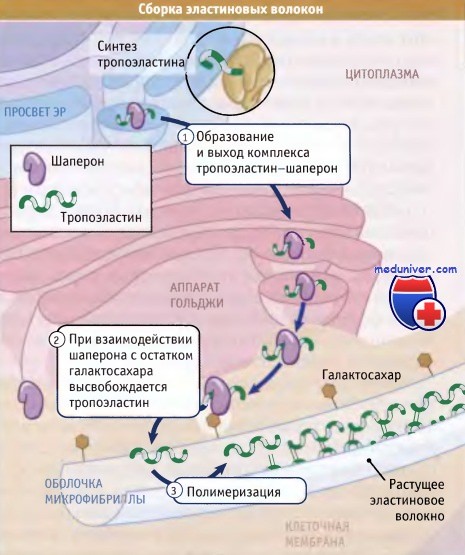
Во время транспорта к клеточной поверхности эластиновые мономеры (тропоэластины) связаны с шаперонами.
Связывание шаперонов с оболочкой микроволокна приводит к высвобождению мономеров эластина.
Полимеризация катализируется поперечными сшивками тропоэластинов, которые образуются при действии лизилоксидазы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Основная функция коллагена состоит в обеспечении структурной опоры тканей
• Коллагены представляют собой семейство, состоящее более чем из 20 различных белков внеклеточного матрикса. Эти белки — наиболее распространенные в царстве животных
• Все коллагены организованы в тройные спирализованные «коллагеновые субъединицы», обладающие суперспиральной структурой и состоящие из трех отдельных полипептидов
• Коллагеновые субъединицы выходят из клеток и затем, во внеклеточном пространстве, собираются в более крупные фибриллы и волокна
• Мутации в коллагеновых генах вызывают множество патологических состояний, начиная от появления морщин до развития хрупкости костей и таких тяжелых заболеваний, как образование кожных волдырей
Семейство коллагенов включает более 20 белков, которые относятся к наиболее распространенным белкам клеток животных. У многоклеточных организмов коллагены существуют по крайней мере 500 млн лет. Почти все клетки животных синтезируют и секретируют по меньшей мере одну из форм коллагена.
Коллагены обеспечивают тканям структурную поддержку и существуют во множественных формах, организованных в различные структуры. Все белки семейства коллагенов характеризуются одним общим свойством: они собраны в тонкие (примерно 1,5 нм диаметром) тройные спиральные суперспирализованные структуры, состоящие из трех субъединиц коллагеновых белков, которые удерживаются вместе ковалентными и нековалентными связями.
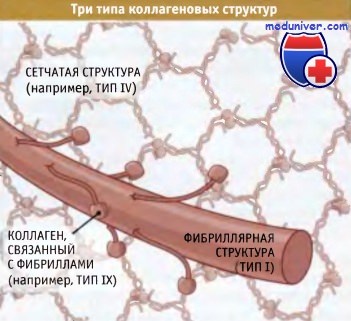
Коллагеновые субъединицы собираются в тройные спиральные структуры, которые организуются в фибриллы или в сеть,
где они связаны между собой другими белками внеклеточного матрикса, включая коллагены, связанные с фибриллами.
Суперспирализованные структуры бывают трех типов — фибриллярные, слоистые и связанные с фибринами:
• В фибриллярных коллагенах суперспирализованные спирали организованы в фибриллы или «канаты», которые обеспечивают прочность структуры вдоль единственнной оси (такая структура напоминает прочный стальной трос, образованный проволочными пучками). Когда эти фибриллы собраны в параллельно расположенные пучки, как в сухожилиях, они обеспечивают невероятную прочность структуры, которая способна противостоять усилиям, развиваемым мышцами, закрепленными на костях.
• Слоистые коллагены представляют собой сеть, состоящую из суперспирализованных спиральных структур. Они в меньшей степени устойчивы к мышечным усилиям, но гораздо лучше противостоят растяжению в нескольких направлениях. Сеть таких структур, например, характерна для кожи.
• Третий тип коллагена, известный как «фибриллярные связки», образует суперспирализованные спиральные структуры, связывающие коллагеновые фибриллы вместе.
Независимо от организации, коллагены образуют основную каркасную структуру внеклеточного матрикса. Такие входящие во внеклеточный матрикс белки, как фибронектин и витронектин, связываются с коллагенами и вплетены в структуры, образованные коллагеновым каркасом. Один из представителей семейства коллагенов представляет собой трансмембранный белок, который участвует в формировании межклеточных контактов.
Существует примерно 20 различных типов коллагена, большая часть которых может быть сгруппирована в четыре класса. Каждая из тройных спиралеобразных структур обозначается римской цифрой (I, II, III и т. д.). Каждая коллагеновая субъединица имеет обозначение как субъединица а, а ее типу присвоен номер (а1, а2, а3 и т. д.), после которого римской цифрой обозначен тип, в котором она находится. Например, основной фибриллярный коллаген хвоста (и других тканей) крыс относится к типу I и состоит из двух копий субъединиц а1(1) и одной копии субъединицы а2 (I).
На рисунке ниже представлена структура коллагеновых волокон. Три полипептидные субъединицы параллельно обернуты вокруг друг друга и образуют суперспирализованную спиральную структуру длиной 300 нм. Для коллагенов характерна повторяющаяся последовательность аминокислот, содержащая элемент глицин-X-Y, где X и Y могут представлять собой любую аминокислоту, но обычно это пролин и гидроксипролин соответственно.
Такая последовательность способствует плотной упаковке трех субъединиц и облегчает образование суперспиральной структуры. Субъединицы длиной 300 нм скрепляются вместе посредством ковалентных связей, которые образуются между N-концевым участком одной субъединицы и С-концевым участком примыкающей к ней. Суперспирализованные спиральные структуры располагаются параллельно, образуя между собой небольшие зазоры (64-67 нм). Эти зазоры обеспечивают характерный вид (исчерченность) фибрилл, видимый в электронном микроскопе.

Коллагеновые белки подразделяются на четыре основные группы, которые отличаются по молекулярной формуле,
характеру полимерных форм и по распределению в тканях. Некоторые группы включают коллагены нескольких типов.
Полностью собранные коллагеновые структуры (фибриллярные или сетчатые) по размерам оказываются гораздо больше, чем сами клетки; некоторые фибриллы могут достигать нескольких миллиметров длины. Таким образом, субъединицы коллагена синтезируются и секретируются в виде суперспирализованных спиральных структур, и окончательные этапы их сборки происходят вне клетки. Как показано на рисунке ниже, синтез коллагена и дальнейший его процессинг происходят на протяжении всего секреторного пути. При синтезе коллагеновые белки направляются в гранулярный эндоплазматический ретикулум (ЭПР) при участии частиц, распознающих сигнал и связанного с ними белкового аппарата.
Коллагеновые субъединицы синтезируются в виде крайне длинных полипептидов, которые называются проколлагены и содержат пропептиды, представляющие собой «хвосты», расположенные на амино- и карбоксильном концах.
После того как проколлагены попали в просвет ЭР, по мере транспорта из ЭР через аппарат Гольджи и в секреторные везикулы, они претерпевают серию модификаций. В процессе транспорта проколлагена через ЭР и аппарат Гольджи, к боковым цепям пролина и лизина, находящимся в средней части молекул проколлагена, добавляются гидроксильные группы (-ОН). При этом образуются гидроксипролин и гидроксилизин.
Эти модификации обеспечивают правильное образование водородных связей, которые скрепляют вместе три субъединицы в суперспирализованной спиральной структуре. Между амино- и карбоксиконцевыми частями пропептидов образуются дисульфидные связи, которые затем обеспечивают правильное расположение трех проколлагеновых субъединиц с образованием тройной спиральной суперспирализованной структуры. Затем спираль образуется спонтанно, в направлении от С-конца к N-концу.
Пропептиды препятствуют взаимодействию суперспирализованных спиралей друг с другом, тем самым предотвращая полимеризацию коллагена в клетке. Когда произошла секреция тройных спиралей проколлагена, ферменты, которые называются протеазы проколлагена, отщепляют пропептиды. Остающийся белок, известный под названием тропоколлагена, почти весь организован в тройную спираль и представляет собой основную структурную единицу коллагеновой фибриллы.
Фибриллы собираются просто: боковые цепи лизина в тропоколлагене модифицируются при действии фермента лизилоксидазы, образуя аллизины. Эти модифицированные лизины образуют ковалентные сшивки, которые обеспечивают полимеризацию тропоколлагенов. Лизилоксидаза представляет собой внеклеточный фермент, и эта стадия сборки фибрилл происходит только после выхода проколлагена из клетки. После сборки фибриллы могут объединяться, образуя большие пучки или волокна, характерные для фибриллярного коллагена.
Принимая во внимание всю важность коллагена в обеспечении структурной поддержки тканей, можно представить, какие тяжелые последствия для организма будет иметь нарушение процесса сборки фибрилл. Мутации в генах, кодирующих синтез коллагенов или ферментов, модифицирующих проколлаген, вызывают развитие множества генетических заболеваний, затрагивающих практически все ткани. Например, коллаген типа I представляет собой основной структурный белок костной ткани. Мутации в коллагеновых генах этого типа служат причиной незавершения остеогенеза, т. н. развития «болезни хрупких костей».
Мутации в коллагеновом гене типа IV приводят к нарушению сборки базальной ламины в большинстве эпителиальных тканей и к развитию такого кожного заболевания, как буллезный эпидермоз.
Клетки связываются с коллагеном посредством специфических рецепторов, называемых интегринами. Эти рецепторы обеспечивают возможность обратимого связывания клеток с коллагенами по мере их движения по внеклеточному матриксу. Интегриновые рецепторы также активируют пути передачи сигналов, так что связывание с коллагенами (и с другими белками внеклеточного матрикса) изменяет активность в клетке биохимических процессов и, таким образом, способствует контролю над ростом и дифференцировкой клеток.
Схематическое строение тройной спиральной структуры коллагена (наверху),
организация витой структуры в фибрилле (в середине) и фибрилл в коллагеновом волокне (внизу).
Наличие 67-нм зазора между соседними спиральными структурами обусловливает видимую в электронном микроскопе исчерченность фибрилл, составляющих волокно. Посттрансляционная модификация и сборка субъединиц проколлагена в тройные спиральные структуры происходит при внутриклеточном перемещении по секреторному пути.
Однако сборка фибрилл происходит во внеклеточном пространстве после секреции тройных спиралей, обладающих витой структурой.
Для упрощения в тройных структурах не показаны гидроксильные группы и сахарные остатки. Лизилоксидаза катализирует ковалентное связывание двух боковых цепей лизина с образованием аллизинов (альдегидных производных лизина),
которые затем образуют между собой альдольную связь.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Связки - особенности строения
Связки обеспечивают статическую стабильность суставов и соединяют одну кость с другой. Связки и связочно-капсулярные структуры сустава состоят из плотной оформленной соединительной ткани. Связки содержат коллаген и эластин, количество которого изменяется. Коллаген придает связкам прочность при растяжении, а эластин — эластичность. Волокна коллагена расположены более или менее параллельно силам, действующим на связку.
Большинство связок и тканей капсулы проникают в вещество кости следующим образом: коллагеновые волокна входят в волокнистый хрящ, затем в кальцифицированный хрящ и затем, наконец, в кость. Некоторые связки (и сухожилия) сначала прикрепляются к надкостнице и лишь затем, к кости. Связки значительно лучше выдерживают постепенные нагрузки, чем резкие. Поэтому, резкие нагрузки могут вызвать внутрисвязочное повреждение, тогда как постепенное увеличение нагрузки приведет к повреждению в месте соединения связки с костью.
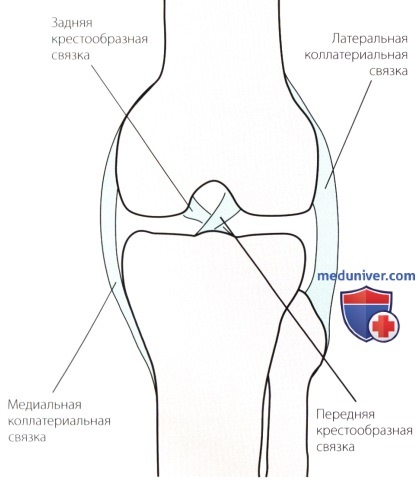
Связки коленного сустава. В связи со свойственной суставу подвижностью, для его стабилизации при движениях необходим развитый связочный аппарат.
Связки играют роль первичных стабилизаторов сустава, их функцию дополняют мышцы и другие соединительные ткани.
Эластин — белок, обеспечивающий эластичные свойства ткани связок. Некоторые связки, такие как крестообразные связки коленного сустава, почти не содержат эластина. Другие, такие как желтая связка спины, содержат эластин в большом количестве. Поскольку передняя крестообразная связка содержит больше коллагена, чем эластина, она способна выдерживать значительные нагрузки на растяжение, незначительно удлиняясь при этом.
Таким образом, передняя крестообразная связка стабилизирует коленный сустав. Напротив, желтая связка спины, состоящая в основном из эластина и содержащая лишь незначительное количество коллагена, может быть значительно растянута прежде, чем разорвется, но при этом выдерживает только слабые нагрузки.
Функцией связок является ограничение подвижности суставов и направление костей во время их движения. Поэтому связки обычно имеют двойную структуру, позволяющую стабилизировать сустав даже в крайнем положении. При среднем положении сустава натяжение связок минимальное. Синовиальная капсула сустава по своей сути является слабой связочной структурой. Разрыв связки может привести к значительной нестабильности сустава и увеличению фрикционной нагрузки на суставные поверхности.
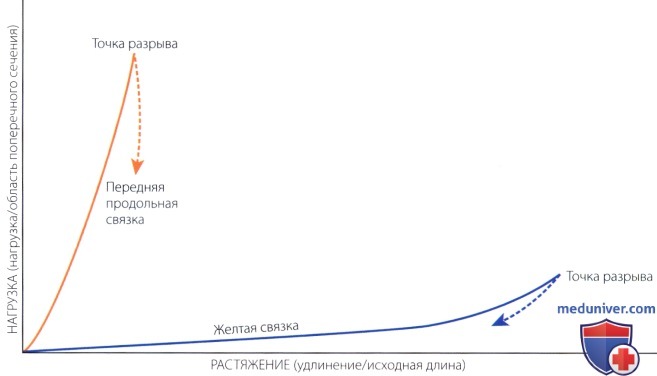
Влияние нагрузки и растяжения на переднюю продольную и желтую связки.
Передняя крестообразная связка, содержащая больше коллагена, чем эластина, может выдерживать большую нагрузку, но имеет небольшой запас растяжения до разрыва.
Желтая связка, содержащая больше эластина, нежели коллагена, не способна выдерживать большую нагрузку, однако имеет большой запас растяжения перед разрывом.
Как результат — быстрое развитие остеоартрита. И наоборот, нарушение нормальной способности капсулы к расслаблению при посттравматическом фиброзе приведет к значительному ограничению подвижности сустава (например, в случае посттравматического адгезивного капсулита плечевого сустава).
Связки кровоснабжаются очень бедно, и, как следствие, их заживление происходит медленно. Однако они хорошо иннервированы, что используется при определении степени повреждения связок. Когда структурная целостность связки полностью нарушена, возникает относительно слабая боль, так как поврежденная связка практически не растягивается. Это происходит потому, что через полностью разорванную связку не может передаваться никакая нагрузка. Однако при менее серьезном частичном разрыве нагрузка на связку вызывает острую и сильную боль.
Такая парадоксальная картина болевых ощущений, установленная в ходе физикального исследования при свежем повреждении связки (более слабая боль соответствует большему растяжению связок), может значительно облегчить постановку диагноза.

Тело человека состоит из триллионов разнообразных клеток. Наиболее важными клетками самого большого органа в теле человека – кожи, являются фибробласты. Их называют клетками молодости, так как именно активная работа фибробластов способствует поддержанию молодости и красоты кожи.
Фибробласты
Зародышевые клетки соединительной ткани организма. Они участвуют в процессах регенерации и синтеза белков, наиболее важных для омоложения клеток дермы.
В организме человека фибробласты могут находиться в двух формах: активные и неактивные. Активный фибробласт имеет большой размер, отростки, овальное ядро и много рибосом. Такая клетка может делиться и интенсивно вырабатывать коллаген. Неактивные фибробласты называются также фиброцитами. Они являются высокодифференцированными клетками, которые образовываются их фибробластов, не имеют способности к делению, но принимают активное участие в синтезе волокнистых структур и заживлении ран. Неактивные фибробласты имеют несколько меньший размер, чем активные, и отличаются веретенообразной формой.
Все активные фибробласты разделяются на несколько структурно-функциональных типов, каждый из которых выполняет определенные функции:
- малодифференцированные фибробласты обладают выраженными пролиферативными свойствами, то есть, они активно размножаются и растут;
- юные фибробласты – более дифференцированные клетки, которые также способны к пролиферации, но в отличие от малодифференцированных, могут синтезировать коллаген и кислые гликозаминогликаны;
- зрелые фибробласты образуются из юных форм, практически не могут размножаться, и разделяются на три подтипа:
- фиброкласты разрушают коллаген путем фагоцитоза и внутриклеточного лизиса;
- коллагенобласты синтезируют коллаген;
- монофибробласты играют роль в сокращении фиброзной ткани при заживлении ран.
Фибробласты располагаются в среднем слое кожи человека – в дерме. Там они вырабатывают внеклеточный матрикс, компоненты которого и формируют своеобразный каркас кожи. Основными компонентами внеклеточного матрикса являются гликопротеины, протеогликаны и гиалуроновая кислота. Широко известный коллаген является превалирующим гликопротеином внеклеточного матрикса. Кроме того, фибробласты продуцируют также белки фибрин, эластин, тинасцин, нидоген и ламинин, которые используются в качестве «строительного материала» для кожи.
Еще один продукт синтеза фибробластов – это факторы клеточного роста, к которым относятся:
- основной фактор, усиливающий рост всех клеток кожи;
- трансформирующий фактор, способствующий стимулированию выработки эластина и коллагена;
- эпидермальный фактор, ускоряющий деление клеток и перемещение кератиноцитов;
- фактор роста кератиноцитов.
Основные функции фибробластов:
- синтез коллагена, эластина, гиалуроновой кислоты и других компонентов внеклеточного матрикса;
- формирование сосудов;
- усиление процессов клеточного роста;
- ускорение разрастания тканей;
- заживление поврежденной кожи;
- направление клеток иммунной системы к бактериям и другим чужеродным агентам.
С возрастом в организме человека способности фибробластов в плане активного синтеза и пролиферации в тканях кожи снижаются, в результате чего происходит уменьшение содержания их главных компонентов — гиалуроновой кислоты, коллагена, эластина, сосудистой сети. Это отражается на внешнем виде кожного покрова.
Сегодня, благодаря успехам биотехнологии, появилась возможность естественным путем повлиять непосредственно на причину возрастного увядания кожных тканей. Этого удалось достигнуть способом обогащения ее собственными молодыми фибробластами, которые являются строителями внеклеточного матрикса.
Трансплантация в кожу лица собственных молодых клеток фибробластов способна эффективно и достаточно быстро активизировать процессы обновления и восстановления ее структуры. Аутологичные (свои) клетки не воспринимаются собственной иммунной системой как антиген (чужеродные) и, следовательно, организмом не отторгаются, а полноценно функционируют. Преимуществом клеточного омоложения является и то, что трансплантированные фибробласты долгое время (от полугода до полутора лет) сохраняют функциональную активность в части усиленного синтеза гиалуроновой кислоты, коллагена, эластина и других компонентов матриксной системы кожи. В течение этого срока постоянно продолжается улучшение ее состояния.
Такая методика аутотрансплантации фибробластов в косметологии получила официальное разрешение Росздравнадзора.
Читайте также:

