Какие гормоны вырабатываются эпителием кишечника
Обновлено: 27.04.2024
ГАСТРОИНТЕСТИНА́ЛЬНЫЕ ГОРМО́НЫ (от гастро. и лат. intestinum – кишка), группа гормонов пептидной природы, вырабатываемых в слизистой оболочке желудочно-кишечного тракта позвоночных животных и выделяемых в кровь. Участвуют в секреторной деятельности желудка и кишечника, действуют на тонус гладких мышц кишечника и кровеносных сосудов, регулируют моторику желудочно-кишечного тракта и выполняют др. физиологич. функции. Состоят из 17–43 аминокислотных остатков. К числу Г. г. относятся: гастрин , стимулирующий выделение соляной кислоты желудком; секретин , повышающий секрецию желудочного сока; мотилин , усиливающий двигательную активность желудка и кишечника, контролирующий выделение пепсина; холецистокинин , способствующий секреции пищеварительных ферментов поджелудочной железой; бомбезин , по биологич. активности сходный с холецистокинином. Кроме того, в желудочно-кишечном тракте вырабатываются: вазоактивный интестинальный полипептид (ВИП), расширяющий кровеносные сосуды и усиливающий секрецию воды и электролитов поджелудочной железой, желчевыделение; гастроингибирующий полипептид (ГИП), подавляющий секрецию кислоты в желудке; глюкагон – физиологич. антагонист инсулина и глюкагоноподобный пептид 1 (ГПП1), образующиеся из одного предшественника – проглюкагона в ходе его протеолиза. ГПП1, как и выделяемый клетками желудка пептид YY, действуя на соответствующие рецепторы в нейронах гипоталамуса, вызывает снижение аппетита, препятствуя развитию ожирения. Помимо этого, ГПП1 стимулирует секрецию поджелудочной железой инсулина, снижает секрецию глюкагона, регулируя тем самым углеводный обмен, а пептид YY повышает эффективность действия инсулина, препятствует развитию у взрослых людей сахарного диабета. Г. г. грелин , после связывания со своими рецепторами в гипофизе, стимулирует секрецию гормона роста, пролактина и адренокортикотропного гормона. В отличие от ГПП1 и пептида YY, грелин способствует повышению аппетита.
Гормоны кишечника и их функция
Кишечник — один из крупнейших эндокринных органов. Он секретирует многочисленные пептидные гормоны из специализированных эндокринных клеток, которые выступают в качестве химических сенсоров, реагирующих на состав и количество питательных веществ в просвете кишки. Во многих случаях пептидные гормоны функционируют как нейроэндокринные факторы, которые активируют нервы внутри и вне кишки. Эти нервы, в свою очередь, активируют секреторные и моторные рефлексы ЖКТ.
К гормонам кишечника, вовлеченным в процесс стимуляции трофического функционального ответа на минимальное энтеральное питание, относятся гастрин, ССК и пептид YY. Гастрин секретируется G-клетками антрального отдела желудка и в первую очередь стимулирует пролиферацию париетальных и энтерохромаффиноподобных клеток слизистой желудка.
Холецистокинин вырабатывается эндокринными клетками кишечника в нейронах кишки и головного мозга. Главными мишенями ССК служат ткани поджелудочной железы и желчного пузыря. ССК стимулирует рост поджелудочной железы и пролиферацию клеток. Эти трофические эффекты осуществляются исключительно через ССК-А-рецепторы. Новорожденные отличаются наличием гипергастринемии и сравнительно высоким рН желудка, однако секреция гастрина индуцируется питанием. Трофический эффект гастрина наиболее ярко проявляется в желудке и связан с повышенной активностью фермента орнитиндекарбоксилазы и клеточной пролиферацией.
Пептид YY секретируется энтероэндокринными L-клетками и стимулирует рост кишечника у развивающихся крыс.
Помимо влияния на рост гастроинтестинальных тканей, ССК и пептид YY в большей степени важны для созревания и развития моторной и секреторной функций ЖКТ, что имеет особое значение для недоношенных детей. ССК является одним из ключевых гормонов поджелудочной железы билиарного отдела. Холецистокинин изучали в качестве возможного препарата для лечения холестаза, вызванного полным парентеральным питанием, однако недавнее клиническое исследование показало неэффективность ССК.
Глюкагоноподобный пептид (GLP) 2 — кишечный пептид, которому уделяется значительное внимание как трофическому фактору кишечника. GLP-2, как и пептид YY, секретируется энтероэндокринными L-клетками в ответ на энтеральное питание, причем секреция его достигает высокого уровня на поздних сроках гестации.
GLP-2 оказывает значительный трофический эффект на тонкую кишку новорожденного посредством увеличения пролиферации клеток, синтеза белка, кровотока и транспорта глюкозы. Кроме того, GLP-2 увеличивает кровоток в верхней брыжеечной артерии без увеличения системного артериального давления и изменений мозгового кровотока у новорожденных поросят.
Предполагается, что его действие происходит только на локальном уровне. Лечение GLP-2 также показало уменьшение количества провоспалительных цитокинов и восстановление структуры кишечника у животных при вызванных GLP-2 воспалительных заболеваниях кишечника и энтерите. GLP-2 обладает терапевтическим потенциалом; был одобрен как препарат для лечения орфанного заболевания и показал улучшение функции кишечника у взрослых пациентов с синдромом короткой кишки.
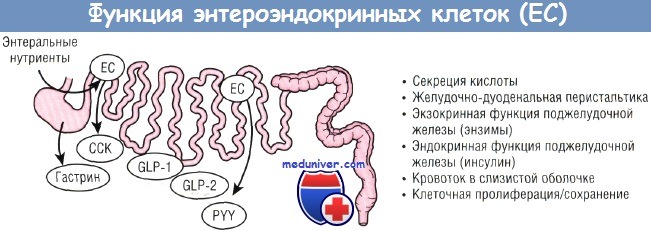
Роль энтероэндокринных клеток (ЕС) в качестве нутритивных сенсоров в ЖКТ новорожденных.
ССК — холецистокинин;
CLP — глюкагоноподобный пептид;
PYY — пептид YY
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гуморальная регуляция секреции пищеварительных соков и моторики желудка и кишечника. Гормональная регуляция пищеварительного тракта.
Центральные, периферические и местные рефлексы осуществляются в тесном взаимодействии с гуморальным механизмом регуляции миоцитов, гландулоцитов и нервных клеток.
В слизистой оболочке желудочно-кишечного тракта и в поджелудочной железе имеются эндокринные клетки, которые вырабатывают гастроинте-стинальные гормоны (регуляторные пептиды, энтерины). Эти гормоны через кровоток и местно (паракринно, диффундируя через межклеточную жидкость) оказывают влияние на миоциты, гландулоциты, интрамураль-ные нейроны и эндокринные клетки. Их выработка запускается рефлекторно (через блуждающий нерв) во время приема пищи и длительное время поддерживается за счет раздражающего влияния продуктов гидролиза пищевых веществ и экстрактивных веществ.
Таблица 11.1. Гормоны желудочно-кишечного тракта, место их образования и вызываемые ими эффекты
| Название гормона | Место выработки гормона | Типы эндокринных клеток | Эффект действия гормонов |
| Соматостатин | Желудок, проксимальный отдел тонкой кишки, поджелудочная железа | D-клетки | Тормозит выделение инсулина и глюкагона, большинства известных желудочно-кишечных гормонов (секретина, ГИПа, мотилина, гастрина); тормозит активность париетальных клеток желудка и ацинарных клеток поджелудочной железы |
| Вазоактивный интестинальный (ВИП) пептид | Во всех отделах желудочно-кишечного тракта | D-клетки | Тормозит действие холецистокинина, секрецию соляной кислоты и пепсина желудком, стимулированную гистамином, расслабляет гладкие мышцы кровеносных сосудов, желчного пузыря |
| Панкреатический полипептид (ПП) | Поджелудочная железа | D2-клетки | Антагонист ХЦК-ПЗ, усиливает пролиферацию слизистой оболочки тонкой кишки, поджелудочной железы и печени; участвует в регуляции обмена углеводов и липидов |
| Гастрин | Антральная часть желудка, поджелудочная железа, проксимальный отдел тонкой кишки | G-клетки | Стимулирует секрецию И выделение пепсина желудочными железами, возбуждает моторику расслабленного желудка и двенадцатиперстной кишки, а также желчного пузыря |
| Гастрон | Антральный отдел желудка | G- клетки | Снижает объем желудочной секреции и выход кислоты в желудочном соке |
| Бульбогастрон | Антральный отдел желудка | G- клетки | Тормозит секрецию и моторику желудка |
| Дуокринин | Антральный отдел желудка | G- клетки | Стимулирует выделение секрета бруннеровых желез двенадцатиперстной кишки |
| Бомбезин (гастринвысвобождающий пептид) | Желудок и проксимальный отдел тонкой кишки | Р-клетки | Стимулирует высвобождение гастрина, усиливает сокращение желчного пузыря и выделение ферментов поджелудочной железой, усиливает выделение энтероглюкагона |
| Секретин | Тонкий кишечник | S-клетки | Стимулирует секрецию бикарбонатов и воды поджелудочной железой, печенью, железами Бруннера, пепсина; тормозит секрецию в желудке |
| Холецистокинин-панкреозимин (ХЦК-ПЗ) | Тонкий кишечник | I-клетки | Возбуждает выход ферментов и в слабой степени стимулирует выход бикарбонатов поджелудочной железой, тормозит секрецию соляной кислоты в желудке, усиливает сокращение желчного пузыря и желчевыделение, усиливает моторику тонкой кишки |
| Энтероглюкагон | Тонкий кишечник | ЕС1-клетки | Тормозит секреторную активность желудка, снижает в желудочном соке содержание К+ и повышает содержание Са2+, тормозит моторику желудка и тонкой кишки |
| Мотилин | Проксимальный отдел тонкой кишки | ЕС2-клетки | Возбуждает секрецию пепсина желудком и секрецию поджелудочной железы, ускоряет эвакуацию содержимого желудка |
| Гастроингибирующий пептид (ГИП) | Тонкий кишечник | К-клетки | Тормозит выделение соляной кислоты и пепсина, высвобождение гастрина, моторику желудка, возбуждает секрецию толстой кишки |
| Нейротензин | Дистальный отдел тонкой кишки | N-клетки | Тормозит секрецию соляной кислоты железами желудка, усиливает высвобождение глюкагона |
| Энкефалины (эндорфины) | Проксимальный отдел тонкой кишки и поджелудочная железа | L-клетки | Тормозит секрецию ферментов поджелудочной железой, усиливает высвобождение гастрина, возбуждает моторику желудка |
| Субстанция Р | Тонкая кишка | ЕС1-клетки | Усиливает моторику кишечника, слюноотделение, тормозит высвобождение инсулина |
| Вилликинин | Двенадцатиперстная кишка | ЕС1-клетки | Стимулирует ритмические сокращения ворсинок тонкой кишки |
| Энтерогастрон | Двенадцатиперстная кишка | ЕС1-клетки | Тормозит секреторную активность и моторику желудка |
| Серотонин | Желудочно-кишечный тракт | ЕС1,ЕС2-клетки | Тормозит выделение соляной кислоты в желудке, стимулирует выделение пепсина, активирует секрецию поджелудочной железы, желчевыделение, кишечную секрецию |
| Гистамин | Желудочно-кишечный тракт | ЕС2-клетки | Стимулирует выделение секрета желудка и поджелудочной железы, расширяет кровеносные капилляры, оказывает активирующее влияние на моторику желудка и кишечника |
| Инсулин | Поджелудочная железа | Бета-клетки | Стимулирует транспорт веществ через клеточные мембраны, способствует утилизации глюкозы и образованию гликогена, тормозит липолиз, активирует липогенез, повышает интенсивность синтеза белка |
| Глюкагон | Поджелудочная железа | Альфа-клетки | Мобилизует углеводы, тормозит секрецию желудка и поджелудочной железы, тормозит моторику желудка и кишечника |
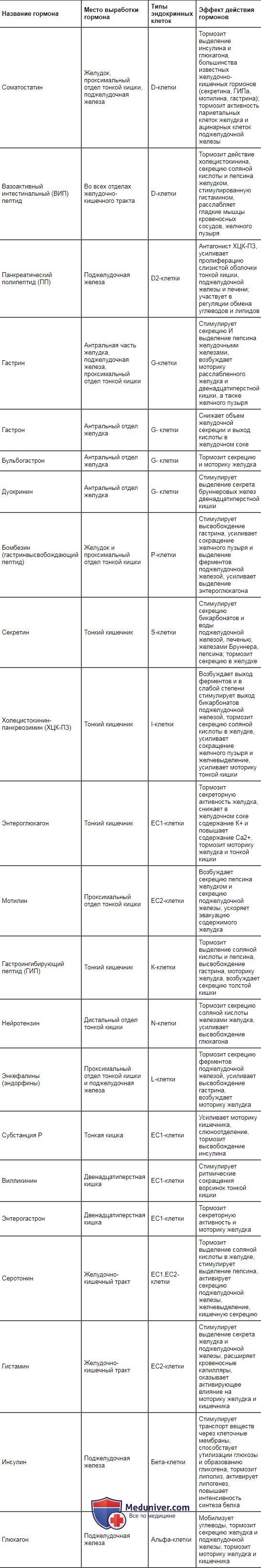
Место выработки основных гастроинтестинальных гормонов, вызываемые ими эффекты и продуцирующие их клетки представлены в табл. 11.1. В настоящее время обнаружено около 30 регуляторных пептидов. Как следует из представленной таблицы, они оказывают стимулирующее, тормозное и модулирующее влияние на секрецию пищеварительных соков, моторику гладкой мускулатуры желудочно-кишечного тракта, всасывание, выделение энтеринов эндокринными элементами слизистой оболочки желудка, кишечника и поджелудочной железы.
Выделение гастроинтестинальных гормонов имеет каскадный характер. Например, под влиянием гастрина обкладочные клетки желез желудка увеличивают выработку соляной кислоты, которая в слизистой оболочке тонкой кишки стимулирует выделение S- и J-клетками секретина и холеци-стокинна — панкреозимина. Секретин усиливает секрецию воды и бикарбонатов поджелудочной железой и печенью, а холецистокинин — панкреозимин — возбуждает выделение ферментов поджелудочной железой и тормозит секрецию соляной кислоты обкладочными клетками, усиливает моторику тонкой кишки и желчного пузыря.
Регуляторные пептиды, поступая в кровоток, быстро разрушаются в печени и почках и тем самым создают условия для осуществления эффектов других гастроинтестинальных гормонов.
Выработка некоторых энтеринов носит циклический характер и может осуществляться и при отсутствии пищевого раздражителя. Например, мо-тилин, вырабатываемый ЕС2-клетками проксимального отдела тонкой кишки, вызывает сокращения мышц желудка и кишечника, совпадающие с периодами «голодной» активности пищеварительного тракта.
Гастроинтестинальные гормоны и пептиды
Функция многих гастроинтестинальных пептидов как истинных гормонов ЖКТ такая же, как и нейропептидов для энтеральной нервной системы (ЭНС). И наоборот, ЭНС запускает выброс пептидов, ответственных как за переваривание нутриентов, так и за иммунный ответ.
Кишечник является самым большим гормонпродуцирующим органом человека как по числу клеток, так и по количеству произведенных гормонов. Первый гормон был идентифицирован более 100 лет назад, а к 1970 г. были обнаружены только три гормона: секретин, гастрин и холецистокинин. С тех пор идентифицированы более 100 биологически активных пептидов и обнаружено, что энтероэндокринные клетки составляют 1% всех эпителиальных клеток кишечника.
Зрелые энтероэндокринные клетки имеют малую продолжительность жизни, но их количество непрерывно пополняется. Стволовые клетки дают начало абсорбирующим или секреторным клеткам (бокаловидным, энтероэндокринным и клеткам Панета) в зависимости от факторов транскрипции и сигнального пути Notch.
Клетки, которые показывают высокие уровни Notch и которые индуцируют фактор транскрипции Hes-1 и подавляют Mathl, становятся абсорбирующими, в то время как клетки с низкими уровнями Notch становятся секреторными. Также важны другие компоненты сигнального пути (включая факторы транскрипции ngn3 и BETA2/NeruoD, bHLH). Мыши, имеющие дефицит фактора ngn3, не могут сформировать какие-либо эндокринные клетки кишечника.
Гены Pax, которые присутствуют на протяжении всего кишечника, также регулируют дифференцировку энтероэндокринных клеток. У мышей, имеющих дефицит гена Рах4, отмечается значительное сокращение количества клеток, синтезирующих соматостатин и серотонин, но есть нормальное число клеток, синтезирующих гастрин, тогда как у мышей, имеющих дефицит гена Рах6, значительно сокращено количество клеток, синтезирующих соматостатин и гастрин, но нормальное количество клеток, синтезирующих серотонин.
В настоящее время известно, что многие гастроинтестинальные пептиды не могут функционировать как истинные гормоны. Вместо этого многие гастроинтестинальные пептиды выполняют паракринную или нейрокринную функцию, а некоторые функционируют как факторы роста. Как показал Walsh, истинный гормон должен иметь следующие особенности:
(1) поступать в кровь при наличии биологического стимула и запускать физиологический ответ в органе-мишени;
(2) связываться с распознающим его рецептором;
(3) иметь известную и искусственно воспроизводимую химическую структуру;
(4) при поступлении искусственно синтезированного пептида в плазму он должен оказывать действие на орган-мишень;
(5) физиологический ответ органа-мишени может быть заблокирован, если пептид из крови удален или если заблокирован таргетный рецептор.
Семейства гастроинтестинальных пептидов
1. Гастрин:
Гастрин
Холецистокинин
Секретин
2. Секретин:
Глюкагон и глюкагоноподобные пептиды
Желудочный ингибиторный полипептид
Вазоактивный интестинальный полипептид
Пептид гистидин изолейцин
Рилизинг-фактор гормона роста
Гипофизарный пептид, активирующий аденилатциклазу
3. Инсулин:
Инсулиноподобный фактор роста I
Инсулиноподобный фактор роста II
Релаксин
4. Соматостатин:
Соматостатин
Кортикостатин
5. Панкреатический полипептид:
Панкреатический полипептид
Пептид YY
Нейропептид
6. Тахикинин:
Субстанция Р
Нейрокинин А
Нейрокинин В
7. Эпидермальный фактор роста:
Эпидермальный фактор роста
Трансформирующий фактор роста
Амфирегулин
8. Грелин:
Грелин
Мотилин

Ген холецистокинина (ССК) кодирует пропептиды, которые обрабатывают до шести ССК-пептидов длиной от 8 до 83 аминокислотных остатков через дифференцированные эндопротеолитические расщепления. Все шесть пептидов имеют те же С-концевые последовательности биоактивного октапептида. Ген глюкагона кодирует препропептид, который через клеточно-специфическое эндопротеолитическое расщепление вырабатывает настоящий глюкагон поджелудочной железы (в клетках островков поджелудочной железы) или глюкагоноподобные пептиды 1 и 2 (CLP-1, CLP-2)
Гастрин — пример классического гормона, который выделяется G-клетками, когда белок поступает в ЖКТ. Когда гастрин выделяется, происходит запуск париетальных клеток, которые продуцируют кислоту.
Меньше 10 кишечных пептидов признаны истинными гормонами. Другие выполняют паракринную или нейрокринную функцию. Пептиды с паракринной функцией имеют паракринные клетки и направляются к таргетным рецепторам. Примером пептида с паракринной функцией является вазоактивный интестинальный пептид (ВИП). Пептиды с нейрокринной функцией высвобождаются нервными окончаниями.
Примером пептида, у которого есть нейрокринная функция, является субстанция Р, найденная в нервных окончаниях кишечных нервов. Факторы роста — это пептиды, которые оказывают трофические эффекты.
Примером может служить эпидермальный фактор роста, стимулирующий рост слизистой оболочки верхних отделов тонкой кишки.
Часть гормонов и пептидов выполняют только одну функцию (например, фактор роста), другие пептиды действуют в нескольких областях. Например, гастрин-рилизинг-пептид, который проявляет себя и как истинный гормон, и как нейропептид. Некоторые пептиды могут действовать как гормоны и оказывать трофические эффекты, как в случае гастрина. Кроме того, определенные нервные окончания могут продуцировать отдельные нейропептиды.
Интересно, что некоторые из этих пептидов также найдены в тканях вне ЖКТ (нейротензин и соматостатин). Очевидно, эта недавно признанная комплексность функции кишечных пептидов оказала влияние на классификацию гастроинтестинальных гормонов и пептидов, которая в настоящее время стала более сложной, чем ранее. Эволюция клеточной и молекулярной биологии заставила ученых пересмотреть свое понимание гастроинтестинальных пептидов, как это предложено Rehfeld.
До недавнего времени пептиды кишечника классифицировали по принципу структурного подобия. Пока использовали этот классический метод, приблизительно 50% пептидов классифицировали согласно последовательности аминокислот как членов восьми семейств. Считается, что все пептиды в семействе, произошли от одного предшественника и в ходе эволюции сохранили свою определенную тканевую специфичность.
Пептиды семейства секретина (например, секретин, глюкагон и ВИП) обнаружены в кишечнике, как и рилизинг-фактор гормона роста и гипофизарный пептид, активирующий аденилатциклазу.
Тот факт, что многие из недавно идентифицированных гормонов и пептидов не являются членами этих восьми семейств, ограничивает использование принципа структурного подобия для их классификации. В дополнение было показано, что гены гормонов могут иметь многочисленные фенотипы. Ранее считалось, что один ген кодирует один гормон, но теперь известно, что один ген может определять несколько биологически активных пептидов.
Это может происходить несколькими путями: путем последовательного соединения транскриптов (транскрипция гена кальцитонина может генерировать РНКазы, кодирующие пептиды кальцитонина, CGRP), выработки прогормонов в продукты пептидов, отличающихся по длине и являющихся биологически активными (I-клетка секретирует прохолецистокинин, который образует гетерогенную смесь продуктов холецистокинина (ССК)), или кодирования пропептидов, содержащих разные, но подобные гормоны (проглюкагон, который в соответствующих тканях может преобразовываться в истинный глюкагон или в клетках панкреатических островков преобразовываться в глюкагоноподобные пептиды 1 и 2).
Большое количество гастроинтестинальных пептидов широко экспрессируются вне тонкой кишки. Ген гастрина, например, экспрессируется в антродуоденальных G-клетках, в поджелудочной железе плода и новорожденного, кортикотрофах и меланотрофах гипофиза и сперматогенных клетках человека. Наконец, продукция пептида зависит от клеточно-специфического прогормонального процесса и клеточно-специфического процесса выделения пептида. Описание этих процессов в данной статье не приводится.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В статье рассматриваются механизмы влияния некоторых нейрогуморальных веществ на моторику желудочно-кишечного тракта, в том числе на кишечные сокращения. Основная часть работы посвящена роли серотонина на двигательную активность пищеварительной трубки. Пр
Mechanisms of the effect of some neurohumoral agents on alimentary canal motor activity including intestinal abridgement are discussed in the article. Major part of the work is dedicated to serotonin effect on motor activity of digestive tube. The authors also provide comparative analysis of serotonergic preparations that affects motor activity of esophagus, stomach and bowels. Clinical manifestations of deficit and excess of serotonin and the ways of its corrections are described.
Основными классами рецепторов, участвующих в регуляции моторно-эвакуаторной функции желудочно-кишечного тракта (ЖКТ), являются холинергические, адренергические, допаминергические, серотониновые, мотилиновые и холецистокининовые. Препараты, применяемые при депрессивных и тревожных расстройствах, панических атаках и других вегетативных дисфункциях, действуют на те же рецепторы, которые отвечают за моторно-эвакуаторную функцию желудочно-кишечной трубки. Регулирование деятельности гладкой мускулатуры и подвижности кишечника происходит на нескольких уровнях. Гормоны и нейротрансмиттеры являются доминирующими компонентами, которые прямо или косвенно воздействуют на гладкомышечные клетки. Постпрандиальный эндокринный ответ включает в себя выработку инсулина, нейротензина, холецистокинина (ХХК), гастрина, глюкагоноподобных пептидов (ГПП-1 и ГПП-2), глюкозозависимый инсулинотропный полипептид (ГИП, ранее известный как желудочный ингибиторный пептид) [1], данные об эффектах нейромедиаторов и гормонов представлены в табл. 1. Например, ХХК выделяется в проксимальных отделах тонкой кишки и непосредственно влияет на сокращение мышечных клеток желчного пузыря и нейромедиированную релаксацию мышц клеток сфинктера Одди, которая опосредуется через ГИП нервно-мышечные соединения.
В настоящей статье особое внимание уделено серотонинергическим рецепторам, которые являются одними из важных регуляторов кишечной перистальтики. Серотонин, или 5-гидрокситриптамин (5-HT), — моноаминовый нейромедиатор, который является главным посредником в физиологии психологического состояния и настроения человека, а также одним из регуляторов функции сосудов и желудочно-кишечной моторики. 5-HT, как известно, представлен в тромбоцитах, ЖКТ и центральной нервной системе человека и животных [2–5]. Серотонин вырабатывается в организме человека из поступившей с пищей аминокислоты триптофана — так как именно она нужна для непосредственного синтеза серотонина в синапсах; второй путь выработки серотонина связан с поступлением глюкозы с углеводной пищей, которая стимулирует выброс инсулина в кровь, далее происходит катаболизм белка в тканях, что также приводит к повышению уровня триптофана в крови.
На основе биохимических и фармакологических критериев 5-HT-рецепторы подразделяются на семь основных подтипов, пять из которых находятся в кишечных нейронах, энтерохромаффинных (ЭХ) клетках и в гладкой мускулатуре ЖКТ — это 5-HT1, 5-HT2, 5-HT3, 5-НТ4 и 5-HT7 [6, 7]. Около 80% от общего количества 5-НТ-рецепторов находятся в ЭХ-клетках кишечника, где они принимают участие в кишечной перистальтике через несколько подтипов 5-HT-рецепторов [8, 9]. За исключением 5-HT3-рецепторов, лиганда закрытого ионного канала, все 5-HT-рецепторы связываются с рецепторами G-белка, которые активируют внутриклеточные реакции второго каскада, стимулируя возбуждающие или тормозные реакции в ЖКТ [10]. Серотонин обладает хорошо изученным воздействием на кишечную моторику, секрецию и сенситивность через центральные и периферические нейромедиаторные пути, что делает его ключевым фармакологическим средством, применяемым в лечении моторных нарушений ЖКТ [11]. Серотонин высвобождается из ЭХ-клеток в ответ на химическое или механическое раздражение слизистой оболочки [12] или в ответ при экспериментальных моделях стресса [13]. Серотонин синтезируется и хранится не только в ЭХ-клетках (90%), но и в нейронах кишечника (10%). Как говорилось выше, 5-HT выделяется в кровь после приема пищи и в ответ на изменения давления в кишечной стенке, а также при воздействии вредных раздражителей [13], а затем поступает в просвет кишечника и далее в его стенки из базолатерального депо ЭХ-клеток [14]. 5-HT стимулирует круговые и продольные мышцы желудка, двенадцатиперстной кишки и тощей кишки [15]. Важно стратегическое расположение ЭХ-клеток в непосредственной близости от сенсорных нервных окончаний слизистой оболочки кишечника, интерганглионарных нейронов и синапсов двигательных возбуждающих и тормозных нейронов. Серотонин увеличивает сокращение амплитуды мышц желудка, двенадцатиперстной кишки, тощей кишки и подвздошной кишки [16]. В тонкой кишке 5-HT стимулируют круговые сокращения мышц в течение первой манометрической фазы, вызываемые сокращения распространяются, становятся более частыми и активируют быстрые моторные комплексы [17]. В толстой кишке серотонин стимулирует подвижность на протяжении всей длины, вызывая фазовые сокращения, но не гигантские двигательные комплексы [18]. Кишечные гладкомышечные ритмические колебания определяются спонтанной активностью интерстициальных клеток Кахаля, которые работают как кардиостимулятор для клеток в ЖКТ [19–22]. Кишечная нервная система (КНС) состоит из полуавтономных эффекторных систем, которые связаны с центральной вегетативной системой. При освобождении серотонина из энтерохромаффинных клеток происходит инициация вагусных рефлексов — перистальтических, выделительных, сосудорасширяющих, ноцицептивных. Парасимпатический и симпатический отделы вегетативной нервной системы образуют КНС через афферентные и эфферентные связи. Текущие двунаправленные отношения рефлекторной дуги «мозг–кишка» с участием 5-HT оказывают существенное влияние на эффекторные системы. Нарушенная 5-HT-трансмиссия может привести к возникновению как кишечных, так и внекишечных проявлений синдрома раздраженного кишечника (СРК) [23].
Степень участия в функциональной перистальтической активности ЖКТ различных 5-HT подразделяется следующим образом — 5-HT3 — 65%, 5-НТ4 — 85% и 5-HT7 — 40%. В сочетании антагонисты этих рецепторов, приведенные в парах, способны уменьшить перистальтическую активность кишечника примерно на 16% (5-HT3 + 5-HT4), на 70% (5-HT3 + 5-HT7) и на 87% (5-HT4 + 5-HT7), а одновременное введение всех трех антагонистов неизбежно блокирует всю перистальтическую активности. Таким образом, 5-HT-рецепторы играют ключевую роль в модуляции кишечной перистальтики с одновременной блокадой трех рецепторов и подавляют перистальтическую активность. Среди 5-HT-рецепторов ЖКТ подтип 5-HT4 наиболее функционально важен для перистальтики, а 5-HT3- и 5-HT7-рецепторы играют несколько менее активную роль в этом процессе, что отражено в табл. 2 и на рис. 1 [24].
5-HT4-агонисты были доступны с введением в клиническую практику метоклопрамида в 1964 г. Этот препарат является антагонистом дофаминовых D2- и 5-HT3-рецепторов, а также агонистом 5-HT4-рецепторов и до сих пор широко используется во всем мира. Его успех привел к разработке альтернативных молекул, которые не влияют на D2-рецепторы, устраняя тем самым такие неблагоприятные события, как акатизия и экстрапирамидные двигательные расстройства.
Серотониновые рецепторы, в частности, 5-HT3 и 5-НТ4, участвуют в сенсорных и рефлекторных реакциях на раздражители при гастроинтестинальных расстройствах, обусловливая такие проявления, как рвота, запор или диарея, нарушения пищевого поведения, боли в животе, измененные сенсомоторные рефлексы [25]. Было высказано предположение, что селективные ингибиторы обратного захвата серотонина (СИОЗС) могут влиять на функцию 5-HT3-рецепторов, а также могут улучшить симптоматику СРК и сопутствующей депрессии у пациентов. Согласно ряду исследований и обзоров [26–29], трициклические антидепрессанты (амитриптилин, Мелипрамин), антидепрессанты ряда СИОЗС, такие как флуоксетин, пароксетин, циталопрам, кломипрамин, литоксетин, тразодон, и ряда селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСиН) (дулоксетин) улучшают симптомы СРК. Долгосрочные побочные эффекты данной терапии являются общими для лечения антидепрессантами и связаны с антихолинергическим, серотонинергическим, седативным, антигистаминым и альфа-адренергическим эффектами. Эти эффекты необходимо учитывать при выборе подхода к лечению, поскольку описанные выше препараты влияют на моторику кишечника, функция кишечника пациента также должна учитываться при выборе серотонинергических препаратов (рис. 2) [30].
Как указывалось ранее, 5-HT1-, 5-HT3- и 5-НТ4-подтипы рецепторов играют важную роль в двигательных, чувствительных и секреторных функциях ЖКТ. Препараты, непосредственно влияющие на 5-HT-рецепторы, в отличие от трициклических антидепрессантов и СИОЗС, модулируют 5-гидрокситриптамин (5-HT) путем связывания с 5-HT-рецепторами, их характеристики отражены в табл. 3. Кишечные функции 5-HT-рецепторов связаны с гладкими мышцами, увеличением количества дефекаций, а также со снижением кишечного транзитного времени [31, 32]. Блокада 5-НТ3-рецепторов, в частности противорвотными средствами типа ондансетрона, приводит к запорам [33]. В течение последнего десятилетия были разработаны и испытаны блокаторы 5-НТ3-рецепторов — алосетрон и силансетрон при СРК-Д (СРК с диареей). Недавний систематический обзор и метаанализ 11 рандомизированных контролируемых исследований (РКИ) сравнения этих двух 5-НТ3-антагонистов с плацебо выявили положительный эффект препаратов [34]. Тем не менее, ряд редких побочных эффектов, включая ишемический колит и тяжелые запоры, привел к тому, что производство алосетрона и исследования по силансетрону были приостановлены [35]. Алосетрон сегодня доступен только по строгим показаниям (в США) для пациенток с тяжелым резистентным СРК с диареей, которые не ответили на первую или вторую линии терапии.
5-HT4-агонисты доказали свой терапевтический потенциал для лечения больных с нарушениями моторики ЖКТ. Препараты, у которых отсутствует селективность к 5-HT4-рецепторам, имеют ограниченный клинический успех в гастроэнтерологической практике. Например, наряду со сродством к 5-HT4-рецепторам, такие препараты, как цизаприд и тегасерод, имеют заметное сродство и к другим рецепторам, каналам или белкам-трансмиттерам. Неблагоприятные кардиоваскулярные события, наблюдаемые при применении этих средств, связаны с их неселективностью и перекрестными эффектами. Систематический обзор и метаанализ показали, что тегасерод превосходит плацебо при лечении запоров, в том числе и при СРК. Большинство исследований, относящихся к тегасероду, проводились с участием женщин, и в результате препарат первоначально был одобрен для лечения СРК-З (СРК с запором) только у женщин. Тем не менее, маркетинг тегасерода был также приостановлен, когда стали сообщаться данные о возможном росте сердечно-сосудистых и цереброваскулярных событий на фоне приема препарата [6].
Важным событием в клинической фармакологии стало открытие селективного лиганда (лиганд, от лат. ligare — связывать, атом, ион или молекула, связанные с неким центром (акцептором), термин применяется в биохимии для обозначения агентов, соединяющихся с биологическими акцепторами — рецепторами, иммуноглобулинами и др.) к 5-HT4-рецептору — прукалоприда (prucalopride). Избирательность этого нового препарата значительно отличает его от старших поколений альтернативных препаратов благодаря сведению к минимуму возможностей побочных эффектов. Кроме того, концепция поиска аналогичных лигандов открывает широкие возможности для дальнейшей разработки лекарственных препаратов и создания агонист-специфических эффектов в различных типах клеток, тканей или органов. Селективный агонист 5-HT4-рецепторов прукалоприд является инновационным препаратом с привлекательным профилем безопасности для лечения пациентов, страдающих гипомоторными расстройствами ЖКТ [36]. Прукалоприд имеет высокое сродство и избирательность к 5-HT4-рецепторам ЖКТ. За время существования препарата прукалоприд было проведено несколько крупных и долгосрочных исследований, которые позволили в полной мере оценить риски и преимущества использования прукалоприда при хронических запорах [36–38]. В целом прием прукалоприда был связан с последовательным и значительным улучшением удовлетворенности пациентов в их лечении, по оценке опросника качества жизни при запорах (Patient Assessment of Constipation Quality of Life questionnaire — PAC-QOL). Доля участников, получавших прукалоприд в дозе 2 мг в сутки, которые отметили улучшение ≥ 1 пункт по 5-балльной подшкале PAC-QOL, составила 45,3%, по сравнению с 21,3% среди тех больных, кто получал плацебо (р ≤ 0,001), но число ответчиков почти во всех исследованиях было менее 50%. В ходе других испытаний — PRU-США-11 и PRU-США-13 — не было выявлено никакого существенного различия между прукалопридом и плацебо во всех суррогатных точках. Общая частота нежелательных явлений была статистически достоверно чаще у пациентов, получавших прукалоприд (72%), по сравнению с пациентами, принимавшими плацебо (59%) (отношение рисков (ОР) 1,21, 95% доверительный интервал (ДИ): 1,06, 1,38). Неблагоприятные события, которые наиболее часто сообщали пациенты, получавшие прукалоприд, были головная боль (до 30%), тошнота (до 24%), диарея (до 5%), боли в животе и метеоризм (до 23%), головокружение (до 5%) и инфекции верхних дыхательных путей [39]. R. Cinca и соавт. сравнили эффективность, безопасность и влияние на качество жизни макрогола и прукалоприда у 240 женщин с хроническими запорами, которым другие слабительные не обеспечивали адекватную помощь. В этом исследовании макрогол оказался более эффективным для лечения хронического запора, чем прукалоприд, и лучше переносился [40]. В итоге можно сделать вывод, что прукалоприд может назначать врач, имеющий опыт в лечении хронических запоров, женщинам от 18 до 75 лет в том случае, если в их лечении не были эффективны другие слабительные средства.
Важно знать, что не всегда у пациентов бывает дефицит серотонина, в ряде случаев врач может сталкиваться с его избытком. У беспокойных гастроэнтерологических пациентов, которые имеют повышенное содержание серотонина, развивается аэрофагия, что вызывает увеличение воздушного пузыря в желудке и приводит к раздражению рецепторного аппарата [41]. Повышенный уровень серотонина обуславливает частую тошноту и рвоту вследствие активации блуждающего нерва, диарею или спастический запор, гастроинтестинальные панические атаки, головную боль, тремор, гипергидроз, волнение и тревогу, сердцебиение, нестабильное артериальное давление, бессонницу.
Серотонин играет важную роль не только в регуляции моторики и секреции в ЖКТ, усиливая его перистальтику и секреторную активность, но и является фактором роста для некоторых видов симбиотических микроорганизмов, усиливает бактериальный метаболизм в толстой кишке. Сами бактерии толстой кишки также вносят некоторый вклад в секрецию серотонина кишечником, поскольку многие виды симбиотических бактерий обладают способностью декарбоксилировать триптофан. При дисбиозе и ряде других заболеваний толстой кишки продукция серотонина кишечником значительно снижается. Массивное высвобождение серотонина из погибающих клеток слизистой желудка и кишечника при воздействии цитотоксических химиопрепаратов является одной из причин возникновения тошноты и рвоты, а также диареи при химиотерапии злокачественных опухолей [42, 43].
Трудно переоценить роль серотонина в организме человека. В передней части мозга под воздействием серотонина стимулируются области, ответственные за процесс познавательной активности, а повышение серотонинергической активности создает в коре головного мозга ощущение подъема настроения. Поступающий в спинной мозг серотонин положительно влияет на двигательную активность и тонус мышц, это состояние можно охарактеризовать фразой «горы сверну». Кроме настроения, серотонин «отвечает» за самообладание или эмоциональную устойчивость. Серотонин контролирует восприимчивость мозговых рецепторов к стрессовым гормонам адреналину и норадреналину. У людей с пониженным уровнем серотонина малейшие поводы вызывают обильную стрессовую реакцию. Отдельные исследователи считают, что доминирование особи в социальной иерархии обусловлено именно высоким уровнем серотонина [42, 43].
Заключение
Когда в организм поступает пища, в том числе содержащая триптофан, увеличивается выработка серотонина, что повышает настроение. Мозг быстро улавливает связь между этими явлениями и, в случае депрессии (серотонинового голодания), незамедлительно «требует» дополнительного поступления пищи с триптофаном или глюкозой. Наиболее богаты триптофаном продукты, которые почти целиком состоят из углеводов, например, хлеб, бананы, шоколад, инжир, курага, финики, изюм, арбузы и т. п. Перечисленные продукты давно известны и как регуляторы кишечной перистальтики. Их дефицит в питании приводит к депрессиям и проблемам ЖКТ, что можно часто наблюдать у людей, соблюдающих строгую низкокалорийную диету. По этой причине прежде чем назначать пациенту лекарственные препараты, повышающие уровень серотонина, необходимо уточнить причину его дефицита. Знание о деталях строения серотониновых рецепторов, несомненно, найдет применение в лечении пациентов некардиотоксичными аналогами серотонина или препаратами, повышающими уровень серотонина, которые будут выполнять свою целебную функцию и окажутся приятны во всех отношениях, например, такие как шоколад [44]. Препараты, повышающие уровень серотонина в синаптической щели и способствующие усилению его эффектов, относятся к группе антидепрессантов. Сегодня они являются одними из самых назначаемых лекарств врачами общей медицинской практики многих стран мира, в том числе Европы и Северной Америки. Своевременное назначение антидепрессантов как в монотерапии, так и в схемах лечения различных заболеваний, позволяет повысить эффективность лечения основного заболевания и улучшить качество жизни пациентов, особенно у пациентов гастроэнтерологического профиля.
Литература
Е. Ю. Плотникова 1 , доктор медицинских наук, профессор
О. А. Краснов, доктор медицинских наук, профессор
Читайте также:

