Как рассосать рубец в пищеводе
Обновлено: 25.04.2024
Рекомендовано
Экспертным советом
РГП на ПХВ «Республиканский центр
развития здравоохранения»
Министерства здравоохранения
и социального развития
Республики Казахстан
от «10» декабря 2015 года
Протокол № 19
Название протокола: Послеожоговые рубцовые стриктуры пищевода
Послеожоговые рубцовые стриктуры пищевода– это сужения просвета пищевода различной протяженности и на разных его уровнях за счет разрастания и созревания рубцовой ткани в стенке пищевода вследствие воздействия экзогенных факторов, сопровождающиеся его деформацией.
Код протокола:
Код(ы) МКБ-10:
T28.6 –Химический ожог пищевода
К22.2 –Непроходимость пищевода
Сокращения, используемые в протоколе:
АД – артериальное давление
АЛТ – аланинаминотрансфераза
АСТ – аспаратаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВИЧ – вирус иммунодефицита человека
ЖЕЛ – жизненная емкость легких
ЖКТ – желудочно-кишечный тракт
ИВЛ – искусственная вентиляция легких
ИФА – иммуноферментный анализ
КТ – компьютерная томография
МНО – международное нормализованное отношение
ОАК – общий анализ крови
ОАМ – общий анализ мочи
СОЭ – скорость оседания эритроцитов
УЗИ – ультразвуковое исследование
ФБС – фибробронхоскопия
ФЭГДС – фиброэзофагогастродуоденоскопия
ЭКГ – электрокардиограмма
КЩС – кислотно-щелочное состояние
ММВ – максимальная минутная вентиляция
МОД – минутный объем дыхания
ОГК – органы грудной клетки
СКФ – скорость клубочковой фильтрации
Дата разработки протокола: 2015 год.
Категория пациентов: взрослые.
Пользователи протокола: хирурги, терапевты, токсикологи, врачи общей практики, врачи скорой медицинской помощи, эндоскописты

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Клиническая классификация
По причине отравления:
· случайные;
· преднамеренные (суицидальные).
По степени тяжести:
· лёгкой степени;
· средней степени;
· тяжёлой степени.
По характеру местного химического поражения:
· ожоги с коагуляционным некрозом (кислоты);
· ожоги с колликвационным некрозом (щелочи).
Рубцовые стриктуры пищевода могут быть:
· одиночными и множественными;
· полными (проходимость пищевода отсутствует) и неполными (сохраняется некоторый просвет пищевода),
· высокими (глоточные, шейные, бифуркационные) и низкими (эпифренальные и абдоминальной части пищевода), расположенными по оси пищевода или эксцентрично.
По протяженности различают:
· пленчатые стриктуры, представляющие собой тонкие мембраны шириной до 0,5 см;
· кольцевидные протяженностью 2-3 см и трубчатые длиной более 3 см.
Клиническая картина
Cимптомы, течение
Диагностические критерии:
Жалобы и анамнез.
Жалобы: тошнота, рвота (при кровотечениях - с кровью); мучительные боли в горле, по ходу пищевода, эпигастрии; общая слабость, головокружение; затрудненное дыхание.
Анамнез: ожог пищевода.
Физикальное обследование: при физикальном обследовании:
· отек и набухание слизистой ротовой полости, зева, гортани; рыхлая слизистая;
· пораженная поверхность - студневидная, со стекловидным оттенком;
· резкой границы с неповрежденными тканями нет;
· кровавые рвотные массы;
· болезненность в эпигастрии при пальпации;
· аускультативно в легких, возможно, ослабленное дыхание;
· сухие и влажные хрипы;
· тахикардия;
· болевой шок.
Диагностика
Перечень основных и дополнительных диагностических мероприятий:
Основные (обязательные) диагностические обследования, проводимые на амбулаторном уровне:
· ОАК;
· биохимический анализ крови (общий белок, мочевина, креатинин, билирубин, АЛТ, АСТ, глюкоза);
· контрастная рентгенография (рентгеноскопия) пищевода и желудка с барием (в положении стоя) (УД-В);
· эндоскопическая эзофагогастроскопия (ФЭГДС);
· рентгенография органов грудной клетки;
· УЗИ брюшной полости (УД-В);
· ФБС.
Дополнительные диагностические обследования, проводимые на амбулаторном уровне, при наличии показаний:
· УЗИ органов брюшной полости (печень, желчный пузырь, поджелудочная железа, селезенка, почки);
· ЭКГ для исключения сердечной патологии;
· обзорная рентгенография органов грудной клетки;
· компьютерная томография органов грудной клетки и органов брюшной полости (УД – В);
· спирография.
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: согласно внутреннему регламенту стационара с учетом действующего приказа уполномоченного органа в области здравоохранения.
Основные (обязательные) диагностические обследования, проводимые на стационарном уровне (при экстренной госпитализации проводятся диагностические обследования, не проведенные на амбулаторном уровне):
· ОАК;
· ОАМ (исключение патологии со стороны мочевыделительной системы);
· биохимический анализ крови: глюкоза, альбумин, электролиты;
· коагулология (ПТИ, фибриноген, время свертываемости, МНО);
· определение группы крови по системе АВ0;
· определение резус фактора крови;
· анализ крови на ВИЧ;
· анализ крови на сифилис;
· определение HBsAgв сыворотке крови методом ИФА;
· определение суммарных антител к вирусу гепатита С (HCV) в сыворотке крови методом ИФА;
· УЗИ органов брюшной полости (УД-В);
· рентгенография органов грудной клетки;
· контрастная рентгенография пищевода и желудка (УД-В).
Дополнительные диагностические обследования, проводимые на стационарном уровне (при экстренной госпитализации проводятся диагностические обследования не проведенные на амбулаторном уровне):
· ЭКГ для исключения сердечной патологии.
Инструментальные исследования:
При фиброэзофагоскопии уточняют уровень и расположение устья сужения пищевода; определяют диаметр сужения; состояние слизистой оболочки в супрастенотическом расширении и степень вовлечения ее в воспалительный процесс.
При рентгенологическом исследовании с использованием контрастных препаратов выявляется локализация и протяженность сужения просвета, оценка состояния стенки пораженного пищевода и определение патологии со стороны желудка.
При подозрении на перфорацию органа и при изучении состояния внутри - и внеполостного пищеводного анастомоза в раннем послеоперационном периоде контрастирование пищевода проводится с помощью водорастворимых веществ.
При рентгеноскопии пищевода с использованием контрастной массы удается установить степень нарушения акта глотания, уровень сужений пищевода, их количество и протяженность, расположение устья стеноза (центральное или эксцентрическое), состояние супрастенотического отдела, наличие «слепых карманов» в пищеводе и «ложных» каналов, формирующихся во время бужирования рубцовой стриктуры, форму и протяженность суженного участка.
При ожоговых стриктурах пищевода контуры сужения просвета обычно ровные.
Показания для консультации специалистов:
· консультация кардиолога: для коррекции стойкой АГ, хронической сердечной недостаточности, нарушения ритма сердечной деятельности.
· консультация анестезиолога: при необходимости подготовки к операции.
· консультация торакального хирурга: при развитии периэзофагальных осложнений.
· консультация реаниматолога: в случаях тяжёлых осложнений для определения характера и объёма детоксикационной терапии.
· консультация психиатра: для коррекции острых психических расстройств.
Лабораторная диагностика
Лабораторные исследования:
· при выраженном воспалительном процессе и присоединении бактериальной инфекции: лейкоцитоз, повышенное СОЭ;
· метаболический ацидоз;
· снижение функциональных резервов дыхания оценивается по величине жизненной емкости легких (ЖЕЛ), минутного объема дыхания (МОД) и максимальной минутной вентиляции (ММВ).
Дифференциальный диагноз
Дифференциальный диагноз:
Отравления кислотами
| Нозологическая единица | Дифференциально-диагностические признаки |
| Гемолитические яды | Отсутствие ожоговой поверхности |
| Щелочи | Отсутствие гемолиза эритроцитов |
| Нозологическая единица | Дифференциально-диагностические признаки |
| Желудочно-кишечные кровотечения при язвенной болезни, расширенных венах пищевода, и др. | Наличие анамнеза, отсутствие объективных данных, кровотечения, характерных для химического поражения ЖКТ, ФГДС-картина |
| Кислоты | Наличие гемолиза эритроцитов |
| Нозологическая единица | Дифференциально-диагностические признаки |
| Желудочно-кишечные кровотечения, при язвенной болезни расширенных венах пищевода, и др. | Наличие анамнеза, отсутствие объективных данных характерных для химического поражения ЖКТ, ФГДС-картина |
| Кислоты | Наличие гемолиза эритроцитов |
| Абсцессы, флегмоны | Наличие анамнеза, отсутствие объективных данных, характерных для химического поражения ЖКТ, ФГДС- картина |
Лечение
Цели лечения:
· купирование симптомов интоксикации;
· восстановление или улучшение проходимости пищевода.
Тактика лечения:
Хирургическое вмешательство в условиях стационара:
Бужирование пищевода.
Показания:
· короткие неполные стриктуры пищевода
· сочетанный ожог пищевода и желудка I степени
· сочетанный ожог глотки и пищевода I степени
· предоперационная подготовка к пластике пищевода.
Хирургическое лечение.
Перед эзофагопластикой необходимо определить функциональные изменения в системе внешнего дыхания по данным спирографического исследования.
Показания:
· облитерация пищевода;
· протяженные стриктуры;
· частые рецидивы стеноза после бужирования;
· выраженный болевой синдром;
· язвенный эзофагит;
· малигнизация.
Виды хирургического лечения:
· эзофагопластика целым желудком;
· эзофагопластика желудочной трубкой;
· эзофагопластика толстой кишкой.
Медикаментозное лечение:
Антибактериальная терапия. При воспалении послеоперационной раны и для профилактики послеоперационных воспалительных процессов применяются антибактериальные препараты. С этой целью применяются цефазолин или гентамицин при аллергии на b-лактамы или ванкомицин при выявлении/высоком риске наличия метициллин - резистентного золотистого стафилококка. Согласно рекомендациям Scottish Intercollegiate Guidelines и др. антибиотикопрофилактика при данном виде операций настоятельнорекомендована. При возникновении гнойно-воспалительных осложнений предпочтение следует отдавать комбинации (2-3) антибиотиков различных групп. Изменение перечня антибиотиков для периоперационной профилактики должно проводиться с учетом микробиологического мониторинга в стационаре.
Анальгетическая терапия. Ненаркотические и наркотические анальгетики (трамадол или кетопрофен или кеторолак; парацетамол). НПВС в целях обезболивания назначается перорально. НПВС в целях послеоперационного обезболивания следует начинать за 30-60 мин до предполагаемого окончания операции внутривенно. Не показано внутримышечное введение НПВС для послеоперационного обезболивания из-за изменчивости концентраций препаратов в сыворотке крови и боли, вызванной инъекцией, исключением является кеторолак (возможно внутримышечное введение). НПВС противопоказаны пациентам с язвенными поражениями и кровотечениями из желудочно-кишечного тракта в анамнезе. В данной ситуации препаратом выбора будет парацетамол, не оказывающий влияния на слизистую желудочно-кишечного тракта. Не следует комбинировать НПВС между собой. Комбинация трамадола и парацетамола является эффективной.
| № п/п | Название МНН | Доза | Кратность | Способ введения | Продолжительность лечения | Примечание | УД |
| Анальгетики | |||||||
| 1 | Тримеперидин | ||||||
Немедикаментозное лечение:
Режим.
· Режим 2 – при средней степени тяжести состояния.
· Режим 1 –при тяжелом состоянии.
Постельный режим в токсикогенной фазе и при развитии осложнений в соматогенной фазе.
Диета [1,16].- щадящая диета.
· Диетотерапия - при легком ожоге:1-я неделя – стол №1а по Певзнеру,
последующие 2 недели – стол №1.
· При ожоге желудка средней тяжести в первые 2 недели – стол №1а, 3-я неделя – стол №1б,
после выписки на 15-20-й день - стол №1 в течение 2-3-х недель.
· При тяжелом ожоге: в первые дни – парентеральное питание или энтеральное зондовое, после восстановления глотания на 5-7-й день - молоко, сливки, яйца всмятку, кисель, желе, мороженое, затем на 2,3 недели – стол №1а, в дальнейшем стол №1б (1-2 недели).
· Промывание желудка только через зонд, даже в более поздние сроки (6-9 часов), обильно смазанный вазелином, холодной водой; при отравлении щелочами можно промывать некипяченым молоком, разведенным водой; при отравлении перманганатом калия – 0,5-1% р-ром аскорбиновой кислоты с последующим введением активированного угля.
· Внутрь при отравлении кислотами, щелочами - белковая вода (4 белка куриного яйца на 1 литр воды); при отравлении перманганатом калия - 50-100 мл аскорбиновой кислоты по одной столовой ложке, в течение получаса .
· Внутрь - облепиховое масло.
· Ингаляции ротовой полости, зева с глюкокортикоидами, антибиотиками.
· Гипербарическая оксигенация.
· При тяжелом химическом ожоге верхних дыхательных путей – трахеостомия.
Другие виды лечения:
· лечебная гимнастика,
· дыхательная гимнастика.
Индикаторы эффективности лечения:
· восстановление проходимости пищевода;
· восстановление показателей крови;
· отсутствие послеожоговых осложнений.
Стриктура пищевода – доброкачественное сужение просвета пищевода вызванное, как правило, рубцовым процессом(синоним – РУБЦОВАЯ СТРИКТУРА ПИЩЕВОДА).
Как в пищеводе появляются рубцы и возникают стриктуры?
По существу, причина появления рубцов в пищеводе (и не только в пищеводе) одна – это воспалительный процесс. А вот причины воспаления, действительно, различны. Применительно к РУБЦОВЫМ СТРИКТУРАМ ПИЩЕВОДА таких причин несколько, причем две из них встречаются наиболее часто – ожог пищевода (ОЖОГОВАЯ СТРИКТУРА ПИЩЕВОДА) и его пептическое поражение (ПЕПТИЧЕСКАЯ СТРИКТУРА ПИЩЕВОДА). Реже причиной появления рубцов является воспаление вследствие инфекции, травмы, в том числе операционной и пр.
Каковы причины ожогов пищевода?
Не все знают, что ожоги бывают не только вследствие воздействия высокой температуры (хотя и термическое поражение пищевода возможно, например, под воздействием горячего пара или газа), но и агрессивного химического агента, что случается гораздо чаще.
Поэтому диагноз «ОЖОГОВАЯ СТРИКТУРА ПИЩЕВОДА» практически всегда означает употребление больным в прошлом какого-либо жидкого химического вещества. Чаще всего это кислота или щелочь имеющие отношение к бытовой химии, уксусная эссенция и другие. Большинство больных получает ожог пищевода случайно, нередко – в раннем детстве, гораздо реже – с суицидальной попыткой. Во всех случаях в пищеводе развивается очень опасное и выраженное острое воспаление, требующее интенсивного лечения и даже реанимационных мероприятий. А после стихания острого воспаления в просвете пищевода формируются рубцы, суживающие его просвет.
Важно знать, также, что агрессивная жидкость может повредить не только пищевод, но также глотку и даже желудок. Все это надо учитывать при определении тактики лечения.
Что такое ПЕПТИЧЕСКАЯ СТРИКТУРА ПИЩЕВОДА и что, вообще, означает слово «пептическая»?
NB Пептический – способствующий пищеварению, относящийся к действию пепсина.
NB Пепсин – пищеварительный фермент, вырабатываемый клетками желудка. Пепсин был открыт Теодором Шванном (Theodor Schwann) в 1836 году.
| Это любопытно ↑ |
Таким образом « ПЕПТИЧЕСКАЯ СТРИКТУРА ПИЩЕВОДА» возникает вследствие попадания желудочного содержимого в пищевод. Пепсин и соляная кислота, постоянно воздействуя на стенку органа, приводят к развитию хронического воспаления и к формированию рубцовой стриктуры.
Почему происходят забросы агрессивных веществ из желудка в пищевод?
Основная причина забросов (рефлюксов) – ГРЫЖА ПИЩЕВОДНОГО ОТВЕРСТИЯ ДИАФРАГМЫ, описанная в соответствующем разделе.
Как проявляют себя РУБЦОВЫЕ СТРИКТУРЫ ПИЩЕВОДА?
По мере развития стриктуры все в большей степени сужается просвет пищевода, и возникают затруднения при прохождении пищи в желудок, тем более выраженные, чем больше рубцовые изменения. Этот симптом носит название дисфагия (затруднение глотания) – основная жалоба у больных с РУБЦОВОЙ СТРИКТУРОЙ ПИЩЕВОДА. Второй и очень опасный симптом – прогрессирующее похудание, вплоть до истощения и кахексии , если причина дисфагии не будет своевременно устранена.
Какие бывают стриктуры пищевода и почему это важно?
Специалисты выделяют короткие (до 3 см) и протяженные (более 3 см) стриктуры пищеводы. Кроме того, стриктуры бывают единичные и множественные. Протяженность и количество стриктур определяет выбор лечебной тактики, о чем будет сказано далее.
Каковы методы выявления РУБЦОВЫХ СТРИКТУР ПИЩЕВОДА?
Стандартным планом обследования у больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА являются рентгеноскопия пищевода и эндоскопическое исследование (эзофагоскопия).
Вид протяженной стриктуры на рентгеновском снимке показан ниже.
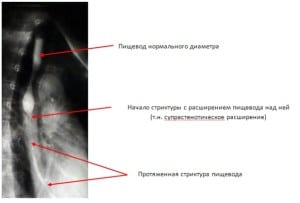 |
А это короткая стриктура пищевода.
 |
Эндоскопическое исследование подтверждает наличие у больного стриктуры, позволяет описать ее характер, уточнить состояние поврежденной стенки пищевода. Кроме того, важность эндоскопии у этих больных характеризуется не только диагностическими, но и лечебными возможностями (ссылка на раздел –«Что такое бужирование пищевода?»).
Как РУБЦОВУЮ СТРИКТУРУ ПИЩЕВОДА видит эндоскопист?
РУБЦОВАЯ СТРИКТУРА ПИЩЕВОДА (эндовидео) – ссылка на — Специалистам — Видеоматериалы – Внутрипросветная эндоскопия (создать подменю)
Как лечат стриктуру пищевода?
Методу лечения больных со стриктурами пищевода различны, и это далеко не всегда хирургическая операция. Тем не менее, и медикаментозных методов лечения стриктур не существует. Чаще всего больным, особенно с короткими стриктурами, помогает бужирование пищевода. Этот метод лечения может применяться как при стационарном лечении, так и амбулаторно.
NB Бужирование – метод диагностики и лечения, применяемый при заболеваниях полых органов, выполняется специальными инструментами (бужами), позволяющими расширить просвет органа.
NB Буж – инструмент для исследования и расширения просвета полого органа. Бужи известны с глубокой древности. Бронзовые бужи для расширения мочевых путей, похожие на современные, были найдены при раскопках Помпеи, города, разрушенного в 79 году нашей эры, почти две тысячи лет тому назад!
Что такое бужирование пищевода?
Бужирование выполняется как в хирургических стационарах, под контролем рентгеноскопии, так и в эндоскопических отделениях. Применение последовательно бужей все возрастающего диаметра позволяет существенно расширить пищевод и восстановить нормальное питание через рот.
Бужи различного диаметра
 |
На рентгенограмме – буж, введенный в просвет пищевода.
 |
Высока ли эффективность бужирования пищевода у больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА?
Бужирование пищевода – высокоэффективный метод лечения больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА. Хороших результатов у этих больных можно добиться, по данным различных исследователей, можно добиться в 75 – 85% случаев. Иное дело, что такие результаты можно получить не во всех группах больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА. В частности, при протяженных стриктурах этот метод гораздо менее эффективен, чем при коротких сужениях. Кроме того, стойкий эффект во многих случаях достигается лишь после нескольких курсов бужирования. Тем не менее – бужирование, это метод выбора, позволяющий избежать операции у значительной части больных со стриктурами пищевода.
Показано ли хирургическое лечение больным с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА?
Как и во многих других ситуациях показания к операциям у больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА возникают, когда менее травматичные и доступные виды лечения оказываются неэффективными. В частности, таковыми являются невозможность проведения бужирования, или неэффективность бужирования с быстрым возвращением проявлений заболевания (рецидив стриктуры).
В чем заключается хирургическое лечение больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА?
У больных с пептической стриктурой пищевода (ссылка на раздел – «Что такое ПЕПТИЧЕСКАЯ СТРИКТУРА ПИЩЕВОДА …») возможен вариант органосохраняющей операции, когда после бужирования выполняется так называемая фундопликация, то есть специальная манжетка предотвращающая заброс желудочного содержимого в пищевод. Пр этом создаются условия для стихания воспаления в пищеводе и для предотвращения дальнейшего развития стриктуры. Впервые антирефлюксная операция — фундопликация — была проведена Рудольфом Ниссеном (Rudolph Nissen, 1896 –1981) в 1955 году.
NB Фундопликация – антирефлюксная операция, заключающаяся в том, что дно желудка обворачивают вокруг пищевода, создавая манжетку, препятствующая забросу желудочного содержимого в пищевод.
NB Рефлюкс – (лат. refluo — течь назад) — обратный ток содержимого полых органов по сравнению с нормальным его движением. Антирефлюксный – препятствующий рефлюксу.
Тем не менее, основным способом лечения больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА является так называемая эзофагопластика, то есть вмешательство, при котором содается новый пищевод. Материалом для создания пищевода служит, обычно, собственные желудок или кишка больного, из которых формируется трубка необходимого диаметра. Собственный пищевод больного, в зависимости от показаний, может быть удален или сохранен, с формированием нового пищевода в обход старого (так называемая, шунтирующая пластика пищевода). Сегодня эти вмешательства становяться малотравматичными и выполняются с использованием эндоскопической техники (ссылка – раздел «Специалистам» — «Видеоматериалы»).
Перспективные методы лечения больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА?
Таким методом следует считать стентирование пищевода, то есть помещение в просвет пищевода специального трубчатого протеза, который не позволит рубцам суживать пищевод. На сегодняшний день эти стенты только разрабатываются и испытываются, но преспективным это направление, безусловно, является.
Несомненно актуальным является использование эндоскопической техники при выполнении операций как на грудной клетке, так и на брюшной полости.
Наконец, важным и перспективным направлением работы отделения является выполнение повторных операций на пищеводе, после неудачных попыток вмешательства, а также с использованием рианее травмированных или поврежденных органов (т.н. патологически-измененных).
Например, как было сказано ранее, ожогом может быть поврежден не только пищевод больного, но и его желудок. Тем не менее, в отделении разработаны технологии использования такого желудка для выполнения операции, что можно продемонстрировать описанием клинического наблюдения.
Клинические случаи
Для ознакомления с клиническими случаями пациентов cо стриктурой пищевода нажмите на ссылку ниже. Обращаем Ваше внимание, что эта информация предназначена для специалистов и содержит натуралистические фото и видео материалы.
Читайте информацию про особенности проведения торакоскопических операций.
Хирургическое лечение стриктур пищевода может проводиться в рамках оказания ВМП. Подробнее о бесплатной высокотехнологической медицинской помощи.
Как попасть на лечение в Отделение хирургии желудка и пищевода РНЦХ.
Для записи на консультацию позвоните по телефонам:
Отправьте заявку на консультацию, заполнив форму на нашем сайте и прикрепив необходимые документы.
Проблема выбора тактики и способа лечения рубцовых стриктур пищевода остается актуальной. Использование временного стентирования нитиноловыми эндопротезами у больных при постоянно рецидивирующих доброкачественных стриктурах пищевода является манипуляцией, альтернативной бужированию, позволяющей получить стойкую ремиссию заболевания в 75 % случаев. Основным методом профилактики и раннего лечения постожоговых рубцовых стриктур является своевременная дилатация пищевода, которую необходимо выполнять на 30–40 сутки с момента получения ожога биодеградируемыми коллагеновыми стентами. Основная проблема стентирования при постожоговых рубцовых стриктурах – миграция стента в дистальные отделы пищеварительного тракта. Использование визуальной фиксации стента к ушной раковине пациента за нить, выведенную через носовую хоану, позволяет контролировать явление миграции, тем самым снизить риск осложнений.

2. Ванцян Э.Н., Тощаков Р.А. Лечение ожогов и рубцовых сужений пищевода. - М.: Медицина, 1971. - С. 260.
3. Галлингер Ю.И., Годжелло Э.А. Эндоскопическое лечение рубцовых стенозов пищевода // Эндоскопическая хирургия. - 2000. - №5. С. 33-39.
4. Сапегина Ф.З. Оптимальные сроки баллонной дилатации при химическом ожоге пищевода (экспериментальное исследование): автореф. дис. . канд. мед. наук. - М., 2005.
5. Смирнов А.А. Эндопротезирование саморасправляющимися металлическими стентами при стенозирующих заболеваниях пищевода: автореф. дис. . канд. мед. наук. - СПб., 2010.
7. Repici A., Rondo G. Expandable Stents for Malignant Dysphagia // Tech. Gastrointest. Endosc. - 2008. - Vol. 10. - P. 175-183.
8. Song H.Y., Jung H.Y., Park S.I. et al. Covered retrievable expandable Nitinol stents in patients with benign esophageal strictures: initial experience // Radiology. - 2000. - № 217. - P. 551-557.
9. Spechler S.J. American gastroenterology association medical position statement on treatment of patients with dysphagia caused by benign disorders of the distal esophagus // Gastroenterology. - 1999. - Vol. 117. - P. 229-232.
10. Therasse E., Oliva V.L., Lafontaine E. et al. Balloon Dilation and Stent Placement for Esophageal Lesions: Indication, Methods, and Results // Radiographics. - 2003. - Vol. 23. - P. 89-105.
Возникновение постожоговых рубцовых стриктур пищевода занимает второе место среди всех заболеваний этого органа и достигает 75 %. Если, по данным зарубежных авторов, отмечается тенденция к уменьшению числа больных с постожоговыми рубцовыми стриктурами пищевода, то в России увеличивается количество случаев у детей, лиц молодого и трудоспособного возраста [1].
В последнее время для реканализации стриктур широко применяются различные варианты интубации пищевода. Традиционно эта патология лечится при помощи бужирования и баллонной дилатации. Перспективным направлением является стентирование саморасширяющимися эндопротезами. Однако использование стентов у больных с постожоговыми рубцовыми сужениями сейчас остается дискутабельным. Одни авторы расценивают установку стента в зону стриктуры как длительную дилатацию и указывают на устранение дисфагии в 48 % случаев с отсутствием необходимости в дальнейшем лечении [8]. По данным других авторов, такая манипуляция сопровождается тяжелыми осложнениями, общая доля которых доходит до 30 % [7]. Хотим поделиться клиническим опытом профилактики и лечения постожоговых стриктур пищевода методом стентирования.
Цель исследования: выбрать оптимальные сроки, методы профилактики и лечения доброкачественных постожоговых рубцовых стриктур пищевода.
Материалы и методы исследования
За период с 2004 по 2010 год в хирургическом отделении Пензенской областной клинической больницы им. Н.Н. Бурденко находился на лечении 261 человек с постожоговой рубцовой стриктурой пищевода. 21 пациенту (18 мужчинам и 3 женщинам) выполнено временное стентирование пищевода. Всем остальным больным проводилось ортоградное форсированное бужирование по ните и струне направителю.
Возраст пациентов составил от 25 до 79 лет. В 62 % случаев рубцовые стриктуры сформировались после ожога пищевода уксусной кислотой, в 24 % - щелочью и в 14 % случаев - другими агрессивными жидкостями. Высокие стриктуры наблюдались у 3 человек (14 %), срединные - у 4 пациентов (19 %), низкие - у 9 (43 %), комбинированные - у 5 (24 %). По протяженности имелись короткие, трубчатые, четкообразные, тотальные сужения.
У 8 пациентов использовали методику внешней фиксации стента для контроля за его дислокацией в дистальные отделы желудочно-кишечного тракта. Стент фиксировали к ушной раковине пациента за нить, выведенную через носовую хоану.
Размеры эндопротеза выбирали индивидуально. Обязательным условием стентирования являлось применение саморасширяющихся нитиноловых конструкций, полностью покрытых, с целью предотвращения врастания их в окружающие ткани.
Контроль за положением стента и проходимостью пищевода осуществляли с помощью эндоскопического и рентгенологического исследований.
5 пациентам было выполнено стентирование пищевода биодеградируемыми коллагеновыми стентами на 30-40 сутки с момента получения ожога: с целью раннего лечения и профилактики формирования постожоговой рубцовой стриктуры.
С целью лечения рассасывающиеся коллагеновые стенты были установлены 3 пациентам, имеющим клинические признаки дисфагии и явление стеноза пищевода по данным фиброгастродуоденоскопии, рентгеноскопии. С целью профилактики стентирование пищевода выполнено 2 пациентам с высоким риском формирования рубцовой стриктуры в отдаленном периоде (без клиники дисфагии). Отбор пациентов на раннее и профилактическое стентирование проводили с помощью нейросетевой модели прогнозирования рубцовых стриктур. Последняя создана нами на основе клинико-диагностических критериев неблагоприятного течения постожоговых рубцовых стриктур, выявленных ретроспективным анализом историй болезни 536 пациентов, пролеченных в отделении токсикологии с ожогами пищевода.
Установку биодеградируемых эндопротезов осуществляли по классической методике. Для закрепления позиции стента на время окончательного расправления и контроля за его миграцией до начала врастания в слизистую пищевода (первые 2 недели) проводили временную визуальную фиксацию стента за нить к ушной раковине пациента.
Результаты исследования и их обсуждение
Процедуру стентирования большинство пациентов переносили удовлетворительно, хотя она была сопряжена с известным дискомфортом.
Технические осложнения манипуляции отмечены у 2 больных (9,5 %): в связи с тем, что полное раскрытие стента происходит не сразу, не удалось удалить доставляющую систему с оливой. Последняя отделена и эвакуирована естественным путем (отделение оливы предполагается благодаря конструктивным особенностям доставляющего устройства). Других осложнений во время выполнения стентирования не наблюдали.
У всех больных с дисфагией на следующие сутки, у многих уже после стентирования, появилась возможность приема пищи. Спустя 3-5 суток явления дисфагии полностью исчезли.
Из ранних осложнений имели место боль и дискомфорт в грудной клетке, обусловленные давлением расширяющегося протеза на пищевод - 19, обильное слюнотечение - 4, тошнота и рвота (скорее всего рефлекторного характера) - 6, отсутствие аппетита - 4, субфебрилитет - 2. В течение последующих 3-4 суток все эти явления на фоне проводимой консервативной терапии регрессировали.
На этапе освоения методики наблюдали миграцию покрытых нитиноловых стентов в дистальные отделы желудочно-кишечного тракта у 4 пациентов (19 %). У 3 из них эндопротез дислоцировался в желудок.
В 2 случаях стенты были ретроградно извлечены за проксимальное кольцо с помощью гибкой эндоскопии. Хочется отметить возникшие сложности при извлечении стента, имеющего сегментарное строение - при потягивании за петлю для извлечения, уменьшаются в диаметре только проксимальная и дистальная часть конструкции, а сам стент на всем протяжении остается в раскрытом состоянии, что создает сложности для манипуляции в ограниченном пространстве. В одном случае эндоскопические попытки извлечения мигрировавшего в желудок стента оказались безуспешными, оборвалась проксимальная петля. В результате неэффективности проводимых мероприятий пациенту под местной анестезией выполнена операция - гастротомия, антеградное извлечение стента через гастростому.
У 1 пациента на фоне мнимого благополучия стент мигрировал в дистальные отделы подвздошной кишки и вызвал пролежень кишки в проекции проксимального и дистального концов протеза (рис. 1, 2). Это потребовало выполнения оперативного вмешательства в экстренном порядке. Выполнена лапаротомия, резекция участка подвздошной кишки с анастомозом конец в конец.

Рис. 1. Стент, мигрировавший в подвздошную кишку у пациента Н.
У 1 пациента имело место возникновение грануляционного стеноза по краям проксимального отдела стента на фоне нахождения его в просвете пищевода в течение 3 месяцев. С помощью эндоскопической петли стент подтянут и удален.
Следует отметить, что миграции покрытых нитиноловых стентов имели место в период накопления нами технического опыта по стентированию, когда методику визуальной фиксации стента еще не применяли.
Анализируя сроки миграции, выявили, что стенты дислоцировались на 40-60 сутки с момента установки. По всей видимости, за этот промежуток времени стриктура полностью реканализировалась.
Экспозиция протезов в просвете пищевода в среднем составила 1,5-2 месяца. У пациентов с внешней фиксацией стента сигналом к удалению последнего являлся симптом натяжения фиксирующей нити.
В процессе дальнейшего наблюдения у 100 % пациентов, подвергшихся стентированию покрытыми нитиноловыми саморасширяющимися эндопротезами, наступило эффективное улучшение проходимости пищевода. После извлечения нитиноловых конструкций у 12 (75 %) больных достигнута стойкая ремиссия. Срок наблюдения составил 3 года. Явления дисфагии не отмечается. У 4 человек развился рецидив стриктуры, что явилось показанием к выполнению реконструктивной восстановительной операции.
Установленные рассасывающиеся коллагеновые стенты, как с лечебной, так с профилактической целью, позволили избежать стенозирования пищевода и добиться хороших результатов лечения. За период наблюдения 6-8 месяцев у 5 больных (100 %) рестенозирования не наблюдали. Эффект каркасного действия стентов продолжался на протяжении 45-60 суток. Полная их биодеградация наступала в среднем в течение 3-4 месяцев (рис. 3, 4, 5).

Рис. 2. Пролежни подвздошной кишки, вызванные нитиноловым стентом

Рис. 3. Фиброгастродуоденоскопия пациента З. через 1 неделю после имплантации

Рис. 4. Фиброгастродуоденоскопия пациента З. через 1 месяц после имплантации биодеградируемого стента

Рис. 5. Фиброгастродуоденоскопия пациента З. через 3 месяца после имплантации биодеградируемого стента
Учитывая современные подходы к внедрению щадящих методик лечения в клиническую практику, считаем, что оптимальным способом реканализации постоянно рецидивирующих постожоговых стриктур пищевода является временное протезирование нитиноловыми стентами. Стентирование позволяет равномерно, дозировано и надежно дилатировать стриктуру в отличие от традиционных методов лечения. Несмотря на большое количество предложенных методик бужирования и баллонной дилатации, данные манипуляции остаются высоко травматичными и влекут за собой множество негативных последствий. Успешное применение баллонной дилатации постожоговых рубцовых стриктур возможно только при коротких стриктурах (до 5 см), при наличии достаточного (не менее 3 мм) диаметра просвета и одиночном поражение пищевода. Обычно адекватно расширить рубцовую стриктуру (до 13-15 мм) и восстановить почти нормальный пероральный прием пищи удается за 4-5 сеансов. Однако в дальнейшем у большинства больных в достаточно короткий период постепенно развивается рестеноз [3].
Бужирование считается технически неосуществимым при невозможности провести буж через стриктуру из-за ее ригидности или невозможности провести через стриктуру струну-проводник. Образующиеся при использовании этого метода глубокие одномоментные надрывы в области стриктуры впоследствии заживают с образованием грубого рубца, что приводит к быстрому рестенозу [2]. 30-40 % «бужируемых» стриктур в последующем рецидивируют [9].
Однократная установка стента - более легко переносимая манипуляция для пациента, чем этапное бужирование или баллонная дилатация.
При своевременном проведении комплекса профилактических мер, основой которых является дилатационная терапия, исход в рубцовый стеноз пищевода наблюдается менее чем в 10 %, а без этого в 73 % [2]. На основании этого считаем необходимым выявлять пациентов с прогностически неблагоприятным течением постожоговой рубцовой стриктуры: позднее стенозирование, непрерывно рецидивирующее течение, полная облитерация пищевода. Отбор пациентов следует проводить на основании прогноза, созданного нейросетевой моделью. С целью предотвращения неблагоприятного исхода заболевания следует проводить как ранние лечебные манипуляции (при дисфагии и явлении стеноза при ФГДС и рентгеноскопии), так и профилактические (при отсутствии клиники дисфагии, но при наличии клинико-диагностических критериев неблагоприятного течения стриктуры).
Оптимальным сроком для начала инвазивных манипуляций считаем 30-40 сутки с момента получения ожога. Экспериментальные исследования Ф.З. Сапегиной (2005) показали, что дилатация, проведенная на 30-40 сутки с момента травмы, препятствует формированию рубцовой ткани в просвете пищевода [4]. Вмешательство в ранние сроки (в первые 2 недели) увеличивает вероятность возникновения осложнений в виде кровотечения и перфорации пищевода, нарушает процессы заживления в поврежденной стенке органа, приводит к формированию грубой рубцовой деформации [3, 4]. В то же время инвазивные манипуляции в поздние сроки (40-60 сутки) применяются при прочно сформированной рубцовой стриктуре, что часто приводит к непрерывным рецидивам ее образования [5].
С целью профилактики неблагоприятного течения заболевания и раннего лечения считаем целесообразным использование биодеградируемых коллагеновых стентов. Преимущества их несомненны - эффект каркасного действия протеза сохраняется до 2 месяцев, более длительный период времени дилатации в сравнении с традиционными методами, способность их к врастанию в слизистую пищевода исключает возможность миграции в дистальные отделы желудочно-кишечного тракта, нет необходимости их извлечения.
У пациентов с длительной (более 6 месяцев существования) непрерывно рецидивирующей стриктурой (рестенозирование более 3 раз в год), считаем оправданной методику временного стентирования пищевода нитиноловыми саморасщиряющимися эндопротезами, осуществляемую под контролем эзофагоскопии, рентгеноскопии. Применение саморасщиряющихся нитиноловых конструкций цельноплетеного строения, полностью покрытых, позволяет создать равномерную оптимальную нагрузку по всей площади воздействия и предотвратить врастание стента в окружающие ткани.
Единственной потенциальной проблемой является способность к дислокации эндопротеза в дистальные отделы желудочно-кишечного тракта. Считаем необходимым контролировать местонахождение стента, используя его визуальную фиксацию к ушной раковине пациента за нить, выведенную через носовую хоану. Данную методику также используем при установке рассасывающихся коллагеновых стентов для закрепления позиции протеза на время его окончательного расправления и начала врастания в слизистую пищевода в течение первых 2 недель (временная фиксация стента).
Одним из дискуссионных остается вопрос о времени необходимой экспозиции протеза в просвете пищевода. По данным H.Y. Song и соавторов (2000), применение нитиноловых покрытых стентов у больных с ожоговыми стриктурами пищевода на протяжении 8 недель является достаточным для заживления стриктуры [8]. Стентирование саморасправляющимися металлическими эндопротезами на длительный срок (от 6 до 16 месяцев) сопровождается тяжелыми осложнениями, исход которых непредсказуем: сужение просвета пищевода до 2-5 мм выше и ниже стента или его полная облитерация, отслойка внутреннего покрытия стента с частичным нарушением его просвета, разрастание грануляционной ткани по краям стента, протяженная рубцовая стриктура нижней трети пищевода, сформировавшиеся пищеводно-респираторные свищи [6]. На основании клинического опыта полагаем, что экспозиция стента до 2 месяцев надежно дилатирует стриктуру, позволяет получить выраженный и стабильный клинический эффект, предупреждает развитие поздних стриктур. У 100 % пациентов, подвергшихся стентированию, наблюдалось устранение дисфагии. У 75 % достигнута стойкая ремиссия. На фоне длительного нахождения (более 2 месяцев) стента в просвете пищевода возникает грануляционный стеноз.
Основным методом профилактики и раннего лечения постожоговых рубцовых стриктур является своевременная дилатация пищевода, которую считаем необходимым выполнять на 30-40 сутки с момента получения ожога биодеградируемыми коллагеновыми стентами.
При сформированной длительной непрерывно рецидивирующей рубцовой стриктуре целесообразно применять временное стентирование покрытыми цельноплетеными нитиноловыми конструкциями продолжительностью не более 2 месяцев.
Использование визуальной фиксации стента к ушной раковине пациента за нить, выведенную через носовую хоану, позволяет контролировать явление миграции стента в дистальные отделы желудочно-кишечного тракта, тем самым снизить риск осложнений и непредсказуемых негативных последствий.
Профилактика и лечение постожоговых рубцовых стриктур пищевода методом стентирования имеет свои неоспоримые преимущества перед традиционными методами. Временное стентирование при длительной непрерывно рецидивирующей рубцовой стриктуре позволяет добиться стойкой ремиссии заболевания у 75 % пациентов.
Митрошин А.Н., д.м.н., профессор, директор медицинского института Пензенского государственного университета (Минобрнауки России), г. Пенза.
Сиваконь С.В., д.м.н., профессор, зав. кафедрой травматологии, ортопедии и военно-экспериментальной медицины медицинского института Пензенского государственного университета (Минобрнауки России), г. Пенза.
Нарушение проходимости пищевода - это симптом, возникающий при различных приобретенных заболеваниях пищевода.
Из данной подрубрики исключены:
- Q39.0 Атрезия пищевода без свища;
- Q39.1 Атрезия пищевода с трахеально-пищеводным свищем;
- Q39.3 Врожденные стеноз и стриктура пищевода;
- Q39.4 Пищеводная перепонка;
- Q39.9 Врожденная аномалия пищевода неуточненная.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Непроходимость пищевода развивается при сужении (стенозе) его просвета.
1. Доброкачественные стенозы пищевода могут возникать вследствие перенесенных химических ожогов, появившихся в результате случайного или специального (с целью самоубийства) приема прижигающих жидкостей, а также вследствие длительно существующих язв пищевода или его воспаления.
Воздействие веществ, вызывающих ожоги:
- кислоты вызывают коагуляционный некроз тканей с формированием плотного струпа, препятствующего проникновению вещества вглубь и уменьшающего его попадание в кровь;
- вещество, принятое внутрь, оказывает как местное, так и общетоксическое действие с развитием полиорганной недостаточности (прежде всего печеночно-почечной).
2. Злокачественные стенозы - развиваются вследствие рака пищевода.
3. Кольца пищевода* - концентрические, гладкие, тонкие (3-5 мм) расширения нормальной ткани пищевода, состоящие из 3 анатомических слоев: слизистой оболочки, подслизистой и мышечной массы. Кольцо пищевода может быть найдено в любом месте пищевода, но обычно локализуется в дистальной части пищевода. Существуют три типа колец пищевода, которые классифицируются в алфавитном порядке А, В и С в зависимости от локализации, строения и формы, выявляемой при контрастировании. Чаще всего специально выделяют кольца Шацки (кольца типа В).
Этиология и патогенез колец пищевода точно неизвестны. Гипотезы по этому поводу значительно разнятся.
* До выяснения этиопатогенеза кольца пищевода могут кодироваться как в данной подрубрике "Непроходимость пищевода" - K22.2, так и в подрубрике Q39.3 (для детей, имеющих соответствующие изменения с рождения).
4. В редких случаях нарушение проходимости пищевода может быть вызвано дивертикулами пищевода Дивертикул пищевода - выпячивание стенки пищевода, сообщающееся с его просветом.
Подробно , инородными телами, туберкулёзом (K23.0* Туберкулезный эзофагит (A18.8+), сифилисом, поражением пищевода при склеродермии и других заболеваниях (K23.8* Поражения пищевода при других болезнях, классифицированных в других рубриках).
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Дисфагия (расстройство глотания) является основным признаком непроходимости пищевода. В зависимости от степени сужения просвета пищевода она может быть выражена в различной степени: от неопределенных неприятных ощущений за грудиной при глотании, до полной невозможности принимать пищу и воду. Обычно проходимость для воды и полужидкой пищи сохраняется в течение более длительного времени; сухая и плохо пережеванная пища проходит туго, часто задерживается в пищеводе, вызывая загрудинные боли и рвоту.
Дисфагия в большинстве случаев развивается незаметно и сначала бывает эпизодической или не резко выраженной. При значительном сужении пищевода больные обычно вынуждены принимать только жидкую и полужидкую пищу.
Среди других признаков непроходимости пищевода часто наблюдаются отрыжка, боли за грудиной при проглатывании, слюнотечение, изжога.
В результате нарушения питания уменьшается масса тела больного.
Для колец пищевода клиническими признаками являются:
- эпизоды дисфагии со значительными перерывами (месяцы, недели, годы); ежедневные эпизоды дисфагии говорят не в пользу наличия колец;
- дисфагия при приеме только твердой пищи;
- дисфагия провоцируется быстрой едой без достаточного пережевывания и приема необходимого количества жидкости;
- эпизод дисфагии недлительный;
- прием жидкости или регургитация (рвота) ликвидируют дисфагию и позволяют далее продолжить прием пищи без затруднений;
- вероятно сочетание с так называемым "обмороком при глотании".
Прием в пищу свежеиспеченного хлеба и прожаренного мяса особенно часто сочетается с дисфагией такого типа, поэтому многие специалисты называют это состояние "стейк-синдром".
При появлении первых признаков нарушения проходимости пищевода следует обратиться к врачу.
Диагностика
Лабораторная диагностика
Общий анализ крови. Изменения неспецифичны. Может наблюдаться анемия, в некоторых случаях - лейкопения (при терминальных стадиях злокачественных опухолей).
Биохимия:
- гипопротеинемия;
- диспротеинемия;
- гипогликемия (редко);
- признаки повышенного катаболизма;
- гиповитаминоз;
- гипокалиемия (редко - у детей).
Дифференциальный диагноз
Истинную (механическую) непроходимость пищевода нужно дифференцировать от нейрогенной дисфункции (т.н. тоническая ахалазия - диффузный спазм пищевода), психических заболеваний, панических атак, истерии.
Осложнения
Развитие осложнений связано в основном с нарушением питания и водно-солевого обмена.
Лечение
Лечение непроходимости пищевода зависит от причин его возникновения:
- при доброкачественных стенозах пищевода предпочтение отдается бужированию (расширение просвета пищевода с помощью специальных инструментов) в том числе - так называемой "баллонной дилатации";
- возможен разрез электрокоагуляционной иглой зоны стеноза;
- при раке пищевода производятся лучевая терапия или хирургическое лечение;
- коррегируются возможная сопутствующая анемия и недостаточность питания;
- кардиоспазм в большинстве случаев лечится без хирургического вмешательства (см. Дискинезия пищевода - K22.4).

- мембранозный стеноз, вызванный наличием перепончатой перегородки с отверстием;
- сегментарный стеноз, вызванный фиброзно-мышечным утолщением стенки пищевода;
- комбинация мембранозного и сегментарного стенозов;
- трахеобронхиальные остатки в строме, сужающие дистальный отдел пищевода.
Эпидемиология
Врожденный стеноз пищевода составляет 3-5% от общего числа аномалий пищевода и 10% от общего числа стенозов пищевода.
Частота врожденного стеноза в популяции - 1:20 000 - 1:30 000 новорожденных.
Клиническая картина
Cимптомы, течение
Признаки врожденного стеноза пищевода проявляются сразу после рождения.
У больных с врожденным стенозом пищевода нередко возникает аспирационная пневмония. Незначительный стеноз клинически проявляется при кормлении ребенка густой пищей. Впервые подозрение на наличие стеноза пищевода может появиться при острой закупорке суженной части органа куском пищи. В последующем, с прогрессированием супрастенотического расширения, пища задерживается в пищеводе в течение длительного времени, изо рта ребенка появляется гнилостный запах. Кровянистое окрашивание рвотных масс свидетельствует о развитии эрозивного или эрозивно-язвенного эзофагита Эзофагит - воспаление слизистой оболочки пищевода.
Подробно .
Диагностика
Диагноз врожденного стеноза пищевода предполагают при наличии описанных выше характерных клинических симптомов и на основании результатов дополнительных методов исследования. Врожденный стеноз трудно диагностируется и нередко проходит под диагнозом пептического стеноза, выявляемого необычно рано - до 1,5-летнего возраста, что мало характерно.
Инструментальная диагностика: рентгеноконтрастное исследование пищевода и желудка, фиброэзофагоскопия.
Лабораторная диагностика
Обязательные исследования: общий анализ крови, гематокрит.
Дополнительные исследования: биохимический анализ крови (кислотно-основное состояние, общий белок, глюкоза, АлАТ, АсАТ, креатинин, мочевина).
Читайте также:

