Как проявляется себорейный дерматит у вич
Обновлено: 01.05.2024
Цель исследования. Выявление клинических особенностей течения себорейного дерматита (СД) у ВИЧ-инфицированных больных в зависимости от стадии ВИЧ-инфекции, состояния иммунного статуса и уровня вирусной нагрузки.
Материалы и методы. Под наблюдением находился 401 больной СД: в основную группу вошли 198 (49,4%) ВИЧ-инфицированных, в группу сравнения – 203 (50,6%) ВИЧ-негативных больных. Для оценки выраженности симптомов СД определялся дерматологический индекс (PODSI/ИТПОД). Кроме общепринятых стандартных методов исследования определяли уровень РНК ВИЧ методом ПЦР на приборе ICYCLER (Австрия) с использованием тест-системы «АмплиСенс HIV-Monitor», (Центральный НИИ эпидемиологии Роспотребнадзора, Россия), количества субпопуляции CD3+-, CD4-+ и CD8+-лимфоцитов методом проточной цитометрии на приборе FACS Calibur (Becton Discenson, США).
Результаты. У 372 (92,7 %) пациентов дебют или обострение кожного заболевания наблюдались в сроки от 6 мес. до 3 лет до момента включения в исследование. Прогрессирование/обострение СД на стадии вторичных заболеваний отмечено у 140 (76,5%) больных основной группы. В 33,5% случаев процесс имел вялотекущее и непрерывно-рецидивирующее течение. Сочетание двух кожных патологий наблюдалось у 46,1% пациентов в обеих группах, при этом в основной группе сочетаемость составила 73,2%. У пациентов в стадии вторичных заболеваний на начало исследования наблюдался выраженный иммунодефицит (у 101 больного количество CD4+-лимфоцитов было менее 350 клеток/мл), при этом вирусная нагрузка составляла более 103 копий вируса РНК ВИЧ, у 71 больного отмечали умеренно-тяжелое и тяжелое течение СД, требующие постоянной медикаментозной терапии.
Заключение. Учитывая корреляционную связь интенсивности проявлений кожных элементов СД у ВИЧ-инфицированных больных с клинической стадией ВИЧ-инфекции, уровнем вирусной нагрузки и количеством CD4+-лимфоцитов, оценка количественной и качественной фиксации морфологических изменений кожи служит прогностическим критерием течения ВИЧ-инфекции.
Себорейный дерматит (СД) – хроническое рецидивирующее заболевание кожи, связанное с повышенной секрецией кожного сала и изменением его качественного состава, он является одним из самых распространенных дерматозов в мире [1]. N. Zander и соавт. при обследовании более 160 000 человек отметили встречаемость СД у 3,2% респондентов, при этом фиксировалось частое сочетание СД с другими поражениями кожи [2]. У взрослых эта патология кожи является хроническим часто рецидивирующим заболеванием и проявляется очагами покраснения, шелушащимися пятнами, наличием жирных или сухих чешуек на коже в областях с повышенным количеством сальных желез. Кожа лица у больных СД поражается в 90% случаев, кожа волосистой часть головы – в 70%, верхняя часть туловища – в 27%. У 1,5–2% больных отмечается поражение кожи конечностей [3–5].
У ВИЧ-инфицированных больных поражение кожных покровов и слизистых оболочек встречается примерно в 90% случаев, при этом СД встречается значительно чаще, чем другие дерматозы, и связано это с вовлечением ВИЧ в ведущие дермальные иммунные реакции. В связи с ростом продолжительности жизни ВИЧ-инфицированных больных при использования антиретровирусной терапии (АРТ), на первый план у этих пациентов выходит лечение сопутствующей патологии, а заболевания кожи являются самыми распространенными.
Важным звеном в оценке проявлений различных дерматозов у ВИЧ-инфицированных больных является их «стандартизация», которая позволит использовать «связывающие симптомы» для оценки тяжести течения ВИЧ-инфекции и назначать адекватную терапию [6–8]. Для понимания особенностей течения кожных заболеваний, оценки их влияния на состояние больных и рекомендаций по лечению в научной среде используется большое количество как общих, так и частных дерматологических индексов. Так, частный индекс тяжести периорального дерматита (ИТПОД), основанный на наличии и интенсивности проявления 3 симптомов – эритемы, папул и шелушения кожи – был предложен в 2006 г. A. Wollenberg и T. Oppel и используется для клинической оценки течения дерматоза у больных СД [9, 10].
Особый интерес представляет изучение течения у пациентов с ВИЧ-инфекцией СД, который встречается в 30–70% случаев, может регрессировать, появляться вновь, сочетаться с другими кожными заболеваниями, принимать упорное рецидивирующее течение. Многие исследователи указывают на клинические и морфологические особенност.
Медицинский колледж Университета министерства обороны, г. Аддис-Абеба;
Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого
Медицинский колледж Университета министерства обороны, г. Аддис-Абеба;
Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого
Заболевания кожи и слизистых оболочек у больных с ВИЧ-инфекцией
Журнал: Клиническая дерматология и венерология. 2011;9(3): 19‑22
Гобена Дорсиса.Легессе., Гузей Т.Н. Заболевания кожи и слизистых оболочек у больных с ВИЧ-инфекцией. Клиническая дерматология и венерология. 2011;9(3):19‑22.
Gobena DorsisaLegesse, Guzeĭ TN. Skin and mucous membrane diseases in patients presenting with HIV infection. Klinicheskaya Dermatologiya i Venerologiya. 2011;9(3):19‑22. (In Russ.).
Медицинский колледж Университета министерства обороны, г. Аддис-Абеба;
Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого
В статье представлены четыре клинических случая поражения кожи на фоне ВИЧ-инфекции.
Медицинский колледж Университета министерства обороны, г. Аддис-Абеба;
Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого
Медицинский колледж Университета министерства обороны, г. Аддис-Абеба;
Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого
ВИЧ-инфекция относится к медленным вирусным инфекциям, для которых характерны многолетнее вялое течение с медленным, но неуклонным прогрессированием, бурный финиш и неизбежный летальный исход. ВИЧ-1 и ВИЧ-2 принадлежат к семейству ретровирусов, геном которых отличается наличием двух молекул одноцепочечной РНК и обратной транскриптазой (ревертазой). Это облигатный внутриклеточный микроорганизм. Основной, но не единственной мишенью ВИЧ являются Т-лимфоциты-хелперы, особенно богатые рецепторами CD4. Рецепторы CD4 имеют моноциты крови, макрофаги тканей, эозинофилы, дендритные клетки крови, лимфатических узлов, селезенки и кожи, а также макроглия, некоторые клоны В-лимфоцитов, эпителиальные клетки кишечника, клетки Лангерганса. Главной особенностью этой инфекции является нарастающее угнетение иммунитета, первоначально клеточного, а затем и гуморального. В итоге развивается полная несостоятельность иммунной системы, что и определяет разнообразие клинических проявлений на коже и слизистых оболочках [1].
Распространение ВИЧ-2 ограничено преимущественно районами Западной Африки с очагами в Анголе и Мозамбике. Описаны также случаи инфекции в Европе — в странах, имевших ранее тесные связи с Западной или Центральной Африкой. По сравнению с инфекцией ВИЧ-1 распространение ВИЧ-2 происходит медленнее, она в меньшей степени способна передаваться половым путем, ее клиническое течение менее активное [2].
От 1 до 3% пациентов со СПИД в эндемических зонах страдают висцеральным лейшманиозом. Лейшманиозная инфекция увеличивает репликацию ВИЧ и приводит к хронической иммунной активации [3, 5, 6]. Сочетанная инфекция лейшманиоза с ВИЧ, риск осложнений для ВИЧ-положительных лиц изучены недостаточно.
Лейшманиоз и ВИЧ могут сочетаться с множественными дерматофибромами, псориазом, синдромом Рейтера, бациллярным ангиоматозом, криптококкозом и афтозным стоматитом, а также с высыпаниями, подобными дерматомиозиту [6—8]. Диагностика таких сочетанных случаев достаточно сложная; могут быть полезны современные методы исследования, такие как полимеразная цепная реакция, RK 39 иммунохроматографический тест и др. [7, 9].
Описание клинических случаев поражений кожи в регионах, где ВИЧ-инфекция является эндемичной, представляет значительный интерес для практических врачей.
Приводим наши наблюдения.
Эфиопская девушка сомалийской нации 25 лет, предъявляет жалобы на незначительный зуд, поражение кожи лица и губ. За 1 мес до обращения на открытых участках кожи, преимущественно на конечностях и лице, появились инфильтраты размером до 2 см, которые быстро изъязвлялись, покрывались корками. За медицинской помощью обратилась впервые. Из анамнеза жизни известно, что она живет на границе Сомали и Эфиопии, ведет кочевой образ жизни (путешествует с рогатым скотом и верблюдом). При опросе пациентки выяснилось, что она ВИЧ-положительная (подтверждено нами лабораторными методами).

Локальный статус: на лице, руках видны множественные язвы, покрытые струпом; на красной кайме губ — язвы с гнойным отделяемым (рис. 1, а). Рисунок 1. Больная 25 лет. Лейшманиоз на фоне ВИЧ-инфекции. а — до лечения, б — после лечения. В отделяемом язв обнаружены лейшмании. На основании анамнестических, клинических и лабораторных данных больной был поставлен диагноз лейшманиоз кожный зоонозный.
Больной была рекомендована высокоактивная антиретровирусная терапия, которую обычно используют для лечения пациентов с ВИЧ-инфекцией, сочетанной с оппортунистическими инфекциями. Из-за высокой стоимости данного лечения больная была отправлена в больницу под наблюдение дерматолога и заведующего отделением, где получала десенсибилизирующую терапию, глюкозу внутривенно, витамины группы В, антибиотик широкого спектра действия клоксациллин (500 мг/сут) в течение 1 нед, антилейшманиозный препарат пентостам (препарат пентавалентной сурьмы — стибоглюконат натрия; 2 мг на 1 кг массы тела в сутки внутривенно) в течение 20 дней. Процесс постепенно разрешился, лицо очистилось от корок, язвы эпителизировались (рис. 1, б). Больной рекомендована антиретровирусная терапия в течение всей жизни.

Мужчина 29 лет, солдат военной базы Эфиопии, по прибытии в Аддис-Абебу обратился в отделение дерматологии и венерологии госпиталя Министерства обороны с жалобами на множественные узелковые высыпания в области головки полового члена. Болен в течение 1 мес. Высыпания на половом члене быстро приобрели множественный характер. За медицинской помощью ранее не обращался, самостоятельно не лечился. Холост. Находясь в армии, имел половые контакты с проститутками. В анамнезе хронические заболевания не отмечены. При осмотре в области головки и листков крайней плоти видны множественные папилломатозные разрастания с плоским основанием на ножке, безболезненные, эластической консистенции. Диагноз: остроконечные кондиломы (рис. 2). Рисунок 2. Больной 29 лет: остроконечные кондиломы на фоне ВИЧ-инфекции. При обследовании на ВИЧ-инфекцию методом иммуноферментного анализа (ИФА) результат оказался положительным. Больному радиоволновым методом были удалены кондиломы, проведено лечение ректальными свечами генферон в течение 10 дней. В дальнейшем у больного отмечались рецидивы заболевания, по поводу чего он вновь получал лечение.
Больная 28 лет, жена солдата, прибывшая из восточной части Эфиопии (Сомали). Обратилась в отделение дерматологии и венерологии с жалобами на болезненные узелковые образования и свищи, расположенные на стопах и голенях, с неприятным запахом, припухлостью, а также на затруднение при ходьбе. Заболела 4 года назад, когда впервые в пяточной области правой ноги заметила узелок темно-красного цвета без субъективных ощущений. Процесс медленно прогрессировал, появлялись новые узелки и узлы на стопах и голени не только правой, но и левой конечности. Поверхность многих узлов приобрела бородавчатый вид, присоединились гнойное отделяемое, болезненность, повышение температуры тела. До прибытия в Аддис-Абебу за медицинской помощью не обращалась.
В мазках гнойного отделяемого определяются сферические тельца (клетки гриба, окруженные толстой двухконтурной стенкой). При посеве на среду Сабуро отмечен рост бархатистых колоний темно-зеленого цвета. На основании анамнестических, клинических и лабораторных данных диагностирована бугорковая форма хромобластомикоза. Больной назначен итраконазол в дозе 400 мг/сут в 2 приема. В настоящее время больная находится на лечении, наблюдается дерматологом и инфекционистом.

Мужчина 28 лет, солдат, прибывший из северной части Эфиопии, обратился в отделение офтальмологии с жалобами на опухоль в области височной кости, орбитальной зоны, снижение зрения. При осмотре в правой скуловой области с захватом глаза определяется узел 5×7 см вишнево-красного цвета, плотной консистенции, в верхней части в стадии изъязвления, покрытый геморрагической коркой. В области лба видны три узелка темного цвета, плотной консистенции размерами от 1 до 1,5 см, безболезненные (рис. 4). Рисунок 4. Больной 28 лет: плоскоклеточный рак в правой орбитальной области на фоне ВИЧ-инфекции (а, б). В результате гистологического исследования биоптата выявлен плоскоклеточный рак II степени с метастазами. При исследовании в лаборатории сыворотки крови пациента выяснилось, что он инфицирован ВИЧ.
Первый клинический случай является наглядным примером того, что у пациентов с ВИЧ-инфекцией кожный лейшманиоз проявляется атипично, с массивным поражением кожи и протекает как оппортунистическая инфекция. Описание больного с остроконечными кондиломами является типичным для ВИЧ-инфицированных пациентов, у которых на фоне иммунодепрессии данное заболевание протекают как СПИД-ассоциированная инфекция с быстрым развитием и резистентностью к терапии. Клинический случай больной с хромомикозом на фоне ВИЧ-инфекции является примером заболевания, характерного для эндемичных регионов земли с тропическим климатом (Африка) и редким — для стран с умеренным климатом. Развитие плоскоклеточной карциномы в четвертом клиническом случае свидетельствует о необходимости обследования подобных больных на ВИЧ-инфекцию.
Что такое перхоть? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ляшко Маргариты Анатольевны, дерматолога со стажем в 10 лет.
Над статьей доктора Ляшко Маргариты Анатольевны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Перхоть (Dander) — это мелкие чешуйки на волосистой части головы, которые делают её внешний вид неопрятным. К аждый человек в своей жизни так или иначе сталкивается с этой проблемой [1] . Чешуйки перхоти образуются в результате ускоренного роста кератиноцитов (основных клеток эпидермиса) во время обновления клеток кожи.
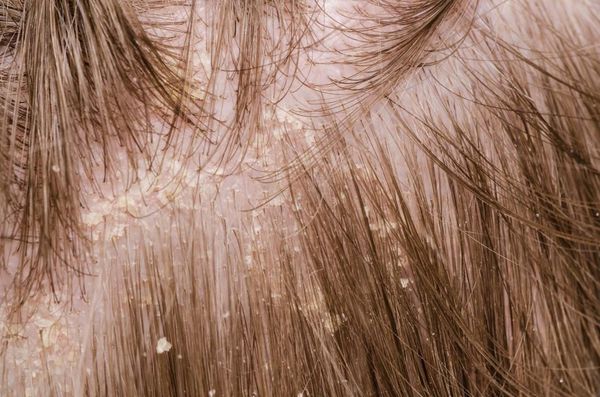
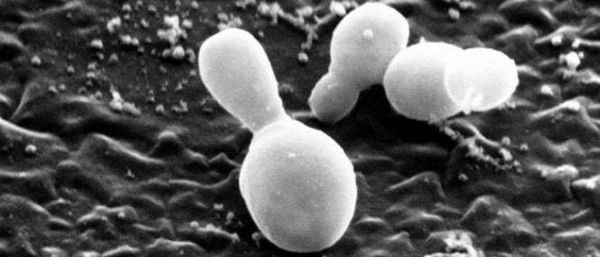
Перхоть не заразна, её появление не зависит от времени года. Основной причиной перхоти являются дрожжевые грибы Malassezia furfur (Pityrosporum ovale) [4] . Они входят в состав постоянной и временной микробиоты кожи большинства людей. Грибы могут проникать в эпидермис, дерму и волосяные луковицы [6] [7] . Их излюбленная локализация — участки, богатые кожным салом: грудь, спина, волосистая часть головы. Поскольку высокая плотность дрожжевых грибов не всегда сопровождается кожными симптомами, исследователи пришли к выводу, что патогенность присутствующих на коже Malassezia в большей степени зависит от их подтипа, чем от плотности распределения [8] .
Предрасполагающие и провоцирующие факторы образования перхоти:
- Наследственность — наличие в семье родственников, страдавших себорейным дерматитом.
- Избыточная работа сальных желёз.
- Себорея — избыточное образование кожного сала, вызванное гормональными изменениями [1] .
- Поражения нервной системы — парез мимических мышц , параличи туловища, болезнь Паркинсона .
- Приём антипсихотических препаратов , таких как галоперидол , тиоридазин, тиопроперазин, сульпирид , хлорпротиксен, рисперидон . Однако их роль в образовании перхоти пока не доказана.
- Эмоциональные перегрузки — вызывают обострение перхоти [9] .
- Заболевания пищеварительного тракта — нарушение выработки ферментов, дисбактериоз кишечника .
- Авитаминозы — нехватка кисломолочных и молочных продуктов, а также еды, содержащей витамины А, В, С, Е, медь, кальций, цинк, селен.
- Конституциональные особенности — болезнь Иценко — Кушинга , сахарный диабет и др. [1] .
- Химическая и термическая обработка кожи головы — использование пенки, геля и лака для укладки волос, высушивание их феном, вытягивание горячими щипцами.
В редких случаях перхоть может возникнуть, если использовать шампуни с агрессивными поверхностно-активными веществами (л аурил- и лаурет сульфатами ), редко или слишком часто мыть и расчесывать волосы.
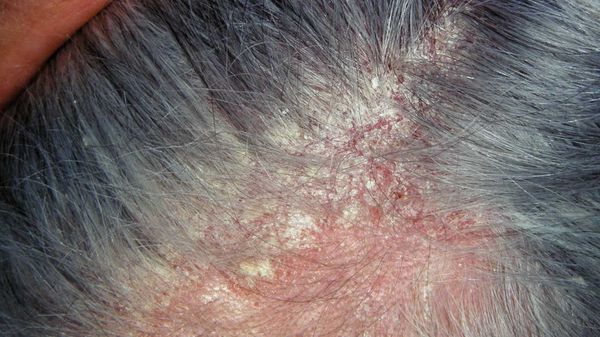
Перхоть — это синдром. Она является лёгким проявлением себорейного дерматита — хронического заболевания, при котором на лице, груди, спине и волосистой части головы возникают розовые или красные пятна с нечёткими границами, покрытые серебристыми чешуйками [10] . Условия, при которых перхоть может трансформироваться в себорейный дерматит, включают повышенную индивидуальную чувствительность кожи к компонентам жирных кислот, что проявляется разной степенью выраженности чешуйчатого дерматита [1] .
Причины перхоти у грудничков
- перхоть может появляться из-за нежной кожи и недоразвития сальных желез в первые месяцы жизни;
- у некоторых малышей перхоть выступает аллергической реакцией на продукты, которые ест кормящая мама;
- выбор "неподходящего" шампуня или других гигиенических средств.
Причины перхоти у подростков
Появление перхоти у подростков связано с усиленным образованием кожного сала из-за активной работы сальных желёз в пубертатный период.
Особенности возникновения у мужчин и женщин
У мужчин перхоть возникает чаще [9] . Это объясняется особенностями выработки кожного сала — себума. Так, влияние мужских половых гормонов чаще приводит к его избыточному выделению.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы перхоти
Так как перхоть является лёгким проявлением себорейного дерматита, она включает в себя признаки данного заболевания:
- жирный блес к и шелушение кожи головы;
- зуд и повышение чувствительности кожи;
- выпадение волос;
- обильное количество чешуек на волосах и одежде;
- появление красных пятен при ухудшении процесса [1] .
Чешуйки перхоти можно обнаружить на волосах. Как правило, они очень тонкие, полупрозрачные, при нормальном салоотделении — белого или бело-серого цвета. Иногда чешуйки образуют небольшие скопления на любом участке кожи головы .
Зачастую отмечается зуд и появляются пятна розового цвета с нечё ткими границами, которые покрыты тонкими хлопьями перхоти. Весь этот процесс может распространиться на участки кожи за пределами волосистой части головы.
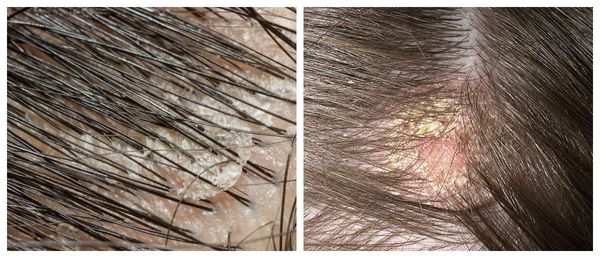
Перхоть распределяется на голове неравномерно. Количество чешуек увеличивается в местах сдавления кожи: под головными уборами и дужками очков, под волосами, собранными в пучок или косичку. Чешуйки перхоти легко осыпаются на плечи и одежду при расчёсывании волос и движении.
Патогенез перхоти
Ключевой фактор образования перхоти — гриб Malassezia globosa, генетически адаптированный к паразитированию на липидной (жирной) среде. Отсутствие способности синтезировать жирные кислоты, необходимые для жизнедеятельности, Malassezia globosa компенсирует выработкой большого количества липаз и фосфолипаз — ферментов, которые разлагают триглицериды кожного сала и способствуют получению необходимых жирных кислот. Изменения кожного покрова при перхоти провоцируют внеклеточные протеины, которые также секретирует Malassezia. Они взаимодействуют с кожей, тем самым приводя к развитию патологического процесса [1] .
Основными клетками эпидермиса кожи человека являются базальные кератиноциты. Физиологический цикл их развития длится около 25-30 дней. В случае возникновения патологического цикла они обновляются в разы быстрее — за 5-14 дней. При этом клетки не успевают терять воду, что приводит к их склеиванию и отшелушиванию в виде заметных бело-серых хлопьев. Эти хлопья и являются перхотью.
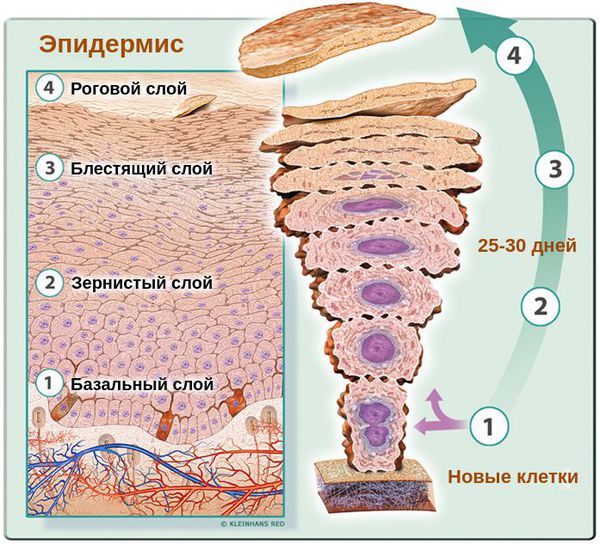
Как показывают исследования, при увеличении скорости обновления клеток в случае перхоти отсутствуют признаки усиленного роста клеток (гиперпролиферации) [2] . Это говорит о том, что повышение клеточной продукции скорее является следствием воспаления.
Верхний слой здорового эпидермиса, т. е. роговой слой представляет собой 25-35 плотно прилегающих друг к другу слоёв, состоящих из полностью кератинизированных (оформленных) корнеоцитов — плоских защитных чешуек. При развитии патологического процесса количество слоёв уменьшается максимум до 10-ти. При этом они, вместе с клетками в них, расположены хаотично [13] .
При перхоти корнеоциты отделяются друг от друга, соединения между клетками (десмосомы) становятся менее прочным или вовсе исчезают. Из-за этого между корнеоцитами появляется большое количество плотной салоподобной массы межклеточных липидов [11] [12] .
Классификация и стадии развития перхоти
Международная классификация болезни отн осит перхоть к себорейному дерматиту [14] .
Различают три вида себореи:
- Жирная себорея — возникает тогда, когда сальные железы выделяют избыточное количество кожного сала. Волосы и кожа с тановятся жирными и блестящими. В зависимости от консистенции кожного сала выделяют два типа жирной себореи :
- Густаясеборея — чешуйки перхоти, как правило, склеиваются друг с другом; волосы становятся грубыми, жёсткими; возникают чёрные угри — комедоны, при сдавлении которых выделяется густая сальная масса.
- Жидкаясеборея — кожа лоснится, напоминает апельсиновую корку из-за расширенных пор; жёлтые чешуйки перхоти плотно прилегают к коже, крепко сцеплены между собой; пряди волос склеиваются.
- Сухая себорея — возникает при плохом выделении кожного сала в результате высокой вязкости. Это приводит к сухости кожи головы, ломкости и истончению волос. Перхоть при этом легко отделяется от кожного покрова.
- Смешанная себорея — проявляется как совокупность жирной и сухой себореи. К примеру, на волосистой части головы имеются очаги сухой себореи, а на лице — жирной себореи [21][24] .

Осложнения перхоти
Перхоть — это доброкачественное состояние. При усиленной выработке кожного сала, недостатке цинка, первичном или вторичном иммунодефиците патогенные свойства грибов Malassezia globosa усиливаются. Это может привести к следующим осложнениям:
- Себопсориаз — доклиническая стадия псориаза. Проявляется шелушением волосистой части головы, бровей и образованием шелушащихся бляшек на туловище.
- Себорейный дерматит — хроническое воспаление кожи в себорейных зонах на фоне длительно существующей перхоти. У ВИЧ-инфицированных людей себорейный дерматит встречается чаще и протекает тяжелее, чем у других пациентов. Не поддающийся лечению себорейный дерматит — показание к обследованию на ВИЧ-инфекцию[22][23] .
- Выпадение волос. Перхоть опасна тем, что чешуйки перекрывают волосяным фолликулам доступ к кислороду. Из-за недостатка питания волосы ослабевают, истончаются, секутся, перестают расти, что способствует их постепенному выпадению. Иногда перхоть приводит к смерти волосяной луковицы, и тогда в зонах её локализации наступает облысение.
- Пиодермия — гнойные болезни кожи. В случае перхоти голова пациента постоянно чешется. Это чревато микротравмами и занесением в них стрептококковой и стафилококковой инфекции. Они в свою очередь приводят к появлению таких заболеваний, как фурункул, абсцесс, фолликулит, сикоз , импетиго.
- Атерома — киста сальной железы. Перхоть может заблокировать проток сальной железы, в результате чего выделяемый секрет будет скапливаться внутри неё. После разрешения атеромы на её месте появляется рубец.
- Юношеские угри . Юношеские угри возникают при обильной выработке кожного сала, увеличении сальной железы и неконтролируемом отделении клеток кожи в устьях волосяных фолликулов. Всё это приводит к воспалительным реакциям в окружающих тканях [24][25] .
Помимо прочего, перхоть вызывает социальный и психологический дискомфорт. Возникнув на фоне стресса, она может усилить и без того подавленное состояние.
Диагностика перхоти
Диагноз себорейного дерматита основывается на данных клинической картины. При каких-либо сомнениях необходимо:
- Тщательно собрать анамнез, т. е. узнать детали заболевания: когда появились высыпания, с чем их связывает пациент и др.
- Выявить факторы риска развития себоре и.
- Сделать биохимический анализ крови, чтобы исключить другие заболевания: системную красную волчанку, системную склеродермию и др. При перхоти будет наблюдаться дефицит микро- и макроэлементов (белка, железа, цинка, меди).
- Выполнить анализ крови на сахар для исключения сахарного диабета.
- Провести анализ крови на гормоны щитовидной железы для исключения гипертиреоза и гипотиреоза .
- Исследовать состояние кожи и волос визуально и с помощью дерматоскопа. В случае перхоти на коже головы будут наблюдаться чешуйки белого, бело-серого или жёлтого цвета, иногда — пятна розового цвета.
- Проконсультироваться с гастроэнтерологом.

При сомнениях в постановке диагноза необходимо провести гистологическое исследование биоптата кожи — взять кусочек кожи с поражённого участка и определить под микроскопом наличие морфологических признаков, характерных для заболевания [14] .
Дифференциальная диагностика
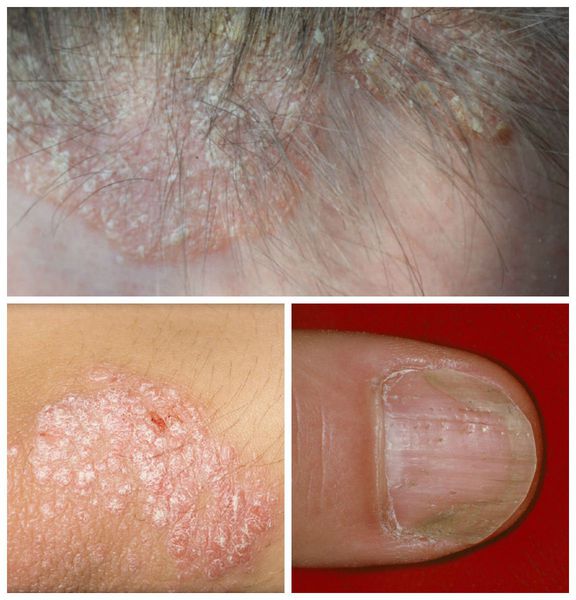
Для правильного постановки диагноза и назначения лечения себорейных дерматит следует отличать от таких заболеваний, как псориаз, ирритантный дерматит, трихомикозы (поражение волос другими грибками), асбестовидный лишай .
Псориаз волосистой части головы сопровождается появлением розовых или красных пятен, чешуйчатых бляшек с чётко ограниченными краями. Диагноз облегчается в случае обнаружения бляшек на других участках кожи или типичных поражений ногтей.
Ирритантный (раздражающий) дерматит возникает при попадании на кожу волосистой части головы кислоты или щёлочи. Характеризуется появлением сухих истончённых ломких чешуек, сопровождается симптомами жжения, покалывания и зуда. Данный дерматит встречается при использовании шампуня с сильными сурфактантами: лаурилсульфатом натрия, диэтаноламином, бензолами, парабенами, триклозаном. Все эти вещества хорошо пенятся, при этом нарушают pH кожи головы и вызывают раздражение. Также этот вид дерматита возможен при применении химических агентов во время укладки волос.
Трихомикозы , особенно инфекция, вызванная Trichophyton surans, могут напоминать перхоть. Обычно они возникают в детстве. Для них характерно наличие обломанных пеньков или выпадение волос в поражённой зоне, увеличение шейных и заушных лимфатических узлов.
Асбестовидный лишай не является дерматологической инфекцией. Он представляет собой большую массу волос, плотно склеенных белыми или желтоватыми чешуйками, часто в области макушки. Мнения многих авторов по поводу этого заболевания разнятся [1] .
Лечение перхоти
Средства против перхоти включают вещества для удаления чешуек, снятия зуда и подавления грибов Malassezia. Так как развитию себореи способствует нарушение работы сальных желёз, её лечение предполагает уменьшение выделения кожного сала. Оно направлено внутрь кожи. Для этого в первую очередь назначают себорегулирующие маски или лосьоны на основе цинка, салициловой кислоты, гормональных компонентов. Их нужно выдерживать после нанесения 20-30 минут. Шампунь же только дополняет лечение. Он помогает смыть сальный секрет, покрывающий кожу головы.
Когда необходимо обращаться к врачу
Как избавиться от перхоти в домашних условиях
Вылечиться самостоятельно можно с помощью аптечных линеек шампуней, направленных на лечение перхоти.
Чем мыть голову от перхоти: шампуни и маски
Основными ингридиентами большинства шампуней и масок от перхоти являются салициловая кислота, сульфат селена, сера, пиритион цинка. Самым эффективным шампунем будет тот, в котором будут присутствовать два или три нижеперечисленных компонента:
В настоящее время на рынке представлены следующие препараты:
Все существующие лосьоны и шампуни против перхоти бывают:
- терапевтическими — продаются в аптеке;
- косметическими — продаются в обычных магазинах.
Терапевтические шампуни применяются строго по инструкции, как правило, не менее 1-2 раз в неделю. Косметические шампуни используются ежедневно или через день до тех пор, пока количество перхоти не уменьшится, после этого — 2-3 раза в неделю.
Чтобы действующее средство шампуня успело подействовать и помогло избавиться от перхоти, средство необходимо тщательно втирать в кожу головы, оставляя его минимум на пять минут. Если спустя 2-3 недели использования шампуня перхоть не исчезает, то следует обратиться к дерматологу-трихологу.
Во время лечения важно придерживаться сбалансированной диеты: стараться меньше есть сладкую, жирную пищу; чаще употреблять кисломолочные продукты, а также еду с большим содержанием клетчатки и витаминов. Это позволит нормализовать работу сальных желёз.
Чем снять зуд от перхоти
Избавиться от зуда поможет правильно подобранный шампунь по типу кожи головы. Своевременный и адекватный гигиенический уход за волосами с использованием шампуней, содержащих пиритион цинка, позволяет контролировать появление перхоти и уменьшить зуд.
Лекарства и аптечные средства от перхоти
Препаратов в форме таблеток для уменьшения перхоти не существует. Лечение проводится с помощью специальных шампуней, описанных выше.
Как быстро избавиться от перхоти
Лечение предполагает длительное использование косметических и лечебных средств, поэтому быстро избавиться от перхоти не получится.
Как избавиться от перхоти народными средствами
Методы нетрадиционной медицины не имеют доказанной эффективности, их действие непредсказуемо, поэтому они не могут быть рекомендованы для лечения.
Прогноз. Профилактика
Прогноз благоприятный. При правильно назначенном, адекватном лечении выздоровление наступает в большинстве случаев. Длительность терапии обычно составляет от трёх до шести недель. В дальнейшем можно пользоваться обычными косм етическими шампунями против перхоти. Рецидивы могут возникать при развитии или обострении болезней желудочно-кишечного тракта или других хронических заболеваний кожи [15] .
Полезные советы по уходу за волосами
Людям с жирным типом волос желательно регулярно мыть голову, а лучше — каждый день. Это позволит снизить вероятность возникновения перхоти. Также необходимо как можно реже использовать лаки, спреи, гели и другие средства для волос, так как они усиливают выделение кожного сала.
В рамках профилактики по возможности нужно избегать стрессовых состояний. Они негативно влияют не только на состояние волос и кожного покрова, но и весь организм. Также стоит обратить внимание на свой рацион: употреблять больше продуктов, содержащих цинк, полинасыщенные жиры и витамин B.
С большой осторожностью пациенты с себореей должны относиться к нанесению макияжа и использованию косметических средств. Они повышают чувствительность кожи, тем самым приводя к нарушению образования чешуек рогового слоя кожи [18] [19] [20] .
Среди большого числа проявлений ВИЧ-инфекции поражения кожи занимают особое место. Поражения кожи могут иметь важное диагностическое значение как для острой стадии болезни, так и для определения стадий вторичных заболеваний.
Among a large number of manifestations of HIV infection lesions occupy a special place. Skin lesions may have important diagnostic value for the diagnosis of acute stage of the disease, and to identify the stages of secondary diseases.
Заболеваемость ВИЧ-инфекцией (ВИЧ — вирус иммунодефицита человека) сохраняет тенденцию к неуклонному росту. Существенно увеличилось число больных с поздними стадиями ВИЧ-инфекции и наличием различных оппортунистических заболеваний, в частности поражений кожного покрова. Диагностика этих изменений нередко представляет большие трудности на догоспитальном уровне для врачей общего профиля, а также дерматологов и инфекционистов [1, 2].
Среди множества специфических проявлений ВИЧ-инфекции и оппортунистических заболеваний поражения кожи занимают особое место, т. к. уже с момента манифестации заболевания являются наиболее частым и ранним ее проявлением [1–3]. Вовлечение кожи в патологический процесс обусловлено как иммунодефицитом в целом, так и тем обстоятельством, что ВИЧ поражает не только Т-лимфоциты-хелперы, но и клетки Лангерганса, играющие важную роль в дермальных иммунных реакциях и, возможно, являющиеся местом первичной репликации ВИЧ в коже.
В 2011–2014 гг. в ИКБ № 2, куда госпитализируется более 80% ВИЧ-инфицированных больных в г. Москве, нами наблюдались 586 пациентов с различными кожными проявлениями, что составило 69% от общего числа госпитализированных (в 4-й стадии ВИЧ-инфекции — 88%). Их можно подразделить на 3 группы: кожные проявления при манифестации ВИЧ-инфекции, заболевания в стадии вторичных проявлений (4-я стадия) и поражения кожи, не связанные с ВИЧ-инфекцией. Поражения кожи могут иметь важное диагностическое значение. Часто на ранних стадиях развития болезни (уже через 3–4 недели после заражения) на коже больного может появиться острая экзантема (3-е место после мононуклеозоподобного синдрома и лимфаденопатии), состоящая из отдельных эритематозных пятен и папул [1, 4]. Пятнисто-папулезная сыпь — своеобразное поражение кожи у ВИЧ-инфицированных, которое до сих пор не получило определенного нозологического статуса. Сыпь имеет распространенный характер, обычно сопровождается легким зудом. Она локализуется в основном на верхней половине туловища, шее и лице; дистальные отделы конечностей поражаются редко. Папулезную сыпь рассматривают как проявление морфологической реакции кожи на инфицирование ВИЧ. Изменения на коже сопровождаются лихорадкой, изменениями на слизистых ротоглотки (чаще кандидоз полости рта). После стихания острой фазы (2–2,5 недели) пятна и папулы подвергаются спонтанному регрессу. Экзантема при острой ВИЧ-инфекции не отличается морфологической спецификой, поэтому в стационар больные чаще всего направляются с диагнозами: острая респираторная вирусная инфекция, токсикоаллергическая реакция, корь, краснуха. Надо отметить, что состояние иммунного статуса у этой категории больных не имеет существенных отклонений от нормы, а исследование крови на ВИЧ методом иммуноферментного анализа имеет сомнительные или отрицательные результаты, т. к. специфические антитела еще отсутствуют. В ранние сроки диагноз ВИЧ-инфекции может быть подтвержден только методом полимеразной цепной реакции. Серологические реакции на ВИЧ у этих больных становятся положительными позже, чаще через 6–12 недель от начала острой фазы болезни.
Экзантема, наблюдаемая в периоде сероконверсии, обусловлена самим вирусом иммунодефицита, все другие изменения кожи связаны с оппортунистическими заболеваниями, развивающимися на фоне иммунодефицита при снижении СД4+ менее 300 клеток. Этиологически можно выделить 3 основные группы кожных проявлений у больных ВИЧ/СПИД: неопластические, инфекционные (вирусные, грибковые, бактериальные, паразитарные) и дерматозы неясной этиологии. Первые две группы относятся к ВИЧ-индикаторным заболеваниям, так как все виды опухолей у больных ВИЧ/СПИД имеют вирусную этиологию и их формирование обусловлено тяжелым иммунодефицитом. Дерматозы неясной этиологии, возможно, обусловлены лекарственно-аутоиммунными поражениями, особенно при длительной антиретровирусной терапии (АРВТ) (в частности — Эпивиром) или специфической терапии оппортунистических заболеваний, не исключено и непосредственное воздействие ВИЧ на кожу. Самыми распространенными у больных СПИДом являются грибковые поражения кожи и слизистых. Наиболее часто наблюдаются кандидоз, руброфития, разноцветный лишай (81%) [5, 6]. Другие микозы встречаются значительно реже. Особенностями грибковых заболеваний при ВИЧ-инфекции являются: поражение лиц молодого возраста, особенно мужчин; быстрая генерализация с формированием обширных очагов, расположенных по всему кожному покрову; упорное течение; резистентность к проводимой терапии. Характерно сочетание поражения кожи и слизистых оболочек (полость рта, гениталии). Второе место среди поражений кожи занимает себорейный дерматит (68%). Как правило, у этих больных он протекает остро и тяжело. Вначале процесс локализуется только на лице (брови, усы, область рта), волосистой части головы и на разгибателях верхних конечностей. При развитии процесса на волосистой части головы можно обнаружить довольно сильное шелушение, напоминающее перхоть. Иногда при ВИЧ процесс может распространиться по всему кожному покрову в виде зудящих экзематозных бляшек. Такое распространение дерматита говорит о резко пониженном иммунитете и является плохим прогностическим признаком. Третье место по частоте занимают герпетические инфекции, в частности вирусы простого герпеса 1-го и 2-го типов и varicella zoster (28%) [7, 8]. Герпетические высыпания могут появиться на любом участке кожи и слизистых оболочек, но чаще они возникают на губах, половых органах или в перианальной области. Высыпания часто трансформируются в крупные, болезненные, долго не заживающие язвы. Нередко клинические проявления герпеса напоминают ветряную оспу или импетиго. Помимо поражения кожи и слизистых оболочек, при ВИЧ-инфекции у больных часто развивается герпетический проктит, который проявляется в виде болезненной отечной эритемы в перианальной области. Опоясывающий лишай при условии возникновения его у лиц молодого возраста из группы риска, отсутствии провоцирующих заболеваний и иммуносупрессивной терапии служит индикатором ВИЧ-инфекции. Пузырьковые высыпания сопровождаются сильными болями, оставляют рубцы, рецидивируют, что не наблюдается у лиц без иммунного дефицита. Наиболее характерным дерматологическим неопластическим проявлением ВИЧ-инфекции остается саркома Капоши, вызванная вирусом простого герпеса 6-го типа [9, 10]. Надо отметить, что ее частота снизилась с 40% у мужчин со СПИДом в 1980–90 гг. до 9% начиная с 2000 г. Основными клиническими особенностями саркомы Капоши является то, что у большинства больных заболевание развивается в возрасте до 35 лет; очаги поражения на коже носят распространенный характер; склонность к быстрой генерализации процесса (в первую очередь поражаются легкие, желудочно-кишечный тракт, лимфоузлы и слизистая оболочка полости рта); высокая смертность в течение короткого времени без лечения. Появление на коже различных пятен синюшного или розового цвета, бляшек или папул у лиц молодого возраста обязательно должно насторожить лечащего врача в отношении ВИЧ-инфекции и требует обязательного проведения гистологического исследования биоптата кожи для исключения саркомы Капоши. В поздних стадиях болезни кожные элементы (розеолы, папулы, пятна) становятся многочисленными, инфильтрируются, могут изъязвляться. Обильные кожные проявления практически всегда сопровождаются выраженным лимфостазом, поражением суставов, с развитием контрактур. Примером прямой зависимости поражения кожи от ВИЧ-инфекции может служить папилломавирусная инфекция кожи и слизистых оболочек (10%) [11, 12]. У ВИЧ-инфицированных больных изменения на коже имеют необычный вид, поражают нетипичные места, многочисленные, имеют участки распада в центре папул, сливаются и после хирургического удаления практически всегда рецидивируют. Эти элементы появляются преимущественно на лице, а также в области гениталий и могут быть крупными (гигантский моллюск), напоминать рак кожи, остроконечные кондиломы, обычные вульгарные бородавки и кератоакантомы.
У трети ВИЧ-инфицированных в течение нескольких недель от начала лечения различных оппортунистических инфекций этиотропными препаратами, а также АРВТ появлялась распространенная зудящая сыпь в виде эритематозных пятен и папул, что расценивалось как медикаментозная токсикоаллергическая реакция. Нами наблюдались и более тяжелые медикаментозные реакции, в частности синдром Стивенса–Джонсона и токсический эпидермальный некролиз.
Таким образом, несмотря на то, что клинических вариантов дерматологических проявлений ВИЧ-инфекции довольно много, такие поражения кожи, как саркома Капоши, стойкий кандидоз кожи и слизистой оболочки полости рта, часто рецидивирующий простой и опоясывающий герпес, себорейный дерматит, контагиозный моллюск, «волосатая» лейкоплакия языка и вульгарные бородавки, следует отнести к наиболее характерным и диагностически значимым маркерам ВИЧ-инфекции, особенно если они протекают на фоне общих симптомов — лихорадки, лимфаденопатии, слабости, диареи, потери массы тела. Следует отметить, что в динамике болезни различные поражения кожи могут регрессировать, появляться вновь, сменять одно другим, давать разнообразные сочетания.
Учитывая все вышеизложенное, больным ВИЧ-инфекцией с поражениями кожи и слизистых оболочек необходимо постоянное наблюдение врача-дерматолога. Для достижения положительного эффекта от проводимого лечения необходимы более продолжительные курсы терапии кожных заболеваний и максимальные дозы используемых препаратов, а после излечения — прием показанных препаратов профилактически. Помимо терапии кожных заболеваний больным ВИЧ-инфекцией показано назначение АРВТ. Диагностика кожных проявлений имеет важное практическое значение, так как способствует более раннему установлению диагноза ВИЧ-инфекции, своевременному назначению АРВТ, улучшению качества и продолжительности жизни пациента.
Литература
- Бартлетт Дж., Галант Дж., Фам П., Мазус А. И. Клинические аспекты ВИЧ-инфекции. М.: Гранат. 2013. 590 с.
- ВИЧ-инфекция и СПИД/Под ред. В, В. Покровского. 2-е изд., перераб. и доп. М.: ГЭОТАР-медиа, 2010. 192 с. (Серия «Клинические рекомендации»).
- Motswaledi M. H., Visser W. The spectrum of HIV-associated infective and inflammatory dermatoses in pigmented skin // Dermatol Clin. 2014; 32 (2): 211–225. doi: 10.1016/j. det.2013.12.006. Epub 2014 Jan 22.
- Rane S. R., Agrawal P. B., Kadgi N. V., Jadhav M. V., Puranik S. C. Histopathological study of cutaneous manifestations in HIV and AIDS patients // Int J Dermatol. 2014; 53 (6): 746–751. doi: 10.1111/ijd.12298. Epub 2013 Dec 10. PMID: 24320966.
- Zacharia A., Khan M. F., Hull A. E., Sasapu A., Leroy M. A., Maffei J. T., Shakashiro A., Lopez F. A. A. Сase of disseminated cryptococcosis with skin manifestations in a patient with newly diagnosed HIV // J La State Med Soc. 2013; 165 (3): 171–174.
- Mischnik A., Klein S., Tintelnot K., Zimmermann S., Rickerts V. Cryptococcosis: case reports, epidemiology and treatment options // Dtsch Med Wochenschr. 2013 Jul 16; 138 (30): 1533–8. doi: 10.1055/s-0033–1343285.
- Ngouana T. K., Krasteva D., Drakulovski P., Toghueo R. K., Kouanfack C., Ambe A., Reynes J., Delaporte E., Boyom F. F., Mallié M., Bertout S. Investigation of minor species Candida africana, Candida stellatoidea and Candida dubliniensis in the Candida albicans complex among Yaoundé (Cameroon) HIVinfected patients // Mycoses. 2014, Oct 7. doi: 10.1111/myc.12266.
- Barnabas R. V., Celum C. Infectious Co-factors in HIV-1 transmission Herpes Simplex Virus type-2 and HIV-1: New Insights and interventions // Curr. HIV Res. Apr 2012; 10 (3): 228–237.
- Gouveia A. I., Borges-Costa J., Soares-Almeida L., Sacramento-Marques M., Kutzner H. Herpes simplex virus and cytomegalovirus co-infection presenting as exuberant genital ulcer in a woman infected with human immunodeficiency virus // Clin Exp Dermatol. 2014, Sep 23.
- Gbabe O. F., Okwundu C. I., Dedicoat M., Freeman E. E. Treatment of severe or progressive Kaposi’s sarcoma in HIV-infected adults // Cochrane Database Syst Rev. 2014, Aug 13; 8: CD003256.
- Duggan S. T., Keating G. M. Pegylated liposomal doxorubicin: a review of its use in metastatic breast cancer, ovarian cancer, multiple myeloma and AIDS-related Kaposi’s sarcoma // Drugs. 2011, Dec 24; 71 (18): 2531–2558.
- Hu Y., Qian H. Z., Sun J., Gao L., Yin L., Li X., Xiao D., Li D., Sun X., Ruan Y. et al. Anal human papillomavirus infection among HIV-infected and uninfected men who have sex with men in Beijing // J Acquir Immune Defic Syndr. 2013, Sep 1; 64 (1): 103–114.
- Videla S., Darwich L., Cañadas M. P., Coll J., Piñol M., García-Cuyás F., Molina-Lopez R. A., Cobarsi P., Clotet B., Sirera G. et al. Natural history of human papillomavirus infections involving anal, penile, and oral sites among HIV-positive men // Sex Transm Dis. 2013, Jan; 40 (1): 3–10.
М. В. Нагибина* , 1 , кандидат медицинских наук
Н. Н. Мартынова**, кандидат медицинских наук
О. А. Преснякова**
Е. Т. Вдовина**
Б. М. Груздев***, кандидат медицинских наук
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ГБУЗ ИКБ № 2, Москва
*** МГЦ СПИД, Москва
Социально-экономические, медицинские и климатические особенности жизни населения в Африке, в частности в Эфиопии, создают благоприятные условия для широкого распространения ряда заболеваний, в том числе СПИДа.
Социально-экономические, медицинские и климатические особенности жизни населения в Африке, в частности в Эфиопии, создают благоприятные условия для широкого распространения ряда заболеваний, в том числе СПИДа.
ВИЧ-инфицированию и развитию СПИДа способствует низкий уровень социально-экономического развития страны и материальная необеспеченность населения, отсутствие общегосударственной системы здравоохранения и квалифицированной медицинской помощи, низкий санитарно-гигиенический уровень жизни. Дефицит витаминов и белка в пище, привычка употреблять в пищу сырое мясо (кэтфо и куртцэга), использование для питья воды из открытых водоемов, широкое распространение наркотика из растения чад становятся причинами возникновения протозойных, глистных и других инфекций.
Высокая температура и влажность, интенсивное УФ-излучение, тесный контакт населения с домашними животными также благоприятствуют быстрому распространению инфекций, а также переходу вирусов, микробов и грибов из сапрофитного в патогенное состояние.
ВИЧ-инфекция и СПИД-ассоциированные заболевания представляют существенные трудности для диагностики, т. к. по существу базируются на весьма многообразных клинических проявлениях СПИДа, поражающего многие органы и системы — легкие, желудочно-кишечный тракт, лимфатические узлы, кожу и слизистые оболочки, органы чувств, нервную систему и др. Такие неспецифические симптомы, как лихорадка, головная боль, миалгия, лимфоаденопатия, фотофобия и пр. характерны и для других болезней, вызванных, в частности, вирусами Эпштейна-Барр и Коксаки. Не только клинические, но и лабораторные критерии СПИДа могут быть обнаружены при системной красной волчанке, моноцитозе, вызванном вирусом Эпштейна-Барр (гипергаммаглобулинемия, лимфоаденопатия, увеличение СОЭ и др.). Постановка диагноза «СПИД» затрудняется еще и тем, что, например, туберкулез и криптококковый менингит, являющиеся характерными ассоциированными инфекциями при СПИДе в Африке, наблюдаются и у людей с относительно нормальным состоянием или активированной иммунной системой.
Одним из перспективных способов предупреждения гипо- и гипердиагностики, в том числе псевдо-СПИД, является синдромальный подход, строящийся на клинико-инструментальном выявлении патогенетически связанных комплексов.
В этой связи целью настоящего исследования явилось выявление специфических особенностей кожно-слизистых и висцеральных поражений в динамике СПИД, подтвержденное морфологическими и иммунными параметрами у пациентов в Эфиопии.
Нами в течение 5 лет (с 1993 по 1997 гг.) в поликлинике и госпитале РОКК им. Балча (г. Аддис-Абеба, Эфиопия) наблюдались 1015 ВИЧ-инфицированных и больных СПИД. Среди них в стационаре обследовано 825 (81,2%) и в поликлинике — 119 (18,8%) пациентов; число мужчин составляло 696, женщин — 319. Возраст основной части пациентов колебался от 20 до 60 лет.
Клинический диагноз СПИД первоначально устанавливали на основании больших и малых признаков, предложенных ВОЗ для стран, где серологическая диагностика мало доступна. Для подтверждения диагноза СПИД проводили анализ СПИД-ассоциированных заболеваний.
Методы исследования включали анамнестические данные и клинические наблюдения и инструментальные исследования; использовали рентгенологические и ультразвуковые методы; при необходимости выполняли эзофагогастроскопию и колоноскопию. Всех пациентов осматривали терапевт, дерматолог, офтальмолог, отоларинголог, невропатолог, гинеколог и уролог. Широко использовались лабораторные методы исследования. Помимо общеклинических, применяли серологический тест на ВИЧ-инфекцию (Test for the detection of Antibodies to HIV-1, HIV-2) с чувствительностью по HIV-1 — HIV-2, равной 99,6% и специфичностью HIV-1 — HIV-2, равной 99,7%. Для оценки состояния Т-системы иммунитета у группы из 120 больных определяли общее число лимфоцитов и количество Т-хелперов (CD4 Т-лимфоцитов) с помощью реактива Becton-Dickinson Immunocytometry system CD4 (Leu TM — 3aFJTC), в качестве флюоресцентного красителя использовали изотиоционат.
Клиническая картина СПИДа в значительной степени зависела от стадии болезни, которую в свою очередь определяли по уровню иммуносупрессии. Для распределения больных по стадиям заболевания нами использована классификация В. И. Покровского.
Основная часть больных, обратившихся в поликлинику и госпитализированных, включала пациентов на поздних стадиях СПИДа с выраженными расстройствами жизнедеятельности. В этой связи нами были специально рассмотрены три группы пациентов со СПИД: первая — на стадии начальных клинических проявлений, соответствующая IIIА; вторая — на стадии выраженных клинических проявлений, соответствующая IIIБ; и третья — на завершающей стадии, соответствующая IIIВ и IV. Все группы пациентов сравнивались между собой по СПИД-ассоциированным и индикаторным заболеваниям, а также по уровню CD4 Т-лимфоцитов в периферической крови.
Из табл. 1 следует, что ни у одного больного на данных стадиях СПИДа число CD4 Т-лимфоцитов не превышало 400/мкл (в норме, в среднем, 1000/мкл), а из общего числа пациентов (120 человек) только у 6 больных (5%) количество CD4 T-лимфоцитов составляло 400—300/мкл. Наибольшую по численности группу составили пациенты, у которых число CD4 Т-лимфоцитов было 200—100/мкл — 43 (35,8%); это пациенты со СПИД в основном IIIБ стадии. У большого числа этих пациентов была выявлена завершающая стадия СПИД, т. е. IIIВ и IV. Важно отметить, что с увеличением тяжести СПИД количество больных с числом CD4 Т-лимфоцитов 400—300/мкл снижается с 6 до 0 (в группах со стадиями III В и IV), а количество пациентов, имеющих CD4 Т-лимфоцитов менее 50/мкл, возрастает с 1 до 26 (в группах с теми же стадиями СПИД).
Итак, распределение больных по стадиям СПИД подтверждает прогрессирующее падение числа CD4 Т-лимфоцитов в крови по мере возрастания тяжести болезни. Наши результаты подтверждают данные литературы о том, что содержание CD4 Т-лимфоцитов в крови в целом отражает стадию СПИДа и может быть использовано для прогноза дальнейшего развития заболевания.
На фоне иммунодефицита при уровне CD4 Т-лимфоцитов 300—200/мкл крови в СПИД-ассоциированном комплексе на IIIA стадии кожно-слизистые поражения занимали одно из важных мест (табл. 2).
Патология кожи и слизистых оболочек на стадии начальных клинических проявлений ВИЧ-инфекции наблюдалась в 71,8% случаев (268 из 366 пациентов). Эти поражения носили вирусный, бактериальный, грибковый, паразитарный и аллергический характер. В ряде случаев кожно-слизистые заболевания были первыми и единственными признаками перехода ВИЧ-инфекции в клиническую стадию. Чаще всего указанные заболевания характеризовались слабой выраженностью общих симптомов и сводились к местным изменениям. Клинические проявления этих заболеваний мало отличались от аналогичных нозологических форм у не ВИЧ-инфицированных.
Мы полагаем, что данное явление можно рассматривать как синдром, относящийся к СПИД-ассоциированному комплексу.
На фоне выраженного иммунодефицита при уровне CD4 Т-лимфоцитов 200—100 /мкл крови на IIIБ стадии СПИД кожно-слизистые заболевания встречались еще чаще — 80,6% случаев (у 367 из 455 пациентов), приобретали генерализованный характер и отличались глубиной поражения, упорным рецидивирующим течением, а также резистентностью к терапии. Они сопровождались общими расстройствами.
Некоторые заболевания при этом протекали крайне злокачественно (пиодермии, чесотка, отит) и сочетались с тяжелой висцеральной патологией, а также патологией органов зрения, слуха, мозговыми расстройствами, приводящими даже к гибели. На этой стадии болезни обнаруживались отдельные случаи витилиго, волосатой лейкоплакии, глубоких микозов и саркомы Капоши.
Лимфаденит в стадии IIIБ приобретал ярко выраженный генерализованный характер, нередко обнаруживались гепатоспленомегалия, эндомиоперикардит и другие висцеральные поражения (пневмония, эзофагит, гастрит, энтероколит). Таким образом, наблюдавшийся синдром можно рассматривать как этап в развитии процесса на определенной стадии его течения.
В условиях глубокой иммуносупрессии при уровне в крови СД4 Т-лимфоцитов 50/мкл и менее на завершающих стадиях СПИДа (IIIВ и IV) заболевания кожи и слизистых оболочек присутствовали у всех без исключения пациентов. Причем нередко наблюдались сочетания различных нозологических форм. В основном это были те же заболевания, что и на предшествующей стадии, но они характеризовались крайне злокачественным течением, сочетались с тяжелым поражением висцеральных органов и ЦНС.
На данных стадиях СПИД мы впервые наблюдали случаи токсоплазмоза с выраженной диссеминацией паразита, возникновением энцефалита и других органных поражений.
Таким образом, заболевания кожи и слизистых оболочек могут развиться как первые клинические признаки ВИЧ-инфекции. Они встречаются у большинства больных (71,8 — 100% случаев), диапазон частоты их возникновения зависит от тяжести иммунного дефицита (CD4 Т-лимфоцитов от 300 до 50/мкл и менее) и клинической стадии развития СПИД (от IIIА до IV).
На начальной стадии СПИД (IIIА) кожно-слизистые поражения могут быть не только первыми, но и единственными его клиническими проявлениями; увеличение забрюшинных лимфоузлов в сочетании с очаговыми изменениями селезенки и перикарда является транзиторным синдромом, относящимся к СПИД-ассоциированному комплексу.
Нарастание тяжести и переход в терминальную стадию СПИД способны привести к генерализации кожно-слизистых поражений и усугублению полиорганных расстройств. В этих случаях могут присоединиться гистоплазмоз, токсоплазмоз, глубокие микозы, саркома Капоши, поражения органов чувств.
Читайте также:

