Как предотвратить рецидивы герпеса во время беременности
Обновлено: 25.04.2024
Значение вируса герпеса, как современного фактора бесплодия, широко обсуждается как медицинским сообществом, так и на форумах. Это связано с несколькими причинами.
Основные из них – высокая частота бесплодия у пар, имеющих герпесвирусную инфекцию, а также развитие пороков у плода и тяжелых заболеваний у детей, родители которых инфицированы герпесом. ВПГ (вирус простого герпеса)-2 обнаруживается у 50% беременных. Сама беременность может быть причиной повышения титров антител к ВПГ, причем, активация ВПГ представляет большую опасность для беременных, чем ЦМВ (цитомегаловирус). В последнее время все большее внимание специалистов привлекает проблема бессимптомной ХГИ (хроническая герпетическая инфекция) , при которой антитела к ВПГ 1 и ВПГ 2 выявляются, но выделений вируса не происходит. Это, так называемое, вирусоносительство. Ухудшение иммунных процессов приводит к активации вируса.
Нужно помнить, что наличие ГИ (герпетической инфекции) и повышенного содержания вируса в организме (высокие титры антител) еще без клинического проявления болезни – это свидетельство иммунодефицита.

По данным ВОЗ, в мире до 12% пар страдает бесплодием. В отдельных районах РФ — до 20%, уровень, который характеризуется как критический.
На первый план вышли «новые» патогены устойчивые к антибиотикам, — вирусы и заболеваемость только растет. Особые внимание уделяется 3-м представителям семейства герпсвирусов: ВПГ 1, ВПГ 2 и ЦМВ (цитомегаловирус).
Инфицированность мужчин ВПГ 2 доходит до 49%. После спонтанных абортов (выкидышей) ВПГ обнаруживается в 59% случаев, в то время как % инфицированных матерей составляет 20% (Kulgas, G, 1991г.) т.е. мужской фактор вносит вклад в самопроизвольное прерывания беременности.
У женщин ВПГ 1 обнаруживается в 30% случаев, а ВПГ 2 – у 46%. Генитальный герпес – занимает, по данным ВОЗ, 3-е место среди ИППП (инфекции, передаваемые половым путем) , уступая по частоте лишь гонорее и негонококковым уретритам.
Вывод:
воспалительные изменения в детородных органах женщин с бесплодием, в основном, является следствием ХГИ (хронических герпесвирусных инфекций). Герпесвирусы и продуцируемые ими факторы, вызывают воспаление слизистых оболочек, разрушение эпителия репродуктивных органов и подавление гуморального звена иммунитета – все это приводит к нарушению фертильности и бесплодию. В РФ речь идет о миллионах больных.
В настоящее время, по данным эпидемиологических исследований, до 90% населения инфицировано вирусом простого герпеса (ВПГ). К счастью, несмотря на это, общий прирост рождаемости на планете все же положителен.
Герпес и бесплодие у мужчин
Герпес и бесплодие у мужчин, по данным современных методов исследования, имеют высокую взаимосвязь.
Детальное исследование мужчин с ВПГ показало, что инфицированность спермы приводит к снижению в 2 раза количества сперматозоидов и уменьшению их активности.
Герпес при планировании беременности
На этапе планирования беременности рекомендуется обследование. При выявлении активной инфекции лечение необходимо в период ремиссии. Учитывая серьезное повреждающее действие ВПГ на плод, каждая будущая мама должна подумать сейчас, как обезопасить своего ребенка.
Забеременеть при герпесе – за и против

Опасен ли герпес при беременности? – наверное, один из самых частых вопросов, который задают женщины на приме у врача. Безусловно, наличие инфицированности ВПГ требует более внимательного обследования и наблюдения таких пациенток.
При ГГ ( генитальном герпесе ) поражение плаценты и плода могут возникать на любом сроке беременности и приводить к порокам развития, иммунодефицитным состояниям и к гибели плода, выкидышам, преждевременным родам в связи с тяжелыми изменениями всех трех оболочек плаценты и сосудов пуповины. Внутриутробная ГИ — неуправляемая причина перинатальной смертности, заболеваемости и ранней детской инвалидности.
Важность проблемы обусловлена тем что, ВПГ, в отличие от других инфекционных заболеваний, оказывают деструктивное действие на ткани и органы плода.
Исследование перед проведением ЭКО у женщин с ВПГ показало снижение способности эмбриона к имплантации более чем в 2 раза по сравнению со здоровыми женщинами.
Бессимптомный герпес
Бессимптомный герпес – совсем не редкость. Отсутствие видимых проявлений при генитальном герпесе еще не гарантирует отсутствия самой инфекции. Воспаление влагалища, цервикального канала, эндометрия, придатков матки не исключают ГГ. Еще не так давно полагали, что серьезную угрозу для здоровья современной женщины и ее ребенка представляют только клинически выраженные формы ГГ. Отсутствие клинических проявлений ВПГ-инфекции у беременной инфицированной женщины не препятствует передаче вируса в перинатальном периоде ребенка. В пользу этого утверждения свидетельствуют данные о том, что в 60-80% случаев дети с неонатальным герпесом рождаются от матерей с атипичными или бессимптомными формами течения ВПГ – инфекций (Bursrein D.N. 2003).
При бессимптомном течении вирус герпеса можно определить культуральным и иммуногистохимическим методами, а значит, вовремя принять меры.
- Культуральный метод (выращивание вируса на культуре клеток)
- ПЦР – диагностика на наличие ДНК вируса в эякуляте и его фракциях
- Cпермограмма (определяется количество сперматозоидов, их подвижность, количество нормальных сперматозоидов)
- Исследование популяции незрелых половых клеток в эякуляте
У фертильных мужчин активный ВПГ выявляется в 6-10% случаев при использовании культурального метода и до 47% — при использовании ПЦР-диагностики, т.е. ПЦР более информативная методика.
Как влияет герпес на беременность?
Герпес на ранних сроках беременности достаточно труден для изучения. Наличие большого кол-ва ВПГ в организме женщины свидетельствует о падении иммунной защиты. Как известно, иммунитет нам обеспечивает здоровая нормофлора, т.е. иммунодефицит наступает только в случае дисбактериоза.
Обязательным исследованием у беременных с ВПГ-инфекцией является определение иммуноглобулинов М и G (включено в обязательную программу ведения беременности). При высоких титрах иммуноглобулинов М (говорят о заражении или обострении инфекции) требуется лечение, а беременность не рекомендуется.
Рецидив герпеса при беременности
Если обострение герпеса произошло во время беременности, тактика врача зависит от выраженности обострения. Материнские иммуноглобулины G защищают и маму, и ребенка в большинстве случаев.
Рецидив герпеса при беременности в первом триместре нередко заканчивается ее прерыванием или развитием серьезных пороков и уродств у плода.
Рецидив герпеса при беременности во втором и третьем триместрах может приводить к развитию инфекции кожи и внутренних органов.
Лечение и профилактика герпеса
Медикаментозное лечение сводится к 3 этапам:
- подавлению вспышки или рецидива заболевания с помощью противовирусных (химио) препаратов, интерферонов;
- восстановлению защитных сил организма – иммунитета с помощью общеукрепляющих средств, пробиотиков, витаминов, интерферонов;
- вакцинации антигерпетической вакциной «Витагерпавак».
Чем лечить герпес?
Эффективными противовирусными химиопрепаратами при герпесе являются такие препараты, как ацикловир, а также более эффективные его производные второго поколения: валцикловир, валтрекс, фамцикловир, пенцикловир. Данные препараты имеют сравнимый механизм действия и клиническую эффективность, помогают быстро и эффективно снизить выраженность симптомов, субъективных ощущений, продолжительность рецидива, однако излечить инфекцию (полностью удалить вирус из организма) не могут.
Ацикловир и его аналоги действуют только на активный вирус герпеса, но не влияют на вирусы, находящиеся в латентном состоянии. Общим недостатком ацикловирсодержащих препаратов является неспособность предотвратить рецидивы заболевания и инфицирование родственным типом вируса и негативное действие на состояние иммунитета. Дальнейшее подавление иммунитета приводит к появлению штаммов вируса, устойчивых к данным препаратам.
Противовирусные химиопрепараты используют эпизодически коротким курсом (5-10 дней) при первичном герпесе или при рецидивах герпеса.
При герпесе возможно использовать противовирусные средства местно. Это помогает привести к значительному сокращению сроков появления и регресса высыпаний за счет высокой биодоступности активных веществ в месте поражения. Хорошо зарекомендовали себя Ацикловир (мазь, крем) и новый препарат Пенцикловир (1% крем Фенистил® Пенцивир). Эффективность Фенистил® Пенцивира на 20–30% выше крема на основе ацикловира. Крем Фенистил® Пенцивир может применяться у больных старше 12 лет. При наличии резистентности к ацикловир-содержащим препаратам применяются противовирусные лекарственные средства с другим механизмом действия (фоскарнет, изопринозин, панавир, алоферон и др.).
Во время беременности с целью лечения и профилактики рецидивирования генитального герпеса и инфицирования плода препараты от герпеса в таблетках (Ацикловир, таблетки) назначают, начиная со II триместра беременности по согласованию с врачом.
Наличие побочных эффектов от использования химио препаратов способствовали внедрению в лечение герпеса современных, эффективных и безвредных средств – интерфероновых препаратов. Необходимость назначения интерфероновых препаратов (гиаферон и т.д.), объясняется их способностью подавлять размножение вируса в организме человека. Эффективность Гиаферона на 30% выше эффективности других препаратов этой группы, т.к. содержит и гиалуроновую кислоту – самостоятельный иммуномодулятор. Применение их как противовирусных средств и иммуномодуляторов, обрывая рецидивы болезни и корректируя иммунитет, позволяет их эффективно использовать также и в лечении беременных женщин и кормящих матерей, предотвращать внутриутробное инфицирование плода.
Нужно ли говорить о важности лечения, направленного на укрепление защитных сил и предотвращения рецидива герпеса?
В случаях средне-тяжелых и тяжелых форм заболевания (рецидив 1 раз в 3 месяца и чаще) для повышения эффективности лечения в схемы терапии наряду с противовирусными препаратами включают иммунокорригирующие препараты: иммуномодуляторы, интерфероны, витамины, общеукрепляющие средства, иммуноглобулины и пробиотики. Следует отметить, что иммунотерапия приводит к глубокой ремиссии, т.е. к восстановлению иммунитета, позволяет сократить длительность лечения, снизить токсическое действие на организм химиопрепаратов, предотвратить формирование к ним резистентности и привести к глубокой ремиссии, т.е. к восстановлению иммунитета.
Для повышения эффективности лечения герпесвирусной инфекции группой ученых-вирусологов и инфекционистов во главе с д.м.н., проф. В.А. Исаковым* была разработана поэтапная, комплексная методика лечения и профилактики рецидивирования заболевания с использованием препаратов, охарактеризованных выше:
- 1 этап лечения – купирование острого периода болезни (химиопрепараты, интерфероны),
- 2 этап – общеукрепляющая терапия, иммунокоррекция,
- 3 этап – специфическая иммуннопрофилактика – вакцинация антигерпетической вакциной Витагерпавак,
- 4 этап – диспансерное наблюдение.
Химиопрепараты и интерфероны только подавляют вирус в его активной стадии, а вакцина – лечит, нормализуя иммунную защиту, поэтому относится к группе лечебных вакцин.
Следует отметить, что особое внимание отведено восстановлению иммунологической реактивности организма при помощи медикаментозного и противорецидивного лечения с использованием общеукрепляющих средств, витаминов, интерферонов, пробиотиков, иммуноглобулинов. Иммунопрофилактика на финальном этапе лечения антигерпетической вакциной Витагерпавак позволяет восстановить специфический противовирусный иммунитет, т.е. добиться подавления вируса и нормализации иммунитета, приводящего к длительным (многолетним) ремиссиям. Данная методика получила на западе название «русского метода лечения».
Важно помнить и учитывать что:
- Герпетические инфекции – это следствие нарушенного иммунитета.
- При легких формах заболевания (обострение не чаще 1 раза в 3 месяца) имеется незначительная иммунодепрессия. Поэтому, вакцинацию можно проводить сразу, без общеукрепляющего лечения (через 7-10 дней после заживления герпетических высыпаний с интервалом в 7-10 дней, в количестве 5 инъекций).
- При средне-тяжелых и тяжелых формах заболевания (рецидив 1 раз в 3 месяца и чаще) необходимо устранить тяжелую иммунодепрессию путем назначения общеукрепляющих средств, витаминов, иммуномодуляторов, пробиотиков, а только затем приступить к вакцинации (через 10 дней после заживления высыпаний с интервалом 10 дней в количестве 5 инъекций). Необходимо провести 4 курса вакцинации с интервалом в 3 месяца под прикрытием Гиаферона (1 свеча 2 раза в день ректально – 5 дней).
Эффективность лечения более 86%, что подтверждено результатами ее использования в течении 12 лет и многочисленными исследованиями результативности, проводимыми разнопрофильными ведущими учеными — клиницистами РФ.
Вакцина «Витагерпавак» применяется в период ремиссии заболевания. Цель вакцинации – активация клеточного иммунитета, т.е. его иммунокоррекция.
Динамика клинических показателей у больных рецидивирующим герпесом в ходе вакцинотерапии
| Клинические показатели | До вакцинотерапии | После вакцинотерапии |
|---|---|---|
| Длительность ремиссии | 2 месяца | 6 месяцев у 36-ти (59,0 %) пациентов |
| Частота рецидива | 5–10 раз в год | 2–3 раза в год |
| Длительность рецидива | 3–8 дней | 2–3 дня |
В выше упомянутых исследованиях было также показано, что проведение вакцинации сопровождалось увеличением в 3-4 раза специфических реакций Т-клеточного иммунитета, на фоне неизменного уровня В-клеточных реакций иммунитета. Изучение реакций Т-клеточного иммунитета показало увеличение специфической Т-киллерной активности лимфоцитов и активности NK-клеток. Вакцинация способствовала прекращению вирусемии как после окончания вакцинации, так и в отдаленные сроки наблюдения (через 6 мес).
Вакцинация с использованием Витагерпавак приводила к выраженному иммунокорригирующему эффекту, снижая иммунные расстройства с 3-ей и 2-ой степеней до 1-й. Спустя 6 мес. после вакцинации иммунные расстройства соответствовали 1-ой степени.
Приведенные выше результаты многолетних исследований вакцины Витагерпавак свидетельствуют о достоверной эффективности вакцины в профилактике рецидивов герпетической инфекций на фоне активации реакций клеточного иммунитета и специфической десенсибилизации.
Как лечить герпес используя вакцину Витагерпавак?
Базовая схема вакцинации с использованием вакцины «Витагерпавак»: 0,2 мл вакцины вводят внутрикожно в сгибательную поверхность предплечья. Цикл вакцинации состоит из 5 инъекций, которые проводят с интервалом в 7-10 дней. Для стойкого профилактического эффекта необходимо проведение повторных курсов вакцинации. В случае появления герпетических высыпаний промежутки между инъекциями следует увеличить до 14 дней. Через 6 месяцев проводится ревакцинация (5 инъекций). При тяжелых формах болезни ревакцинация проводится через три месяца 4 курса в течении 1,5 — 2 лет.

Вакцина для профилактики хронической герпесвирусной инфекции.
1 упаковка — полный курс лечения.
Курс вакцинации: 5 инъекций, которые проводят с интервалом в 7-10 дней
Хранить при температуре 2-8 ºС. Допускается транспортирование препарата при температуре 9-18 ºС, но не более 3-х суток.
Для повышения эффективности лечения и профилактики рецидивов генитального герпеса у лиц с ослабленным иммунитетом, наряду с медикаментозным лечением, необходимо уделять внимание укреплению защитных сил организма. Особое внимание стоит также уделить профилактике факторов, способствующих снижению иммунитета и обострению герпетической инфекции.
Кратко о вакцине Витагерпавак:

Состав:
— Препарат представляет собой лиофилизат для приготовления раствора для внутрикожного введения
— Содержит специфические инактивированные антигены вируса простого герпеса I и II типа, выращенного на перевиваемой линии клеток VERO, допустимых ВОЗ в качестве субстрата для производства вакцин
- Вакцинации подлежат больные с ХГИ.
- Подготовка женщин, имеющих в анамнезе рецидивы хронической герпетической инфекции, к беременности.
- ВИЧ-инфицированые пациенты в 1-2 стадии болезни.
Противопоказания к применению вакцины:
- Активная стадия герпеса
- Острые инфекционные и неинфекционные заболевания
- Хронические заболевания в стадии обострения или декомпенсации
- Злокачественные новообразования
- Беременность
- Наличие активной симптоматики СПИДа
Вакцинация против герпеса проводится в учреждениях под контролем врача
- Вакцина вводится в стадии ремиссии через 7-10 дней после исчезновения клинических проявлений
- Курс вакцинации состоит из 5-и инъекций с промежутком в 7-10 дней
- Ревакцинация — через 6 месяцев
- При осложненном герпесе 2-ю и следующие инъекции вводят с интервалом в 10-14 дней – 5 инъекций. Таким пациентам рекомендуется провести 4 курса вакцинации в течение 1,5 — 2-х лет.
Подробную информацию о вакцине Витагерпавак и ее использовании можно получить из Методических рекомендаций МЗ3.3.1.0002-10 «Иммунизация вакциной «Витагерпавак» (герпетическая культуральная инактивированная сухая) для профилактики рецидивов инфекции, обусловленной вирусами простого герпеса 1 и 2 типов», утвержденных Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Главным государственным санитарным врачом РФ Онищенко Г.Г. **** Данные рекомендации вступили в силу в 2010 г.
Вакцинация – наиболее эффективное средство при частых обострениях герпетической инфекции.
Вакцинация необходима перед планированием беременности.
Ее основная задача — сформировать нормальный иммунный ответ и предупредить обострение герпесвирусной инфекции во время беременности.
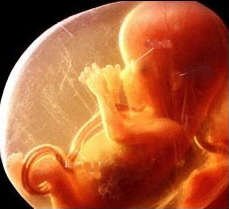
Вирусные инфекции приобретают особую актуальность в период беременности, так как могут влиять на здоровье не только будущей мамы, но и плода. Герпес среди них занимает одно из главных мест, поскольку это заболевание очень часто встречается у беременных женщин.
Герпетическая инфекция - это большая группа инфекционных заболеваний, вызываемых вирусами герпеса человека. Это одно из наиболее распространенных заболеваний человека. По данным многочисленных исследований, к 18 годам более 90% населения планеты инфицируются одним или несколькими штаммами вирусов герпеса. Среди инфекций, передающихся половым путем, генитальный герпес занимает второе место после трихомониаза.
Особенностью герпеса является его рецидивирующее течение. Находящийся в спящем состоянии вирус пробуждается при снижении иммунитета, а беременность сама по себе обладает свойством ослабления иммунных сил организма, так как организм женщины вынашивает наполовину чужеродный с иммунологической точки зрения плод, что невозможно без снижения интенсивности работы ряда звеньев иммунитета. Именно поэтому обострения герпеса во время беременности происходят довольно часто.
Многие беременные, обнаружив у себя пузырьковые высыпания, впадают в панику, тревожась о том, не повредит ли инфекция малышу. Чаще всего о наличии герпеса женщины знают еще до наступления беременности, и появление зудящих пузырьков, наполненных прозрачной жидкостью, говорит о «возрождении» заболевания. Но, к счастью, опасное влияние герпеса несколько преувеличено, и существует не так много ситуаций, когда герпес может стать причиной проблем при беременности.
Проявления заболевания
Клинические проявления герпеса зависят от многих факторов - типа вируса, локализации поражения, возраста и иммунного статуса человека. Классическая симптоматика - это появление группы мелких пузырьков, наполненных прозрачной жидкостью. Для герпеса характерно появление пузырьков при очередном рецидиве всегда в одном и том же месте.
При локализации в верхней половине туловища высыпания возникают преимущественно на губах (так называемая «простуда»), а также на слизистой носа, рта, конъюнктиве глаз, в области слухового прохода и на веках.
При генитальном варианте герпеса высыпания локализуются на половых губах, на коже промежности, внутренней поверхности бедер, лобке или вокруг заднего прохода.
За нес¬колько дней до появления сыпи может быть ощущение зуда и дискомфорта в месте будущих высыпаний (герпетический «звоночек»).
Сыпь сопровождается неприятными ощущениями, зудом, жжением, болью. Затем пузырьки лопаются, на их месте образуются сначала язвочки, затем корочки. Герпетические язвочки характерно болезненны, а образующиеся на их месте корочки исчезают бесследно через 2—3 дня, не оставляя на коже ни пигментации, ни рубцов.
Общая симптоматика заболевания весьма разнообразна: повышение температуры тела, увеличение лимфатических узлов (чаще – паховых), суставная и мышечная боли, упорные мигрени, раздражительность, отсутствие аппетита и т.д.
Типичная клиническая картина проявляется не более чем в трети случаях носительства генитального герпеса. Нередко генитальный герпес протекает бессимптомно или без характерных высыпаний.
Атипичное течение герпеса более коварно: отсутствие пузырьковых высыпаний с лихвой компенсируется многообразием общих проявлений, что часто создает трудности в постановке верного диагноза. Симптомы атипичного герпеса - жжение, трещины промежности, поло¬вых губ или заднего прохода, отек, покраснение слизистых оболочек. В таких случаях часто диагноз ставится неверно либо женщины, уверенные в наличии кандидоза (молочницы) или бактериального вагиноза, безрезультатно занимаются самолечением.
Тяжесть любых проявлений герпетической инфекции определяется состоянием иммунитета.
Разновидности вируса
Наиболее распространенными являются ВПГ 1 и 2 - вирус простого герпеса первого и второго типов. ВПГ 1 чаще всего проявляется в виде пузырьковых высыпаний на губах, возможны поражения глаз, ротовой полости, носа. Классическая локализация ВПГ 2 (генитального герпеса) - слизистая оболочка мочеполового тракта. В некоторых случаях наблюдается следующий феномен перекрестного инфицирования: виновником герпетических высыпаний верхней половины туловища является ВПГ 2 (генитальный) и наоборот - ВПГ 1 вызывает развитие инфекции нижней половины. Как правило, это связано с двумя причинами: нарушением элементарных правил гигиены, когда происходит самозаражение - перенос вируса через кожу и слизистые оболочки, и орально-генитальными контактами.
Заражение герпесом половых путей происходит в основном только через незащищенный половой контакт. В редких случаях возможна передача инфекции через поцелуй, использование общей посуды и белья. Это так называемый горизонтальный путь передачи. При вертикальном пути передачи происходит передача вируса от матери плоду во время беременности (при прохождении ребенка через родовые пути при условии наличия в слизистой вируса герпеса, то есть при родах в момент обострения герпес-вирусной инфекции). При локализации очагов на губах можно заразиться через общую посуду, полотенца и поцелуи. Надо отметить, что риск внутриутробного инфицирования плода при первичном герпесе составляет 50%, при рецидиве – не более 4%, во время родов при наличии высыпаний на шейке матки и наружных половых органов – 90%.
Как действует вирус?
Рассмотрим некоторые особенности взаимодействия вируса с организмом человека.
- Попадая в клетку, вирус герпеса (впрочем, как и любой другой вирус) проникает в ее ядро и заставляет клетку человека производить вирусы герпеса. Таким образом, клетка человека «собственноручно» производит новые поколения вирусов.
- Вирус простого герпеса (ВПГ) распространяется по организму по нервным волокнам. Для проведения периода простоя (ремиссии), когда человек никак не ощущает наличия вируса в организме, вирус выбирает нервные сплетения - ганглии. И проводит там время в ожидании снижения иммунитета хозяина. В этот период носительство герпеса никак не проявляется и обнаружить его практически невозможно. ВПГ первого типа депонирует в тройничном ганглии (это особое сплетение нервных волокон, находящееся в полости черепа), а ВПГ второго типа - в крестцовых ганглиях (нервных сплетениях органов малого таза).
При наступлении благоприятных для вируса условий (переохлаждение, стресс, беременность) происходит его выход и дальнейшее распространение по коже и слизистым оболочкам. - Под влиянием различных факторов, повреждающих иммунную систему, возможно ослабление контролирующих механизмов «хозяина» (организма человека) и переход к активному размножению вируса – так развивается рецидив, что проявляется обострением герпеса.
Обострения герпеса могут быть связаны с двумя факторами:
- уже имеющимся иммунодефицитом, что является пусковым механизмом для рецидива герпетической инфекции;
- влиянием вируса на сам иммунитет. Длительное нахождение герпеса в организме обладает прямым повреждающим действием на клетки иммунной системы. Таким образом, развивается порочный круг: ослабленный иммунитет запускает рецидив герпетической инфекции, а вирус герпеса еще более усугубляет имеющийся иммунодефицит.
Диагностика
Диагностика герпеса при типичной картине не представляет сложности для врача (да и для пациента тоже). Клинические проявления герпетической инфекции весьма яркие: характерные пузырьковые высыпания, рецидивирующее течение говорят сами за себя.
В случаях атипичного герпеса, вирусоносительства и при профилактическом обследовании методы лабораторной диагностики приобретают особое значение.
Основные направления лабораторных методов исследований:
- Определение непосредственно самих вирусных частиц. Для этого используются методы электронной микроскопии с использованием специальных методов окрашивания мазков, ИФА (иммуноферментный ана¬лиз) и ПЦР. Последний метод (полимеразная цепная реакция) широко распространен и дает достаточно точные результаты - он доступен, высокочувствителен, специфичен. Как правило, материал для анализа ПЦР берут путем соскоба (мазка) с шейки матки, влагалища, уретры, также исследуют соскоб со дна ранки или содержимое пузырька. При подозрении на скрытое течение инфекции исследуют еще мочу и слюну.
- Исследование крови на антитела к вирусу простого герпеса, при котором выявляется иммуноглобулины классов М и G. Если заражение человека произошло впервые (первичное инфицирование) или в момент диагностики соответствует острой фазе заболевания (рецидив), то в крови обнаруживают ранние антитела класса М.
Определение поздних иммуноглобулинов класса G свидетельствует о том, что встреча организма с вирусом уже произошла много ранее.
Особое внимание уделяется лабораторной диагностике в случае впервые выявленных симптомов герпеса при беременности. Такая ситуация может отвечать как первичному эпизоду, так и первому рецидиву (т.е. ранее организм уже встречался с вирусом, но проявлений не давал).
Если в крови есть IgG (поздние иммуноглобулины), значит, герпес рецидивирующий и угрозы для плода или эмбриона практически нет. Если в крови нет Ig, а есть IgМ, то необходимо проявить крайнюю степень настороженности, поскольку это является лабораторным подтверждением первичного эпизода.
Генитальный герпес и беременность
Особую же актуальность в период беременности приобретает именно генитальный герпес.
Во время беременности происходит мощная перестройка всех систем, в том числе и иммунитета. Беременность сама по себе является физиологическим иммуносупрессивным фактором, т.е. происходит закономерное снижение защитных свойств организма с целью предотвращения выкидыша. Обратной стороной такого иммунологического отступления является манифестация ранее «дремлющих» инфекций, в том числе генитального герпеса.
Очевидно, что при возникновении проблемы герпеса у будущей мамы появляется масса волнений. К счастью, в большинстве случаев эти тревоги безосновательны.
Когда же действительно есть повод для волнений? Наибольшую опасность представляет ситуация, когда заражение герпесом происходит у женщины во время беременности - первичный эпизод генитального герпеса. Такая ситуация характеризуется выраженными проявлениями, т.к. в организме матери нет защищающих от герпеса антител. Для плода риск особенно высок при заражении генитальным герпесом в первом и третьих триместрах. Инфицирование плода в первом триместре беременности приводит к возникновению гидроцефалии (накоплению жидкости в головном мозге), пороков сердца, аномалий развития желудочно-кишечного тракта и др. Такие случаи чрезвычайно редки, так как при первичном эпизоде герпеса, как правило, происходит самопроизвольное прерывание беременности до срока 10 недель.
Лечение герпеса во время беременности
При доказанном первичном инфицировании на ранних сроках беременности обсуждается вопрос о ее прерывании.
Лечение рецидивов герпеса во время беременности и вне ее не имеет принципиальных различий. В любом случае преследуются одинаковые цели: снижение выраженности симптомов (боль, зуд, лихорадка и т.д.), сокращение сроков заживления ран, предотвращение новых обострений. Следует помнить, что чем скорее начато лечение, тем больший эффект оно будет иметь. Если лечение начато в продромальный период (когда появляются начальные признаки заболевания – покалывание или легкий зуд на месте будущих пузырьков, озноб, недомогание), то это достоверно поможет снизить выраженность проявлений герпеса.
Особенностью лечения герпетической инфекции является точное соблюдение назначенной дозы и режима приема препаратов. Если пропущена очередная доза противовирусного препарата, то вирус герпеса может успеть в этот период размножиться, что приведет к неэффективности лечения.
Единственными препаратами, обладающими доказанной эффективностью в лечении герпетической инфекции, являются специфические виростатики – аналоги нуклеозидов (АЦИКЛОВИР, ВАЛАЦИКЛОВИР, ПЕНЦИКЛОВИР, ФАМЦИКЛОВИР).
Лечение герпетической инфекции при беременности подразумевает использование разрешенных противовирусных препаратов (ацикловир ЗОВИРАКС и валацикловир ВАЛТРЕКС) в виде мазей, кремов и таблеток.
Одновременно с противовирусными препаратами в комплексном лечении используют иммуномодуляторы (ВИФЕРОН), витамины, физиотерапевтические методы, местные антисептики для более быстрого заживления ранок.
Безусловно, целесообразность и курс лечения определяются в каждом индивидуальном случае. Ситуация сочетание беременности и герпеса должна находится под бдительным контролем врача и самолечение в этих случаях просто недопустимо.
Герпес новорожденных
В каких же случаях коварный вирус все-таки достигает своей цели и вызывает заболевание у новорожденных? В подавляющем большинстве случаев (90%) заражение происходит контактным путем при прохождении через родовые пути. Внутриутробное заражение новорожденного отмечается только в 5% случаев герпеса новорожденных. Причем важным условием является наличие у мамы именно первичного эпизода гениального герпеса, в случаях бессимптомного носительства или рецидивирующего герпеса инфицирование плода в родах случается не чаще, чем в 4% случаев.
Симптомы и признаки герпеса у младенцев появляются уже на 2-й неделе после рождения. Для герпеса новорожденного характерно наличие пузырьков на коже, слизистых оболочках (полости рта, половых органов) и конъюнктиве глаз. Чем более недоношенными рождаются дети, тем более сложнее протекает инфекция; в таких случаях часто встречается поражение головного мозга (герпетический энцефалит).
Профилактика
Специфических методов профилактики герпеса, к сожалению, не существует. Профилактика инфекции на этапе планирования, при беременности и после родов носит исключительно предупредительный характер. Применяются следующие меры:
Московский областной НИИ акушерства и гинекологии
НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи, Москва
Московский областной НИИ акушерства и гинекологии
Современные подходы к определению лечебной тактики при герпес-вирусной инфекции у беременных
Журнал: Российский вестник акушера-гинеколога. 2015;15(6): 92‑95
Московский областной НИИ акушерства и гинекологии
Цель исследования — уточнение эффективности иммунотерапии рекомбинантным интерфероном α-2b человека (вифероном) герпесвирусной инфекции у беременных на основе сопоставления диагностических результатов и клинических данных, а также состояния новорожденных. Материал и методы. Обследованы 69 беременных с герпесвирусной инфекцией, которые получали комплекс стандартной базисной терапии, и 62 беременные, которые в дополнение к этой терапии получали курсы лечения вифероном. Проведено определение маркеров герпесвирусной инфекции в динамике, начиная со II триместра беременности и до родов, оценивалось состояние детей, родившихся у этих матерей. Использовались быстрый культуральный метод, молекулярно-биологические и серологические исследования. Результаты. Установлено, что виферон является высокоэффективным препаратом, оказывая противовирусное, иммуномодулирующее, антипролиферативное и антиоксидантное действие на системном и локальном уровнях. Это подтверждается отсутствием структурных изменений в ЦНС у новорожденных, матерям которых проводилась антенатальная иммунокоррекция вифероном, а также отсутствием морфологических признаков гематогенного инфицирования в последах пациенток этой группы. Заключение. Целесообразно планирование беременности у женщин с герпесвирусной инфекцией после тщательного их обследования и проведения терапии уже на этапе прегравидарной подготовки. Авторы информируют об отсутствии конфликта интересов.
Московский областной НИИ акушерства и гинекологии
НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи, Москва
Московский областной НИИ акушерства и гинекологии
Плацентарная недостаточность (ПН) — это синдром, имеющий морфологические и функциональные проявления. К основным морфологическим его проявлениям можно отнести гипоплазию плаценты, редукцию ее сосудистого русла и отсутствие в сосудистом русле плаценты компенсаторных реакций. Что касается функциональных проявлений, то это, прежде всего, повреждения ЦНС у плода гипоксически-ишемического и инфекционного генеза [1].
Инфекционный процесс вызывает развитие ряда патологических и компенсаторно-приспособительных реакций у беременной. К их числу относятся индукция аутоиммунных процессов и депрессия иммунного ответа. Это усугубляет патологическое влияние инфекции на организм матери и плода, создавая порочный круг [2]. В результате снижается устойчивость фетоплацентарного комплекса (ФПК) и к инфекционным агентам, и к условно-патогенным микроорганизмам.
Известно, что течение и исход заболевания зависят от скорости включения в процесс противоинфекционной и в первую очередь противовирусной защиты организма — системы интерферона (ИФН). Нарушение функционирования системы ИФН у беременных со смешанной урогенитальной инфекцией (УГИ), значительная частота перинатальных осложнений, в том числе ПН и внутриутробной инфекции (ВУИ), ассоциированных с нарушением интерфероногенеза, недостаточная эффективность традиционных методов лечения больных со смешанными инфекциями являются несомненным основанием для разработки вопросов интерферонотерапии в акушерстве.
На основе ИФН-α создан целый ряд лекарственных средств [3], одно из которых — препарат «Виферон». В его состав включены α-2b-ИФН и антиоксиданты: аскорбиновая кислота и токоферола ацетат. Виферон — первый препарат интерферона, разрешенный к применению у беременных, начиная со II триместра беременности.
Герпетическая инфекция создает серьезный риск внутриутробного инфицирования плода и неблагоприятного исхода беременности: до 30% спонтанных абортов в ранние и более 50% — в поздние сроки гестации, развитие неврологических, соматических и эндокринных проблем у новорожденных и детей более старшего возраста. Известно, что серьезную угрозу для здоровья беременной и ее ребенка представляют не только клинически выраженные, но и так называемые инаппарантные формы инфекции, для выявления которых требуются комплексные исследования [2, 4, 5].
Цель настоящего исследования — уточнение эффективности иммунотерапии рекомбинантным интерфероном α-2b человека (вифероном) при герпесвирусной инфекции у беременных на основе сопоставления диагностических результатов и клинических данных, а также состояния новорожденных.
Материал и методы
Проспективно наблюдались и были обследованы 131 беременная, их плоды и новорожденные. Все обследованные были разделены на две группы. В 1-ю группу были включены 69 беременных с герпесвирусной инфекцией, которые наблюдались во время беременности и получали комплекс стандартной базисной терапии (вазоактивные препараты, витамины, препараты железа); 2-я группа — 62 беременные, которые в дополнение к базисной терапии получали виферон. В эту группу были отнесены беременные, у которых вирус либо его присутствие в организме (ДНК) обнаруживались хотя бы одним из вирусологических методов исследования. Основной противовирусный и противомикробный курс предполагал назначение препарата «Виферон», суппозитории ректальные 500 000 МЕ, по 1 свече 2 раза в день в течение 10 дней, затем по 1 свече 2 раза в день 2 раза в неделю (5 лечебных дней). Всего на курс использовалось 30 свечей. Каждые 4 нед проводились стабилизирующие курсы. С этой целью назначался виферон, суппозитории ректальные 150 000 МЕ по 1 свече 2 раза в день в течение 5 дней (10 свечей на курс). Стабилизирующие курсы повторялись на протяжении всего гестационного периода.
Проведено определение маркеров инфекции вирусом простого герпеса (ВПГ) в динамике, начиная со II триместра беременности и до родов. Кроме того, оценивалось состояние детей, родившихся у ВПГ-инфицированных матерей. Обследование проводилось в 3 этапа: в сроке гестации 14—22 нед, через 4 нед после скрининга и накануне родоразрешения. После рождения аналогичные исследования были проведены у новорожденных [6].
В составе комплексного обследования проводились вирусологический быстрый культуральный метод — БКМ, молекулярно-биологические (полимеразная цепная реакция ПЦР, полимеразная цепная реакция в реальном времени — ПЦРrt) и серологические исследования (твердофазный иммуноферментный анализ —mИФА). БКМ был использован для определения ВПГ с использованием клеток линии VERO. Материалом для исследований служили образцы мочи, крови и урогенитальных соскобов. На всех этапах исследования план обследования оставался без изменений [4].
Результаты
Возраст пациенток варьировал от 18 до 37 лет, при этом во 2-й группе они были в среднем на 4,5 года старше. Анамнез пациенток обеих групп характеризовала высокая частота вирусных и интеркуррентных инфекций. Наиболее часто встречались ветряная оспа (до 65%), ОРВИ (до 45%), грипп (до 80%). Экстрагенитальные заболевания, определяющие высокий риск инфекционно-воспалительных заболеваний (ИВЗ), встречались с частотой от 6 до 29%. Кроме того, соматический анамнез обследованных отягощали эндокринные заболевания (до 6,5%), заболевания желудочно-кишечного тракта (до 20%), сердечно-сосудистой системы (до 29%) и органов зрения (до 25%). Гинекологические заболевания также встречались с высокой частотой: 77 и 97%. Обследование на наличие ИППП выявило высокую инфицированность — 58%. Единственный возбудитель УГИ встречался у 30%.
Анализ репродуктивной функции показал, что первородящих среди обследованных было 55% в 1-й и 39% во 2-й группе. В то же время первобеременных в 1-й группе было 35%, а во 2-й — 27%. Только у обследованных 2-й группы в анамнезе были отмечены ранние репродуктивные потери (8,1%). Поздние репродуктивные потери во 2-й группе также встречались в 3 раза чаще, чем в 1-й. Неблагоприятный для наступления и развития беременности фон способствовал росту частоты гестационных осложнений: угроза прерывания беременности (44,9 и 48,4%), синдром задержки роста плода (СЗРП) (10,8 и 23,3%), многоводие (23,1 и 20%), маловодие (в 2-й группе у 5%), анемия (5,8 и 12,9%), преэклампсия (7,3 и 11,3%).
В 1-й группе самопроизвольные роды произошли у 77%, кесарево сечение произведено 23% беременных из числа обследованных. При этом у 5,8% роды были преждевременными. Во 2-й группе у 68% женщин роды произошли через естественные родовые пути, но в 5% наблюдений завершились путем вакуум-экстракции плода в связи с начавшейся острой гипоксией. Кесарево сечение было произведено в 32% наблюдений. Преждевременных родов во 2-й группе было в 2,2 раза больше (12,9%).
На первом этапе обследования был проведен сравнительный анализ частоты выявления прямых маркеров ВПГ — инфекционной активности вируса и ДНК ВПГ. Пациентку считали инфицированной, если маркер вируса был обнаружен хотя бы в одном изученном клиническом материале. Ни у одной из этих женщин во время обследования не было обнаружено каких-либо клинических проявлений генитального герпеса. С помощью БКМ инфекционный вирус был обнаружен у 4% женщин. Различия в частоте выявления ДНК ВПГ по сравнению с инфекционно-активным вирусом были статистически значимыми (p<0,05).
По мере увеличения гестационного срока частота обнаружения вируса или его ДНК у беременных 1-й группы увеличивалась. Только при высоком уровне ИФН-α сыворотки вирус не обнаруживался в организме. Это свидетельствует о том, что базовая терапия в сочетании с возможностями факторов неспецифической резистентности организма не может во всех случаях служить противовирусной защитой. Только изначально высокие уровни интерферонов создают условия, препятствующие рецидиву герпесвирусной инфекции во время беременности.
У беременных 2-й группы при проведении скрининга показатели были неоднородны. На фоне виферонотерапии отмечалась явная тенденция к стабилизации показателей, что наиболее четко прослеживалось на примере интерферонов. Что касается сопоставления с вирусологическими данными, то по мере прогрессирования беременности частота обнаружения вируса или его присутствия снижалась. На этапе 3-го визита вирусологическими методами ни вируса, ни его присутствия в организме обнаружено не было [4].
Интерфероны — семейство белков, вырабатываемых клетками в ответ на вирусную инфекцию и другие стимуляторы. Они блокируют репликацию вирусов в других клетках и участвуют во взаимодействии между клетками иммунной системы. Функционирование системы ИФН играет определенную роль в формировании акушерских и перинатальных осложнений при наличии связей системы ИФН с иммунной, нервной и эндокринной системами, показатели интеферонового статуса (ИФС) могут быть использованы как для оценки уровня неспецифической резистентности организма, так и для анализа комплекса адаптационных реакций.
Системное применение интерферонотерапии в акушерской практике разработано и впервые применено в Московском областном НИИ акушерства и гинекологии [2]. Виферон производится в виде ректальных свечей четырех дозировок: 150 000 МЕ, 500 000 МЕ, 1 000 000 МЕ, 3 000 000 МЕ. У беременных разрешено применение низких доз препарата: 150 000 МЕ и 500 000 М.Е. Кроме того, ООО «ФЕРОН» выпускает виферон в виде мази и геля, эти формы выпуска препарата также разрешены к применению у беременных на любом сроке гестации и в период лактации.
При разработке принципов интерферонотерапии при смешанных УГИ было выявлено, что ректальное применение препарата «Виферон» способствует более длительной циркуляции ИФН в крови по сравнению с внутривенным и внутримышечным введением. Снижение уровня сывороточного ИФН через 12 ч после введения препарата «Виферон» обосновывает необходимость его повторного введения. В первые 3—4 ч после введения действует непосредственно сам препарат, а второй подъем концентрации сывороточного ИФН обусловлен активацией эндогенной системы ИФН. Иными словами, продукты метаболизма препарата играют роль индукторов ИФН и обусловливают вторую, более длительную фазу действия препарата.
При ведении беременности у женщин с ИППП для профилактики ВУИ, а также для лечения ПН, как правило, формирующейся на фоне инфекционного поражения, виферон применяется с высокой эффективностью, а, обладая противовирусными, иммуномодулирующими, антипролиферативными и антиоксидантными свойствами, реализует свое действие как посредством общего эффекта, так и локально. Общий эффект препарата ассоциируется с повышением фагоцитарной активности лейкоцитов, коррекцией иммуноглобулинов, содержания основных классов, влиянием на ИФС. Локальный эффект виферона связан с восстановлением микробиоценоза влагалища: уменьшением колонизации родовых путей условно-патогенными микроорганизмами, герпесвирусами, хламидиями.
Отрицательного влияния на растущий организм плода виферон не оказывает. В зависимости от типа ИФС могут быть предложены различные схемы для оптимизации общего эффекта препарата. Если нет возможности исследовать тип ИФС, то препарат назначается с 14-й недели беременности.
Согласно результатам проведенного исследования виферон, подавляя вирусную активность, дает возможность оптимизировать продукцию ИФН, а именно: усилить синтез при низкой концентрации в среде и снизить при высокой концентрации. Подобная регуляция обеспечивает оптимальную противовирусную защиту, о чем свидетельствуют данные ПЦР и культуральной диагностики накануне родоразрешения беременных, получавших виферон.
Анализ перинатальных исходов свидетельствовал о том, что у новорожденных, родившихся у матерей 2-й группы, признаки ФПН встречались чаще, и это закономерно, поскольку в I триместре беременности у беременных этой группы имелась реактивированная герпетическая инфекция. Различная степень задержки роста плода и внутриутробной гипотрофии диагностирована у 24,6% новорожденных матерей 1-й группы и у 40% детей матерей 2-й группы. В состоянии легкой асфиксии новорожденные у матерей, получавших виферон, также рождались чаще: 15% против 4,6%. В то же время на 5-й минуте жизни новорожденные матерей 2-й группы чаще оценивались по шкале Апгар на 8 баллов (13,9% против 8,3%), что косвенно свидетельствует о том, что адаптационно-компенсаторные возможности у новорожденных возрастают на фоне проведения антенатальной коррекции препаратом «Виферон» [6].
В раннем неонатальном периоде тяжесть состояния новорожденных в основном определялась степенью перинатального повреждения ЦНС. В 1-й группе симптомы перинатального повреждения ЦНС выявлены у 13 (20%) новорожденных, у 10 из них имелось гипоксически-ишемическое повреждение, а у 3 (4,6%) обнаружены структурные нарушения в виде перивентрикулярных кист. Во 2-й группе симптомы повреждения ЦНС были выражены в меньшей степени. У 9 (15%) новорожденных при проведении нейросонографии обнаружено гипоксически-ишемическое поражение мозга. К 7—10-м суткам жизни нейросонографическая картина нормализовалась.
В 1-й группе ВУИ выявлена у 10 (15,4%) новорожденных: у 2 — внутриутробные пневмонии, у 4 — везикулез, у 2 — конъюнктивит, у 2 — ВУИ без установленного очага. Во 2-й группе выявлено 5 (8,3%) случаев ВУИ: у одного недоношенного ребенка (33 нед гестации) пневмония на фоне тяжелого течения синдрома дыхательных расстройств и у 4 новорожденных — везикулез. По данным микробиологических исследований, отделяемого из зева и ануса у новорожденных, родившихся у матерей 2-й группы, положительные результаты роста условно-патогенной микрофлоры получены в 6,8% наблюдениях. Число положительных результатов такого роста в 1-й группе составило 49,3%.
По результатам патоморфологических исследований, признаки восходящей инфекции обнаружены в 13 (20%) последах пациенток 1-й группы и в 22 (36,7%) — 2-й группы. Признаки гематогенной инфекции наблюдались только в 13 (20%) последах пациенток 1-й группы, что также свидетельствует об эффективности применения виферона во время беременности у пациенток группы инфекционного риска.
Преобладание структурных изменений в ЦНС у новорожденных, родившихся у матерей 1-й группы, при наличии герпесвирусной инфекции у матерей позволяет предположить перенесенную ВУИ. Отсутствие структурных изменений в ЦНС у новорожденных, матерям которых проводилась антенатальная иммунокоррекция препаратом «Виферон», а также отсутствие морфологических признаков гематогенного инфицирования в последах пациенток этой группы позволяет заключить, что виферон является эффективным противовирусным препаратом.
Выводы
1. Рекомбинантный интерферон α-2b человека (виферон) оказывает регулирующее влияние на синтез ИФН, что обеспечивает оптимальную противовирусную защиту. Данные вирусологической диагностики и оценка состояния новорожденных также подтверждают эффективность виферонотерапии у беременных с герпесвирусной инфекцией.
2. Отсутствие неспецифического влияния препарата на функционирующий ФПК подчеркивает необходимость планирования беременности у женщин с герпесвирусной инфекцией после тщательного обследования и проведения терапии уже на этапе прегравидарной подготовки.
Для цитирования: Михайлова О.И., Карапетян Т.Э. Прегравидарная подготовка и профилактика рецидивов у женщин с герпетической инфекцией. РМЖ. Мать и дитя. 2014;22(19):1402.
Анализ медицинской литературы последних лет показывает неослабевающий интерес акушеров-гинекологов к проблеме вирусной инфекции вообще и герпетической инфекции в частности. По данным различных авторов, вирус простого герпеса (ВПГ) является одной из основных причин осложненного течения беременности, внутриутробной и перинатальной инфекции [2, 8, 13]. Несмотря на неоднозначное мнение различных исследователей относительно роли этого вируса в частоте перинатальных осложнений, бесспорным является тот факт, что в современных условиях ВПГ представляет весьма многогранную медико-социальную проблему [1, 3, 6].
По-прежнему у практикующих врачей часто возникают определенные сложности при ведении беременности и родов у женщин с герпетической инфекцией [4, 12]. Одним из решающих этапов в комплексе профилактических мероприятий у данного контингента пациенток является их адекватная прегравидарная подготовка с правильным подбором всех современных методов медикаментозной коррекции.
Возбудителем герпетических заболеваний половых органов является ВПГ – облигатный внутриклеточный паразит, принадлежащий к подсемейству α-вирусов в семействе герпес-вирусов. Идентифицировано два серотипа данного вируса: первый тип (ВПГ-1) поражает преимущественно кожу и слизистую оболочку губ, глаз, носа и др.; второй тип (ВПГ-2) является возбудителем генитального герпеса. Развитие последнего возможно также и при возникновении смешанной инфекции ВПГ первого и второго типов [2, 3, 23].
Единственным резервуаром ВПГ являются зараженные им люди, которые распространяют его среди населения. Генитальный герпес относится к заболеваниям, в 99,9% случаев передаваемых половым путем. Это так называемый горизонтальный путь передачи инфекции от носителей вируса к здоровым людям. Вертикальный путь передачи возможен в случае трансплацентарного инфицирования плода [3, 9].
По данным литературы, частота встречаемости генитального герпеса варьирует от 7 до 40%. Причиной большинства случаев генитального и, соответственно, неонатального герпеса является ВПГ-2 (70–80%), однако в 20–30% случаев эта инфекция может быть вызвана ВПГ-1 [2, 19].
Попав в организм человека, ВПГ сохраняется в нем на протяжении всей жизни, периодически вызывая рецидивы заболевания различной степени тяжести. Прослеживается определенная тенденция к фиксированности очагов высыпания, что объясняется поражением только нескольких ганглиев, которые иннервируют ограниченную зону кожи и слизистых. Первичное заражение сопровождается репликацией (размножением) вируса в месте инвазии с последующим его перемещением либо по нервному стволу, либо гематогенным путем. При гематогенном пути распространения инфекции вирусемия является обязательным этапом как первичного, так и рецидивирующего генитального герпеса. Установлено, что ВПГ оседает в виде элементарных телец в строме эритроцитов, он также обнаруживается в лейкоцитах, тромбоцитах и лимфоцитах [2, 7, 11]. Вирус герпеса может находиться и в лимфатической системе, в свободном состоянии или связанном с лимфоцитами, при определенных условиях размножается в Т- и В-лимфоцитах. При персистенции инфекции данный вирус может длительно находиться в коже, слизистых и половых секретах.
К особенностям герпетической инфекции следует относить:
• высокий уровень инфицированности населения;
• пожизненную персистенцию возбудителя в организме человека;
• системность процесса, а также полиморфизм клинических проявлений;
• трудности лабораторной диагностики атипичных и стертых форм заболевания;
• торпидность к имеющимся методам терапии (ни один из противогерпетических препаратов не приводит к полной элиминации вируса из организма, а только подавляет его репликацию).
При определении формы генитального герпеса выделяют первичную инфекцию или первичный эпизод инфекции и рецидивирующее ее течение. Первично инфицированными считаются пациентки с серонегативными результатами, которые ранее не сталкивались с ВПГ и не имеют к нему антител. Инкубационный период колеблется в широких пределах и составляет в среднем 3–9 дней, в течение которых экспрессия вируса минимальна. В 50–80% случаев появлению типичных повреждений предшествуют локальные продромальные симптомы в виде парестезии, зуда или боли, локального лимфаденита, невралгии в ягодичной, паховой, бедренной областях, дизурии, а также нарушения общего состояния пациенток. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением. Как правило, первичный эпизод заболевания характеризуется обширными высыпаниями, тяжелой общей симптоматикой и длительной экспрессией вируса [1, 3].
Рецидивирующий характер герпес приобретает приблизительно у трети инфицированных людей. Рецидивы наступают в результате периодически возникающего иммунодефицита под влиянием провоцирующих факторов (стресс, менструация, переохлаждение, употребление спиртных напитков, ультрафиолетовое облучение, переутомление и т. д.). На частоту рецидивов также влияет тип вируса и его локализация. Достоверно чаще рецидивы заболевания встречаются при инфицировании ВПГ-2 и поражении половых органов, что, по-видимому, связано с особенностями местного иммунитета [3, 11].
В настоящее время предложены две альтернативные гипотезы для объяснения персистирования вируса и возникновения рецидива заболевания: статическая и динамическая. Ряд авторов [3, 13] придерживаются статической теории, согласно которой вирус находится в клетках паравертебральных сенсорных ганглиев в интегрированном или свободном непродуктивном состоянии. Под влиянием «пускового» фактора вирус из ганглия центробежно мигрирует по аксону периферического нерва и активно репродуцируется в эпителиальных клетках. Другие исследователи [2, 24] являются сторонниками динамической теории, которая предполагает, что репродукция и выделение из ганглия небольшого количества вируса происходят постоянно. Если количество размножающихся вирусных частиц превышает определенный порог, то они по периферическим нервам возвращаются из сакральных ганглиев к половым органам, где размножаются в эпидермисе, что и приводит к характерным рецидивам или бессимптомному выделению вируса.
С нашей точки зрения, следует допустить существование обоих механизмов возникновения рецидивов. Кроме того, важная роль в реактивации инфекции отводится состоянию местного иммунитета, при угнетении которого возникают условия для репродукции вируса [3].
Существует несколько подходов к диагностике герпетической инфекции. Алгоритмы обследования основаны на клинических симптомах и лабораторных тестах. Наиболее распространенным в клинической практике является метод быстрой диагностики герпетической инфекции – полимеразная цепная реакция [2, 21]. Также для постановки диагноза герпетической инфекции часто используется иммуноферментный анализ.
Анализ литературных данных показал, что беременность, как правило, не влияет на частоту возникновения и тяжесть герпетической инфекции. В то же время имеется и противоположное мнение, указывающее на изменение клиники генитального герпеса на фоне физиологического иммунодефицита, имеющего место при беременности [1, 6].
Следует отметить, что пути проникновения вируса к эмбриону и плоду могут быть различными. Первый путь – трансплацентарный, возникает при наличии вирусемии у беременной, когда вирус из межворсинчатого пространства плаценты проникает в сосудистую систему плода с дальнейшей диссеминацией в его органах [3, 9, 13].
Резко увеличивает потенциальную опасность трансплацентарной передачи ВПГ плоду первичное инфицирование женщины во время беременности. Риск увеличивается и при активации латентной герпетической инфекции, однако он значительно ниже, чем при первой встрече организма с вирусом. Возможность трансплацентарной передачи инфекции значительно возрастает на фоне снижения иммунологической реактивности организма и при всех сопутствующих состояниях, увеличивающих проницаемость плаценты. Однако, по мнению ряда авторов [1, 13], вирусы могут проникать в организм плода даже через неповрежденную плаценту.
При восходящем инфицировании основными факторами, повышающими риск заражения плода, являются патологические изменения шейки матки, снижение защитных свойств цервикальной слизи, а также акушерские вмешательства и манипуляции, возможность проникновения вируса в околоплодные воды через плодные оболочки [3].
Бесспорно, как отечественными [1, 6], так и зарубежными авторами [9, 13] лидирующее место (до 90% случаев) отводится контактному механизму заражения плода, возникающему при прохождении ребенка через инфицированные родовые пути матери. При этом передача инфекции возможна как при наличии очагов повреждения в области шейки матки и вульвы, так и при бессимптомном выделении вируса.
В I триместре гестации риск инфицирования плода ВПГ резко возрастает при наличии первичного эпизода инфекции или стадии обострения хронической рецидивирующей формы заболевания, что может явиться причиной возникновения пороков развития плода, неразвивающейся беременности, спонтанных абортов и др. [2, 23]. Эмбриональные ткани с их высоким уровнем метаболизма и энергетики являются идеальной средой для репликации вирусов. При этом вирусная нуклеиновая кислота может включаться в состав клеточного генома, передающего генетическую информацию в аппарат, воспроизводящий клеточный белок, что в конечном итоге приводит к гибели зародыша или нарушению процессов органогенеза и возникновению пороков развития [3].
По данным литературы, при инфицировании беременной после 20 нед. гестации возрастает частота поздних самопроизвольных выкидышей, преждевременных родов, внутриутробного инфицирования плода. В этот период у плода могут развиться воспалительные заболевания головного мозга, глаз, легких, анемия, гепатоспленомегалия и т. д. Генитальная герпетическая инфекция, ввиду частых воспалительных изменений последа, может явиться причиной преждевременного или раннего излития околоплодных вод (с высоким риском восходящего инфицирования плода), нарушений сократительной активности матки с развитием первичной и/или вторичной слабости родовой деятельности, аномалий прикрепления и отделения плаценты с кровотечением в последовом и раннем послеродовом периодах [2, 3, 13].
Внедрение в практику противовирусной терапии привело к значительному снижению заболеваемости и смертности, однако до настоящего времени проблема герпетической инфекции во время беременности и ее влияние на организм ребенка являются одной из наиболее острых проблем в перинатологии [5, 14, 16, 17].
В работах зарубежных авторов было показано, что среди женщин с рецидивирующим генитальным герпесом примерно в 75% случаев следует ожидать по крайней мере один рецидив ВПГ во время беременности и в 14% – клинические проявления на момент родоразрешения [22, 25]. Данные систематического обзора 7 рандомизированных контролируемых испытаний с 1249 участниками выявили, что женщины с первичным эпизодом или рецидивом ВПГ-инфекции, которые получали антивирусную профилактику ацикловиром (400 мг 3 р./сут) или валацикловиром (500 мг 2 р./сут) начиная с 36 нед. беременности, значительно реже имели рецидивы инфекции к моменту родоразрешения (OR=0,28; CI=0,18–0,43), а проведение супрессивной терапии данными препаратами привело к снижению частоты выполнения кесарева сечения в связи с обострением ВПГ-инфекции (OR=0,30; CI=0,20–0,45) [15].
Как известно, во время родоразрешения при рецидивирующей генитальной ВПГ-инфекции происходит заражение плода. В крупном проспективном исследовании (58 362 беременные женщины), проведенном с целью оценки влияния метода родоразрешения на частоту передачи ВПГ-инфекции новорожденным, было показано, что инфицирование новорожденных практически в 6 раз ниже при операции кесарева сечения, чем при самопроизвольных родах (1,2% по сравнению 7,7% соответственно; ОR=0,14; CI=0,02–1,08) [10].
Также в исследованиях было показано, что у беременных с рецидивирующим генитальным герпесом проведение антивирусной профилактики ацикловиром после 36 нед. гестации для снижения риска передачи инфекции новорожденному является более экономически выгодной мерой, чем проведение кесарева сечения в связи с активацией ВПГ-инфекции на момент родоразрешения. Однако в настоящий момент недостаточно исследований, оценивающих экономическую эффективность противовирусной профилактики валацикловиром [18].
С учетом полученных данных, Американский колледж акушеров и гинекологов (AGOG) и общество акушеров и гинекологов Канады (SOGC) рекомендуют женщинам с рецидивирующей генитальной ВПГ-инфекцией проводить супрессивную терапию ацикловиром или валацикловиром после 36 нед. гестации, а также осуществлять родоразрешение путем операции кесарева сечения пациенткам с наличием активных герпетических высыпаний на половых органах и продромальных симптомов инфекции к моменту родов. SOGC предлагает пациенткам с первичной генитальной ВПГ-инфекцией в третьем триместре проводить кесарево сечение вне зависимости от наличия или отсутствия поражения кожных покровов половых органов в связи с высоким риском (до 60%) вертикальной передачи [8, 20].
Осложненное течение гестационного периода у женщин с герпетической инфекцией, тяжесть неонатального герпеса и неблагоприятный прогноз для новорожденного делают весьма актуальной разработку рациональных подходов к диагностике, профилактике и лечению этого заболевания. В профилактике неонатального герпеса большое значение приобретает правильная тактика ведения беременности и родов, однако реальным малоиспользуемым до настоящего времени резервом в решении проблемы рождения здорового ребенка является правильная прегравидарная подготовка пациенток с герпетической инфекцией, которая включает ее лечение с последующей профилактикой рецидивов. При генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисной (противовирусной) терапии, так и лечение сопутствующих заболеваний.
К базисным видам лечения относится:
• Блокада репродукции ВПГ в режиме эпизодической или супрессивной терапии. Применяют ацикловир по 0,2 г 5 р./сут в течение 5 дней при легком течении инфекции (обострения 1 раз в 6–8 мес.) и по 0,2 г 4 р./сут в непрерывном режиме в течение 3–6 мес. и более – при ее частых рецидивах (обострения 1 раз в 30–90 дней).
• Проведение стимуляции неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.).
• Местное применение специфических мазей.
В настоящее время наиболее широко используемыми для купирования обострения различных форм герпеса являются препараты из группы ациклических нуклеотидов. Многочисленными наблюдениями показано, что применение ацикловира в дозе 200 мг 5 р./сут или валацикловира – 500 мг 2 р./сут в течение 5 дней значительно уменьшает клинические проявления заболевания, сокращает время рецидива и период вирусовыделения. Были отмечены абсолютная безопасность, хорошая переносимость препаратов и отсутствие значимых побочных эффектов [6, 14, 16].
Наиболее современным и эффективным противовирусным препаратом является валацикловир, являющийся активным действующим веществом препарата Валцикон (ЗАО «Вертекс», Россия). Валацикловир представляет собой пролекарство – L-валиновый эфир ацикловира. Валацикловир имеет ряд преимуществ в сравнении с ацикловиром (более высокая биодоступность при приеме препаратов внутрь, возможность двух-, трехкратного приема). При ВПГ-инфекции этот препарат применяют у пациентов с резистентностью вируса к ацикловиру. После всасывания в кровь валацикловир почти полностью превращается в ацикловир под влиянием печеночного фермента валацикловир-гидролазы. Образовавшийся ацикловир проникает в пораженные вирусом клетки, где под влиянием вирусного фермента тимидинкиназы превращается в монофосфат, затем – в дифосфат и активный трифосфат. Трифосфат ацикловира угнетает ДНК-полимеразу и тем самым нарушает репликацию ДНК ВПГ. Следовательно, высокая избирательность валацикловира в отношении тканей, пораженных вирусом, объясняется тем, что первый этап цепи реакций фосфорилирования опосредуется ферментом, вырабатываемым самим вирусом. Валацикловир назначают по 0,5 г 2–3 р./сут в течение 5–10 дней. Длительность и дозу препарата подбирают индивидуально с учетом формы и тяжести вирусного заболевания.
Как показывает клиническая практика, эффективность ациклических нуклеозидов зависит от биодоступности препарата, чувствительности герпес-вируса к конкретному препарату, адекватности применяемой дозы, продолжительности и кратности лечения, сроков начала лечения. Назначение валацикловира в дозе 500 мг 2 р./сут в течение 5 дней в продромальном периоде или сразу после появления симптомов рецидива заболевания способствует быстрому купированию проявлений вирусной инфекции. Препарат для системного лечения герпетической инфекции Валцикон сочетает в себе эффективность и безопасность ацикловира при отсутствии его недостатков – таких как ограниченная биодоступность, связанная с недостаточно эффективным всасыванием препарата при пероральном применении. Применение Валцикона дает возможность снизить количество приемов лекарства до 2 р./сут в отличие от 5 р./сут – при назначении ацикловира и повысить приверженность пациентов к проводимой терапии.
В ряде случаев среди пациентов, получавших хотя бы короткие курсы валацикловира в момент рецидива, тенденция к нарастанию частоты клинических проявлений ВПГ-инфекции ниже, чем среди пациентов, получавших только местное лечение, что во многом зависит от исходного состояния противовирусной защиты и продолжительности вторичного иммунодефицита у больных с ВПГ-инфекцией. Супрессивную терапию рекомендуют людям с частыми рецидивами. Для пациентов с сохраненным иммунитетом назначают препарат в дозе 500 мг 1 р./сут, с иммунодефицитом – 500 мг 2 р./сут. Прием препаратов ежедневно в течение 12 и более месяцев в 80% случаев предотвращает рецидивы герпеса и обеспечивает психологическое преимущество над лечением, проводимым во время обострений; при такой терапии рецидивы заболевания становятся достаточно редкими, а у некоторых пациентов возможна ремиссия в течение нескольких лет. Анализ рандомизированного исследования [26] подтвердил высокую клиническую эффективность применения валацикловира в профилактике рецидивирующей ВПГ-инфекции. Супрессивная терапия в прегравидарном периоде и перед родоразрешением может снизить частоту рецидивов ВПГ, риск бессимптомного выделения вируса и частоту кесарева сечения вследствие активации герпетической инфекции. Валцикон с фармакоэкономической точки зрения наиболее оптимально подходит для супрессивной терапии. Учитывая наличие большой упаковки (42 капсулы), доступную стоимость и 2–кратное применение в сутки, препарат Валцикон позволяет достичь очень высокой комплаентности лечения.
Таким образом, следует подчеркнуть, что проведение ранней диагностики, профилактики и лечения ВПГ-инфекции у женщин до наступления беременности, прегравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, предупредить тяжелые формы неонатальной инфекции, уменьшить перинатальную заболеваемость и смертность.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

