Как меняется толщина рогового слоя на участке кожи
Обновлено: 28.04.2024
Кожа. Эмбриогенез кожи. Развитие кожи.
Нижеследующий раздел представляет обобщенные краткие сведения по нормальному строению кожи и этапам ее развития в эмбриогенезе. Некоторые анатомические структуры, важные с точки зрения неопластических преобразований, будут описаны также в соответствующих главах, посвященных основным типам опухолей кожи (например, опухолям придатков, лимфопролиферативным новообразованиям). Строение меланоцитов является важным диагностическим критерием для меланоцитарных опухолей, но эти клетки встречаются также в немеланоцитарных опухолях кожи. Описание меланоцитов будет представлено как в данной главе, так и дополнительно в статье «Опухоли меланогенной системы».
В норме кожа образована двумя различными по происхождению слоями. Наружный слой — производное эктодермы — это многослойный плоский ороговевающий эпителий, который не содержит сосудов и получает питание посредством обмена тканевой жидкости, а тканевая жидкость поступает из второго слоя — производного мезенхимы, располагающегося глубже и содержащего сосуды. Толщина эпидермиса различна и широко варьирует в зависимости от локализации на теле человека, наиболее толстый слой эпидермиса расположен на подошвах и ладонях, а самый тонкий — на веках и крайней плоти. Кожа располагается на подкожной жировой клетчатке, которую называют гиподермой, но она не является собственно частью кожи. Пучки волокон коллагена распространяются из дермы в гиподерму, обеспечивая механическую прочность кожи, в то время как подкожная жировая ткань создает ее относительную подвижность.
Данные раннего (эмбрионального) развития важны в изучении кожных опухолей, так как некоторые из них (например, опухоли придатков кожи) имеют тенденцию повторять эмбриональные структуры.
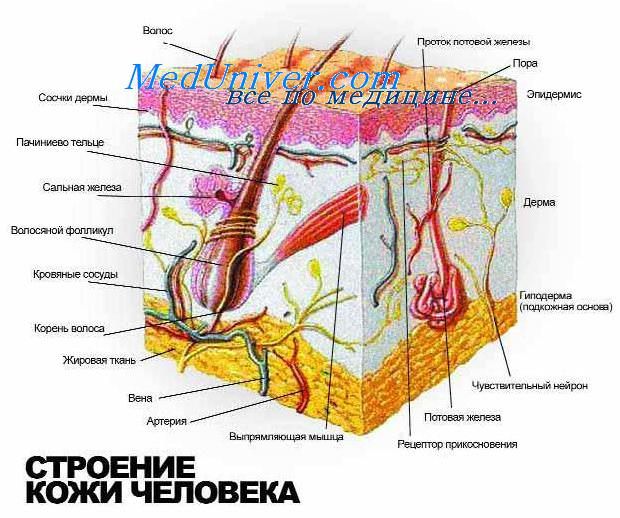
Нормальная кожа взрослого человека состоит из эпидермального слоя, сформированного четырьмя типами клеток: кератиноцитами (90%), меланоцитами (4-5%), клетками Лангерганса (4-5%) и клетками Меркеля (
Постепенно в течение эмбриогенеза дерма становится менее клеточной за счет увеличения коллагеновых и эластических волокон. К 12-й неделе беременности кровеносные сосуды начинают пролиферировать, но правильно сформированные сплетения не выявляются до конечных стадий эмбриогенеза. Нервы в дерме обнаруживаются уже в 5 недель беременности, со временем они про лиферируют, формируют запутанную сеть тонких волокон, которые заканчиваются как специализированные сенсорные рецепторы (рецепторы контакта Мейсснера в поверхностном слое дермы и пачиниевы рецепторы давления в глубоком слое дермы и подкожном слое).
Между 60-м и 70-м днями эмбрионального периода эпидермальный слой становится стратифицированным плоскоклеточным эпителием, в котором появляются отдельные слои эпидермиса (базальные клетки, шиповатый, зернистый и роговой слои). К концу второго триместра беременности синтезируются белки кератина с более высокой молекулярной массой, то есть клетки содержат «большее количество зрелого цитокератина». В этот период дермо-эпидермальная граница, которая была плоской, становится волнообразной, формируя возвышения эпидермиса. Эти возвышения являются результатом инвагинации тысяч дермальных сосочков, содержащих петли капиллярной сети. К 24 неделям беременности кератинизация завершается и перидерма полностью бывает сформирована. Клетки Мерке-ля, обычно связываемые с эпителием волосяных фолликулов взрослых, и потовые железы не определяются в этот период (60—70 дней).
Приблизительно в период от 70-го до 80-го дня беременности начинается развитие волосяного фолликула с появления мезенхимальных уплотнений, которые формируются непосредственно под отдельными скоплениями вытянутых крупных базальных клеток. Далее эти базальные клетки погружаются в основное вещество дермы, в зону мезенхимальных уплотнений. Эпителиальные элементы вначале формируют солидные структуры, которые в конечном счете становятся вытянутыми цилиндрическими и являются основой для не сформированных волосяных фолликулов. Мезенхимальные уплотнения, по-видимому, направляют это погружение и после завершения становятся сосочками, которые окружены герминативным базальным эпителием волосяных луковиц. Со временем фолликулярный эпителий дифференцируется во множество специализированных слоев, некоторые из нихявляются основой для эпителиальных опухолей придатков кожи.
Апокринные железы происходят из поверхностных участков волосяных фолликулов. В процессе формирования клеток, выстилающих эти секреторные структуры, развивается как бы «обезглавленная» форма секреции, что является типичным для апокринной дифференцировки. Эккринные железы образуются в то же самое время в результате пролиферации базалоидных эпидермальных клеток, которые располагаются на верхушках возвышений и формируют тонкие колонки образующих гликоген клеток в основном веществе дермы. После достижения глубокого слоя на границе дермы и подкожных структур эти колонки становятся извитыми. Образование секрета сначала обнаруживается ультраструктурно как отграниченная мембраной вакуоль в отдельной эпителиальной клетке. Разрушением клетки вокруг этой вакуоли впоследствии и заканчивается формирование определенного секрета. Некоторые эккринные опухоли придатков кожи могут быть идентифицированы ультраструктурно на основании обнаружения этой эмбриональной формы образования секрета в неопластических клетках.
Принимая во внимание, что все перечисленные компоненты кожи имеют уникальное или характерное отражение во многих кожных опухолях, что будет особо подчеркнуто в специальных разделах, посвященных конкретным новообразованиям, далее мы даем более полное описание основных структурных элементов кожи.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
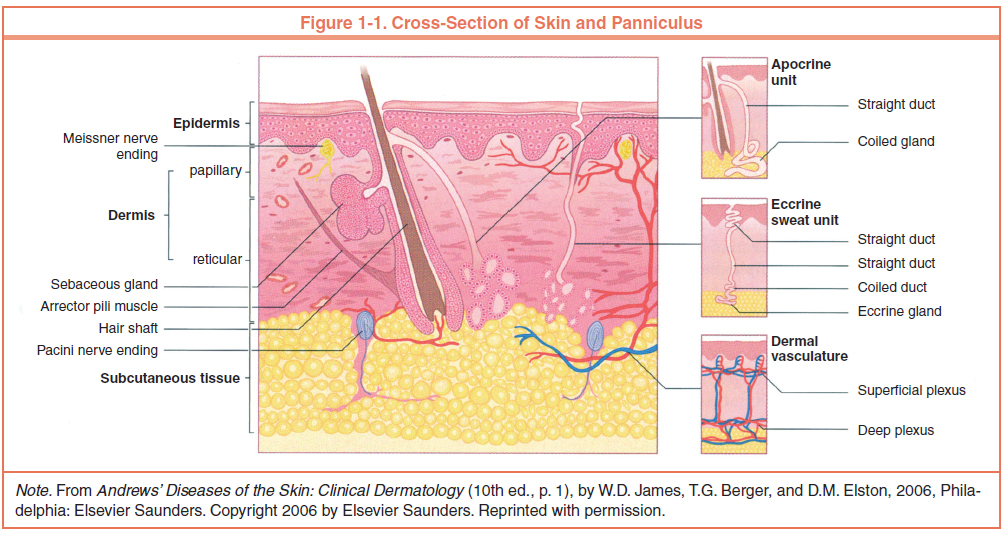
Рис.1. Структура кожи
Эпидермис
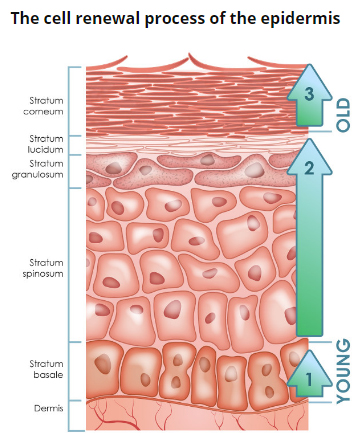
Рис. 2. Эпидермис
Эпидермис – постоянно слущивающийся эпителиальный слой кожи, в котором представлены в основном из 2 типа клеток – кератиноциты и дендритные клетки. В небольшом количестве в эпидермисе присутствуют меланоциты, клетки Лангерганса, клетки Меркеля, внутриэпидермальные Т-лимфоциты. Структурно эпидермис разделяется на 5 слоев: базальный, шиповатый, зернистый, блестящий и роговой , различающиеся положением и степенью дифференцировки кератиноцитов, основной клеточной популяции эпидермиса (рис. 2).
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
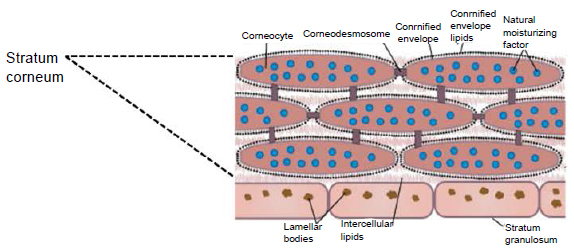
Рис. 3. Схематичное изображение рогового слоя с нижележащим зернистым слоем эпидермиса.
Регуляция пролиферации и дифференцировки кератиноцитов эпидермиса . Являясь непрерывно обновляющейся тканью, эпидермис содержит относительно постоянное число клеток и регулирует все взаимодействия и контакты между ними: адгезию между кератиноцитами, взаимодействие между кератиноцитами и мигрирующими клетками, адгезию с базальной мембраной и подлежащей дермой, процесс терминальной дифференцировки в корнеоциты. Основной механизм регуляции гомеостаза в эпидермисе поддерживается рядом сигнальных молекул – гормонами, факторами роста и цитокинами. Кроме этого, эпидермальный морфогенез и дифференцировка частично регулируются подлежащей дермой, которая играет критическую роль в поддержании постнатальной структуры и функции кожи.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Внеклеточный матрикс (ВКМ) дермы , или межклеточное вещество, в состав которого входят различные белки (главным образом коллаген, эластин), гликозаминогликаны, самым известным из которых является гиалуроновая кислота, и протеогликаны (фибронектин, ламинин, декорин, версикан, фибриллин). Все эти вещества секретируются фибробластами дермы. ВКМ представляет собой не беспорядочное скопление всех компонентов, а сложноорганизованную сеть, состав и архитектоника которой определяют такие биомеханические свойства кожи, как жесткость, растяжимость и упругость. К белкам ВКМ прикрепляются кератиноциты эпидермиса, которые тесно состыкованы друг с другом. Именно они и формируют плотный защитный слой кожи. Структура ВКМ также способна оказывать регулирующее влияние на погруженные в него клетки. Регуляция может быть как прямой, так и косвенной. В первом случае белки и гликозаминогликаны ВКМ непосредственно взаимодействуют с рецепторами клеток и инициируют в них специфические пути передачи сигнала. Косвенная регуляция осуществляется посредством действия цитокинов и ростовых факторов, удерживаемых в ячейках сети ВКМ и высвобождаемых в определенный момент для взаимодействия с рецепторами клеток. Структурная сеть ВКМ подвергается ремоделированию ферментами из семейства матриксных металлопротеиназ (ММР). В частности, ММР-1 и ММР-13 инициируют деградацию коллагенов I и III типов. Плотность сети ВКМ дермы неравномерна – в папиллярном слое она более рыхлая, в ретикулярном - значительно плотнее как за счет более близкого расположения волокон структурных белков, так и за счет увеличения диаметра этих волокон.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
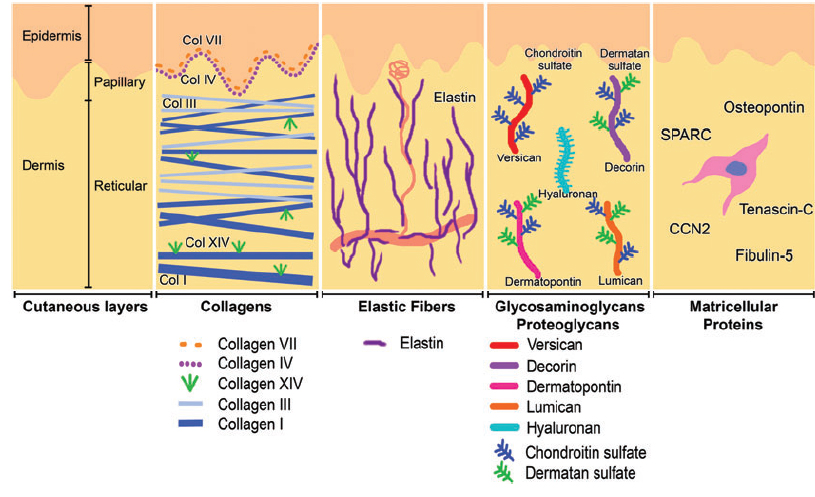
Рис. 4. Схематичное представление слоев кожи и распределения коллагенов разных типов.
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
Гиалуроновая кислота (ГК) представляет собой линейный полисахарид, состоящий из повторяющихся димеров D-глюкуроновой кислоты и N-ацетилглюкозамина. Количество димеров в полимере варьирует, что приводит к образованию молекул ГК разного молекулярного веса и длины - 1х10 5 -10 7 Да (2-25 мкм), оказывающих, соответственно, различный биологический эффект.
ГК - высокогидрофильное вещество, влияющее на движение и распределение воды в матриксе дермы. Благодаря этому ее свойству наша кожа в норме и в молодости обладает высоким тургором и сопротивляемостью механическому давлению.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
Подкожно-жировая клетчатка
Подкожно-жировая клетчатка , или гиподерма, - самый нижний слой кожи, располагается под дермой. Состоит из жировых долек, разделенных между собой соединительнотканными септами, содержащими коллаген и пронизанными крупными сосудами. Главными клетками жировых долек являются адипоциты, количество которых варьирует в различных областях тела. В настоящее время ПЖК рассматривают не только как энергетическое депо, но и как эндокринный орган, адипоциты которого участвуют в выработке ряда гормонов (лептина, адипонектина, резистина), цитокинов и медиаторов, оказывающих влияние на метаболизм, чувствительность к инсулину, функциональную активность репродуктивной и иммунной систем.

Кожа состоит из трех слоев: эпидермиса, дермы (собственно кожи) и гиподермы (подкожной клетчатки).
Эпидермис – самый верхний, наружный слой кожи - состоит из клеток многослойного плоского ороговевающего эпителия, которые по мере дифференцировки продвигаются от базальной мембраны по направлению к поверхности кожи. Эпидермис, в свою очередь, состоит из 5 слоев: базального, шиповатого, зернистого, блестящего и рогового.
Основа эпидермиса – самый нижний, внутренний базальный слой (stratum basale, germinativum), состоит из 1 ряда мелких клеток цилиндрической формы - базальных кератиноцитов. Непосредственно над базальным слоем кератиноциты увеличиваются в размере и формируют шиповатый слой (stratum spinosum), состоящий из 3—6 (до 15) рядов шиповатых кератиноцитов, постепенно уплощающихся к поверхности кожи. Из-за высокой митотической активности (частого деления клеток) базальный и шиповатый слои называют ростковым слоем Мальпиги, за счет него происходят формирование и регенерация эпидермиса.
Зернистый слой (stratum granulosum) состоит из 2—3 рядов клеток, имеющих вблизи шиповатого слоя цилиндрическую или кубическую форму, а ближе к поверхности кожи – ромбовидную.
Блестящий слой (stratum lucidum) выражен в участках наиболее развитого эпидермиса, т. е. на ладонях и подошвах, где состоит из 3—4 рядов вытянутых по форме слабо контурированных клеток.
Роговой слой (stratum corneum) образован полностью ороговевшими безъядерными клетками – корнеоцитами (роговыми пластинками), которые содержат нерастворимый белок - кератин. Наиболее развит роговой слой там, где кожа подвергается наибольшему механическому воздействию (ладони, подошвы).
Кроме вышеперечисленных клеток в эпидермисе также обнаруживаются меланоциты (клетки, вырабатывающие основной пигмент кожи), а также клетки иммунной системы кожи: клетки Лангерганса (эпидермальные макрофаги) и клетки Гринстейна (тканевые макрофаги).
Эпидермис отделен от дермы базальной мембраной, которая является эластической опорой, прочно связывающей эпителий с дермой и препятствующей прорастанию клеток эпидермиса в дерму.

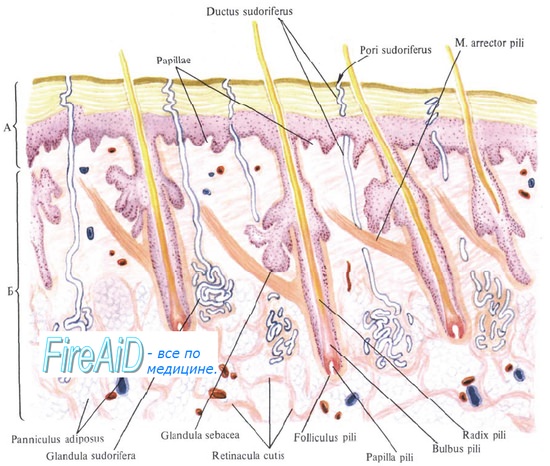
Дерма – соединительнотканная часть кожи – является опорой для придатков кожи (волос, ногтей, потовых и сальных желез), сосудов и нервов. Она состоит из двух слоев: сосочкового и сетчатого.
Тонкий верхний сосочковый слой (stratum papillare) состоит из бесструктурного вещества и тонких соединительнотканных (коллагеновых, эластических и ретикулярных) волокон и образует сосочки, залегающие между эпителиальными гребнями шиповатых клеток. Более толстый сетчатый слой (stratum reticulare) распространяется от основания сосочкового слоя до подкожной жировой клетчатки; основу его составляют пучки толстых коллагеновых волокон, расположенные параллельно поверхности кожи. В дерме располагается поверхностная сосудистая сеть, и две сети лимфатических сосудов - поверхностная и глубокая. В дерме же сосредоточена основная часть нервного аппарата кожи: два нервных сплетения - глубокое и поверхностное и множественные кожные рецепторы (свободные и инкапсулированные: колбы Краузе,тельца Фатера—Пачини, тельца Мейснера, диски Меркеля). В некоторых участках сосочкового слоя дермы располагаются мышечные волокна, связанные с волосяными луковицами - мышцы, поднимающие волос.
Гиподерма – подкожная жировая клетчатка - состоит из сети коллагеновых, эластических и ретикулярных волокон, между которыми располагаются дольки жировой ткани – скопления крупных жировых клеток-липоцитов. Толщина гиподермы варьирует от 2 мм (на черепе) до 10 см и более (на ягодицах). Гиподерма толще на дорсальных и разгибательных, тоньше на вентральных и сгибательных поверхностях конечностей. Местами (на веках, под ногтевыми пластинками, на крайней плоти, малых половых губах и мошонке) она отсутствует. В подкожной жировой клетчатке залегают крупные сосуды и нервные стволы.
Придатки кожи
К придаткам кожи относят волосы, ногти, сальные и потовые железы.
Волосы. В каждом волосе (pilus) различают две части: стержень и корень. Стержень – часть волоса, выступающая над поверхностью кожи. Корень волоса заложен в дерме и иногда доходит до подкожной жировой клетчатки. Корень волоса погружен в дермальное влагалище (соединительнотканную сумку) и формирует вместе с ним волосяной фолликул. Волосяной фолликул имеет цилиндрическую форму и открывается на поверхности кожи своеобразным расширением – воронкой, в которую погружается стержень волоса. На границе верхней и средней трети фолликула в него открывается выводной проток сальной железы. Самая глубокая расширенная часть корня волоса называется волосяной луковицей; нижняя часть луковицы – матрикс – состоит из клеток, отличающихся очень высокой митотической активностью и обеспечивающих рост волоса.
ФГУ Научно-исследовательский детский ортопедический институт им. Г.И. Турнера Росмедтехнологий, Санкт-Петербург
ФГУ Научно-исследовательский детский ортопедический институт им. Г.И. Турнера Росмедтехнологий, Санкт-Петербург
Структурные изменения в рубцовой ткани у детей на различных этапах созревания рубца и на фоне коллагенолитической терапии
Журнал: Клиническая дерматология и венерология. 2013;11(1): 22‑30
Филиппова О.В., Красногорский И.В. Структурные изменения в рубцовой ткани у детей на различных этапах созревания рубца и на фоне коллагенолитической терапии. Клиническая дерматология и венерология. 2013;11(1):22‑30.
Filippova OV, Krasnogorskiĭ IV. Structural changes in the scar tissue of children during different scar maturation stages and collagenolytic therapy. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(1):22‑30. (In Russ.).
ФГУ Научно-исследовательский детский ортопедический институт им. Г.И. Турнера Росмедтехнологий, Санкт-Петербург
В статье рассмотрены клинические и гистологические особенности рубцовой ткани на различных стадиях ее созревания, описаны структурные изменения в рубцах, происходящие под влиянием компрессионной и коллагенолитической терапии. Показано истончение и разрыхление коллагеновых волокон при лечении препаратом коллагеназы, усиление противорубцового эффекта при сочетании коллагенолитической терапии с компрессионной за счет сдавления сосудов кожного сплетения.
ФГУ Научно-исследовательский детский ортопедический институт им. Г.И. Турнера Росмедтехнологий, Санкт-Петербург
ФГУ Научно-исследовательский детский ортопедический институт им. Г.И. Турнера Росмедтехнологий, Санкт-Петербург
Гипертрофические и келоидные рубцы являются медицинской и во многом хирургической проблемой, особенно у пациентов детского возраста. Детский скелет растет и развивается, патологические рубцы, которые всегда отстают в росте от нормальных тканей, нередко вызывают развитие вторичных деформаций опорно-двигательного аппарата [1, 2]. Эффект от реконструктивных операций не всегда бывает стойким и может быть частично утрачен в связи с ростом и естественным развитием ребенка [3, 4], поэтому значение профилактических мероприятий и консервативного лечения рубцов в детской практике трудно переоценить.
В настоящее время предложено значительное количество методов воздействия на рубцово-измененные ткани, однако оценка эффективности разных способов лечения в большинстве случаев основывается на анализе клинических проявлений [5, 6]. Предложены разные шкалы оценки эффективности консервативного лечения, учитывающие ряд наиболее распространенных клинических симптомов: цвета, рельефа рубцов, консистенции и субъективных ощущений пациента [7—9].
Однако, как показывает практика, клинические признаки не всегда дают полное и адекватное представление о процессах, происходящих в рубцовой ткани, а эффект от разных методов воздействия на рубцовую ткань в ряде случаев бывает непредсказуемым и даже противоположным ожидаемому.
Наиболее информативными методами, позволяющими получить наиболее ценную и полную диагностическую информацию о рубцовом процессе, является изучение биоптатов рубцово-измененных тканей с использованием гистологических и биохимических методик [10—12].
Цель исследования — оценить клинические и гистоморфологические изменения в рубцовой ткани у детей на разных стадиях ее созревания и на фоне лечения препаратом коллагеназы Ферменколом.
Материал и методы
Были обследованы 32 пациента в возрасте 4—12 лет, получавшие оперативное и консервативное лечение по поводу послеожоговых рубцовых деформаций, обусловленных гипертрофическими рубцами.
Для реализации поставленной цели были использованы клинический и гистоморфологический методы исследования.
Клинический метод включал оценку жалоб и ощущений пациента, визуальную и мануальную оценку рубцовой ткани в динамике. Оценивали болезненность, окраску, плотность, эластичность, рельеф.
Для оценки структурных изменений рубца выполнялось гистоморфологическое исследование биоптатов рубцовой ткани на разных сроках ее формирования. В исследование включали пациентов, нуждающихся в многоэтапном хирургическом лечении. Биоптаты получали до и после курса консервативной противорубцовой терапии во время плановых реконструктивных операций. Биоптат представлял собой фрагмент рубцовой ткани размером 4×5 мм, взятый на всю толщину рубцовой ткани. Биопсийный материал погружали в 10% раствор Кайзерлинга на 1—2 сут, проводили по стандартной методике, окрашивали гематоксилином и эозином. Затем срезы толщиной 3 мкм изучали под световым микроскопом. При микроскопическом исследовании гистологических препаратов оценивали особенности строения каждого слоя рубцово-измененной кожи, толщину и расположение коллагеновых волокон, распределение сосудов и суммарную площадь микрососудистого русла, учитывали количество клеток, участвующих в воспалительной реакции и синтезе коллагеновых волокон. Кроме того, в ряде случаев на исследование отправляли незначительные излишки нормальной кожи, возникшие в результате перераспределения тканей в процессе выполнения местно-пластических операций.
Между этапами оперативного лечения пациентам проводили консервативную терапию с использованием коллагенолитического препарата Ферменкол в виде электрофореза и наружного нанесения в течение дня, в том числе и в виде аппликаций. Длительность курса консервативной терапии составляла не менее 14 сут.
Результаты исследования
В настоящее время выделяют три стадии формирования рубца:
1) фибробластическую (до 30 сут), которая характеризуется эпителизацией раневого дефекта, обилием сосудов и пролиферацией юных фибробластов, образованием большого количества аморфного вещества и продукцией ретикулярных волокон;
2) волокнистую (30—40 сут): характеризуется скоплением зрелых фибробластов, синтезирующих коллагеновые волокна;
3) гиалиновую: характеризуется гиалинозом коллагеновых волокон рубцовой ткани, уменьшением количества фибробластов и сосудов.
Формирование нормотрофического рубца укладывается в среднем в 12 мес, тогда как при гипертрофическом рубцевании стадия активного синтеза коллагена (волокнистая) значительно растянута во времени, что отдаляет срок окончательной стабилизации рубца.

На разных сроках развития гипертрофической рубцовой ткани свойственны разные клинические проявления. Клиническая картина обычно наиболее яркая в волокнистую стадию рубцевания, в процессе активного синтеза коллагена. Признаки гипертрофии могут появляться уже через 4–6 нед после завершения эпителизации: прежде всего уплотнение рубцовой ткани и возвышение рубца над уровнем интактной кожи (рис. 1, a). Рисунок 1. Клинические проявления гипертрофической рубцовой ткани в разные сроки ее развития. a — уплотнение рубцовой ткани через 4—6 нед после завершения эпителизации; б — гипертрофический рубец через 11—12 мес после эпителизации; в — эрозии рубцовой ткани в подколенных областях. До 11—12 мес рубец увеличивается в объеме, выступая над поверхностью кожи, имеет неравномерный, иногда бугристый рельеф (см. рис. 1, б). Наиболее выступающие участки, как правило, располагаются в зонах локализации наиболее глубокого первичного повреждения кожи. Кроме того, больных беспокоят навязчивый зуд, шелушение, периодически возникающие пузыри на поверхности рубцовой ткани, на месте которых в дальнейшем появляются эрозии. Отмечено, что наиболее часто пузыри и эрозии возникают на грубых гипертрофических рубцах и в функционально активных зонах (см. рис. 1, в). Провоцирующим фактором является интенсивная или продолжительная физическая нагрузка. В этот период рубцы имеют наиболее интенсивную ярко-розовую или цианотичную окраску. Как показывает клиническая практика, при гипертрофических рубцах зуд и шелушение могут сохраняться до 1,5—2,0 лет, когда рубец бледнеет и уплощается.

В табл. 1 представлены усредненные морфометрические параметры рубцовой ткани у пациентов с разной давностью термической травмы и морфометрические параметры нормальной кожи.

Полученные данные иллюстрируют динамику структурных изменений в зависимости от возраста рубца и отличия рубцовой ткани от нормальной кожи (см. табл. 1). Так, толщина рубцово-измененной кожи значительно превышает толщину нормальной кожи (в 2—3 раза), как правило, за счет сетчатого слоя дермы. Сетчатый слой рубца в первые 6 мес после травмы превышает толщину сетчатого слоя нормальной кожи в 5—6 раз и практически полностью представлен рубцовой тканью, сформированной разнонаправленными пучками толстых коллагеновых волокон. Сосочковый слой несколько утолщается в первые 3—4 мес после травмы, и уплощаясь в дальнейшем, становится тоньше нормального, сосочки плохо различимы. Кроме того, на протяжении всего периода созревания рубца наблюдается утолщение в 2—4 раза рогового слоя на фоне некоторого истончения эпидермиса (рис. 2, a, б). Рисунок 2. Морфологическая картина интактной (нормальной) и рубцовой ткани (окрашивание гематоксилином и эозином). а — слои интактной кожи, нормальный роговой слой (×600); б — рубец, утолщение рогового слоя эпидермиса (×600); в — лимфо-лейкоцитарная инфильтрация в рубце (×300); г — лимфо-лейкоцитарная инфильтрация в нормальной коже (×300); д — резкое расширение сосудов сетчатого слоя на ранних сроках формирования рубца (×600); е — сосуды интактной кожи (×600); ж — сосуды, сдавленные пучками коллагеновых волокон и мозаично расположенные участки с паретически расширенными сосудами (×300); з — сосуды, сдавленные пучками коллагена (рубец через 2 года после эпителизации; ×300). У детей, перенесших тяжелую термическую травму, имелось значительное количество лимфоцитов и лейкоцитов как в рубце, так и в интактной коже еще на протяжении 4—6 мес с момента реконвалесценции (см. рис. 2, в, г). При обследовании таких пациентов в клинических анализах крови часто выявляются умеренный лейкоцитоз, лимфоцитоз, повышение скорости оседания эритроцитов.

Клинические проявления гипертрофических рубцов во многом обусловлены особенностями кровообращения в рубцовой ткани (табл. 2).
Имеются значительные различия в строении дермальной сосудистой сети рубцов на разных стадиях развития и по сравнению с интактной кожей (табл. 2). В первые месяцы после травмы количество сосудов в сетчатом слое дермы, где в этот период синтез коллагена протекает наиболее интенсивно, приближено к значениям в интактной коже, тогда как суммарная площадь их сечения превышает нормальные значения. В дальнейшем с 5—6-го месяца после травмы количество сосудов постепенно уменьшается и к окончанию формирования рубца становится в 2—3 раза ниже нормы. Увеличение площади сечения сосудистого русла связано с резким расширением сосудов на ранних сроках формирования рубца (см. рис. 2, д, е). С 4—5-го месяца после эпителизации часто выявлялись сосуды, сдавленные пучками коллагеновых волокон и мозаично расположенные участки с паретически расширенными сосудами (см. рис. 2, ж). Сосуды расположены неравномерно по сравнению с нормальной кожей. В дальнейшем с 12-го месяца до 2 лет после травмы количество сосудов, сдавленных рубцовой тканью, увеличивалось, часто выявлялись спаявшиеся сосуды, практически не содержащие форменных элементов крови (см. рис. 2, з).
Сосудистая перестройка в гипертрофической рубцовой ткани, длящейся, согласно нашим наблюдениям, около 2 лет, клинически проявляется трофическими расстройствами в виде локального цианоза, шелушения, трещин, пузырей и эрозий с перифокальной воспалительной реакцией. Перечисленные симптомы возникают на участках локальной гипоксии рубцовой ткани, что гистологически подтверждается мозаичным расположением зон со спаявшимися и паретически расширенными сосудами сетчатого слоя дермы. Полученная гистологическая картина свидетельствует о тесной взаимосвязи между изменениями условий кровоснабжения покровных тканей и интенсивностью синтеза коллагеновых волокон, которые ухудшают трофику кожи, сдавливая сосуды дермального сплетения. Данное обстоятельство необходимо учитывать при выполнении реконструктивных кожно-пластических операций с использованием рубцово-измененных тканей. Как показывает клиническая практика, интраоперационное нарушение связей между дермальным сосудистым сплетением и лежащими глубже сосудами, нередко приводит к гибели вершин перемещенных лоскутов в лучшем случае до сетчатого слоя, даже при включении фасции в состав рубцово-измененного лоскута.

Синтез коллагена осуществляется клетками соединительной ткани — фибробластами, которые, по мере утраты своей синтетической активности, переходят в неактивную форму — фиброциты. Количество фибробластов и фиброцитов было выше в рубцах, чем в нормальной коже в течение всего периода наблюдения. Однако в ранние сроки после термической травмы этих фиброгенных клеток было больше не только в рубцовой, но и в нормальной коже. Это позволяет предположить, что после термической травмы появляется общая тенденция к гипертрофическому рубцеванию и на интактных участках кожи в случае их повреждения или хирургического вмешательства. С увеличением возраста рубца разница между содержанием фибробластов и фиброцитов в рубцово-измененной и нормальной коже возрастала: в рубце, хотя их количество и снижалось относительно первых месяцев после травмы, их было в 4—5 раз больше, чем в нормальной коже (рис. 3). Рисунок 3. Динамика содержания фибробластов и фиброцитов в рубце и интактной коже.
Основным структурным компонентом рубца, обусловливающим его рельеф и плотность, являются коллагеновые волокна. Применение препаратов, содержащих коллагеназу, разрушающую коллаген, патогенетически обоснованно. В рамках консервативной терапии с коллагенолитической целью мы применяли препарат Ферменкол, содержащий композицию коллагенолитических протеаз. Поскольку ряд пациентов нуждался в нескольких реконструктивных операциях, в перерывах между этапами оперативного лечения им проводили электрофорез и давящий массаж с гелем Ферменкол. Консервативная терапия назначалась в волокнистую стадию рубцевания, при клинических признаках избыточного синтеза коллагена и в ряде случаев — на сформировавшиеся рубцы. Ферменкол применяли как изолированно, так и в сочетании с компрессионной терапией.
Клинически у всех обследуемых на фоне консервативного лечения наблюдались размягчение и визуальное выравнивание рельефа рубцовой ткани, уменьшалась интенсивность зуда.

В табл. 3 представлена динамика морфометрических параметров на фоне монотерапии Ферменколом и в сочетании с компрессией.
На фоне коллагенолитической терапии отмечалось заметное (в 2 раза) уменьшение толщины эпидермиса и рогового слоя (см. табл. 3). Уменьшалась общая толщина дермы, в том числе и за счет объема сетчатого слоя. Однако при монотерапии Ферменколом толщина сосочкового слоя дермы увеличивалась, чего не наблюдалось при использовании препарата в сочетании с компрессией. При применении Ферменкола в сочетании с компрессией уменьшалась толщина всех слоев рубцово-измененной кожи.

Утолщение сосочкового слоя при монотерапии Ферменколом может быть связано с расширением сосудов сосочкового слоя, на что указывает увеличение площади сосудистого сечения. При гистологическом исследовании после применения препарата мы наблюдали заметное разрыхление и уменьшение объема пучков коллагена. Давление коллагеновых волокон на дермальные сосуды ослабевало, что приводило к увеличению просвета сосудов и суммарной площади их сечения (рис. 4). Рисунок 4. Морфологическая картина рубцовой ткани до и после коллагенолитической терапии (окрашивание гематоксилином и эозином; ×150). a — рубец до коллагенолитической терапии: плотная укладка коллагеновых волокон; б — рубец после коллагенолитической терапии: разрыхление коллагеновых волокон, частичная декомпрессия сосудов. Происходящая таким образом частичная реваскуляризация приводила к утолщению сосочкового слоя. Возможно, именно этим процессом объясняется наблюдаемый в ряде случаев противоположный эффект от противорубцовой терапии на активно растущий гипертрофический рубец, проявляющийся гиперемией и некоторой отечностью рубца. Со стороны сформировавшегося рубца такого эффекта не наблюдалось, что, по-видимому, связано с необратимыми склеротическими изменениями сосудистой стенки сосудов из-за длительной компрессии пучками коллагена.

Учитывая полученные данные, мы дополняли коллагенолитическую терапию незрелых рубцов компрессионной терапией: в волокнистую фазу рубцового процесса Ферменкол назначали в сочетании с компрессионным бельем или эластичным бинтованием (рис. 5). Рисунок 5. Клинические проявления рубцовых изменений до и после консервативного лечения с использованием препаратов коллагеназы и компрессионного белья. a, б — больной А.: гипертрофические рубцы ягодиц и бедер до (a) и после (б) лечения; в, г — больной Б.: гипертрофический рубец бедра до (в) и после (г) лечения.
Выводы
Таким образом, ведущими факторами, обусловливающими клиническую картину и дальнейшее развитие рубца, являются изменение трофики кожи и синтез коллагеновых волокон, которые находятся в тесной взаимосвязи.
Измененные условия кровообращения делают рубцовую ткань рискованным пластическим материалом.
Увеличение фиброгенных клеток в покровных тканях носит системный характер, что необходимо учитывать при планировании реконструктивных операций.
В волокнистую стадию развития рубца мы рекомендуем сочетать коллагенолитическую терапию с компрессионной, поскольку изолированное применение коллагеназ на ранних стадиях развития рубца (до 8—10 мес) может улучшить трофику рубцовой ткани за счет истончения и разрушения коллагеновых волокон, сдавливающих сосуды кожного сплетения.
Гистогенез кожи. Строение кожи. Эпидермис. Меланоциты.
В коже как в органе выделяют два слоя: наружный, который образован многослойным плоским ороговевающим эпителием — эпидермисом, и внутренний, состоящий из волокнистой соединительной ткани. Последний именуется собственно дермой. В эпидермисе ведущим клеточным диффероном является эпителиальный, который развивается из кожной эктодермы. Источником развития тканей дермы служит мезенхима дерматомов сомитов.
В первые недели эмбриогенеза эпителий кожи состоит из одного слоя плоских клеток, к концу 2-го месяца становится двухслойным, а на 3-м месяце — многослойным. На 3-м месяце эмбриогенеза вследствие усложнения эпндермо-дермальных взаимодействий в коже появляются базальная мембрана, зачатки желез, волос, ногтей. Параллельно с развитием эпидермиса осуществляются гистогенетические процессы в соединительной ткани кожи, формируются слои дермы (сосочковый и сетчатый), возникает подкожная жировая клетчатка (гиподерма).
В течение 3-го и 4-го месяцев на ладонях и подошвах, включая пальцы, появляются поверхностные гребешки и бороздки. Характер возникающих при этом узоров имеет наследственную природу и не меняется в течение жизни человека. Это используется в методе дактилоскопии, применяемом в криминалистике. На 3-4-м месяцах в эпидермис проникают пигментные клетки — меланобласты и меланоциты, происходящие из материала нервного гребня, затем производные стволовой кроветворной клетки — клетки Лангерганса, а на 5-м месяце — подрастают нервные окончания чувствительных нейронов, позиционную информацию которым передают клетки Меркеля — нейроэндокринные клетки APUD-серии.
Гисто- и органогенез кожи и ее производных характеризуется индуктивными взаимодействиями эпидермиса и дермы. Вначале в качестве индуктора выступает мезенхима, затем усиливается роль эпидермиса, приводящая к значительному усложнению структуры и функции кожи как органа.
Строение кожи.
Эпидермис — полидифферонная ткань. Эпителиоцнты формируют многослойный ороговевающий пласт клеток, в котором различают два основных функциональных слоя — ростковый и роговой. Эти слои подразделяются на большее количество клеточных слоев в зависимости от толщины эпидермиса и других гистотопографических особенностей кожи.
В наиболее толстом эпидермисе ладоней и подошв, испытывающем сильные воздействия внешних факторов, насчитывается 5 слоев клеток: базальный, шиповатый, зернистый, блестящий (выявляется только при световой микроскопии) и роговой. В составе тонкой кожи блестящий слой отсутствует.
В эпидермисе присутствуют 4 клеточных дифферона: эпителиоциты, меланоциты, клетки Лангерганса и клетки Меркеля. Около 85% от общего числа клеток составляют эпителиоциты, или кератиноциты. Подразделение эпидермиса на слои обусловлено вертикально направленной дифференцировкой эпителиоцитов в составе эпидермально-пролиферативной единицы — гистиона эпидермиса. Последний представлен колонкой эпителиоцитов всех слоев эпидермиса, возникших в результате пролиферации и дифференцировки одной стволовой клетки.
Пространственно гистион имеет вид шестиугольной колонки и по площади равен одной роговой чешуйке. В гистионе также присутствует клетка Лангерганса. Эпителиальные клетки гистиона имеют рецепторы к ряду факторов, регулирующих их развитие — эпидермальному фактору роста и фактору роста кератиноцитов, стимулирующим пролиферацию, к кейлонам, тормозящим пролиферацию эпителиоцитов.
Меланоциты — отростчатые пигментные клетки нейроглиальной природы, расположенные в базальном слое эпидермиса. Их предшественниками являются клетки меланобласты, мигрирующие в состав эпителия из нервного гребня и мозаично встраивающиеся среди эпителиоцитов. Количество меланоцитов может достигать 10% и более от общего числа клеток базального слоя. В их цитоплазме выявляются гранулы темно-коричневого пигмента — меланина, а цитохимическим маркером меланоцитов служит фермент тирозиназа.
Синтез меланина происходит в специальных мембранных органеллах — меланосомах. Кожный пигмент из меланоцитов выделяется в межклеточное пространство и эндоцитозом поступает в эпителиоциты, концентрируясь в зоне ядер и защищая клетки от мутагенного влияния ультрафиолетовых лучей. Меланин может также передаваться по отросткам в клетки подлежащей соединительной ткани дермы — в меланодесмоциты, или меланофоры. Меланин существует в двух формах — эумеланина (черного) и феомеланина (красного). Первый является фотопротектором. Феомеланин не обладает таким свойством и преобладает в коже рыжеволосых людей, которые чувствительны к УФ облучению.
Количество пигмента меняется в зависимости от многих внешних и внутренних факторов. Сильная защитная пигментация кожи (например при загаре) развивается при действии ультрафиолетовых лучей. Пигментация наблюдается также при беременности. В условиях патологии из меланоцитов образуются злокачественные опухоли — меланомы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

