Что такое эпи кожа
Обновлено: 27.04.2024
Многие врачи-неврологи выписывают ноотропы от всех болезней. Считается, что они спасают от деменции, улучшают память и стимулируют работу мозга. А люди верят — препараты с ноотропным эффектом входят в десятку самых продаваемых лекарств даже в пандемию. Рассказываем, откуда они взялись, когда их применяют и есть ли от них эффект.
Что это такое
Это препараты, улучшающие работоспособность, память и способность к обучению. Раньше всех создали пирацетам — он появился в шестидесятые годы прошлого века. В семидесятых ученый Корнелиу Джурджа обнаружил, что это лекарство стабилизирует мембраны клеток центральной нервной системы, улучшая работу клеток мозга. Точный механизм работы пирацетама не знали — только догадывались. Джурджа предложил использовать его для восстановления умственных способностей после травм, кислородного голодания мозга, при старческой деменции и врожденном слабоумии у детей.
Большинство ноотропов — животного происхождения. Их добывают из мозга свиней и рогатого скота, богатых низкомолекулярными белками. Стоят препараты недорого, а побочные эффекты вызывают редко, поэтому врачи их любят.
Когда их применяют
Чаще всего ноотропы мелькают в назначениях неврологов. Их назначают от всего — от невроза и ОКР, от ВСД, которого нет, и деменции. В стационарах ноотропные препараты льют внутривенно, чтобы ускорить восстановление тканей после инсульта или транзиторной ишемической атаки — так предписывают клинические рекомендации. Но они же не рекомендуют использовать некоторые ноотропы в острый период ишемического инсульта из за возможного истощения нейронов и синдрома обкрадывания. Поэтому ориентироваться только на них недостаточно.
«Сначала врач ставит общепризнанный диагноз, — рассказывает невролог GMS Сlinic Сергей Макаров. — Если речь идет о сосудистых когнитивных нарушениях, то в первую очередь корректируют факторы риска: сахарный диабет, атеросклероз и артериальную гипертензию. Не все болезни требуют назначения препаратов».
Но многие неврологи и психиатры, которые не интересуются новыми исследованиями, назначают ноотропы людям с ухудшением памяти, внимания и способности к обучению, ориентируясь только на клинические рекомендации. Например, церебролизин рекомендован для профилактики деменции при начальных признаках болезни Альцгеймера. Также многие врачи считают, что ноотропы помогут дольше оставаться в здравом уме и памяти при хронических сосудистых нарушениях головного мозга.
«Когда у ребенка нарушение психоневрологического развития, у врача есть соблазн дать что-то „улучшающее функцию мозга“ — говорит к м.н., невролог детской клиники „Фэнтези“ Варвара Халецкая. — Ведь порой нет действенного метода, ведущего к полному выздоровлению. Поэтому врач и родитель пытаются вкладывать по крупицам: педагогическая коррекция, физиотерапия и медикаменты.
Другое дело, когда есть эффективный протокол лечения, но врач продолжает лечить по своему. Получается некрасиво: ребенку с психоречевыми нарушениями вместо педагогической коррекции дают ноотропные препараты, а с занятиями рекомендуют „подождать“. Или в случае сенсо-невральных нарушений слуха, при которых возможно слухопротезирование, направляют к неврологу „подпитать“ слуховой нерв. В этом случае просто теряется время. Прежде чем назначать лечение с недостаточной доказательной базой врач должен удостовериться, есть ли более эффективное решение».
Есть ли от них эффект
До 2000-х реальный механизм действия и эффективность ноотропов особо не исследовался. Врачи их назначали, а люди — пили. Среди студентов-медиков гулял миф, что месячный курс ноотропов перед экзаменами улучшает запоминание материала, а чтобы наверняка — нужно колоть его в мышцу или вену.
Сейчас доказательство эффективности препарата — не слово врача, а данные исследования. Участников должно быть от трех тысяч, а разделить их нужно минимум на две группы, одна из которых — контрольная с плацебо. При этом ни врач, ни пациент не знают, что пьет каждый из испытуемых — лекарство или «пустышку».
Ноотропные препараты изучены мало, а исследования их эффективности не соответствуют критериям. То людей слишком мало, то критерии непонятные. Например, оценивают количество баллов теста только после лечения — до лечения, видимо, забыли. Американское FDA в принципе не считает ноотропы лекарствами — в США они продаются как БАДы.
«Всем известно, что ноотропы — препараты без доказанной эффективности. Но их продолжают использовать, — говорит Варвара Халецкая. — Есть статистика, есть международные протоколы, которые помогают врачу. Но вместе с тем остается личный опыт каждого доктора с большим диапазоном: от «они бесполезны» до «у многих пациентов они эффективны».
Дело в том, что есть редкое исключение: пирацетам улучшает когнитивные функции у людей с тяжелой деменцией — такой вывод сделали при оценке 19 качественных исследований. Но вот при черепно-мозговой травме или легкой деменции пирацетам уже не поможет. Тем более он бесполезен для здоровых людей, желающих пойти по пути Эдди Морры из фильма «Области тьмы» и стать мегамозгом. Поэтому биохакерские эксперименты с мексидолом если и кажутся действенными, то лишь благодаря самоубеждению.
Важно запомнить
Ноотропы якобы улучшают память и внимание, а ещё ускоряют восстановление после инсульта. Но исследования доказывают, что эффективны только отдельные препараты и только при тяжелой деменции. Поэтому:
Как устроена наша кожа и из-за чего возникает болезнь, при которой кожа становится очень хрупкой и может повредиться от любого прикосновения? Как живут люди, которых называют «бабочками», и чем медицина может им помочь?
Вместе с информационно-просветительским гуманитарным проектом «12 месяцев» мы продолжаем серию материалов о редких (орфанных) генетических заболеваниях и жизни людей с ними.
Читайте в январе рассказ о буллезном эпидермолизе, который встречается у одного из 100 тысяч человек, а также историю юриста Игоря Чувствинова.
Буллезный эпидермолиз (БЭ) — это группа генетических заболеваний, при которых даже незначительное механическое воздействие на кожу и слизистые оболочки приводит к образованию пузырей. Когда эти пузыри разрываются, на их месте остаются болезненные раны, которые быстро инфицируются и с трудом поддаются лечению.
Болезнь сильно снижает качество жизни людей и требует сложного и дорогостоящего ухода. Нередко проявления заболевания выражены настолько, что пациенты полностью зависят от своих близких.

Источник: сайт фонда «Дети-бабочки»
Точно посчитать частоту встречаемости буллезного эпидермолиза сложно. По данным Национального института здоровья США, заболеваемость БЭ составляет примерно 1 случай на 100 тысяч человек в общей популяции и почти 2 случая на 100 тысяч новорожденных. В России, по оценкам фонда «Дети-бабочки», который помогает детям с буллезным эпидермолизом, с этим заболеванием проживает около 2000-2500 человек.
Почему возникает и как проявляется буллезный эпидермолиз?
Кожа человека состоит из нескольких слоев клеток — кератиноцитов. Они соединяются и удерживаются вместе с помощью специальных белков, основные из которых — это кератины, коллаген, ламинин и киндлин. Мутации в генах, необходимых для их синтеза, приводят к нарушению функции этих белков. Это приводит к тому, что даже при небольшом натяжении или давлении на кожу ее слои отходят друг от друга и в этом месте образуются пузыри.
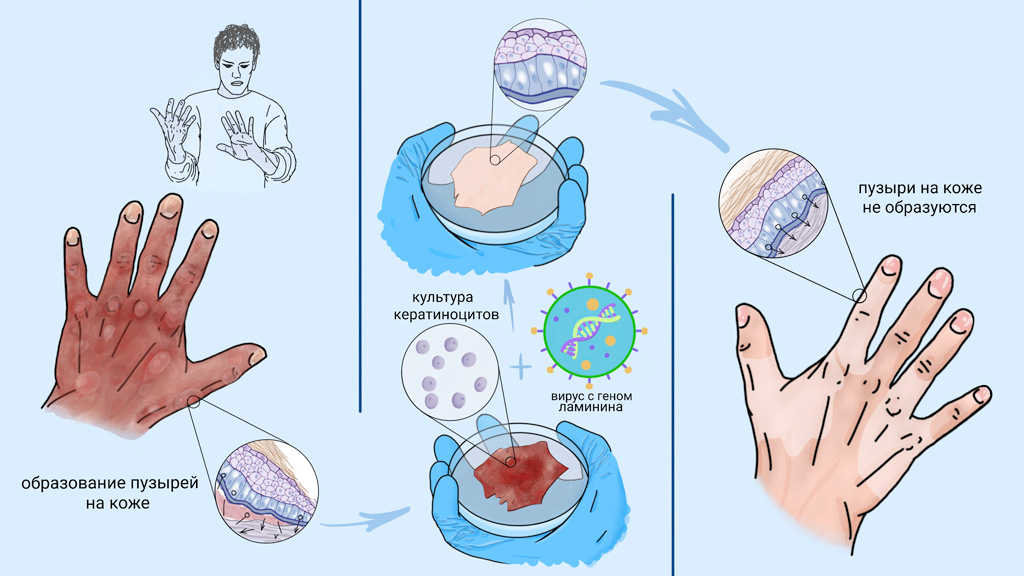
Основные проявления БЭ связаны с кожей, однако болезнь затрагивает весь организм. Так, наиболее часто поражаются слизистые оболочки желудочно-кишечного тракта. В ротовой полости со временем образуются эрозии и пузыри, а в пищеводе — сужения, значительно затрудняющие глотание. Кроме того, нередки случаи нарушения проходимости кишечника, анальных трещин и запоров.
Болезнь поражает и глаза: к ее последствиям относится хроническое воспаление, язвы на роговицах. Способность к самообслуживанию чрезвычайно сильно ограничивает ситуация, когда срастается кожа пальцев.
Еще одна опасность для людей с БЭ — повышенный риск рака кожи, который увеличивается с возрастом.
Можно ли вылечить буллезный эпидермолиз?
Основные способы лечения буллезного эпидермолиза — это ведение образа жизни, уменьшающего вероятность травмирования кожи, и использование специальных дорогостоящих повязок. Однако уже давно у врачей и исследователей появилось желание воздействовать на причину заболевания — неспособность клеток плотно соединяться друг с другом.
Начиная с конца 1980-х годов предпринимались разные попытки лечения, основанные на методах клеточной терапии (то есть терапии стволовыми клетками). Их цель — улучшить течение болезни в тех ситуациях, когда обычное лечение не помогало. Однако в большинстве случаев эффект был выражен слабо и длился очень недолго.
Первым подходом клеточной терапии стала попытка трансплантации пациентам с БЭ кератиноцитов, которые были взяты из непораженных участков кожи. Это дало ограниченный и непродолжительный эффект, который, по-видимому, был обусловлен временным уменьшением воспаления в зоне трансплантации.
Другой подход основывался на внутривенном введении стволовых клеток костного мозга и мезенхимальных стромальных клеток (МСК), способных мигрировать в зоны повреждения. Исследователи предполагали, что эти клетки, трансплантированные от здоровых доноров, синтезируют белки, необходимые для образования нормальной кожи. Однако, как и в предыдущем случае, эффект этого лечения был успешным лишь отчасти.
При использовании стволовых клеток костного мозга наблюдалось временное улучшение течения болезни. Однако несколько пациентов в процессе клинического исследования умерли от осложнений, связанных с подготовкой к трансплантации.
В случае использования мезенхимальных стромальных клеток (МСК) столь драматичных побочных эффектов не было. Но эффект от лечения — ускорение заживления ран и улучшение общего самочувствия — по-прежнему длился не более полугода.
Из-за сложностей при получении стволовых клеток костного мозга и МСК, ученые обсуждают возможность использования индуцированных плюрипотентных стволовых клеток (ИПСК). ИПСК — это любые клетки, которые в лабораторных условиях приводят в т.н. плюрипотентное состояние (когда клетка становится недифференцированной, какой была в эмбриональном периоде развития). Из него они могут стать почти любой другой клеткой, в том числе стволовой клеткой костного мозга, МСК или сразу фибробластом или кератиноцитом. Однако процесс получения клеток из ИПСК пока технически несовершенен, поэтому исследования таких клеток проводятся пока только в условиях лабораторий.
Есть ли надежда на генно-клеточную терапию?
Может сложиться впечатление, что введение стволовых клеток костного мозга и мезенхимальных стромальных клеток (МСК) в системный кровоток малоперспективно из-за технического несовершенства этого подхода и кратковременности терапевтического эффекта. Тем не менее дальнейшие исследования в этом направлении необходимы, потому что на сегодняшний день это единственный подход, потенциально позволяющий действовать на внекожные проявления болезни.

О первом успехе генно-клеточной терапии буллезного эпидермолиза стали говорить в 2006 году, когда группа итальянских исследователей смогла восстановить кожу пациента с пограничным буллезным эпидермолизом. Эта форма заболевания появляется при мутации в гене белка ламинина. Для лечения пациента исследователи выделили из неповрежденных участков его кожи кератиноциты, в которые ввели здоровый ген ламинина. Далее в лабораторных условиях из этих кератиноцитов вырастили тонкие пласты ткани, которые трансплантировали в поврежденные участки кожи. Через полгода кожа в зоне трансплантации не отличалась от нормальной и не требовала повторных вмешательств.
В 2015 году успех этого подхода закрепил опыт по трансплантации практически всего эпидермиса семилетнему мальчику, который к моменту первой трансплантации утратил около 80% кожных покровов.
В результате лечения у пациента сформировалась полностью здоровая и функциональная кожа. Сейчас трансплантированная кожа пациента почти не отличается от здоровой. Он ведет обычную жизнь и даже занимается спортом, хотя до лечения из-за боли практически не мог двигаться, нормально питаться и нуждался в постоянном обезболивании.
-
Сегодня эта технология используется в трех препаратах, проходящих клинические исследования — EB-101, LZRSE-Col7A1 и FCX-007. Другой препарат, проходящий клинические исследования — B-VEC. Его преимущество — возможность непосредственного введения в кожу пациентов, что позволяет миновать затратный по времени этап выделения и выращивания клеток пациента.
26-летний Игорь Чувствинов рассказал, как ему удается учиться, работать, дружить и чувствовать себя счастливым состоявшимся человеком, несмотря на ограничения из-за болезни.
О детстве и постановке диагноза
Дети с буллёзным эпидермолизом нередко имеют слабую кожу уже на момент рождения и получают травмы при родах. Мой случай не был исключением. Но до 3-х лет родителям не понимали, что со мной происходит.
Были две сложности в постановке диагноза: во-первых, врачи первоначально хотели поставить пузырчатку (аутоиммунное заболевание, которое характеризуется появлением пузырей на коже и слизистых оболочках), потому что симптомы этих заболеваний похожи. Во-вторых, врачи принимали проявления болезни за временные явления и ждали, что они пройдут сами, но они не проходили.
Я родился в 1995-м году, и понятно, что всем тогда было не до редких заболеваний. О них не говорили в СМИ, не было профильных фондов. И врачи оказывались в очень сложном положении, видя меня.
На вопрос: «Чем лечиться?» дерматологи отвечали: «Вы столько прожили с этим заболеванием, вы знаете о нем больше, чем я».
О влиянии болезни на жизнь
Я не знаю жизни без этого заболевания, поэтому мне сложно сравнить «до» и «после». Но если смотреть на мою жизнь и жизнь других людей, то, конечно, отличия есть.
Во-первых, я намного чаще наблюдался у врачей.
Во-вторых, точно могу сказать, что мое заболевание повлияло на спектр моих хобби. Я никогда не занимался опасным спортом, не катался на велосипеде, не играл в футбол, не ходил далеко гулять. В детстве это могло быть очень травматичным для моих ног.
Я больше домосед. Заболевание переориентировало меня на книги, фильмы, компьютерные игры и прочее, что не связано с активностью, способной привести к травмам. При этом я довольно общительный человек, поэтому не могу сказать, что болезнь мешала или мешает мне в социализации.
В-третьих, мой диагноз влияет на то, что я ем: я не употребляю продукты, которые могут вызвать аллергическую реакцию. После чего кожа может начать чесаться. И есть риск нарваться на круговорот болячек в природе, когда они уже не заживают, потому что постоянно их расчесываешь. Естественно, что в детстве за этим следили родители, а потом я стал сам видеть связь между употреблением какого-то продукта и последствиями, которые оно вызывает.
И если раньше меня печалило, что мне 14 лет, а я ни разу не пробовал колу, то потом я стал думать: «Ну и хорошо, что не попробовал. А то, кто знает, что было бы?». Я питаюсь, как и остальные члены моей семьи, просто исключив вредные для меня продукты.
Абсолютно все, что связано с применением физической силы, вызывает у меня проблемы. Например, мыть посуду я могу только в перчатках, но на деформированную кисть перчатка не налезает. Если делать это без перчаток, может быть какая-то нехорошая реакция на моющее средство, а кожа на руках будет сохнуть еще сильнее. Я не могу самостоятельно открыть бутылку воды, потому что из-за этого механического воздействия мои ладони травмируются. Я могу открыть не любую дверь. Если дверная ручка шарообразной формы, да ещё и с рельефом, травмы не избежать. Я не могу преодолевать большие расстояния пешком. Чем дольше я иду, тем сильнее это травмирует мои ноги. Даже небольшой выступ на асфальте может быть достаточным для появления раны на стопе. И так со многими действиями.
Но я не совсем беспомощный — с технологиями проблем нет. Я пишу, пользуюсь клавиатурой и мышкой. В работе мне приходится часто и быстро печатать большое количество текста, в том числе на телефоне. С этим я справляюсь.
Об отношении к болезни
Мое заболевание никогда не было для меня чем-то, что заставляло бы меня отчаиваться и падать духом. Скорее, я воспринимал его как само собой разумеющийся факт. Например, как тот, что солнце встает на востоке и заходит на западе.
Я осознаю свои ограничения. Тут вопрос не в том, осознаю ли я их, а в том, как я к ним отношусь. С детства в силу возраста и характера я переживал из-за этого не так сильно, как мог бы. А сейчас мне 26 лет, и я привык к этим ограничениям.
Многие мои сверстники водят автомобиль, а я нет. Когда мне было 18, меня это сильнее трогало, сейчас мне это глубоко индифферентно. Не вожу — и не вожу. Может, и к лучшему. Ни в кого не врежусь и не буду за это привлечен к ответственности. Хорошо, что не ем всякую химозу, зато у меня здоровый желудок. Какое-то такое отношение. С годами стало проще.
Понятно, что некоторые проявления болезни доставляют дискомфорт, но я отношусь к этому со смирением и осознанием того, что если что-то нельзя, то и ладно, живем дальше. С этим можно жить.
И главный вопрос «Как жить?». Отчаявшись? Не ставя перед собой никаких целей? Жить, как получится? Или, даже несмотря на заболевание, стараться чего-то достичь, кому-то помочь? Мне повезло, что сейчас не Средние века, и я вижу много возможностей для самореализации и социализации даже при наличии таких существенных отклонений, как у меня.
О друзьях, учебе и жизни в обществе
Никакого буллинга в мою сторону никогда не было, по крайней мере активного. Я учился в обычной средней общеобразовательной школе, потом поступил в университет. И везде у меня появлялись друзья — общения в моей жизни немало.
Я юрист, сейчас одновременно учусь в аспирантуре и прохожу стажировку в крупной компании. Все выходные и праздники заполняю дополнительной учебой.
Два моих главных хобби с детства — чтение книг и компьютерные игры.
Люблю читать психологов, один из моих любимых — Виктор Франкл. Его «Скажи жизни да» — это, можно сказать, моя настольная книга.
Из последних впечатливших меня книг, — «Игры, в которые играют люди» Эрика Берна. Однако чем старше я становлюсь, тем меньше художественной и больше профессиональной литературы я читаю.
Как я уже говорил, в обычной жизни я испытываю ограничения там, где у других людей их нет. Однако не могу сказать, что испытываю какую-то радость, когда у меня получается что-то, что получается у других. Обычно наоборот: я испытываю радость, когда я делаю что-то, что не могут другие. Вот тогда да! Во многом это касается профессиональных успехов.
О техническом прогрессе, который помогает людям-бабочкам
Кто знает: возможно, лет через 5-10 я и машину смогу водить. Например, еще 5 лет назад у меня не было никакой возможности поставить коронки на зубы. До 8 лет мои зубы в принципе лечить не хотели. «Мы не можем это лечить. Ваш рот плохо открывается. Мы боимся вас травмировать».
Был случай, когда в одной клинике врач выбежала из кабинета с криками: «Я не хочу в тюрьму!». Потому что мое заболевание не только про травмы кожи, но и про травмы слизистых оболочек.
Недавно фонд «Дети-бабочки» обучил врачей в клинике челюстно-лицевой хирургии имени Сеченова. И сейчас мне поставили на некоторые зубы коронки, появились технологии, которые это позволяют. Это та реальность, которая придает мне оптимизм. Технический прогресс на месте не стоит, и он работает на меня.
Однако я бы не согласился участвовать в клиническом исследовании нового препарата от своей болезни. Несмотря на все ограничения, которые у меня есть, я выбираю свою нынешнюю жизнь со всеми неудобствами, а не рискованные методы лечения.
Отдельно я хочу выразить благодарность фонду «Дети-бабочки». Он вносит существенный вклад в мою жизнь и в жизнь других людей с буллезным эпидермолизом — до него нам было намного сложнее.
Благодаря просветительской работе фонда, намного больше врачей знают, что есть такая болезнь. И значит, люди с таким диагнозом могут к ним прийти, быть понятыми и получить помощь.
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
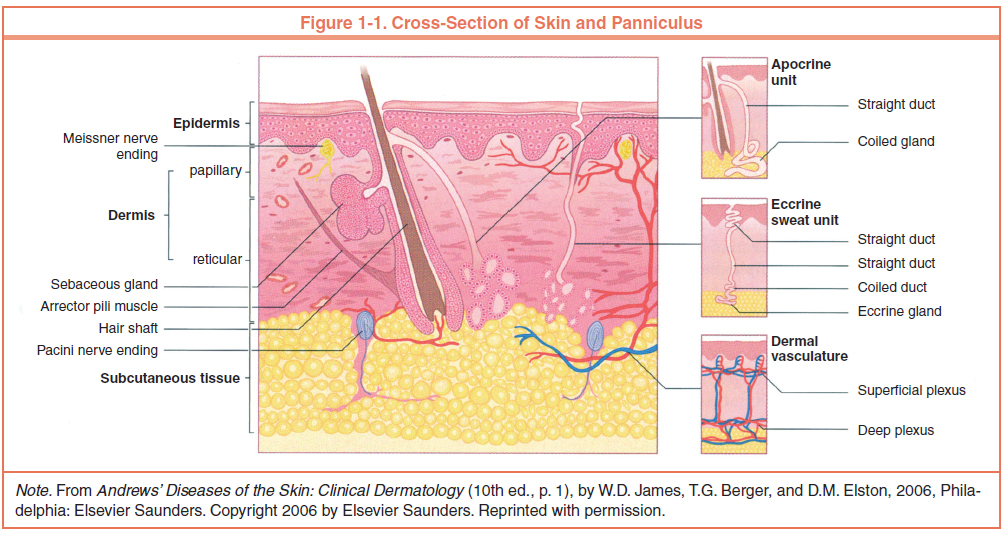
Рис.1. Структура кожи
Эпидермис
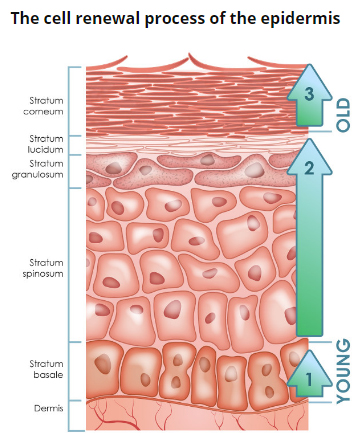
Рис. 2. Эпидермис
Эпидермис – постоянно слущивающийся эпителиальный слой кожи, в котором представлены в основном из 2 типа клеток – кератиноциты и дендритные клетки. В небольшом количестве в эпидермисе присутствуют меланоциты, клетки Лангерганса, клетки Меркеля, внутриэпидермальные Т-лимфоциты. Структурно эпидермис разделяется на 5 слоев: базальный, шиповатый, зернистый, блестящий и роговой , различающиеся положением и степенью дифференцировки кератиноцитов, основной клеточной популяции эпидермиса (рис. 2).
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
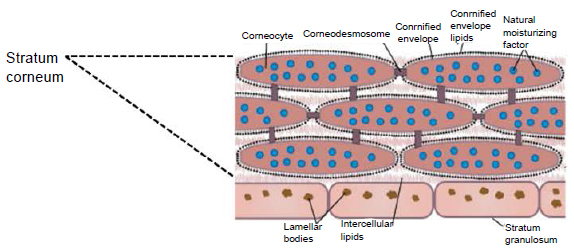
Рис. 3. Схематичное изображение рогового слоя с нижележащим зернистым слоем эпидермиса.
Регуляция пролиферации и дифференцировки кератиноцитов эпидермиса . Являясь непрерывно обновляющейся тканью, эпидермис содержит относительно постоянное число клеток и регулирует все взаимодействия и контакты между ними: адгезию между кератиноцитами, взаимодействие между кератиноцитами и мигрирующими клетками, адгезию с базальной мембраной и подлежащей дермой, процесс терминальной дифференцировки в корнеоциты. Основной механизм регуляции гомеостаза в эпидермисе поддерживается рядом сигнальных молекул – гормонами, факторами роста и цитокинами. Кроме этого, эпидермальный морфогенез и дифференцировка частично регулируются подлежащей дермой, которая играет критическую роль в поддержании постнатальной структуры и функции кожи.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Внеклеточный матрикс (ВКМ) дермы , или межклеточное вещество, в состав которого входят различные белки (главным образом коллаген, эластин), гликозаминогликаны, самым известным из которых является гиалуроновая кислота, и протеогликаны (фибронектин, ламинин, декорин, версикан, фибриллин). Все эти вещества секретируются фибробластами дермы. ВКМ представляет собой не беспорядочное скопление всех компонентов, а сложноорганизованную сеть, состав и архитектоника которой определяют такие биомеханические свойства кожи, как жесткость, растяжимость и упругость. К белкам ВКМ прикрепляются кератиноциты эпидермиса, которые тесно состыкованы друг с другом. Именно они и формируют плотный защитный слой кожи. Структура ВКМ также способна оказывать регулирующее влияние на погруженные в него клетки. Регуляция может быть как прямой, так и косвенной. В первом случае белки и гликозаминогликаны ВКМ непосредственно взаимодействуют с рецепторами клеток и инициируют в них специфические пути передачи сигнала. Косвенная регуляция осуществляется посредством действия цитокинов и ростовых факторов, удерживаемых в ячейках сети ВКМ и высвобождаемых в определенный момент для взаимодействия с рецепторами клеток. Структурная сеть ВКМ подвергается ремоделированию ферментами из семейства матриксных металлопротеиназ (ММР). В частности, ММР-1 и ММР-13 инициируют деградацию коллагенов I и III типов. Плотность сети ВКМ дермы неравномерна – в папиллярном слое она более рыхлая, в ретикулярном - значительно плотнее как за счет более близкого расположения волокон структурных белков, так и за счет увеличения диаметра этих волокон.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
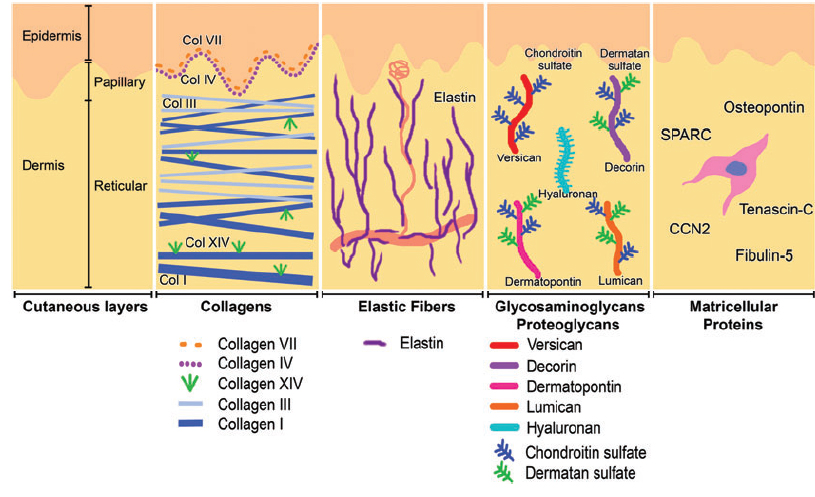
Рис. 4. Схематичное представление слоев кожи и распределения коллагенов разных типов.
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
Гиалуроновая кислота (ГК) представляет собой линейный полисахарид, состоящий из повторяющихся димеров D-глюкуроновой кислоты и N-ацетилглюкозамина. Количество димеров в полимере варьирует, что приводит к образованию молекул ГК разного молекулярного веса и длины - 1х10 5 -10 7 Да (2-25 мкм), оказывающих, соответственно, различный биологический эффект.
ГК - высокогидрофильное вещество, влияющее на движение и распределение воды в матриксе дермы. Благодаря этому ее свойству наша кожа в норме и в молодости обладает высоким тургором и сопротивляемостью механическому давлению.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
Подкожно-жировая клетчатка
Подкожно-жировая клетчатка , или гиподерма, - самый нижний слой кожи, располагается под дермой. Состоит из жировых долек, разделенных между собой соединительнотканными септами, содержащими коллаген и пронизанными крупными сосудами. Главными клетками жировых долек являются адипоциты, количество которых варьирует в различных областях тела. В настоящее время ПЖК рассматривают не только как энергетическое депо, но и как эндокринный орган, адипоциты которого участвуют в выработке ряда гормонов (лептина, адипонектина, резистина), цитокинов и медиаторов, оказывающих влияние на метаболизм, чувствительность к инсулину, функциональную активность репродуктивной и иммунной систем.
Не спешите искать вынесенный в заголовок термин в Яндекс – что-то конкретное об этом направлении сразу вы точно не найдете. В этой статье мы поможем вам разобраться в том, что такое эпигенетическая косметология.
Эпигенетика – это наука, изучающая активность человеческих генов, которые не затрагивают структуру ДНК. Эта научная дисциплина направлена на то, чтобы доказать – внешний вид нашей кожи определяется генетикой лишь на 20-30%. А с остальными 80% или 70% генами человек может работать самостоятельно, по сути, продлевая молодой вид своей кожи.
Скажете, что это фантастика? Возможно. Но в современной косметологии с каждым днем не остается ничего невозможного.

Механизм взаимодействия внешних факторов и изменений в организме
Предмет изучения эпигенетики – любые внешние факторы, влияющие на наши гены. Например, это постоянные стрессы, отражающиеся на состоянии нашей кожи. Или хронический недосып, который тоже не добавляет преимуществ нашему внешнему виду.
Так вот, недосып, стрессы или другие внешние факторы влияют на обменные процессы в нашем организме, на функции клеток и тканей в целом. Это нарушает различные функции и вызывает сбои в работе клеток, тканей и органов.
Но внешние факторы могут оказывать разное воздействие – как негативное, так и благоприятное. Простой пример. Многие согласятся, что современные подростки 14-16 лет выглядят весьма «взросло» для своего возраста. Это вызвано тем, что в современном мире отсутствуют многие внешние факторы, ранее считавшиеся очень опасными, например, различные инфекции и детские заболевания, которых сегодня можно избежать путем своевременной вакцинации. Изменились условия жизни – в сторону большей комфортности, появились возможности вести здоровый образ жизни. Наконец, стала куда более доступной энергетически ценная пища, витамины. Совокупность этих факторов позволила генам, отвечающим за высокий рост и более активное развитие многих систем организма, «проснуться» и начать действовать.
Но внешние факторы могут пробудить к жизни и гены с отрицательным воздействием. Например, это может произойти еще до рождения ребенка. Предположим, что в процессе внутриутробного развития плод получает мало пищи и автоматически запасает еду «впрок». После рождения, если питание вновь недостаточное, организм родившегося ребенка выживает за счет накопленных запасов. Если же нет, то «запасливый» метаболизм может спровоцировать ожирение или диабет на дальнейших этапах жизни.
Омоложение с помощью эпигенетики
Вернемся к косметологии. За последнее время выявили массу генов, ответственных за выработку коллагена и эластина в коже, как положительные, так и отрицательные. Именно отрицательные гены ухудшают способности к регенерации кожи, удержанию влаги, сохранению эластичности. Иными словами – приводят к старению кожи.
И как раз благодаря эпигенетической косметологии внешность реально улучшать не только с помощью мезотерапии или пластических операций, но и с помощью препаратов, состав которых максимально напоминает строение человеческих клеток.
Какие же вещества сегодня используют косметологи в качестве эпигенетических модуляторов?
- Ресвератрол – полифенол из красного винограда, обладающий профилактическим эффектом против опухолей.
- Флавоноиды – кверцетин из ягод, фруктов, сои.
- Полифенолы зеленого чая.
Укрепляют эпигенетический профиль и пептиды, в частности, трипептид GHK-Cu, который также называют «медным» или «медьсодержащим». Он помогает «усмирять» ряд генов возникающих у людей с метастатическими опухолями, повышает активность гена, отвечающего за выработку коллагена и декорина, улучшает генетическую активность стволовых клеток кожи. Сегодня пептиды присутствуют во многих препаратах – масках, кремах, сыворотках, мезотерапевтических препаратах.
В эпигенетической косметологии не обойтись и без ретиноидов. Они активируют гены, отвечающие за деление клеток и омоложение кожи.
Какие препараты используют в клинике «МАК»?
Определение эпигенетических механизмов, от которых зависит изменение кожи, дает современным производителям косметологических препаратов массу возможностей. Сегодня на рынке есть масса средств, в составе которых есть ингредиенты, обладающие позитивным эпигенетическим эффектом. Многие из таких препаратов используют и врачи клиники «МАК».
Во-первых, это линейка препаратов PremierPharm – наружные и инъекционные средства, а также БАДы:

- Kane NY Primer – филлер против морщин.
- Uvenox® AP2 – сыворотка (топический миорелаксант).
- Post-Treatment Mask – маска для восстановления.
- Sculpt Secret™ Facial Sculpting Serum – липомоделирующая сыворотка для лица.
- Sculpt Secret™ Body Slimming Serum – липомоделирующая сыворотка для тела.
- Sculpt Secret™ Eye Sculpting Serum – скульптурирующая сыворотка для лица.
- Meso-Wharton P199™ Facial Renewal Serum и Cream – сыворотка и крем с омолаживающим эффектом.
К инъекционным препаратам относятся:
- MesoEye C71™ – для коррекции периорбитальной области.
- MesoSculpt C71™ – для перепрограммирования жировых клеток.
- Meso-Wharton P199™ – средство для реструктуризации и биорепарации кожи.
- Meso-Xanthin F199™ – для эпигенетической «клеточной» терапии кожи.
Что касается биодобавок, то это препарат Epi-Oral F199™ – противовозрастная биологическая добавка эпигенетической направленности.

Наши специалисты активно применяют и инъекционные препараты немецкого бренда Leistern Pharmaceuticals, направленные на профилактику старения, борьбу с симптомами угревой болезни, коррекцию дисхромий.

Данные средства активно используются в комплексных программах омоложения кожи. Препараты этого бренда помогают восстановить иммунитет кожи, повысить активацию обменных процессов в ней и стимулировать активность фибробластов, что предотвращает старение кожных покровов.
Подведем итог. Сегодня эпигенетическую косметологию можно назвать очередным шагом в развитии биохолистического подхода к профилактике старения и лечению заболеваний кожи. Преимущество эпигенетики в том, что она, выражаясь простыми словами, помогает «зрить в корень», исследуя глубинные структуры кожи и устраняя причины ее плохого состояния там, где «традиционные» лекарства подчас оказываются бессильны.
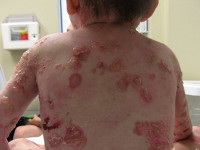
Буллезный эпидермолиз – группа наследственных заболеваний, которые характеризуются легкой ранимостью кожи, отсюда второе название этих патологий - «механобуллезная болезнь». Основным симптомом служит развитие на поверхности кожных покровов пузырей с серозным содержимым, после чего на их месте возникают долго незаживающие эрозии. Диагностика различных типов буллезного эпидермолиза осуществляется при помощи иммуногистологических и генетических методик, а также на основании данных осмотра пациента и изучения его наследственного анамнеза. Специфического лечения не существует, однако правильная и комплексная симптоматическая терапия может в ряде случаев значительно улучшать состояние больного.
МКБ-10
Общие сведения
Буллезный эпидермолиз – это гетерогенная группа наследственных заболеваний кожи, которые характеризуются образованием пузырей и эрозий в ответ на незначительное механическое воздействие. Впервые данный термин был использован в 1886 году немецким врачом-дерматологом Генрихом Кёбнером, дальнейшие исследования продемонстрировали, что существует множество разновидностей этой патологии. Генетические исследования буллезного эпидермолиза показали, что он может наследоваться как аутосомно-рецессивно, так и аутосомно-доминантно, с ним ассоциированы мутации более чем 10 генов. Существенные различия имеются и в клиническом течении разных типов этого заболевания, встречаемость колеблется в пределах 1:30000-1:1000000.
Патогенез нарушений при буллезном эпидермолизе долгое время оставался малоизученным. Прорыв в этом направлении произошел с внедрением в медицинскую практику электронной микроскопии, которая помогла визуализировать ультраструктуру пораженных тканей кожи. Следующий важный шаг в изучении буллезного эпидермолиза был совершен с открытием иммуногистологических исследований (иммунофлуоресценция). В настоящее время именно эти методики играют важнейшую роль в диагностике данных заболеваний, уступая по точности лишь генетическому анализу. Ввиду того, что методы изучения буллезного эпидермолиза постоянно совершенствовались, претерпевала изменения и классификация форм этой группы заболеваний.

Причины буллезного эпидермолиза
Этиология буллезного эпидермолиза неодинакова у разных типов заболевания, что в некоторых случаях достаточно сильно осложняет диагностику. Простой буллезный эпидермолиз обусловлен мутациями генов KRT5 и KRT14, однако, по данным врачей-генетиков, нарушением структуры этих генов объясняется только 75% случаев заболевания этого типа. При этом в кожных покровах, предположительно, нарушается равновесие в системе «ферменты-ингибиторы», и некоторые белки становятся объектом атаки. При простом буллезном эпидермолизе это могут быть протеины базальной мембраны (альфа6-бета4-интегрин) и белки десмосом базального слоя эпидермиса – десмоплакин, плакофиллин-1. В результате при механическом воздействии происходит выделение ферментов, которые разрушают указанные белки, тем самым провоцируя цитолиз и разрушение структуры эпидермиса, приводя к образованию пузырей.
Причиной развития другой формы патологии – пограничного буллезного эпидермолиза – являются мутации в генах LAMB3, LAMA3 и некоторых других. Большинство из этих мутации наследуется по аутосомно-рецессивному механизму, объектом атаки разбалансированной ферментной системы становятся такие протеины, как коллаген 17-го типа и ламинин-332. Эти белки участвуют в поддержании нормальной структуры нижних слоев эпидермиса, поэтому их повреждение приводит к характерным клиническим симптомам пограничного буллезного эпидермолиза. Помимо легкого образования пузырей и эрозий он характеризуется также повышенной ломкостью кожных покровов и более тяжелым течением.
Дистрофический тип буллезного эпидермолиза обусловлен мутациями в гене COL7A1, которые могут наследоваться как по аутосомно-доминантному, так и аутосомно-рецессивному механизмам. Белком-мишенью при этом выступает коллаген 7-го типа, который отвечает за стабильность структуры других соединительнотканных волокон кожи. Уменьшение количества этого протеина в тканях кожных покровов приводит к легкому развитию высыпаний, эрозий и пузырей, а также нередко сопровождается нарушениями других органов. В частности, дистрофический буллезный эпидермолиз часто приводит к развитию контрактуры суставов, поражение захватывает слизистые оболочки органов дыхательной и пищеварительной систем. На рубцах, которые остаются после заживления эрозий, нередко возникают злокачественные опухоли.
В целом, общий патогенез буллезного эпидермолиза можно свести к нарушению активности некоторых ферментов в тканях кожи. В результате этого разрушаются определенные ключевые структурные белки эпидермиса, дермы или базальной мембраны, что нарушает связи между клетками и приводит к образованию пузырей при механическом воздействии даже незначительной силы. Типы буллезного эпидермолиза отличаются один от другого локализацией пузырьков, видом мутации, что привела к этому заболеванию, и разновидностью белка, который стал объектом атаки ферментов.
Классификация буллезного эпидермолиза
В настоящий момент существуют десятки разновидностей буллезного эпидермолиза, которые достаточно трудно классифицировать в определенные группы. Проблема осложняется еще и тем, что почти за полтора века изучения данной патологии предпринимались неоднократные попытки разделить ее на определенные типы, используя самые современные на тот момент данные. В конечном итоге это привело к некоторой путанице, даже в научной литературе можно найти самые разнообразные варианты разделения буллезного эпидермолиза на разновидности. Наиболее современная классификация этого состояния в дерматологии включает в себя четыре типа заболевания, которые, в свою очередь, делятся на ряд подтипов:
- Простой буллезный эпидермолиз – имеет 12 подтипов, наиболее распространенными из которых являются синдромы Вебера-Коккейна, Кёбнера, Доулинга-Меары. Может наследоваться как аутосомно-доминантно, так и рецессивно, встречаемость составляет 1:100000. Простой буллезный эпидермолиз характеризуется образованием внутриэпидермальных или, реже, субэпидермальных пузырей, так как при этом заболевании поражаются белки эпидермиса.
- Пограничный буллезный эпидермолиз – делится на 2 подтипа, один из которых имеет еще 6 самостоятельных клинических форм. Наиболее тяжелой формой этого заболевания является подтип Херлитца, имеющий крайне высокую смертность. Встречаемость пограничного буллезного эпидермолиза составляет около 1:500000, образование пузырей при нем происходит на уровне светлой пластинки, что и дало ему название «пограничный».
- Дистрофический буллезный эпидермолиз – имеет два подтипа, которые делятся по механизму наследования этой патологии (доминантный и рецессивный подтипы). При этом встречаемость доминантного варианта несколько выше (3:1000000 против 1:500000 у рецессивной формы дистрофического буллезного эпидермолиза). Рецессивная разновидность также имеет несколько клинических форм, наиболее тяжелой из которых является подтип Аллопо-Сименса. При этом варианте заболевания у больных возникают глубокие эрозии, оставляющие после себя шрамы, возможны контрактуры суставов, поражение слизистых оболочек. Образование пузырей при этом происходит в сосочковом слое дермы, что и обуславливает появление шрамов и длительное заживление эрозий.
- Синдром Киндлера, или смешанный буллезный эпидермолиз, является одной из наиболее редких и малоизученных форм данной патологии. Особенностью, которая позволила выделить эту форму в отдельный тип, является образование пузырей во всех слоях кожи – эпидермисе, у светлой пластинке, в дерме. В настоящий момент определен только белок, выступающий в качестве мишени ферментов при смешанном буллезном эпидермолизе – киндлин-1.
Такой тип разделения всех клинических форм буллезного эпидермолиза является в настоящее время общепринятым. Но даже в пределах одного типа наблюдается большое разнообразие клинических симптомов заболевания, что осложняет диагностику и нередко влияет на прогноз патологии. Поэтому на сегодняшний день не прекращаются поиски более структурированной и приемлемой классификации буллезного эпидермолиза.
Симптомы буллезного эпидермолиза
Проявления буллезного эпидермолиза разных типов объединяет одно – развитие пузырей и эрозий в ответ на механическое воздействие на кожу. Различается лишь степень выраженности этих изменений, локализация, время существования и результаты заживления. При локализованной форме простого буллезного эпидермолиза (подтип Вебера-Коккейна) поражения располагаются только на определенном участке тела (руки, стопы). В младенческом возрасте возможна более широкая площадь появления пузырей, но с возрастом их выраженность уменьшается. Напротив, генерализованный подтип Доулинга-Меары характеризуется развитием мелких везикулярных высыпаний на значительной площади тела. Такой тип буллезного эпидермолиза возникает с самого раннего детства и может стать причиной смерти ребенка, итогом разрешения пузырьков может быть гиперкератоз, нарушения пигментации кожи, иногда возникает поражение слизистых.
Пограничная форма буллезного эпидермолиза протекает намного более тяжело, особенно так называемый летальный подтип Херлитца. При этом наблюдается повышенная ломкость кожных покровов, образование большого количества пузырьков, эрозий, на лице и спине часто возникают симметричные грануляции. Поражаются и слизистые оболочки рта, обнаруживается гипоплазия эмали и обусловленный ею тяжелый кариес. Столь тяжелое течение пограничного буллезного эпидермолиза часто становится причиной летального исхода в первые годы жизни. У выживших больных во взрослом возрасте формируются контрактуры суставов, поражение почек, потеря ногтей. Более легкая атрофическая форма пограничного буллезного эпидермолиза также характеризуется обширными высыпаниями, после разрешения которых формируются атрофические участки и рубцы. Также она часто приводит к дистрофии ногтей и рубцовой алопеции.
Дистрофический буллезный эпидермолиз практически всегда является генерализованным и поражает обширные участки тела. Доминантный вариант заболевания в целом отличается более доброкачественным течением, образование пузырей и их разрешение происходит медленно, однако большинство больных в конце концов теряют ногти на руках. После заживления эрозий на поверхности кожи формируются заметные рубцы. Рецессивный вариант дистрофического буллезного эпидермолиза, особенно его тяжелый генерализованный подтип, протекает намного тяжелее: помимо высыпаний у больных часто регистрируются псевдосиндактилии, обширные шрамы, потеря ногтей. Возникает поражение костей скелета, на месте заживших шрамов с годами может развиваться плоскоклеточный рак. Проблемой является еще и высокая устойчивость подтипа Аллопо-Сименса к терапевтическим мероприятиям.
Осложнения любого типа буллезного эпидермолиза сводятся к риску развития шока (при обширных поражениях), присоединения вторичной инфекции и спровоцированного ею сепсиса, обезвоживания больных. В большинстве случаев терапевтические процедуры производят только с целью недопущения этих состояний. Вероятность развития осложнений тем выше, чем большую область тела занимают патологические очаги и чем деструктивнее их характер (напряженные пузыри, эрозии, язвы).
Диагностика буллезного эпидермолиза
В настоящее время диагностика буллезного эпидермолиза осуществляется путем осмотра кожных покровов пациента, с помощью проведения иммуногистологических исследований и генетических анализов, в некоторых случаях производят изучение наследственного анамнеза. При осмотре кожных покровов специалист также может произвести диагностические тесты – механически воздействовать на кожу пациента и спустя время оценить результаты. Развитие на этом участке характерных для буллезного эпидермолиза пузырей или эрозий говорит в пользу наличия данного заболевания. На следующих этапах диагностики производят более точное определение формы патологии.
Иммунофлуоресцентный анализ при буллезном эпидермолизе осуществляется при помощи моно- и поликлональных антител, имеющих сродство к основным белкам эпидермиса, светлой пластинки и верхних слоев дермы. Это позволяет оценить количество того или иного белка, что, в свою очередь, говорит о ферментной активности тканей. Уменьшение количества того или иного белка свидетельствует о его низком выделении или же ускоренном разрушении. Снижение концентрации ключевых протеинов на определенных участках позволяет определить уровень развития пузырей на самом раннем этапе, что уже помогает с высокой долей вероятности определить тип буллезного эпидермолиза. Точку в диагностике этого состояния ставит генетический анализ методом прямого секвенирования генов, которые ассоциированы с тем или иным типом заболевания. Такой многостадийный подход к диагностике буллезного эпидермолиза обеспечивает высокую точность.
Значительно упростить диагностику этого заболевания позволяет изучение наследственного анамнеза пациента, по которому можно выявить его кровных родственников с такой же проблемой. Кроме того, если у кого-то из родных имеется буллезный эпидермолиз, имеет смысл производить пренатальную генетическую диагностику, что позволит выявить наличие данной патологии на ранних этапах развития плода. Дифференциальную диагностику осуществляют с истинной пузырчаткой, некоторыми формами буллезного пемфигоида, приобретенным буллезным эпидермолизом (который является не наследственным, а аутоиммунным заболеванием).
Лечение буллезного эпидермолиза
Специфического лечения этого заболевания не существует, все терапевтические процедуры сводятся к предупреждению развития осложнений и уменьшению выраженности пузырьков и эрозий. В случае тяжелых форм буллезного эпидермолиза назначают преднизолон. Из наружных терапевтических манипуляций производят асептическое вскрытие пузырьков, обработку их крышки антисептиками, накладывают гелиомициновую мазь. Наложение повязок нужно производить крайне осторожно, так как давление бинтов может спровоцировать появление новых пузырей. При наличии осложнений (шока, сепсиса) проводят симптоматическое лечение противошоковыми препаратами и антибиотиками. С профилактической целью можно производить облучение кожных покровов ультрафиолетовыми лучами.
Современная генетика и ряд других областей медицины продолжают широкие исследования буллезного эпидермолиза с целью поиска более эффективных методик лечения. Среди основных технологий и методов наиболее перспективными считаются способы с использованием стволовых клеток, белковая и генная терапии. Однако пока ни один из методов не вышел за рамки экспериментов на животных, поэтому буллезный эпидермолиз в настоящее время является неизлечимым заболеванием.
Прогноз буллезного эпидермолиза
Прогноз буллезного эпидермолиза чаще всего неопределенный, так как зависит от множества факторов и обстоятельств – типа заболевания, наличия или отсутствия у больного сопутствующих нарушений, его образа жизни. Например, локальный подтип простого эпидермолиза чаще всего имеет доброкачественное течение и редко создает угрозу жизни пациенту. Тогда как подтип Аллопо-Сименса имеет очень высокую смертность – как и от кожных проявлений, так и по причине отдаленных осложнений, таких как поражения почек и органов ЖКТ, а также развития плоскоклеточного рака кожи. Больные с такой проблемой должны бережно относиться к своей коже, не забывать про антисептическую обработку эрозий и других поражений, избегать занятий травмирующими видами спорта и иной деятельностью такого рода.
Читайте также:


