Как лечить простой герпес и цитомегаловирус
Обновлено: 25.04.2024
В статье рассматриваются некоторые аспекты этиопатогенеза герпесвирусных заболеваний у детей, современные подходы к лекарственной терапии и профилактике рецидивов.
This article discusses some aspects of the pathogenesis of herpes-associated diseases in children, modern approaches to drug therapy and relapse prevention.
В последние годы среди основных возбудителей вирусных инфекций у детей особое место занимают герпес-вирусы, что связано с их повсеместным распространением, широким разнообразием, полиорганностью поражения, многообразием клинических проявлений, а также высокой частотой хронического течения. Герпес-ассоциированные заболевания входят в число наиболее распространенных и плохо контролируемых инфекций человека. Это связано с тем, что герпес-вирусы могут длительно бессимптомно циркулировать в организме человека с нормальной иммунной системой, а при иммуносупрессии способствовать развитию тяжелых заболеваний, вплоть до угрожающих жизни генерализованных инфекций. Так, по данным Всемирной организации здравоохранения (World Health Organization, WHO), смертность от герпетической инфекции составляет около 16% и находится на втором месте после гепатита среди вирусных заболеваний [1].
.jpg)
Для синтеза вирусных белков и образования оболочки вируса, его капсида и ДНК «дочерних» вирионов необходимы аминокислоты, липопротеиды и нуклеозиды клетки-хозяина. По мере истощения внутриклеточных резервов эти молекулы поступают в инфицированную клетку из межтканевых пространств. В связи с тем, что герпес-вирусы напрямую зависят от интенсивности внутриклеточного обмена организма человека, они колонизируют преимущественно клетки эпителия, слизистых оболочек, крови и лимфоидной ткани, которые обладают наиболее высоким темпом обмена веществ.
Вирионы герпес-вирусов термолабильны — они инактивируются в течение 30 мин при температуре 50–52 °C, в течение 20 ч — при температуре 37,5 °C, но хорошо переносят лиофилизацию. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, на влажных медицинских материалах (вата и марля) — до их высыхания при комнатной температуре (до 6 ч). Уникальность герпес-вирусов заключается в том, что они способны непрерывно или циклично размножаться в инфицированных клетках тропных тканей (персистенция), а также пожизненно сохраняться в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных нервных ганглиев (латенция) и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов. Однако способность к персистенции и латенции у различных штаммов неодинаковая: наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна–Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами вирусов. Основной путь инфицирования — воздушно-капельный, при прямом контакте или через предметы обихода (общие посуда, полотенца, носовые платки и пр.). Отмечается также оральный, генитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции. ВПГ 1-го и 2-го типов, цитомегаловирус входят в число возбудителей TORCH-инфекций, способствуют развитию серьезных заболеваний новорожденных и детей младшего возраста. Вирусы простого герпеса, цитомегаловирус, вирус Эпштейна–Барр рассматриваются как индикаторы СПИДа в связи с их частым обнаружением при данном заболевании [3, 4]. С герпес-вирусами связывают развитие синдрома хронической усталости (Chronic fatigue syndrome — CFS) [5].
Клинически герпес-инфекция у детей может протекать в виде ветряной оспы (вирус варицелла зостер), инфекционного мононуклеоза (вирус Эпштейна–Барр), внезапной экзантемы (вирус герпеса человека 6-го и 7-го типов), афтозного стоматита (ВПГ 1-го или 2-го типа), мононуклеозоподобного синдрома (цитомегаловирус). У подростков и взрослых людей часто инфекция протекает бессимптомно, что объясняется как биологическими свойствами штаммов, так и индивидуальными особенностями иммунного ответа. Часто при снижении иммунореактивности организма герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому течению основного заболевания, развитию осложнений. Велика роль герпесвирусных инфекций, особенно цитомегаловирусной, в формировании младенческой смертности. Наибольшую угрозу для жизни и здоровья детей представляют герпетические нейроинфекции — летальность при них достигает 20%, а инвалидизация — 50%. Тяжело протекают офтальмогерпес (развитие катаракты или глаукомы — до 50%), генитальный герпес, генерализованная форма Эпштейна–Барр-вирусной инфекции (инфекционного мононуклеоза) [1, 6].
Герпесвирусная инфекция относится к трудноконтролируемым заболеваниям. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения данной патологии, средств, обеспечивающих полное излечение, не существует. Это обусловлено генотипическими особенностями возбудителя, формированием резистентности герпес-вирусов и молекулярной мимикрией.
Открытые с помощью методов молекулярной биологии механизмов репликации герпес-вирусов, а также изучение взаимодействия вируса с клеткой позволили создать целый ряд эффективных химиотерапевтических средств, обладающих противогерпетической активностью. Однако, эффективно купируя острые проявления инфекции, они не предотвращают рецидивирования, не всегда снижают частоту рецидивов.
Учитывая, что при герпес-ассоциированных инфекциях, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния, для повышения эффективности лечения в схемы терапии наряду с противовирусными препаратами приходится включать препараты, способствующие коррекции иммунного статуса больного. Все это диктует необходимость правильно подбирать лекарственное средство, его дозу и длительность приема, при необходимости использовать комбинацию различных препаратов, избегая при этом полипрагмазии. Определенную сложность терапии в детском возрасте вызывают возрастные ограничения для ряда лекарственных средств, наличие нежелательных лекарстввенных реакций (НЛР) и противопоказаний.
В настоящее время для лечения герпесвирусных заболеваний и профилактики рецидивов используют следующие группы препаратов (табл.).
При лечении герпес-инфекций следует придерживаться комплексного подхода. Длительность и интенсивность терапии определяются возрастом больного, клинической формой заболевания, тяжестью его течения, а также наличием осложнений и сопутствующей патологии. Лечебно-профилактические мероприятия следует разделять на несколько этапов.
- Острый период болезни (рецидив) — охранительный режим, лечебное питание, противовирусные препараты, интерфероны и их индукторы. По показаниям назначаются иммуноглобулины, антибактериальные препараты местного и системного действия, глюкокортикоиды, нейро- и ангиопротекторы, гепатопротекторы, кардиотропные препараты, ингибиторы протеаз. Симптоматическая терапия может включать жаропонижающие, отхаркивающие и муколитические препараты.
- Ремиссия, стихание основных клинических проявлений (иммуномодуляторы, адаптогены растительного происхождения, пре- и пробиотики, витамино-минеральные комплексы).
- Профилактика рецидивов (специфическая профилактика — вакцинация, санация хронических очагов инфекции, восстановление иммунного статуса и пр.).
Следует отметить, что сочетанное применение противовирусных препаратов и иммунобиологических средств имеет ряд преимуществ. Во-первых, комплексная терапия обеспечивает синергидный эффект. Во-вторых, позволяет снизить дозу противовирусного химиопрепарата, уменьшая вероятность развития НЛР, сокращая его токсическое воздействие на организм и снижая вероятность возникновения устойчивых штаммов герпес-вирусов. Кроме того, это значительно сокращает продолжительность острого периода болезни и сроки лечения.
Одним из препаратов, показавшим свою эффективность при лечении герпес-ассоциированных заболеваний у детей, является инозин пранобекс. Инозин пранобекс — это синтетическое комплексное производное пурина, обладающее иммуностимулирующей активностью и неспецифическим противовирусным действием. Препарат восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию иммуноглобулина G, интерферонов, интерлейкинов (ИЛ-1 и ИЛ-2), снижает образование провоспалительных цитокинов (ИЛ-4 и ИЛ-10), потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Механизм противовирусного действия препарата связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации, усилении подавленного вирусами синтеза мРНК лимфоцитов, что сопровождается угнетением биосинтеза вирусной РНК и трансляции вирусных белков.
Инозин пранобекс малотоксичен, хорошо переносится, в России рекомендован в виде таблеток детям с 3-летнего возраста (масса тела более 15 кг). За рубежом он доступен и в форме сиропа и не имеет возрастных ограничений. Препарат назначается по 50–100 мг/кг/сут внутрь в 3–4 приема в течение всего острого периода болезни (5–10 дней в зависимости от длительности вирусемии и выраженности синдрома интоксикации). В качестве поддерживающей терапии для восстановления иммунологических показателей возможно назначение препарата по иммуномодулирующей схеме (50 мг 2 раза в день в течение 14–28 дней). Доказана высокая эффективность курсовой терапии инозином пранобексом (50 мг/кг массы тела в сутки в 3–4 приема внутрь, три курса лечения по 10 дней с интервалом 10 дней) [7], комбинированной курсовой терапии с использованием инозина пранобекса и рекомбинантного интерферона α-2β (3 курса по 10 дней с интервалом 14 дней) у детей с микст-вирусными инфекциями [8].
Применение инозина пранобекса как препарата с иммунотропным и противовирусным действием на различных этапах лечебно-профилактических мероприятий позволяет избежать полипрагмазии, тем самым снизить медикаментозную нагрузку на организм и уменьшить риск нежелательных эффектов.
Литература
- Кускова Т. К., Белова Е. Г. Семейство герпес-вирусов на современном этапе // Лечащий Врач. 2004, № 5, с. 64–69.
- Hjalgrim H., Askling J., Rostgaard K. et al. Characteristics of Hodgkin’s lymphoma after infectious mononucleosis // N. Engl. J. Med. 2003; 349: 1324–1332.
- Никольский И. С., Юрченко В. Д., Никольская К. И. Характеристика активной хронической Эпштейна–Барр вирусной инфекции: клинико-иммунологический синдром // Современные инфекции. 2003, № 3, с. 60–62.
- Katz B. Z., Shiraishi Y., Mears C. J., Binns H. J., Taylor R. Chronic fatigue syndrome after infectious mononucleosis in adolescents // Pediatrics. 2009, Jul; 124 (1): 189–193.
- Lerner A. M., Begar S. N., Deeter R. G. IgM serum antibodies to Epstein-Barr virus are uniquely present in a subset of patients with the chronic fatigue syndrome // In Vivo. 2004, Mar-Apr; 18 (2): 101–106.
- Maakaroun N. R., Moanna A., Jacob J. T., Albrecht H. Viral infections associated with haemophagocytic syndrome // Rev. Med. Virol. 2010, Mar; 20 (2): 93–105.
- Симованьян Э. Н., Денисенко В. Б., Григорян А. В. Эффективность применения инозина пранобекс у часто болеющих детей с хронической Эпштейна-Барр вирусной инфекцией: результаты рандомизированного исследования // Вопросы современной педиатрии. 2011, Т. 10, № 2, С. 16–21.
- Нестерова И. В., Ковалева С. В., Чудилова Г. А., Ломтатидзе Л. В., Клещенко Е. И., Шинкарева О. Н. Динамика изменений фенотипа и функциональной активности нейтрофильных гранулоцитов у иммунокомпрометированных детей с повторными ОРВИ, ассоциированными с герпесвирусными инфекциями, на фоне комбинированной интерфероно- и иммунотерапии // Цитокины и воспаление. 2014, Т. 13, № 1, с. 113.
Т. А. Бокова, доктор медицинских наук, профессор
Инфекции вызванные цитомегаловирусом: диагностика, лечение, профилактика
Вирусы герпеса — большие, покрытые оболочкой, двунитевые ДНК-вирусы (120—200 нм). Геном содержит 120—240 тыс. пар нуклеотидов, кодирующих более 35 белков. Оболочка состоит из гликопротеинов и Fc-рецепторов. Инфекция персистирует у человека на протяжении всей жизни, переходя в латентную форму после острой стадии и периодически рецидивируя (особенно при снижении иммунитета у человека).
Классификация герпес-вирусов
Все вирусы герпеса разделяют на:
• а-герпес-вирусы — быстрорастущие цитолитические вирусы, вызывающие латентную инфекцию и поражающие нейроны (вирусы простого и опоясывающего герпеса);
• бета-герпес-вирусы — медленно растущие вирусы, вызывающие латентные инфекции секреторных желёз и почек (цитомегаловирус);
• у-герпес-вирусы — вирусы, вызывающие латентный инфекционный процесс в лимфоидной ткани (вирус Эпштейна—Барр).
Недавно обнаруженные вирусы герпеса человека типа 6 и 7 (ВГЧ-6 и ВГЧ-7) относят к у-герпес-вирусам, так как они вызывают латентные инфекции лимфатических узлов и имеют генетические сходства именно с этой группой вирусов герпеса. ВГЧ-8, ассоциированный с саркомой Капоши, сходен с вирусом Эпштейна—Барр. Все вирусы герпеса, за исключением вируса простого герпеса типа 1 и 2, различны по антигенной структуре.
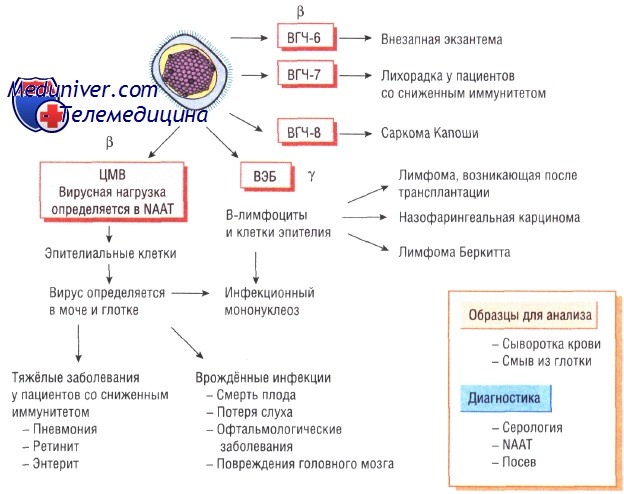
Инфекции вызванные цитомегаловирусом
По своей структуре цитомегаловирус похож на все остальные вирусы герпеса. Обычно он персистирует в организме на протяжении всей жизни. Его обнаруживают в моче и слюне человека. Примерно 50% населения Великобритании инфицированы ВГЧ-5.
Эпидемиология и патогенез цитомегаловирусной инфекции. Механизм передачи инфекции — вертикальный или контактный (от человека к человеку). Чем ниже социально-экономические условия, тем раньше происходит инфицирование. Возможен вертикальный механизм передачи инфекции. Кроме того, заражение может произойти при переливании крови или пересадке органов; в этом случае инфекции свойственно очень тяжёлое течение.
Клинические признаки инфекции вызванной цитомегаловирусом. Врождённая инфекция обычно протекает в тяжёлой форме. В начальном периоде выраженные симптомы заболевания отсутствуют. В дальнейшем возникает прогрессирующая глухота, задержка развития. При заражении после рождения заболевание протекает в лёгкой форме. У пациентов со сниженным иммунитетом (ВИЧ-инфекция, состояние после трансплантации органов) может развиться тяжёлая пневмония, ретинит, поражение кишечника, причём вирусная инфекция может быть приобретённой (от пересаженного органа) или собственной (латентная форма).
Диагностика инфекции вызванной цитомегаловирусом. Врождённую инфекцию диагностируют при проведении анализа мочи через 3 нед после рождения. У взрослых цитомегаловирус может быть культивирован либо определён молекулярно-генетическим методом в образцах мочи и крови. Исследование вирусной нагрузки имеет большое значение для диагностики тяжёлого течения инфекции и назначения своевременного лечения.
Лечение и профилактика инфекции вызванной цитомегаловирусом. При тяжёлой инфекции, угрожающей жизни пациента, а также при риске потери зрения лечение проводят ганцикловиром в комплексе с иммуноглобулином (при развитии пневмонии). Эфир ганцикловира, валганцикловир принимают внутрь, назначают в начале лечения и в качестве поддерживающей терапии. Ещё более токсичные альтернативные препараты (фоскарнет и цидофовир) ингибируют цепочечную ДНК-полимеразу. Важная мера профилактики заболевания — тщательный подбор донорских органов для пересадки и крови для переливания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение цитомегаловирусной инфекции нервной системы. Вирус простого герпеса и нервная система.
В настоящее время используются два вирусостатических препарата для подавления активной ЦМВИ при СПИДе. Оба препарата относятся к вирусостатинам. Некоторые авторы предлагают комбинированную терапию больных с ЦМВ-поражением ЦНС.
Фоскарнет обладает лучшей способностью к проникновению в ЦСЖ, чем ганцикловир. Кроме действия на ЦМВ, он обладает умеренной антиретровирусной активностью. Начальная доза препарата составляет 90 мг/кг внутривенно и назначается пациентам с нормальной функцией почек в течение 14—21 дня. Затем рекомендован переход на поддерживающую терапию со снижением дозы до 90—120 мг/сут. Введение препарата облегчается при установке постоянного подключичного катетера. Больным, страдающим почечной недостаточностью, назначаются более низкие дозы. Кроме токсического поражения почек, выделяют следующие побочные эффекты фоскарнета: дисфункция желудочно-кишечного тракта, нарушения электролитного баланса, головные боли, парестезии, припадки и токсическая энцефалопатия. Иногда бывает трудно отличить побочные эффекты фоскарнета от проявлений собственно ЦМВ-инфекции.
Ганцикловир также эффективен для лечения ЦМВ-поражения нервной системы у больных СПИДом. Лучше всего лечению данным препаратом поддаются ЦМВ-ПРМ и мультифокальная нейропатия. Начальная доза препарата составляет 5 мг/кг внутривенно в течение 14—21 дня. Затем рекомендован переход на поддерживающую дозу 5 мг/кг/сут. Подавление кроветворной функции, в частности нейтропения, нередко отмечается при лечении ганцикловиром, особенно если одновременно больной получает антиретровирусные средства. Их дозу необходимо снизить. К другим побочным эффектам ганцикловира относятся токсическое поражение печени, желудочно-кишечные расстройства, головные боли, припадки, сонливость, парестезии, токсическая энцефалопатия и токсическое поражение почек. Так же, как и при лечении фоскарнетом, зачастую бывает трудно отличить побочные эффекты препарата от проявлений ЦМВ-инфекции. с. Вирусная резистентность может развиться при длительном лечении ганциковиром или фоскарнетом. При начальной ударной терапии ЦМВ-ретинита или энтерита могут появиться неврологические симптомы. Для их лечения рекомендуется назначение альтернативного средства.
Когда и ганцикловир, и фоскарнет утрачивают эффективность, можно попробовать их комбинацию.
Ожидаемый результат лечения цитомегаловирусной инфекции нервной системы. Проспективных исследований по определению эффективности лечения ЦМВ-поражениий нервной системы при СПИДе не проводилось. Известны только единичные описания улучшения на фоне лечения ЦМВ-ПРМ и мультифокальной нейропатии. Очень мало данных о реакции на лечение ЦМВЭ. Больные, получившие ударную терапию, должны быть переведены на поддерживающий режим, хотя до сих пор неясно, какие дозы препаратов целесообразны. Исследование ЦСЖ дает наиболее надежные критерии активности процесса, поэтому его следует проводить сразу после окончания ударной терапии, а также при прогрессировании неврологических симптомов на фоне поддерживающей терапии. Повторное воспаление и, возможно, неоднократное выявление вирусной ДНК в ЦСЖ методом ПЦР свидетельствует об активной репликации вируса и указывают на резистентность к выбранному режиму лечения.
Вирус простого герпеса и нервная система.
1. Течение инфекции вируса простого герпеса. ВПГ распространен повсеместно общей популяции, и у ВИЧ-инфицированных часто наблюдается инфекция, вызванная ВПГ-2 ректально-генитального типа. Многие случаи ВПГ-2-асептического менингита имеют самоограничивающийся характер, но менингорадикулит, энцефалит или миелит могут давать тяжелые проявления, требующие лечения. У ВИЧ-инфицированных описан также энцефалит, вызванный ВПГ-1, с подострым течением и атипичной клинической картиной, обусловленной глубоким иммунодефицитом.
2. Клиническая картина инфекции вируса простого герпеса. ВПГ-1 вызывает фокальный энцефалит с преимущественным поражением глубоких отделов лобных и височных долей. Клиническими признаками заболевания являются припадки, головные боли, изменения личности и нарушения речи. В течение нескольких дней может развиться спутанность сознания, ступор и кома. У некоторых больных СПИДом не наблюдается такого выраженного прогрессирования. ВПГ-2 вызывает асептический менингит с лихорадкой и головными болями; менингорадикулит с частым вовлечением крестцовых корешков, что служит причиной задержки мочи; менингоэнцефалит. У больных с менингомиелитом отмечается прогрессирующая слабость, спастичность, нарушения чувствительности и атаксия, преимущественно в нижних конечностях, а также нарушение тазовых функций. У больных с ВПГ-2-менингоэнцефалитом наблюдаются спутанность сознания, припадки, головные боли и двигательные нарушения различной степени тяжести. Признаки ВПГ-2-поражения нервной системы могут появиться непосредственно после высыпаний в анально-генитальной области или независимо от них.
3. Диагностика инфекции вируса простого герпеса. Диагноз ВПГ-энцефалита можно предположить при обнаружении ограниченных очагов в нижних отделах лобных или височных долей по данным МРТ-исследования с контрастом. На ЭЭГ регистрируются типичные периодические спайковые разряды. Характерных признаков ВПГ-1 энцефалита другой локализации не существует. В ЦСЖ обычно обнаруживается смешанный плеоцитоз, иногда — эритроциты, чуть сниженный или нормальный уровень глюкозы и повышенное содержание белка. Исследования в культуре редко выявляет наличие вируса. Разработан ПЦР-метод, позволяющий фиксировать вирусную ДНК в ЦСЖ.
4. Лечение инфекции вируса простого герпеса
Ацикловир — вирусостатический препарат, эффективный при герпетических инфекциях. Препарат активизирует тимидинкиназу, которая замедляет репликацию вируса. Ацикловир в дозе 10 мг/кг внутривенно назначают сразу же при подозрении на ВПГ-поражение ЦНС, не дожидаясь результатов диагностических исследований. В подтвержденных случаях лечение рекомендовано продолжать в течение 10—14 дней. После этого иногда назначается поддерживающая терапия повторной аногенитальной инфекции в дозе 200 мг внутрь 5 раз в сутки. К сожалению, появились резистентные штаммы вируса. Таким больным показано лечение фоскарнетом в дозе 60 мг/кг 2 раза в сутки в течение 14-21 дня.
К побочным эффектам ацикловира относятся токсическое поражение почек, печени, желудочно-кишечные расстройства и раздражение в области введения препарата. У больных, страдающих почечной недостаточностью, доза ацикловира должна быть снижена.
Если при лечении у пациента появились головные боли, головокружение и другие серьезные признаки токсического воздействия препарата, включая токсический делирий, спутанность сознания, припадки, необходимо определить уровень препарата в крови и при его высоких показателях откорректировать дозу. Описаны случаи подавления костномозгового кроветворения и артериальная гипотензия при лечении ацикловиром.
5. Ожидаемый результат лечения вируса простого герпеса. Клинические испытания, оценивающие течение ВПГ-энцефалита и других герпетических поражений нервной системы при СПИДе, немногочисленны. У многих пациентов лечение ацикловиром эффективно. У некоторых больных эффект отсутствует, что связано либо с вирусной резистентностью, либо с нарушением функции иммунной системы. Серийные исследования ЦСЖ считаются наиболее надежным методом подтверждения резистентности и должны проводиться после окончания антивирусной терапии, а также в случае прогрессирования неврологических симптомов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лечение цитомегаловирусной инфекции - препараты
Подход к лечению ЦМВ-инфекции существенно отличается у реципиентов после аллогенной трансплантации костного мозга (ТКМ) и у больных, подвергающихся химиотерапии (в том числе высокодозной после трансплантации аутологичных стволовых клеток). Больным первой группы необходимо упреждающее лечение, поскольку, несмотря на наличие препаратов, эффективно ингибирующих репликацию вируса, лечение уже развившихся висцеральных поражений эффективно не более чем в половине случаев.
Больным, получающим стандартную химиотерапию, специфическое лечение проводят только при установленном или высоковероятном висцеральном поражении.
Методы контроля ЦМВ-инфекции у реципиентов аллогенного костного мозга зависят от ЦМВ-статуса пары донор — реципиент. При серонегативности как донора, так и реципиента самым надежным способом профилактики ЦМВ-инфекции является использование для трансфузий препаратов крови от серонегативных доноров или лейкодеплеция с помощью фильтров последнего поколения, предназначенных для фильтрации в банках крови. При любом другом сочетании ЦМВ-статусов главные инструменты контроля — еженедельный мониторинг ЦМВ-виремии (методом ПЦР или выявлением антигенемии рр65) и упреждающее лечение ганцикловиром при позитивном результате.
Для начала терапии больных высокого риска (реципиенты неродственной или неполностью совместимой трансплантации, лечение РТПХ антитимоцитарным глобулином) достаточно однократного позитивного анализа. В то же время у больных низкого риска при невысокой вирусной нагрузке назначение специфической терапии можно отложить до повторного позитивного анализа, выполненного с интервалом 3— 5 дней. Этот подход проверен многими исследователями, в том числе нами. Доказано, что такой подход эффективнее и дешевле, чем профилактическое использование высоких доз иммуноглобулина и ацикловира, которое было популярно в конце 80-х — начале 90-х годов.
В настоящее время существует только два препарата, эффективных при лечении ЦМВ-инфекции: ганцикловир (цимевен, фирма «Ф. Хоффманн — Ля Рош») и натрия фосфоноформат (фоскавир, фирма АСТРА). Сидофовир (Vistide, фирма «Пфайзер») активен против резистентных штаммов, удобен тем, что его вводят раз в неделю (5 мг/кг), однако его применение может ограничивать выраженная нефротоксичность. Все остальные препараты (интерфероны, ацикловир и его производные, «иммуномодуляторы») не должны даже рассматриваться как варианты контроля ЦМВ-инфекции.
Из двух указанных препаратов наиболее изучен ганцикловир, коммерчески доступный более 15 лет. Накоплен исчерпывающий опыт его применения при ЦМВ-инфекции.

Ганцикловир (1,3-дигидрокси-пропоксиметил-гуанин) сам по себе не является активным противовирусным агентом, необходимо его фосфорилирование вирусной тимидинкиназой. В форме трифосфата ганцикловир ингибирует вирусную ДНК-полимеразу. Сродство ганцикловира к тимидинкиназам человека значительно меньше, поэтому его токсичность для человеческих клеток относительно невелика.
Доза ганцикловира для курса индукции составляет 10 мг/кг в сутки на два введения. Курс индукции продолжается 2—3 нед, после чего назначают поддерживающую дозу — 5 мг/кг в сутки на одно введение ежедневно или 5—6 раз в неделю. Длительность курса поддерживающей терапии определяют индивидуально. При упреждающем лечении реактивации ЦМВ после аллогенной ТКМ при достижении негативной реакции на антигене-мию или виремию поддерживающее лечение можно не проводить, в то время как при органном поражении (пневмония, ЦМВ-колит) лечение должно быть продолжено до купирования симптомов и негативизации результатов вирусологических исследований, а при ЦМВ-ретините терапия может быть пожизненной.
При длительном профилактическом или упреждающем применении ганцикловира в раннем посттрансплантационном периоде высока частота поздних ЦМВ-пневмоний. Таким пациентам необходимо продолжать мониторинг ЦМВ-виремии или антигенемии и после 100-го дня после трансплантации [11]. Примерно у 20 % больных, леченных ганцикловиром в указанной дозе, развивается гранулоцитопения менее 1000 в 1 м\ во всех случаях обратимая (быстрее под влиянием G-CSF), с медианой длительности 12 дней. Резистентность ЦМВ к ганцикловиру является редкостью.
Отличным от ганцикловира по механизму действия (прямое ингибирование ДНК-полимеразы) является натрия фосфоноформат (фоскарнет, фоскавир), который может быть эффективен при резистентности данного штамма вируса к ганцикловиру. Индукционная доза натрия фосфоноформата 90 мг/кг каждые 12 ч. Продолжительность курса лечения составляет 14 дней, затем проводят поддерживающую терапию в половинной дозе. Побочными реакциями являются нарушение функции почек, гипомагнезиемия, гипокальциемия и изъязвление слизистых оболочек наружных половых органов.
Необходимо отметить коммерчески доступный специфический антицитомегаловирусный иммуноглобулин. Убедительных доказательств его эффективности в лечении вызванных ЦМВ болезней нет. С учетом его дороговизны, а также наличия препаратов, оказывающих специфическое противовирусное действие, дальнейшее применение этого препарата вряд ли оправдано.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Для цитирования: Краснов В.В., Обрядина А.П., Кулова А.А. и др. Эффективность иммунотропной терапии часто болеющих детей, имеющих маркеры цитомегаловирусной инфекции. РМЖ. 2009;15:978.
Одной из актуальных проблем современной педиатрии являются часто болеющие дети (ЧБД). Под термином «часто болеющие дети» принято подразумевать детей, у которых частота острых заболеваний составляет 4 и более раз в год (Хроника ВОЗ, 1980). Известно, что на долю острых респираторных инфекций приходится до 90% всей инфекционной патологии; в свою очередь, до 85% от всех ОРЗ регистрируется именно у ЧБД. С одной стороны, респираторные инфекции, которые ребенок переносит в раннем возрасте, способствуют формированию иммунитета, с другой, при их частоте более 6 раз на протяжении года не происходит полного восстановления иммунитета. Часто болеющий ребенок нередко отстает от сверстников в физическом и общем развитии, что ведет к снижению его социальной адаптации в обществе. В России проблема часто и длительно болеющих детей особенно актуальна. Так, по данным диспансерных осмотров детского населения, к этой категории можно отнести каждого четвертого ребенка.
Цитомегаловирусная инфекция (ЦМВИ) – одно из самых распространенных вирусных заболеваний человека. Европейским региональным бюро ВОЗ оно отнесено к группе болезней, которые определяют будущее инфекционной патологии. По данным серологических исследований, проведенных в разных странах Европы и Америки, маркеры ЦМВИ выявляются у 40–60% детей в возрасте до 5 лет. В некоторых странах число серопозитивных лиц среди взрослого населения достигает 100%. Имеющиеся сведения позволяют заключить, что и в России эта инфекция встречается столь же часто.
Широко используемая в последнее время для диагностики ЦМВИ методика ПЦР констатирует наличие вируса в организме ребенка. Существует мнение, что цельная кровь является наиболее подходящим биологическим материалом для диагностики активной ЦМВИ, а выявление данной вирусной ДНК в других биологических субстратах может свидетельствовать о латентной инфекции. Такая точка зрения не может рассматриваться однозначно, поскольку выявление ДНК вируса и в других субстратах (не в крови) не исключает медленного течения инфекции, в результате которого клиническая манифестация поражения того или иного органа может проявиться спустя достаточно продолжительный период времени. В связи с вышеизложенным любая идентификация вируса, независимо от субстрата, должна быть дополнена серологическим исследованием для определения активности инфекционного процесса.
Из используемых серологических методов наиболее часто применяют твердофазный иммуноферментный анализ, позволяющий идентифицировать весь спектр антител к ЦМВ. Для диагностики острого инфекционного процесса различной этиологии часто определяются специфические IgM, появляющиеся на ранней стадии инфекционного процесса и характеризующие активную фазу заболевания. Титр IgM при ЦМВИ, начиная со 2–го месяца после инфицирования, постепенно снижается и достигает минимума через 8 месяцев. Совпадает ли исчезновение противоцитомегаловирусных IgM с формированием напряженного иммунитета (полноценных – высокоавидных IgG) к данному вирусу и переходом процесса в неактивную (латентную) фазу, не требующую проведения терапевтических мероприятий? Данный вопрос требует осмысления, принимая во внимание, что диагностическая ценность IgM–антител продолжает обсуждаться, поскольку не все индивидуумы способны их вырабатывать. ЦМВИ относится к инфекциям с нетипичной динамикой антителообразования, когда наличие специфических IgМ не является достоверным признаком для дифференциации стадии заболевания. С другой стороны, следует отметить, что при определении IgM возможны и ложноположительные результаты, обусловленные наличием ревматоидного фактора класса М. Для установления точного момента инфицирования и разграничения первичной инфекции, реинфекции и реактивации инфекционного процесса в 1988 году был предложен тест на определение авидности IgG антител. Уровень авидности пропорционален дозе и природе антигена, а также, вероятно, индивидуальным особенностям формирования иммунитета. Низкие дозы антигена приводят к более быстрому возрастанию авидности, а высокие дозы – к более медленному. Для измерения авидности специфических IgG при серодиагностике возбудителей инфекционных заболеваний используют иммуноферментный метод (ИФА). В результате проведения ИФА определяется индекс авидности (ИА). В зависимости от величины ИА могут быть выявлены IgG с низкой авидностью (н/а), что свидетельствует о первичной (недавней) инфекции. Наличие высокоавидных (в/а) IgG говорит о вторичном иммунном ответе в случае реинфекции или реактивации. Также в/а IgG могут определяться в более низких титрах при латентной фазе процесса.
Определенную роль в формировании различной патологии детского возраста играют и другие возбудители, относящиеся к оппортунистической микрофлоре, способные проявлять свой патогенный эффект в условиях супрессивного воздействия на иммунную систему.
Одной из многочисленных причин формирования частых повторных респираторных заболеваний является и нерациональная терапия с использованием ряда лекарственных препаратов, в особенности антибиотиков.
Цель исследования. Определить клинико–лабораторные признаки часто болеющих детей, имеющих маркеры ЦМВИ, и оценить влияние иммунотропной терапии Кипфероном® на фоне пролонгированной коррекции микробиоценоза на возникновение повторных респираторных заболеваний.
Вероятность манифестации врожденной инфекции очень низка, у 99% детей она протекает субклинически. Однако у 5–17% детей при отсутствии проявлений инфекционного процесса выявляются неврологические последствия в виде задержки психомоторного развития, неспособности к обучению, снижения интеллекта, нарушения слуха, патологии зрения и др. в отдаленном периоде времени – через 5–7 лет и более. Считается, что столь же высока частота субклинических форм и при приобретенной ЦМВИ. По всей видимости, такой высокий процент бессимптомного течения обусловлен не истинным состоянием, а неспецифичностью проявлений заболевания, что приводит к невозможности сопоставить те или иные симптомы с ЦМВИ. Первичная латентная инфекция, по данным некоторых авторов, диагностируется у 60% детей второго полугодия жизни. Считают, что приобретенная ЦМВИ не влечет за собой отдаленных последствий в виде поражения нервной системы. Однако исходя из общих закономерностей течения инфекционного процесса (в данном случае по варианту медленной инфекции) правомочно предположение, что и приобретенная ЦМВИ оказывает отрицательное воздействие на детский организм в целом. Имеются публикации о связи данной инфекции с ранним атеросклерозом, диффузными заболеваниями соединительной ткани и рядом другой аутоиммунной патологии, неопластическими процессами, сахарным диабетом, бронхиальной астмой.
Материалы и методы. Под наблюдением находилось 32 ребенка в возрасте от 1 года до 6 лет, из них 20 детей до 3 лет. Все дети в условиях поликлиники обследовались методом ПЦР на наличие оппортунистических микроорганизмов в связи с наличием у них частых повторных респираторных заболеваний. При использовании для этиологической диагностики данного метода (ПЦР) только цитомегаловирус (ЦМВ) выявлен у 22 детей (69%), ассоциация ЦМВ с Эпштейна–Барра вирусом (ЭБВ) – у 9 (28%), и у 1 ребенка ЦМВ – в ассоциации с микоплазмой. Диагностика осуществлялась на основании выявления ДНК или антигена возбудителя в смеси биологических субстратов (кровь, слюна, слеза и моча). После выявления ЦМВ (в ряде случаев в ассоциации с др. микроорганизмами) дети направлялись на консультацию к врачу–инфекционисту. На втором этапе у 26 детей определяли специфические антитела к ЦМВ, ЭБВ, вирусу простого герпеса 1 и 2 типа, токсоплазме и хламидии трахоматис методом ИФА в лаборатории ООО «НПО «Диагностические системы», г. Н. Новгород.
Кроме того, оценивались преморбидный фон и физическое состояние наблюдаемой группы, части детей проводилось УЗИ органов брюшной полости.
Все пациенты с целью предотвращения частых повторных респираторных заболеваний получали иммунобиологический препарат Кипферон®, представляющий собой комбинацию комплексного иммуноглобулинового препарата (КИП) и человеческого рекомбинантного интерферона альфа 2b (регистрационное удостоверение Р N000126/01 от 31.03.2006). Кипферон® назначался по убывающей схеме, общей продолжительностью от 1 до 1,5–2 месяцев и более, на фоне пролонгированной коррекции микробиоценоза кишечника с использованием пребиотика – эубикор.
Результаты и их обсуждение. Поражение ЦНС выявлено у 26 детей (82%), т.е. у большинства, причем у 11 детей легкой степени тяжести, у 5 – средней и у 10 – тяжелой. Как правило, поражение ЦНС расценивалось педиатрами, как постгипоксическое. Со стороны сердечно–сосудистой системы отмечены малые аномалии развития сердца в виде дополнительной хорды у 10 пациентов. У 17 детей в анамнезе выявлены признаки аллергии (как правило, пищевой). Подтвержденный лабораторно дисбиоз имел место у 23 (число обследованных), однако при оценке анамнеза нарушения микробиоценоза кишечника были заподозрены практически у всех детей.
Повторные ОРЗ, которые и послужили первоначально поводом для обследования на наличие ЦМВ, регистрировались от 5–6 раз в год, до (в единичных случаях) 4 раз в месяц. Предположительно повторные ОРЗ обусловлены иммуносупрессивным воздействием ЦМВ, однако не исключена и реактивация данной инфекции, протекающая с поражением респираторного тракта. В половине случаев (16 пациентов) родители обращали внимание на снижение аппетита. При осмотре детей практически у всех определялся умеренный шейный лимфаденит, реже – увеличение лимфоузлов в других группах. Печень пальпировалась на 0,5–3 см ниже реберной дуги у 23 детей, что является допустимым в данном возрасте. Увеличение размеров селезенки определялось при пальпации у 4 детей. Таким образом, клинические проявления были неспецифическими. В общем анализе крови у 18 детей определялась анемия легкой степени тяжести и у 16 – относительный лимфоцитоз.
Ультразвуковое исследование органов брюшной полости проводилось 28 детям. В 14 случаях выявлены увеличенные лимфатические узлы в воротах печени, из них в 4 случаях в сочетании с гепатоспленомегалией и явлениями холестаза. У 4 детей определялась только гепатомегалия, у 10 – только холестаз.
Как уже упоминалось, вирус цитомегалии методом ПЦР в различных субстратах, включая кровь, обнаружен у всех наблюдавшихся детей. Серологически обследовались 26 детей, причем у 20 выявлены н/а IgG и у 6 детей – высокоавидные. Специфические IgM были выявлены лишь у одного ребенка в возрасте двух лет. Таким образом, определение ИА позволило диагностировать первичную (острую) фазу заболевания у 69% детей, обследованных методом ИФА, при отсутствии у них специфических IgM.
Примечательно, что у наблюдаемых детей определялись серологические маркеры и к другим микроорганизмам, относящимся к оппортунистической микрофлоре. Низкоавидные IgG к вирусу простого герпеса 1 и 2 типа выявлены у 7 детей, (у 8 в/а), к ЭБВ – н/а IgG к капсидному антигену – у 8 (у 11 – в/а). Также у 5 пациентов обнаружены IgG к токсоплазме, а IgG и IgA к хламидиям – у 9 детей. Среди детей с н/а IgG к ЭБВ у одного ребенка одновременно регистрировались н/а IgG к ЦМВ. Выявленный спектр антител указывает на то, что чаще всего у детей, начиная с раннего возраста, имеют место различные ассоциации микроорганизмов, относящихся к оппортунистической микрофлоре. Для определения роли ряда возбудителей и установления фазы патологического процесса, ими инициированного, необходимо серологическое обследование детей на комплекс оппортунистических инфекций, включая герпетические, с определением уровня авидности IgG в случае их выявления. Справедливо заметить, что обозначенными микроорганизмами не ограничивается весь спектр инфекционных агентов, вызывающих воспалительные процессы дыхательных путей, а следовательно, при решении вопроса о назначении терапевтических мероприятий следует исходить прежде всего из наличия клинических проявлений.
Принимая во внимание наличие у ЧБД ассоциированного, преимущественно вирусного, инфекционного процесса, лечение включало использование препаратов, обладающих иммунотропным и противовирусным эффектом, на фоне пролонгированной коррекции микробиоценоза кишечника.
В качестве основного иммунотропного средства использовали препарат Кипферон®, суппозитории для вагинального или ректального введения, в состав которого входит 500 000 МЕ человеческого рекомбинантного интерферона альфа 2b и 60 мг комплексного иммуноглобулинового препарата (КИП), содержащего IgG, IgA и IgM. Клинические эффекты Кипферона® обусловлены как действием интерферона, так и иммуноглобулинов. Кроме противовирусного действия интерферона, выявлены и другие его механизмы влияния на организм человека. В частности, интерфероны обладают противомикробным эффектом, стимулируют интерфероногенез, активируют Т– и В–лимфоциты, стимулируют синтез sIgA, осуществляя регулирующее влияние на иммунитет, а также способствуют нормализации состава микрофлоры кишечника. Эффективность интерферонов подтверждена результатами международных многоцентровых научных исследований на протяжении последних 15–20 лет. Следует отметить, что характер воздействия интерферона в организме модулирующий (стимуляция низких, снижение высоких и отсутствие влияния на неизмененные параметры иммунитета). Высокая иммунотропность достигается при использовании небольших терапевтических доз. В КИП–е содержатся антитела против герпес–вирусов, ротавирусов, хламидий, стафилококков, повышенная концентрация антител к энтеробактериям и другим патогенным микроорганизмам. Иммуноглобулины, как и интерферон, также обладают иммуномодулирующим действием. При ректальном введении препарата содержание действующих веществ в крови достигает того же уровня, что и при парентеральном. Максимальная концентрация в крови наблюдается уже через 1 ч и сохраняется на протяжении 12 часов. С 3–х суток лечения базовый уровень интерферона с каждым днем повышается. Ректальное введение Кипферона®, в отличие от парентеральных форм интерферона, не сопровождается гриппоподобным синдромом. Важно, что препарат может сочетаться с антибиотиками и химиопрепаратами.
К настоящему времени накоплен немалый опыт по использованию Кипферона® при острых кишечных инфекциях вирусной и бактериальной этиологии, ОРВИ, включая течение заболевания с бактериальными осложнениями, при ангинах и инфекционном мононуклеозе. Отмечены хорошие результаты применения Кипферона® при смешанных инфекциях (ВПГ + вирус Эпштейна–Барра, ВПГ–1 + ВПГ–2, ВПГ + хламидийная инфекция), а также у детей с сахарным диабетом и присоединившейся цитомегаловирусной инфекцией.
Ряд авторов указывают на то, что до настоящего времени не существует универсальных и безопасных химиопрепаратов, эффективных в отношении большинства респираторных вирусов, а антибактериальная терапия системными антибиотиками при ОРЗ малоэффективна. Следует учитывать, что назначение системных антибиотиков без должных оснований повышает риск побочных эффектов, нарушает микробиоценоз, способствует снижению иммунитета и распространению лекарственной резистентности. Вышеизложенное и послужило обоснованием выбора Кипферона® в качестве основного иммунотропного средства.
Кипферон® назначался по 1 свече 2 раза/сут. в первые 5–10 дней ежедневно. В последующем по 1 свече 2 раза/сут. через день до конца первого месяца лечения, затем по 1 свече 2 раза/сут. через 2 дня. Средняя продолжительность курса составляла 1,5–2 месяца. При необходимости курс лечения занимал больший промежуток времени. Пролонгация курса осуществлялась в тех случаях, когда у ребенка на фоне терапии продолжали возникать респираторные заболевания. Тактика определялась лечащим врачом в зависимости от динамики клинических проявлений. При холестазе использовались препараты, обладающие желчегонным эффектом.
Коррекция микробиоценоза проводилась по следующей схеме: на 10 дней назначался один из пробиотиков, затем на 20–30 дней – пребиотик эубикор. Всего в процессе комплексной терапии проводилось 3–4 курса: первые 2 без перерыва, затем с перерывами в 1–2 недели.
Эффективность проводившейся терапии проявилась в сокращении частоты острых респираторных заболеваний. После проведенных реабилитационных мероприятий в группе ЧБД остались 3 ребенка из 32 (р <0,01) (рис. 1).
У наблюдавшихся детей нормализовались размеры селезенки и печени, улучшился аппетит. Шейный лимфаденит и увеличение лимфатических узлов в области ворот печени сохранялись продолжительное время, до 1 года и более (срок наблюдения), тогда как другие отклонения, выявленные при УЗИ, приходили к норме.
Таким образом, вышеизложенные данные позволяют сделать ряд выводов:
1. У часто болеющих детей, как правило, имеет место ассоциированный инфекционный процесс, обусловленный различными оппортунистическими микроорганизмами, преимущественно герпетическими вирусами, что является обоснованием для проведения терапии, направленной на оптимизацию иммунного процесса.
2. Манифестация ЦМВИ у детей дошкольного возраста обычно проявляется повторными ОРЗ, по сути являющимися маркером иммуносупрессии, характерной для персистенции ЦМВ. У большинства детей имеются изменения со стороны внутренних органов брюшной полости, выявляемые при УЗИ.
3. При наличии ЦМВ инфекции показаниями для назначения лечения являются наличие клинических проявлений (включая частые повторные ОРЗ), определение ДНК вируса в крови, выявление специфических низкоавидных IgG и/или IgM.
4. Иммунотропная терапия с использованием Кипферона® на фоне пролонгированной коррекции микробиоценоза кишечника эффективна при реабилитации часто болеющих детей.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

