Как блокировать андроген рецепторы в коже
Обновлено: 28.04.2024
Андрогеновый рецептор. Строение и функция
Ген андрогенового рецептора (АР) был клонирован в 1988 г. и локализован в Х-хромосоме человека между центромерой и ql3. Как и прогестероновый рецептор (ПР), анрогеновый рецептор (АР) существует в двух формах: В-форме с нормальной длиной и укороченной А-форме (с молекулярными массами ~110 и 87 кДа соответственно); обе формы кодируются одним и тем же геном.
Изоформа 87 кДа (АР-А) содержит интактный С-терминал, но в ней недостает 188 аминокислотных остатков N-терминала изоформы 110 кДа (АР-В). Соотношение АР-А/АР-В в фибробластах кожи гениталий здоровых людей составляет 10:1. Неизвестно, имеются ли функциональные различия между этими изоформами. ДНК-связывающий домен или TAF-2 андрогенового рецептора сходен с регионами TAF-2 других рецепторов к стероидным гормонам (прогестерону, эстрогену, глюкокортикоидам и минералокортикоидам), но более всего с прогестероновым рецептором (ПР).
Прогестерон проявляет перекрестную реактивность с андрогеновым рецептором (АР), но лишь в степени, которая становится значимой только при фармакологических дозировках.
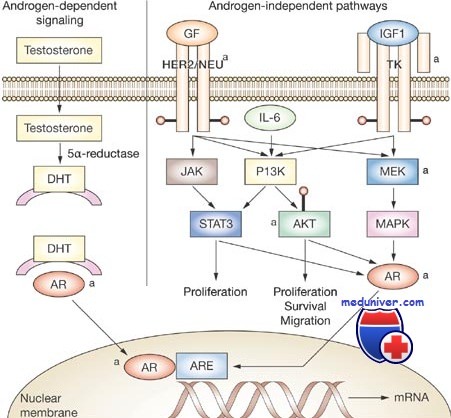
В большинстве тканей тестостерон превращается в дигидротестостерон (ДГТ) под действием фермента 5а-редуктазы. Дигидротестостерон (ДГТ) связывается с андрогеновыми рецепторами с большей аффинностью, чем тестостерон, обеспечивая лучшую стабилизацию рецептора и более эффективную передачу сигнала, что усиливает андрогенный эффект. В связи с этим интенсивность локального превращения тестостерона в ДГТ является важным внутриклеточным фактором андрогенного ответа.
Описано множество мутаций андрогеновых рецепторов (АР), которые нарушают их функцию. Например, инактивирующие точечные мутации в гормонсвязывающем домене андрогенового рецептора (АР) могут обусловливать несколько фенотипов — от частичной до полной потери чувствительности к андрогенам. Точечная мутация в остатке 689 (замещение Про на Гис) может изменять конформацию лигандсвязывающего домена, что приводит к снижению аффинности андрогеновых рецепторов (АР) к дигидротестостерону (ДГТ) и лишает его способность к трансактивации гормонспецифических элементов (ГСЭ).
Замещение Сер на Про в остатке 865 препятствует связыванию андрогена и трансактивации; иными словами, эта мутация тоже приводит к полной потере чувствительности к андрогенам. Замещение Тре на Мет в остатке 807 вызывает частичную потерю чувствительности к андрогенам за счет снижения (но не устранения) связывания андрогена с рецептором. Однако замещение Вал или Арг в том же участке полностью препятствует связыванию с андрогеном и приводит к развитию синдрома отсутствия чувствительности к андрогенам.
- Вернуться в оглавление раздела "физиология человека"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ВГМУ, Профессорская клиника Юцковских, Владивосток
Профессорская клиника Юцковских, Владивосток
Владивостокский государственный медицинский университет
Андрогензависимые синдромы кожи у женщин: роль антиандрогенной терапии на современном этапе
ВГМУ, Профессорская клиника Юцковских, Владивосток
ВГМУ, Профессорская клиника Юцковских, Владивосток
Профессорская клиника Юцковских, Владивосток
Владивостокский государственный медицинский университет
Одной из сложных задач современной дерматологии и косметологии остается лечение андрогензависимых синдромов кожи. Синдромы гиперандрогении (ГА) часто служат причиной психологического дискомфорта и отрицательно влияют на качество жизни женщин. Синдромы ГА у женщин являются частыми причинами психологического дистресса. Внешние проявления избытка андрогенов отмечаются у 10—30% женщин в популяции и становятся существенным косметическим дефектом, отражающимся на нервно-психическом статусе женщины, приводя к раздражительности, депрессивным состояниям, снижая качество жизни и обусловливая социальные проблемы в виде ограничений в выборе профессии и сложностей в трудоустройстве, снижая чувство достоинства женщин. В патогенезе этих процессов большое значение уделяется роли гормонов. Под влиянием избытка андрогенов у женщин развивается синдром ГА, что клинически проявляется себореей, гирсутизмом, андрогензависимой алопецией.
Заболевания, при которых имеются признаки повышенной продукции андрогенов, относятся к междисциплинарной патологии и требуют пристального внимания и знаний не только гинеколога, но и в равной степени затрагивают сферу интересов эндокринологов, дерматологов, косметологов.
Кожа человека является комплексом андрогенчувствительных структур (сальные и потовые железы, волосяные фолликулы). Под влиянием андрогенов находятся многие важные функции кожи: митотическая активность клеток, активность сальных желез, рост волос, выраженность пигментации. Являясь тканью-мишенью для половых стероидных гормонов, например андрогенов, кожа принимает активное участие в метаболизме стероидных половых гормонов, в частности, в экстрагландулярном образовании из стероидов-предшественников.
Источником андрогенов в организме женщины являются яичники и кора надпочечников. Их синтез происходит под стимулирующим действием лютеинизирующего гормона (ЛГ) и адренокортикотропного гормона (АКТГ). Основной андроген надпочечников — дигидроэпиандростерон (ДГЭА) и его сульфат (ДГЭАС), яичников — тестостерон (Т) и андростендион (А). Действие половых гормонов на кожу осуществляется через специфические андрогенные рецепторы (АР) сосочкового слоя дермы, фибробласты, кератиноциты, эпителиальные клетки просвета апокриновых желез и секреторный отдел эккриновых сальных желез, а также в себоцитах и волосяных фолликулах.
Мишенями для половых стероидов в коже являются эпидермис, волосяные фолликулы, сальные железы, меланоциты и фибробласты. Под воздействием андрогенов усиливаются дифференцировка и митотическая активность клеток эпидермиса, увеличивается синтез межклеточных липидов, увеличивается толщина эпидермиса, стимулируется рост и пигментация волос, усиливается продукция кожного сала, снижается синтез глобулина, связывающего половые стероиды (ГСПС) в печени. В то же время под воздействием эстрогенов тормозится рост волос в андрогензависимых зонах, угнетается продукция кожного сала, усиливается синтез ГСПС.
Важным патогенетическим звеном при ГА является нарушение связывания андрогенов со специфическим ГСПС. Связанные с ГСПС стероиды недоступны для соединения с рецепторами в тканях-мишенях и оказания биологического эффекта. Биологический эффект в клетках-мишенях оказывает лишь свободная фракция половых стероидов. Она же ответственна за клинические проявления андрогенного эффекта.
Таким образом, ГА в организме женщины сопровождается избыточной секрецией мужских половых гормонов или повышенной чувствительностью тканей к неизмененному уровню андрогенов. Совокупность признаков поражения кожи и ее придатков, возникающих в результате избытка андрогенов в женском организме (себорея, гирсутизм, андрогензависимая алопеция), можно обозначить термином «гиперандрогенная дермопатия».
ГА может проявляться в виде абсолютного увеличения количества гормонов (абсолютная ГА) или повышенной чувствительностью рецепторов к нормальному или сниженному содержанию андрогенов в организме (относительная ГА).
Акне. В клетках сальных желез — себоцитах тестостерон под действием фермента α5-редуктазы 1-го типа переходит в самый активный метаболит — дигидротестостерон, который служит непосредственным стимулятором роста и созревания себоцитов, образования кожного сала. Основными причинами относительной ГА являются повышенная активность фермента α5-редуктазы 1-го типа, повышенная плотность ядерных дигидротестостероновых рецепторов, увеличение свободной фракции тестостерона в крови. Таким образом, в патогенезе акне ведущая роль принадлежит гормональному фактору, приводящему к гипертрофии и повышенному функционированию сальных желез, фолликулярному гиперкератозу в протоке сально-волосяного фолликула (СВФ), активизации микроорганизмов с последующим воспалением.
Себорея. Себорея — патологическое состояние кожи, обусловленное нарушением функции сальных желез, изменением состава их секрета. Возникновение синдрома ГА — себореи, связано с избытком андрогенов. Проявляется в местах, богатых сальными железами, — на лице, волосистой части головы, верхней части груди, в межлопаточной области. Развитию себореи способствуют нарушения функции половых желез (в частности, нормального соотношения между эстрогенами и андрогенами), надпочечников, щитовидной железы, а также иммунной, пищеварительной, центральной и вегетативной систем. Различают сухую и жирную себорею. У некоторых больных может быть смешанная себорея: на одних участках имеются симптомы сухой, а на других — жирной себореи.
Огромная роль в патогенезе себореи отводится наследственности. Генотип — врожденные качества, заложенные в генах. Структура кожного покрова является врожденной и неизменной на протяжении всей жизни, несмотря на то что поверхность кожи может постоянно меняться — трескаться, шелушиться, менять цвет (тускнеть), стать более грубой, тем не менее структура ее всегда индивидуальная, не меняющаяся.
При повышенном уровне мужских половых гормонов может изменяться тип кожи. Она становится жирной, поры на лице и себорейных участках расширяются, рН достигает 6, появляется склонность к дисхромиям.
Жирную себорею подразделяют на жидкую и густую, в зависимости от консистенции кожного сала, что определяется его физико-химическим составом. Участвуя в формировании водно-липидной мантии, кожное сало оказывает выраженное бактерио- и фунгицидное действие на большинство микроорганизмов. Компоненты липидной пленки на поверхности кожи являются производными сальных желез и эпидермиса и на 60% представлены триглицеридами, на 20—25% — эфирами воска, на 10—15% — скваленом, на 1—3% — эстерифицированными стеролами и на 0,5—2% — свободным стеролом. В увеличенном объеме кожного сала снижается концентрация незаменимой α-линоевой кислоты, которая подавляет экспрессию фермента трансглутаминазы. α-Линоевая кислота является основным регулятором дифференцировки кератиноцитов. Трансглутаминаза участвует в синтезе кератина 1-й и 10-й фракций, белков инволюкрина, лорикрина и филлагрина — основных компонентов цементирующего межклеточного вещества. Уменьшение количества линолевой кислоты приводит к повышению рН кожного сала, в итоге значительно нарушается барьерная функция эпителия и создаются условия для роста микроорганизмов на поверхности кожи и внутри сально-волосяных фолликулов.
Основными критериями оценки типов кожи на приеме у врача-косметолога являются характеристика салообразования — повышенное, пониженное, умеренное; степень расширения пор — расширенные, умеренно-расширенные, точечные; состояние липидной субстанции эпидермиса после умывания — чувство стянутости, дискомфорт, шелушение, покраснение.

Сравнивая различные состояния кожи здоровых пациентов и пациентов с себореей посредством неинвазивных методов морфофункциональной диагностики кожи (себуметрии, корнеометрии, рН-метрии) с применением аппарата SOFT PLUS, CATELLANI GROUP (Италия), мы получили следующие результаты (табл. 1).

Одним из объективных методов оценки состояния кожи является ультразвуковое исследование (УЗИ). У пациента с нормальной кожей при УЗИ видны сглаженность рельефа эпидермиса, равномерное распределение эхосигнала; эпидермис четко отграничен от дермы, дерма дифференцирована на отделы, расположение волокон дермы линейное (рис. 1, а). Рисунок 1. Ультразвуковая картина кожи в норме (а) и у пациента с себореей (б). У пациента с себореей отмечаются изменение эхоструктуры эпидермиса, нарушение его рельефа, протоки сальных желез расширены; отсутствует четкая граница между эпидермисом и дермой, эхогенность субэпидермального отдела дермы снижена (рис. 1, б).
Еще одним симптомом ГА является гирсутизм.

Гирсутизм. Под гирсутизмом (рис. 2) Рисунок 2. Гирсутизм у пациентки (из фотоархива ООО «Профессорская клиника Юцковских»). следует понимать увеличение у женщин количества волос на лице, груди, животе, вокруг сосков, а также на спине и бедрах. При усиленном оволосении женщин еще говорят о гипертрихозе. Между терминами «гирсутизм» и «гипертрихоз» существует разница: первый обозначает мужской тип роста волос у женщин, а второй — количественное увеличение волос на теле. Гирсутизм чаще всего является признаком некоторых эндокринных заболеваний, вызванных поражением гипоталамо-гипофизарной области, коры надпочечников и яичников. Но гирсутизм не всегда связан с нейроэндокринной патологией.
Выделяют следующие формы гирсутизма, не связанные с патологией яичников или надпочечников: конституциональный, экзогенный, идиопатический. Конституциональная форма гирсутизма носит наследственный характер. При этом виде повышенного оволосения продукция андрогенов в норме. К этой форме гирсутизма относится избыточное оволосение у женщин отдельных национальностей (жительницы стран Востока и Средиземноморья). Экзогенная форма гирсутизма возникает в тех случаях, когда приходится вводить андрогены в виде инъекций лекарственных препаратов. Гирсутизм может развиваться при применении таких препаратов, как кортикостероиды, стрептомицин. Предположение об идиопатическом гирсутизме возникает в тех случаях, когда не обнаруживается эндокринная патология и исключается экзогенный и конституциональный гирсутизм. Этот диагноз ставится при нормальном и повышенном содержании свободного тестостерона и невозможности установить причину заболевания. Учитывая, что достаточно часто гирсутизм служит проявлением ГА, целесообразно применение антиандрогенных препаратов. При гирсутизме косметическое устранение волос (эпиляция) эффективно только при условии удаления или угнетения источника повышенной секреции андрогенов.

Алопеция. В развитии андрогенной алопеции (рис. 3) Рисунок 3. Андрогенная алопеция у пациентки (из фотоархива ООО «Профессорская клиника Юцковских»). основная роль принадлежит α5-редуктазе — ферменту, который восстанавливает тестостерон до дигидротестостерона (ДГТ). ДГТ сокращает фазу роста волосяного фолликула, что приводит к его уменьшению и постепенной атрофии. Одновременно сокращается продолжительность жизненного цикла волоса, в результате чего наблюдается усиленное выпадение волос. Исследования показали, что уровень андрогенов у женщин с андрогенной алопецией часто не превышает норму. Это свидетельствует о том, что в патогенезе андрогенной алопеции основную роль играет повышенная чувствительность фолликулов к действию ДГТ. Женская андрогенная алопеция носит диффузный характер и редко приводит к облысению. При андрогенной алопеции на голове всегда остается венчик волос в затылочной и височных областях. Суть феномена состоит в том, что волосяные фолликулы в этих зонах не имеют рецепторов, способных воспринимать действие андрогенов. Поэтому исключается одна из обязательных причин андрогенной алопеции — гормональная активность — и волосы в этих областях генетически «застрахованы» от выпадения.
Современные подходы к лечению различных форм ГА включают назначение системных и наружных препаратов. Выбор методов лечения ГА должен основываться на адекватной клинической оценке степени тяжести синдромов ГА. Следует всегда учитывать состояние эндокринного фона, сопутствующие заболевания и состояния.

По нашим данным, за последние 5 лет значительно увеличилась обращаемость пациентов с синдромами ГА, особенно с такими, как алопеция и гирсутизм (рис. 4). Рисунок 4. Динамика обращаемости пациентов с синдромами гиперандрогении (по данным ООО «Профессорская клиника Юцковских», 2005—2009 гг.).
Механизм антиандрогенного действия КОК заключается в снижении продукции гонадотропинов (ЛГ), редукции уровня циркулирующих андрогенов, увеличении связывания андрогенов, снижении секреции андрогенов надпочечниками, ингибировании α5-редуктазы, связывании андрогенных рецепторов.
Первым КОК антиандрогенного действия был препарат диане-50, созданный на основе синтезированного в 1961 г. ципротерон-ацетата. В 1985 г. были созданы диане-35 (со снижением дозы эстрогенного компонента) и препарат андрокур (10 или 50 мг ципротерона ацетата).
Проведенные в 40 странах Европы два плацебо-контролируемых исследования с участием 1072 женщин в возрасте 14—45 лет с проявлениями акне показали, что применение КОК Джес по сравнению с плацебо к концу 6-го месяца способствует выраженному регрессу как невоспалительных, так и воспалительных акне. К окончанию терапии в среднем по группе акне регрессировали на 56%; состояния клинического излечения удалось достичь у 22% пациенток. Наиболее выраженное улучшение наблюдалось у женщин в возрасте от 14 до 22 лет.
В другом исследовании, посвященном оценке косметических аспектов приема антиандрогенного КОК на основе дроспиренона, к концу 6-го месяца терапии было продемонстрировано уменьшение себореи (на 71%), акне (на 75%) и гипертрихоза (показатель Ферримана—Галлвея — на 43%). При оценке толщины эпидермиса (корнеометрия) выявлено повышение гидратации на 26%, что было обусловлено как влиянием эстрогена в составе КОК, так и снижением концентрации андрогенов и/или их активности. Патоморфологически повышение гидратации эпидермиса обусловлено стимуляцией эстрогенами синтеза гиалуроновой кислоты. Определение снижения уровня испарения жидкости с поверхности кожи (на 35%) с помощью теваметрии (TEWL) также свидетельствовало об улучшении состояния кожи.
Важнейшим преимуществом Джес является хорошая переносимость, в частности, отсутствие влияния на массу тела, а иногда ее снижение. Это объясняется тем, что дроспиренон, входящий в состав препарата, дает антиминералокортикоидный эффект и препятствует задержке жидкости в организме, которая часто служит причиной увеличения массы тела при приеме КОК. Джес эффективно уменьшает проявления предменструального синдрома, в частности, появление акне в период, предшествующий менструации.
Таким образом, патогенетически оправдано и клинически актуально использование для лечения себореи, гирсутизма, андрогензависимой алопеции современных КОК, в частности Джес, которые подавляют секрецию гонадотропинов, стимулируют синтез ГСПС и снижают активность α5-редуктазы. Применение КОК, оказывающих антиандрогенный эффект, может улучшить не только гормональные параметры и классические проявления ГА, но и общее состояние, а также качество кожи, повышая гидратацию и улучшая характеристики, отражающие состояние кожи.
Так как диагностика и лечение различных форм ГА находятся на стыке нескольких специальностей (гинекология, эндокринология, дерматология), то только их объединение позволит добиться высоких результатов в лечении себореи, гирсутизма и андрогензависимой алопеции.
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Чувствительность к андрогенам: за пределами общеизвестного
Журнал: Проблемы эндокринологии. 2018;64(5): 315‑320
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Гонадные и внегонадные эффекты тестостерона у мужчин активно исследуются в последние годы. На сегодняшний день не вызывает сомнения увеличение рисков ожирения, сахарного диабета 2-го типа, артериальной гипертензии и атеросклероза у мужчин с дефицитом тестостерона. Одним из механизмов, посредством которых реализуется действие тестостерона, является чувствительность к андрогенам, определяемая длиной CAG-повторов в гене андрогенного рецептора. Увеличение количества CAG-повторов снижает их активность и проявляется низкой чувствительностью к тестостерону. Напротив, уменьшение числа тринуклеотидных повторов сопровождается повышением чувствительности рецепторов к андрогенам. В этом обзоре рассмотрены данные о влиянии полиморфизма гена андрогенного рецептора на эмбриогенез и дифференцировку пола, регуляцию сперматогенеза, прогрессирование рака и доброкачественной гиперплазии предстательной железы, симптоматику гипогонадизма, контроль углеводного и липидного обменов, минеральную плотность костной ткани, эндотелий сосудов, ответ на заместительную терапию тестостероном, а также на психосоциальные аспекты личности мужчин. Внедрение исследования полиморфизма гена рецептора андрогенов в клиническую практику позволит не только прогнозировать фертильность мужчины или риск развития рака простаты, но и подбирать индивидуальную терапию дефицита тестостерона.
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Действие андрогенов затрагивает практически все органы и системы. Формирование половых признаков в процессе эмбриогенеза, становление и функционирование репродуктивной системы и обеспечение фертильности — это лишь малая часть эффектов тестостерона (Т) и его метаболитов. Гораздо шире внегонадное действие андрогенов, представленное их влиянием на сердечно-сосудистую систему, липидный и углеводный обмены, минерализацию костной ткани, стимуляцию кроветворения, формирование и функционирование когнитивных функций, психосоциальную адаптацию и сексуальность. Одним из наиболее важных вопросов клинической практики является различная выраженность симптомов гипогонадизма, а также разный ответ на заместительную терапию у пациентов с одинаковым уровнем сывороточного Т. Ответ на этот вопрос кроется в определении чувствительности к андрогенам и является на сегодняшний день крайне малоизученным. Данный обзор содержит анализ наиболее актуальных исследований, опубликованных в рецензируемых журналах баз данных PubMed и eLibrary.
Структура и функции андрогенного рецептора
Многогранное действие Т реализуется через андрогенные рецепторы (AR), расположенные внутриклеточно и структурно относящиеся к рецепторам стероидных гормонов. AR присутствуют в клетках семенников, простаты, кожи, нервной системы и других тканей. Генетический контроль за активностью этих рецепторов осуществляется геном AR, который и обусловливает чувствительность к андрогенам и реализацию действия Т. Широта и разносторонность эффектов, реализуемых через ген AR, впечатляют — от дифференцировки пола в эмбриогенезе, регуляции сперматогенеза, прогрессирования рака и доброкачественной гиперплазии предстательной железы (ДГПЖ), симптоматики гипогонадизма до влияния на углеводный и липидный обмены, минеральную плотность костной ткани, эндотелий сосудов и даже психосоциальные аспекты личности.
Ген AR локализован на длинном плече Х-хромосомы и состоит из 8 экзонов, кодирующих 3 структурно-функциональных белковых домена. N-концевой домен участвует в гомодимеризации рецептора и связывании с ко-активаторами или ко-репрессорами и представлен экзоном 1. Второй — ДНК-связывающий домен содержит петлевой участок из двух «цинковых пальцев» (экзоны 2 и 3). С-концевой домен обеспечивает связывание со стероидными гормонами и представлен экзонами 4—8 [1].
В последние годы внимание исследователей особенно сосредоточено на изучении первого экзона гена AR, для которого характерны повторы последовательности из трех нуклеотидов — цитозина, аденина и гуанина — CAG. Триплет CAG кодирует аминокислоту глутамин, поэтому от числа тринуклеотидных повторов зависит количество глутамина в белке. Так, меньшему числу CAG-повторов соответствует меньшая степень конформационных изменений рецептора, что делает связь гормона и рецептора прочнее и приводит к повышению транскрипционной активности AR. Напротив, с увеличением числа CAG-повторов связь между андрогенами и рецептором становится слабее и транскрипционная активность AR снижается. Таким образом, чем больше длина CAG-повторов, тем слабее оказывается эффект андрогенов при одинаковым уровне Т [2]. Слабая активность андрогенов, вызванная удлинением триплета, находит отражение в механизме обратной связи в пределах гипоталамо-гипофизарно-гонадной оси. У здоровых мужчин удлинение CAG-повторов сопровождается усилением секреции лютеинизирующего гормона (ЛГ) [3], что при интактных клетках Лейдига вызывает повышенную продукцию Т и, следовательно, компенсирует ослабление действия андрогенов. Результатом гипертестостеронемии будет повышенная ароматизация Т в эстрадиол, концентрация которого возрастет. По-видимому, именно с этим связана гинекомастия у пациентов с увеличенным числом CAG-повторов [4]. Высокие концентрации эстрадиола у мужчин с удлинением CAG-повторов и сохраненной обратной связью в оси гипоталамус-гипофиз-гонады может усиливать эффекты этих гормонов в эстроген-зависимых тканях, например в костной [3]. Рядом исследователей обнаружена отрицательная корреляция между длиной CAG-повторов и минеральной плотностью костной ткани [5—7]. Эта связь прослеживалась и у молодых субъектов, но с увеличением возраста мужчин негативное влияние полиморфизма гена AR на минеральную плотность костной ткани усиливалось.
Для мужчин европейской популяции нормальным считается количество CAG-повторов от 9 до 37. Однако в этом нормативе существуют популяционные различия. Так, среднее число CAG-повторов в гене AR у мужчин-европейцев составляет 21, у африканцев — 17, у азиатов — 23. При этом, например 25 CAG-повторов хотя и укладывается в нормативные значения, зачастую бывает связано с ослаблением действия андрогенов, проявляющимся соответствующей клинической симптоматикой [8].
Эмбриогенез и дифференцировка пола
Предстательная железа
Одним из наиболее андроген-чувствительных органов является простата, имеющая большое число рецепторов к андрогенам. Предполагается, что полиморфизм гена AR с его способностью моделировать эффекты андрогенов влияет на долю злокачественных клеток в предстательной железе (ПЖ) [9]. Согласно метаанализу множества исследований [10], отношение шансов возникновения рака ПЖ при снижении частоты тринуклеотидных повторов составляет 1,19.
Возможная связь между ДГПЖ и CAG-полиморфизмом гена AR имеет также другой аспект: ДГПЖ представляет собой разрастание ткани переходной зоны и периуретральной области ПЖ (эпителиальная и фибромышечная гиперплазия). В 2 крупных исследованиях сравнивали сопоставимые когорты здоровых добровольцев и пациентов с ДГПЖ. Отношение шансов увеличения размеров простаты до необходимого хирургического вмешательства в группе с частотой CAG-повторов 24 составляло 1,92. Более того, при снижении длины CAG-повторов увеличивалась частота средних и тяжелых обструктивных симптомов нижних мочевых путей. Также была найдена обратная корреляция между частотой аденом и размером простаты, с одной стороны, и длиной CAG-повторов — с другой [11, 12]. Помимо этого, была выявлена связь полиморфизма гена AR с сексуальной активностью мужчин с ДГПЖ [13].
Фертильность
Установлена связь числа CAG-повторов в гене AR с олигозооспермией [14, 15]. Хорошо известно, что для осуществления сперматогенеза необходима стимуляция клеток Сертоли фолликулостимулирующим гормоном (ФСГ). Так, интратестикулярная активность андрогенов опосредуется важным кофактором, положительно влияющим на функцию клеток Сертоли. Установлена отрицательная связь числа CAG-повторов с эффективностью сперматогенеза [16]. Наиболее тяжелые формы нарушений сперматогенеза наблюдаются у пациентов со спинобульбарной атрофией Кеннеди — редким наследственным заболеванием, характеризующимся яркой неврологической симптоматикой в сочетании с гипогонадизмом и бесплодием. При этом число тринуклеотидных повторов в гене AR достигает 36 и более [17].
Клинические проявления гипогонадизма и психосоциальные аспекты личности
Анализируя клинические проявления андрогенного дефицита, следует подчеркнуть их тесную связь с полиморфизмом гена AR. Так, среди пациентов с нормальными концентрациями Т у мужчин с большим числом CAG-повторов увеличен риск развития симптомов андрогенного дефицита [18, 19]. Регрессионный анализ данных международного опросника Aging Males’ Symptoms выявил нарастание симптомов дефицита Т по двум шкалам (психологической и соматической) по мере увеличения длины CAG-повторов в гене AR, тогда как симптомы сексуальной шкалы были связаны непосредственно с уровнем эндогенного Т [18]. Азиатское исследование с участием 702 мужчин, не выявив связи между уровнем Т и распределением в популяции полиморфизма гена AR, показало, что при уровне Т выше 340 нг/дл пациенты с числом CAG-повторов более 25 имели достоверно более высокий риск развития симптомов андропаузы, чем лица со значением тринуклеотидных повторов менее 22 [19]. Иными словами, мужчины с нормотестостеронемией, имеющие большую длину CAG-повторов в гене AR, подвержены более высокому риску возникновения симптомов андрогенного дефицита.
Кроме того, установлена связь между длиной CAG-повторов в гене AR с неспецифическими проявлениями андрогенного дефицита, такими как тревожность и депрессия [20, 21]. Регрессионный анализ выявил положительную связь числа CAG-повторов с выраженностью депрессии у мужчин старше 50 лет. Это демонстрирует нарастание симптомов депрессии синхронно с увеличением длины тринуклеотидных повторов по мере ослабления чувствительности рецепторов к андрогенам независимо от уровня эндогенного Т [21]. Показано также, что генетически детерминированное удлинение CAG-повторов в гене AR является независимым фактором риска высокой тревожности, панических атак и фобических расстройств [20].
Удивительными кажутся данные о связи полиморфизма гена AR с интеллектуальной одаренностью мальчиков [22]. Так, установлено, что высокий уровень интеллекта (IQ более 130) у мальчиков ассоциирован с малой длиной CAG-повторов в гене AR, даже при допубертатно низких уровнях Т. Другими словами, высокая чувствительность к андрогенам является фактором, предрасполагающим к интеллектуальной одаренности вне зависимости от уровня самого Т.
Представляют интерес данные о полиморфизме гена AR у мужчин с синдромом Клайнфельтера, имеющих дополнительную Х-хромосому, на которой и расположен обсуждаемый ген [23]. Длина тринуклеотидных повторов имела положительную связь с ростом, но в то же время была отрицательно связана с минеральной плотностью костной ткани и отношением размаха рук к росту, что отражает негативное влияние андрогенов на эпифизарные зоны роста кости. Кроме того, удлинение CAG-повторов способствовало развитию гинекомастии и уменьшению размеров тестикул, тогда как укорочение длины триплета ассоциировалось со стабильными партнерскими отношениями и профессиями, требующими более высокого уровня образования.
Поразительно, что чувствительность к андрогенам может обусловливать и такое явление, как транссексуализм. Установлено, что удлинение цепи CAG-повторов в гене AR является одной из трех изученных генетических причин мужского транссексуализма [24].
Метаболический статус
Выявлена положительная независимая корреляция числа CAG-повторов в гене AR с содержанием жировой ткани тела, уровнем лептина и инсулина. Малое число CAG-повторов было независимо ассоциировано с протективными параметрами (низкая жировая масса, низкий уровень инсулина плазмы), но одновременно и с нежелательными факторами (низкий уровень липопротеинов высокой плотности) [25]. Сходные данные в отношении дислипидемии были получены и в исследовании больных сахарным диабетом 2-го типа [26].
Еще одним интереснейшим аспектом влияния полиморфизма гена AR является эффективность заместительной терапии тестостероном (ЗТТ) у пациентов с различными формами гипогонадизма. Крупное исследование TIMES 2 показало, что высокая чувствительность к андрогенам, моделируемая малым числом CAG-повторов в гене AR, независимо положительно связана с более значимой динамикой уровня инсулина натощак, триглицеридов, диастолического артериального давления и индекса инсулинорезистентности НОМА на фоне ЗТТ. Однако связи полиморфизма гена AR с уровнем гликированного гемоглобина, другими показателями липидограммы, ожирением или распределением жировой ткани не выявлено [10]. Негативное влияние удлинения CAG-повторов было обнаружено и в другом исследовании [27], показавшем более высокие цифры артериального давления и худшие значения липидограммы на фоне ЗТТ в сочетании с более низкими значениями гематокрита, находящегося под контролем андрогенов. Еще одним параметром, реагирующим на ЗТТ, является размер ПЖ [28]. Выявлена негативная связь между длиной тринуклеотидных повторов и изменением объема ПЖ на фоне терапии Т [10]. Причем 20 триплетов гена AR и менее повышают риск увеличения размеров ПЖ и темпы роста уровня простат-специфического антигена (ПСА) [27].
Терапия Т у пациентов с синдромом Клайнфельтера при коротких триплетных повторах вызывает более глубокое подавление уровня ЛГ, выраженный рост концентрации ПСА и повышает уровень гемоглобина [23].
Эндотелий
Одной из важнейших точек приложения внегонадного действия Т является эндотелий, причем данное взаимодействие моделируется полиморфизмом гена AR. Этот вопрос наименее изучен. Ранее у здоровых добровольцев была обнаружена связь низкого числа CAG-повторов в гене AR с нарушениями артериальной вазореактивности вне зависимости от уровня общего и свободного T [29]. Некоторыми исследованиями [30, 31] доказано ухудшение функции эндотелия у больных сахарным диабетом 2-го типа. В то же время существуют данные о негативном влиянии дефицита Т на сердечно-сосудистую систему у мужчин [32, 33]. При исследовании влияния полиморфизма гена AR на формирование нарушений функции эндотелия у мужчин с сахарным диабетом 2-го типа [34] было установлено, что большее количество CAG-повторов в гене рецептора AR через ослабление чувствительности к андрогенам обусловливает снижение выраженности эндотелий-зависимой вазодилатации в ходе пробы с реактивной гиперемией одновременно с усилением продукции таких маркеров дисфункции эндотелия, как P-селектин и резистин. Таким образом, увеличение числа CAG-повторов в гене AR ухудшает как сосудодвигательную, так и секреторную функцию эндотелия и может рассматриваться как предиктор развития и прогрессирования сердечно-сосудистых поражений у мужчин с сахарным диабетом.
Заключение
Нарастающий интерес исследователей к изучению биохимических и молекулярных механизмов действия Т диктует необходимость расшифровки генетических аспектов функционирования AR. Изучение чувствительности к андрогенам, определяемой длиной тринуклеотидного повтора CAG в гене AR, не только объясняет феномен различного ответа на ЗТТ у пациентов с одинаковым уровнем эндогенного Т, но и необходимо для понимания половой дифференцировки, психологического статуса, сексуальности и репродуктивного потенциала, а также рисков развития рака ПЖ и ДГПЖ, остеопороза, нарушений углеводного, липидного обменов и даже сердечно-сосудистых заболеваний у мужчин. Наиболее важной в клинической практике является возможность прогнозирования ответа пациента на ЗТТ. У лиц с малым числом CAG-повторов в гене AR из-за высокой чувствительности к андрогенам могут быть использованы более низкие дозы препаратов Т, тогда как неэффективность стартовой дозы ТЗТ у мужчин с большим числом тринуклеотидных повторов, свидетельствует о необходимости повышения дозы вводимого Т. На сегодняшний день определение CAG-полиморфизма гена AR не рекомендовано для рутинной практики, однако в ближайшем будущем оно может быть использовано, в частности для подбора индивидуальной терапии андрогенного дефицита.
Дополнительная информация
Источник финансирования. Работа выполнена при поддержке Российского научного фонда (грант РНФ № 14−25−00052).
Конфликт интересов. Авторы статьи заявляют об отсутствии финансовой заинтересованности и других потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов:
Сбор и анализ материала, написание текста — Хрипун И.А.; написание и редактирование текста — Воробьев С.В. Оба автора внесли существенный вклад в проведение поисково-аналитической работы и подготовки статьи, прочли и одобрили финальную версию текста перед публикацией.
Периферическая блокада андрогенов при гирсутизме. Антиандрогены
Блокирование связывания тестостерона и дегидротестостерона андрогенными рецепторами — эффективный способ лечения гирсутизма. В настоящее время существует ряд медикаментозных препаратов, обладающих этими свойствами. Однако все они потенциально тератогенны и должны использоваться у женщин детородного возраста в сочетании с контрацепцией.
Спиронолактон. Антагонист альдостерона спиронолактон также является конкурентом тестостерона и дегидротестостерона при воздействии на андрогенные рецепторы.
Спиронолактон (в дозе от 50 до 200 мг в день) способствует уменьшению роста волос на лице и изменяет качественный состав волосяного покрова у большинства женщин, страдающих умеренной и тяжелой формой гирсутизма. Максимальный эффект отмечают по прошествии 6 мес, он сохраняется до 12 мес лечения. Препарат одинаково эффективен при лечении женщин с идиопатическим гирсутизмом и гирсутизмом, связанным с СПКЯ. Отмечают снижение синтеза андрогенов в яичниках, однако на количество надпочечниковых андрогенов или кортизола он влияния не оказывает. В первые несколько дней лечения происходит снижение диуреза.
Аналогичное снижение количества общего тестостерона происходит при назначении доз спиронолактона от 100 до 200 мг в день. В обеих группах уменьшался диаметр анагенных волос (соответственно у 19 и 39% пациенток). Хотя нет данных о сравнительных исследованиях пероральных контрацептивов и спиронолактона, комбинированная терапия в значительной степени облегчает течение гирсутизма и снижает количество общего тестостерона сыворотки крови и свободного тестостерона. Кроме того, включение в терапию пероральных контрацептивов может снизить частоту одного из побочных эффектов спиронолактона — нерегулярность менструальных циклов.
К побочным эффектам, обычно связанным с применением спиронолактона, относятся нарушения со стороны желудочно-кишечного тракта, полиурия, никтурия, быстрая утомляемость, головные боли, нерегулярные менструальные кровотечения, снижение либидо и ато-пические реакции. Гиперкалиемия у женщин с нормальными функциями почек встречается редко.
Флутамид. Данный препарат используют для лечения рака предстательной железы, эффективен также при терапии гирсутизма. Исследование, проведенное у 18 женщин с гирсутизмом, получавших 125 мг флутамида 3 раза в день на протяжении 12 мес, показало, что течение гирсутизма значительно облегчалось у всех пациенток, одновременно происходило снижение концентрации андрогенов сыворотки крови. Флутамид эффективнее спиронолактона при лечении гирсутизма, в случае лечения флутамидом явления гирсутизма значительно уменьшаются (почти до нормальных показателей) в течение 6 мес, тогда как при лечении спиронолактоном аналогичное улучшение наступает только у 30% больных.
Главными проблемами остаются высокая стоимость лечения и редко встречающаяся гепатотоксичность (иногда выраженная). В связи с этим в настоящее время при гирсутизме флутамид используют редко.
Финастерид. Финастерид — ингибитор второго типа 5а-редуктазы, в настоящее время одобренный для лечения доброкачественной гиперплазии предстательной железы. Он также используется для лечения андрогенной алопеции у мужчин (в дозе 1 мг в день). По результатам исследования 27 женщин с идиопатическим гирсутизмом, лечение финастеридом по 5 мг в день или в комбинации с пероральными контрацептивами на протяжении 6 мес показало значительное улучшение клинического течения гирсутизма. В группе больных, получавших только финастерид, не отмечено изменения концентрации андрогенов в сыворотке крови. Однако у женщин, получивших комбинированную терапию, наблюдали снижение количества дегидротестостерона.
При лечении гирсутизма финастерид столь же эффективен, как и спиронолактон. На основании проспективного исследования, в котором сравнивали эффективность малых доз флутамида, финастерида, кетоконазола и комбинированного лечения ципротероном и эстрогенами, наименьшее улучшение состояния больных оказалось в группе пациенток, получавших финастерид. У этой группы больных также в наименьшей степени замедлялся рост волос. Однако переносимость пациентками этого режима лечения была наилучшей из всех четырех вариантов.
Гирсутизм — заболевание, в связи с которым женщины часто обращаются за медицинской помощью. Причиной, вызвавшей его, чаще всего оказываются доброкачественные состояния. Сбор анамнеза и физикальное обследование нередко дают клиницисту достаточную информацию для того, чтобы сделать обоснованное предположение о патологии, вызвавшей это заболевание. Скрининг-тесты (определение содержания общего и/или свободного тестостерона в сыворотке крови, ДГЭА-С и 17-гидроксипрогестерона в фолликулярную фазу) позволяют клиницисту сделать вывод о наиболее вероятной этиологии заболевания. У женщин с сопутствующей олигоменореей и/или бесплодием следует также определять концентрацию пролактина и ТТГ.
У большинства женщин с гирсутизмом диагностируют СПКЯ. С учетом повышенного риска сахарного диабета, артериальной гипертензии и гиперлипидемии у больных этой группы необходимо тщательное обследование с целью выявления таких состояний.
При выборе метода лечения необходимо учитывать цели и пожелания самой пациентки. Некоторым женщинам бывает достаточно того, что их убедят в доброкачественности заболевания. Другим необходимо подобрать комбинацию механических методов воздействия и фармакологических средств. В любом случае пациентке необходимо разъяснить, что замедление роста волос будет происходить сравнительно медленно.
• Регулярные менструации не свидетельствуют о нормальном андрогенном статусе у женщин с гирсутизмом.
• В большинстве случаев причиной гирсутизма бывает СПКЯ.
• Андроген-секретирующие опухоли встречаются редко и обычно вызывают появление новых симптомов, которые быстро прогрессируют.
• Концентрация тестостерона в сыворотке крови выше 200 нг/дл (7 нмоль/л) и ДГЭА-С более 700 мкг/дл (24,3 мкмоль/л) заставляет предположить наличие опухоли, но не является достоверным признаком ее существования. У большинства женщин с такой концентрацией гормонов в сыворотке крови опухоль не обнаруживают.
• Определение количества 17-гидропрогестерона в утренние часы во время фолликулярной фазы (без стимуляции) рекомендовано как скрининговый инструмент для выявления ВГН. Показатели менее 2 нг/дл — 100% достоверный отрицательный диагностический признак.
• Механическое удаление волос и применение пероральных контрацептивов — основные методы лечения.
• Спиронолактон служит эффективным средством лечения гирсутизма. Все другие периферические антиандрогены имеют значительные ограничения.
• Поскольку все антиандрогены потенциально тератогенны, показана контрацепция.
Учебное видео андрогены в норме и при патологии у женщин, мужчин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Снижение уровня андрогенов при гирсутизме. Пероральные контрацептивы и глюкокортикоиды
Пероральные контрацептивы при гирсутизме. Как и аналоги люлиберина, экзогенные эстрогены и прогестерон в составе пероральных контрацептивов ингибируют секрецию гонадотропинов, что приводит к снижению синтеза андрогенов в яичниках. Кроме того, пероральные контрацептивы повышают количество ГСПГ и снижают в надпочечниках синтез андрогенов и их предшественников. В свете этого пероральные контрацептивы — идеальное средство для женщин с гирсутизмом и гиперандрогенией. В целом в результате приема этих препаратов улучшения состояния удается достичь у 60-100% пациенток с гирсутизмом.
В настоящее время назначение низких доз эстрогенов, содержащихся почти во всех пероральных контрацептивах, позволяет избежать побочных действий, встречающихся при использовании высоких доз эстрогенов, на фоне сравнимого эффекта в плане понижения количества андрогенов и уменьшения роста волос. Однако между различными пероральными прогестинами есть различия, некоторые из них проявляют андро-геннуга активность.
В пероральных контрацептивах более ранних поколений снижение дозы прогестинов минимизировало их андрогенные побочные эффекты. В настоящее время стали использовать новые прогестины с селективностью к ПР. К таким препаратам относятся норгестимат, дезогестрел и гестоден . Новые варианты пероральных контрацептивов содержат прогестины, показавшие себя эффективными при лечении гирсутизма.
Агонисты люлиберина при гирсутизме. Люлиберин — гипоталамический декаиептидный гормон, который поступает в кровь импульсно и регулирует синтез и выброс как ЛГ, так и ФСГ (в передней доле гипофиза). Люлиберин и его агонисты использовали для стимуляции гипофизарно-гонадной зоны (в случае острой необходимости) или для блокады люлибериновых рецепторов при продолжительном непрерывном воздействии, приводящем к гонадотропиновой/гонадной супрессии (химической кастрации). Ряд исследований показал эффективность использования агонистов люлиберина при лечении гирсутизма.
Лечение женщин с гирсутизмом нафарелином в течение 6 мес приводило к значительному снижению содержания в сыворотке крови гонадотропинов, свободного тестостерона, а также андростендиона, и значительному уменьшению гирсутизма. Однако стоимость терапии и клинические последствия гипоэстрогении (приливы, уменьшение МПК) ограничивают ее применение. В настоящее время такое лечение не рекомендовано как метод выбора при лечении гирсутизма.
Комбинация агонистов люлиберина с эстрогеновой терапией снизила побочные эффекты гипоэстрогении. В одном из исследований, где при лечении гирсутизма сравнивали комбинацию леупролида + эстрогенов с оральными контрацептивами, был сделан вывод, что комбинация леупролида с эстрогенами дает менее выраженный терапевтический эффект.
Глюкокортикоиды при гирсутизме. При лечении глюкокортикоидами снижается синтез андрогенов в надпочечниках. Однако эффективность такой терапии при лечении гирсутизма ограничена. Следует использовать малые дозы препаратов, чтобы избежать таких побочных эффектов, как увеличение массы тела, остеопороз, нарушение толерантности к глюкозе и угнетение работы надпочечников. Даже у женщин с ВГН результаты лечения гирсутизма глюкокортикоидами часто неутешительны.
В одном из исследований, где сравнивали эффективность ципротерона и гидрокортизона при лечении гирсутизма у женщин в течение года, при использовании ципротерона уменьшение проявлений гирсутизма было отмечено в 54% случаев, а при использовании гидрокортизона — лишь в 26%. Однако гидрокортизон имеет более короткий период полувыведения по сравнению с преднизоном или дексаметазоном, использование которых могло изменить результаты исследования. Последние два препарата более предпочтительны для использования при этом состоянии. Обычная доза преднизона — 2,5 мг 2 раза в день, а дексаметазона — 0,125-0,25 мг перед сном. Более высокие дозы не рекомендованы.
Учебное видео андрогены в норме и при патологии у женщин, мужчин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

