Гистологический тип опухоли эпителиальный что это
Обновлено: 29.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Карцинома: причины появления, симптомы, диагностика и способы лечения.
Определение
Карциномой называют злокачественные опухоли, произрастающие из эпителиальных клеток. Заболевание может поражать кожу и те внутренние органы, где присутствует эпителиальная ткань. К карциномам относится рак легких, молочной железы, предстательной железы, прямой кишки, печени, щитовидной железы, почки. Это ведущие и наиболее изученные локализации злокачественных опухолей.
Рак представляет собой активное прогрессирующее патологическое разрастание атипичных клеток, заменяющих нормальные ткани.
Карциномы имеют тенденцию к быстрому росту за достаточно короткое время с прорастанием в соседние органы и ткани, распространением метастазов и образованием новых очагов в других частях тела.
Причины появления карциномы
Клетки в организме человека делятся и обновляются в разных тканях с разной скоростью. Под воздействием различных факторов в ДНК клеток могут возникать ошибки (генетические мутации), которые, с одной стороны, нарушают правильное деление клетки, а с другой – механизм запуска исправления ошибок во время деления. Если мутировавшая клетка начинает бесконтрольно делиться и «отказывается» умирать, она дает начало опухолевому процессу. Со временем появляется другая клетка, которая способна открепиться от первичной опухоли, найти подходящее место для вторичного очага и начать делиться там, – так формируется метастаз, то есть вторичный очаг роста злокачественной опухоли.
Существуют факторы, которые могут стать спусковым крючком для мутаций ДНК, – их называют канцерогенными. К таким факторам относятся:
- ультрафиолетовое и ионизирующее излучение (физические канцерогены);
- асбест, компоненты табачного дыма, алкоголь, афлатоксины в виде вредных примесей в составе пищевых продуктов, мышьяк в виде вредной примеси в составе питьевой воды (химические канцерогены);
- инфекции, вызываемые определенными онкогенными вирусами, бактериями или паразитами, такими как Helicobacter pylori, вирус папилломы человека, гепатит B, гепатит C, вирус Эпштейна-Барр;
- расстройства гормонального статуса – нарушение метаболизма половых гормонов.
Генетические факторы (наследование определенных дефектов) определяются как причина карциномы менее чем в 10% случаев.
Классификация заболевания
Основа классификации карцином – тип клеток, их локализация, а также стадии карциномы.
Наиболее распространены следующие типы карциномы:
- базальноклеточная карцинома (базалиома) – происходит из внешнего слоя кожи, отличается ограниченным и медленным ростом клеток. Чаще всего регистрируется на открытых участках тела, подвергающихся воздействию ультрафиолета – лице, голове и шее; метастазирует крайне редко;
- плоскоклеточная карцинома – как следует из названия, опухоль происходи из клеток плоского эпителия, которые присутствуют на поверхности кожи, ротовой полости, губах, языке, миндалинах, пищеводе, легких, гортани, вульве, шейке матки, половом члене, влагалище, анальном канале, мочевом пузыре. Опухоль быстро растет и метастазирует (распространяется с током крови и лимфы путем);
- аденокарцинома – опухоль развивается из клеток секреторного железистого эпителия, способна поражать многие органы: поджелудочную, предстательную, молочную, щитовидную, слюнные и потовые железы, пищевод, желудок, печень, кишечник, яичники, матку, гипофиз;
- инвазивная лобулярная карцинома, или дольковый рак молочной железы, возникает в вырабатывающих молоко дольках и постепенно прорастает в окружающие структуры;
- инвазивная протоковая карцинома – самый распространенный вид рака молочной железы – формируется в клетках протоков, по которым молоко из долек поступает в сосок;
карцинома Меркеля – редкий и агрессивный тип рака кожи, образуется в клетках нижнего слоя эпидермиса;
- высокодифференцированный рак (его клетки в значительной степени напоминают те, из которых они произошли);
- среднедифференцированный и малодифференцированный (это два промежуточных варианта);
- стадия 0 – раковые клетки не распространяются в иные ткани и имеют небольшой размер, располагаясь в месте своего первоначального появления. Опухоль легко удаляется и с вероятностью 100% наступает ремиссия;
- стадия 1 – опухоль имеет небольшой размер и находится в пределах органа;
- стадия 2 – отличается от первой увеличением опухоли в размерах;
- стадия 3 – прорастание раковых клеток в ближайшие ткани и лимфоузлы;
- стадия 4 – представляет собой активное прогрессирующие развитие опухоли и метастазирование в отдаленные органы.
На начальной стадии карцинома, как правило, не проявляет себя какими-либо симптомами и обнаруживается в ходе профилактических медосмотров.
Когда новообразование растет, может появиться припухлость и покраснение в месте его локализации, наблюдается нарушение функций пораженного органа. Поводами для беспокойства могут стать:
- необычные узелки, вздутия и припухлости, незаживающие язвочки или ранки, особенно во рту;
- неожиданное изменение размера или формы молочных желез, изменения ощущений при прикосновении, появление уплотнения ткани груди и кровянистые выделения из соска;
- затяжной кашель, одышка или изменение тембра голоса больного;
- проблемы с глотанием или нарушение пищеварения (затруднение при проглатывании твердой или жидкой пищи);
- хроническая стойкая изжога или другие регулярные расстройства пищеварения – тошнота, рвота, чувство дискомфорта, вздутие живота и др.;
- нарушения мочеиспускания (частое или затрудненное мочеиспускание, боль при мочеиспускании);
- изменения в привычной работе кишечника, внезапно начавшиеся запоры или, напротив, диарея;
- неожиданные кровотечения, включая небольшие выделения крови из влагалища, прямой кишки, включения крови в моче или мокроте при кашле;
- потеря аппетита, дискомфорт после еды;
Проводят гистологическое исследование биопсийного материала и иммуногистохимическое исследование, которые являются главными методами подтверждения диагноза карциномы.
Взятие биоматериала оплачивается отдельно. Согласно требованиям п. 17 Правил проведения патолого-анатомических исследований, утв. Приказом Минздрава России от 24.03.2016 № 179н, в целях уточнения диагноза заболевания (состояния) с учетом требований стандартов медицинской помощи и кл.
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»;
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Классификация эпителиальных опухолей желудка ВОЗ 2019 г., 5-е издание
Журнал: Архив патологии. 2020;82(4): 58‑69
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
Классификация эпителиальных новообразований желудка 2019 г. частично изменена по сравнению с изданием 2010 г.: выделены новые гистологические подтипы дисплазий (зубчатая дисплазия, дисплазия желудочных ямок/крипт), изменилась структура классификации доброкачественных новообразований (термин аденоматозный полип вновь вводится в обращение и представляет собой группу доброкачественных опухолей, ранее относимых к аденомам желудочного типа), раздел злокачественных эпителиальных опухолей расширен за счет карциномы из париетальных клеток, микропапиллярной и мукоэпидермоидной карцином, рака из клеток Панета. Факторы риска рака желудка разделены на две группы в зависимости от уровня доказательности их участия в канцерогенезе. Наиболее значимыми признаны: выявленная инфекция Helicobacter pylori, работа, связанная с производством резины, курение табака, рентгеновское и гамма-излучение. Изменены подходы к градации раков желудка по степени дифференцировки: подчеркивается предпочтительное использование двухступенчатой градации (low grade/ high grade). Нововведения также коснулись стадирования рака желудка. Раздел, посвященный нейроэндокринным опухолям, существенных изменений не претерпел. В целом новая классификация содержит более подробные данные по каждому из разделов, однако она не является интуитивно понятной. Пункты классификационной таблицы не соответствуют названиям разделов в тексте, что затрудняет понимание структуры и навигацию.
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»;
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Дата принятия в печать:
В июле 2018 г. в Лионе состоялось заседание рабочей группы по опухолям пищеварительной системы под эгидой Международного агентства по изучению рака (International Agency for Research on Cancer, IARC). В результате классификация опухолей была пересмотрена и издана в 2019 г. в составе серии «WHO Classification of Tumors», 5-е издание [1]. Следует отметить, что разделы, посвященные отдельным локализациям, включают в себя только эпителиальные опухоли. Мезенхимальные опухоли и лимфомы представлены в виде отдельных глав. Другой особенностью новой классификации является наличие кодов классификации МКБ-11, которая официально вводится в России с 01.01.21, и отдельной главы, посвященной генетическим опухолевым синдромам желудочно-кишечного тракта. Разделы классификации 2019 г. (табл. 1) выглядят более структурированными, в каждый раздел добавлена чрезвычайно важная информация о необходимых и желательных диагностических критериях каждой конкретной опухоли, что упрощает работу с изданием для практического врача.
Таблица 1. Классификация эпителиальных опухолей желудка
Доброкачественные эпителиальные опухоли и предраковые поражения
Железистая интраэпителиальная неоплазия, low grade
Железистая интраэпителиальная неоплазия, high grade
Дисплазия зубчатая, low grade
Дисплазия зубчатая, high grade
Дисплазия кишечного типа
Дисплазия фовеолярного (желудочного) типа
Дисплазия желудочных ямок/крипт**
Аденома кишечного типа, low grade
Аденома кишечного типа, high grade
Аденома желудка кишечного типа, спорадическая
Аденома желудка кишечного типа, синдромная
Аденоматозный полип, low grade
Аденоматозный полип, high grade
Злокачественные эпителиальные опухоли
Карцинома из париетальных клеток
Папиллярная аденокарцинома NOS***
Микропапиллярная карцинома NOS***
Медуллярная карцинома с лимфоидной стромой
Карцинома клеток Панета
Плоскоклеточная карцинома NOS***
Крупноклеточная карцинома с рабдоидным фенотипом
Карцинома с остеокластоподобными гигантскими клетками
Нейроэндокринная опухоль NOS***
Нейроэндокринная опухоль, G1
Нейроэндокринная опухоль, G2
Нейроэндокринная опухоль, G3
Карциноид из энтерохромаффинных клеток
Злокачественный карциноид из ECL-клеток
Нейроэндокринная карцинома NOS***
Крупноклеточная нейроэндокринная карцинома
Мелкоклеточная нейроэндокринная карцинома
Смешанная нейроэндокринная и ненейроэндокринная опухоль (MiNEN)
Примечание. * — новые коды для МКБ-O; ** — см. пояснения в тексте статьи; *** — NOS — not otherwise specified (без дополнительных уточнений).
В 5-м издании классификации значительно увеличены разделы, касающиеся фоновых и предопухолевых поражений, а также доброкачественных эпителиальных опухолей желудка.
К фоновым состояниям относят:
— атрофию и кишечную метаплазию,
— полипы фундальных желез,
— гиперпластические полипы желудка.
Большое внимание уделяется гастриту, вызванному Helicobacter pylori, стадированию атрофических изменений по системе OLGA [2—4], а также различным видам кишечной метаплазии.
Предопухолевые изменения слизистой оболочки желудка (дисплазия /железистая интраэпителиальная неоплазия) определены как неопластические изменения эпителия слизистой оболочки без признаков стромальной инвазии. Наиболее часто дисплазия встречается в антруме, однако может наблюдаться в любых отделах желудка [5]. В 5-м издании, как и в 4-м, выделяется два основных вида дисплазии: кишечного и фовеолярного (желудочного) типа. При этом в 5-м издании выделяют также подтипы дисплазий желудка: зубчатую дисплазию высокой степени, зубчатую дисплазию низкой степени, дисплазию желудочных ямок/крипт. Однако, несмотря на то что эти подтипы вынесены в классификационную таблицу, в тексте обозначено, что их клиническое значение определено нечетко и приводятся крайне короткие описания. Таким образом, решение составителей классификации о внесении редких подтипов дисплазии с неясной клинической значимостью в основную классификационную таблицу остается труднообъяснимым.
Дисплазия/железистая интраэпителиальная неоплазия желудка может представлять собой плоский, втянутый или полиповидный участок поражения слизистой оболочки. Градация дисплазии желудка предусматривает выделение дисплазии низкой степени (low grade) и дисплазии высокой степени (high grade) [6, 7].
Дисплазия кишечного типа описывается как очаг, состоящий из тубулярных, тубулярно-ворсинчатых или ворсинчатых структур, выстланных высоким цилиндрическим эпителием с увеличенными, удлиненными, гиперхромными ядрами, расположенными в эпителиальном пласте в несколько рядов. Часто встречается терминальная дифференцировка в виде наличия бокаловидных или нейроэндокринных клеток, иногда клеток Панета. Выявляется экспрессия MUC2, CD10, CDX2 [8].
Дисплазия фовеолярного типа описывается как очаг из тубулярно-ворсинчатых и/или зубчатых железистых структур, выстланных кубическим или низким цилиндрическим эпителием, напоминающим фовеолярный эпителий. Ядра круглые или овальные, с четко различимыми ядрышками. Цитоплазма клеток бледно-эозинофильная. Выявляется положительное иммуногистохимическое окрашивание с маркерами MUC5AC, MUC6.
Дисплазия желудочных ямок/крипт. В оригинальном тексте классификации употреблен термин «ямки/крипты», в связи с чем обращаем внимание, что использование термина «крипты» для слизистой оболочки желудка не соответствует международной гистологической номенклатуре. Такой тип дисплазии наблюдается в базальных отделах желудочных ямок, где железистые структуры демонстрируют созревание до поверхностных эпителиальных клеток. В 49—72% случаев встречается по периферии традиционной неоплазии и считается независимым предиктором прогрессии в инвазивный рак [9], однако в тексте классификации не указано, чем она отличается от дисплазии фовеолярного типа.
Зубчатая дисплазия локализуется только в желудочных ямках, характеризуется наличием микропапиллярных структур, экспрессирующих MUC5AC. Подобные гистологические изменения в литературе иногда называют зубчатой аденомой желудка [10].
Классификация доброкачественных эпителиальных опухолей значительно изменена. Если ранее понятия «аденома кишечного типа» и «аденоматозный полип» являлись синонимами, то в новой редакции аденомы кишечного типа стоят особняком, а к аденоматозным полипам относят образования, ранее находившиеся в группе аденом желудочного типа (аденомы фовеолярного типа, аденомы из пилорических желез). К группе аденоматозных полипов в новой классификации также относят аденомы из кислотообразующих желез (oxyntic gland adenoma), не упоминавшиеся в предыдущей классификации. Полипы фундальных желез (fundic gland polyps) более не рассматриваются как истинные опухоли и не имеют кода МКБ-О. Итак, к доброкачественным эпителиальным опухолям относят аденомы кишечного типа и аденоматозные полипы (аденомы фовеолярного типа, аденомы из пилорических желез, аденомы из кислотообразующих желез (oxyntic gland adenoma). Причем каждая из этих категорий может сопровождаться дисплазией высокой или низкой степени. Аденомам кишечного типа соответствуют коды МКБ-О 8144/0 и 8144/2 в зависимости от степени дисплазии, а для всех разновидностей аденоматозных полипов предусмотрены единые коды 8210/0 и 8210/2.
Аденома кишечного типа является третьим по частоте встречаемости образованием среди полиповидных новообразований желудка (после гиперпластических полипов и полипов фундальных желез), локализуется преимущественно в тех отделах желудка, где распространена кишечная метаплазия (в 60% случаев поражаются дистальные отделы желудка) [11]. Пациенты обычно старше 60 лет. Аденомы кишечного типа часто сочетаются с атрофическим гастритом и выраженной кишечной метаплазией. Выделяют два подтипа аденом кишечного типа: спорадические и синдромные. Синдромные аденомы иногда являются одним из проявлений семейного аденоматозного полипоза. Размеры аденом не превышают 2 см. Гистологически аденомы кишечного типа представляют собой совокупность тубулярных структур, выстланных пролиферирующим эпителием с признаками дисплазии, которые формируют полиповидное образование. Аналогичная картина на плоской слизистой оболочке без формирования полиповидного образования обозначается как дисплазия (интраэпителиальная неоплазия). Большинство клеток имеют цилиндрическую форму, вытянутое вдоль длинной оси ядро, присутствуют бокаловидные клетки и клетки Панета. При наличии дисплазии высокой степени аденомы кишечного типа стадируются как Tis.
Аденома фовеолярного типа — доброкачественная опухоль из фовеолярного эпителия. Локализуются обычно в теле или дне желудка, развиваются без предшествующих фоновых процессов в виде гастрита или атрофии/метаплазии [12]. Спорадические опухоли крайне редки [13], обычно аденомы фовеолярного типа возникают при семейном аденоматозном полипозе и других наследственных синдромах. Гистологически опухоли состоят из сосочковых и тубулярных структур, покрытых цилиндрическим эпителием фовеолярного типа с удлиненными ядрами и признаками дисплазии (чаще всего низкой степени). Поверхностный эпителий содержит нейтральные (ШИК-позитивные) муцины, что отличает аденому фовеолярного типа от аденомы из пилорических желез. Отмечается выраженная диффузная экспрессия MUC5AC и локальная слабая экспрессия MUC6; реакции с MUC2 и CDX2 отрицательные. Однако ориентироваться при постановке диагноза необходимо в первую очередь на окраску гематоксилином и эозином и ШИК-реакцию, нежели чем на иммуногистохимию.
Аденома из пилорических желез — доброкачественная опухоль из эпителия пилорических желез, возникающая обычно в теле и дне желудка [14]. Большинство таких аденом выявляется у пациентов 60—70 лет и сочетается с атрофией/метаплазией слизистой оболочки дна и тела желудка, вызванной аутоиммунным или H. pylori-ассоциированным гастритом [14]. Размер от 0,3 до 10 см (средний — 2 см). Аденомы из пилорических желез представлены плотно лежащими железами пилорического типа, выстланными кубическим или низким цилиндрическим эпителием. Клетки со светлой или слегка эозинофильной цитоплазмой, ядра расположены базально, округлые или овоидные, со слабо различимыми ядрышками. Поверхностный эпителий не содержит нейтральные (ШИК-позитивные) муцины. В крупных опухолях железы могут быть кистозно-расширены. В 40—50% случаев в аденомах из пилорических желез встречаются дисплазия высокой степени и фокусы аденокарциномы, однако только в 10% случаев наблюдается инвазия в подслизистый слой [15]. Риск прогрессии в аденокарциному увеличивается с размером аденомы, при наличии тубуловорсинчатых структур. В связи с высоким риском прогрессии в рак желудка рекомендовано тотальное удаление образования.
Аденома из кислотообразующих желез (oxyntic gland adenoma) — доброкачественная опухоль из главных (зимогенных) и/или обкладочных (париетальных) клеток с высоким риском прогрессии в инвазивный рак. Локализуется в верхней трети желудка, точная частота встречаемости не установлена. Опухоль состоит из тубулярных структур, выстланных цилиндрическими клетками со светлой эозинофильной цитоплазмой, слабой ядерной атипией, похожих на клетки фундальных желез (преимущественно главные). Может находиться на поверхности, однако чаще встречается внутрислизистое расположение. Дифференцировку клеток можно подтвердить иммуногистохимически с помощью окраски на пепсиноген I (главные клетки) и Н+/К+ АТФазу (обкладочные клетки) [16]. Иногда в опухоли формируются солидные структуры и анастомозирующие тяжи, что может симулировать картину нейроэндокринной опухоли (NET) [17]. В таких случаях полезно определение экспрессии хромогранина А, в аденомах из кислотообразующих желез желудка данный маркер не выявляется.
Рак желудка занимает в мире 3-е место по уровню смертности [27], несмотря на снижение заболеваемости, ежегодно в мире выявляется около 1 млн новых случаев рака желудка [18, 19]. Наиболее высокий уровень заболеваемости отмечается в центральной и восточной Азии, восточной Европе и Южной Америке [18].
Рак желудка развивается под воздействием комбинации различных неблагоприятных факторов, в 90% случаев является спорадическим и только у 10% пациентов связан с наследственными/врожденными причинами. Факторы риска для развития рака желудка перечислены в табл. 2. В новом издании эти факторы разделены на две группы в зависимости от различного уровня доказательности. Следует отметить, что авторы придают большое значение инфекционным (H. pylori, вирус Эпштейна—Барр) и химическим агентам [20], а также особенностям диеты [19, 21—24], в то время как рефлюкс желчи больше не выносится как значимый фактор риска.
Таблица 2. Факторы риска возникновения рака желудка
Факторы, для которых имеются достаточные доказательства участия в канцерогенезе рака желудка у человека:
Злокачественные новообразования — это группа заболеваний, насчитывающая несколько тысяч видов опухолей разных типов и разной степени злокачественности. Они подразделяются на большие группы в зависимости от того из каких тканей они развиваются: если из эпителиальных (барьерных) — то это раки, если из соединительных тканей (мягких тканей и костей) – саркомы, если из лимфоидных (иммунных) – лимфомы/лейкозы. От того насколько правильно верифицирована опухоль (определен ее тип, степень злокачественности и другие характеристики) зависит правильность и эффективность лечения. Важную роль в этом играют гистологические исследования.
О том, как проходят гистологические исследования, какие задачи кроме диагностических они позволяют решать, что влияет на сроки их выполнения рассказывает заведующая патологоанатомическим отделением с прозектурой НМИЦ онкологии им. Н.Н. Петрова, к.м.н. Анна Сергеевна Артемьева.
Что служит материалом для патоморфологических (гистологических) исследований?
Кусочек ткани пациента: кожи, слизистых оболочек, внутренних органов, костей, головного и спинного мозга и т.п., так называемый биоптат.
Процесс получения фрагмента ткани (биоптата) — биопсия – это несколько разных способов забора материала для гистологического исследования.
- Пункционная биопсия – «тычок», тонкой или толстой иглой. Пункционные биоптаты редко имеют диаметр больше 1-2 мм.
- Ножевая биопсия – открытая или эндоскопическая (малоинвазивная), в том числе лапароторако-медиастиноскопия.
Биопсию внутренних органов делают под УЗИ-навигацией, либо с помощью хирургического вмешательства.
Операционный материал – это все что удалено во время операции, как правило, орган или его часть, или несколько органов и/или их частей с образованием (опухолью) или без него.
Как обрабатывают эти материалы для проведения гистологического исследования?
1 Этап. Фиксация — «консервирование» биоптата в формалине — специальном химическом растворе, который предотвращает гниение, позволяет сохранить структуры ткани.
Фиксация биоптата может занимать от 6 до 24 часов – в зависимости от его вида и размера.
Операционный материал фиксируется дольше, в несколько этапов. Сначала предварительная фиксация, которая занимает примерно 12 часов. Затем вырезка нужных фрагментов и повторная фиксация еще 24 часа.
Соотношение объема материала к объему формалина должно быть 1:20.
2 Этап. Процессинг — процесс обезвоживания, обезжиривания и пропитки материала парафином. Автомат перемещает кусочек материала из раствора в раствор.
В качестве растворов применяются: абсолютированный изопропиловый спирт (6-8 смен), ксилол (2 смены), расплавленный парафин (2 смены).
Программа разнится для «жирного» материала (к которым относятся, например, ткани молочной железы) и «нежирного» – 36 и 24 часа соответственно.

Процесс получения парафиновых блоков.
3 Этап. Изготовление парафинового блока. Кусок материала помещается в форму с расплавленным парафином (уже другим нежели во время процессинга – с более высокой температурой плавления) и охлаждается. Выполняется вручную, сложно ускорить.

4 Этап. Изготовление срезов. Толщина образца — кусочка ткани, залитого в парафин – 1-3 мм. Толщина каждого среза 4-5 мкм (0,004-0,005 мм). Выполняет лаборант с использованием специального инструмента – микротома.
Срезы монтируются на стекла и должны высохнуть.
Несмотря на то, что часть материала теряется при выравнивании в микротоме, при должном профессионализме, из одного образца — материала от одной биопсии, операционного материала от одной опухоли, возможно изготовить около 100 стекол (микропрепаратов).
Для чего делаются срезы?
Срезы делаются для рутинной окраски гематоксилинном и эозином, иммуногистохимического исследования и других видов исследований.
Срезы для всех исследований используются одинаковые, различается окраска, могут отличаться стекла, на которые они монтируются, так для ИГХ и FISH нужны специальные адгезивные стекла или заряженные стекла.

Блоки и стекла способны храниться долгие годы и использоваться для проведения дополнительных гистологических исследований, пересмотров, а также в научных целях.

Архив гистологических материалов собирается в НМИЦ онкологии им. Н.Н. Петрова с 1927 года и содержит более 10 млн единиц хранения (микропрепараты — стекла, парафиновые блоки, архивные карточки, влажный архив).
Какие виды гистологических исследований наиболее информативны?
- Гистологическое исследование
- Иммуногистохимия (ИГХ)
- Флуоресцентная гибридизация in situ (FISH), может быть хромофобной (принцип тот же, другой тип метки)
Что позволяют определить разные виды гистологических исследований
Гистологическое исследование – что это такое?
Позволяет верифицировать опухоль – то есть определить из каких клеток она состоит (из какой ткани она развивается), степень ее дифференцировки (зрелости).
Рутинная окраска, выполняющаяся при гистологическом исследовании, позволяет выявить патологический процесс в анализируемом материале (биоптате, операционном материале):
- воспаление,
- специфическое воспаление,
- аномалия развития,
- опухоль.
Также, в большинстве случаев, благодаря рутинной окраске, можно определить степень злокачественности опухоли и, если она достаточно зрелая, то какова ее природа.
Окрашенные срезы под микроскопом
Инвазивный протоковый рак er 100%.
Карцинома сигмовидной кишки.
Крупноклеточная нейроэндокринная опухоль.
МТС крупноклеточной нейроэндокринной опухоли.
Неспецифический рак молочной железы. Участок in situ карциномы внутри протока, криброзного типа.
Низкодифферинцированный рак пищевода.
При гистологическом исследовании биоптата и операционного материала можно оценить распространенность: размер опухоли и прорастание в окружающие ткани, насколько затронуты лимфоузлы и есть ли метастазы в отдаленные органы (если эти все структуры присланы для гистологического исследования). При консультации готовых микропрепаратов – стекол, это, как правило, невозможно, если опухоль больше размеров гистологической кассеты или рассечена предыдущим исследователем и не предоставлены данные макроскопического исследования.
Во время гистологического исследования изучаются все стекла от одного образца – материала, полученного от одного вмешательства — одной операции или одной биопсии, вне зависимости от их количества, это считается одной консультацией.
Сроки выполнения гистологического исследования зависят от количества микропрепаратов и от категории сложности того процесса, который в них обнаруживается, сроки могут удлиняться, особенно при необходимости использования дополнительных методов исследования и анализа дополнительных сведений. На сроки выполнения гистологического исследования влияет полнота предоставленной пациентом клинической информации, в том числе данных уже проведенных исследований.
Иммуногистохимия (ИГХ)
Сложное многоэтапное исследование, выполняется после гистологического исследования на том же материале. Опухолевые срезы окрашиваются антителами, которые способны связываться антигенами (белками), которые несут опухолевые клетки. Разные опухолевые клетки несут разные антигены, к каждому из которых подобно ключа к замку подходит антитело.

Один из этапов ИГХ
ИГХ исследование — это комбинаторика. 100% специфичных и чувствительных к какой-то опухоли маркеров не существует, но есть набор антигенов, которые в определенном типе опухоль должны быть и набор тех, которых там быть не должно, таким образом ИГХ-панель строится так чтобы включать несколько антител, которые должны быть позитивны и несколько, которые должны быть негативны. Для разных опухолей различаются эти наборы позитивных/негативных маркеров.
При проведении прогностической ИГХ – выявлении маркеров чувствительности к терапии определяется набор таких маркеров для конкретных опухолей, например, рака молочной железы: рецепторы стероидных гормонов (эстроген, прогестерон), рецептор эпидермального фактора роста (HER2) и индекс пролиферативной активности Ki67 (скорости деления клеток).
Стекла окрашиваются последовательно — различными антителами красятся наборы маркеров в несколько этапов, процесс окраски стекол одним антителом занимает 48 часов.
Таким образом, каждое антитело наносится на отдельный срез ткани, монтированный на отдельное стекло, как правило с соответствующим внешним контролем, количество реакций (используемых антител) и этапов окраски может существенно варьировать в зависимости от конкретной диагностической ситуации, все зависит от индивидуальных особенностей опухоли. Проводится такое количество окрасок, которое необходимо для того, чтобы выявить наиболее характерный для определенной опухоли набор позитивных и негативных маркеров.
Кому-то для этого будет достаточно 5 антител, а кому-то необходимо сделать 20 окрасок и более. Максимальное количество окрасок, которое нам приходилось делать – 212.
Поэтому точные сроки и стоимость этого исследования невозможно определить заранее. Разные по течению и прогнозу опухоли могут быть очень похожи друг на друга, только минимальные различия в окрашивании, с учетом клинических данных и данных других методов обследования, могут позволить установить верный диагноз.
Есть целый ряд доброкачественных опухолей, симулирующих злокачественные, в том числе высокоагрессивные, а некоторые злокачественные высоко дифференцированные опухоли трудно отличить от воспалительных и реактивных процессов. В таких ситуациях только опыт и квалификация патоморфолога, анализ всего комплекса доступной информации (снимки КТ, МРТ, рентген, протокол операции, и др.) позволяют поставить диагноз.
В грамотной интерпретации результатов ИГХ очень важна роль эксперта, ведь те случаи, с которыми приходится работать, в большинстве своем, сложные. Практически не существует антител, которые могут выступать в качестве 100%-х маркеров той или иной опухоли, врачу всегда приходится взвешивать различные вероятности.
Что определяется с помощью ИГХ?
- Наличие рецепторов гормонов прогестерона и эстрогена при раке молочной железы;
- Экспрессию HER-2/neu в клетках при раке молочной железы, раке желудка;
- Определить ходжкинские и неходжкинские лимфомы — установить точный диагноз лимфомы на сегодняшний день невозможно без применения этого вида исследования.
- Определить первичная это опухоль или метастазы, тканевую принадлежность метастазов.
Иммуногистохимия позволяет оценить потенциальный темп роста опухоли, ответ на химио-, таргетную, гормональную терапию.
Флуоресцентная гибридизация in situ (FISH-тест)
Это метод молекулярно-генетической диагностики в ткани.
FISH проводится в срезе ткани и позволяет привязать генетическую перестройку к конкретной опухолевой клетке.
В этом тесте также используются специальные красители, которые связываются только с определенными участками хромосом. Их называют зондами, которые могут быть помечены флуоресцентным или хромогенным красителем, визуализирующимися при помощи флуоресцентного или светового микроскопа.
Технические операции по подготовке гистологических стекол к этому исследованию занимает 2 рабочих дня.

Анализ препарата с помощью многоголового микроскопа.
Полученные микропрепараты очень чувствительны к внешней среде – они могут выцвести со временем, чтобы избежать потерь информации все FISH-препараты сканируются, создается их цифровая копия, которая доступна для внешнего пересмотра. Специалисты просматривают флуоресцирующий материал в темном поле, в анализе препарата принимают участие как минимум 2 специалиста. При необходимости используется и цифровой анализ.
Что определяется с помощью FISH-теста?
FISH-тест позволят диагностировать некоторые виды опухолей, определяет целесообразность использования некоторых химиотерапевтических препаратов.
- определяется наличие амплификации HER2 в случаях пограничного результата по данным ИГХ, что необходимо для назначения таргетной терапии;
- проводится диагностика, то есть выявление генетических перестроек специфичных для определенного типа опухолей, когда невозможно окончательно установить диагноз при помощи более простых методик, чаще всего это саркомы мягких тканей и опухоли головного мозга;
- генетические отклонения, вызывающие рак того или иного органа;
- при лимфомах эта методика используется в диагностических целях и для выявления факторов неблагоприятного прогноза, то есть показаний для ранней интенсификации лечения.
Проведение гистологического исследования, и в первую очередь FISH-теста — это экспертная работа, которая зависит от квалификации специалиста. Очень многие мутации, которые выявляются в опухолях, не всегда являются метками опухолей, они могут находиться и в доброкачественных образованиях или нормальных тканях.
За год патологоанатомическое отделение НМИЦ онкологии имени Н.Н. Петрова выполняет около 20000 гистологических исследований (пациентов), из них около 5000 консультативных случаев (пересмотров), более 30000 ИГХ исследований, а также участвует в программе внешнего контроля качества ИГХ исследований NordIQ.
Специалисты отделения обладают огромным опытом проведения гистологических исследований и экспертными компетенциями.
Помните! Гистологические исследования – это отправная точка, от того насколько грамотно они выполнены зависит точность поставленного диагноза и эффективность назначенного лечения.
Скорость выполнения гистологических исследований и адекватность гистологического заключения зависят от ряда факторов:
- Качества стекол и блоков;
- Комплектности предоставления стекол (необходимо предоставить все стекла и блоки);
- Предоставление пациентом дополнительной информации, которая поможет верно интерпретировать данные гистологического исследования, ИГХ и FISH-теста, а именно: данные анамнеза заболевания, данные о сопутствующих заболеваниях, в первую очередь инфекционных (ВИЧ, гепатиты); все данные всех проведенных обследований и вмешательств: снимки — рентген, КТ, МРТ, УЗИ, протоколы операций, выписки.
После выполнения гистологического исследования пациент получает гистологическое заключение/протокол исследования гистологического материала.
Расшифровка гистологического исследования: на что обратить внимание?
Гистологическое заключение включает в себя несколько рубрик (полей):
Макроскопическое описание
Заполняется как для биоптатов — не обязательно, так и для операционного материала, для которого имеет крайне важное значение в ряде случаев.
Микроскопическое описание
Описание изменений на микроскопическом уровне, не обязательно к заполнению, так как вся необходимая информация может быть отражена в поле «заключение».
Результаты иммуногистохимического исследования
В этом поле описано какие антитела использовались в данном случае и каков результат окрашивания: наличие окрашивание или его отсутствие, локализация в клетке при необходимости, а также процент позитивных клеток и интенсивность реакции, когда это имеет значение.
Патологоанатомическое заключение
Содержит нозологическую/классификационную единицу, если ее возможно установить по исследованному материалу, то есть дает ответы на вопросы:
- Это первичная опухоль или метастаз?
- Где локализован первичный опухолевый очаг?
- Каков гистологический тип опухоли (из клеток какого типа она состоит).
Также приводятся все необходимые прогностические данные: степень дифференцировки, параметры, влияющие на стадию, состояние краев резекции, если возможно их оценить и т.п.
Дополнительные замечания и рекомендации
Поле может содержать комментарии, относительно возможного направления дальнейшего обследования, вероятности того или иного диагноза, необходимости ознакомиться с теми или иными клиническими данными и др.
Мы не рекомендуем пациентам самостоятельно заниматься расшифровкой показателей гистологического исследования, используя информацию, полученную на различных Интернет-сайтах и форумах пациентов, так как на интерпретацию данных влияет большое количество факторов, в том числе, возраст пациента, данные других исследований и др.
Расшифровкой исследования может заниматься только специалист – врач онколог по профилю заболевания!

Авторская публикация:
АРТЕМЬЕВА АННА СЕРГЕЕВНА
заведующий патологоанатомического отделения с прозектурой ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, кандидат медицинских наук
Рак прямой кишки – одна из самых серьезных болезней нашей цивилизации, которая занимает 4 место среди всех онкологических патологий и 2-е место среди опухолей желудочно-кишечного тракта.
Рак прямой кишки – что это такое?
Это злокачественное онкологическое заболевание происходит из эпителия прямой кишки. Этой опухоли присущи характерные черты любого злокачественного образования – быстрый рост, прорастание в соседние ткани, метастазирование.
Подвержены болезни мужчины и женщины в равной степени. Рост числа заболевших отмечается с 45 лет, а пик заболеваемости приходится на 75-летних.
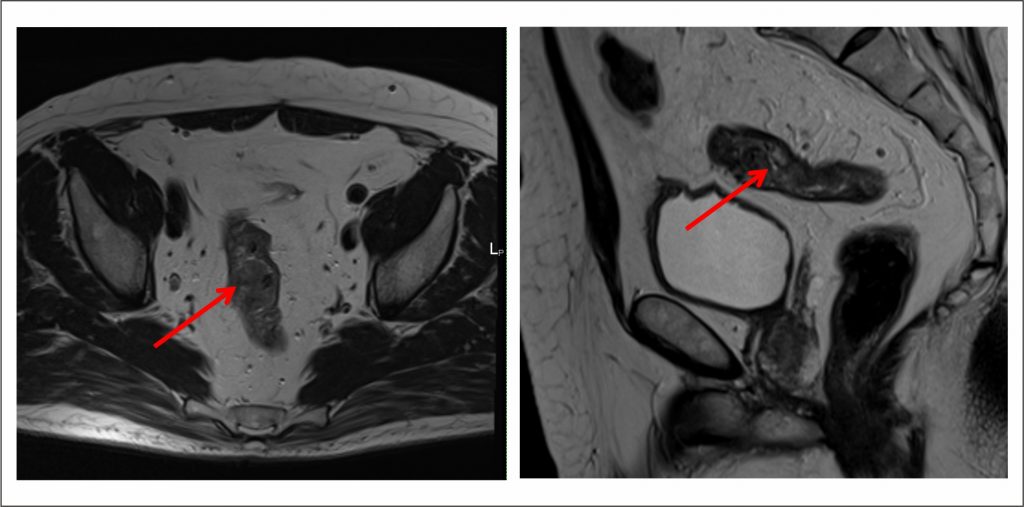
О заболевании
Слизистая оболочки конечного участка толстой кишки покрыта цилиндрическим эпителием с большим количеством желез. Их клетки продуцируют слизь. Под влиянием факторов риска появляются патологические клетки с бесконтрольным делением и утратой механизма апоптоза – запрограммированной гибели. Постепенно из них формируется опухоль прямой кишки.
Предположительно установлены причины рака прямой кишки:
- Неправильное питание.
Преобладание в рационе мясной пищи, животных жиров с одновременным дефицитом растительной клетчатки ухудшает прохождение кала, способствует запорам и развитию колоректальных опухолей. - Роль наследственности — замечена при возникновении некоторых форм новообразований.
- Предраковые патологии — полипы, болезнь Крона, неспецифический язвенный колит.
- Иммунодефицитные состояния, карцинома половых органов или молочной железы у женщин.
Виды рака прямой кишки
Тип опухоли определяется ее локализацией:
- Аноректальное расположение характерно для 5-8% случаев.
- Ампулярное встречается чаще других, до 80%. Это патология в самой широкой части кишки.
- Надампулярная локализация до 12% больных.
Характер роста опухоли может быть:
- экзофитный – растет в просвет кишечника;
- эндофитный – прорастает толщу стенки, инфильтрирует ее, может охватывать циркулярно;
- смешанный рост.
По гистологической картине новообразование бывает:
- железистый рак (аденокарцинома);
- солидный;
- перстневидно-клеточный;
- скирр;
- плоскоклеточный.
Симптомы рака прямой кишки, первые признаки
Развитие опухолевого процесса вызывает отдаленные признаки рака прямой кишки:
- слизь и кровь в кале;
- гнойные выделения;
- чувство переполненного кишечника;
- вздутие живота;
- боль в области прямой кишки;
- хроническая усталость, утомляемость;
- анемия;
- потеря веса.
На начальных стадиях проявления болезни может не быть. При выявлении анемии неизвестного происхождения стоит искать причину скрытого кровотечения. Возможно, это рак.
Поздние стадии характеризуются поражением других органов:
- прорастание в соседние органы, образование межорганных свищей;
- гнойно-воспалительные процессы – парапроктит, флегмона малого таза;
- перфорация опухоли надампулярной локализации с развитием перитонита;
- кровотечение.
Как выглядит рак прямой кишки – фото
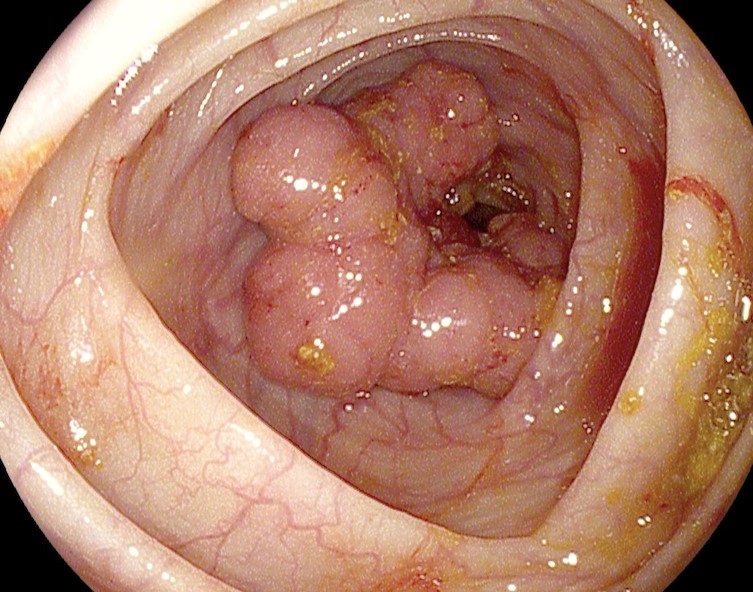
На фото рака прямой кишки можно заметить, что он значительно сужает просвет кишечника. Это является причиной запоров, переполненного живота, метеоризма.
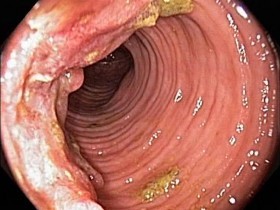
На этом фото карцинома растет инфильтративно, охватывая стенку.
Диагностика
После обращения к врачу, определяют симптомы, которые беспокоят пациента и позволяют предположить болезнь ректального отдела.
Общий анализ мочи и крови отражают состояние организма, наличие воспаления, анемию, работу почек и мочевого пузыря
Этот метод позволяет выявить опухоли аноректальной локализации. Определяют состояние сфинктера, слизистой оболочки.
Для обследования внутренней поверхности прямой кишки в более удаленных участках:
— ректороманоскопия – изучение кишечника с помощью жесткой трубки с оптическим прибором на конце;
— колоноскопия – исследование с помощью гибкого эндоскопа, позволяет обследовать весь кишечник.
Из подозрительных и измененных участков берут части тканей, которые изучаются на предмет раковых клеток или диспластических предраковых процессов.
Для дифференциальной диагностики рака, обнаружения на ранней стадии изменений, которые могут привести к онкологии.
Для определения распространенности злокачественного процесса. Можно выполнять абдоминально – через брюшную стенку, и трансректально – через анальное отверстие.
Часто возникает сочетание опухолей кишечника с гинекологическими карциномами – раком тела матки, яичников, а также молочной железы.
С применением контрастного вещества. На снимках заметны дефекты наполнения кишечника, патологические разрастания тканей, стенозы, вызванные новообразованием.
Выявляет даже небольшие по размеру патологические очаги, метастазы и инвазию опухоли в соседние органы, ее топографическое положение относительно других структур. Метод безопасен, не создает радиационную нагрузку, в отличие от КТ.
Стадии рака прямой кишки
Течение ракового процесса при отсутствии должного лечения прогрессирует. Стадия определяется по степени поражения самого кишечника, прорастанием ее через стенку, наличием метастазов в лимфоузлах, отдаленных поражениях других органов.
В связи с этим опухоли делят на 4 стадии. Такое распределение универсально для любых злокачественных опухолей.
1 стадия – опухоль небольших размеров, растет на слизистом слое, не поражает соседние органы и лимфоузлы.
2 стадия делится на А и Б. 2А – это поражение от трети до половины окружности кишечной трубки, но растет строго в стенке или просвете, метастазов нет. 2Б – размер очага такой же, но есть метастазы в околокишечных лимфоузлах.
3А – опухоль занимает более половины окружности кишки, прорастает через все слои и околокишечную клетчатку. Могут быть единичные метастазы в ближайших лимфоузлах.
3Б – любой размер опухоли, метастазы в отдаленных лимфоузлах, принимающих лимфу от ректальной области.
4 стадия – метастазы распространяются по внутренним органам и отдаленным лимфатическим узлам. Размер первичной опухоли может быть любой.
Методы лечения рака прямой кишки
Небольшой размер опухоли и ее прорастание только через слизистый и подслизистый слой прямой кишки, не затрагивая мышечный и серозный, позволяет выполнить хирургическое удаление самой опухоли. Иногда возможно проведение операции через кишку с помощью колоноскопа.
Если она проросла в мышечный слой, то показана резекция прямой кишки или экстирпация (полное удаление органа). Также удаляется параректальная клетчатка и лимфоузлы, в которых в 20% случаев уже обнаруживаются метастазы. Для проведения операции используют два доступа – лапаротомия (рассечение брюшной стенки) и лапароскопия (операция с помощью видеооборудования через несколько проколов на животе).
Тип операции выбирается исходя из локализации опухоли. Высокое расположение позволяет провести удаление новообразования и временно вывести конец кишки на брюшную стенку – сформировать колостому для дефекации. Такая манипуляция нужна, если пока сшить между собой концы кишки невозможно. Вторым этапом через некоторое время восстанавливают целостность кишечника.
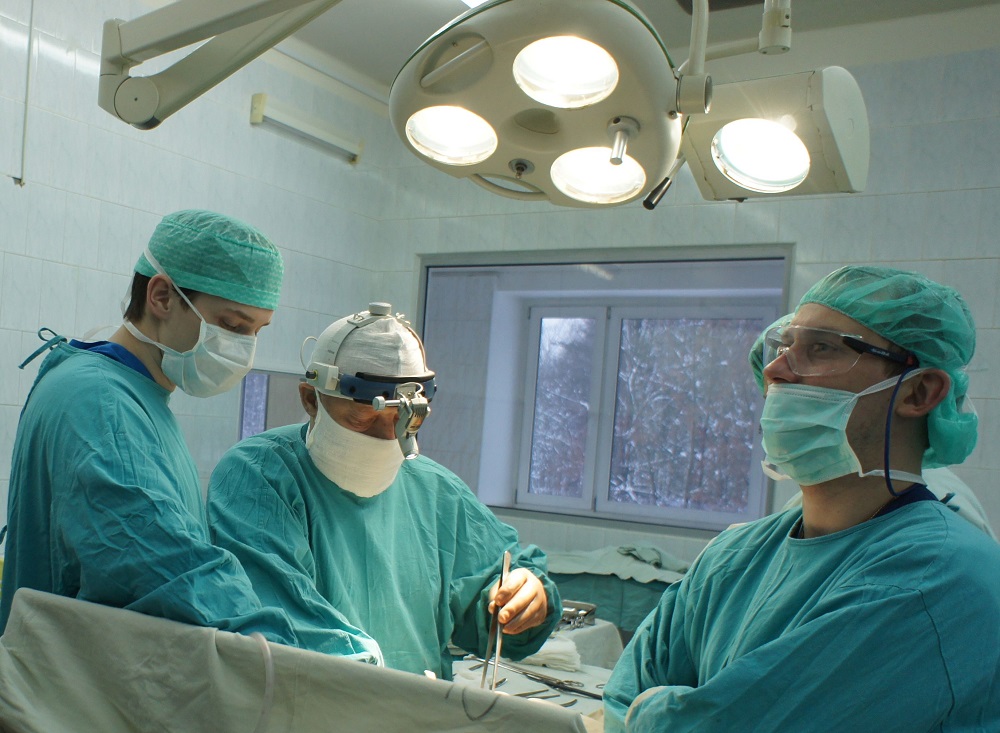
При низком расположении опухолевого процесса, если ниже ее не осталось здоровых тканей, проводят удаление пораженного участка и анального отверстия, накладывают колостому на брюшную стенку.
Прогноз выживаемости
После проведения радикальной операции выживаемость в течение 5 лет колеблется в пределах 34-68%. На исход лечения влияет стадия, на которой была диагностировна опухоль, состояние самого пациента, его возраст, сопутствующие заболевания.
В зависимости от стадии опухолевого процесса, пятилетняя выживаемость определена следующими цифрами:
- 1 стадия – до 77%;
- 2 стадия – до 73%;
- 3 а стадия – 46%;
- 3 б стадия – 43%.
4 стадия не рассматривается в данной статистике. Радикальные операции зачастую провести невозможно, т.к. метастазы опухоли диссеминрованы по всему организму. Летальный исход зависит от общего состояния больного.
Противопоказания
Операция противопоказана при следующих условиях:
- тяжелые хронические заболевания пациента – артериальная гипертензия, ишемическая болезнь сердца, когда невозможно дать наркоз;
- преклонный возраст пациента;
- запущенные стадии рака.
При распространенном процессе с метастазированием во многие органы применяют паллиативные резекции, направленные на облегчение состояния больного. Симптоматические операции – наложение обходных анастомозов, чтобы разгрузить кишечник и избежать осложнений на последних стадиях рака.
Лечение до и после операции
Химиотерапия и лучевая терапия показаны для больных с опухолями 2 и выше стадиями.
Если до операции были выявлены метастазы в нескольких лимфоузлах, а опухоль проросла мышечный слой, то на этапе подготовки к операции проводят лучевую терапию коротким курсом в течение 5 дней. Это позволяет уничтожить ранние метастазы, уменьшить размер самого образования.
Лечение рака прямой кишки после хирургического вмешательства проводится после получения патоморфологических данных об удаленных тканях. Решается вопрос о проведении облучения или его сочетании с химиотерапией. Лучевая терапия после операции уничтожает оставшиеся клетки в зоне первичной опухоли и предупреждает ее рецидив. У неоперабельных больных она облегчает состояние.
Чувствительность к химиотерапии выявляется у 30% больных. Ее назначают с лечебной целью для уничтожения метастазов.
Также химиотерапию проводят адьювантно – для предупреждения распространения карциномы, если выявлялось поражение нескольких лимфоузлов. Этот способ терапии улучшает качество и продолжительность жизни пациентов с метастазами. Применяют препараты платины, 5-фторурацил, лейковарин, фолинат кальция. Лекарства вводятся внутривенно капельно, курсами по несколько дней. Также применяют химиотерапию в сочетании с лучевой до проведения операции при местнораспространенной форме рака. Такое комбинированное лечение проводят в течение 1-1,5 месяца, а после окончания облучения через 6 месяцев выполняют операцию.
Рак легкого – это злокачественная опухоль, источником которой являются клетки бронхиального и альвеолярного эпителия. Это опасное заболевание характеризуется неконтролируемым ростом клеток в тканях лёгкого, склонностью к метастазированию. При отсутствии лечения опухолевый процесс может распространиться за пределы легкого в близлежащие или отдаленные органы. В зависимости от характеристик опухолеобразующих клеток, основными типами рака легких являются мелкоклеточный рак легкого (МРЛ) и немелкоклеточный рак лёгкого (НМРЛ).
По данным ВОЗ эта болезнь занимает одну из лидирующих позиций неинфекционных заболеваний, ставших причиной смерти до 70 лет.
Классификация
По месту первичного очага классифицируют виды опухоли легкого.
Центральный рак локализирован в проксимальных (центральных) отделах бронхиального дерева. Первые признаки рака легких (симптомы), которые должны насторожить, в этом случае выражены ярко:
- сухой продолжительный кашель, не поддающийся лечению.
- начинается кровохарканье с присоединением мокроты.
- закупорка просвета бронха опухолевыми массами приводит к одышке даже в состоянии покоя. В некоторых случаях возможно повышение температуры.

Фото 1 — Центральный рак правого нижнедолевого бронха (1) с обтурацией и метастазами (2) в бифуркационные лимфатические узлы
Периферический рак постепенно сформировывается в боковых отделах легких, медленно прорастая и ничем себя не обнаруживая. Данная опухоль легкого симптомы долгое время может не давать, они появляются при значительном местном распространении, вовлечении соседних органов и структур, прорастания бронхов. Диагностика рака легких этого типа локализации чаще всего возможна при профилактическом обследовании (рентгенографии или компьютерной томографии).

Фото 2 — Периферический рак (1) верхней доли правого легкого
Причины
Причиной рака легких, в подавляющем большинстве случаев (до 85%), становится долгосрочное табакокурение. В 10-15-процентной вероятностью заболевание проявляется у людей, которые не имеют этой вредной привычки. В этом случае можно отметить сочетание генетических факторов и воздействие радона, асбеста, вторичного табачного дыма или других форм загрязнения воздуха.
Диагностика
Онкология легких обычно выявляется при рентгенографическом исследовании грудной клетки и компьютерно-томографическом сканировании (КТ). Диагноз подтверждается биопсией, которая обычно выполняется при трахеобронхоскопии или под КТ контролем.
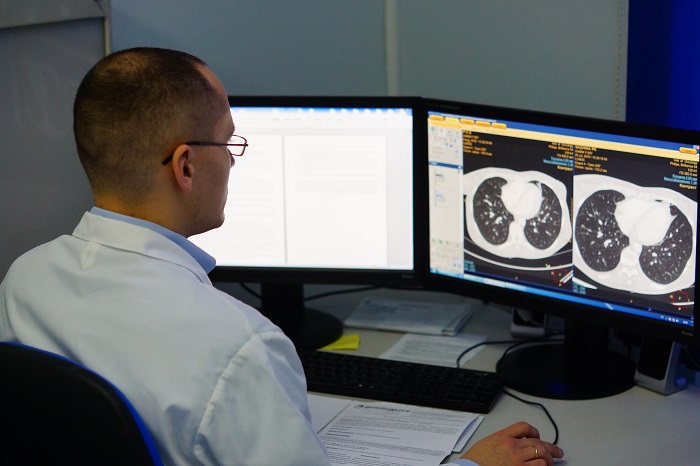
Профилактика
Профилактикой рака легкого является снижение влияния факторов риска:
- отказ от курения, в том числе и «пассивного» (вдыхание табачного дыма от находящегося рядом курящего человека),
- применение средств индивидуальной защиты (маски, респираторы) при работе с вредными материалами.
Лечение
Лечение онкологии легких и отдаленные результаты зависят от типа рака, степени распространения (стадии), а также общего состояния здоровья человека. При немелкоклеточном раке легкого применяют:
- хирургический
- химиотерапевтический
- лучевой методы лечения
Для мелкоклеточного рака легкого характерна лучшая чувствительность к медикаментозной и лучевой терапии.
Хирургический метод лечения рака легкого
— основной радикальный способ при 1-3 стадии болезни. Операции, выполняемые при данном заболевании классифицируются:
- по объему резекции (лобэктомии (удаление доли легкого), билобэктомии (удаление двух долей легкого), пневмонэктомии (удаление целого легкого)),

Фото 3 — Лобэктомия
Фото 4 — Пневмонэктомия
- по объему удаления лимфатических узлов грудной полости (стандартные, расширенные, сверхрасширенные),
- по наличию резекции соседних органов и структур (комбинированные операции проводятся при прорастании опухоли в перикард, трахею, верхнюю полую вену, пищевод, аорту, предсердие, грудную стенку, позвоночник). Помимо оперативного лечения возможно применение комплексного подхода, включающего лучевую и химиотерпию.
При лечении местнораспространенного злокачественного образования с переходом на главный бронх и лёгочную артерию, в тех случаях, где раньше единственным вариантом оперативного лечения являлась пневмонэктомия, сейчас возможно выполнение органосохранных операций. В этом случае иссекается пораженный участок главного бронха с последующим восстановлением непрерывности (бронхопластические и ангиопластические лобэктомии)

Фото 5 — Схема верхней бронхопластической лобэктомии
Лучевая терапия рака лёгкого
На сегодняшний день активное внедрение получают такие современные методы радиотерапии, как IMRT (радиационная терапия с возможностью изменения дозы излучения), 3Д конформная лучевая терапия (трехмерное компьютерное планирование избирательного облучения) стереотаксическая (точно сфокусированная) лучевая терапия. В проведении этих манипуляций, помимо онкологов, участвуют медицинские физики, врачи-радиологи, физики-дозиметристы и др. специалисты.
- пациентам с резектабельной опухолью лёгкого, которым оперативное лечение выполнить невозможно ввиду противопоказаний со стороны сердечно-сосудистой системы или по другим причинам;
- как альтернатива хирургическому вмешательству;
- для снижения риска рецидива при поражении лимфаузлов средостения, положительном крае резекции по данным гистологического исследования.
Химиотерапия
Планирование курса лечения немелкоклеточного рака лёгкого включает в себя использование фармакологических средств. Применяется в целях профилактики: адъювантная (вспомогательная), послеоперационная химиотерапия при 2-3 стадии заболевания и в терапевтическом курсе.
В зависимости от гистологического типа опухоли, стадии заболевания и предполагаемой чувствительности к воздействию, разработаны различные схемы применения химиопрепаратов.
Таргетная терапия (англ. target – мишень, цель)
Отдельный вид фармакологического лечения, заключающийся в назначении препаратов-ингибиторов, действующих только на опухолевые клетки, в которых выделены различные нарушения, задерживающих или даже блокирующих дальнейший рост.
- ингибиторы тирозинкиназы (гефитиниб, эрлотиниб, афатиниб) используются в лечении больных, в опухолевой ткани которых выявлены мутации в гене EGFR.
- При отрицательном статусе EGFR-мутации — ингибиторы ALK (кризотиниб, алектиниб).
Существуют таргетные препараты, для назначения которых не требуется выявление каких-либо нарушений в опухолевых клетках. К ним относятся бевацизумаб (ингибитор VEGF), ниволюмаб и пембролизумаб (анти PDL1 антитела).
Прогноз жизни
Прогноз онкологии легких при НМРЛ включает симптоматику, размер опухоли (> 3 см), неплоскоклеточный гистологический вариант, степень распространения (стадию), метастазирование в лимфаузлы и сосудистую инвазию. Неоперабельность заболевания, выраженная клиника и потеря веса более, чем на 10% — дают более низкие результаты. Прогностические факторы при мелкоклеточном раке легкого включают в себя статус состояния, пол, стадию заболевания и вовлеченность центральной нервной системы или печени во время диагностики.
Для немелкоклеточного рака легкого прогноз жизни, при полной хирургической резекции стадии IA (ранняя стадия заболевания) — 70% пятилетняя выживаемость.
Читайте также:

