Гигантские многоядерные клетки при герпесе
Обновлено: 28.04.2024
По данным ВОЗ заболевания, передаваемые вирусом герпеса, занимают 2-е место (15,8%) после гриппа (35,8%) как причина смерти от вирусных инфекций.
На территории России и в странах СНГ от хронической герпетической инфекции страдает не менее 22 миллионов человек [5]. Среди вирусных инфекций, поражающих генитальные органы, герпетическая инфекция встречается наиболее часто. Этому возбудителю принадлежит преобладающая роль в этиологии спонтанных абортов и преждевременных родов, в нарушении эмбрио- и органогенеза, врожденной патологии новорожденных.
Почти треть населения Земли поражена герпетической инфекцией и у 50% из них ежегодно наблюдаются рецидивы заболевания, так как иммунитета против этой вирусной инфекции нет. Имеются данные, что к 5 летнему возрасту около 60% детей уже инфицировано вирусом герпеса, а к 15 годам - почти 90% детей и подростков. Большинство людей являются пожизненными вирусоносителями. Причем в 85-99% случаев первичная инфекция у них протекает бессимптомно и только в 1-15% - в виде системной инфекции.
При обследовании студентов одного из колледжей США у 1-4% лиц были выявлены антитела к вирусу простого герпеса 1 и 2 типов; среди студентов университета - у 9%; лиц, посещающих клинику по планированию семьи - 22%, среди беременных женщин (не имеющих в анамнезе генитальный герпес) - 32% и лиц, посещающих клинику по поводу лечения заболеваний, передаваемых половым путем - в 46% случаев (Frenkel М., 1993).
Под герпетической инфекцией понимают болезни, характеризующиеся высыпаниями на коже, и/или слизистых оболочках в виде сгруппированных на отечно-эритематозном основании пузырьков и протекающие с поражением внутренних органов.
Этиология: герпес вирусы - "ползучие" ДНК, содержащие вирусы размером 150-300 нм.
Классификация:
Группа вирусов герпеса включает следующие подгруппы:
1. Вирус простого герпеса (ВПГ) - herpes simplex:
1.1. ВПГ 1 типа (ВПГ-1) клинически проявляется в виде герпеса губ, полости рта, глаз, генитального герпеса.
1.2. ВПГ 2 типа (ВПГ-2) - генитальный герпес и генерализованный герпес новорожденных.
2. V. Varicella Zoster - ветряная оспа и опоясывающий герпес (лишай).
3. Вирус Эпштейна-Барра - инфекционный мононуклеоз и лимфома Беркета.
4. Цитомегаловирус (ЦМВ) - цитомегалия.
Вирус простого герпеса.
Воротами инфекции являются губы, кожа, слизистые оболочки (в том числе и глаз). После инфицирования ВПГ-инфекция восходит по периферическим нервам до ганглиев, где и сохраняется пожизненно. Латентная герпетическая инфекция ВПГ-1 персистирует в ганглии тройничного нерва, а ВПГ-2 - в ганглии крестцового сплетения. При активации вирус распространяется по нерву к первоначальному очагу поражения [1].
Считается, что распространение герпетической инфекции поддерживается не цепочкой непрерывных заражений, а периодической активацией латентной инфекции, переходящей в клинически выраженные формы под влиянием факторов, снижающих функционирование иммунной системы (грипп, переохлаждение, лечение иммунодепрессантами, стресс и др.)
ВПГ-1.
Пути передачи: от больного человека здоровому при прямом контакте (чаще через поцелуй), воздушно-капельный, через предметы обихода, трансплацентарный, фекально-оральный и половой. ВПГ-1 можно выделить из слюны у 2-2,5% внешне здоровых лиц. Около 5% здоровых людей имеют вирус простого герпеса во рту, носоглотке, слезной жидкости, а иногда в спинномозговой жидкости и выделяют с фекалиями.
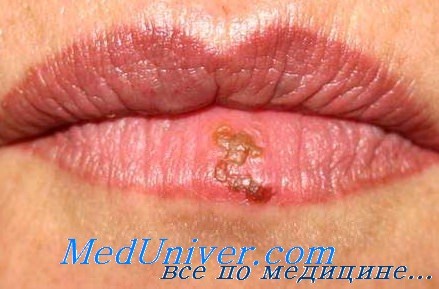
Герпес губ.
Клинически проявляется в виде группы пузырьков 1-3 мм в диаметре, расположенных на отечном гиперемированном основании. Пузырьки заполнены серозным содержимым и сгруппированы вокруг рта, на губах, крыльях носа. Иногда наблюдается распространенная герпетическая сыпь на коже рук, ягодиц.
Заболевание склонно к рецидивированию. Появление сыпи зачастую сочетается с головной болью, недомоганием, субфебрилитетом, чувством жжения, покалывания, зуда. Регрессируя, пузырьки ссыхаются с образованием корочки, либо вскрываются с образованием эрозий. Выздоровление наступает через 7-10 дней.
Лечение: мази ацикловир, зовиракс, госсипол, теброфеновая, а при корочках - тетрациклиновая или эритромициновая мазь.
Герпес полости рта протекает в виде герпетического стоматита и проявляется высыпаниями на слизистой оболочке полости рта в виде везикул, которые вскрываются с образованием эрозий с серовато-белым налетом (афтозный стоматит).
Лечение: обработка слизистых полости рта 0,1% раствором 5-йод-дезоксиуридина (керицид), таблетки ацикловир 200 мг 5 раз в сутки в течение 5 дней.
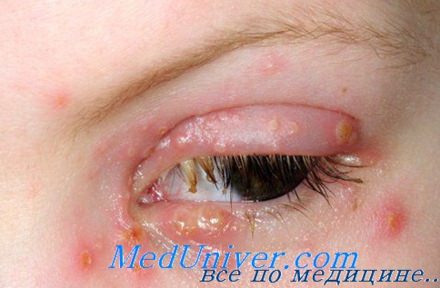
Герпес глаз протекает в виде кератитов (поверхностных или глубоких). Заболевание склонно к длительному рецидивирующему течению. Болезнь часто приводит к стойкому помутнению роговицы и снижению остроты зрения. Самыми опасными осложнениями являются: перфорация роговицы, эндофтальмит, повышение внутриглазного давления, развитие катаракты.
Лечение: таблетки ацикловир 200 мг 5 раз в сутки в течение 5 дней; закапывание раствора человеческого лейкоцитарного интерферона на конъюнктиву глаз, иммуностимуляторы.
ВПГ-2, генитальный герпес.
Основной путь передачи - половой. Заражение обычно происходит в том случае, когда у партнера, являющегося источником инфекции, наблюдается рецидивирование инфекции. Наряду с выраженными формами заболевания больше распространены асимптомные и не диагностируемые генитальные заболевания, обусловленные ВПГ-2. Такие больные становятся резервуаром и носителями вирусной инфекции, заражая других. Так, среди взрослого населения США их насчитывается 65-80% [1]. Асимптоматическое выявление ВПГ более определяется у женщин, чем у мужчин и более типично для ВПГ-2, чем ВПГ-1 [9].
Клиника.
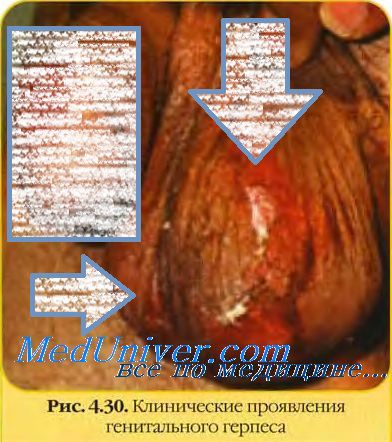
1. Первичный генитальный герпес у лиц, не имевших контакта с ВПГ, характеризуется генитальными и экстра генитальными поражениями. Чаще всего процесс протекает на больших и малых половых губах, слизистой влагалища и шейки матки, в области балано-препуционной бороздки, крайней плоти, слизистой головки полового члена и мочеиспускательного канала [7]. После скрытого периода, длящегося от 1 до 5 дней, появляются боль, зуд в местах поражения, выделения. У 60% больных наблюдается повышение температуры, головные и мышечные боли, в 23% случаев - увеличение паховых и бедренных лимфоузлов. На пораженных участках возникают мелкие, 1-3 мм в диаметре серозные пузырьки, сидящие на гиперемированном основании. Вначале прозрачное, содержимое пузырьков становится мутным, гноевидным. Вскрываются пузырьки с образованием ярко-красной эрозии, покрываясь тонкой корочкой, которая по мере эпителизации отпадает. Заживление происходит без рубцов, но остается временная гиперемия или пигментация. Средняя продолжительность местных проявлений 10-12 дней.
Поражение мочеиспускательного канала начинается внезапно с выделения слизи в виде "утренней капли", почти бесцветной. Больные жалуются на расстройство мочеиспускания, боли, чувство жара, иногда зуда или жжения в области наружных гениталий [9]. Через 1-2 недели симптомы исчезают, но у большинства больных возникают рецидивы болезни с интервалами от нескольких недель до нескольких лет.
2. Вторичный генитальный герпес протекает легче, и выздоровление наступает быстрее. Высыпанных элементов мало. Рецидивы при ВПГ-2 проявляются раньше и чаще, чем при ВПГ-1.
Анализ сывороток различных групп населения показал очень высокое содержание антител против ВПГ-2 у пациентов с инвазивной карциномой шейки матки (в 83% случаев, против 20% в контрольной). Врачи должны более тщательно обследовать больных с герпетической инфекцией гениталий, как на вирусное, так и злокачественное заболевание шейки матки [4].
Вторичный генитальный герпес способствует возникновению рака головки полового члена.
Лечение: зависит от формы и периода заболевания.
При первичном генитальном герпесе местно 5% мазь или крем ацикловир, таблетки ацикловир по 200 мг 5 раз в день в течение 5 дней или внутривенное введение ацикловира 5мг/кг каждые 8 часов в течение 5 дней, бонофтоновая, теброфеновая или оксолиновая мази 6 раз в сутки в течение 15-20 дней, иммуностимуляторы.
При поражении уретры - введение каплями раствора интерферона [2].
При эрозиях - примочки или суппозитории с интерфероном, виферон.
При рецидивирующем генитальном герпесе:
- эпизодическое лечение каждого обострения: наружно 5% крем ацикловир 5 раз в день в течение 10 дней, иммуностимуляторы,
- при 6 и более обострений в год - продолжительная терапия ацикловиром по 200 мг 4-5 раз в день в течение 3 месяцев, иммуностимуляторы.
Профилактика заключается в 100% обследовании супругов и беременных женщин для выявления антител к вирусам герпеса. При явных клинических проявлениях генитального герпеса у беременной - рождение ребенка кесаревым сечением.
Прогноз - сомнительный, смертность достигает 90%.
2. Трансплацентарно или путем восходящей инфекции, особенно после преждевременного разрыва оболочек, а также путем передачи вирусов со спермой через инфицированную яйцеклетку, развивается внутриутробное инфицирование, на 50% обусловленное ВПГ-2. Наибольшее число заболеваний у новорожденных встречается при первичной инфекции у матери на поздних сроках беременности [6]. Это может привести к молниеносной диссеминирующей инфекции плода и послужить причиной нарушения органогенеза и возникновения уродств или обусловливает самопроизвольное преждевременное прерывание беременности, мертворождение и раннюю детскую смертность. Дети могут рождаться с недоразвитостью головного мозга, гепатитом, желтухой, менингитом, отложением кальция в головном мозге, поражением глаз, зрительного нерва, клеток крови, надпочечников и др. Такие дети, как правило, нежизнеспособны.
Вирус Зостер.
1. Ветряная оспа - развивается при отсутствии предшествующего иммунитета. Возбудитель передается воздушно-капельным путем. Чаще болеют дети. После исчезновения клинических проявлений вирус в организме сохраняется пожизненно.
2. При резком снижении защитных сил организма вирус персистирует, что манифестно проявляется в виде клиники ветряной оспы (у лиц, уже переболевших ей). Затем наступает (атентный период, характеризующийся развитием вирусов в ганглиях периферической нервной системы, и развивается клиника, широко известная под названием опоясывающий лишай [11]. Появляется сильное чувство жжения, стреляющие боли, покалывания. Боли часто симулируют клинику стенокардии, аппендицита и др. Вскоре на отечном гиперемированном основании развиваются многочисленные пузырьки с серозным содержимым. Высыпания локализуются по ходу нервов (чаще межреберных и тройничных). Присоединяются резкие, жгучие боли такой интенсивности, что больные кричат, вынуждены искать положение тела, при котором боли менее сильные. Пузырьки сливаются в буллы, появляются очаги некроза. Длительность заболевания 3-4 недели, после чего сыпь исчезает, боль может оставаться несколько месяцев или лет.
Больных с опоясывающим герпесом нужно наиболее тщательно обследовать на выявление онкологических заболеваний.
Лечение: местно в остром периоде жидкий анальгин и флуцинар; мази госсипол, теброфеновая, Ацикловир по 800 мг 5 раз в день в течение 7-10 дней и иммунокорректоры. После однократно перенесенного заболевание не повторяется.
Вирус Эпштейна-Барра.
С этим вирусом связано развитие инфекционного мононуклеоза. Заболевание часто дает малигнизацию в лимфому Беркета. Встречается больше в странах Африки и Азии, поражая детей 2-15 лет. Процесс протекает в верхней челюсти, яичниках, орбитах глаз, почках, селезенке, периферических лимфоузлах [12]. Лечение по схеме полихимиотерапии агрессивных лимфом.
Вирус Цитомегалии.
Инфекционный процесс характеризуется поражением слюнных желез с образованием в тканях гигантских клеток с внутриядерными включениями, ассоциирован с ВИЧ [10]. Для передачи возбудителя требуется длительный и тесный контакт [8].
Основной путь передачи - половой. Вирус обнаруживается в слюне, моче, крови, грудном молоке, сперме (очень много). Выделяется со слюной до 4 недель, с мочой - до 2-х лет.
Заболевание протекает бессимптомно или с небольшой клиникой. При внутриутробном заражении дети рождаются с недоразвитым головным мозгом, с массивными отложениями кальция в нем, водянкой головного мозга, гепатитом, желтухой, увеличением печени и селезенки, пневмонией, пороками сердца, поражением миокарда, паховой грыжей, врожденными уродствами и др.
Лечение: ацикловир внутривенно 5 мг/кг веса (10 мг/кг) 3 раза в день в течение 10 дней в сочетании с иммуностимулирующей терапией.
Литература.
Для выявления возбудителя инфекций вирусов простого герпеса используют вирусоскоспический, вирусологический, биологический и серологические методы.
Материал для исследования инфекций вирусов простого герпеса — содержимое пузырьков, слюна, соскобы роговицы и др.
• При микроскопии мазков, окрашенных по Романовскому-Гимзе, выявляют многоядерные гигантские клетки (клетки Цанка) с тельцами включений (тельца Коудри).
• Для выделения вирусов простого герпеса используют культуры клеток и проводят посев исследуемого материала на куриные эмбрионы. В культурах клеток вирусы образуют бляшки (бляшки, образованные ВПГ 2-го типа крупнее) и дают характерный цитопатический эффект на куриных эмбрионах.
• Заражение лабораторных животных вирусом простого герпеса применяют редко. При заражении мозга белых мышей развивается специфический энцефалит; при заражении роговицы кроликов — герпетический кератит. Активность возбудителей in vivo нейтрализуют стандартные иммунные антисыворотки.
• Сывороточные AT к вирусам простого герпеса выявляют при РН, РСК или ИФА; однако ввиду значительной инфицированности населения обнаружение сывороточных AT не имеет существенной диагностической ценности. Большую ценность представляет выявление Аг вирусов в исследуемом материале методами РП и иммунодиффузии. Также используют РИФ с моноклональными AT,

Лечение и профилактика инфекций вируса простого герпеса
Поражения, вызванные ВПГ 1-го типа, обычно проходят самостоятельно и требуют лишь проведения местных мероприятий, направленных на профилактику вторичного бактериального инфицирования очагов поражения.
При тяжёлых поражениях назначают ацикловир; возможно его наружное применение в составе специальных мазей и кремов. При плохой переносимости препарата назначают фамцикловир, реже вызывающий побочные эффекты.
Для специфической иммунопрофилактики разработаны инактивированные вакцины, многократная иммунизация которыми снижает частоту рецидивов герпетической инфекции.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Простой герпес. Причины и механизмы развития
а) Пример из истории болезни. 32-летний мужчина обратился к врачу с жалобами на болезненные везикулы, персистирующие на половом члене в течение одной недели, в сочетании с выраженной паховой лимфаденопатией. Везикулы вскрылись за два дня до обращения к врачу, и боль усилилась. Подобные очати возникали у пациента один год тому назад, но за медицинской помощью он не обращался. За последние два года у него было три половые партнерши, но он не знает, имелись ли у них какие-либо заболевания. Пациенту был поставлен предположительный диагноз генитального герпеса и назначен курс ацикловира. Анализ на культуру герпеса оказался положительным, тест быстрых плазменных реагинов и тест на ВИЧ-инфекцию были отрицательными.

Рецидивирующий генитальный ВПГ на половом члене в виде сгруппированных язв
б) Распространенность (эпидемиология):
• Вирус простого герпеса (ВПГ) поражает более одной трети населения мира. Два наиболее распространенных кожных проявления вируса - генитальный и оролабиальный герпес.
• Оролабиальный герпес - наиболее распространенная форма герпетической инфекции, часто поражающая детей в возрасте до 5 лет. Продолжительность заболевания составляет 2-3 недели, а передача вируса оральным путем может происходить в течение 23 дней.
• Герпетический панариций - активная болезненная инфекция кисти, поражающая дистальную фалангу одного или нескольких пальцев. В Соединенных Штатах ежегодная заболеваемость составляет 2,4 случая на 100000 человек.
Простой герпес
в) Этиология (причины), патогенез (патология):
• Вирус простого герпеса (ВПГ) принадлежит к семейству герпесвирусов и содержит двухцепочечную ДНК.
• Различают два типа вируса простого герпеса (ВПГ) (1 и 2) с аффинностью к различным видам эпителия. 90% инфекций, вызванных ВПГ-2, являются генитальными, в то время как 90% инфекций ВПГ-1 - оролабиальные.
• Вирус простого герпеса (ВПГ) попадает в организм через поврежденную кожу или целостные слизистые оболочки. При инфицировании эпителиальные клетки погибают, формируя везикулы с образованием многоядерных гигантских клеток.
• Возвращение вируса в чувствительные ганглии приводит к развитию пожизненной латентной инфекции. Реактивация ВПГ может быть вызвана иммунодефицитным состоянием, травмой, лихорадкой или ультрафиолетовым облучением.
• Генитальная инфекция вирусом простого герпеса (ВПГ) обычно передается при половом контакте. Если инфекция наблюдается в предпубертатный период, нельзя исключить сексуального насилия.
• Данные свидетельствуют о том, что у 21,9% населения США старше 12 лет имеется серологическое подтверждение инфицирования ВПГ-2, который обычно ассоциируется с генитальными инфекциями.
• Примерно 90% инфицированных не знают о наличии у них герпетической инфекции и могут ненамеренно распространять ее.
• Средний инкубационный период для первичного генитального герпеса составляет 4 дня, после чего следует продромальный зуд, жжение и эритема.
Простой герпес
• При обоих типах вируса в случае первичной инфекции обычно наблюдаются системные симптомы, такие как лихорадка, недомогание, боль в животе и миалгия. Рецидивы обычно менее тяжелые и более короткие, чем первичный эпизод.
• Передача вируса простого герпеса (ВПГ) от матери к плоду связана с тяжелым заболеванием и смертностью. К проявлениям неонатального герпеса относятся инфекция кожи, глаз и полости рта, поражение ЦНС или мультисистемное поражение внутренних органов. Центр контроля заболеваний и Американская Коллегия акушеров и гинекологов рекомендуют как можно раньше проводить кесарево сечение женщинам с активными очагами ВПГ, а также переболевшим генитальным герпесом, болью или жжением в области вульвы перед родами.
• Герпетический панариций развивается как осложнение оральной или гениталыюй инфекции ВИГ, а также у медицинского персонала, контактировавшего с секреторными выделениями полости рта.
• Дети первых лет жизни и дошкольники предрасположены к развитию герпетического панариция при наличии у них герпеса и привычки к сосанию своих пальцев.
• Как и другие герпетические инфекции, герпетический панариций обычно развивается как первичная инфекция, за которой могут последовать рецидивы. Вирус мигрирует в периферические ганглии и шванновские клетки, где находится в латентном состоянии.
Рецидивы наблюдаются в 20-50% случаев, протекают обычно легче и бывают менее продолжительны.
Cohen PR, Paravar T, Lee RA. Epidermal multinucleated giant cells are not always a histopathologic clue to a herpes virus infection: multinucleated epithelial giant cells in the epidermis of lesional skin biopsies from patients with acantholytic dermatoses can histologically mimic a herpes virus infection.
Эпидермальные многоядерные гигантские клетки не всегда являются гистопатологическим ключом к герпесвирусной инфекции
Филип Р. Коэн, Таране Паравар, Роберт А. Ли, отдел дерматологии Калифорнийского университета в Сан-Диего, Сан-Диего, Калифорния
Клинический случай
Случай 1
У 24-летней европеоидной женщины появились болезненные язвы в полости рта, которые сохранялись после короткого курса пероральных кортикостероидов (несколько доз метилпреднизолона), который был прекращен через 5 дней.
Ее анамнез был отягощён по сахарному диабету 1 типа и генитальной инфекции, вызванной вирусом простого герпеса. Впоследствии у нее появились заполненные жидкостью пузыри в подмышечной впадине и паховой области, и она эмпирически лечилась пероральным валацикловиром по 1000 мг два раза в день без улучшения.
Осмотр выявил язвы на твердом небе, слизистой оболочке щек и слизистой оболочке десен и половых губ. Пустулы, пузырьки и буллы наблюдались в правой подмышечной впадине (рис. 1) и больших половых губах.
Была выполнена биопсия пораженной кожи из правой подмышечной впадины; также были получены образцы для культурального исследования, прямой иммунофлюоресценции антител и вирусных культур.
Микроскопическое исследование показало эпидермальный некроз и изъязвление с базофильными остатками; единичные бактерии в форме кокков были замечены в корке воспалительного очага.
Были отмечены очаговая ретикулярная дегенерация, внутриэпидермальные нейтрофильные пустулы, образующие супрабазилярное расщепление, и многочисленные многоядерные гигантские клетки кератиноцитов, демонстрирующие ядерную дегенерацию.
В верхней части дермы наблюдался периваскулярный инфильтрат, состоящий из нейтрофилов и эозинофилов (рис. 2).
Патология соответствовала герпетической инфекции. Пациентка была госпитализирована и лечилась от диссеминированной герпесвирусной инфекции внутривенным введением ацикловира в дозе 10 мг на килограмм каждые 8 часов.
В бактериальной культуре высеяли метициллинрезистентный золотистый стафилококк и добавляли в лечение внутривенный ванкомицин.
У нее продолжали развиваться похожие новые высыпания не только во рту, подмышечной впадине и паху, но также на руках и животе; кроме того, более ранние пустулы и пузырьки увеличились и/или вскрывались (рис. 3).
Исследования методом прямой иммунофлюоресценции и вирусных культур были отрицательными как для вируса простого герпеса, так и для вируса ветряной оспы. Повторные биопсии кожи выполнялись для методов рутинного окрашивания и прямой иммунофлуоресценции.
Микроскопическое исследование показало внутриэпидермальный пузырь, содержащий акантолитические кератиноциты, многочисленные эозинофилы и единичные нейтрофилы; соседствующий эпителий показал спонгиоз с эозинофилией. Периваскулярное воспаление, состоящее из эозинофилов и единичных лимфоцитов, присутствовало в верхней части дермы (рис. 4).
Прямая иммунофлуоресценция показала положительное межклеточное окрашивание в эпидермисе на IgG и C3. Впоследствии иммуноферментный анализ (ИФА) показал, что титры IgG в сыворотке крови были повышены как для десмоглеина 1, так и для десмоглеина 3.
Сопоставление клинических результатов, лабораторных исследований и повторных биопсий кожи позволило установить диагноз вульгарной пузырчатки.
Первоначальное лечение включало 60 мг перорального преднизолона в день. Она также получала внутривенно ритуксимаб, 2 дозы по 1000 мг каждая, разделенные на 2 недели, до того, как в течение следующих 6 месяцев она сократила свою ежедневную дозу преднизона. Высыпания на коже разрешились без рецидивов.
У здоровой 40-летней кавказской женщины наблюдалась рецидивирующая зудящая сыпь на груди и животе продолжительностью более одного года. Герпес-вирусную инфекцию в анамнезе отрицает.
Осмотр кожи выявил зудящие эритематозные и покрытые коркой папулы на груди и животе (рис. 5). Была проведена биопсия очага поражения. Эмпирическое местное лечение было начато с 0,1% мази триамцинолона.
Микроскопическое исследование показало супрабазальный эпидермальный акантолиз и образование полостей с нейтрофилами и эозинофилами как в интраэпидермальных пузырьках, так и в дерме.
В полости пузыря также наблюдались многоядерные гигантские клетки (рис. 6). Патологические изменения были интерпретированы как инфекция, вызванная вирусом герпеса.
Клиническое течение и улучшение при топической терапии кортикостероидами не коррелировали с наблюдаемыми патологическими изменениями. Прямая иммунофлуоресценция и исследование вирусных культур не показали заражения вирусом герпеса. Была проведена повторная биопсия кожи нового элемента сыпи в верхней части груди.
Повторная биопсия показала акантоз с очаговым акантолизом и дискератозом; вирусные цитопатические изменения отсутствовали. Лимфоцитарный воспалительный инфильтрат присутствовал в верхней части дермы (рис. 7).
Корреляция клинической картины, лабораторных исследований и патологических изменений позволила установить диагноз транзиторного акантолитического дискератоза (болезнь Гровера).
В эпидермисе можно наблюдать многоядерные гигантские клетки (табл. 1) 6. Происхождение гигантских клеток может быть эпителиальным или гистиоцитарным.
Гистиоцитарные эпидермальные многоядерные гигантские клетки выявляются при гигантоклеточном лихеноидном дерматите [7, 8] и блестящем лишае ладоней [9, 10].
Эпителиальные многоядерные гигантские клетки чаще всего ассоциируются с инфекциями, вызванными вирусом герпеса 2.
Однако они иногда встречаются как при доброкачественных, так и при злокачественных опухолях эпидермального клеточного происхождения, таких как трихоэпителиомы или базальноклеточные карциномы соответственно 5.
Недавно мы наблюдали многоядерные гигантские клетки кератиноцитарного происхождения, которые имитировали клетки, выявляемые при герпесвирусной инфекции, в эпидермисе пациентов с акантолитическими дерматозами: пузырчаткой обыкновенной 13 и транзиторным акантолитическим дерматозом 18.
Герпесвирусные инфекции кожи обычно проявляются в виде эритематозных пузырьков. Микроскопическое исследование биоптата очага поражения часто выявляет многоядерные гигантские клетки в эпидермисе, содержащие серые ядра с выделяющейся нуклеоплазмой на их периферии; также можно отметить акантолитические, иногда некротические кератиноциты во внутриэпидермальных пузырях.
Диагноз герпесвирусной инфекции может быть подтвержден прямым флуоресцентным исследованием или методом вирусных культур [1-3,22-25].
Вирусная инфекция простого герпеса может сосуществовать в сочетании с другими кожными заболеваниями; это, вероятно, представляет собой совпадающее развитие этой вирусной инфекции с ослабленным иммунитетом—в области кожи, которая стала уязвимой из-за предшествующего или сопутствующего кожного заболевания [26].
В дополнение к акантолитическим дерматозам и буллезным заболеваниям (таблица 2) 31 вирус простого герпеса также может активироваться в связи с гематологическими злокачественными новообразованиями [27, 34, 35], воспалительными дерматозами [27, 35] и физиотерапией [27, 35, 36]. Редко герпетическая инфекция была обнаружена при доброкачественных опухолях кожи, таких как себорейные кератомы [37].
У наших пациентов были акантолитические дерматозы, которые первоначально интерпретировались как герпесвирусная инфекция, основанная на выявлении многоядерных эпителиальных гигантских клеток в эпидермисе в биоптатах кожи.
Однако дополнительная оценка (включая прямую флуоресценцию и метод вирусных культур) была отрицательной для вирусной инфекции. Кроме того, одному пациенту не удалось улучшить течение заболевания после перорального или внутривенного назначения противовирусной терапии. Впоследствии повторные биопсии для исследования методом прямой иммунофлуоресценции и/или рутинной гистологии установили правильный диагноз для обоих пациентов.
Выводы
Эпителиальные и гистиоцитарные многоядерные гигантские клетки иногда можно обнаружить в эпидермисе. Хотя кератиноцитарные многоядерные гигантские клетки чаще всего обусловлены инфекцией, вызванной вирусом герпеса, они также могут наблюдаться при доброкачественных или злокачественных опухолях кожи или у пациентов с акантолитическими дерматозами.
Действительно, у наших пациентов были обнаружены везикулярные поражения кожи, в которых обнаруживались эпидермальные многоядерные гигантские клетки в образцах биоптатов и первоначально были интерпретированы как инфекция, вызванная вирусом герпеса. Однако прямые флуоресцентные исследования антител и вирусной культуры не подтвердили диагноз вирусной инфекции.
Впоследствии повторные биопсии пораженной кожи выявили патологические особенности, которые позволили установить правильный диагноз либо вульгарной пузырчатки, либо транзиторного акантолитического дерматоза.
Поэтому, когда подозрение на герпетическую инфекцию основано на обнаружении эпителиальных многоядерных гигантских клеток в эпидермисе, но либо клинической картине, либо основываясь на отсутствии ответа на противовирусную терапию, либо отсутствие подтверждающих лабораторных исследований не позволяют поставить диагноз вирусной инфекции, следует рассмотреть вероятность первичного акантолитического дерматоза и провести дополнительные гистологические исследования пораженной кожи.
Кроме того, поскольку окрашивание гематоксилином и эозином не является золотым стандартом для подтверждения аутоиммунных буллезных дерматозов, при подозрении на первичный буллезный дерматоз следует проводить биопсию кожи для прямой иммунофлуоресценции, поскольку гистопатологические изменения, наблюдаемые на окрашенных гематоксилином и эозином срезах, могут вводить в заблуждение.
Epidermal multinucleated giant cells are not always a histopathologic clue to a herpes virus infection: multinucleated epithelial giant cells in the epidermis of lesional skin biopsies from patients with acantholytic dermatoses can histologically mimic a herpes virus infection
Background: Multinucleated giant cells in the epidermis can either be epithelial or histiocytic. Epithelial multinucleated giant cells are most often associated with herpes virus infections. Purpose: To review the histologic differential diagnosis of conditions with epithelial and histiocytic multinucleated giant cells—since multinucleated giant cells in the epidermis are not always pathognomonic of a cutaneous herpes virus infection—and to summarize dermatoses in which herpes virus infection has been observed to coexist. Methods: Two individuals with acantholytic dermatoses whose initial lesional skin biopsies showed multinucleated epithelial giant cells suggestive of a herpes virus infection are reported. Using the PubMed database, an extensive literature search was performed on multinucleated giant cell (and epidermis, epithelial, and histiocytic) and herpes virus infection. Relevant papers were reviewed to discover the skin conditions with either multinucleated giant cells in the epidermis or coincident cutaneous herpes virus infection. Results: Initial skin biopsies from patients with either pemphigus vulgaris or transient acantholytic dermatosis mimicked herpes virus infection; however, laboratory studies and repeat biopsies established the correct diagnosis of their acantholytic dermatosis. Hence, epidermal multinucleated giant cells are not always a histopathologic clue to a herpes virus infection. Indeed, epithelial multinucleated giant cells in the epidermis can be observed not only in the presence of infection (herpes virus), but also acantholytic dermatoses and tumors (trichoepithelioma and pleomorphic basal cell carcinoma). Histiocytic multinucleated giant cells in the epidermis can be observed in patients with either giant cell lichenoid dermatitis or lichen nitidus of the palms. Conclusions: Epithelial and histiocytic multinucleated giant cell can occur in the epidermis. Keratinocyte-derived multinucleated giant cells are most commonly associated with herpes virus infection; yet, they can also be observed in patients with skin tumors or acantholytic dermatoses. Cutaneous herpes simplex virus infection can coexist in association with other conditions such as acantholytic dermatoses, benign skin tumors, bullous disorders, hematologic malignancies, inflammatory dermatoses, and physical therapies. However, when a herpes virus infection is suspected based upon the discovery of epithelial multinucleated giant cells in the epidermis, but either the clinic presentation or lack of response to viral therapy or absence of confirmatory laboratory studies does not support the diagnosis of a viral infection, the possibility of a primary acantholytic dermatosis should be considered and additional lesional skin biopsies performed. Also, because hematoxylin and eosin staining is not the golden standard for confirmation of autoimmune bullous dermatoses, skin biopsies for direct immunofluorescence should be performed when a primary bullous dermatosis is suspected since the histopathology observed on hematoxylin and eosin stained sections can be misleading.
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Доказано, что повреждение нейрональных структур начинается перед появлением кожной сыпи. При этом VZV по ходу чувствительных нервных волокон проникает в кожу, «ускользая» от факторов врожденного и приобретенного иммунитета, что в конечном итоге обусловливает возникновение односторонней везикулярной кожной сыпи, характерной для опоясывающего лишая.
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Читайте также:

