Герпетический энцефалит у новорожденных последствия что будет
Обновлено: 25.04.2024
Инфекции с осложнением в виде энцефалита у ребенка
а) Микоплазменный энцефалит. Микоплазма, хотя и не является вирусом, также нуждается в механизме репликации клетки-хозяина. Энцефалит микоплазменной этиологии иногда может иметь острое начало одновременно с респираторными симптомами или чаще в виде вторичного явления с атипичным иммунным ответом на инфекцию в ЦНС (Abramovitz с соавт., 1987). В одном из исследований были представлены плохие продолжительные неврологические последствия у пациентов с микоплазменным энцефалитом (Koskiniemi et al., 1991). Диагноз ставится при выделении ДНК из ликвора и/или серологическим методом определения продукции IgM, IgG и IgA к микоплазме в крови и/или СМЖ (Bencina et al., 2000).
Несмотря на то, что макролидные антибиотики эффективны против микоплазменного агента и должны использоваться при острой системной инфекции, в отдельных случаях трудно установить, является ли энцефалит первичным или иммунной реакцией. Однако проникновение макролидов в ЦНС недостаточно, и эффективность в преодолении гематоэнцефалического барьера не определена.
б) Респираторные вирусные инфекции:
1. Гриппозный энцефалит (грипп А и В). Несмотря на то, что у большинства новорожденных и детей, зараженных вирусом гриппа, развивается легкая респираторная инфекция, могут встречаться более тяжелые проявления болезни, включая неврологические симптомы (Wang et al., 2003; Maricich et al., 2004). Неврологическое поражение часто стойкое с серьезными последствиями или смертельным исходом, и включает острый энцефалит, синдром Рейе, острую некротическую энцефалопатию и миелит, а также аутоиммунные состояния типа синдрома Гийена-Барре. Вирусологическая диагностика основана на выделении вируса или определении антигенов в носоглоточном секрете, а так же на выявлении РНК в ликворе с помощью ПЦР или сероконверсией (Studahl, 2003).
Первоначально о повышенном уровне заболеваемости грипп-ассоциированным энцефалитом/энцефалопатией было заявлено у японских детей. В одном исследовании у 89 детей со средним возрастом 3,8 лет, ни один из которых не получал аспирин, заболевание отмечалось в течение восьми сезонов гриппа (1994-2002 гг.) (Togashi et al., 2004). После короткого респираторного продромального периода у большинства пациентов быстро развилось коматозное состояние с (или без) судорогами; 37% умерли, 19% имели неврологические последствия. В образцах плазмы и ликвора у двоих пациентов, которые умерли от молниеносного течения болезни, отмечалось значительное повышение уровня интерлейкина-6 (ИЛ-6) и фактора некроза опухоли-α (ФНО-α).
При посмертном исследовании одного летального случая выявлен вазогенный отек мозга с генерализованной васкулопатией, подтверждая повреждение эндотелия сосудов, вероятно, за счет высокой активности цитокинов. Другие исследования показали повышенный уровень системных и ликворных цитокинов при гриппозном энцефалите (ИЛ-6 и ФНО-а), так же как увеличение цитохрома С, свидетельствующего о вторичной смерти клеток путем апоптоза в результате гиперцитокинемии (Hosoya et al., 2005, Nunoi et al., 2005). Наиболее высокий уровень отмечен у пациентов с летальным исходом.
2. Энцефалит птичьего гриппа. На сегодняшний день птичий грипп A (H5N1) возникает у небольшой группы лиц, обычно там, где имеется контакт с больными птицами (de Jong et al., 2006). Как и при тяжелой респираторной инфекции, возможно сочетанное поражение многих органов с комой, в большинстве случаев с летальным исходом.
3. Аденовирусный энцефалит. Чаще встречается у детей, обычно проявляясь в виде легкой простудной или гастроинтестинальной болезни. К более тяжелым осложнениям относятся дыхательная недостаточность, энцефалопатия и хронические последствия, включая облитерирующий бронхиолит и продолжительное повреждение ЦНС (Chuang et al., 2003). Аденовирус может быть причиной асептического менингита, однако некоторые штаммы, такие как аденовирус 7 типа, часто вызывают менингоэнцефалит с более тяжелым течением. Другие неврологические синдромы, связанные с аденовирусом — миелит, подострый очаговый аденовирусный энцефалит и Рейе-подобный синдром (Straussberg et al., 2001).
У детей с ослабленным иммунитетом аденовирус может быть причиной полиорганной недостаточности с энцефалитом, печеночной коагулопатией и смертью. Диагноз выставляется на основе изоляции вируса или определения антигенов в носоглоточном секрете или стуле, так же как определение ДНК методом ПЦР в спинномозговой жидкости.
в) Гастроинтестинальные вирусы. Энцефалитное заболевание может также возникать после желудочно-кишечного продрома. Все энтеровирусы (включая полиовирусы, Коксаки-вирусы и ЕСНО-вирусы) могут вызывать спектр заболеваний от «чистого» энцефалита до «чистого» менингита. Часто проявляются в виде вспышек, где лишь в немногих случаях имеются более тяжелое течение энцефалитной реакции (Huang et al., 2003). Для постановки диагноза вирус можно амплифицировать из СМЖ методом ПЦР, изолировать из стула или мазков из зева или последовательным подтверждением сероконверсии. В лечении может использоваться плеконарил (Rotbart и Webster, 2001). Недавняя эпидемия энтеровируса 71 привела к тяжелой форме заболевания и летальным исходам у некоторых детей. В одном исследовании, все летальные случаи имели доказательства ромбэнцефалита, энцефалита ствола мозга и сердечной недостаточности. Оказалось, что в большинстве случаев сердечная недостаточность не была вызвана миокардитом (Fu et al., 2004).
Редкие проявления энцефалопатии возникали при ротавирусных гастроэнтеритах, но, вероятно, это не связано с проникновением вирусов в ткани ЦНС (Nakagomi и Nakagomi, 2005). Энцефалитные проявления с припадками и расстройствами сознания могут быть осложнением других невирусных диарейных заболеваний, включая энтеритные инфекции Shigella (Mulligan et al., 1992) и C. jejuni (Nasralla et al., 1993).
г) Постинфекционные энцефалиты. Постинфекционные энцефалиты, вероятно, самый распространенный тип острых энцефалитов в европейских странах. Поскольку ни в одном из этих случаев не обнаруживают вирус, они скорей всего не являются результатом прямого вирусного вторжения в ЦНС, а вероятно возникают благодаря ответу иммунной системы на инфекционный агент в тканях хозяина посредством механизмов, обсуждаемых в отдельной статье на сайте при остром диссеминированном энцефаломиелите (ADEM).
Большинство случаев постинфекционного энцефалита являются осложнением заболеваний, сопровождающихся экзантематозной сыпью. Однако многие случаи возникают вследствие недиагностированных инфекционных заболеваний. Частота постинфекционных энцефалитов оценивается приблизительно, так как во многих случаях не доступны данные патогенеза и механизма острой энцефалитной картины. Так, при свинке менингит возникает очень часто, но доказательства перивенозного энцефалита представлены лишь в некоторых случаях (Johnson, 1982а). В ряде случаев болезнь, предшествующая началу энцефалита, не диагностируется и не идентифицируется ни один вирус, даже ретроспективно. Диагноз вирусной инфекции основывается на клинических проявлениях и течении продромального периода.
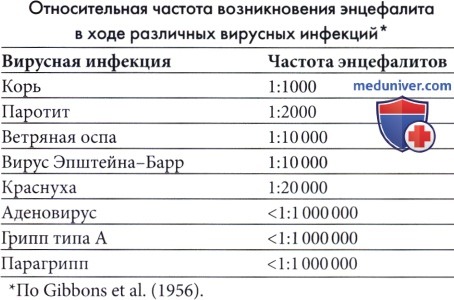
Корь — наиболее частая причина экзантематозной сыпи; таким образом, заболеваемость энцефалитом будет зависеть от заболеваемости корью и уровня иммунизации против кори среди населения. Острый коревой энцефалит начинается через 6-8 дней после первых высыпаний и встречается в 1 из 1000 случаев (Johnson et al, 1984). Несмотря на вариабельность интенсивности, заболевание часто протекает тяжело, со смертельными исходами в 10% случаев и частыми осложнениями, включая припадки, двигательные нарушения и умственную отсталость. Трудности в обучении и поведенческие расстройства характерны для детей с очевидным полным выздоровлением. Описаны редкие случаи постинфекционного энцефалита вследствие вакцинации против кори, но их частота значительно меньше, чем энцефалиты, связанные с диким вирусом кори (Landrigan и Witte, 1973). Постинфекционный энцефалит, ассоциированный с пятой болезнью (парвовирус В19) и внезапной сыпью (HHV-6 и 7) встречается очень редко.
В странах с вакцинацией против кори, свинки и краснухи, rubella (коревая краснуха) в настоящее время является редким заболеванием и случаи острого краснушного энцефаломиелита, следовательно, крайне редки. Постинфекционный краснушный энцефалит — тяжелое заболевание со смертностью примерно в 20% случаев, возникающее в 1 из 5000 острых случаев краснухи. Может развиваться одновременно с сыпью или даже через неделю или позже.
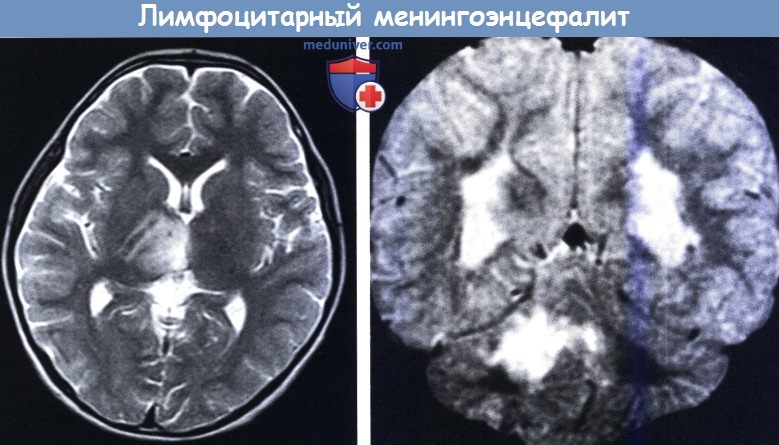
MPT (слева): патологический сигнал от правого таламуса и среднего мозга, вызванный параинфекционным лимфоцитарным менингоэнцефалитом.
12-последовательность (справа): более обширная зона интенсивного сигнала от правого полушария мозжечка и двусторонний интенсивный сигнал от супратенториального белого вещества полушарий (четырехлетняя девочка с мозжечковой атаксией с внезапным началом,
продолжающейся несколько недель, с легким ступором, который исчез через несколько дней).
1. Патология. Патогенез постинфекционного энцефалита имеет отличительные черты. Представлен множественными очагами перивенозной демиелинизации. Осевые цилиндры обычно лучше сохраняются, чем миелин. Определяются лейкоцитарные муфты вокруг вен и венул из мононуклеарных клеток, в демиелинизированных участках видны клетки микроглии и макрофаги.
2. Клинические проявления. Клинические проявления те же, что и при уже описанных типах энцефаломиелита. В большинстве случаев имеется внезапное начало с расстройствами сознания и припадками. Эти симптомы появляются в среднем через шесть дней (до 21 дня) после появления инфекции верхних дыхательных путей или экзантемы, в большинстве случаев у детей в возрасте старше двух лет. Могут быть представлены различные неврологические проявления, включая гемипарез, экстрапирамидные симптомы, атаксию, лицевые параличи, нистагм и поражение черепных нервов (Kennard и Swash, 1981; Marks et al, 1988). Результаты нейровизуализации могут быть отрицательными, а при МРТ обычно выявляются участки повышения сигнала преимущественно в белом веществе полушарий и иногда с вовлечением мозжечка. Характерны вовлечение зрительного бугра и базальных ганглиев. Течение заболевания варьирует от случая к случаю и зависит от причинных факторов. Уровень смертности низкий. Три четверти случаев протекают быстро, с выздоровлением в течение двух недель.
Другим вариантом постинфекционного энцефалита является острый геморрагический лейкоэнцефалит. Это фульминантное заболевание, которое характеризуется быстрой прогрессией очаговых неврологических симптомов и признаков, особенно гемиплегии, сопровождающейся беспокойством, комой и лихорадкой. Ликвор при этом ксантохромный в 20% случаев и показывает полиморфноядерный плеоцитоз. В периферической крови часто представлен выраженный лейкоцитоз. Возможно бифазное течение. Демиелинизирующие повреждения имеют геморрагический характер из-за некротизирующего ангиита венул и капилляров. В постановке диагноза может помочь КТ и МРТ, указывая на наличие больших гиподенсных участках иногда с геморрагическим компонентом (Watson et al., 1984, Huang et al., 1988). При некоторых случаях острого геморрагического лейкоэнцефалита удавалось выделить ДНК и РНК герпесвирусов, но до сих пор неясно, вовлекаются ли эти вирусы в патологический процесс (An et al., 2002).
Лечение постинфекционного энцефалита в основном такое же, как при всех острых энцефалитных заболеваниях. Значение стероидной терапии остается неясным, несмотря на весьма впечатляющее немедленное действие в отдельных случаях (Pasternak et al, 1980). В некоторых случаях применяли внутривенное введение иммуноглобулинов (Kleiman и Brunquell, 1995).
д) Энцефалит ствола мозга и мозжечка. При рентгенографии в случаях острого диссеминированного энцефалита может выявляться вовлечение ствола мозга. Ограниченное вовлечение ствола мозга не характерно и может встречаться при первичных энцефалитах (Kaplan и Koveleski, 1978; North et al., 1993; Duarte et al., 1994) и реже, при постинфекционных типах.
Среди клинических проявлений выделяют лихорадку, системные симптомы и асептический менингит вместе с симптомами и признаками дисфункции ствола головного мозга. Заметно поражение глазодвигательных нервов и нижней лицевой пары, что может сопровождаться заторможенностью и признаками вовлечения длинных нервных путей, что приводит к пирамидальным и мозжечковым проявлениям. Участие черепных нервов и атаксия могут имитировать синдром Миллера-Фишера, который некоторыми авторами рассматривается в качестве формы энцефалита ствола мозга. МРТ может продемонстрировать повышенный сигнал в ножках мозга, в мосте, мозжечке и продолговатом мозге (Ormerod et al., 1986, Hosoda et al., 1987) и энцефалит следует отличать от опухоли ствола мозга, абсцесса или других нейрохирургических проблем. Всегда следует помнить о возможности ромбэнцефалита, вызванного L. monocytogenes, при эффективности антибиотикотерапии (Frith et al., 1987).
е) Острый очаговый энцефалит. Острый очаговый энцефалит, поражающий ограниченный участок при инфекции коксаки-вирусом А9 (Roden et al., 1975) и ЕСНО-вирусом 25 (Peters et al., 1979), может привести к острой гемиплегии или гемихорее. Лакунарные повреждения в центральном сером веществе или внутренней капсуле могут быть результатом сосудистых инфарктов или очаговых церебритов.
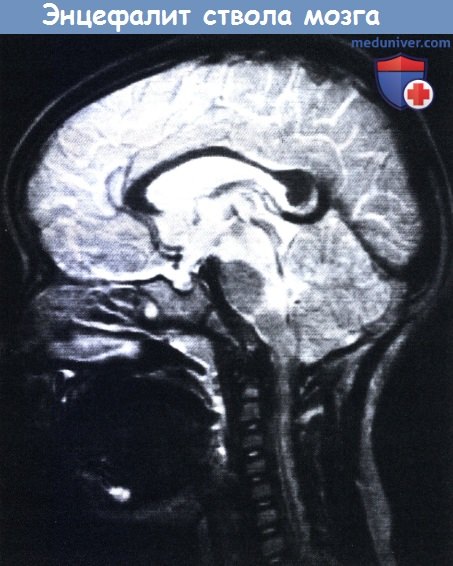
Энцефалит ствола мозга у четырехлетней девочки с клиникой ступора и множественными параличами черепных нервов.
При МРТ выявлено усиление сигнала от ножек мозга и дорсальной части моста.
При повторной МРТ через два месяца патологических изменений не обнаружено.
Врожденный герпес – герпетическая инфекция, встречающаяся у новорожденных при антенатальном или интранатальном заражении от инфицированной матери. Характеризуется специфическими кожными проявлениями в виде везикулярной сыпи, которая может также располагаться на слизистых оболочках глаз, рта, внутренних органов. Часто развивается герпетический энцефалит с очаговой симптоматикой и судорогами. Патологические изменения отмечаются в печени, селезенке, легких, почках и других органах. Врожденный герпес диагностируется на основании результатов серологических, гистологических исследований, а также выявления частиц вируса. Лечение – противовирусные препараты, иммуномодуляторы, иммуноглобулины, витаминотерапия.
Общие сведения
Врожденный герпес является одним из множества вариантов герпетической инфекции, к которой также относятся цитомегалия, ветряная оспа, внезапная экзантема детей и другие нозологии. Частота встречаемости заболевания – 1 случай на 2,5-60 тыс. новорожденных. Предположительно, такой разброс статистических данных связан с низкой выявляемостью в развивающихся странах. Врожденный герпес имеет высокую значимость в педиатрии в связи с ростом заболеваемости, а также увеличением случаев рецидивирующего течения. Это обусловлено тем, что вирусом простого герпеса инфицировано практически все население планеты, а сам вирус постоянно претерпевает значительные мутации. Кроме того, низкая специфичность симптомов часто является причиной запоздалой диагностики, что, в свою очередь, представляет опасность для жизни ребенка.

Причины и классификация врожденного герпеса
Возбудитель заболевания – вирус простого герпеса человека. Известно множество типов данного вируса, однако врожденный герпес в 80% случаев вызывается вирусом 2 типа, который также известен как генитальный герпес. Оставшиеся 20% в структуре заболеваемости приходятся на долю вируса простого герпеса 1 типа. Заражение чаще всего происходит интранатально, при прохождении плода по инфицированным родовым путям. Реже врожденный герпес развивается еще в утробе, попадая в организм малыша через плаценту. В этом случае речь идет о наиболее тяжелом течении заболевания, результатом чего обычно является выкидыш или рождение ребенка с разной степенью недоношенности и тяжелыми пороками развития.
Заболевание может протекать в нескольких формах, которые отражают доминирующие клинические проявления. Выделяют 3 формы врожденного герпеса: локализованную, церебральную и генерализованную. Первая из них представлена характерными кожными высыпаниями, и именно этот симптом является ведущим. Церебральная форма, как правило, проявляется менингитом и энцефалитом герпетической природы. Генерализованный врожденный герпес у новорожденных достаточно часто развивается вследствие несовершенства иммунного ответа и сопровождается симптомами со стороны внутренних органов. Мозговые нарушения и кожные элементы также присутствуют.
Симптомы врожденного герпеса
Как уже было сказано выше, симптоматика различается в зависимости от формы заболевания. Чаще всего врожденный герпес дебютирует на 7-14 день жизни. Время появления первых клинических признаков зависит от многих факторов: сроки гестации, срока инфицирования, сопутствующей патологии и т. д. Примерно в половине случаев врожденный герпес проявляется специфической для данной нозологии везикулярной сыпью. Мелкие пузырьки с серозным содержимым могут локализоваться на любой части тела, при этом элементы располагаются группами, образуя скопления и иногда сливаясь. Везикулы окружены кольцом гиперемии и отека, за счет чего они слегка приподнимаются над кожей. Характерно поражение слизистой оболочки глаз в виде кератитов и конъюнктивитов.
Часто содержимое кожных элементов в короткие сроки становится геморрагическим или гнойным. После вскрытия на месте пузырьков остаются эрозии, заживающие путем образования корочки. Общее состояние малыша может ухудшаться незначительно, температура повышается до субфебрильных значений. Исключение составляют случаи так называемого первичного врожденного герпеса, представляющего собой локализованную форму заболевания и проявляющегося обильной сыпью, элементы которой часто сливаются, оставляя после вскрытия обширные эрозии. Температура высокая, высыпания присутствуют не только на коже, но и на слизистых. В отсутствие своевременной терапии генерализация происходит в 50% случаев.
Церебральная форма врожденного герпеса проявляется менингеальной симптоматикой при отсутствии поражения кожи. Иногда везикулярная сыпь возникает позже, спустя примерно неделю после дебюта мозговых нарушений, но элементов сыпи в этом случае всегда немного. На первый план выходят симптомы менингита и энцефалита: нарушения сознания, эпилептиформные, тонические и тонико-клонические судороги. Симптомы неспецифичны, поэтому герпетический энцефалит легко спутать с энцефалитом любой другой природы. Значительная интоксикация ухудшает состояние, однако у новорожденных лихорадка может быть не выражена. Также присутствуют признаки отека мозга, что проявляется стволовыми нарушениями: дисфагией, расстройствами дыхания и пр.
Генерализованная форма врожденного герпеса является самой опасной. Она включает в себя и элементы сыпи, и церебральную симптоматику, описанную выше. Помимо этого, заболевание проявляется поражением внутренних органов: гепатоспленомегалией, пневмонией, специфическими изменениями в почках и надпочечниках. Явления токсикоза выражены в значительной степени. Смертность при генерализованной форме врожденного герпеса составляет более 50%, а по некоторым данным достигает 80-90% случаев, при этом половина выживших детей остаются глубокими инвалидами. Медленный регресс общемозговых и очаговых расстройств и их частая необратимость являются особенностью герпетической инфекции.
Диагностика врожденного герпеса
Выявление заболевания сопряжено для педиатра со значительными трудностями. Во-первых, если отсутствуют кожные проявления, то врожденный герпес можно заподозрить с той же вероятностью, что и многие другие патологии неонатального периода, в частности, внутриутробные инфекции, гипоксическую травму и т. д. Кроме того, часто выявление возбудителя не является доказательством герпетической инфекции, поскольку основная масса населения в мире имела контакт с данным вирусом. Тем не менее, основой диагностики является обнаружение самого вируса или его антигенов в разных средах, например, в содержимом везикул, крови, мазках из носо- и ротоглотки, цереброспинальной жидкости и др.
Метод высокоспецифичен, но занимает много времени. По этой причине проводятся серологические исследования с целью определения специфических антител класса IgM, что является подтверждением острой фазы врожденного герпеса. Подтверждение диагноза возможно также на основании обнаружения антител класса IgG, при этом решающую роль играет не сам факт их наличия, а нарастание титра в динамике не менее чем в 4 раза (при отсутствии нарастания антитела являются материнскими). В диагностике герпетического энцефалита врачи опираются именно на данные серологического исследования. Врожденный герпес также подтверждается, исходя из анамнеза матери и результатов гистологического обследования последа.
Лечение и прогноз врожденного герпеса
Проводится этиотропная терапия заболевания, от сроков ее начала во многом зависит прогноз для жизни и здоровья ребенка. Применяются противовирусные препараты, высокотропные именно к вирусу простого герпеса. Используется парентеральный путь введения. Также назначаются средства наружного действия для лечения везикулярной сыпи. Кроме того, к терапии врожденного герпеса всегда подключаются иммуноглобулины и иммуномодуляторы, проводится курс витаминотерапии. По показаниям осуществляется кислородная поддержка и ИВЛ, вводятся противосудорожные препараты, проводится дегидратация.
Прогноз неблагоприятный. Врожденный герпес часто протекает в генерализованной форме, последствия герпетического энцефалита необратимы. Выжившие дети очень редко не отстают в развитии от сверстников. Большинство из них остаются инвалидами или погибают в период разгара клинических проявлений. Даже если терапия начата своевременно, заболевание может неоднократно рецидивировать с той же симптоматикой. Для профилактики рецидивов возможно использование герпетической вакцины. В настоящее время существует несколько ее видов, но вследствие частых мутаций вируса эффективность вакцинации остается под вопросом.
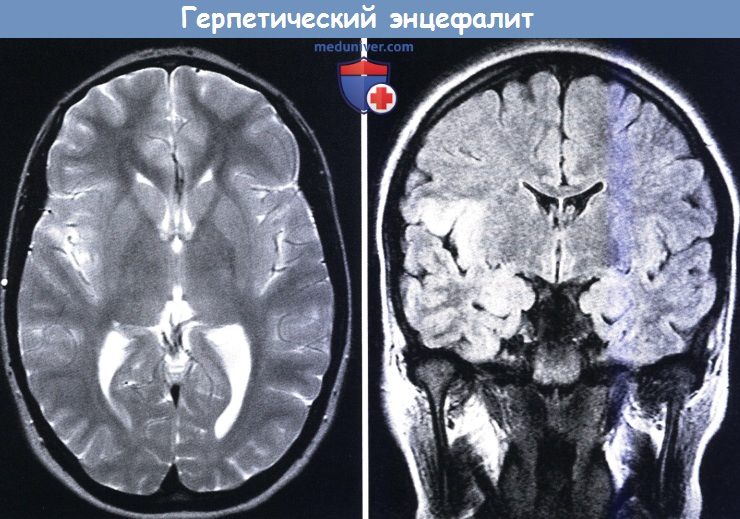
Герпетический энцефалит — это диффузное или очаговое поражение мозгового вещества, вызванное герпесвирусами ВПГ-1, ВПГ-2, Varicella Zoster. Основные симптомы болезни: фебрильная лихорадка, прогрессирующее угнетение сознания, судорожные приступы. По завершении острого периода инфекции в течение длительного времени сохраняются резидуальные неврологические нарушения. Для установления диагноза необходимо проведение ПЦР-диагностики ликвора, томографии головного мозга, электроэнцефалограммы. Лечение патологии включает противовирусные препараты, противоотечную, нейрометаболическую и противосудорожную терапию.
МКБ-10
Общие сведения
Энцефалит герпетического происхождения составляет до 15-20% всех вирусных воспалительных процессов в мозговой ткани. Симптомы встречаются с частотой 4-5 случаев на 1 млн. населения, причем до трети больных составляют дети, а еще около 20% приходится на возрастную категорию старше 60 лет. Заболевание не теряет своей актуальности в современной неврологии, поскольку для успешного исхода патологии необходимо вовремя поставить диагноз и начать лечение, а промедление в оказании медицинской помощи чревато смертью пациента.

Причины
Болезнь в 95% случаев вызывается вирусом простого герпеса 1 типа, что объясняется высокой распространенностью возбудителя. По данным ВОЗ, около 2/3 населения мира в возрасте до 50 лет инфицированы ВПГ-1. На втором месте по частоте находится Varicella Zoster Virus (VZV) — возбудитель ветряной оспы, опоясывающего герпеса. Энцефалит, вызванный ВПГ-2, встречается редко, преимущественно у иммунокомпрометированных пациентов.
Ведущим среди факторов риска служит сниженный иммунный статус. Герпетическая инфекция протекает латентно, активизируется на фоне нарушения общей резистентности организма (при переохлаждении, стрессе, менструации у женщин). В группе риска находятся люди с врожденными и приобретенными иммунодефицитами, больные, получающие лечение иммуносупрессивными препаратами. К триггерам относят реинфицирование другими штаммами герпесвирусов, сопровождающееся аутоиммунными реакциями.
Патогенез
Первичное заражение ВПГ-1, как правило, происходит в детстве при попадании вирусных частиц на слизистые оболочки, после чего возбудитель начинает размножаться, мигрирует в нервные ганглии, где длительное время находится в состоянии латентной инфекции. Заражение ВПГ-2 наблюдается после начала сексуальной жизни через слизистые половых путей, а дальнейший путь развития патогена сходен с ВПГ-1.
Симптомы болезни в большинстве случаев возникают при реактивации инфекции под действием провоцирующих факторов. Герпесвирусы проникают в головной мозг гематогенным путем либо по нервным стволам (через тройничный или обонятельный нерв). Из гассерова узла они распространяются на таламус, подкорковые ядра, кору больших полушарий. При распространении по ольфакторному тракту первой страдает лимбическая система (гиппокамп, височная кора).
Симптомы герпетического энцефалита
В типичном течении острого мозгового воспаления выделяется несколько последовательных стадий: ранняя, период разгара болезни, регресс признаков, стадия остаточных явлений. В 70% патология манифестирует с внезапно возникшей высокой лихорадки (более 39°С), сопровождающейся интенсивными головными болями в лобно-височной зоне, сильной сонливостью, рвотой, не связанной с приемом пищи.
На вторые-третьи сутки симптомы дополняются нарушениями сознания: больные начинают путаться во времени и пространстве, не узнают родственников, испытывают разнообразные галлюцинации. По мере усугубления тяжести состояния появляются фокальные или генерализованные судорожные припадки. Изредка наблюдается оперкулярный автоматизм — повторяющиеся причмокивающие или сосательные движения.
В среднем через 3 дня заболевание переходит в стадию разгара. Основное проявление — глубокое угнетение сознания вплоть до комы. Пациенты не отвечают на звуковые и тактильные раздражители, однако двигательные реакции на болевые стимулы остаются в пределах нормы. Также могут возникать симптомы декортикации или децеребрации, аритмичное дыхание, двусторонние моторные нарушения.
Если пациенту было предоставлено комплексное лечение, с 3-4 недели начинается обратное развитие симптомов герпетического энцефалита. Этот этап длится от нескольких месяцев до 1 года, характеризуется постепенным восстановлением временно утраченных неврологических функций. По окончании третьей стадии около 80% больных имеют стойкие резидуальные (остаточные) явления, которые могут сохраняться пожизненно.
Осложнения
В остром периоде прогностическим неблагоприятным является прогрессирование отека мозга, что чревато его вклинением. При височно-тенториальной форме вклинения возникает триада признаков: потеря сознания, гемипарез, анизокория. Симптомами транстенториальной формы являются отсутствие реакции зрачков на свет, фиксация глазных яблок по срединной линии, двусторонний гипертонус мышц. Зачастую нарушается работа дыхательного центра.
Патология имеет тяжелое течение, при отсутствии своевременной медицинской помощи летальность достигает 70%. Даже если проводится этиотропное лечение, смертельный исход регистрируется у 15-20% пациентов, чаще у младенцев, пожилых людей, больных из группы риска. У выздоровевших полный регресс неврологической симптоматики наблюдается только в 20% случаев, а остальные сталкиваются с резидуальными симптомами.
Наиболее опасным хроническим осложнением заболевания считается прогрессирующее вегетативное состояние (акинетический мутизм), характеризующийся необратимым разрушением высших психических функций. У больных сохранено сознание, витальные функции (дыхание, кровообращение), однако полностью отсутствует познавательная деятельность. Такие пациенты не говорят, не реагируют на внешние раздражители, требуют постоянного ухода.
К типичным последствиям герпетической формы энцефалита относится синдром Клювера-Бьюси, при котором развиваются тяжелые длительные расстройства психической и когнитивной сферы. Симптомы расстройства включают ажитированное состояние, агрессивность, патологическую гиперсексуальность. Также наблюдаются интеллектуальные нарушения, проблемы с концентрацией внимания, ослабление памяти.
Диагностика
Обследованием пациента занимаются инфекционисты, неврологи, врачи экстренной помощи и реанимационного отделения. Заподозрить энцефалит удается по острому началу, наличию фебрильной лихорадки, сочетанию общемозговых и очаговых симптомов. Для подтверждения заболевания, уточнению этиологии воспалительного процесса назначаются следующие методы исследования:
- Нейровизуализация. «Золотым стандартом» диагностики является МРТ головного мозга, чувствительность которой при выявлении очагов поражения достигает 100% на ранней стадии болезни. При недоступности этого метода либо на более поздних этапах герпетического энцефалита применяется КТ головного мозга.
- Электроэнцефалография. В острый период ЭЭГ показывает очаговые или диффузные нарушения биоэлектрической мозговой активности: высокоамплитудные дельта- и тета-волны, появление комплексов «острая‒медленная волна».
- Люмбальная пункция. Цереброспинальная жидкость имеет нормальную прозрачность, при микроскопическом исследовании обнаруживается лимфоцитарный плейоцитоз (около 100 клеток в 1 мл), повышение количества белка, снижение уровня глюкозы.
- ДНК-диагностика. Чувствительность ПЦР-исследования ликвора на герпесвирусы составляет 96-98%, а специфичность достигает 94%. Поскольку в ранний период инфекции не исключены ложноотрицательные результаты, тестирование обязательно повторяют на 4-й день заболевания.
Лечение герпетического энцефалита
Консервативная терапия
Герпетический энцефалит характеризуется быстрым нарастанием неврологического дефицита, прогрессированием общемозговых симптомов, поэтому комплексное лечение должно начинаться в максимально ранние сроки. Наилучшие шансы на полное выздоровление у пациентов, которые начали получать этиотропные препараты в первые сутки манифестации болезни. Лечение заболевания включает следующие группы медикаментов:
- Противовирусные средства. Препаратом выбора является ацикловир, вводимый внутривенно капельно при подозрении на герпетический энцефалит еще до лабораторного подтверждения диагноза. Критерий завершения терапии — отрицательный тест ПЦР ликвора.
- Интерфероны. При тяжелых формах энцефалита целесообразно сочетать иммуномодуляторы с этиотропными противовирусными медикаментами. Применяются интерфероны или индукторы интерферонов, усиливающие неспецифическую резистентность организма.
- Глюкокортикоиды. В основном назначаются для купирования мозгового отека. Также гормоны используются в случае рецидивирующей герпетической инфекции, при которой в организме развивается аутоиммунный процесс.
- Диуретики. Лекарства показаны при отеке-набухании головного мозга. Экстренная дегидратация проводится с помощью осмодиуретика маннитола или салуретика фуросемида. Также рекомендованы онкодегидратанты (альбумин), глицериновые растворы для зондового введения в желудок.
- Антиконвульсанты. Медикаменты «первой линии» для устранения судорожного синдрома — бензодиазепины. При их недостаточной эффективности лечение усиливается препаратами для наркоза, барбитуратами.
Реабилитация
Благотворное влияние на состояние ЦНС после перенесенного герпетического энцефалита оказывают витаминные комплексы (витамины группы В, аскорбиновая кислота) в сочетании с антиоксидантами. Восстановительное лечение также включает ноотропы и нейрометаболические препараты для улучшения когнитивных мозговых функций. Коррекция иммунологического статуса проводится адаптогенами, актопротекторами, неспецифическими иммуномодуляторами.
Для восполнения энергозатрат организма, стимуляции репаративных процессов показано адекватное по калорийности и витаминному составу энтеральное питание. Большое внимание уделяется физиотерапевтическим процедурам, массажу и лечебной физкультуре, направленным на улучшение двигательной функции. При наличии показаний рекомендуются занятия с логопедами, дефектологами.
Прогноз и профилактика
Несмотря на проводимое этиотропное лечение, прогноз при герпетическом энцефалите остается неблагоприятным, показатель летальности составляет 15-20%. У большинства выздоровевших сохраняется неврологический дефицит. Для предупреждения заболевания необходима рациональное лечение герпеса кожи и слизистых оболочек, своевременное консультирование больных с диссеминированной герпетической инфекцией.
2. Менингиты и энцефалиты: уч. пос. для врачей/ Д. А. Валишин, Р. Т. Мурзабаева, А. П. Мамон, М. А. Мамон, Л. В. Мурзагалеева. — 2012.
3. Герпетическое поражение нервной системы/ М.Н. Лебедюк, М.Э. Запольский, Ю.И. Горанский// Украинский журнал дерматологии, венерологии, косметологии. — 2011. — №2.
4. Герпетический энцефалит/ Т.В. Матвеева, Н.В. Токарева, Г.А. Шакирзянова// Неврология. — 2006. — №16.
Энцефалит у детей — это воспаление ткани головного мозга, вызванное инфекционными, аутоиммунными или паранеопластическими факторами. Заболевание проявляется очаговыми нарушениями, судорожным синдромом, менингеальными знаками. Неспецифические симптомы включают лихорадку, недомогание, респираторные и диспепсические расстройства. Диагностика представлена современными методами нейровизуализации (МРТ, КТ), вирусологическим и серологическим исследованием спинномозговой жидкости (СМЖ), биопсией мозговой ткани. Этиотропное лечение ацикловиром назначается при герпетическом энцефалите, в остальных случаях применяют поддерживающую терапию.
МКБ-10
Общие сведения
Среди всех инфекционных болезней у детей нейроинфекции, которые обычно проявляются энцефалитом, составляют 3-5%. Заболевание возникает у пациентов любого возраста, в современной неонатологии нередки случаи внутриутробного церебрального воспаления. Половых различий среди заболевших нет. Ситуация осложняется тем, что типичные детские инфекции, такие как ветрянка и корь, при неблагоприятных условиях дают осложнения в виде энцефалита.

Причины
Основной этиологический фактор болезни — заражение детей нейротропными вирусами (арбовирусами, энтеровирусами, герпесвирусами). У школьников среди причин энцефалита повышается удельный вес экзантематозных инфекций (краснухи, кори, ветряной оспы), что обусловлено тесным взаимодействием в коллективе и высокой контагиозностью этих возбудителей. Симптомы энцефалита могут возникать под влиянием таких факторов, как:
- Бактериальная инфекция. Мозговые поражения встречаются при сифилисе (чаще врожденном), генерализованной стрептококковой или стафилококковой инфекции, что характернее для детей с отягощенной наследственностью или сниженным иммунитетом. Энцефалиты бывают при протозойных инфекциях: малярии, токсоплазмозе.
- Вакцинация. Существует риск воспаления нервной ткани после проведения АКДС, введения антирабической вакцины. Состояние типично для детей в возрасте 3-7 лет. Оно появляется спустя 1-2 недели после прививки. В 70% случаев наблюдаются легкие формы с быстрым самостоятельным восстановлением неврологических функций.
- Опухоли. Энцефалит иногда возникает при нарушениях работы иммунной системы и образовании аутоантител на фоне злокачественных новообразований. Состояние носит название паранеопластического процесса. Помимо повреждения мозга, у больных детей отмечаются полиорганные нарушения.
Патогенез
В пораженном отделе головного мозга у детей развивается острое или подострое воспаление, которое сопровождается отечностью тканей. Под токсическим влиянием продуктов распада вирусов и биологически активных веществ повышается проницаемость капилляров, в результате чего происходят петехиальные кровоизлияния. Такие патологические изменения вызывают общемозговые симптомы энцефалита.
Вирусы обладают прямым патогенным влиянием на нейроны, они провоцируют гибель клеток или появление в цитоплазме включений, которые нарушают образование нейромедиаторов и передачу импульсов. При этом определяются очаговые симптомы повреждения, которые зависят от локализации дефекта. В редких случаях болезнь заканчивается церебральным геморрагическим некрозом.
Классификация
С учетом распространенности поражения бывают полиоэнцефалиты (воспаление серого мозгового вещество), лейкоэнцефалиты (воспаление белого вещества) и панэнцефалиты (диффузный процесс). По локализации очага выделяют полушарные, стволовые, мозжечковые и другие виды. В клинической практике чаще всего используют классификацию по этиологическому фактору, согласно которой различают 2 формы:
- Первичный. Вызван попаданием в организм ребенка нейротропных вирусов, бактерий и простейших. В таком случае болезнь начинается с воспалительного процесса в головном или спинном мозге. Сюда относят клещевой энцефалит, японский комариный энцефалит, эпидемический летаргический энцефалит.
- Вторичный. Возникает как осложнение инфекций другой локализации либо развивается в асептических условиях под действием аутоиммунных процессов. Самые распространенные варианты: коревой, гриппозный, поствакцинальный.
Симптомы энцефалита у детей
Для энцефалита типична полиморфность клинических признаков, а его начальные этапы могут протекать в стертой форме, что затрудняет диагностику церебрального воспаления в практике современной педиатрии и детской неврологии. Патология в основном манифестирует общеинфекционными проявлениями: у детей повышается температура тела, беспокоят интенсивная головная боль, ломота в мышцах и суставах.
В зависимости от происхождения болезни, в продромальном периоде энцефалитов зачастую бывают симптомы со стороны желудочно-кишечного тракта, дыхательных органов. Возможна заложенность носа и слизистые выделения, гнусавость голоса, покашливание. Среди пищеварительных признаков выделяют рвоту и диарею, что более характерно для поражения энтеровирусами.
На вовлечение в процесс мозговой ткани указывает очаговая неврологическая симптоматика: расстройства чувствительности отдельных частей тела, парезы и параличи, нарушения зрения и обоняния. При тяжелом течении патологии у детей возможен судорожный синдром. Менингеальные знаки выражены незначительно, они присоединяются в случаях вовлечения в процесс мозговых оболочек с развитием менингоэнцефалита.
Осложнения
При обширных церебральных поражениях у ребенка есть риск возникновения эпилептического статуса, который сопровождается непрекращающимися судорожными припадками и потерей сознания. Тяжелые энцефалиты иногда вызывают угнетение сознания вплоть до глубокой комы. Среди отдаленных последствий заболевания называют стойкий неврологический дефицит (до 32% от всех случаев патологии), обусловленный необратимым повреждением участка нервной ткани.
Диагностика
При первичном обследовании детский невролог обращает внимание на общее состояние ребенка, наличие общемозговых и очаговых проявлений. При физикальном осмотре оценивают деятельность сердечно-сосудистой и дыхательной системы, проверяют рефлексы, мышечный тонус и когнитивные функций. Симптомы не позволяют поставить окончательный диагноз, поэтому проводятся инструментальные и лабораторные методики:
- МРТ головного мозга. Самый чувствительный метод для выявления воспаления на ранней стадии. О наличии патологии свидетельствует отечность отдельных областей мозговой коры, небольшие участки демиелинизации, изменения в зоне базальных ядер и таламуса.
- КТ головного мозга. Менее информативный способ нейровизуализации, который рекомендуется при отсутствии оборудования для МРТ. Компьютерную томографию полезно делать детям перед люмбальной пункцией, чтобы исключить противопоказания к ней (мозговой отек, гидроцефалию, опухоли).
- Биопсия головного мозга. Инвазивный метод диагностики применяется у детей в осложненных случаях, когда врачи не могут установить этиологию энцефалита либо при неэффективности стандартной интенсивной терапии. Биопсия производится целенаправленно после определения очага поражения на МРТ или КТ.
- Исследование СМЖ. Микроскопический, бактериологический и вирусологический анализы выполняются, чтобы найти причину развития энцефалита. Для точной диагностики герпесвирусов и энтеровирусов показано ПЦР-исследование ликвора. Серологические реакции СМЖ используются для оценки динамики болезни.
Лечение энцефалита у детей
Консервативная терапия
При любой форме энцефалита назначается патогенетическое лечение, которое направлено на стабилизацию витальных функций и активизацию собственных защитных сил организма ребенка. На первом месте стоит коррекция обезвоживания и электролитных нарушений, борьба с отеком мозга, десенсибилизирующая терапия. В случае высокой лихорадки используются антипиретики и физические методы охлаждения.
Важно место в лечении занимает устранение гипоксии, для чего ребенку проводят оксигенотерапию с повышенным содержанием кислорода в смеси, по показаниям выполняют интубацию и ИВЛ. Внутривенно вводят антиоксиданты, которые нейтрализуют свободные радикалы и продукты анаэробного распада молекул. В целях коррекции иммунитета рекомендованы рекомбинантные интерфероны, другие иммуностимуляторы.
Этиотропная терапия энцефалита возможна только при инфицировании герпесвирусами. Поскольку симптомы этого вида заболевания неспецифичны, введение препаратов группы ацикловира практикуют всем детям до установления этиологического фактора. Если подтверждено заражение вирусами герпеса лечение продолжают минимум 14 дней в возрастных дозировках.
Реабилитация
После ликвидации острых инфекционных проявлений ребенку необходимо длительное поддерживающее лечение, чтобы устранить остаточные симптомы. Из медикаментов назначают нейрометаболические препараты, миорелаксанты, лекарства на основе леводопы. Восстановить двигательную активность помогает лечебная физкультура, массаж, механотерапия. Для коррекции когнитивных нарушений требуется помощь логопеда, психолога.
Прогноз и профилактика
Восстановление после перенесенного энцефалита занимает длительное время, но при правильном подборе лечения и реабилитации у большинства детей симптомы полностью исчезают. Стойкие нарушения двигательной функции или органов чувств бывают после тяжелых форм заболевания. С целью профилактики энцефалитов необходимо своевременно выявлять и лечить детские инфекционные заболевания, проводить иммунизацию против клещевого энцефалита в эпидемически неблагоприятных регионах.
2. Клещевой энцефалит у детей: диагностика, лечение профилактика/ Н.В. Скрипченко// Инфекционные болезни. — 2010.
3. Вирусные энцефалиты у детей: прогнозирование исходов/ Н.В. Скрипченко, М.В. Савина, В.Н. Команцев, Г.П. Иванова // Детские инфекции. — 2009.
Герпетический энцефалит у ребенка - причины, клиника, диагностика, лечение
Первичные энцефалиты характеризуются наличием вирусов и их репликацией в клетках-мишенях в ЦНС. Хотя большое число вирусов может индуцировать первичный энцефалит, в Западной Европе одним из наиболее распространенных возбудителей является вирус простого герпеса. Энтеровирусы также могут стать причиной первичного энцефалита. Однако в других странах, включая Северную Америку, важнейшим этиологическим фактором являются арбовирусы.
Не менее 90% случаев связаны с вирусом простого герпеса 1 типа, хотя и ВПГ-2 является широко распространенным возбудителем диссеминированной инфекции и энцефалитов новорожденных (Kennedy и Chaudhuri, 2002). До появления ацикловира смертность от герпетического энцефалита составляла более 70% и менее 3% пациентов выживали без тяжелых последствий. В западных странах заболевание среди всех возрастных групп встречается от 1 на 200000 до 1 на 400000 населения в год, что составляет около 10% всех тяжелых вирусных инфекций ЦНС.
31% случаев относятся к возрасту до 20 лет, из них 12% среди детей от 6 месяцев до 10 лет (Whitley et al., 1982b; Whitley и Kimberlin, 2005).
Первоначально большинство случаев герпетического энцефалита приписывали реактивации латентной вирусной инфекции, но геномный анализ вирусных штаммов от пациентов показал, что случаи энцефалита вызываются путем первичной инфекции, реактивации латентной инфекции и реинфекции новыми штаммами (Whitley и Alford, 1982). Первичное инфицирование у новорожденных и детей раннего возраста встречается в норме.
Герпетический энцефалит крайне цитопатический, патоморфологически характеризующийся некротическими поражениями, которые чаще всего имеют геморрагический характер с обширными участками размягчения и, в тяжелых случаях, с полной утратой нейрональных и глиальных элементов. Повреждение преобладает в орбитальной, средней височной, поясной и островковой коре и в некоторых случаях может распространяться на ствол мозга (Duarte et al., 1994). У перинатально инфицированных новорожденных повреждение обычно распространяется по всему мозгу. Внутриядерные эозинофильные включения (тельца Каудри типа А) можно обнаружить в нейронах, олигодендроцитах и астроцитах, а вирус может быть выделен из ткани и СМЖ.
Клиническим симптомам энцефалита в 60% случаев предшествуют продромальные явления, которые могут быть чисто системными, такими как лихорадка и недомогание, но встречаются и более специфичные при наличии очевидных расстройств памяти и поведения. Продромальная фаза обычно длится несколько дней с усилением симптомов угнетения сознания, патологического поведения и высокой лихорадки. Наиболее полная картина включает симптомы, обычные для всех случаев энцефалита, т.е. вялость, оглушенность или кома и судорожные припадки.
Судороги особенно часто встречаются и повторяются в случаях герпетической инфекции и почти всегда бывают очаговыми, особенно поражая лицо и верхнюю конечность, отражая грубую асимметрию повреждений, что несомненно является патологическим. Может также встречаться эпилептический статус фокальных судорог. ВЧД зачастую повышено, и отек зрительного сосочка представлен у 15% пациентов. Часто становятся заметны гемиплегия и афазия, нередко они являются первой находкой у более старших детей и подростков. Могут проявляться изменения, указывающие на очаговый некроз височнобазальных структур, такие как аносмия, обонятельные галлюцинации и расстройства поведения (Whitley et al., 1981).
Во многих случаях, однако, клинические особенности не специфичны, но ВПГ-инфекцию всегда необходимо иметь в виду из-за ее распространенности, потенциальной тяжести последствий и в связи с возможностью излечения (Rose et al., 1992). У новорожденных и детей раннего возраста фебрильные судороги, обычно частичные, часто являются доминирующим симптомом и могут оставаться обособленными в течение нескольких дней. Такие случаи могут представлять особенно сложную диагностическую проблему. Puchhammer-Stockl et al. (1993) сообщали о пяти случаях, представленных как «осложненные фебрильные судороги», в обследовании пациентов (n=151) с энцефалитом, вызванным ВПГ по данным ПЦР диагностики. У трех из них в ликворе не было цитоза и только у одного были подтверждающие признаки на МРТ.
С момента появления более чувствительного метода ПЦР для диагностики герпесных энцефалитов спектр заболеваний ЦНС, вызываемых этим вирусом у взрослых и детей, расширился за счет включения более легких и атипичных форм (Dennett et al., 1996). Общепризнано, что заболевание у пациентов с иммуносупрессией протекает длительнее (Kleinschmidt-DeMasters и Gilden, 2001).
В отличие от диффузных медленных волн на ЭЭГ при других менингитах, запись при ВПГ обычно очень асимметрична, и часто выявляется четкий очаг спайков при патологически замещенной фоновой активности. Низкая амплитуда в одной или многих областях, особенно над височной долей, не является необычной. В этих же областях часто имеются периодические комплексы через 1-3 секунды, но обычно они имеют транзиторный характер (Mizrahi и Tharp, 1982). Периодические комплексы возникают чаще всего между 2-15 сутками болезни и реже выявляются в более поздние сроки (Schauseil-Zipf et al., 1982). Они не специфичны, но могут встречаться при энцефалите, вызванном М. pneumoniae (Hulihan et al., 1992) или вирусом Эпштейна-Барр.
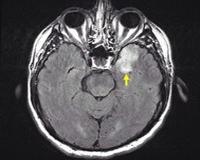
FLAIR (слева) и Т2-взвешенное (справа) МРТ:
гиперинтенсивные зоны в правой островковой коре и задне-базальной части лобной доли как вторичные проявления герпетического энцефалита.
Сканирование мозга может дать нормальные показатели в первые 24-48 часов после начала заболевания, а изменения на МРТ визуализируются до изменений на КТ (Kapur et al., 1994). На МРТ можно увидеть очаговый отек в средних отделах височной и орбитальной поверхности лобных долей, коры островка и угловой извилины. Патологическая КТ обычно показывает сниженное затухание в одной или обеих лобных или височных долях и иногда участки гиперэхогенности, представляющие небольшие кровоизлияния, в более чем 50% случаев также может быть смещение срединных структур (Greenberg et al., 1981; Dutt и Johnston, 1982).
В ходе течения болезни может наблюдаться начальное распространение поражения (Koskiniemi и Ketonen, 1981). Позже постепенно появляется и остается атрофия паренхимы с отчетливым преобладанием в перисильвиевой и височной области, иногда развивается кальцификация. Полное исчезновение патологических изменений на КТ у детей отмечается редко, но бывает у взрослых.
Ликвор может быть нормальным у 20-25% пациентов. В большинстве случаев он находится под повышенным давлением и содержит избыточное количество клеток, обычно лимфоцитов, и менее, чем 50 мононуклеаров/мм 3 приблизительно в четверти случаев (Whitley et al., 1982b). СМЖ часто геморрагическая или ксантохромная из-за некротического и геморрагического характера поражений.
Диагностика герпетического энцефалита основана на ПЦР амплификации ДНК вируса простого герпеса из ликвора. Этот метод высоко чувствительный (>95%) и специфичный (>95%), но могут встречаться ложноотрицательные результаты ПЦР в образцах, взятых рано, в течение первых 24-48 часов или позднее, через 10-14 дней и у пациентов, получавших лечение ацикловиром (Lakeman и Whitley, 1995; Koskiniemi et al., 1996; Davis, 2000). Количественное соотношение ДНК-копий вируса в миллилитре ликворной жидкости и степени повреждения ЦНС до сих пор не изучалось (Tyler, 2004). При отрицательном результате ПЦР наличие четырехкратного увеличения титра антител против ВПГ-1 инфекции в СМЖ является значимым, но требуется не менее 10-14 дней для их появления (Koskiniemi et al., 1984).
Изначально антитела принадлежат к классу IgM, позднее сменяющимся типом IgG. Они связаны с наличием олигоклонального белка в СМЖ (Mathiesen et al., 1988). Антитела и олигоклональные структуры могут персистировать годами, после приступа герпетического энцефалита (Tardieu и Lapresle, 1980), отражая сохранение ВПГ в ЦНС.
При наличии анамнестических, клинических и/или полученных при визуализации признаков герпетического энцефалита лечение должно быть начато немедленно. Биопсия мозга показана только в исключительных случаях детям, у которых после сканирования мозга предполагается другой диагноз, требующий иного лечения, а не для подтверждения диагноза ВПГ. Такие диагнозы могут включать абсцессы мозга, опухоли или гранулематозный менингит (Whitley et al, 1989). Другие состояния, имитирующие герпетический энцефалит, такие как паранеопластический лимбический энцефалит или митохондриальная энцефаломиопатия с лактоцизом и инсультоподобные эпизоды (MELAS) (Johns et al., 1993), у детей встречаются редко.
Лечение герпетического энцефалита проводится аналогом нуклеозидов — ацикловиром, который ингибирует ДНК-полимеразу ВПГ и таким образом, вирусную репликацию (Skoldenberg et al., 1984; Whitley et al, 1986). Ацикловир фосфорилируется в активную форму с помощью вирусной тимидин-киназы в ВПГ инфицированных клетках и поэтому нетоксичен для здоровых клеток хозяина. В оригинальном рандомизированном контролируемом исследовании Skoldenberg et al., смертность среди взрослых с лечением ацикловиром составила 19% в отличие от 70% смертельных исходов без лечения, существенные последствия встречались в 14%, а 56% пациентов были выписаны с полным выздоровлением.
Даже при начале лечения вскоре после начала заболевания почти у двух третей выживших сохраняются остаточные неврологические расстройства, а у детей в возрасте менее 12-18 месяцев наблюдались наиболее неблагоприятные прогнозы по показателям заболеваемости и смертности (Whitley и Kimberlin, 2005). Среди последствий выделяют гемиплегию (Rautonen et al., 1991), билатеральный оперкулярный синдром (van der Poel et al., 1995) и тяжелую эпилепсию, которая у новорожденных может проявляться в виде инфантильных спазмов. Часто наблюдаются изменения в поведении. Обычно имеется афазия из-за частых поражений височной локализации, которая может быть глобальной или более специализированной.
Резистентные штаммы ВПГ у детей встречаются редко; они более распространены у пациентов с ослабленным иммунитетом, которых часто лечили ацикловиром и в таких случаях может потребоваться использование других противовирусных средств, таких как фоскарнет или цидофовир (Whitley, 2002). Применение кортикостероидов совместно с противовирусными препаратами оправдано для устранения отека, но в связи с сопутствующим риском снижения реакции хозяина их использование не рекомендуется (Wood et al., 1994).
Как и у взрослых, лечебная дозировка ацикловира у детей составляет 10 мг/кг (или 500 мг/м 2 ) внутривенно каждые 8 часов (доза в мг/м 2 несколько превышает общую суточную дозу при дозировании в мг/кг). Внутривенное введение препарата рекомендовано для поддержания адекватной дозы, проникающей в ЦНС. В целом дети очень хорошо переносят ацикловир, хотя при высоких дозах при отсутствии достаточной дегидратации возможна нефротоксичность. В подтвержденных случаях курс терапии проводится 21 день; более короткие курсы лечения были связаны с повышенным риском рецидивов. Дети раннего возраста и новорожденные, по всей видимости, более подвержены риску или рецидиву (Davis, 2000; Ito et al„ 2000; Love et al., 2004; Valencia et al., 2004).
Хотя в некоторых случаях рецидив обусловлен возвратом вируса в ЦНС, другим этиологическим фактором может быть иммуноопосредованный механизм, связанный со вторичной демиелинизацией (Barthez et al., 1987; Pike et al, 1991; Rautonen et al., 1991; De Tiege et al., 2003, 2005). Рецидив у детей может быть связан с хореоатетоидным синдромом, который имеет плохой прогноз (Barthez et al, 1987; Shanks et al., 1991; Wang et al., 1994; Valencia et al., 2004). Рецидив также может быть связан с отсутствием выработки антител против ВПГ в ликворе (De Tiege et al., 2006).
У новорожденных более высокая доза ацикловира (20 мг/кг внутривенно каждые 8 часов до 21 дня) увеличила эффективность по показателям смертности и заболеваемости (Kimberlin et al., 2001). Увеличение дозы сопровождалось легкой нейтропенией у большинства пациентов, но при более тяжелой форме проводили поддержку колониестимулирующим фактором гранулоцитов. В связи с более обширным и диффузным поражением ЦНС и незрелым иммунным ответом у новорожденных, рекомендуется повторить исследование СМЖ методом ПЦР после лечения для подтверждения очистки от вирусов (Kimberlin, 2004). Кроме того, постоянная профилактика высокими дозами перорального ацикловира в первые 1-2 года жизни рекомендуется для снижения риска реактивации вируса и дальнейшего поражения ЦНС (Tiffany et al., 2005). Спорным остается вопрос о необходимости профилактики младенцам и детям после неонатального периода.
Обычная клиническая дилемма возникает при отрицательном результате ПЦР ликвора в случае начатого лечения пациента с фебрильным энцефалитом. Можно ли остановить начатое лечение ацикловиром, особенно с учетом того, что трехнедельное внутривенное введение препарата весьма обременительно для маленьких детей? Если не было выявлено иного диагноза, наш прагматичный подход при таких обстоятельствах допускает раннее прекращение лечения ацикловиром только в тех случаях, если клинически состояние ребенка возвращается к нормальному, данные ЭЭГ в пределах нормы, и УЗ-сканирование мозга хотя бы 5-7 дней не выявляет патологии. Но при выявлении очаговых патологических изменений при УЗ-сканировании или ЭЭГ необходимо провести полный курс (21 день).
Другие герпесвирусные энцефалиты. Они менее распространены и чаще всего связаны с иными механизмами, чем прямое внедрение.
• Вирус ветряной оспы. Первичное инфицирование ВОГ (ветряной оспы) может вызвать как постинфекционный энцефалит, обычно мозжечковый энцефалит, так и первичный энцефалит, чаще с более размытым проявлением, возникающим в первые пять дней вместе с высыпанием новых везикулярных элементов. Сообщалось о нескольких случаях раннего преэруп-тивного начала энцефалита (Maguire и Meissner, 1985). Манифестация патологии ЦНС, вызванной ВОГ, также встречается при повторной инфекции ветряной оспы или даже без каких-либо кожных поражений, что более характерно для взрослых или для пациентов с ослабленным иммунитетом (Koskiniemi et al., 2002). Количественный анализ ДНК ВОГ в ликворе показывает повышенные уровни у пациентов с более тяжелым течением заболевания (Aberle et al., 2005). Ветряная оспа может вызывать и синдром Рейе.
Ветряночный церебеллит обычно имеет легкое течение, проявляясь острой атаксией у детей с недавней перенесенной инфекцией в анамнезе и в большинстве случаев с полным выздоровлением через несколько недель. В одном из небольших исследований у некоторых детей с таким постинфекционным состоянием были выявлены высокие титры аутотоантител, реагирующих на ткань мозга или мозжечка (Adams et al., 2000). Лечение ацикловиром (500 мг/м 2 /дозу через каждые 8 часов) может быть эффективным против острого энцефалита, но не требуется при постинфекционном церебеллите.
• Герпесвирусы человека 6 и 7 типов. Первичная инфекция ВГЧ 6 типа чаще всего протекает бессимптомно, но может быть связана с детским инфекционным синдромом, называемым «внезапная экзантема» или «roseola infantum» (Asano et al., 1992, 1994). Первичное инфицирование также связано с фебрильными судорогами, сопровождавшимися сероконверсией, по крайней мере, в трети случаев по данным крупного эпидемиологического исследования в США (Hall et al., 1994). Настоящее происхождение первичного заражения ВГЧ 7 типа до сих пор не очень понятно, но с этим вирусом связывают также внезапную сыпь и воздействие на ЦНС (Ward, 2005). Проспективное исследование детей в возрасте до трех лет с фебрильным энцефалитом в Великобритании показало, что у 17% детей имеется первичное инфицирование либо ВГЧ-6, либо ВГЧ-7, и у двух обнаружено первичное заражение обоими типами вируса (Ward et al., 2005).
Диагноз энцефалита, вызванного ВГЧ-6/7, основывается на выделении вируса из ликвора и/или сероконверсии в крови. Эти вирусы имеют отношение также к энцефалитам у у детей с ослабленным иммунитетом.
• Вирус Эпштейна-Барр. Большинство случаев инфицирования ВЭБ на раннем этапе жизни бессимптомно; позднее могут развиваться симптомы инфекционного мононуклеоза. Неврологические проявления инфекции В-клеточным лимфотропным вирусом герпеса встречаются редко, но первичное инфицирование может быть связано с энцефалитическими поражениями (Domachowske et al., 1996; Hung et al., 2000). Другие неврологические проявления включают острый паркинсонизм с последующим полным выздоровлением (Hsieh et al., 2002); энцефалит ствола мозга, имитирующий опухоль (Angelini et al., 2000); и постинфекционные энцефалитные синдромы (Weinberg et al., 2002). Реактивация латентной инфекции ВЭБ также может проявляться в виде неврологического заболевания, и в одном из исследований наблюдалась связь с продолжительными последствиями, включающими гиппокампальный склероз (Hausler et al., 2002).
ДНК вируса может быть амплифицирована из СМЖ в течение острого энцефалита, хотя более высокие уровни ДНК ВЭБ обнаруживаются у пациентов с иммунодефицитом с вызываемой ВЭБ лимфомой ЦНС (Weinberg et al., 2002).
• Цитомегаловирус. Инфицирование плода ЦМВ может привести к тяжелому повреждению ЦНС, тогда как первичная инфекция в детском возрасте обычно имеет бессимптомное течение, хотя в редких случаях возможно заболевание, подобное инфекционному мононуклеозу. Как и при всех других герпесвирусах, первичная инфекция может быть представлена в виде латентной с последующей реактивацией. Она также обычно бессимптомная, исключая хозяев с ослабленным иммунитетом, у которых могут развиваться симптомы сочетанных заболеваний.
Читайте также:

