Фибробласты кожи что это такое
Обновлено: 26.04.2024
Рассказываем о механике формирования рубцовой ткани, приводим типологию рубцов и описываем оптимальные методы коррекции каждого из них.
Введение
Нет ни одного человека на Земле, не знающего, что такое шрамы. Начиная с детского возраста, с момента нашего знакомства с внешним миром, открытия новых горизонтов и начала физической активности, неизбежны травмы, которые так или иначе ведут к рубцеванию. Этот процесс обеспечивает быстрое и качественное закрытие дефектов, препятствуя нарушению функции органа, распространению воспаления и присоединения инфекции.
За миллионы лет эволюции природа обеспечила нас эффективными механизмами заживления ран, однако не всегда для нас они приемлемы, учитывая частую эстетическую значимость объекта. Иногда и вовсе они принимают патологическую сторону, приводя к гиперкоррекции дефекта, вызывая неприятные ощущения, нарушение работы различных структур.
Механика возникновения и анатомия
Согласно определению, «рубец» (cicatrix) — это соединительная ткань, возникшая вследствие регенерации тканей после повреждения или воспаления. При повреждениях кожи восстановление происходит за счёт наиболее активного — базального — слоя эпидермиса. Сохранившиеся вблизи дефекта кератиноциты, через нейрогуморальные механизмы получив информацию о повреждении, начинают активно делиться и устремляются на дно раны, наползают с краёв, создавая сначала монослой клеток, а затем и многослойный пласт, под которым идёт завершение процесса репарации кожного дефекта и восстановление кожи.
При поражении кожи на данной глубине, под воздействием солнечного излучения, возможно появление гиперпигментаций. Особенно это касается кожи III и IV фототипов по Фитцпатрику. Возникающая при поражении петель капилляров воспалительная реакция, приводит к стимуляции тучных клеток, выделению большого количества биологически активных молекул, медиаторов воспаления, гистамина, стимулирующих синтетическую активность меланоцитов. В них образуется большее количество меланина, который передаётся кератиноцитам и вызывает очаговую посттравматическую гиперпигментацию.
При отягощающих обстоятельствах (присоединение инфекции, снижении иммунитета и др.) происходит углубление кожного дефекта ниже базальной мембраны, где располагаются меланоциты. В этих случаях после заживления дефекта на его месте может остаться депигментированное пятно или атрофичная кожа, а при полном отсутствии базальных кератиноцитов на базальной мембране — рубец.
Также депигментация кожи возможна: при I и II фототипах, химических травмах, наличии в анамнезе витилиго, дефиците микроэлементов (меди, железа, цинка, селена, тирозина и др.). Травмы кожи ниже гребешков эпидермиса на границе сосочкового и сетчатого слоёв дермы практически всегда заканчиваются рубцеванием.
В том случае, если на месте раны много придатков кожи с сохранившимися эпителиальными клетками, реактивность организма высокая, хорошее кровоснабжение, травма может заканчиваться без образования выраженных рубцов, но кожа при этом может быть тонкой, атрофированной, с депигментированными участками.
В случае вторичной инфекции, наличия сопутствующих отягощающих факторов, снижающих реактивность организма, возможно затяжное воспаление с неадекватной воспалительной реакцией, расширением и углублением площади деструкции и появлением гипертрофических и келоидных рубцов.
Рубцовая ткань — это «заплатка» из волокон коллагена, которая отличается от окружающей кожи: она менее эластична, более подвержена ультрафиолетовому излучению, в ней не восстанавливаются потовые, сальные железы и волосяные фолликулы.
Продукция коллагена — один из наиболее важных процессов в ранозаживлении, так как именно коллагеновыми волокнами замещается глубокий раневой дефект.
Синтез коллагена зависит не только от функциональной активности фибробластов, но и от биохимических процессов в ране, микроэлементного состава. Межклеточное вещество также выполняет не последнюю роль, так как обеспечивает межклеточное взаимодействие. Это своеобразный «суп», в котором «варятся» вышеуказанные ингредиенты, обеспечивая репаративные процессы.
Основным компонентом межклеточного матрикса является гликопротеид фибронектин. Фибробласты и макрофаги раны активно секретируют фибронектин для ускорения контракции раны и восстановления базальной мембраны.
Типы рубцов и методы их коррекции
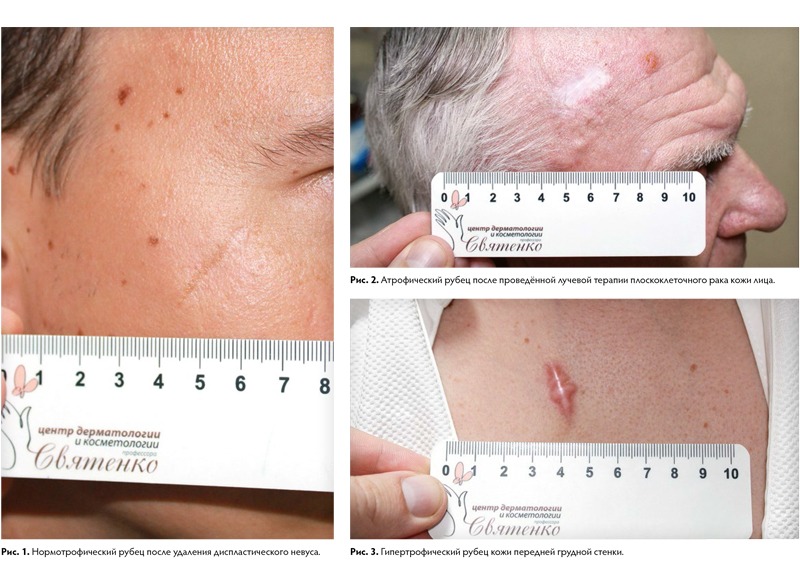
По объёму образования тканей выделяют три формы нормального рубца: атрофический, нормотрофический и гипертрофический.
Атрофические — это рубцы, объём которых снижен по сравнению с окружающими тканями. Они тонкие, имеют молочно-белый или бледно-розовый окрас, часто на их поверхности находятся множественные телеангиэктатические сосуды, субъективных ощущений не вызывают. Учитывая особенность строения кожи, наиболее частые локализации для их возникновения — это кожа спины, передней грудной и брюшной стенок. Также атрофические рубцы возникают после перенесённой ветряной оспы, в местах везикулёзных высыпаний, вследствие их расчесывания, при пустулёзных высыпаниях угревой болезни (постакне), после проведения лучевой терапии при раке коже.
Для лечения данного вида рубцов могут быть использованы:
- биоревитализанты — с целью волюмизации,
- методы светолечения, включая Nd: Yag-лазер, IPL — для коагуляции сосудов на поверхности,
При формировании рубца молекулы клеточного фибронектина связываются друг с другом с помощью дисульфидных связей и вместе с коллагеном, эластином, гликозамингликанами заполняют межклеточный матрикс.
- различные методики дермабразии, при больших площадях поражения возможно применение методик пластической хирургии.
Нормотрофические — рубцы, которые не изменяют рельеф кожи, белесоватого цвета, со сниженной чувствительностью и нормальной эластичностью. В большинстве случаев они не требуют лечения. Возможно применение:
- различных вариантов дермабразии (механическая, лазерная),
- химических пилингов (TCL, миндальный, Джесснера) для оптимизации текстуры рубца, границы перехода на здоровую кожу.
Для каждого вида рубцов характерны особенности локализации, причины формирования. Несмотря на отсутствие патологических изменений, они могут вызывать эстетические дефекты, доставлять беспокойство пациенту. Для каждого вида рубцов также существуют оптимальные методы коррекции.
Гипертрофическим рубец будет вследствие избытка продукции коллагена, однако при увеличенном объёме площадь такого рубца не будет превосходить площадь зоны повреждения. Гипертрофические рубцы могут иметь тенденцию к регрессии, как ранняя стадия формирования нормотрофического рубца, так и являться пограничным состоянием, если речь идёт о длительном временном периоде (более 6‑ти месяцев).
Чаще всего гипертрофические рубцы формируются на коже туловища, при массивных повреждениях. Инфицирование раны, трение, повторная травма в месте рубцевания могут провоцировать гипертрофию рубца.
С целью профилактики гипертрофии применяют силикон, который обеспечивает реполяризацию заряда на поверхности нитей коллагена, обеспечивая структурную организацию рубца. Также силикон препятствует испарению эндогенной воды с поверхности, улучшая трофику.
Основным методом лечения гипертофического рубца является внутрирубцовое введение депонированных кортикостероидов. Препаратом выбора в данном случае является триамцинолона ацетонид. Инъекции выполняются с интервалом в 4 – 5 недель, курс лечения, как правило, составляет 1 – 6 введений.
При возникновении контрактур, усиленного натяжения тканей рубца используют протеолитические ферменты.
Также для коррекции объёма рубца хорошо себя зарекомендовал эрбиевый лазер.
Последнее время для лечения различных рубцовых процессов активно используется инъекционная карбокситерапия: конкурентное замещение кислорода в нестабильной молекуле оксигемоглобина на углекислый газ. Процесс приводит к образованию стойкой молекулы карбоксигемоглобина и высвобождению кислорода, что положительно сказывается на трофике тканей, снижает показатель pH, стабилизирует мембраны клеток, препятствует активации воспалительных цитокинов.
Существуют также виды патологических рубцов: истинные и ложные келоидные рубцы. Келоидный рубец — опухолевидное разрастание грубой волокнистой соединительной ткани кожи. Развитие келоидов связывают с мутацией коллагена 7‑го типа и атипичной активностью фибробластов.
Для келоидных рубцов характерен быстрый, импульсный, безудержный рост, выходящий за пределы имеющегося повреждения и не зависящий от степени повреждения. Рост наблюдается в ранний период рубцевания и стабилизируется, как правило, к 3 – 6‑му месяцу от момента начала формирования. Для истинных келоидов характерно появление на неизменённой коже, без инициирующей травмы или воспалительного процесса. Излюбленной локализацией для возникновения у европеоидной расы является лицо, ушные раковины, область верхней половины туловища. Для лиц монголоидной и негроидной рас прослеживается тенденция их формирования на коже конечностей.
Ткань келоидных рубцов содержит незначительное количество капиллярных сосудов, тучных и плазматических клеток. Такие рубцы зачастую вызывают жалобы на зуд, жжение, покалывание, различные болевые ощущения, что и служит поводом для обращения к врачу.
Наряду с инъекциями депонированных кортикостероидов для лечения келоидных рубцов используют:
- внутриочаговую криодеструкцию,
- лучевую терапию (близкофокусная рентгенотерапия),
- иммунотерапию (имиквимод, интерферонотерапия, пиротерапия),
- инъекции цитостатиков (5‑фторурацил, блеомицин).
Учитывая крайне агрессивное течение, применение хирургических методик в монорежиме не оправдано и ведёт к рецидивам до 100 % случаев.
Заключение
В этой статье поговорим о функции дермальных фибробластов в коже, процессе их старения, а также о методе обновления и стимуляции регенерации кожи путём введения аутологичных фибробластов.
Введение
Роль дермальных фибробластов (ДФ) в обновлении кожи трудно переоценить, поскольку они являются основным клеточным компонентом соединительнотканной основы кожи, обеспечивающим её гомеостаз и морфофункциональную организацию. Очевидна актуальность этой темы для регенеративной (репаративной) косметологии, задача которой — омоложение кожи путём активации естественных процессов её восстановления.
Функции дермальных фибробластов
Из всех функций ДФ наибольшее внимание специалистов в области эстетической медицины и дерматологии сосредоточено на продуцировании этими клетками компонентов внеклеточного матрикса (ВКМ) дермы: коллагена, эластина, протеогликанов, особенно гиалуроновой кислоты (ГК), и структурных гликопротеинов.
Повышенный интерес именно к этой функции ДФ понятен: названные компоненты ВКМ формируют и поддерживают структуру кожи, обеспечивая её упругость и прочность. Причём ДФ не только синтезируют эти вещества, но и обеспечивают их катаболизм путём прямого фагоцитоза «отработанных» фрагментов фибрилл коллагена и эластина, секреции коллагеназы, гиалуронидазы и прочих ферментов.
Резидентные клетки ткани — образующиеся и постоянно пребывающие в этой ткани.
Другая, и не менее значимая для кожи, активность ДФ оставалась до недавнего времени несколько на обочине поля зрения врачей-практиков, однако сегодня она тоже становится объектом пристального внимания клиницистов. Речь идёт о целом ряде важнейших функций фибробластов. Так, продуцируя коллаген IV типа и ламинин, они влияют на формирование базальной мембраны. Фибробласты формируют строму, которая не только служит каркасом (опорой) для эпителия, но и регулирует структурную организацию и функционирование эпителиальных клеток. Они вырабатывают и выделяют факторы клеточного роста (KGF-1 — фактор роста кератиноцитов, GM–CSF — гранулоцитарно-макрафагальный колониестимулирующий фактор роста), иммунорегуляторные интерлейкины IL-6, IL-8. За счёт секреции факторов роста и интерлейкинов и непосредственного взаимодействия с эпителиальными клетками ДФ играют ключевую роль в регуляции эпидермального морфогенеза. Их паракринная активность служит основой для поддержания гомеостаза стволовых кератиноцитов.
Дермальные фибробласты секретируют факторы, влияющие на дифференцировку лимфоцитов, и факторы, регулирующие численность, миграцию и функции гранулоцитов и макрофагов, обеспечивая тем самым поддержание иммунитета кожи. Вырабатывая множество проангиогенных факторов, которые индуцируют дифференцировку и миграцию эндотелиальных клеток, ДФ способствуют образованию и стабилизации сосудов.
Они принимают участие в процессах нейроэндокринной регуляции кожи. Синтезируют биологически активные пептиды: гормоны, биогенные амины, нейропептиды и нейротрансмиттеры, идентичные таковым в центральной нервной и эндокринной системах, экспрессируют рецепторы андрогенов и эстрогенов, посредством которых осуществляется влияние этих гормонов на кожу человека.
Фибробласты, взаимодействуя с различными резидентными клетками: эпидермальными, эндотелиальными, нервными, жировыми, гемопоэтическими, участвуют практически во всех кожных процессах, в том числе — физиопатологических. Таким образом, ДФ представляют собой центральное звено в биологии кожи: они поддерживают не только гомеостаз ВКМ дермы, обеспечивая её ремоделирование и обновление, но и физиологическое состояние других слоёв и структур кожи.
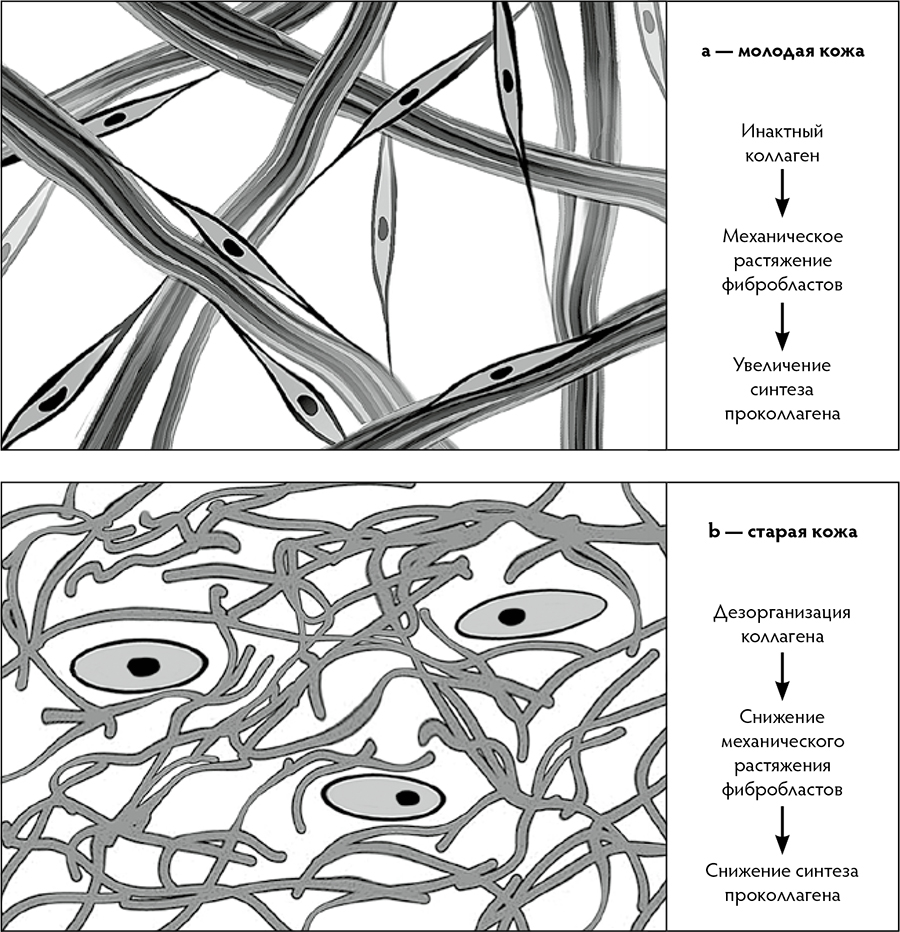
Рис. 1. Взаиморасположение фибробластов и коллагеновых волокон: a — в коже молодых людей (18–29 лет); b — в коже людей старшего возраста (старше 80 лет) (Varani J., et al. 2006, с изм.)
Инволюция дермальных фибробластов
По мере старения организма растёт число ДФ, в которых происходят возрастзависимые изменения, связанные преимущественно с непрерывным накоплением повреждений. Такие ДФ обозначают как «стареющие», или сенесцентные фибробласты (ДФст). Снижается их способность к ремоделированию и организации ВКМ, так как уменьшается синтез и секреция ими основных компонентов ВКМ. Нарушается эпидермальный гомеостаз из‑за негативных изменений в паракринных механизмах, связывающих эпидермис и папиллярный слой дермы. В популяции ДФст происходит увеличение секреции богатого цистеином ангиогенного индуктора — белка 61 (CYR61, или CCN1), стимулирующего продукцию провоспалительных цитокинов и матриксных металлопротеиназ (MMPs). CCN1 и MMPs поддерживают старение клетки путём негативной регуляции гомеостаза коллагена и увеличения его деградации.
Постепенно баланс между синтезом и деградацией коллагена нарушается в пользу последней. Повреждённый коллагеновый каркас ВКМ уже не может удерживать фибробласты в растянутом состоянии, свойственном молодым клеткам. Происходит своего рода коллапс фибробластов, что приводит к нарушению их функций. В процессе инволюции уменьшается численность фибробластов. Снижается и биосинтетическая активность этих клеток, нарушается баланс между синтезом и деградацией ВКМ дермы. В среднем, у пожилых / старых людей, по сравнению с молодыми, общее количество ДФ меньше на 35 %, продукция коллагена в коже снижена на 75 %, причём содержание коллагена уменьшается приблизительно на 1 % в год.
Все сенесцентные изменения в популяции ДФ приводят к постепенному и значительному снижению способности кожи к регенерации и обновлению. Как при этом меняется статус кожи? Уменьшается её толщина, снижается упругость и эластичность, появляются морщины, заломы, птоз тканей — кожа стареет.
Очевидно, что именно ДФ должны быть основной «мишенью» омолаживающих кожу косметологических методов. Так оно и есть: все современные терапевтические воздействия в целях коррекции возрастных изменений кожи — инъекционные, включая PRP-терапию, аппаратные (лазерные, радиочастотные, ультразвуковые) — направлены прежде всего на стимуляцию функциональной активности ДФ, как пролиферативной, так и биосинтетической. Особое место в этом ряду занимает применение аутологичных (собственных) дермальных фибробластов, или SPRS-терапия.
SPRS-терапия как метод оздоровления и обновления кожи
SPRS-терапия (SPRS — от англ. Service for Personal Regeneration of Skin — персонифицированный комплекс лечебно-диагностических процедур для восстановления кожи) — метод регенеративной медицины (РУ ФС №2009 / 308 от 21.07.2010). Его применение позволяет восполнить уменьшившуюся с возрастом популяцию ДФ за счёт введенных в кожу специализированных молодых и функционально активных клеток. Трансплантируются собственные фибробласты кожи пациента, поэтому они полноценно приживаются, интегрируют с резидентной клеточной популяцией и живут «по законам» дермы.
После трансплантации их биосинтетическая активность сохраняется не менее года, причём без какой‑либо дополнительной стимуляции. Как результат, увеличивается синтез коллагена и других компонентов ВКМ, благодаря чему происходит ремоделирование микроструктуры дермы, увеличение её толщины, уменьшение количества и глубины морщин.
Сенесценция — это состояние, при котором клетки с накопленными повреждениями ДНК и истощением механизмов её восстановления перестают делиться, теряют способность к ремоделированию и организации ВКМ.
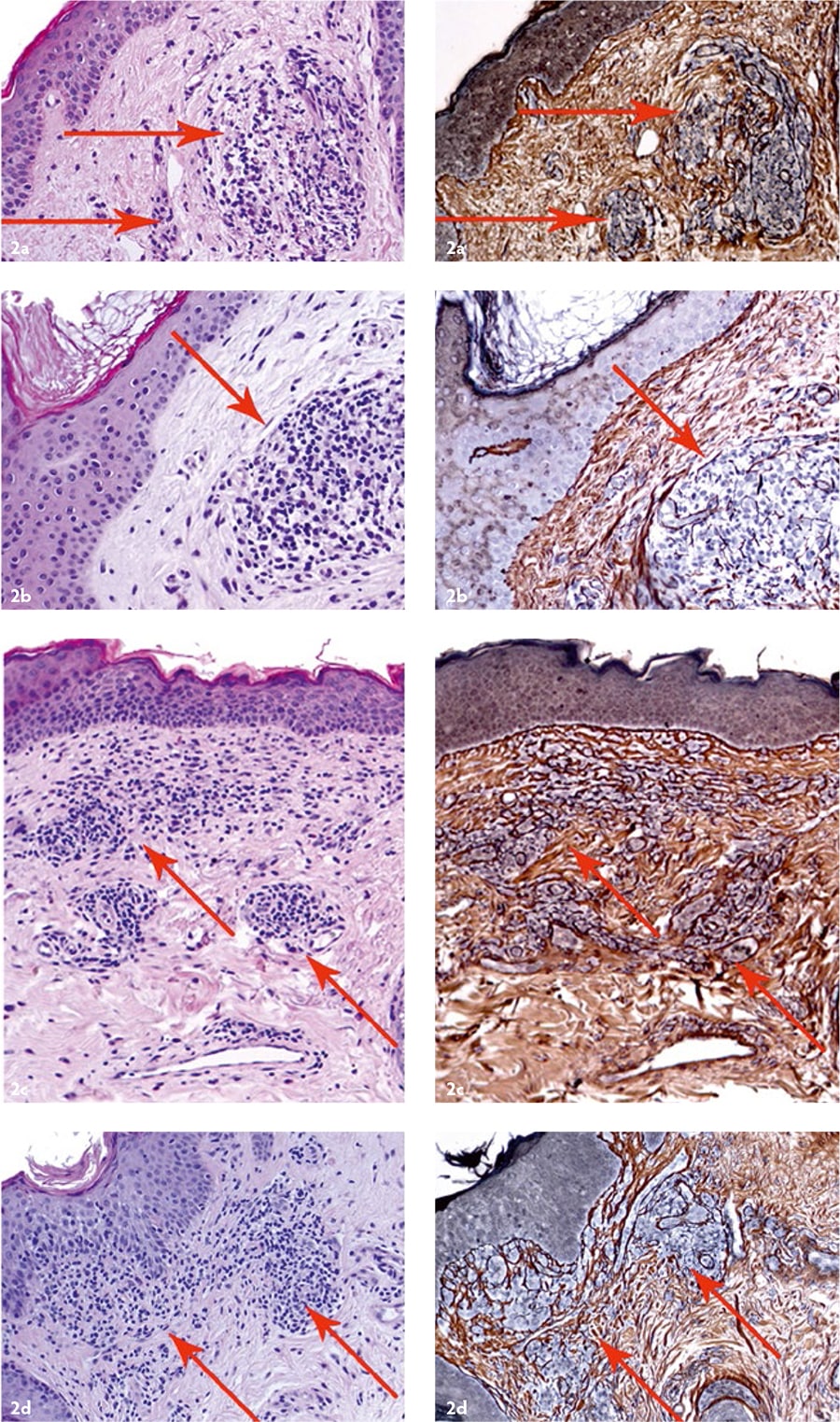
Рис. 2. Кожа после применения аутоДФ: a — через 1 месяц, b — через 3 месяца, c — через 6 месяцев, d — через 12 месяцев. Стрелками указаны группы введённых культивированных аутоДФ. Левая колонка — окраска гематоксилином и эозином, правая колонка — импрегнация нитратом серебра. Ув. ×200. Препараты и микрофотографии Р. В. Деева.
Описание технологии
В специализированной лаборатории Института стволовых клеток человека, соответствующей международным стандартам GMP*, из 4 мм биоптата кожи пациента получают клеточный препарат, содержащий культивированные аутологичные ДФ (аутоДФ). На этапах клеточного процессинга происходит отбор и стимуляция только функционально активных ДФ, которые, несмотря на старение организма, сохраняют высокую способность к делению и синтезу важных для кожи компонентов. Дело в том, что пролиферативный потенциал всей популяции дермальных фибробластов взрослого человека в течение всей его жизни остаётся на довольно высоком уровне — благодаря наличию в фибробластическом диффероне стволовых / прогениторных клеток. Это клетки-предшественницы, которые отвечают за обновление клеточной популяции дермы. Как показали исследования in vitro, первичные культуры, полученные даже от очень пожилых людей (95 лет), содержат до 14 % митотически активных фибробластов.
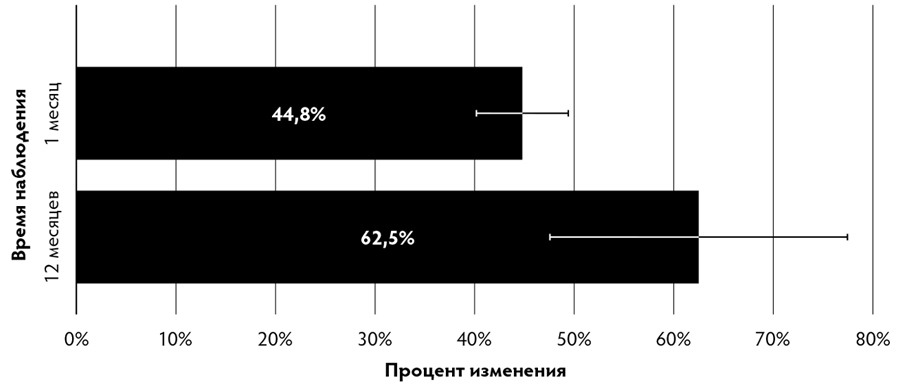
Рис. 3. Относительное изменение толщины кожи после применения аутоДФ (по результатам гистологических исследований).
Данный факт подтверждается и нашими экспериментами: культуры фибробластов дермы, полученные от пациентов 18–82 лет, характеризуются довольно высокой эффективностью колониеобразования (45.0±9.5 %), независимо от возраста донора. Это даёт возможность из небольшого биоптата кожи любого взрослого человека получить необходимое для проведения терапии количество функционально активных клеток.
После трансплантации культивированных ауто ДФ в дерму их биосинтетическая активность сохраняется. В своей работе мы вводили полученный клеточный материал одновременно и в кожу лица, и в кожу за ушной раковиной, откуда затем проводили забор биоптата для гистологического изучения. Наши исследования показали:
- трансплантированные аутоДФ синтезировали компоненты ВКМ дермы на протяжении как минимум 12 месяцев [Рис. 2];
- трансплантированные аутоДФ присутствовали в дерме небольшими группами, без признаков митотической активности, то есть без признаков деления клеток (следовательно, риск развития каких‑либо гиперпластических процессов при их использовании отсутствует);
- образовались новые коллагеновые волокна;
- толщина дермы увеличилась в среднем на 62,5±13,6 % (р=0,028) в течение первых 12 месяцев после применения аутоДФ [Рис. 3].
Через 24 месяца после применения аутоДФ в дерме также регистрировали отдельные группы фибробластоподобных клеток [Рис. 4], продуцирующих коллагеновые волокна. Однако признаков созревания (утолщения) коллагена не наблюдали, из чего следует, что через два года после трансплантации аутоДФ интенсивность их синтетической активности (по сравнению с таковой в течение первого года после трансплантации) была снижена.
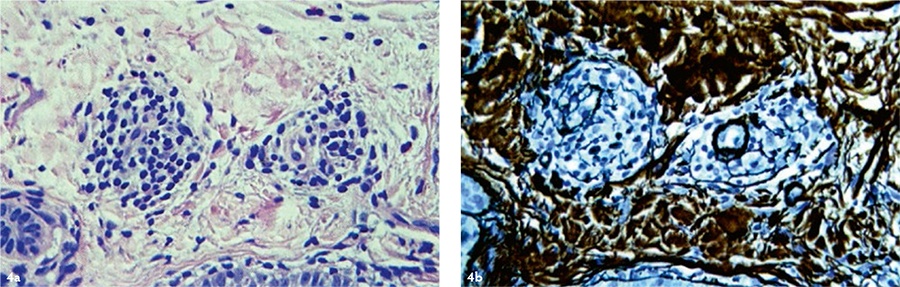
Рис. 4. Кожа пациента М. (54 г.) после применения аутоДФ через 24 месяца. Левая колонка — окраска гематоксилином и эозином, правая колонка — импрегнация нитратом серебра. Ув. ×200. Препараты и микрофотографии Р. В. Деева.
Скорее всего, это связано с уровнем физиологических потребностей дермы (известно, что для обеспечения её физиологического состояния достаточно незначительной функциональной активности фибробластов). По всей видимости, трансплантированные аутоДФ полноценно интегрировались с дермой, стали естественной составляющей её основной клеточной популяции — фибробластического дифферона — и находятся под контролем микроокружения.
Выводы гистологического исследования:
- введенные аутоДФ сохраняют свою жизнеспособность в дерме;
- они располагаются в дерме преимущественно группами;
- их функционирование не приводит к неблагоприятным последствиям, клетки пролиферативно не активны;
- на всех сроках наблюдения в дерме регистрируются признаки увеличения её объёма и процесс синтеза молодых коллагеновых волокон.
Выявленная на гистологическом уровне положительная динамика изменений кожи после применения аутоДФ полностью соответствует клинической картине. Уже через 10–14 дней после окончания курса SPRS-терапии отмечается повышение упругости кожи, уменьшение её рельефности (уменьшение выраженности морщин), улучшение цвета и контуров лица. Эффект имеет нарастающий характер. Так, если через месяц после инъекции на «хорошо» и «отлично» клинический результат оценили 88 % пациентов, то уже через три месяца и позже — 100 %. Врачи-исследователи через месяц определили результат как «хороший» и «отличный» у 86 % пациентов, через три месяца и позже — у 100 % пациентов. Положительные, прогрессирующие со временем (на протяжении как минимум 12 месяцев) изменения состояния кожи подтверждены нами и с помощью инструментальных методов исследования.
Заключение
Инновационная технология — SPRS-терапия, основанная на принципах регенеративной медицины, — позволяет восстанавливать утраченные с возрастом структуру и функции дермы за счёт уникального биологического механизма собственных коллагенобразующих клеток кожи пациента.
SPRS-терапия используется в отечественной эстетической медицине более восьми лет, зафиксировано более 1000 клинических наблюдений пациентов, из которых более 80 % повторно (два и более раз), пролечив одну область кожи, обращались в клиники для лечения этим методом кожи других областей.
Для врачебной практики важно, что SPRS-терапия является не только самостоятельным эффективным методом ремоделирования дермы, но и хорошей базовой основой для применения других косметологических вмешательств, направленных на стимуляцию синтетической активности фибробластов, что позволяет в течение длительного времени поддерживать кожу пациента в хорошем состоянии.
Авторы:
Алла Зорина, к. м. н., врач-биохимик, Москва.
Вадим Зорин, к. б. н., врач-биофизик, Москва.

Тело человека состоит из триллионов разнообразных клеток. Наиболее важными клетками самого большого органа в теле человека – кожи, являются фибробласты. Их называют клетками молодости, так как именно активная работа фибробластов способствует поддержанию молодости и красоты кожи.
Фибробласты
Зародышевые клетки соединительной ткани организма. Они участвуют в процессах регенерации и синтеза белков, наиболее важных для омоложения клеток дермы.
В организме человека фибробласты могут находиться в двух формах: активные и неактивные. Активный фибробласт имеет большой размер, отростки, овальное ядро и много рибосом. Такая клетка может делиться и интенсивно вырабатывать коллаген. Неактивные фибробласты называются также фиброцитами. Они являются высокодифференцированными клетками, которые образовываются их фибробластов, не имеют способности к делению, но принимают активное участие в синтезе волокнистых структур и заживлении ран. Неактивные фибробласты имеют несколько меньший размер, чем активные, и отличаются веретенообразной формой.
Все активные фибробласты разделяются на несколько структурно-функциональных типов, каждый из которых выполняет определенные функции:
- малодифференцированные фибробласты обладают выраженными пролиферативными свойствами, то есть, они активно размножаются и растут;
- юные фибробласты – более дифференцированные клетки, которые также способны к пролиферации, но в отличие от малодифференцированных, могут синтезировать коллаген и кислые гликозаминогликаны;
- зрелые фибробласты образуются из юных форм, практически не могут размножаться, и разделяются на три подтипа:
- фиброкласты разрушают коллаген путем фагоцитоза и внутриклеточного лизиса;
- коллагенобласты синтезируют коллаген;
- монофибробласты играют роль в сокращении фиброзной ткани при заживлении ран.
Фибробласты располагаются в среднем слое кожи человека – в дерме. Там они вырабатывают внеклеточный матрикс, компоненты которого и формируют своеобразный каркас кожи. Основными компонентами внеклеточного матрикса являются гликопротеины, протеогликаны и гиалуроновая кислота. Широко известный коллаген является превалирующим гликопротеином внеклеточного матрикса. Кроме того, фибробласты продуцируют также белки фибрин, эластин, тинасцин, нидоген и ламинин, которые используются в качестве «строительного материала» для кожи.
Еще один продукт синтеза фибробластов – это факторы клеточного роста, к которым относятся:
- основной фактор, усиливающий рост всех клеток кожи;
- трансформирующий фактор, способствующий стимулированию выработки эластина и коллагена;
- эпидермальный фактор, ускоряющий деление клеток и перемещение кератиноцитов;
- фактор роста кератиноцитов.
Основные функции фибробластов:
- синтез коллагена, эластина, гиалуроновой кислоты и других компонентов внеклеточного матрикса;
- формирование сосудов;
- усиление процессов клеточного роста;
- ускорение разрастания тканей;
- заживление поврежденной кожи;
- направление клеток иммунной системы к бактериям и другим чужеродным агентам.
С возрастом в организме человека способности фибробластов в плане активного синтеза и пролиферации в тканях кожи снижаются, в результате чего происходит уменьшение содержания их главных компонентов — гиалуроновой кислоты, коллагена, эластина, сосудистой сети. Это отражается на внешнем виде кожного покрова.
Сегодня, благодаря успехам биотехнологии, появилась возможность естественным путем повлиять непосредственно на причину возрастного увядания кожных тканей. Этого удалось достигнуть способом обогащения ее собственными молодыми фибробластами, которые являются строителями внеклеточного матрикса.
Трансплантация в кожу лица собственных молодых клеток фибробластов способна эффективно и достаточно быстро активизировать процессы обновления и восстановления ее структуры. Аутологичные (свои) клетки не воспринимаются собственной иммунной системой как антиген (чужеродные) и, следовательно, организмом не отторгаются, а полноценно функционируют. Преимуществом клеточного омоложения является и то, что трансплантированные фибробласты долгое время (от полугода до полутора лет) сохраняют функциональную активность в части усиленного синтеза гиалуроновой кислоты, коллагена, эластина и других компонентов матриксной системы кожи. В течение этого срока постоянно продолжается улучшение ее состояния.
Такая методика аутотрансплантации фибробластов в косметологии получила официальное разрешение Росздравнадзора.

Основа всех основ для любого косметолога. Знание строения, функций и клеток кожи необходимо для эффективной работы с пациентами.
Кожа является самым большим органом нашего тела, которая выполняет множество важнейших функций:
- регуляция температуры;
- защита внутренних органов от повреждений;
- предохранение организма от обезвоживания;
- барьерные функции;
- произведение гормональных соединений;
- передача различных ощущений в мозг с помощью рецепторов;
- выделение продуктов обмена веществ: мочевая кислота, соль, холестерин и др.;
- отражение состояния внутренних органов.
Сама кожа делится на три слоя: эпидермис, дерму и гиподерму. Каждый слой отличается по строению и функциям. Рассмотрим каждый из них.
Эпидермис
Самый верхний слой кожи, представляющий собой типичную пролиферативную ткань, которая способна к постоянному самообновлению. Эпидермис в свою очередь делится еще на 5 уровней: роговой, блестящий, зернистый, шиповатый, базальный.
Роговой слой
Является внешним слоем эпидермиса. В нем содержится от 15 до 30 слоев клеток, выполняющих защитные функции. Роговой слой – это конечный продукт процесса дифференцировки клеток. Прочность рогового слоя обусловлена качеством кератина и наличием межклеточного диффузионного барьера. Целостность и качество рогового слоя сильно зависит от pH. Воздействие на pH-градиент рогового слоя может привести к изменению активности ферментов, что влечет за собой нарушения во всем эпидермисе.
Блестящий слой
Идет сразу после рогового. Это очень тонкий слой безядерных клеток, которые пропитаны особым веществом – элеидином.
Зернистый слой
Состоит 3-4 слоев клеток, в которых скапливаются нити кератина (строительный материал рогового слоя). Здесь кератиноциты производят липиды и компоненты, составляющие NMF (естественный увлажняющий фактор).
Шиповидный слой
Состоит из 4-8 рядов полигональных клеток, которые соединены прочной связью протоплазматических отростков. Слой получил свое название благодаря шиповатым клеткам, которые имеют в своем составе артефакт, возникающий при гистологической обработке образцов ткани. В клетках шиповидного слоя откладываются продукты синтеза, такие как кератин и липиды. Здесь же располагаются иммунологически активные клетки Лангерганса.
Базальный слой
Состоит из коллагеновых и эластиновых волокон, а также из протоплазматических отростков эпителиальных клеток. В базальном слое расположены меланоциты, несущие в меланосомах запасы пигмента. Каждый меланоцит контактирует приблизительно с 30 кератиноцитами через разветвлённые дендриты и поставляет им пигмент. Таким способом меланоциты защищают кожу от негативного воздействия УФ-излучения. Базальной слой контактирует с дермой и, следовательно, с зоной дермо-эпидермального соединения.
Дерма и гиподерма
Глубже эпидермиса находится дерма, имеющая толщину от 1.5 до 5 мм. Она состоит из двух слоев: сосочкового и сетчатого. Дерма пронизана кровеносными и лимфатическими сосудами, железами.
Сосочковый слой
Представляет собой рыхлую волокнистую соединительную ткань, которая состоит из коллагеновых, эластических и ретикулярных волокон, а также из клеток: фибробластов, тучных клеток, макрофагов и других. Сосочковый слой получил свое название благодаря большому количеству сосочков, вдающихся в эпителий. Размер и количество сосочков по всему тело неодинаково. В дерме лица сосочки совсем плохо развиты и с возрастом имеют тенденцию исчезать.
Также в этом слое находятся гладкие мышечные клетки, которые собираются в пучки, связанные с корнем волоса. Здесь же происходит процесс появления «гусиной кожи», когда сокращаются мышечные клетки. При этом снижается теплоотдача организма, так как мелкие кровеносные сосуды сжимаются, тем самым уменьшая приток крови к коже.
Сетчатый слой
Состоит из плотной соединительной ткани с пучками коллагеновых волокон и сетью эластических волокон. Коллагеновые волокна проходят в двух направлениях: параллельно и косо к поверхности кожи. В сетчатом слое дермы на участках кожи, подверженных сильному растяжению, располагается узкопетлистая коллагеновая сеть. В зонах, где кожа испытывает особое давление, коллагеновая сеть является широкопетлистой. Сеть эластических волокон повторяет расположение коллагеновых пучков. В сетчатом слое фибробласты являются основными клеточными элементами. Кроме этого, в сетчатом слое располагаются кожные железы: потовые и сальные, а также корни волос.
Гиподерма или подкожная жировая клетчатка образуется из соединительнотканных фиброзных тяжей, которые образуют ячейки, наполняющиеся жировой тканью. Жировая ткань состоит из адипоцитов (жировых клеток). В фиброзных тяжах располагаются лимфатические сосуды, нервы, малые артерии, венулы и артериолы. Гиподерма в некоторых областях тела человека отсутствует, например, ее нет в области век, в мошонке и на половом члене. Слой подкожной жировой клетчатки обуславливает подвижность и тургор кожи, принимает участие в жировом обмене организма, является жировым депо и амортизатором внешних механических воздействий. Важно понимать, что ПЖК является сложным органом с важными метаболическими и эндокринными функциями в организме человека.

Фибробласты — особые клетки кожи, поддерживающие ее молодость. С годами их количество уменьшается почти на 40% — это одна из причин ухудшения состояния кожи. Повлиять на ситуацию может SPRS-терапия — антивозрастная методика, основанная на действии фибробластов.
Лусине КАРАПЕТЯН, заведующая косметологическим отделением
Эстетической клиники ЕМС
Что такое SPRS-терапия
SPRS — это аббревиатура от выражения service for personal regeneration of skin. В переводе – услуга по персональной регенерации кожи. Это инъекционная методика, в ходе которой пациенту вводят его собственные клетки — фибробласты. Попадая в кожу, они начинают активно синтезировать коллаген, эластин и гиалуроновую кислоту, которые отвечают за эластичность, плотность кожи и ее увлажненность. Таким образом, SPRS-терапия позволяет не только скорректировать внешние проявления возраста, но и в том числе омолодить более глубокие слои кожи.
Как получить фибробласты
Фибробласты выращивают из небольшого (диаметром всего 5 мм) фрагмента кожи, который берут у пациента за ухом, в незаметном месте, - процедура достаточно простая. Забор производят под местной анестезией специальным инструментом — панчем (циркулярный нож с цилиндрическим лезвием), который позволяет нажатием получить круглый фрагмент (столбик) ткани.
Далее образец отправляют в лабораторию, где проводят диагностику фибробластов, оценку функциональной активности клеток и их способности к делению. Отбирают лучшие клетки с высоким потенциалом и затем наступает этап выращивания фибробластов, который длится шесть недель.
После составляют индивидуальный паспорт кожи — описание регенераторного потенциала фибробластов. На его основе пациент получает рекомендации по SPRS-терапии. Также паспорт кожи позволяет узнать, какие косметологические процедуры будут для конкретного человека эффективными, а какие — нет или в целом противопоказаны.
При необходимости культивированные фибробласты могут храниться в криобанке для последующего использования.
SPRS-терапия
Выполняют инъекции по типу мезотерапии — микродозами на небольшую глубину и небольшое расстояние между точками вкола. Кожу предварительно обрабатывают анестетиком. В среднем курс состоит из двух процедур с интервалом в месяц-полтора. Однако каждому пациенту дают индивидуальные рекомендации, так как все зависит от уровня дефицита фибробластов в каждом конкретном случае и их способности к делению. Затем можно выполнять поддерживающую терапию раз в несколько лет. Все это время клетки можно хранить в криобанке.

Эффективность
Процедура позволяет добавить десятки и даже сотни миллионов молодых фибробластов, активно вырабатывающих коллаген, эластин, гиалуроновую кислоту, и этот синтез будет продолжаться еще не менее восьми месяцев. В результате, за счет увеличения толщины дермы, на 60% повышается упругость кожи, на 70% устраняются морщины и улучшается микрорельеф кожи. Тон кожи выравнивается, уходит пигментация. Эффект заметен почти сразу после процедуры и усиливается на протяжении нескольких месяцев после завершения курса. Также SPRS-терапия помогает быстрее восстановиться после агрессивных процедур, например, пилинга. Этот метод омоложения кожи сочетается с любыми косметологическими манипуляциями и хирургическими вмешательствами.
Особенность
SPRS-терапия — это метод, устраняющий причину старения кожи, а не только его последствия. Неслучайно его называют методом клеточного омоложения, ведь старение кожи происходит на клеточном уровне, и SPRS (клеточная технология) запускает процесс омоложения кожи как раз на клеточном уровне.
Так как пациенту вводят его собственные клетки, то исключаются аллергические и другие негативные реакции организма.
Показания
- коррекция рубцов постакне
- восстановление кожи после агрессивных процедур
- подготовка кожи к операции или восстановление после них
- коррекция возрастных изменений кожи (лицо, шея, декольте, кисти рук)
- профилактика старения
Клеточное омоложение не стоит выполнять при иммунодефицитных состояниях, аутоимунных и онкологических заболеваниях, а также любых других в острой форме.
Надо отметить, что SPRS-терапия — весьма дорогостоящая, но эффективная процедура, которая, по утверждению специалистов, позволит выглядеть на 10-15 лет моложе без операций и реабилитаций.
Стоимость SPRS-терапии составляется из открытия собственного банка фибробластов, забора образца для выращивания фибробластов, введения фибробластов (цена определяется их количеством) и хранения материала в криобанке для последующих инъекций. В сумме стоимость может достигать 1 млн рублей и выше.
Читайте также:

