Диссеминированная меланома кожи что это такое
Обновлено: 10.05.2024
Меланома кожи, от древнегреческого «melas» (черный) и «oma» (опухоль), агрессивное злокачественное образование, развивающееся в результате необратимого генетического перерождения меланобластов и меланоцитов. Данные клетки продуцируют пигмент меланин и отвечают за цвет кожи, способность к загару и образование невусов (родинок). На протяжении последних десятилетий наблюдается неуклонный рост заболеваемости. Эту тенденцию чаще всего объясняют возросшим воздействием ультрафиолетовых лучей и модой на загар.
Меланома, что это такое?
Меланоциты синтезируют пигменты, отвечающие за окрашивание кожи, цвет глаз, волос. Пигментированные образования, переполненные меланином, называются родинками и могут проявляться в течение всей жизни. Определенные причинные факторы экзогенного (от греч. «exo» — внешнего) и эндогенного («endo» — внутреннего) характера способны вызвать озлокачествление невусов. Вследствие этого, риску развития меланомы подвергаются участки тела, где имеются врожденные или приобретенные невусы: кожа, реже слизистые оболочки и сетчатка глаза. Измененные клетки способны бесконтрольно размножаться и расти, формируя опухоль, метастазируя. Чаще всего, среди доброкачественных «собратьев», обнаруживают одиночное злокачественное новообразование.

Клиническая картина разнообразна. Размеры, очертание, поверхность, пигментация, плотность опухоли варьируются в широких пределах. Любые изменения, происходящие с родинкой, должны насторожить.
Характерные черты
Опухоль меланома, развивающаяся из невуса, отличается продолжительным нарастанием изменений (вплоть до нескольких лет) и последующей агрессивной трансформацией (1-2 месяца). Ранняя самодиагностика и своевременный осмотр у специалиста помогут выявить симптомы меланомы:
- Гладкая зеркальная поверхность, с исчезновением кожных борозд.
- Увеличение размеров, рост по поверхности.
- Неприятные ощущения в области родинки: зуд, покалывание, жжение.
- Сухость, шелушение.
- Изъязвление, кровотечение.
- Признаки воспалительного процесса в области родинки и окружающих ее тканей.
- Появление дочерних образований.
Внезапное появление подкожных уплотнений и узелков также может свидетельствовать о развивающемся заболевании.
Клиническая классификация. Виды меланомы
Меланома проявляется в различных формах, выделяют 3 основных типа:
Опухоль меланоцитарного происхождения. Наиболее часто встречающееся заболевание (от 70 до 75% случаев) среди людей европеоидной расы, среднего возраста. Сравнительно небольшая, сложной формы с неровными краями. Окрас неравномерный, рыже-бурый или бурый, с мелкими вкраплениями синюшного оттенка. Новообразование имеет тенденцию к дефекту ткани, сопровождающемуся выделениями (чаще кровянистыми). Рост возможен как по поверхности, так и вглубь. Переход к фазе вертикального роста может занимать месяцы и даже годы.
Как выглядит меланома на фото?
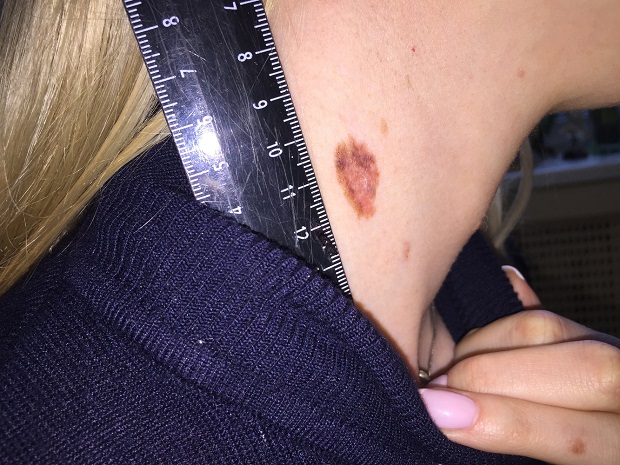
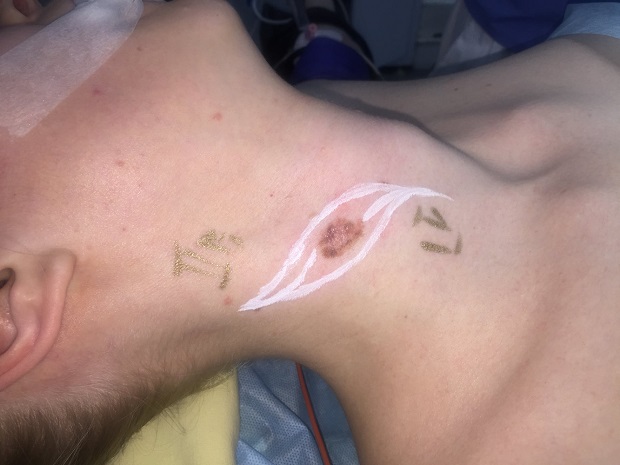
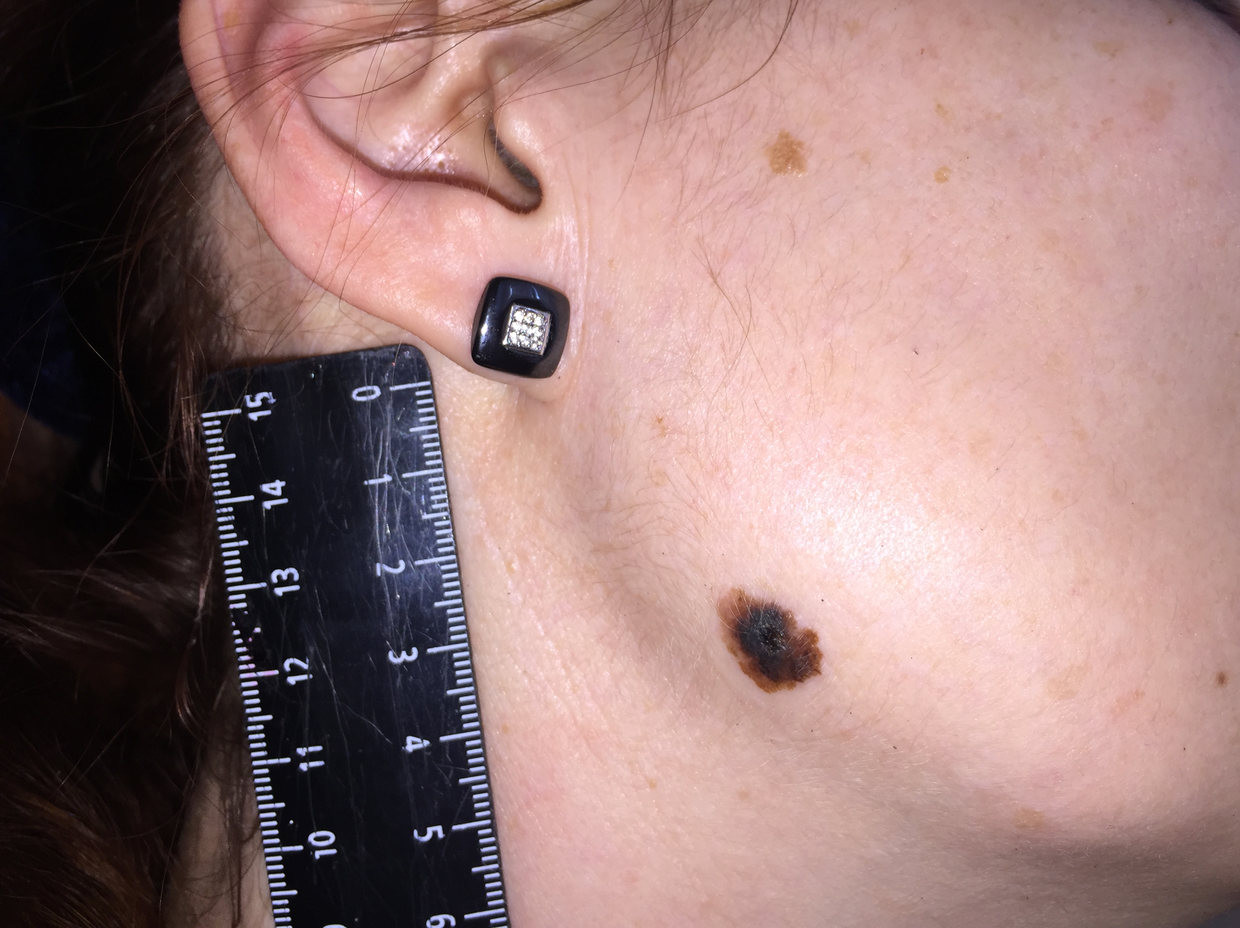
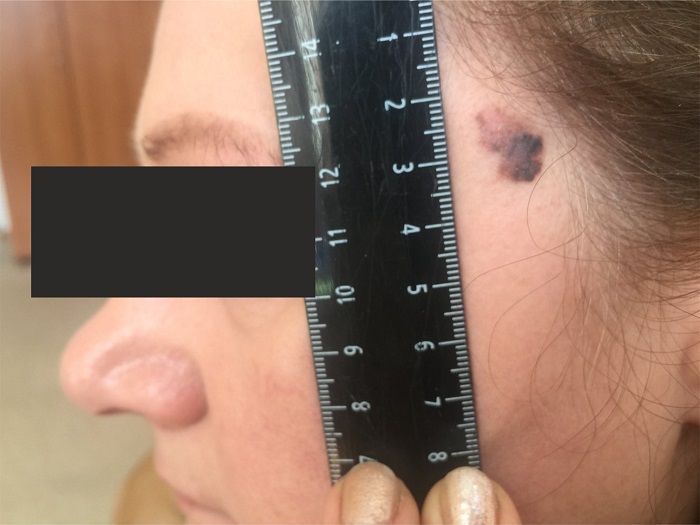
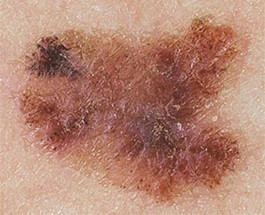
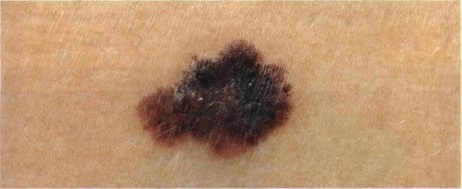
Нодулярное (уменьшительное от лат. «nodus» — узел) образование встречается реже (14-30%). Наиболее агрессивная форма. Рак меланома характеризуется быстрым ростом (от 4 месяцев до 2 лет). Развивается на объективно неизмененной коже без видимых повреждений или из пигментного невуса. Рост вертикальный. Окрас равномерный, темно-синий или черный. В редких случаях подобная опухоль, имеющая сходство с узелком или папулой может быть не пигментированной.
Заболеванию подвержены лица пожилого возраста (после 60 лет) и выявляется в 5-10% случаев. Открытые участки кожного покрова (лицо, шею, руки) захватывают узелки темно-синего, темно- или светло-коричневого цвета диаметром до 3мм. Медленный радиальный рост опухоли в верхних отделах кожи (20 лет и дольше до вертикальной инвазии в глубокие слои дермы) может захватывать волосяные фоликулы.
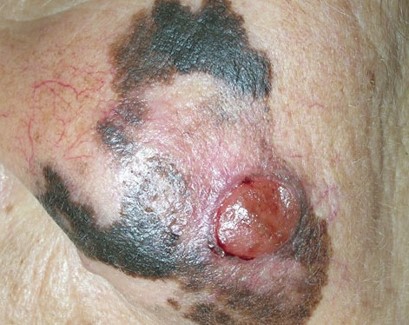
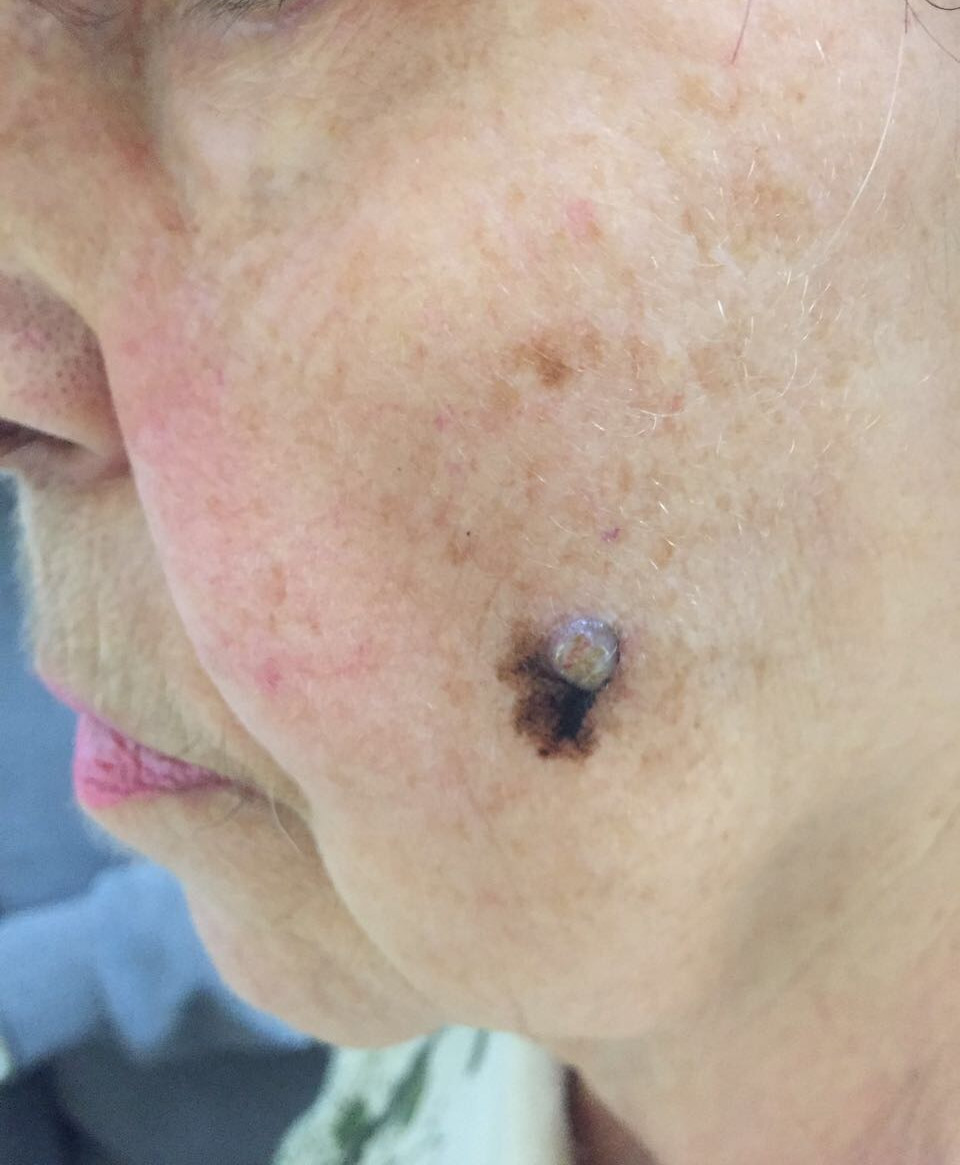
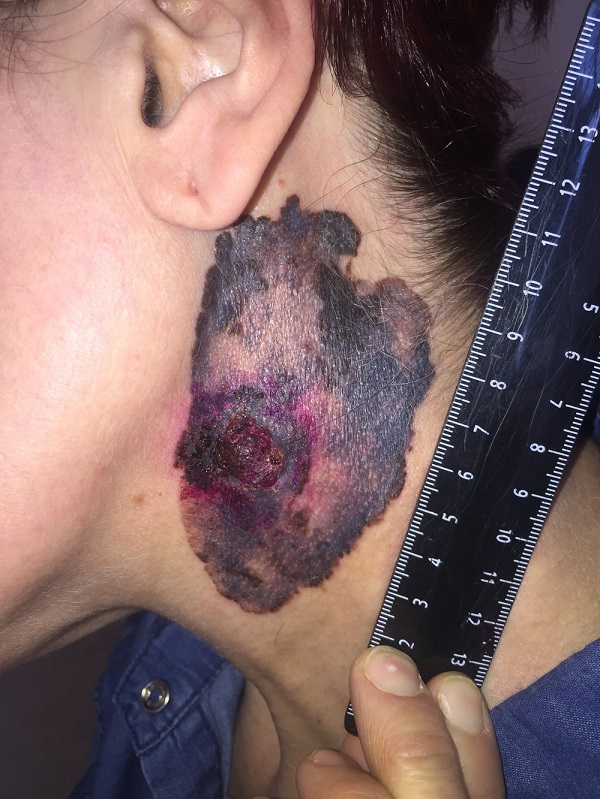
Первые признаки меланомы
Меланома – это приобретение клетками неблагоприятных признаков малигнизации (свойств озлокачествления), выраженное различными симптомами.
Для удобства запоминания признаков меланомы используют правило «ФИГАРО»:
Форма – вздутая над поверхностью;
Изменения – ускоренный рост;
Границы – ажурные, неправильные, изрезанные;
Асимметрия – отсутствие зеркальной схожести двух половинок образования;
Размер – критической величиной считается образование диаметром более, чем 6 мм;
Окраска – неравномерность цвета, включение беспорядочных пятен черного, синего, розового, красного цвета.
В широкой практике также популярен англоязычный вариант, суммирующий основные, наиболее типичные признаки – «правило ABCDE»:
Asymmetry – асимметричность, при которой, если провести воображаемую черту, делящую образование пополам, одна половина не будет похожа на другую.
Border irregularity – край неровный, фестончатый.
Color – цвет, отличный от других пигментных образований. Возможны вкрапления участков синего, белого, красного цветов.
Diameter – диаметр. Любое образование более 6 мм требует дополнительного наблюдения.
Evolution – изменчивость, развитие: плотности, структуры, размера.

Без специальных исследований сложно определить тип невуса, но вовремя замеченные изменения в характере пятна помогут обнаружить озлокачествление.
Диагностика
- Визуальный метод. Осмотр кожных покровов, с использованием «правила злокачественности».
- Физический метод. Пальпация доступных групп лимфоузлов.
- Дерматоскопия. Оптическое неинвазивное поверхностное исследование эпидермиса при помощи специальных приборов, дающих 10-40-кратное увеличение.
- Сиаскопия. Аппаратный спектрофотометрический анализ, заключающийся в интракутантном (глубинном) сканировании образования.





- Рентген.
- УЗИ внутренних органов и регионарных лимфоузлов.
- Биопсия. Возможен как забор образования целиком, так и его части (эксцизионная или инцизионная).
Стадии меланомы
Опухоль имеет несколько стадий развития.
- При нулевой и первой – клетки опухоли располагаются во внешнем слое дермы (локально);
- На второй и третьей – развитие изъязвлений в поражении, распространением на ближайшие лимфоузлы (локально-регионально);
- На четвертой – поражение лимфоузлов, органов, других участков кожи человека (отдаленное метастазирование).
Лечение
- Лечение локальных местных повреждений состоит в своевременном выявлении и хирургическом вмешательстве. Удаление чаще всего проводится под инфильтрационной анестезией. Для иссечения образований большого размера возможно применение общего обезболивания. Помимо злокачественных образований, существует ряд предмеланомных заболеваний, в которых показан хирургический метод.
- Локально-регионарные повреждения. Лечение включает в себя иссечение с увеличенным захватом площади и лимфодиссекцию пораженных лимфатических узлов. Разновидности нерезектабельных, транзиторно метастазирующих опухолей подвергают изолированной регионарной химиоперфузии. В определенных случаях отлично зарекомендовал себя комбинированный подход, с проведением дополнительной терапии, стимулирующей иммунитет.
- Лечение отдаленных метастазов выполняется монорежимной химиотерапией. Определенные виды мутаций подвергаются воздействию прицельных таргетных препаратов.
Меланома. Прогноз выживаемости
Толщина новообразования, глубина инвазии, локализация, наличие изъязвлений и радикальность вмешательства при лечении болезни имеет важное прогностическое значение.
Радикальное воздействие на поверхностные меланомы обеспечивает пятилетнюю выживаемость в 95 процентах заболеваемости. Опухоль с поражением лимфатических узлов снижает этот процент до 40.
Противопоказания
Принадлежность человека к светочувствительному фототипу, большое количество невусов, атипичные родинки, наличие наследственной предрасположенности, иммунных и эндокринных нарушений – дополнительные факторы в пользу внимательного отношения к кожным новообразованиям. Противопоказано:
- Травматизация
- Самодеятельное удаление родинок
- Длительное пребывание под УФ-излучением без средств защиты кожи
Лечение после операции
При локальных стадиях наблюдение проводится в течение 5 лет. 10 лет – при других формах. Этот срок считается достаточным для обнаружения появления рецидива заболевания. Пациент инструктируется о применении соответствующих средств защиты от УФ лучей, в условиях естественного и искусственного излучения.


Авторская публикация:
ГАФТОН ИВАН ГЕОРГИЕВИЧ
врач-онколог
НМИЦ онкологии им Н.Н. Петрова

Фотографии из личного архива:
РАДЖАБОВА ЗАМИРА АХМЕДОВНА
врач-онколог, заведующий хирургическим отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова

Далеко не все злокачественные новообразования поражают внутренние органы. Так, диссеминированная меланома может формироваться как на слизистых оболочках внутренних органов, так и на поверхности кожи. Это крайне агрессивная опухоль, быстро распространяющаяся на соседние ткани и дающая метастазы в отдаленные органы. Опасной особенностью такого типа опухоли является бессимптомное течение на ранних стадиях роста. Врачебная консультация может пациенту узнать больше о такой патологии, как диссеминированная меланома: факторы риска, способы лечения и осложнения.
Основные сведения о болезни
Меланомой называют злокачественное новообразование, формирующееся из пигментных клеток слизистых оболочек и кожных покровов. Аномальные клетки, формирующие опухоль, являются видоизмененными меланоцитами. Такие клетки располагаются также в области ротовой полости, кишечнике, слизистой оболочке глаз и под ногтями. Иногда ранние признаки заболевания легко обнаружить из-за явного расположения опухоли, однако далеко не всегда диссеминированная меланома берет свое начало от родинки.
Диссеминированная меланома – это не что иное, как распространившаяся опухоль пигментных клеток. Меланобластомы очень быстро растут в пределах собственной ткани и распространяются на соседние анатомические участки. Проникновение злокачественных клеток в кровоток и лимфу приводит к возникновению вторичных новообразований в других органах. В частности, метастазы меланомы часто обнаруживают в головном мозге и легких. Наличие распространенной опухоли указывает на терминальную стадию болезни и неблагоприятный прогноз.
Диссеминированная меланома может располагаться в разных участках кожи. У мужчин опухоль чаще обнаруживается на коже спины, а у женщин – на поверхности нижних конечностей. На начальных стадиях злокачественного перерождения обычный невус сложно отличить от опухоли, однако постепенно формируются специфические изменения, заметные даже для обывателя. Признаки новообразований внутренних органов могут не отличаться от других форм онкологии.
Частота обнаружения меланобластом может быть связана с климатом и индивидуальными особенностями определенных популяций. Так, возникновению злокачественных опухолей кожи более подвержены люди со светлой кожей. Тем не менее следует учитывать наследственные особенности и другие факторы риска.
Кожа как орган
Кожный покров человека является самым большим по своей протяженности органом. Это своеобразная наружная оболочка, являющаяся границей между внешним пространством и внутренней средой. С точки зрения гистологии кожа разделена на эпидермис, являющийся наружным ороговевшим слоем клеток, дерму и подкожную жировую клетчатку. К производным кожи следует отнести волосы, ногти, сальные, потовые и молочные железы.
Основные функции органа:
- Сохранение тепла в организме.
- Защита внутренних структур от инфекционных агентов, механического и химического воздействия.
- Поглощение кислорода для дыхания и удаление углекислого газа.
- Удаление избытка жидкости, продуктов обмена веществ и минеральных соединений с секретом потовых желез.
- Депонирование крови.
- Поддержание выделительной функции почек.
- Выработка собственного витамина D и некоторых гормональных веществ.
- Обработка ощущений, связанных с внешними воздействиями (рецепторы).
- Поддержание функций иммунной системы.
В коже также содержится большое количество пигментных клеток (меланоцитов), определяющих цвет внешнего покрова человека. Так, цвет кожи зависит от концентрации меланина в клетках. Большое количество меланина связано с лучшей защитой кожи от ультрафиолетового излучения. Люди с бледной кожей, напротив, плохо защищены от УФ-лучей и подвержены риску злокачественного новообразования.
На поверхности кожи практически любого человека есть родинки, представляющие собой доброкачественные опухоли, состоящие из меланоцитов. В зависимости от формы родинки могут быть плоскими, висячими, выпуклыми или круглыми. Средний размер невуса не превышает 1-2 см, однако встречаются и достаточно крупные образования. Диссеминированная меланома часто берет свое начало от родинок, поэтому количество таких образований на коже может быть связано с риском возникновения заболевания.
Причины возникновения
Как и в случае многих других онкологических заболеваний, точные причины возникновения меланомы до сих пор изучаются. Предполагается, что при длительном воздействии патологических факторов нормальные клетки кожи видоизменяются и начинают бесконтрольно делиться, что приводит к росту опухоли. Нормальные клетки имеют ограниченный цикл деления, однако при нарушении ДНК или внутренних систем регуляции возможно возникновение злокачественных клеток.
Существует множество факторов, повреждающих генетическую информацию в клетках. Это ионизирующее излучение, онкогенные химические вещества и механические повреждения. В случае меланобластомы более существенным фактором риска является ультрафиолетовое излучение солнца. Длительное воздействие УФ-лучей провоцирует возникновение генетических мутаций. Также мутации могут передаваться по наследству.
Возможные факторы риска:
- Светлая кожа. Недостаточная концентрация меланина в коже обуславливает слабую защиту от ультрафиолетового излучения.
- Частое возникновение солнечных ожогов и искусственный загар.
- Проживание в климатической зоне с высокой инсоляцией. Для уменьшения воздействия солнечного излучения можно наносить на кожу специальные крема.
- Большое количество родинок на коже. Формирование более 50 невусов обычно связывают с высоким риском злокачественного перерождения меланоцитов. В частности, опасны висячие и выступающие невусы.
- Диссеминированная меланома в семейном анамнезе (особенно у отца или матери).
- Механическое повреждение родинки.
- Нарушение функций иммунной системы, сопровождающееся ослаблением противоопухолевой защиты.
Таким образом, меланобластома является полиэтиологическим заболеванием. При выявлении факторов риска необходимо регулярно проходить обследования.
Симптомы и признаки

Ранние признаки роста меланомы проявляются редко. Заметить формирующуюся опухоль можно только при заметной локализации или при случайном диагностическом обнаружении. Следует учитывать, что новообразования меланоцитов нередко формируются в малозаметных местах.
Признаки патологического невуса:
- Отсутствие симметрии. Обычные родинки круглые и симметричные.
- Нечеткая граница образования. Края здорового невуса резко переходят в кожу.
- Изменение цвета. Особенно важным признаком является появление неравномерной окраски.
- Значительное увеличение.
Другие возможные признаки:
- Выделение крови с каловыми массами при наличии меланобластомы в желудочно-кишечном тракте.
- Зуд в области патологической родинки.
- Нарушение аппетита и потеря веса.
- Депрессия и апатия.
- Постоянная слабость и усталость.
- Неврологическая симптоматика при метастазировании опухоли в головной мозг.
При обнаружении перечисленных симптомов следует незамедлительно обратиться к врачу.
Методы диагностики и лечение
Диагностикой и лечением заболеваний кожи занимаются дерматологи. Во время приема врач спросит пациента о жалобах, изучит анамнестические данные для выявления факторов риска и проведет физикальное обследование. Обычно пациенты уже на приеме показывают подозрительные образования, поэтому общий осмотр помогает обнаружить признаки злокачественного новообразования. Для постановки точного диагноза и назначения лечения необходимы данные инструментальной и лабораторной диагностики.
Специальные методы исследования:
- Дерматоскопия – инструментальный осмотр патологического образования кожи или слизистой оболочки. Система линз ручного устройства дает возможность многократно увеличить область осмотра для более точного обследования. Кроме того, используются цифровые дерматоскопы, способные выводить высокоточные изображение на экран и самостоятельно обнаруживать патологические признаки. пораженного участка – удаление клеточного материала родинки или слизистой оболочки для последующего гистологического исследования в лаборатории. Процедура может быть осуществлена с помощью различных малоинвазивных методов. Результаты гистологического исследования указывают на наличие аномальных клеток и тип новообразования.
- Полный анализ крови для обнаружения признаков онкологии.
- Ультразвуковое исследование – метод сканирования с помощью высокочастотных звуковых волн. УЗИ используют для диагностики близлежащих лимфатических сосудов, что может быть важно при подозрении на метастазирование опухоли.
- Компьютерная, магнитно-резонансная или позитронно-эмиссионная томография органов – высокоточные методы визуализации, позволяющие получать изображения разных отделов органов. Данные КТ, МРТ и ПЭТ позволяют обнаружить вторичные патологические очаги в отдаленных анатомических структурах.
В зависимости от стадии могут быть применены хирургические и терапевтические методы лечения. Как правило, сначала производится полное удаление патологического очага, после чего врачи назначают химиотерапию и лучевую терапию. На поздних стадиях болезни, когда метастазы возникают в отдаленных органах, чаще назначается паллиативное лечение.
Таким образом, диссеминированная меланома является поздней стадией онкологического заболевания кожи. Важно помнить, что раннее обращение к врачу значительно улучшает прогноз.
Что такое меланома? Причины возникновения, диагностику и методы лечения разберем в статье доктора Беляниной Елены Олеговны, онколога со стажем в 25 лет.
Над статьей доктора Беляниной Елены Олеговны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Меланома (от греч. melanos – "чёрный", "тёмный") — это злокачественная опухоль, развивающаяся из меланоцитов (клеток, синтезирующих меланин). Чаще всего она образуется из кожных меланоцитов, то есть располагается на коже. В 7% случаев меланома локализуется на сетчатке глаза и в 1-3% случаев — на слизистых оболочках прямой кишки, полости рта, оболочках головного и спинного мозга. [1] [2]
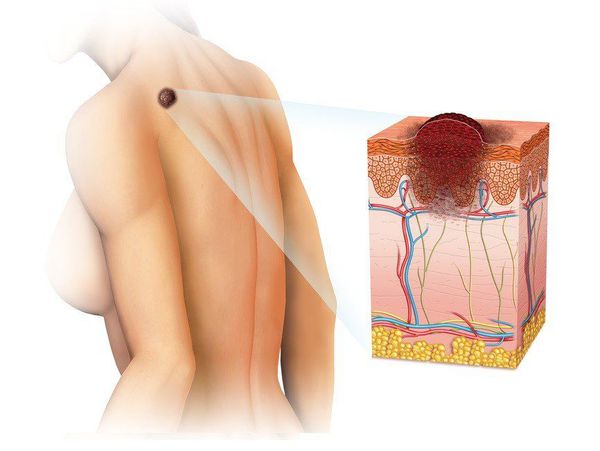
Эта болезнь — одна из наиболее злокачественных опухолей, которая часто метастазирует в разные органы.
Заболеваемость меланомой продолжает увеличиваться. По росту смертности эта патология занимает второе место после рака лёгкого. [3]
В настоящее время и звестно значительное количество факторов, которые повышают вероятность заболевания меланомой. Ни один из них не может быть признан главным или обязательным дл я возникновения заболевания. Однако современные исследования чётко установили, что основная причина меланомы — воздействие ультрафиолетовых лучей естественного солнечного света (а также излучения солярия) на кожу человека. [1] [4]
Другие факторы риска развития меланомы:
- светлая кожа (склонность к солнечным ожогам, светлые или рыжие волосы, голубой цвет глаз);
- большое количество невусов (родинок), в том числе наличие атипичных;
- меланома в личном анамензе, а также наличие меланомы у кровных родственников;
- солнечные ожоги с образованием пузырей, наличие солнечных ожогов в детстве;
- существование врождённого невуса (риск возрастает пропорционально увеличению его размера).
Особенности меланомы у детей
У детей меланома бывает редко. Однако беспигментная меланома у детей может выглядеть как обычная бородавка. Также часто встречается разновидность невусов — невус Шпитц (резко очерченная куполообразная розовато-красная папулу или бляшку), который также не всегда можно отличить от меланомы. Для уточнения необходимо наблюдение и цифровая дерматоскопия.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы меланомы
Первые признаки меланомы — появление на коже образования, непохожего на остальные по размеру, цвету и форме.
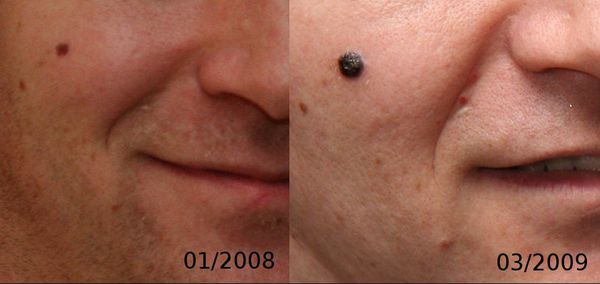
Меланома отличается от родинки следующими признаками: образование асимметричное по цвету и структуре, его края неправильные и зубчатые, оттенки в пределах одного образования отличаются, размер образования более 4 мм. С течением времени меланома изменяется по одному или нескольким ранее перечисленным критериям.
При обследовании важно учитывать, насколько пигментное образование отличается от остальных. Выявление "гадкого утёнка" среди родинок является причиной его более детального осмотра.
Клиническая картина меланомы достаточна разнообразна. Внешне она может представлять собой как незначительное пигментное пятно, так и узловое образование с изъязвлением. Цвет варьируется от светло-коричневого до чёрного.
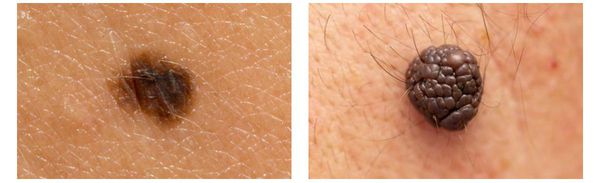
Зачастую меланома возникает у взрослых, но иногда встречаются случаи врождённой формы заболевания. В детском возрасте меланома развивается редко.
Меланома локализуется на любых участках кожи, в том числе и на ногтевой ложе.
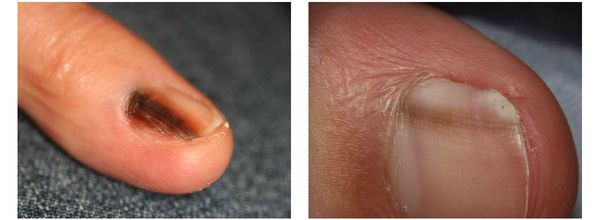
Различают четыре основных типа меланомы в зависимости от клинической картины, течения заболевания, анатомического расположения и гистологических параметров.
1. Поверхностно-распространяющаяся меланома встречается в 65-75% случаев. Для неё характерно длительное течение. Сначала это пятно коричневого цвета, которое постепенно растёт и становится асимметричным по структуре и цвету (появляются вкрапления тёмно-коричневого, чёрного и розового цвета). При переходе в вертикальную фазу роста на пятне появляется утолщение — бляшка. Наиболее часто встречаемая локализация у мужчин — на спине, а у женщин — преимущественно на нижних конечностях.
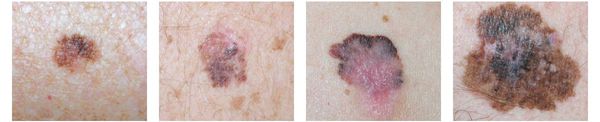
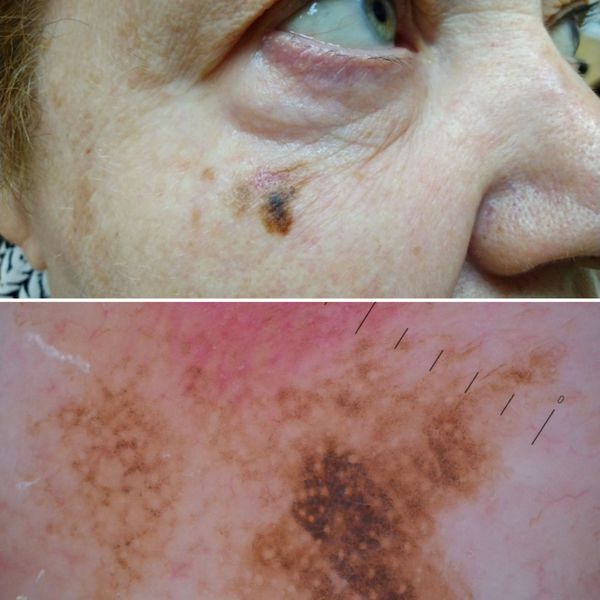
2. Лентиго-меланома представлена в виде пятна неправильной формы и окраски. Она развивается у лиц пожилого возраста. Чаще всего локализуется на лице, шее и тыле конечностей. Лентиго-меланома растёт на фоне длительно существующего злокачественного лентиго (предракового меланоза Дюбрейля). При инвазии клеток меланомы за пределы эпидермиса на пятне появляются возвышающиеся участки.
3. Узловая меланома представлена выступающим над поверхностью кожи образованием тёмно-коричневого или чёрного цвета. Часто эти образования симметричны и не вызывают подозрений. Однако, как правило, такая меланома характеризуется быстрым ростом и плотные на ощупь. С ростом опухоли она может изъязвляться. Чаще всего располагается на спине, голове и шее.
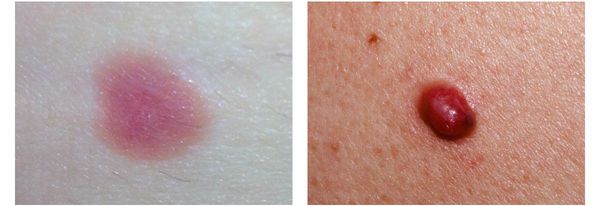
4. Во всех формах возможны беспигментные варианты (около 2%). Беспигментная (амеланотическая) меланома достаточно сложна для диагностики, так как сначала выглядит как безвредная розово-красная папула.
Поздние симптомы меланомы. Появление метастазов
Признаки метастазов зависят от того, в каком органе они появились:
- головной мозг — головные боли, неврологические симптомы (нарушение чувствительности к теплу, боли, расстройства памяти, координации и подвижности и т. п.);
- кости — боли в спине;
- лимфатические узлы — их увеличение и болезненность;
- на коже вблизи первичного очага — одновременное появление множества чёрных образований.
Патогенез меланомы
Патогенез меланомы, как и всех злокачественных опухолей, весьма сложный. Результат воздействия ультрафиолета на кожу человека (лучей А и В, длиной 280-340 нм) зависит от многих факторов, включающих дозу облучения и индивидуальный ответ организма (особенности иммунного ответа и генетическую предрасположенность).
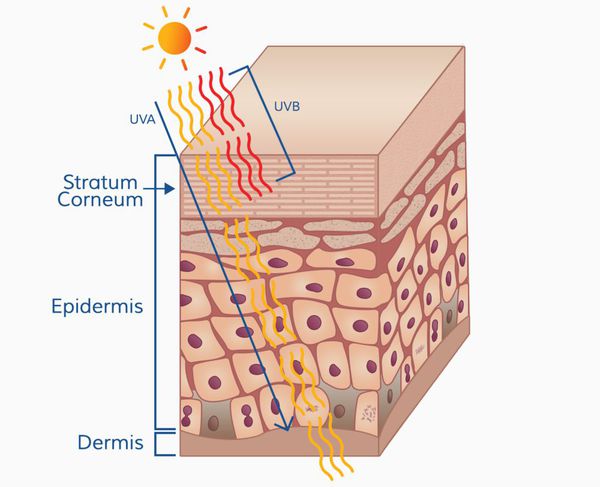
Ультрафиолетовое облучение вызывает:
- фотохимические реакции;
- повреждение молекулы ДНК (иногда повреждение восстанавливается);
- мутации (когда повреждение ДНК "не лечится" организмом);
- иммунные нарушения.
Образование пиримидиновых димеров (т. е. дефектов ДНК) под действием УФО — основная причина мутаций. [5]
Роль диспластических невусов в развитии меланомы недостаточно ясна. Проводимые исследования пока не ответили на вопрос, являются ли эти образования предраковым состояниям, или развитие меланомы в их зоне является статистически случайным событием.
По данным многочисленных гистологических исследований, около 30% меланом развиваются в области меланоцитарных невусов , остальные 70% развиваются на неизменённой коже. [6] [7] [8]
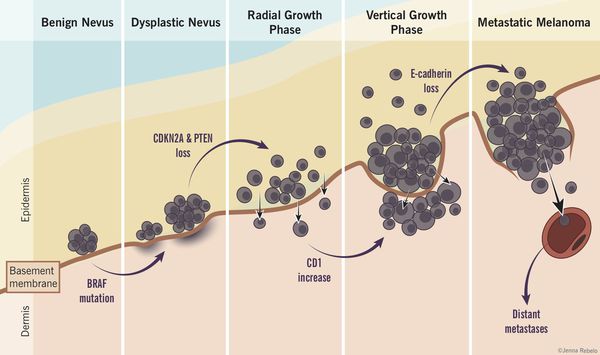
Таким образом, по имеющимся данным, на фоне невусов развивается небольшой процент всех случаев злокачественной меланомы. [4]
Атипичные невусы в первую очередь являются важными маркерами повышенного риска меланомы. При этом профилактическое удаление таких невусов нецелесообразно (они не являются 100% предшественником меланомы)
Пациенты с диспластическими невусами представляют собой группу повышенного риска и должны находиться под постоянным врачебным наблюдением.
В 7-15% всех случаев меланома является наследственной патологией. При этом обнаруживаются мутации в генах-супрессорах опухолевого роста.
Классификация и стадии развития меланомы
Стадию опухолевого процесса меланомы определяют в соответствии с классификацией TNM. Она зависит от толщины первичной опухоли, а также наличия или отсутствия регионарных и/или отдалённых метастазов.
Для определения стадии меланомы необходимо гистологическое исследование. Оценку состояния лимфоузлов для установления стадии выполняют при помощи клинического осмотра и ультразвукового исследования.
Критерий Т говорит о распространённости первичной опухоли (для классификации по этому критерию необходимо удалить первичную опухоль и провести её гистологическое исследование):
- pТis — первичная (неинвазивная) меланома (I уровень инвазии);
- pТ1 — толщина опухоли ≤ 1 мм:
○ pТ1а — II уровень прорастания опухоли в соседние ткани или III уровень без изъязвления опухоли;
○ pТ1b — IV или V уровень прорастания опухоли в соседние ткани или присутствие её изъязвления;
○ pТ2а — без изъязвления опухоли;
○ pТ2b — с изъязвлением;
○ pТ3а — без изъязвления;
○ pТ3b — с изъязвлением;
○ pТ4а — без изъязвления;
○ pТ4b — с изъязвлением.
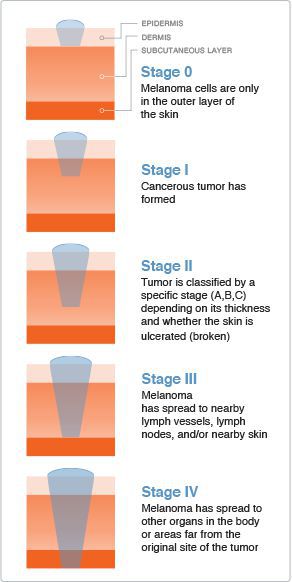
Критерий N говорит о существовании или отсутствии метастазов в регионарных лимфоузлах :
Для цитирования: Носов Д.А., Гарин А.М. Возможности химиотерапии диссеминированной меланомы. РМЖ. 2001;22:1009.
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Д иссеминированная меланома кожи является крайне неблагоприятным в прогностическом отношении заболеванием, которому свойственно агрессивное течение и быстрая дальнейшая генерализация опухолевого процесса. Несмотря на значительные достижения лекарственной терапии ряда опухолей, успехи при химиотерапии меланом остаются весьма скромными, о чем свидетельствуют неудовлетворительные и устойчиво низкие показатели выживаемости: медиана продолжительности жизни больных на этапе диссеминации колеблется от 6 до 9 месяцев, 5–летняя выживаемость – менее 5% [20]. Вместе с тем, 5–летняя выживаемость больных, леченных с эффектом, может достигать 33–47%, а полных ремиссий – даже превышать этот рубеж. Данные факты вселяют некоторый оптимизм и указывают на необходимость как совершенствования уже имеющихся терапевтических подходов, так и поиска новых более эффективных методов лекарственного лечения диссеминированной меланомы, основанных на понимании сложных молекулярных и иммунологических механизмов контроля опухолевого роста.
В клинической практике накоплен значительный опыт использования различных препаратов, которые в зависимости от принадлежности к той или иной группе определяют метод системного воздействия при диссеминированной меланоме – химиотерапевтический, иммунотерапевтический и комбинированный химиоиммунотерапевтический. Такое деление в некоторой степени отражает и историю развития системного лечения данного заболевания. В настоящий момент продолжаются споры о том, какой из режимов – химиотерапевтический или химиоиммунотерапевтический, является более предпочтительным в качестве терапии первой линии.
Результаты крупных рандомизированных исследований, которыми мы располагаем к настоящему моменту, пока не позволяют четко высказаться в пользу химиоиммунотерапевтических комбинаций с включением цитокинов (интерферон– a и интерлейкин–2) [11, 16–17,28]. В то же время достоверное увеличение частоты полных и частичных ремиссий в отдельных исследованиях, а иногда и времени до прогрессирования, оставляют надежду на перспективность комбинированного использования химиотерапевтических и иммунотерапевтических режимов.
Таким образом, многие исследователи по–прежнему рассматривают химиотерапию, как основной метод системного лечения диссеминированной меланомы. Эндокринная терапия не имеет самостоятельного значения и считается одним из возможных компонентов вышеперечисленных лекарственных подходов.
Спектр цитостатиков, применяемых как в однокомпонентных, так и в комбинированных химиотерапевтических режимах, в основном представлен алкилирующими агентами (дакарбазин, цисплатин), производными нитрозомочевины (фотемустин, ломустин, кармустин, нидран) и винкаалкалоидами.
Эффективность монотерапии, как правило, не превышает 20–25%. Дакарбазин (DTIC) по–прежнему считается «золотым стандартом» лекарственного лечения диссеминированной меланомы (табл. 1). Средняя продолжительность ремиссий, достигнутых с помощью однокомпонентных режимов, небольшая и, по данным разных авторов, составляет 5–7 мес [4,12,18].
Небольшие успехи монотерапии послужили стимулом к созданию и изучению комбинированных химиотерапевтических режимов на основе дакарбазина. В результате в клиническую практику были введены комбинации DBDT, CVD и BOLD, ставшие популярными в 80–х и начале 90–х годов (табл. 2).
В 1984 г. Del Prete et al. впервые сообщили о высокой эффективности схемы DBDT (дакарбазин, кармустин, цисплатин, тамоксифен) при лечении больных метастатической меланомой. Последующие исследования, проведенные в рамках II фазы, также демонстрировали высокую активность этой комбинации, получившей название «Dartmouth» режим (табл. 3).
По литературным данным эффективность других многокомпонентных режимов (CVD, BOLD, дакарбазин +фотемустин) сопоставима с DBDT, хотя прямого сравнения этих комбинаций между собой не проводилось (табл. 4).
Вместе с тем, методика проведения этих исследований – отсутствие рандомизации, малое число пациентов (в основном с разными прогностическими показателями) – позволила некоторым авторам поставить под сомнение преимущество комбинированной химиотерапии над монотерапией дакарбазином. Известно, что наиболее значимыми параметрами, определяющими прогноз больных меланомой на этапе диссеминации, являются характер метастазирования, исходный соматический статус, время от удаления первичного очага до развития рецидива заболевания и ряд лабораторных показателей (ЛДГ, щелочная фосфататаза и др.). При метастазах в мягкие ткани и/или отдаленные лимфоузлы 5–летняя выживаемость пациентов может достигать 13,5%, в то время как при висцеральных поражениях – 2,5–3,6% [3,22]. Причем наихудший прогноз имеют больные с метастазами в печень, головной мозг и/или кости. Возможно, что преобладание пациентов, входящих в благоприятную прогностическую группу и объясняет высокую эффективность комбинированной химиотерапии в представленных выше исследованиях.
Результаты первого масштабного рандомизированного исследования, в котором проводилось прямое сравнение эффективности комбинации DBDT и дакарбазина, только углубили имеющиеся противоречия в выборе терапии [6]. Частота и продолжительность объективных эффектов, а также общая выживаемость в обеих группах достоверно не отличались. Токсичность была существенно выше при использовании комбинации DBDT. В ходе другого рандомизированного исследования также не удалось доказать превосходство комбинации CVD над монотерапией дакарбазином [5] (табл. 5). Проведенный авторами спустя 7 лет окончательный анализ лишь подтвердил вывод о равной эффективности этих двух режимов [21].
Тем не менее, во многих странах мира комбинации с включением DTIC в качестве химиотерапии первой линии по–прежнему занимают ведущее место в лечении метастатической меланомы. В первую очередь это объясняется желанием врачей задействовать весь арсенал активных при данном заболевании цитостатиков, а также явным дефицитом масштабных рандомизированных исследований, которые убедительно демонстрировали бы отсутствие преимуществ у комбинированных режимов.
На наш взгляд, у больных с хорошим соматическим состоянием предпочтительнее использовать комбинированную химиотерапию, в то время как у ослабленных пациентов с сопутствующей патологией и/или признаками полиорганной недостаточности целесообразно проводить монотерапию дакарбазином.
При выборе лечебной комбинации следует также руководствоваться локализацией метастатического поражения. При наличии метастазов в головной мозг, которые клинически могут выявляться у 8–46% больных диссеминированной меланомой, преимущество имеют комбинации с производными нитрозомочевины, поскольку препараты этой группы способны преодолевать гематоэнцефалический барьер. На данный момент мы располагаем результатами нескольких исследований, демонстрирующих возможности терапии больных меланомой с метастатическим поражением головного мозга. В одном из них монотерапия фотемустином была эффективна в 25% случаев, в другом – не уступала комбинации фотемустин + лучевая терапия по частоте объективных эффектов и показателям выживаемости, хотя время до прогрессирования болезни было достоверно выше в группе больных, получавших комбинированное лечение (табл. 6). Химиотерапевтические режимы с включением фотемустина могут рассматриваться в качестве терапии первой линии при метастазах меланомы в головной мозг.
Много исследований посвящено выяснению роли тамоксифена в лекарственных режимах лечения меланомы. В ранних работах, в которых оценивалась эффективность монотерапии тамоксифеном, была отмечена слабая (менее 5%) противоопухолевая активность этого препарата [30]. В то же время результаты отдельных исследований свидетельствовали, что добавление тамоксифена к цисплатину (DDP) приводит к усилению цитотоксического действия последнего in vitro. Данное наблюдение послужило основанием для изучения роли тамоксифена в составе химиотерапевтических схем и комбинаций. В 1993 г. McClay на небольшой группе больных продемонстрировал возможность преодоления резистентности опухоли к цисплатину после комбинации его с тамоксифеном в дозе 20 мг/сутки. У 3 (16%) из 19 больных, не ответивших на монотерапию цисплатином, простое добавление тамоксифена в схему лечения приводило к развитию частичных ремиссий [26].
В одном из первых рандомизированных исследований комбинация дакарбазин + тамоксифен оказалась эффективнее монотерапии дакарбазином [7]. Причем среди больных, получавших комбинированную терапию, частота ремиссий и показатели выживаемости у женщин были достоверно выше, чем у мужчин, что вероятно и повлияло на результатах лечения данной группы.
В последующих двух рандомизированных исследованиях результаты лечения как мужчин, так и женщин не зависели от присутствия тамоксифена в составе режима «Dartmouth», а монотерапия дакарбазином по эффективности не уступала комбинации дакарбазин + тамоксифен (табл. 7). Соответственно был сделан вывод, что химиотерапевтические схемы с включением тамоксифена не имеют преимуществ.
И все же некоторые исследователи допускают, что у отдельных больных тамоксифен является активным компонентом противоопухолевой терапии, хотя при этом может и не оказывать существенного влияния на конечные результаты химиотерапии.
В конечном итоге, оценивая химиотерапевтические возможности при диссеминированной меланоме, может сложиться достаточно печальное представление о том, что мы так и не смогли добиться выразительных успехов в лечении данного заболевания. Тем не менее, нельзя забывать о наблюдаемых продолжительных ремиссиях у отдельных пациентов. В недавнем ретроспективном анализе результатов терапии больных, получавших режим «Dartmouth», 5–летняя выживаемость при полных ремиссиях достигла 33% (!) [22]. Возможно, что разрабатываемые в настоящее время более специфические иммунотерапевтические подходы (вакцинотерапия, генная терапия) позволят улучшить результаты и таким образом перевести диссеминированную меланому из разряда устойчивых опухолей в чувствительные.
1. Булат Ю.В. Современные возможности лекарственного лечения диссеминированной меланомы кожи. Дисс. . докт. мед.наук, 2000, стр. 189–195.
2. Avril MF, Bonneterre J, Cupissol D, et al. Fotemustine plus dacarbazine for malignant melanoma. Eur J Cancer 11, 1992:1807–18811.
3. Barth A., Wanek L., Morton D. Analysis of prognostic factors in 1521 patients with metastatic melanoma. Proc ASCO, 1995:1299.
4. Bleehen N.M., Newlands E.S., Lee S.M. et al. Cancer research campaign phase II trial of temozolomide in metastatic melanoma. – J. Clin. Oncol., 1995, 13, p. 910–913.
5. Buzaid AC, Legha S., Winn R. et al. Cisplatin, Vinblastin and Dacarbazine versus Dacarbazine alone in metastatic melanoma: preliminary results of a phase III Cancer Community Oncology Program (CCOP) trial. Proc ASCO, 1993, 1328.
6. Chapman P., Einhorn LH., Meyers M., et al. A Phase III Multicenter Randomized Trial of the Dartmouth regimen versus dacarbazine in patients with metastatic melanoma. J Clin Oncol 17, 1999: 2745–2751.
7. Cocconi G., Bella M., Calabresi F. et al. Treatment of metastatic malignant melanoma with dacarbazine plus tamoxifen. – N. Engl. J. Med., 1992, 327, p. 516–523.
8. Del Prete S.A., Maurer L.H., O(Donnell J. et al. Combination chemotherapy with cisplatin, carmustine, dacarbazine and tamoxifen in metastatic melanoma. – Cancer Treat. Rep., 1993, 68, p. 1403–1405.
9. Delaunay M, Mohr P, Mornex F, et al. A randomized phase III trial of fotemustine versus fotemustine combined with whole brain radiation for brain metastases of melanoma. Ninth international congress on anti–cancer treatment, abs.96, 1999.
10. Eton O, East M, et al. Phase I trial of subcutaneous recombinant human IL–2 in patients with metastatic melanoma. Proc Am Soc Clin Oncol, 1999, abst.2053.
11. Eton O, Legha S, Bedikian A, et al. Phase II randomized trial of cisplatin, vinblastine and dacarbazine plus IL–2 and INF versus CVD in patients with metastatic melanoma. Proc ASCO, V19, 2000, 2174 (abst).
12. Falkson C.I., Falkson G., Falkson H.C. Improved results with the addition of interferon alfa–2b to dacarbazine in the treatment of patients with metastatic malignant melanoma. – J.Clin.Oncol., 1991, 9, p.1403–1408.
13. Falkson C.I., Ibrahim J., Kirkwood J. et al. A randomized phase III trial of dacarbazine versus dacarbazine + interferon alfa–2b versus dacarbazine + tamoxifen versus dacarbazine + interferon alfa–2b + tamoxifen in metastatic malignant melanoma: an ECOG trial. J Clin Oncol, 1998, 16: 1743–1751.
14. Hoffman R., Muller I. et al.: Risk and outcome in metastatic malignant melanoma patients receiving DTIC, cisplatin, BCNU and tamoxifen followed by immunotherpy with interleukin–2 and interferon alpha2a. Brit J Cancer V78, 1998: 1076–1080.
15. Jacquillat C, Khayat D, Banzet P. et al. Final report on a french multicenter phase II study of the nitrosourea fotemustine in 153 evaluable patients with disseminated malignant melanoma including patients with cerebral metastases. Cancer 66, 1990:1873–1878.
16. Keilholz U, Cornelis J, Gore M, et al. Dacarbazine, cisplatin and interferon alpha with or without IL–2 in advanced melanoma: interim analysis of EORTC trial 18951. Pr. ASCO, V18, 1999: 2043 (abst).
17. Keilholz U, Goey S, Punt C, et al. Interferon alfa–2a and interleukin–2 with or witout cisplatin in metastatic melanoma: A randomized trial of the EORTC–MCG. J Clin Oncol 15, 1997: 2579–2588.
18. Lattanzi S.C., Tosteson T., Chertoff J. et al. Dacarbazine, cisplatin and carmustine, with or without tamoxifen, for metastatic melanoma: 5–year follow–up. – Melanoma Res, 1995, 5, p. 365–369.
19. Legha S.S., Ring S., Papadopoulos N. et al. A phase II trial of Taxol in metastatic melanoma. Cancer, 1990, 65, p. 2478–2481.
20. Lotze MT, Kirkwood JM. Current Cancer Therapeutics; 2–nd Edit. C Livingstone, 1996, 178–184.
21. Lotze M., Kirkwood J., et al. Cuteneous melanoma in DeVita V.T., Hellman S.A., Rosenberg S.A. (6th eds): Principles and Practice of Oncology, Philadelphia, Lippincott Co., 2001, p. 2012–2069.
22. Manola J, Ibrahim J, Atkins M, et al. Prognostic factors in metastatic melanoma: A pooled analysis of ECOG trials. Proc ASCO, V19, 2000: 2171 (abst).
23. Margolin K., Liu P–Y., Flaherty L. et al. Phase II stud of carmustine, DTIC, cisplatin and tamoxifen in advanced melanoma: a Southwest Oncology Group study. J Clin Oncol V16, 1998: 664–669.
24. Mastrangelo M.J., Bellet R.E., Berd D. Agressive chemotherapy for melanoma, in DeVita V.T., Hellman S.A., Rosenberg S.A. (eds): Principles and Practice of Oncology, Vol. 5(5), Philadelphia, Lippincott Co., 1991, p. 1–11.
25. McClay E.F., Mastrangelo M.J., Berd D. et al. Effective combination chemo/hormonal therapy for malignant melanoma: Experience with three consecutive trials. – Int. J. Cancer, 1992, 50, p. 553–556.
26. McClay E.F., McClay M.E., Albright K.A. et al. Tamoxifen modulation of cisplatin resistance in patients with metastatic melanoma: A biologically important observation. Cancer , 1993, 72, p. 1914–1918.
27. Richards J.M., Gilewski T.A., Ramming et al. Effective chemotherapy for melanoma after treatment with interleukin–2. – Cancer, 1992, 69, p. 427–429.
28. Ridolfi R, Romanini A, Labianca R, et al. Chemotherapy vs. Biochemotherapy: Phase III trial in outpatients with advanced melanoma. Proc ASCO, V20, 2001, 1392 (abst).
29. Ringborg U, Rudenstam C, Hansson J et al. Dacarbazine versus dacarbazine–vindezine in disseminated malignant melanoma: A randomized phase II study. Med. Oncol Tumor Pharmacother 6:285–289, 1989.
30. Rumke P., Kleeberg U.R., MacKie R.M. et al. Tamoxifen as a single agent for advanced melanoma in postmenopausal women. A phase II study of the EORTC malignant melanoma cooperative group. – Melanoma Res., 1992, 2, p. 153–155.
31. Rusthoven J.J., Quirt IC., Iscoe N.A. et al. Randomized, double–blind, placebo–controlled trial comparing the response rates of carmustine, dacarbazine and cisplatin with and without tamoxifen in patients with metastatic melanoma. J. Clin. Oncol., 1996, 14, p. 2083–2090.
32. Saba H.I, Klein C., Reintgen D. Management of advanced stage IV metastatic melanoma with a platinol based combination chemotherapy regiment: A University of South Florida and H. Lee Moffitt Melanoma Center study. Proc. ASCO, 1993, 397a.
33. Schultz M., Buzaid A.C., Poo W.J. A Phase II study of cisplatin, dacarbazine, carmustine, tamoxifen, and interferon–alpha 2B in metastatic melanoma. Melanoma Research 7, 1997: 147–151.
34. Seigler SA, Lucas VS, Pickett NJ et al.: DTIC, CCNU, Bleomycin and Vincristine in metastatic melanoma. Cancer 46, 1980: 2346–2348.
35. York R, Foltz A.: Bleomycine, vincristine, lomustine and DTIC chemotherapy for metastatic melanoma. Cancer 61: 2183–2186, 1989.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Материал и методы: проведен ретроспективный анализ историй болезни 53 больных с первичной МК. Группы разделены по возрасту на подгруппы. В 1-ю вошли 26 человек моложе 55 лет, средний возраст — 41,9±8,9 года (диапазон 26–54 года), из них 15 женщин и 11 мужчин; во 2-ю — 27 больных 55 лет и старше, средний возраст — 66,2±7,1 года (диапазон 55–82 года), из них 15 женщин и 12 мужчин. Анализировались подтвержденные данные анамнеза, клинического осмотра и физикального обследования, стандартной инструментальной диагностики и имеющаяся интеркуррентная патология.
Заключение: проведенный анализ позволит учитывать особенности клинического развития МК и способствовать ее ранней диагностике. Целесообразно углубленное изучение влияния характера интеркуррентной патологии на этиопатогенез МК.
Ключевые слова: меланома кожи, возраст больных, пол больных, анамнез, локализация, морфология.
Для цитирования: Розенко Л.Я., Франциянц Е.М., Гусарева М.А. и др. Клиническая характеристика больных меланомой кожи различных возрастных групп. РМЖ. Медицинское обозрение. 2020;4(3):137-142. DOI: 10.32364/2587-6821-2020-4-3-137-142.
L.Ya. Rozenko, E.M. Frantsiyants, M.A. Gusareva, M.S. Zin’kovich, N.G. Kosheleva,
E.O. Vasil’eva, Yu.N. Krokhmal’, A.K. Donskaya, A.A. Solntseva, N.B. Fat’kina
National Medical Research Centre for Oncology, Rostov-on-Don, Russian Federation
Aim: to identify specific clinical characteristics of patients with cutaneous melanoma of different gender and age.
Patients and Methods: retrospective analysis of medical records of 53 patients with primary cutaneous melanoma was performed. The patients were divided into two age groups. Group 1 included 26 patients under 55 years, mean age was 41.9±8.9 years (26–54 years), 15 women and 11 men. Group 2 included 27 patients older than 55 years, mean age 66.2±7.1 years (55–82 years), 15 women and 12 men. Confirmed anamnestic data, the results of clinical and physical examination and standard instrumental tests, and verified intercurrent diseases were analyzed.
Conclusion: our analysis provides the hallmarks of the clinical course of cutaneous melanoma and contributes to its early diagnosis. In-depth study of the effect of intercurrent diseases in terms of the etiology and pathogenesis of cutaneous melanoma is useful.
Keywords: cutaneous melanoma, age of patients, gender of patients, medical history, tumor site, morphology.
For citation: Rozenko L.Ya., Frantsiyants E.M., Gusareva M.A. et al. Clinical characteristics of cutaneous melanoma in patients of different age. Russian Medical Inquiry. 2020;4(3):137–142. DOI: 10.32364/2587-6821-2020-4-3-137-142.
Введение
Меланома кожи (МК), как и другие злокачественные опухоли, характеризуется повсеместным ростом заболеваемости. Так, в России на 2008 г. заболеваемость при этой патологии составила 42,6 на 100 тыс. населения с индексом накопления 8,2, а в 2018 г. установлен рост этих показателей до 64,1 и 9,2 соответственно. Общий и среднегодовой темп прироста заболеваемости у женщин составил 16,54% и 1,52%, у мужчин — 20,14% и 1,81%. В Ростовской области ежегодно имеет место превышение российских данных по заболеваемости МК. В частности, в период с 2008 по 2018 г. заболеваемость в нашем регионе выросла с 54,6 до 72,1 на 100 тыс. населения, а индекс накопления увеличился с 8,4 до 10,5 [1–3].
Ранее высказывалось мнение о зависимости частоты возникновения МК от возраста и о росте заболеваемости в молодом возрасте. Hoffman и Kuhn в 1985 г. привели данные о нарастании в ГДР в течение 1968–1975 гг. заболеваемости МК у лиц в возрасте 30–35 лет среди мужчин с 2,06 до 3,63, а среди женщин — с 1,93 до 3,30 на 100 тыс. населения [4].
В России в начале XXI в. подавляющее число больных регистрировалось в возрасте 40–50 лет [5–7]. При этом уменьшение частоты возникновения МК после 50 лет объяснялось снижением с возрастом активности меланостимулирующего гормона [8].
В 2016 г. подсчитано, что удельный вес больных с МК до 30 лет составил только 3,14%. Большинство заболевших (55–60%) были в возрасте 65 лет и старше. Средний возраст больных мужчин и женщин с выявленной МК — 60,5 и 61,4 года соответственно. В старших возрастных группах фиксировались наиболее высокие «грубые» показатели заболеваемости — от 20,86 до 24,24 на 100 тыс. населения, причем самые высокие — в возрасте 80–84 года (28,97 у мужчин и 22,52 у женщин) [9, 10]. Наблюдаемое с течением времени изменение состава больных МК по возрасту послужило основанием для проведения данного исследования.
Цель исследования: выявление особенностей клинической характеристики больных с МК, отличающихся по полу и возрасту.
Материал и методы
Проведен ретроспективный анализ историй болезни 53 больных (30 женщин и 23 мужчины) с впервые установленным диагнозом МК, получавших лечение в ФГБУ «НМИЦ онкологии» Минздрава России в период с 2016 по 2017 г. Критерием включения больных в исследование являлось наличие полной и подтвержденной информации по выбранным и анализируемым клиническим данным (анамнез, морфология, соматическая патология и др.). Распределение по группам проводилось по полу и возрасту. В 1-ю подгруппу вошли 26 человек моложе 55 лет (
Диагностические мероприятия включали тщательный сбор жалоб, анамнеза и данных физикального обследования с подтверждением интеркуррентной патологии. Инструментальная диагностика проводилась с использованием эпилюминесцентной микроскопии (дерматоскопия), пункционной биопсии, ультразвукового исследования регионарных лимфоузлов, спиральной рентгеновской компьютерной томографии органов грудной, брюшной полости и малого таза, по показаниям проводилась магнитно-резонансная томография головного мозга с внутривенным контрастированием. Стадирование процесса проводилось по системе UICC TNM (7-й пересмотр, 2009) [11].
Статистическую обработку полученных данных проводили с использованием пакета прикладных программ Statistica 6,0 (StatSoft, USA). Оценку значимости различий средних значений показателя осуществляли с использованием t-критерия Стьюдента для независимых выборок. Статистические гипотезы считали достоверными при уровне значимости р
Результаты исследования
Клиническая характеристика пациентов, вошедших в исследование, представлена в таблице 1. Соотношение мужчин и женщин в нашем исследовании было 1:1,3. Вместе с тем, по данным 1995 г., это соотношение находилось на уровне 1:2,05 [12], а в 2006 г. составляло 1:1,43 [7]. Эти данные могут явиться косвенным свидетельством увеличения заболеваемости МК среди мужчин.
Независимо от возраста женщин частота локализации очага МК на коже туловища составила 40% (12 из 30). Вместе с тем выявлено, что в возрастной группе ≥50 лет у 8 из 15 (53,3%) женщин очаг поражения развивался на коже туловища, т. е. возникал в 2 раза чаще, чем в возрасте
В.В Анисимов и соавт. в 1995 г. [12] на основе анализа 1334 больных МК пришли к заключению: «У женщин первичная МК статистически достоверно чаще, чем у мужчин, локализуется на лице, ягодицах и голени; у мужчин первичная опухоль статистически достоверно чаще, чем у женщин, локализуется на коже передней и боковой поверхностей грудной стенки, бедра, кистей, пяточной области и пальцев стопы». По данным
В.В. Поздняковой, в 2006 г. поражение кожи туловища у женщин без разделения по возрасту составляло 45 из 230 (19,5%), т. е. встречалось в 2 раза реже (р<0,05), чем в нашем исследовании [7].
Небольшая выборка нашего клинического материала не позволяет сделать однозначные выводы, однако в дальнейшем представляет определенный интерес анализ возможных причин выявленного различия в изменении характера локализации очага поражения у женщин с МК, различающихся по возрасту.
Существенных различий по стадиям процесса и гистологической структуре в сравниваемых подгруппах между больными в возрасте 3bN2M1а, b, при этом у 2 больных исходно была стадия M1а, у 1 пациента — метастазы в легкие. У 3 женщин (10%), в отличие от мужчин, было диагностировано поражение лимфоузлов без первично выявленного очага. Изъязвление опухоли в подгруппе
Заключение
Проведенный сравнительный анализ основных клинических критериев среди больных с МК, различающихся по полу и возрасту, свидетельствует об отсутствии кардинальных отличий, касающихся степени распространенности процесса по стадиям, гистологической структуре, с учетом данных о степени накопления пигмента, уровней инвазии или толщины опухолей.
Вместе с тем, по данным нашего небольшого по объему клинического материала, можно сделать определенное предварительное заключение. Так, при сравнении характера локализации МК было выявлено, что у женщин в возрасте
Установленный факт существенно более длительного анамнеза независимо от пола больных в возрасте ≥55 лет, явившегося возможной причиной увеличения количества случаев регионарного и отдаленного метастазирования у этих пациентов, несомненно, требует оптимизации мер по более эффективной и своевременной диагностике данного заболевания.
Заметные различия в частоте интеркуррентной патологии, с одной стороны, подтверждают «гормональную зависимость» возникновения МК кожи, с другой стороны, указывают на целесообразность более детального изучения характера сопутствующей патологии как этиопатогенетического фактора у больных в старшей возрастной группе.
Сведения об авторах:
Розенко Людмила Яковлевна — д.м.н., профессор, врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0001-7032-8595.
Гусарева Марина Александровна — к.м.н., заведующая отделением радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0002-9426-9662.
Зинькович Михаил Сергеевич — к.м.н., врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0003-3751-055X.
Кошелева Наталия Геннадьевна — врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0001-7630-1502.
Васильева Екатерина Олеговна — врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0001-9503-8295.
Крохмаль Юлия Николаевна — к.м.н., врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0002-3100-339X.
Донская Алия Катифовна — врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0001-7353-2807.
Солнцева Анна Анатольевна — к.м.н., врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0003-4052-3597.
About the authors:
Lyudmila Ya. Rozenko — Dr. of Sci. (Med.), Professor, radiotherapist of the Department of Radiation Therapy, National Medical Research Centre for Oncology. 63, 14 th Line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0001-7032-8595.
Elena M. Frantsiyants — Dr. of Sci. (Biol.), Deputy Director General for Science, National Medical Research Centre for Oncology. 63, 14 th Line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0002-5191-1758.
Marina A. Gusareva — Cand. of Sci. (Med.), Head of the Department of Radiation Therapy, National Medical Research Centre for Oncology. 63, 14 th Line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0002-9426-9662.
Mikhail S. Zin’kovich — Cand. of Sci. (Med.), radiotherapist of the Department of Radiation Therapy, National Medical Research Centre for Oncology. 63, 14 th Line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0003-3751-055X.
Nataliya G. Kosheleva — radiotherapist of the Department of Radiation Therapy, National Medical Research Centre for Oncology. 63, 14 th Line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0001-7630-1502.
Ekaterina O. Vasil’eva — radiotherapist of the Department of Radiation Therapy, National Medical Research Centre for Oncology. 63, 14 th Line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0001-9503-8295.
Yuliya N. Krokhmal’ — Cand. of Sci. (Med.), radiotherapist of the Department of Radiation Therapy, National Medical Research Centre for Oncology. 63, 14 th Line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0002-3100-339X.
Aliya K. Donskaya — radiotherapist of the Department of Radiation Therapy, National Medical Research Centre for Oncology. 63, 14 th Line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0001-7353-2807.
Anna A. Solntseva — Cand. of Sci. (Med.), radiotherapist of the Department of Radiation Therapy, National Medical Research Centre for Oncology. 63, 14 th Line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0003-4052-3597.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

