Дерматит преднизолон не помогает
Обновлено: 02.05.2024
В каких случаях проводится терапия глюкокортикоидами? Какие виды гормональной терапии используются? История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была изве
В каких случаях проводится терапия глюкокортикоидами?
Какие виды гормональной терапии используются?
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов ХХ столетия. Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году всем троим была присуждена Нобелевская премия за «. открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов».
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией — кортизон и гидрокортизон (кортизол), так и их синтезированные аналоги — преднизон, преднизолон, метилпреднизолон и др., включая галогенированные (фторированные) производные — триамцинолон, дексаметазон, бетаметазон и др. Широкий спектр физиологических и фармакологических эффектов глюкокортикоидов (адаптогенный, противовоспалительный, обезболивающий и жаропонижающий, неспецифический мембраностабилизирующий и противоотечный, противоаллергический и иммуносупрессивный, гематологический, гемодинамический и противошоковый, антитоксический, противорвотный и др.) делает эти препараты чуть ли не универсальными лекарственными средствами, и сегодня трудно найти такое патологическое состояние, при котором на том или ином этапе развития они не были бы показаны. Среди показаний в первую очередь можно выделить так называемые ревматические заболевания, болезни почек, крови, аллергические заболевания, трансплантации, ургентные состояния.
В зависимости от цели различаются три варианта терапии ГКС; при этом любая из них может быть как ургентной, так и плановой.
- Заместительная терапия, проводимая при надпочечниковой недостаточности, должна имитировать как базальную секрецию надпочечников и ее суточный ритм, так и ее усиление при стрессе; при этом используемые дозы близки к суточной секреции гормона. Здесь предпочтительнее применять естественный гормон — гидрокортизон (солу кортеф), обладающий глюкокортикоидной и определенной минералокортикоидной активностью, в дозе от 20-25 до 30-37,5 мг в сутки. При незначительном выпадении минералокортикоидной функции (небольшие потери соли) бывает достаточно его одного. При выраженной потере соли или при использовании эквивалентных доз преднизолона (от 5 до 7,5 мг), который может оказаться более эффективным, добавляется кортикостероид с выраженной минерало- и некоторой глюкокортикостероидной активностью — флудрокортизон (кортинефф, кортеф). На практике применяются те минимальные дозы, которые обеспечивают хорошее самочувствие и работоспособность, нормальный уровень АД и электролитов крови. При стрессе доза гидрокортизона может достигать 250-300 мг в сутки. Для имитации ритма секреции 2/3 дозы назначаются в 8 часов и 1/3 — в 16.
- При блокирующей (подавляющей) терапии используется эффект, чаще всего рассматриваемый как побочный, — блокада оси гипоталамус-гипофиз-кора надпочечников (ГГКН). Так, при терапии адреногенитального синдрома вводимые извне ГКС кроме заместительной выполняют и блокирующую функцию в отношении гиперсекреции АКТГ и андрогенов. ГКС подавляют и секрецию ТТГ, что наряду со снижением уровня тиреоидсвязывающего глобулина и торможением конверсии Т4 в Т3 уменьшает тиреоидную активность и используется при лечении тиреотоксических кризов. Наиболее активно ось ГГКН подавляется естественными ГКС или препаратами с длительным тканевым периодом полураспада (фторированные гормоны — дексаметазон, бетаметазон); при этом применяются как физиологические, так и более высокие (фармакодинамические) дозы.
- Большинство показаний к фармакодинамической терапии базируются на одной особенности ГКС — уникальном сочетании противовоспалительного и иммунодепрессивного эффектов. Это сочетание лежит в основе традиционных представлений о том, что так называемые ревматические болезни, где воспаление является следствием иммунопатологического процесса, служат чуть ли не абсолютным показанием к ее проведению.
В отличие от плановой терапии применение ГКС в ургентных ситуациях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяются при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного).
Из-за обилия побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при назначении минимальных доз, величина которых определяется заболеванием и не зависит от массы тела и возраста; доза корректируется в соответствии с индивидуальной реакцией. Приняты две принципиально разные схемы назначения ГКС:
- начиная с наименьшей возможной дозы, увеличивают ее при недостаточном эффекте до оптимальной; при этом возникает опасность увеличения сроков лечения, потери эффективности и развития побочного действия;
- начиная с максимальных суточных доз, их снижают после получения клинического эффекта; при этом достигается скорейший эффект, уменьшаются длительность лечения и суммарная доза ГКС.
В зависимости от суточной дозы (в пересчете на преднизолон) и длительности применения ГКС принято выделять несколько видов терапии, имеющих различные показания:
- в ситуациях, непосредственно угрожающих жизни, назначается интенсивная терапия сверхвысокими (до 500–4000 мг внутривенно) или средними/высокими (25–150 мг внутрь) дозами (пероральная доза преднизолона эквивалентна примерно 1/6 внутривенной) — такая терапия может проводиться несколько дней и не требует постепенной отмены;
- при тяжелых обострениях или при хроническом течении тяжелых заболеваний (лейкозы, некоторые коллагенозы, гемолитическая анемия, тромбоцитопении) проводится лимитированная терапия, ограниченная неделями при использовании внутрь высоких доз (80–200 мг) и неделями или месяцами в случае применения средних доз (25–60 мг); максимальные дозы, назначаемые вначале, по мере улучшения состояния ступенчато уменьшаются с последующим переходом на поддерживающие;
- при ряде хронических заболеваний (бронхиальная астма, ревматоидный артрит) проводится длительная терапия низкими дозами (до 10 мг), однако дозы менее 5 мг скорее всего являются лишь заместительными и дают клинический эффект только при атрофии коры надпочечников, индуцированной длительной глюкокортикоидной терапией.
Результат терапии ГКС зависит не только от дозы, но и от режима дозирования. Наиболее перспективными можно считать прерывистые схемы применения, когда за счет увеличения суточной дозы препарат принимается не каждый день. Самой эффективной представляется внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной. Значительно более безопасным должен быть признан режим «мини-пульс», который, однако, уступает по эффективности пульс-терапии. Столь же эффективно назначение умеренной/высокой дозы, разделенной на несколько приемов; но по безопасности этот режим уступает «мини-пульсу». Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного назначения умеренной/высокой дозы; первый из них безопаснее и по этому критерию приближается к «мини-пульсу». Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 — днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Важной проблемой терапии ГКС является выбор препарата. Фармакокинетические и фармакодинамические свойства ГКС, включая их побочные эффекты, существенно различаются у отдельных препаратов (табл. 1, табл. 2). Приняв за единицу выраженность различных эффектов гидрокортизона, можно получить количественные характеристики активности отдельных препаратов. При сравнении ГКС чаще всего анализируется противовоспалительное действие этих препаратов, в соответствии с которым и рассчитывается эквивалентная пероральная доза, снижающаяся по мере увеличения противовоспалительной активности. Ее возрастание, параллельное увеличению длительности действия отдельных ГКС, сопровождается уменьшением минералокортикоидной активности, которой у метилпреднизолона (солу-медрола) и фторированных соединений вообще можно пренебречь.
Соотношение терапевтического и побочных эффектов позволяет утверждать, что в настоящее время препаратом выбора для длительной и пожизненной терапии является метилпреднизолон (солу-медрол). В настоящий момент солу-медрол широко используется в лечении аутоиммунных заболеваний, в трансплантологии и интенсивной терапии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных категориях в оптимальных дозировках.
Вторым по эффективности препаратом остается в большинстве случаев преднизолон. Во многих же ургентных ситуациях определенными достоинствами обладают фторированные соединения: дексаметазон (дексазон, дексона) и бетаметазон (целестон, дипроспан). Однако в случае неотложной терапии, при которой противовоспалительное действие не играет ведущей роли, сравнительная оценка эффективности и безопасности различных препаратов весьма затруднительна по крайней мере по двум причинам:
- соотносить эффективность и безопасность различных препаратов можно только на основе их эквивалентных доз. Между тем, если для различных побочных эффектов отдельных ГКС имеются характеристики относительной активности, из всех лечебных эффектов сравнивается только противовоспалительный, в соответствии с которым и рассчитывается эквивалентная доза;
- о соотношении доз при пероральном и парентеральном применении конкретных препаратов отсутствуют однозначные данные даже тогда, когда речь идет о противовоспалительном эффекте, не говоря уже о других лечебных или побочных свойствах.
В связи с вышеуказанными трудностями была предложена условная эквивалентная единица (УЭЕ), за которую принимаются минимальные эффективные дозы. Показано, что выраженные в УЭЕ максимальные суточные эффективные дозы фторированных ГКС (дексаметазона и бетаметазона) в пять раз меньше, чем у негалогенированных препаратов. Это обеспечивает не только более высокую эффективность и безопасность данной группы препаратов, назначаемых в определенных ситуациях, но и их фармакоэкономические преимущества.
Как бы тщательно ни проводился выбор препарата, режима дозирования и вида терапии, полностью предотвратить развитие тех или иных побочных эффектов при применении ГКС не удается. Характер побочных реакций может зависеть от ряда причин (табл. 3).
Вероятность и выраженность подавления оси ГГКН с развитием вначале функциональной недостаточности, а позже и атрофии коры надпочечников определяются дозой и длительностью терапии. Прекращение глюкокортикоидной терапии почти всегда сопряжено с угрозой развития острой надпочечниковой недостаточности.
Частым побочным действием ГКС оказываются инфекционные осложнения, которые в этом случае протекают атипично, что связано с противовоспалительной, аналгетической и жаропонижающей активностью этих средств. Это затрудняет своевременную диагностику и требует проведения ряда профилактических мероприятий. Из-за склонности к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии эти осложнения становятся особенно грозными. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Между тем желудочный дискомфорт, тошнота, другие диспепсические жалобы на фоне приема ГКС чаще не связаны с поражением слизистой. Экзогенный синдром Кушинга как осложнение терапии ГКС встречается далеко не всегда, однако отдельные нарушения метаболизма, гормональной регуляции и деятельности тех или иных систем развиваются почти во всех случаях глюкокортикоидной терапии.
С сожалением приходится отметить, что утверждение Е. М. Тареева, назвавшего терапию ГКС трудной, сложной и опасной, до сих пор справедливо. Как писал Тареев, такую терапию гораздо легче начать, чем прекратить. Однако ответственный подход к лечению позволяет значительно повысить его безопасность. Это достигается благодаря строгому учету противопоказаний (абсолютных среди которых нет) и побочных эффектов ГКС (оценка отношения «ожидаемый эффект/предполагаемый риск»), а также проведению «терапии прикрытия» в группах риска (антибактериальные препараты при хронических очагах инфекции, коррекция доз сахароснижающих средств или переход на инсулин при сахарном диабете и др.). Особое место при длительном применении ГКС занимает метаболическая терапия, которая проводится в целях предупреждения и коррекции нарушений электролитного обмена и катаболических процессов в первую очередь в миокарде (дистрофия) и костной ткани (остеопороз). Однако наиболее надежным путем обеспечения безопасности терапии ГКС остается соблюдение основного принципа клинической фармакологии и фармакотерапии — назначение лечения по строгим показаниям.
В. В. Городецкий, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Назначили дексаметазон в ампулах. - Эффективность при тяжелой аллергии
Наверняка всем известно, что от внешних чужеродных агентов наш организм защищает иммунная система. В норме она эффективно распознает, связывает и уничтожает или выводит из организма любые потенциально опасные высокомолекулярные вещества и микроорганизмы. Однако в некоторых случаях этот страж внутренней среды организма "сходит с ума" и начинает атаковать собственные органы и ткани, приводя нередко к тяжелейшим нарушениям. Этот механизм лежит в основе аллергических и аутоиммунных заболеваний и таких стрессовых для организма состояниях как шок различного происхождения. В такой ситуации необходимо применение, иногда экстренное, препаратов, способных уменьшать активность иммунной системы. Одним из наиболее активных лекарственных веществ этой группы является Дексаметазон.
Данный препарат выпускается во многих лекарственных формах, наиболее быстро оказывает необходимый эффект раствор для инъекций в ампулах. Как правило, выделяют две группы показателей для инъекционного введения Дексаметазона: экстренные - при тяжелых состояниях, угрожающих жизни человека, таких как анафилактический и другие виды шока, отек Квинке, астматический бронхоспазм, и плановые или терапевтические - инъекции Дексаметазона назначаются в виде курса лечения, как правило короткого, после которого рекомендуется переходить на прием препаратов в таблетированной форме.
При экстренном применении раствора Дексаметазона препарат вводят внутривенно с очень низкой скоростью. Действующее вещество этого лекарственного средства представляет собой аналог стероидных гормонов коры надпочечников, известных своим свойством тормозить развитие иммунных реакций. В случае тяжелых аллергических реакций инъекция Дексаметазона останавливает патологический иммунный ответ и, как следствие, уменьшает проявление эффектов воспаления, и самое главное отек (особенно отек гортани, развитие которого может привести к асфиксии и смерти). В случае экстренного лечения шока какого-либо происхождения проявляется еще одно занимательное свойство этого гормонального препарата - он способен усиливать выделение адреналина.
При шоковом состоянии происходит резкое падение артериального давления и коллапс, но адреналин, выделяющийся сразу после внутривенного вливания Дексаметазона, сужает кровеносные сосуды, повышая тем самым артериальное давление и предотвращая развитие тяжелых осложнений.
В других случаях свойства этого препарата (противовоспалительное, противоотечное, антиаллергическое) используются не для выведения человека из критического состояния, а для лечения некоторых заболеваний. На первом месте стоит лечение все тех же аллергических заболеваний, хоть и менее тяжелых, но достаточно неприятных - атопического дерматита у детей, экземе, тяжелого аллергического насморка. Как правило, курс инъекций Дексаметазона в этом случае кратковременный и призван снять остроту процесса, после чего человека переводят на менее сильные препараты.
Также курс инъекций прописывается при астматическом статусе - осложнении бронхиальной астмы, когда бронхоспазмы и приступы идут одним за другим, мучая человека и иногда даже угрожая его жизни. При лечении аллергических заболеваний раствор Дексаметазона вводиться внутримышечно, дозировку и длительность курса определяется врачом.
Другой группой заболеваний, в лечении которых могут использоваться инъекции этого препарата, являются инфекционно-аллергические патологии - состояния, когда иммунная система помимо болезнетворных микроорганизмов атакует и собственные ткани, широко известным заболеванием этой группы является ревматизм. Дексаметазон чаще всего используется для лечения ревматоидного артрита - заболевания, поражающего различные суставы, вызывающего разрушение суставного хряща и впоследствии деформацию и ограничение подвижности в суставе. Эта патология имеет хроническое течение, в период обострений возникают сильные боли в области пораженного сустава, его покраснение и опухание.
Дексаметазон весьма эффективен при этом заболевании, но только в случае его внутрисуставного введения. Понятно, что неспециалист не сможет сделать такую сложную процедуру, поэтому внутрисуставные инъекции производятся только при стационарном или амбулаторном лечении. Другим распространенным инфекционно-аллергическим заболеванием является гломерулонефрит. При отсутствии лечения эта патология прогрессирует и приводит к хронической почечной недостаточности. Применение раствора Дексаметазона замедляет развитие заболевания и препятствует разрастанию рубцовой соединительной ткани в паренхиме почек.
Естественно, что такой активный гормональный препарат имеет побочные эффекты и противопоказания. К нежелательным эффектам относят - подавление функции надпочечников, угнетение иммунитета, нарушение баланса половых гормонов (причем как у мужчин, так и у женщин). Противопоказаниями являются беременность, кормление грудью, заболевания эндокринной системы (феохромоцитома, тиреотоксикоз, сахарный диабет), тяжелые заболевания сердечно-сосудистой системы и печени, резко сниженный иммунитет (при ВИЧ-инфекции, состоянии после лучевой терапии).
- Вернуться в оглавление раздела "фармакология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Назначили преднизолон мазь от зуда и воспаления кожи. - Отзывы и побочные эффекты
Среди огромного спектра заболеваний человека особое место занимают заболевания кожи. Это связано с тем, что кожа является внешним покровом организма и любые патологические изменения на ней сразу заметны всем окружающим. Кроме того, как правило, кожные заболевания сопровождаются весьма неприятными симптомами - кожным зудом, отеком, покраснением, выделением экссудата (например, при мокнущих высыпаниях). Поэтому абсолютно понятна необходимость в использовании препарата, который хотя бы ослабит эти проявления. Чаще всего для этого применяют преднизолоновую мазь.
Преднизолон по своей химической структуре относится к группе гормональных соединений - кортикостероидов. Данная группа веществ способна уменьшать действие иммунной системы на собственные ткани и патологические агенты. Именно поэтому преднизолоновая мазь (где содержание преднизолона 0,5 % или, проще говоря, в 1 грамме мази содержится 5 миллиграмм преднизолона) и оказывает противовоспалительное, антиотечное, противозудное действие. Проникая во все слои кожи, преднизолон снижает синтез биологически активных веществ (гистамина, серотонина) путем уменьшения количества клеток, которые их выделяют - тканевых базофилов.
Этим же самым устраняются и эффекты аллергии и проявляются противоаллергические свойства преднизолона - за развитие реакции гиперчувствительности отвечают именно базофилы. Кроме того, у данного лекарственного вещества есть и еще один интересный эффект - он снижает синтез нуклеиновых кислот в клетках кожи (в том числе и ДНК), тем самым препятствуя чрезмерному размножению клеток соединительной ткани. Это тормозит излишнее разрастание рубцовых изменений кожи (послеоперационных шрамов). Также небольшая доля преднизолона проникает в кровь и разносится по всему организму.

Применяют преднизолоновую мазь при кожных заболеваниях, которые не вызваны различными микроорганизмами - при атопическом и себорейном дерматитах, экземе, нейродермите, псориаз, эритродермия. Также ее применяют для сохранения волосняного покрова при этих заболеваниях. Наносят мазь тонким слоем на пораженные участки кожи 2-3 раза в день. Курс лечения обычно не составляет более двух недель - при длительном использовании возможно нарушение местного иммунитета кожи, кроме того проявляются явления и общего характера - результат попадания преднизолона в системный кровоток.
В связи с тем, что преднизолоновая мазь, как и другие препараты преднизолона, снижают реактивность иммунной системы и являются серьезными гормональными препаратами, их должен назначать только врач. С иммуносупрессивным действием преднизолона связаны и его противопоказания - его нельзя использовать при инфекционных поражениях кожи. Особую опасность вызывает применение преднизолоновой мази при таких заболеваниях, как сифилитические и туберкулезные поражения кожи, вирусные инфекции кожи (опоясывающий лишай, ветряная оспа, герпетические поражения), гнойничковые заболевания кожных покровов. Кроме того, в связи с тем, что преднизолон проникает в кровь и способен проходить через плаценту и в грудное молоко, противопоказано применение преднизолоновой мази при беременности и кормлению грудью.
Являясь довольно активным гормональным препаратом преднизолон имеет и достаточно много побочных эффектов. Чаще всего они возникают при длительном и неконтролируемом применении мази, при эпизодическом использовании препарат хорошо переносится. К побочным эффектам относится нарушение кожного иммунитета с последующим присоединением вирусной, грибковой или бактериальной инфекции, появление на коже участков атрофии (в следствие повышенного распада белков кожи), появление растяжек и кровоизлияний на коже - последствия дистрофии коллагеновых волокон.
Может изменяться и картина пигментации кожи - появление участков как повышенной, так и пониженной окраски. Кроме того, локально могут появится участки повышенного оволоснения (результат гормонального действия преднизолона) и замедление заживления повреждений кожи (из-за нарушения белкового обмена в клетках эпидермиса). Также нельзя забывать и про системное действие преднизолона при длительном использовании его мази (может произойти общее снижение иммунитета).
В целом, можно сказать, что преднизолоновая мазь - это весьма эффективный препарат для лечения неинфекционных заболеваний кожи. Но как и любое гормональное лекарственное средство, его должен назначать врач. При правильном применении преднизолоновая мазь снизит проявление заболевания и сохранит красоту вашей кожи.
- Вернуться в оглавление раздела "фармакология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лечение преднизолоном и другими глюкокортикоидами
Кора надпочечников синтезирует глюкокортикоид кортизол (гидрокортизон) в пучковой зоне и минералокоргикоид альдостерон в клубочковой зоне. Оба стероидных гормона жизненно необходимы для адаптации в ответ на стрессовые ситуации (заболевание, травма или операция). Секреция кортизола стимулируется АКТГ, секреция альдостерона — ангиотензином II.
В печени кортизол активирует глюконеогенез из аминокислот и защищает организм от гипогликемии, если питание отсутствует в течение длительного времени и истощены запасы гликогена. Кроме того, он предотвращает избыточные воспалительные реакции. Альдостерон стимулирует реабсорбцию Na + , Cl - и Н2O в почках, что препятствует уменьшению объема внеклеточной жидкости.
а) Заместительная терапия преднизолоном и другими глюкокортикоидами. При недостаточности надпочечников (первичная надпочечниковая недостаточность, болезнь Аддисона) необходима замещающая терапия как кортизолом, так и альдостероном. При дефиците продукции АКТГ (вторичная недостаточность надпочечников) необходимо заменить только кортизол. Кортизол эффективен при введении внутрь (30 мг/сут, 2/3 утром и 1/3 вечером).
В стрессовых ситуациях дозу увеличивают в 5-10 раз. Альдостерон неэффективен при пероральном введении, поэтому вместо минералокорти-коида вводят флудрокортизон (0,1 мг/сут).
б) Фармакодинамическая терапия глюкокортикоидами. В нефизиологических высоких концентрациях кортизол и другие глюкокортикоиды подавляют все фазы (экссудация, пролиферация, образование рубца) воспалительной реакции. В развитии данного эффекта участвует несколько компонентов, в т. ч. изменения в транскрипции гена.
Во-первых, комплекс рецептора глюкокортикоида действует как фактор транскрипции для стимуляции экспрессии определенных противовоспалительных генов (липокортин, который ингибирует фосфолипазу А2). Во-вторых, комплекс может захватыватьдругие факторы транскрипции, которые фактически ответственны за продукцию провоспалительных белков. Это влияет на синтез нескольких белков, которые участвуют в воспалительном процессе, в т. ч. интерлейкинов и других цитокинов, фосфолипазы А2 и ЦОГ-2. В очень высокой дозе могут развиться негеномные эффекты через рецепторы, связанные с мембраной
Желательные эффекты. Как противоаллергические, иммуносупрессивные или противовоспалительные препараты глюкокортикоиды очень эффективны против нежелательных воспалительных реакций (аллергии, аутоиммунных заболеваний и т. д.).
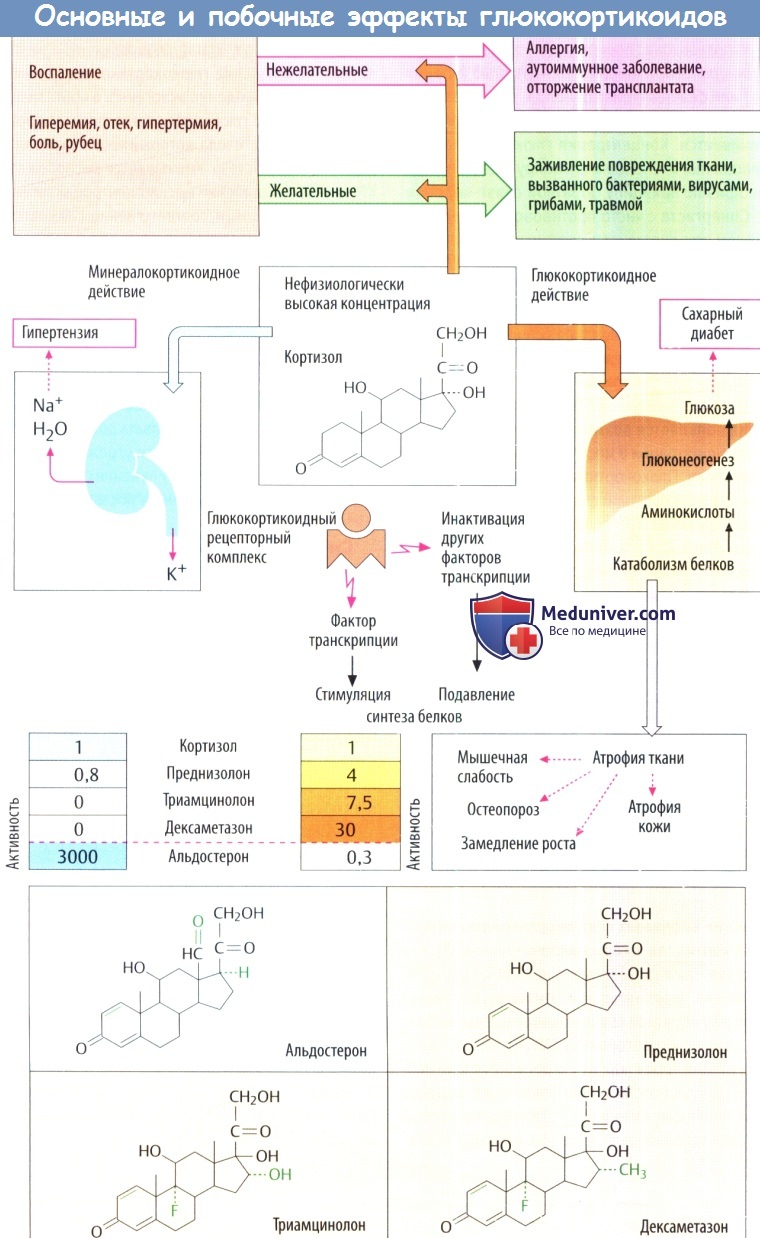
Нежелательные эффекты. При кратковременном системном использовании у глюкокортикоидов практически отсутствуют нежелательные эффекты даже в максимальной дозе. Длительное использование, вероятно, вызывает изменения, аналогичные синдрому Кушинга (эндогенная гиперпродукция кортизола). В результате противовоспалительного действия снижается резистентность к инфекции и замедляется заживление ран. К последствиям избыточного действия глюкокортикоидов относятся:
а) повышенный глюконеогенез и высвобождение глюкозы, инсулинзависимое превращение глюкозы в триглицериды (ожирение в основном заметно на лице, шее и туловище) и «стероидный диабет» при недостаточном высвобождении инсулина;
б) повышенный катаболизм белков с атрофией скелетных мышц (худые конечности), остеопороз, задержка роста детей и атрофии кожи. К последствиям слабого, но все же заметного минералокортикоидного действия кортизола отнсосятся задержка солей и жидкости, гипертензия, отек и потеря KCI с риском гипокалиемии. При длительном применении глюкокортикоидов следует помнить о психических расстройствах, которые проявляются в основном в виде колебаний настроения от эйфории до мании.
Меры по ослаблению или профилактике ятрогенного синдрома Кушинга:
1. Использование производных кортизола с меньшей минералокортикоидной активностью (преднизолон) или без нее (триамцинолон, дексаметазон). Глюкокортикоидная активность этих синергистов увеличивается. Концентрация глюкокортикоидов, противовоспалительное и ингибирующее влияние на гипофиз по принципу обратной связи коррелируют. Синергиста с чисто противовоспалительным действием не существует. Связанных с глюкокортикоидами кушингоподобных симптомов избежать невозможно.
На рисунке ниже показана относительная активность в сравнении с кортизолом, минералокортикоидная и глюкокортикоидная активность которого соответствуют 1.0. Все перечисленные глюкокортикоиды эффективны при приеме внутрь.
2. Местное применение. При таком способе применения появляется возможность создать эффективные концентрации в месте введения без системного действия. Глюкокортикоиды, которые подвергаются быстрой биотрансформации и инактивации после диффузии из места действия, являются препаратами выбора. Следовательно, ингаляционным путем вводятся глюкокортикоиды, которые в большом количестве выводятся до попадания в общий кровоток (беклометазона дипропионат, будесонид, флунизолид или флутиказона пропионат).
Тем не менее встречаются также местные побочные эффекты: при ингаляции — кандидоз ротоглотки (свободный рост Candida в результате местной иммуносупрессии) и охриплость голоса (вероятно, из-за повреждения мышцы голосовой связки): при накожном использовании — атрофия кожи, стрии, телеангиэктазии и стероидное акне; при закапывании в глаза — катаракта и повышенное внутриглазное давление (глаукома).
3. Минимальная возможная доза. При длительном лечении вводят только необходимую дозу.
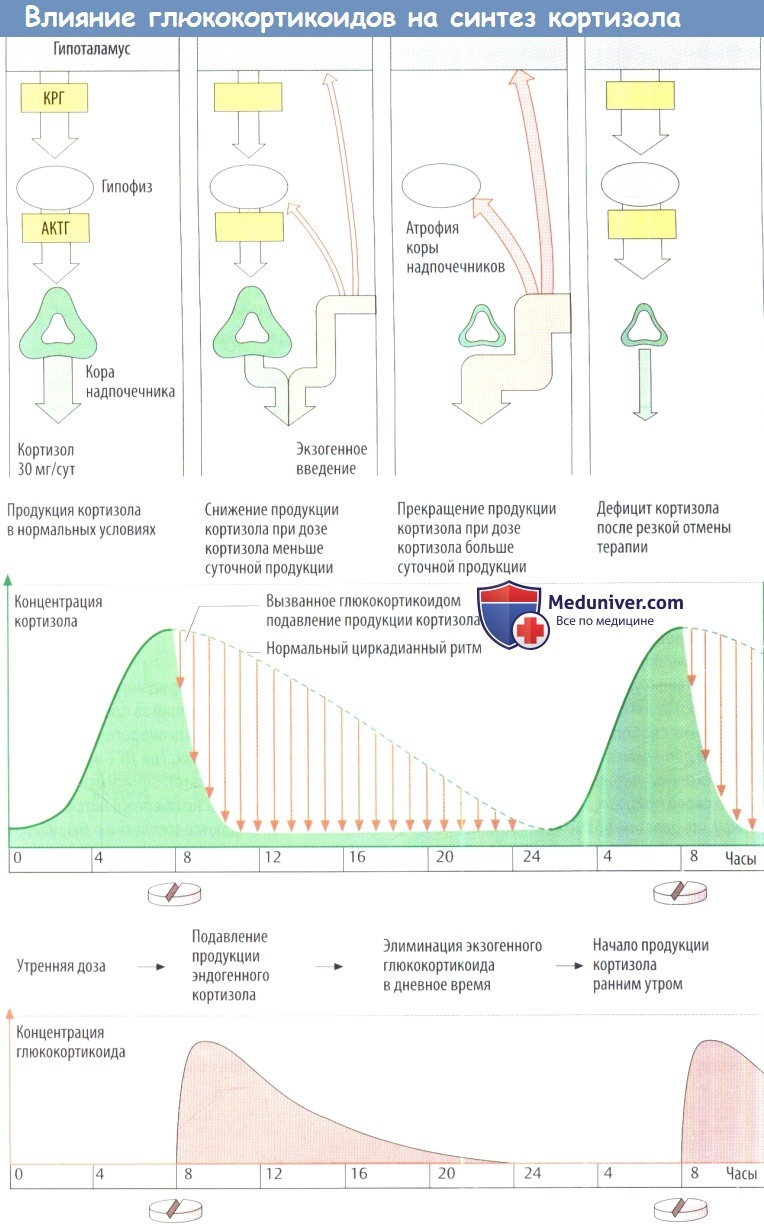
Влияние вводимых глюкокортикоидов на продукцию кортизола в коре надпочечников. Как в гипофизе, так и гипоталамусе находятся рецепторы кортизола, через которые кортизол осуществляет по принципу обратной связи подавление высвобождения регулирующих гормонов (АКТГ и КРГ). С помощью этих рецепторов кортизола регулирующие центры контролируют соответствие фактического уровня в крови заданному значению. Если уровень в крови превышает заданное значение, то выход АКТГ и, следовательно, продукция кортизола снижаются. Таким способом поддерживается необходимая концентрация кортизола.
Управляющие центры реагируют на синтетические глюкокортикоиды, так же как и на кортизол. Введение экзогенного кортизола или любого другого глюкокортикоида снижает уровень эндогенного кортизола, который необходим для поддержания гомеостаза. Уменьшается высвобождение КРГ и АКТГ (подавление высших центров экзогенным глюкокортикоидом) и, соответственно, снижается секреция кортизола (супрессия коры надпочечников). При нефизиологически высоких дозах глюкокортикоидов в течение нескольких недель уменьшаются продуцирующие кортизол участки коркового вещества надпочечников (атрофия коры надпочечников).
Тем не менее способность к синтезу альдостерона не изменяется. Если неожиданно прекратить введение глюкокортикоидного препарата, то атрофированная кора не сможет продуцировать достаточное количество кортизола и разовьется угрожающий жизни дефицит кортизола. Поэтомулечение глюкокортикоидами следует всегда отменять постепенно.
Схемы для профилактики атрофии коры надпочечников. Уровень секреции кортизола высокий ранним утром и низкий поздним вечером (циркадианный ритм). Соответственно, чувствительность к подавлению по принципу обратной связи должна быть высокой поздним вечером. Если развилась атрофия коры надпочечников или способность к синтезу кортизола (повышение в 10 раз при стрессе в сравнении с уровнем в покое) не восстановилась после постепенной отмены, необходимо ввести глюкокортикоид, чтобы компенсировать тяжелый физический стресс (большая операция).
1. Системное применение глюкокортикоидов с учетом циркадианных ритмов. Суточная доза глюкокортикоида вводится утром. Продукция эндогенного кортизола уже началась, а центры регулирования относительно нечувствительны к подавлению. В ранние утренние часы следующего дня происходит высвобождение КРГ/АКТГ и стимуляция коры надпочечников.
2. Пульс-терапия. Двойная суточная доза вводится утром через день. В промежуточный день происходит продукция эндогенного кортизола.
Недостатком обеих схем является рецидив симптомов заболевания в интервале без введения глюкокортикоида.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В последнее время аллергические заболевания занимают одну из лидирующих позиций среди заболеваний детского возраста и представляют собой чрезвычайно важную медико-социальную проблему.
В последнее время аллергические заболевания занимают одну из лидирующих позиций среди заболеваний детского возраста и представляют собой чрезвычайно важную медико-социальную проблему. В ряду этих заболеваний одно из главных мест занимает аллергическая патология кожи, представленная в основном атопическим дерматитом (АД), имеющим постоянную тенденцию к росту распространенности и развитию более тяжелых форм болезни [1, 2]. Несмотря на большие успехи, достигнутые в области изучения особенностей возникновения и развития АД у детей, не удается предотвратить формирование тяжелых форм заболевания, приводящих к ухудшению качества жизни и инвалидизации больного ребенка (табл.) [3].
Лечение детей с тяжелыми формами АД представляет собой сложную задачу. Связано это не только с клиническим полиморфизмом заболевания и вовлечением в патологический процесс различных органов и систем, но и с ранним тяжелым дебютом АД (в первые месяцы жизни), когда выбор врача ограничен определенным количеством применяемых в этом возрасте лекарственных средств, способных купировать симптомы заболевания. Серьезная ситуация сложилась в последнее время, когда несмотря на наличие опубликованных программ и согласительных документов, созданных для улучшения качества оказания медицинской помощи больным с АД, врач не всегда достаточно информирован о принципах лечения тяжелых форм этого заболевания. Все это ведет к неадекватной терапии АД, снижающей качество жизни больных детей и их родителей [4–7].
Лечение тяжелых форм АД строится по определенному плану. Характерной особенностью терапии является перемещение акцента с наружной терапии в сторону проведения системной фармакотерапии, что отличает его от терапевтической тактики для легких и среднетяжелых форм, где проведение наружной терапии рассматривается как первая линия лечения [3, 5, 7, 9]. Использование при тяжелом течении АД наружной терапии, играющей важную роль в разрешении локализованного воспалительного процесса, вне рамок комплексного лечения, при отсутствии фармакологического контроля ведет к прогрессированию АД и ухудшению состояния больного ребенка [8].
Терапия тяжелых форм атопического дерматита у детей и подростков
- Диетотерапия.
- Системная фармакотерапия (системные глюкокортикостероиды (ГКС), антигистаминные препараты, энтеросорбенты).
- Наружная терапия (антисептическая терапия, ГКС-препараты, нестероидные средства).
- Плазмаферез.
- Иммуносупрессивная терапия (Циклоспорин А).
- Противорецидивная терапия (кетотифен, кромоны, косметические средства).
В настоящей статье мы остановимся на некоторых вопросах тактики проведения системной фармакотерапии при тяжелом течении АД, которая включает в себя назначение системных стероидов, антигистаминных препаратов и, при резистентном к традиционной терапии течении болезни, - иммуносупрессивных препаратов и плазмафереза.
Системная фармакотерапия
ГКС. Необходимость использования противовоспалительного лечения системными ГКС продиктована тяжестью течения заболевания и развитием патологических состояний, которые требуют активных вмешательств. Известно, что ГКС обладают выраженным противовоспалительным и иммуносупрессивным эффектами, способствующими разрешению аллергического воспаления в эффекторных зонах. Фактически ГКС проявляют свое действие после проникновения в ядро клетки, где они связываются со специфическими рецепторами, расположенными не в наружной мембране клетки, а в цитоплазме. В фармакологических концентрациях системное действие ГКС связано с ингибированием биосинтеза IL-1, 3, 4, 5, 8, TNF-альфа, GM-CSF, что приводит к купированию воспалительного процесса, зависящего от этих цитокинов, а также с подавлением образования фосфолипазы А2 и циклооксигеназы 2-го типа, являющихся субстратами для синтеза простогландинов и лейкотриенов. ГКС способны ингибировать экспрессию молекул межклеточной адгезии, приводя к снижению экстравазии лейкоцитов в очаги воспаления. И что особенно важно для купирования аллергического воспаления, ГКС могут индуцировать апоптоз, т. е. элиминировать из организма активированные лимфоциты и тем самым останавливать деструктивный компонент иммунного ответа. Связывают это с возможностью ГКС индуцировать в активированных лимфоцитах и эозинофилах эндонуклеазы, разрушающие ДНК в межнуклеосомных участках, что заканчивается апоптозом клетки [10].
Назначение ГКС при тяжелых формах АД в настоящее время никем не оспаривается [3, 5, 7, 11, 13]. В случаях, когда невозможно добиться контроля над течением АД с использованием оптимальной наружной терапии в период тяжелого обострения болезни, альтернативы системным ГКС нет. Чаще всего вопрос об их назначении встает тогда, когда поражено более чем 20% поверхности кожи.
За большой период времени накоплен положительный опыт применения системных ГКС при тяжелых формах АД [3, 5, 7, 11, 13]. Назначают ГКС коротким курсом (в течение 5–7 дней) из-за опасности развития серьезных побочных эффектов: задержки роста, подавления функции гипоталамо-гипофиз-надпочечниковой системы, артериальной гипертензии, катаракты, остеопороза и других [5, 11, 14].
Лечение системными ГКС детей и подростков с тяжелым течением АД проводят в дозе, не превышающей 1,5 мг на 1 кг веса тела ребенка, однократно, путем парентерального (внутримышечного) введения. В редких случаях системные ГКС назначают перорально, обычно решение использовать такой метод лечения принимает консилиум специалистов [3–5, 9]. В таких случаях доза преднизолона составляет 1 мг/кг/сут, что позволяет добиться максимального противовоспалительного и иммуносупрессивного эффекта. С одной стороны, необходимо достаточно быстро достигнуть ремиссии АД, с другой стороны, исключить риск возникновения серьезных побочных эффектов как в период проведения лечения, так и после прекращения назначения системного лечения. Преднизолон назначается в максимальной дозе на 5 дней с последующим резким снижением суточной дозы на 50% на 6-й день, далее на 50% оставшейся суточной дозы на 9-й день лечения с постепенной отменой гормональной терапии в течение недели. Таким образом, полный курс лечения составляет 18 дней. Вся суточная доза преднизолона принимается утром, что минимизирует гипоталамо-гипофизарную надпочечниковую супрессию, имитируя нормальный ритм выброса гормонов корой надпочечников.
Мы имеем опыт эффективного применения системных ГКС (парентеральное внутримышечное введение в дозе (по преднизолону) не превышающей 1,5 мг/кг/сут в течение 5–7 дней) у больных в период обострения АД тяжелого течения. В анамнезе у всех пациентов, несмотря на проведение комплексного лечения, включающего в себя назначение наружной терапии ГКС, антигистаминных препаратов, достигнуть клинической ремиссии заболевания не удавалось. Лечение было эффективно у всех больных. В большинстве случаев, при назначении после проведенного лечения оптимальной противорецидивной терапии (косметические средства, кромоны, антигистаминные препараты нового поколения), клиническая ремиссия АД продолжалась более 10 месяцев. Было обращено внимание на то, что всем больным с лихеноидной формой заболевания из-за отсутствия продолжительной ремиссии АД в дальнейшем была назначена иммуносупрессивная терапия Циклоспорином А [15].
Антигистаминные препараты давно и широко используются при лечении АД, занимая определенное место в комплексном лечении этого заболевания, особенно при тяжелом его течении [3, 5, 16].
В последнее время дискутируется вопрос о возможности использования антигистаминных препаратов первого (или старого, что идентично) поколения в лечебной практике. Связано это не только с недостаточной эффективностью и с наличием у этих препаратов побочных эффектов из-за возможного их влияния на мускариновые, серотониновые и адренергические рецепторы, но и c опасностью их передозировки. Так, в США и Канаде планируется запретить безрецептурный доступ к этим препаратам для всех возрастных групп населения из-за использования их в криминальных ситуациях (суицид и убийство), а также запрет назначения их детям до 6-месячного возраста или ограничение применения этих препаратов для детей до 6-летнего возраста [17].
В то же время за продолжительный период существования этих препаратов на фармацевтическом рынке (с середины прошлого века) накоплен богатый положительный опыт. Бесспорно, назначение их больным в период обострения АД является патогенетически обоснованным. Наличие у этих препаратов лекарственной формы для парентерального введения и седативного действия, улучшающего сон ребенка, страдающего от интенсивного зуда, позволяет использовать их у детей с тяжелыми обострениями заболевания, особенно в раннем возрасте. Препараты этой группы, наряду с антигистаминной, обладают антисеротониновой активностью, анаболическим действием и разрешены детям, начиная с первого месяца жизни. Обычно рекомендуют непродолжительные курсы лечения (до 14 дней) в период обострения АД [3, 5, 7, 16].
При лечении АД также часто используются антигистаминные препараты второго поколения и их метаболиты, не вызывающие сонливости и не влияющие на моторную функцию и когнитивные способности. Их применение ограничивается возрастом больного (некоторые только с 2-летнего возраста). Несмотря на то, что препараты этой группы, не проникая через гемоэнцефалический барьер, не вызывают седативного эффекта, плацебо-контролируемые клинические исследования цетиризина показали более низкий седативный эффект в сравнении его с препаратами старого поколения и высокий в сравнении с препаратами своей группы. В связи с этим цетиризин сейчас расценивается как лекарственное средство, обладающее седативным действием, что также ограничивает его применение [18]. Имеются сведения о предупреждении атопического марша у детей раннего возраста с отягощенным семейным анамнезом по аллергическим заболеваниям, длительно принимающих цетиризин. Однако в исследовании только у 50% наблюдаемых детей с АД, имеющих сенсибилизацию к аэроаллергенам, удалось предотвратить развитие астмы. Таким образом, эти данные не позволяют широко предлагать такой вариант предупреждения развития других аллергических заболеваний [19].
Иногда в случаях тяжелого течения АД, когда не удается предупредить очередное тяжелое обострение заболевания, приходится прибегать к более серьезным вариантам терапии, таким как плазмаферез и иммуносупрессивное лечение.
Плазмаферез рекомендован больным с тяжелыми формами АД с резистентным к проводимой терапии течением. Используется этот метод лечения редко из-за опасности развития анафилактического шока при введении белковых растворов. Обычно рекомендуют удалять за сеанс 30–40% объема циркулирующей плазмы, проводить три сеанса на курс один раз в 4 дня, замещение плазмы производить белковыми растворами [20].
Иммунносупрессивная терапия показана также в случаях, когда исчерпаны все возможности традиционной терапии тяжелых форм АД при непрерывно-рецидивирующем течении заболевания. Из препаратов этой группы сегодня рассматривают два: циклоспорин и азатиоприн. Системная иммуносупрессивная терапия чаще всего проводится Циклоспорином А. Азатиоприн используется в основном у взрослых, а в некоторых странах (не в России) — у детей. Применение иммуносупрессивного лечения, направленного на восстановление нормального соотношения Тh1- и Th2-лимфоцитов, позволяет устранить нарушенный баланс в продукции Т-лимфоцитами ИЛ-4 и ИНФ-гамма, приводящий к значительному повышению уровня IgE. Терапия циклоспорином и азатиоприном проводится только больным с рефрактерным течением болезни под наблюдением специалистов, способных контролировать риск возникновения побочных эффектов [21–23].
Азатиоприн — хорошо известный иммуносупрессант — широко используется в Англии. Действие препарата направлено на нарушение синтеза нуклеиновых кислот. Препарат может использоваться как монотерапия при АД. Имеется большое количество открытых, неконтролируемых и ретроспективных исследований, демонстрирующих эффективность азатиоприна при лечении этого заболевания. Ряд побочных эффектов, включающих в себя миелосупрессию, повышение восприимчивости к инфекции, риск развития рака кожи, ограничивает его использование в педиатрической практике. Перед назначением азатиоприна и во время лечения необходимо исследовать тиопурин метилтрансферазу, так как этот фермент участвует в метаболизме азатиоприна. Рекомендованная доза от 1 до 3 мг/кг в сутки связана с уровнем исследуемого фермента. Эффективность лечения оценивается между 2-м и 3-м месяцем лечения [24]. Из-за возможности серьезных побочных эффектов в России азатиоприн не рекомендован для лечения АД.
Циклоспорин А относится к группе лекарственных веществ, для которых критически значимым является правильный выбор дозы препарата. Связано это с низким терапевтическим индексом Циклоспорина А, при котором токсическая концентрация препарата близка к терапевтической. Даже небольшое повышение концентрации Циклоспорина А в крови при неадекватном лечении приводит к нежелательным побочным эффектам, угрожающим жизни больного [25]. В то же время низкие дозы препарата не обладают достаточным терапевтическим эффектом, что может дискредитировать этот метод лечения [21]. Из-за множественных взаимодействий с препаратами, способными снижать и повышать концентрацию Циклоспорина А в крови, конкурируяза пути метаболизма в печени, врач должен постоянно контролировать любые дополнительные терапевтические вмешательства, оценивая возможные риски лечения [26].
Основные побочные эффекты лечения Циклоспорином А сводятся к нефротоксичности и повышению артериального давления. Опасность возникновения нежелательных последствий иммуносупрессивного лечения возрастает при назначении высоких доз препарата и при увеличении длительности терапии. В то же время Циклоспорин А лишен многих угрожающих жизни побочных эффектов, таких как рак кожи, гепатотоксичность, задержка роста, характерных для других методов лечения тяжелых форм АД [27].
Описывая возможную продолжительность лечения, все авторы сходятся во мнении, что минимальный курс терапии составляет 6 недель, максимальный — 12 месяцев. При оценке зависимости эффективности лечения от длительности курса в зарубежных источниках сделан вывод о том, что при коротком курсе лечения эффективность выше, чем при длительном лечении. Отмечено, что после достижения максимального эффекта на 6–10 неделе лечения в дальнейшем, при продолжении терапии, существенного изменения в состоянии больных уже не отмечается, в то же время после прекращения терапии Циклоспорином А обострение заболевания возникает в сроки от 2 до 5 месяцев с момента прекращения приема препарата [31, 33–35].
В нашей стране об опыте использования Циклоспорина А при лечении детей и взрослых с тяжелыми формами АД сообщено в работах Кочергина Н. Г. с соавт. (1999) [34], Короткого Н. Г. с соавт. (2003) [35] и Кудрявцевой А. В. с соавт. (2009) [36].
В работе [34] опубликованы данные о лечении 25 детей в возрасте от 9 до 13 лет. Среднесуточная доза Циклоспорина А составила 3 мг/кг, продолжительность лечения 4–6 недель. Отмечено, что иммуносупрессивная терапия Циклоспорином А была эффективней у детей по сравнению с взрослыми, больными АД. Так, клиническая ремиссия и значительное улучшение было достигнуто у 72% больных детского возраста в сравнении с 60,7% у взрослых. Сделан вывод об эффективности, безопасности и хорошей переносимости лечения Циклоспорином А, проводимого детям с тяжелым течением АД.
В работе [35] сообщается об опыте лечения 21 больного в возрасте 5–10 лет, курс лечения 6 недель. Отмечена высокая эффективность терапии при редких случаях развития побочных эффектов.
В нашей работе [36] были опубликованы данные об эффективности лечения Циклоспорином А больных с тяжелым течением АД с максимальной продолжительностью терапии 8 месяцев и суточной дозой от 2,3 до 4,5 мг/кг. Сделан вывод о необходимости рекомендовать этот вариант лечения детям и подросткам c тяжелыми формами заболевания, предупреждая развитие побочных эффектов под контролем специалистов, имеющих опыт проведения иммуносупрессивного лечения.
На основании накопленного опыта лечения тяжелых форм АД был разработан алгоритм проведения системной фармакотерапии в период обострения АД, основой которого являются противовоспалительная терапия, проводимая системными стероидами или Циклоспорином А и назначение антигистаминных препаратов первого поколения. Отмечено, что больным с лихеноидной формой заболевания Циклоспорин А назначают уже на первом этапе лечения, в то время как при эритематосквамозной форме и эритематосквамозной форме с лихенизацией Циклоспорин А назначают только при неэффективности системной стероидной терапии в рамках комплексного лечения (рис.).
В работе Сидоренко О. А., Короткого Н. Г. (2008) описано успешное использование тимодепрессина при лечении тяжелых форм АД, который назначали по 1 мл парентерально ежедневно в течение 5 дней, после 2-дневного перерыва повторяли курс, при тяжелом течении дополнительно проводили интраназальное введение препарата по 1 мл в течение 10 дней. Отмечена высокая клиническая эффективность лечения без побочных эффектов и осложнений [37].
Использование микофенолата мофетила, иммуносупрессора, подавляющего пролиферативный ответ Т- и В-лимфоцитов; рекомбинантных человеческих моноклональных антител (анти-TNF-альфа, анти-IL-5, анти-IgE) и других патогенетически обоснованных методов лечения в будущем, возможно, позволит повысить эффективность лечения АД, не приводя к серьезным негативным последствиям на фоне этой терапии для растущего организма больного ребенка [40–42].
В заключение можно сказать, что как за рубежом, так и в нашей стране накоплен достаточный опыт терапии тяжелых форм АД. Правильное использование комплексного патогенетически обоснованного лечения будет способствовать улучшению качества жизни больного ребенка и его семьи.
Читайте также:

