Что включает в себя защитный кожный барьер
Обновлено: 05.05.2024
Кожа человека состоит из трех основных слоев: наружный слой эпидермис, дерма и гиподерма. Защитный барьер кожи формируют три составляющих:
- Роговой слой — наружный слой эпидермиса, на поверхности которого скапливаются омертвевшие клетки кожи.
- Гидролипидная мантия — тончайшая пленка, которая состоит из клеток кожи кератиноцитов. Они «склеены» между собой липидами трех видов: свободными жирными кислотами, холестеролом и церамидами. Пленка буквально «прячет» под собой роговой слой, создавая дополнительную защиту.
- Микробиом кожи — совокупность микроорганизмов, при котором баланс «хороших» бактерий должен превышать концентрацию «плохих».
ПРИЧИНЫ ОСЛАБЛЕНИЯ ЗАЩИТНОГО БАРЬЕРА КОЖИ
«Солнечные лучи, загрязненный воздух, бытовая химия, косметика, стресс и синий свет от гаджетов — все это может привести к ослаблению защитного барьера кожи, — объясняет Виктория Клишко, врач-косметолог и сооснователь клиники Institute Beauty. — Эти факторы влияют на нашу гормональную, эндокринную, нервную и половую системы, а значит, отражаются и на состоянии кожи. Чаще всего реагировать будет атопичная, чувствительная, сухая кожа».
Но есть кое-что пострашнее ослабленного защитного барьера — поврежденный. В чем отличие? Если при ослаблении защитной функции кожа может не подавать никаких сигналов, то при повреждении она становится гиперчувствительной, раздраженной и обезвоженной . Нарушается выполнение ее главной функции – защиты. На коже может появиться ощущение жжения и зуда, она может краснеть после нанесения привычных средств ухода, шелушиться и оставлять ощущение стянутости.
Зачастую главной причиной повреждения становимся мы сами, а точнее, наши действия в гонке за безупречностью . Гиперочищение и слишком сложный многоэтапный уход с помощью большого количества косметических средств.
ОСНОВНЫЕ ОШИБКИ В УХОДЕ ЗА КОЖЕЙ, КОТОРЫЕ ВЕДУТ К ОСЛАБЛЕНИЮ ЗАЩИТНОГО БАРЬЕРА
«Уход за кожей может как улучшать ее состояние, так и ухудшать его. Когда мы используем средства, проникающие в кожу, это подразумевает изменение ее состояния. Как компоненты косметики, так и наши действия способные повлиять на состояние рогового слоя, от которого зависит барьерная функция», — говорит Тийна Орасмяэ-Медер, врач-косметолог, разработчик бренда Meder Beauty Science.
ОШИБКА №1:
СЛИШКОМ ИНТЕНСИВНЫЙ УХОД ЗА КОЖЕЙ
Активные компоненты, например ретинол или кислоты, творят чудеса с нашей кожей. Однако стоит помнить, что они это делают за счет разрушения верхних слоев рогового слоя, поэтому использовать все сразу не рекомендуем.
«Иногда такое воздействие на защитный барьер действительно необходимо, чтобы выровнять и осветлить тон. Однако после курса интенсивной терапии назначают специальные средства, восстанавливающие защитные функции кожи», – объясняет Тийна Орасмяэ-Медер.
КАК ПРАВИЛЬНО:
Не перегружайте кожу множеством продуктов, даже если они обещают помочь. Вводите активные компоненты постепенно, начиная с одного раза в неделю и наблюдайте за реакцией. И да, не стоит за один сеанс ухода скрабировать кожу, наносить кислотный пилинг и «закрывать» все сывороткой с витамином С.
При использовании активных компонентов в бьюти-рутине не забывайте про деликатное очищение, глубокое восстановление и качественное увлажнение. Компоненты, которые справятся с обезвоженностью и стянутостью за счет образования тонкой пленки на коже и сохранению влаги внутри:
ОШИБКА №2:
ЕЖЕДНЕВНОЕ ОТШЕЛУШИВАНИЕ
Помочь отмершим клеткам рогового слоя покинуть поверхность кожи не возбраняется, но злоупотреблять этим не стоит. «Ежедневное отшелушивание лишает кожу естественной жировой смазки, провоцирует воспаления и вызывает раздражение, потому что мы снова повреждаем роговой слой кожи до того, как он успевает восстановиться», — говорит в одном из своих интервью Джоанна Варгас, звездный косметолог и создательница бренда Joanna Vargas. Количество отшелушивающих процедур зависит от типа кожи и используемого продукта.
КАК ПРАВИЛЬНО:
Отдавайте предпочтение мягким гоммажам, средствам с PHA- или AHA-кислотами либо с фруктовыми энзимами, а также энзимным пудрам. Все эти продукты мягко уберут ороговевшие клетки, не повреждая защитный барьер. Пользуйтесь ими аккуратно — распределяйте по лицу без лишнего трения, применяйте без фанатизма: один-два раза в неделю для тонкой чувствительной кожи, два-три раза для жирной и плотной.
ОТ НЕКОТОРЫХ СРЕДСТВ СТОИТ ОТКАЗАТЬСЯ СОВСЕМ:
- Скрабы для лица с жесткими абразивными частицами из абрикосовых косточек, скорлупы грецких орехов или кофейных зерен.
- Грубые спонжи для очищения лица. Они истончают кожу, нарушают микробиом и оставляют микроповреждения.
- Химические пилингис высоким содержанием кислот . При неправильно подобранной концентрации и несоблюдении мер предосторожности есть риск получить ожог и разрушить защитный барьер.
ОШИБКА №3:
ОЧИЩЕНИЕ «ДО СКРИПА»
Кажется, что, если после умывания присутствует ощущение «чистоты до скрипа», мы все сделали правильно — теперь кожа свободна от косметики и загрязнений. На самом деле нет: средства для глубоко очищения (обычно они предназначены для жирного типа) могут содержать спирт, бензоил пероксид и жесткие ПАВ.
«Поверхностно-активные вещества, которые используют в таких средствах для умывания, избавляют кожу не только от омертвевших клеток и загрязнений, но и от липидов защитной мантии эпидермиса», — объясняет Тийна Орасмяэ-Медер.
КАК ПРАВИЛЬНО:
Используйте мягкое средство для умывания. Это может быть пенка или гель с нейтральным кислотно-щелочным балансом, без отдушек и скрабирующих частиц. Первое время можно умываться теплой водой, если кожа остро реагирует даже на самые деликатные средства очищения.
СРЕДСТВА ДЛЯ ВОССТАНОВЛЕНИЯ ЗАЩИТНОГО БАРЬЕРА КОЖИ
Избегайте новых средств с незнакомыми компонентами, только если их не назначил дерматолог или косметолог, оценив состояние кожи. Вот ингредиенты, которые помогут:
- Антиоксиданты борются со свободными радикалами, которые разрушают здоровые структуры кожи.
- Ниацинамид усиливает синтез церамидов, незаменимых для здоровья рогового слоя.
- Мочевина препятствует размножению патогенных бактерий, препятствующих восстановлению защитного барьера.
- Пребиотики стимулируют рост микроорганизмов, необходимых для здорового микробиома кожи.
- Пробиотики снижают чувствительность кожи и увлажняют ее.
- Церамиды, согласно данным исследований, ускоряют восстановление защитного барьера кожи, избавляют от стянутости и зуда.
ВЫБОР BURO.: ТОП СРЕДСТВ ДЛЯ ВОССТАНОВЛЕНИЯ ЗАЩИТНОГО БАРЬЕРА КОЖИ
Формула с оливковым скваланом, маслами макадамии, кунжута, бурачника, вечерней примулы, семян дикой моркови восстанавливает защитную мантию кожи после первого же применения. Также в составе — антиоксиданты бета-каротин, витамины С и Е.
Густой питательный бальзам на основе пантенола в концентрации 5% успокаивает кожу, снимает раздражение и зуд, защищает. Не содержит ланолина, парабенов и парфюмерных отдушек.
Помогает коже усилить защитные функции и противостоять влиянию негативных внешних факторов за счет комплекса антиоксидантов, в который входят витамины С и Е, феруловая кислота и экстракт расторопши.
Для сухой и чувствительной кожи — крем с жирными кислотами омега-3, 6, 9, глицерином, маслом крамбе и протеинами риса. Образует на поверхности невесомую защитную пленку, оберегая от потери влаги и воздействия агрессивных факторов окружающей среды.
Защитные качества крема с насыщенной текстурой и скваланом в составе проверили альпинисты во время экспедиции в Гренландию в 2005-м. С тех пор средство стало бестселлером и особенно хорошо проявляет себя в холодное время года.
Гидролипидная мантия кожи – одна из составляющих эпидермального барьера кожи.
Здоровье кожи в широком смысле этого слова – её качество, цвет, тонус, увлажненность и т.п. – напрямую зависит от состояния эпидермального барьера. Многие дерматологические проблемы возникают именно из-за «брешей» в его работе.
Нарушения функции и дефекты в этом барьере неизбежно провоцируют проникновение чужеродных микробов и аллергенов в кожу, активируют дегидратацию эпидермиса и вызывают сухость кожи, повышают её чувствительность к различным воздействиям окружающей среды.
Что же такое эпидермальный барьер
Кожа – самый большой орган человеческого тела. Она составляет почти 18% общего веса человека.
В составе кожи три основных слоя:
- 1. Самый глубокий - гиподерма или подкожно-жировая клетчатка;
- 2. Средний – дерма. В ней расположены основные каркасные белки – коллаген и эластин;
- 3. Верхний слой кожи - эпидермис состоит из четырёх слоёв и постоянно обновляется.
Кожа выполняет несколько очень важных для организма и самой кожи функций. При этом, основную - защитную функцию обеспечивает эпидермис.
Именно самый верхний слой кожи - эпидермис является своего рода барьером, защищающим ее от агрессивных атак множества микроорганизмов и аллергенов, внешних механических и химических воздействий, потери влаги – сохраняет коже увлажнение.
Эпидермальный барьер состоит из:
- Гидролипидной мантии, укрывающей поверхность кожи;
- Липидо-эпидермального барьера.
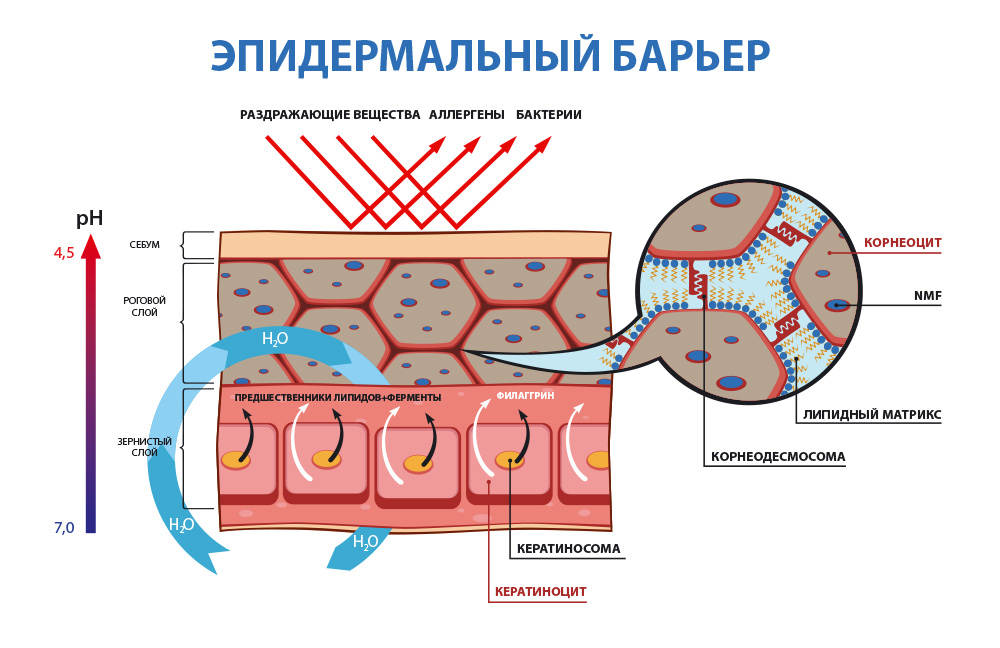
1. Гидролипидная или водно-жировая мантия
- это, некая, невидимая глазу пленка на поверхности кожи, которая образуется из смеси отслоившихся роговых чешуек, пота, кожного сала, а также органических кислот и микрофлоры.
Главная функциональная особенность гидролипидной мантии здоровой кожи человека - её кислая среда - pH от 4,7 до 5,7. (Для справки: кислотная среда pH 0 - 6,9; нейтральный pH – 7; щелочная среда pH 7,1 – 14).
Благодаря наличию кислой среды, в которой перестают размножаться и погибают вредоносные бактериии, гидролипидная мантия является самым первым звеном защиты кожи от большинства чужеродных микроорганизмов и агентов.
Свой вклад в формирование кислой среды на поверхности кожи вносят с одной стороны, органические кислоты - молочная, лимонная и другие, которые образуются в результате биохимических и метаболических процессов, протекающих в эпидермисе. С другой стороны, кислый pH гидролипидной мантии помогает поддерживать жизнедеятельность полезных бактерий - Staphylococcus epidermidis и лактобактерий, которые постоянно живут на коже и составляют её микробиоту.
Кислотность гидролипидной мантии может нарушаться в ту или иную сторону по разным причинам (будет описано ниже). Например, при грибковых заболеваниях рН возрастает до 6, при экземе до 6,5; при угревой болезни защелачивается до 7.
Повреждённая гидро-липидная мантия кожи восстанавливается самостоятельно при правильном очищении, грамотном уходе и защите.
2. Липидо-эпидермальный барьер
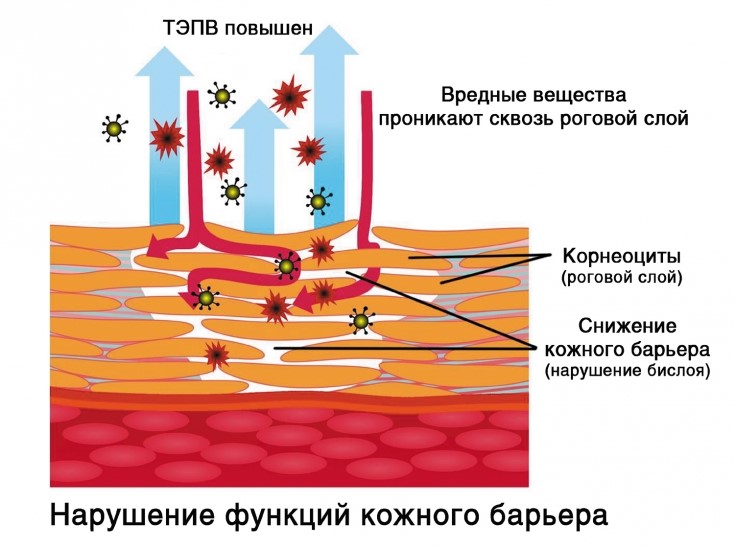
– основной защитный барьер кожи. Находясь непосредственно в эпидермисе, он защищает организм и кожу от обезвоживания путем механизма транс-эпидермальной потери влаги (ТЭПВ), а также является вторым звеном защиты после гидролипидной мантии от проникновения в кожу патологических бактерий и аллергенов, различных химических соединений.
Основу липидо-эпидермального барьера составляют три вида липидов — церамиды, свободные жирные кислоты и холестерин.
Механизм ТЭПВ. По большому счету кожа увлажняется изнутри – то есть из глубоких слоёв гиподермы и дермы вода поступает к эпидермису, липиды удерживают воду в эпидермисе, обеспечивая его увлажненность. Повреждённый липидо-эпидермальный барьер является главной причиной неадекватной трансэпидермальной потери влаги и в результате сухости кожи. Поэтому, чтобы обеспечить хорошую увлажненность кожи, необходимо в первую очередь восстановить липидный барьер.
Кроме того, бреши в липидо-эпидермальном барьере приводят не только к обезвоженности кожи, но и к её повышенной чувствительности, аллергическим реакциям, раздражениям и кожным заболеваниям.
Незначительные повреждения липидо-эпидермального барьера клетки кожи восстанавливают сами. В случае выраженных нарушений – им необходимо помочь. В первую очередь это процедуры регулярного увлажнения, правильного ухода за поверхностью кожи и дермы, здоровый образ жизни и сбалансированное питание.
Внешние проявления, связанные с повреждением гидролипидной мантии
- Периодические или постоянные ощущения стянутости кожи, вызывающие дискомфорт; сухость и шелушение кожи даже в условиях привычного ухода;
- Выраженная гиперчувствительность и реакция кожи различные атмосферные явления: на ветер, солнце, мороз,
- Повышенная чувствительность кожи при применении очищающих и уходовых средств;
- Периодическое появление раздражений и покраснений, зудящих красных пятен; перманентные дерматиты.
Наличие вышеперечисленных проблем – повод обратиться к дерматологу.
Факторы, повреждающие кожные барьеры
Применение при очищении кожи мыла, умывалок и др., содержащих ПАВы и щелочи; частое использование обезжиривающих и спиртовых тоников.
Щелочи и ПАВы, присутствующие в большинстве очищающих средств нарушают кислый pН гидролипидной мантии. В результате водно-жировая мантия разрушается. Открываются входные ворота для чужеродных бактерий. Повреждается липидный барьер, вода активно начинает испаряться с поверхности кожи, вызывая её сухость.
Здоровый эпидермальный барьер — залог красивого вида любого типа кожи — жирной, проблемной, сухой, чувствительной и даже увядающей.
Сохранение и восстановление эпидермального барьера один их самых ключевых принципов в профессиональных программах по уходу за любым типом кожи и омолаживающих врачебных процедурах, а также домашнего хода за кожей.
Методы восстановления и сохранения барьеров кожи
Адекватное очищение кожи.
Домашний уход. Важно правильно определить с профессиональным дерматологом свой тип кожи и использовать ежедневно очищающие средства, которые соответствуют вашему типу кожи, не нарушая при этом эпидермальный барьер.
Профессиональный уход. В условиях клиники – проведение грамотно подобранных процедур очищения и эксфолиации кожи и соблюдения режима их выполнения: химического пилинга, и лазерного пилинга,ручной чистки лица с учётом вашего типа кожи и решаемых проблем.
Регулярное увлажнение.
Домашний уход. Ежедневно наносите на кожу увлажняющие кремы и периодически маски, содержащие компоненты, удерживающие влагу: аминокислоты, гиалуроновую кислоту, коллаген, эластин, алое вера и др. Плюс, как это ни банально, пейте адекватное количество чистой воды.
Профессиональный уход в условиях клиники. Регулярно (курсами 2 раза в год) проводите процедуры биоревитализации, биорепарации, мезотерапии
Профессиональный уход в условиях клиники. При повреждении кожи и развитии патологической флоры, например при угревой болезни – применение различных медикаментозных препаратов, назначенных врачом, а также лечение акне на лазерной установке Fotona с целью инактивации патологической флоры, уменьшения воспалительного процесса и улучшения трофики тканей.
Сбалансированное питание и уход.
Домашний уход. Ежедневно используйте питательные крема, соответствующие вашему типу кожи, возрасту и времени сезона года, чередуйте их с увлажняющими средствами. Отдавайте предпочтение средствам, содержащим церамиды, липосомы и жирные кислоты – они защищают и восстанавливают повреждённый липидный слой.
Употребляйте в пищу продукты, богатые омега 3 и омега 6 жирными кислотами. Не исключайте из рациона масла и жиры.
Постоянная защита.
Не используйте скрабы и избегайте сильного механического воздействия. Применяйте средства, содержащие в своём составе плёнкообразующие компоненты — коллаген, эластин, воска, силиконы, ланолин, парафин - руки. Регулярно наносите на кожу солнцезащитные крема при выходе на улицу, особенно летом.
Подводим итоги
Здоровье кожи напрямую зависит от целостности и нормального функционирования эпидермального барьера, основу которого составляет гидро-липидная мантия и липидо-эпидермальный барьер.
Сверху эпидермальный барьер «окутан» в гидролипидную мантию. Важно бережно относиться к ней и не повреждать её. Она первая «встречает» патогенные микробы и агенты, препятствуя их проникновению вглубь кожи.
Повреждение липидо-эпидермального барьера и гидролипидной мантии является серьёзной проблемой для кожи. Как правило, это приводит к обезвоживанию эпидермиса, появлению сухости, повышенной чувствительности, раздражениям, может спровоцировать и поддерживать кожные заболевания и др.
Нарушенный эпидермальный барьер можно восстановить, если правильно подобрать домашний уход, а также проводить профессиональные процедуры у косметолога. Сбалансированный уход за кожей и правильный образ жизни обеспечат защиту, увлажнение и восстановление кожи.
Поделитесь со знакомыми и друзьями:
В представленной статье обобщены современные данные о строении и функции эпидермального барьера, рассмотрены вопросы его роли в развитии атопического дерматита.
This article summarizes current data on the structure and function of the epidermal barrier, we also considered its role in development of atopic dermatitis.
С тех пор как наземная жизнь стала угрожать млекопитающим обезвоживанием, все более становятся актуальными исследования структурных, клеточных, биохимических и регуляторных механизмов организма, участвующих в поддержании гомеостаза проницаемости эпидермального барьера [1].
Кожа обеспечивает жизненно важную функцию, защищая позвоночных от повседневных и экстремальных влияний факторов внешней среды, таких как воздействие антигенов, ультрафиолетового света, моющих средств, микроорганизмов, токсинов, наночастиц и иных повреждений [2]. Таким образом, эпидермальный барьер, являясь физическим барьером [3], обеспечивает защиту организма на границе двух сред, ограничивая как потерю воды из организма, так и попадание патогенных микроорганизмов в организм [4].
Важнейшая составная часть эпидермального барьера, от которой зависит проникновение раздражителей и аллергенов, находится в нижней части рогового слоя [5]. Несмотря на минимальные размеры (толщина около 7–35 мкм), он играет определяющую роль в формировании защитного барьера и способствует предотвращению чрезкожного проникновения патогенов. Кроме роли физического барьера, роговой слой участвует в терморегуляции, газообмене, гидратации, обеспечении врожденного иммунитета, а создавая определенную pH поверхности кожи (слегка кислую), обеспечивает дополнительную защиту от болезнетворных микроорганизмов [6].
Во время терминальной дифференцировки кератиноциты зернистого слоя «заменяют» свою клеточную мембрану на нерастворимый белковый слой — роговую оболочку [7]. Она придает прочность корнеоцитам и является «платформой» для прикрепления липидов. Роговая оболочка в основном сформирована структурными белками, такими как лорикрин, инволюкрин, филаггрин (ФЛГ) и малыми пролин-богатыми белками. Особенно важен филаггрин, объединяющий кератиновые волокна клеток, «скручивая» кератиноциты в уплощенные диски с большой площадью поверхности [8].
Вокруг корнеоцитов расположены холестерин, фосфолипиды и церамиды, создавая многослойную мембрану из липидных пластинок [3, 9]. Последние играют важную роль в регуляции водного гомеостаза кожи, помогают сохранять воду в организме, а также предотвращают проникновение патогенных микроорганизмов и аллергенов [10].
На границе между роговым и зернистым слоями происходит секреция ламеллярных телец, содержащих предшественники липидов, а также необходимые ферменты для переработки этих прекурсоров в зрелые составляющие липидной матрицы [11]. Перед секрецией происходит сборка ламеллярных телец в пластинчатом комплексе, посредством дифференцированной их упаковки с различным содержимым [12]. Кроме вышеупомянутых метаболитов липидов, липидные тельца доставляют в межклеточное пространство рогового слоя протеолитически активные ферменты, такие как сериновые протеазы семейства калликреина, а также их ингибиторов, в том числе и лимфоэпителиальный ингибитор сериновых протеаз типа Kazal-5 (LEKTI) [13].
Единство между корнеоцитами рогового слоя зависит прежде всего от корнеодесмосом. Подобно десмосомам, они поддерживают целостность тканей посредством молекул межклеточной адгезии с помощью кальций-зависимых взаимодействий между двумя представителями семейства кадгерина, внеклеточных трансмембранных гликопротеинов — десмоглеина и десмоколлина. Внутри корнеоцитов десмоглеин и десмоколлин соединяют кератиновые филламенты корнеодесмосом посредством «соединительной бляшки», состоящей из плакоглобина, десмоплакина и плакофиллина. Десмоглеин и десмоколлин перемещаются от оболочки корнеоцитов в липидную пластину между корнеоцитами и связывают воедино белки соседних клеток. Кроме того, в процессе кератинизации эпителия экспрессируется специфический белок с молекулярной массой 52 кДа — корнеодесмосин [8, 14]. После секреции в экстрацеллюлярное пространство корнеодесмосин перемещается в область между зернистым и роговым слоями и проникает в десмосому. Появление корнеодесмосина знаменует переход от десмосом к корнеодесмосомам [3, 12].
Во время «нормальной» десквамации рогового слоя самые поверхностные корнеоциты «уходят» с поверхности кожи, замещаясь кератиноцитами, подвергшимися терминальной дифференцировке [14, 15]. Таким образом, существует «тонкий» баланс между базальной клеточной пролиферацией и десквамацией рогового слоя. Это обеспечивает постоянное обновление клеток эпидермиса, а также способствует поддержанию одинаковой толщины эпителия [14, 16]. Caubet и соавт. [15] описали несколько деградационных протеаз, которые разрушают внеклеточные корнеодесмосомальные адгезивные белки, связывающие корнеоциты вместе.
В роговом слое среди протеаз, вовлеченных в процесс десквамации, присутствуют хемотрипсиновые (SCCE) и трипсиновые ферменты (SCTE), которые экспрессируются кератиноцитами зернистого слоя и находятся во внеклеточном пространстве рогового слоя [14]. Данные протеазы гидролизуют корнеодесмосин и десмоколлин [15]. Их активность контролируется семейством специфических ингибиторов, в которое входит LEKTI [17]. При этом скорость десквамации коррелирует с количеством ингибиторов протеаз, поступивших из ламеллярных телец [3].
На барьерную функцию эпидермиса влияют структура, дифференцировка, функциональная активность кератиноцитов, качественный и количественный состав липидов рогового слоя эпидермиса, наличие веществ, относящихся к естественному увлажняющему фактору, а также рН поверхности кожи [18]. При изменении каких-либо из перечисленных показателей барьерная функция эпидермиса нарушается, что приводит к усиленному испарению воды через роговой слой. У человека эпидермальный барьер восстанавливается на 60% через 12 часов, а полное восстановление занимает 72 часа [19]. Полагают, что быстрое восстановление эпидермального барьера происходит за счет массового выброса из клеток готовых ламеллярных телец. В медленную фазу восстановления усиливается синтез жирных кислот, холестерина, церамидов, а также образование новых ламеллярных гранул. Нарушение восстановления кожного барьера приводит к обезвоживанию эпидермиса и развитию выраженной сухости кожи, что и наблюдается при развитии атопического дерматита (АД) [20].
Повреждение эпидермального барьера способствует проникновению через кожу микробов, аллергенов и различных поллютантов (токсины, раздражающие и загрязняющие вещества). Проникновение агентов с антигенными свойствами увеличивает риск сенсибилизации, поскольку взаимодействие аллергенов и аллерген-представляющих клеток кожи инициирует воспаление [14]. Степень дисфункции барьера коррелирует со степенью воспаления и тяжестью АД [11]. Впервые Y. Werner и M. Lindberg (1985 г.) привели доказательства нарушений барьерной функции кожи, измерив трансэпидермальную потерю воды (ТЭПВ) у лиц с АД. Авторам удалось показать, что у больных АД нарушения эпидермального барьера отмечаются не только в очагах активного воспаления, но и на клинически неизмененной коже [10, 21].
Изменения в свойствах эпидермального барьера, которые наблюдаются при АД, включают увеличение ТЭПВ, изменения рН поверхности кожи, повышение ее проницаемости, увеличение бактериальной колонизации, изменение в экспрессии антимикробных пептидов, а также нарушение его целостности. При аномалии эпидермального барьера аллергены, раздражающие и другие вещества могут проникать через кожу, способствуя обострению АД [6].
В настоящее время нарушение функции кожного барьера является одним из ведущих этиопатогенетических факторов АД. По данным разных авторов у 30–66% больных АД протекает без изменения уровня общего IgE в сыворотке крови и специфичных IgE к аллергенам. Полагают, что именно у этих пациентов нарушение функции кожного барьера играет ведущую роль в развитии и прогрессировании заболевания [22].
В последние годы определен ряд генетических мутаций, приводящих к изменениям в роговом слое эпидермиса. Так, у больных АД определяются мутации гена профилаггрина [23], способствующие нарушению синтеза белка ФЛГ — одного из компонентов цитокератинового скелета, обеспечивающего ороговение кератиноцитов. В результате изменения терминальной дифференцировки кератиноцитов развивается их функциональная несостоятельность [24]. Кроме того, снижение экспрессии гена ФЛГ уменьшает уровень «натурального увлажняющего фактора» [25]. Дефицит ФЛГ и/или продуктов его деградации способствует сухости кожи, что коррелирует с клинической картиной нарушения эпидермального барьера при АД [26]. Более того, при уменьшении ФЛГ усиливается «раздражающий» эффект аллергенов на дендритные клетки, понижая при этом порог их чувствительности к воспалению, что демонстрирует важность этого белка в предотвращении пенетрации аллергенов [27].
Кроме того, у больных АД выявлены полиморфные варианты гена SPINK5, приводящие к дизрегуляции синтеза ингибитора сериновой протеазы LEKTI, который в норме блокирует избыточную продукцию SCCE [28]. Активность деградационных протеаз также значимо связана с дефектом кожного барьера при АД [23]. Разбалансировка функционирования этих ферментов ведет к усиленному отшелушиванию клеток и истончению рогового слоя, увеличивая проницаемость эпидермального барьера [14]. Установлено, что у больных АД изменена липидная мантия рогового слоя, предупреждающая ТЭПВ. Отмечается низкий уровень церамидов первого и третьего типов в сочетании с повышением уровня свободного холестерола [29]. Повышение уровня рН на поверхности кожи приводит к снижению синтеза липидов и активизации ферментов (в частности, SCCE), повреждающих корнеодесмосомы. Уменьшение количества веществ, относящихся к «натуральному увлажняющему фактору», также способствует нарушению функционирования эпидермального барьера [30].
Таким образом, у больных АД отмечается комплекс нарушений, приводящих к дисфункции кожного барьера, усилению ТЭПВ и обезвоживанию кожных покровов [14]. Из вышеуказанного следует, что пациенты с АД могут иметь дефект кожного барьера, в основе которого лежат как генетические, так и приобретенные механизмы. Этот дефект способны спровоцировать внешние факторы, такие как царапины, использование моющих средств, микробная колонизация, а также воздействие протеаз различных аллергенов (в частности, протеаз клещей домашней пыли) [10]. Распознание конкретных механизмов, участвующих в патогенезе воспалительных заболеваний кожи, в частности, АД, безусловно, будет способствовать поиску и разработке новых, более эффективных методов воздействия на патологический процесс с минимальным количеством системных эффектов [8].
Литература
- Elias P. M. The skin barrier as an innate immune element // Semin. Immunopathol. 2007. Vol. 29 (1); р. 3–14.
- De Benedetto A., Kubo А., Beck L. A. Skin barrier disruption — a requirement for allergen sensitization? // J. Invest. Dermatol. 2012. Vol. 132 (3); р. 949–63.
- Danby S. G., Cork M. J. New understanding of atopic dermatitis: the role of epidermal barrier dysfunction and subclinical inflammation. // J. Clin. Dermatol. 2010. Vol. 1 (2); р. 33–46.
- Котлуков В. К., Кузьменко Л. Г., Антипова Н. В. Наружные дерматологические средства серии «Бепантен» в практике педиатра // Медицинский совет. 2012. Т. 5; с. 81–85.
- Madison K. С. Barrier function of the skin: «la raison d’etre» of the epidermis // J. Invest. Dermatol. 2003. Vol. 121; р. 231–241.
- Lorena S. T., Morello III A. P., Mack Correa M. C. et al. The infant skin barrier: can we preserve, protect, and enhance the barrier? // Dermatol. Res. Pract. 2012. Doi: 10.1155/2012/198789.
- Candi E., Schmidt R., Melino G. The cornified envelope: a model of cell death in the skin // Nat. Rev. Mol. Cell Biol. 2005. Vol. 6; р. 328–340.
- Michael J. C., Simon G. D., Yiannis V. et al. Epidermal barrier dysfunction in atopic dermatitis // J. Invest. Dermatol. 2009. Vol. 129; р. 1892–908.
- Ревякина В. А. Современные тенденции в комплексной наружной терапии атопического дерматита у детей // Лечащий Врач. 2014. № 6, с. 38.
- De Benedetto А., Agnihothri R., McGirt L. Y. et al. Atopic dermatitis: a disease caused by innate immune defects? // J. Invest. Dermatol. 2009. Vol. 129; р. 14–30.
- Roelandt T., Thys B., Heughebaert C. et al. LEKTI-1 in sickness and in health // Int. J. Cosmetic Sci. 2009. Vol. 31 (4); р. 247–254.
- Ishida-Yamamoto A., Simon M., Kishibe M. et al. Epidermal lamellar granules transport different cargoes as distinct aggregates // J. Invest. Dermatol. 2004. Vol. 122; р. 1137–1144.
- Ishida-Yamamoto A., Deraison C., Bonnart C. et al. LEKTI is localized in lamellar granules, separated from KLK5 and KLK7, and is secreted in the extracellular spaces of the superficial stratum granulosum // J. Invest. Dermatol. 2005. Vol. 124; р. 360–366.
- Cork M. J., Robinson D. A., Vasilopoulos Y. et al. New perspectives on epidermal barrier dysfunction in atopic dermatitis: gene-environment interactions // J. Allergy Clin. Immunol. 2006. Vol. 118; р. 3–21.
- Caubet C., Jonca N., Brattsand M. et al. Degradation of corneodesmosome proteins by two serine proteases of the kallikrein family, SCTE/KLK5/hK5 and SCCE/KLK7/hK7 // J. Invest. Dermatol. 2004. Vol. 122; Р. 1235–1244.
- Goldstein A. M., Abramovits W. Ceramides and the stratum corneum: structure, function, and new methods to promote repair // Int. J. Dermatol. 2003. Vol. 42; р. 256–59.
- Chavanas S., Bodemer C., Rochat A. Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome // Nat. Genet. 2000. Vol. 25; р. 141–142.
- Мурашкин Н. Н. Нарушения дермального барьера как фактор хронизации дерматозов в детском возрасте, подходы к терапии: теоретические и практические инновации // Лечащий Врач. 2014. № 6, с. 19.
- Эрнандес Е., Марголина А., Петрухина А. Липидный барьер кожи и косметические средства // Косметика и медицина. 2005. Т. 6; с. 35–38.
- Тамразова О. Б. Синдром сухой кожи // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 3; с. 25–31.
- Хлебникова А. Н. Увлажняющие средства в терапии хронических дерматозов // Клиническая дерматология и венерология. 2010. Т. 4; с. 32–39.
- Palmer C. N., Irvine A. D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nat. Genet. 2006. Vol. 38 (4); р. 441–446.
- Молочков А. В., Тамразова О. Б. Ксероз кожи — основной патогенетический фактор развития атопического дерматита // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 4; с. 48–54.
- Vasilopoulos Y., Cork M. J., Murphy R. et al. Genetic association between an AACC insertion in the 3’UTR of the stratum corneum chymotryptic enzyme gene and atopic dermatitis // J. Invest. Dermatol. 2004. Vol. 123; р. 62–66.
- Smith F. J., Irvine A. D., Terron-Kwiatkowski A. et al. Loss-of-function mutations in the gene encoding filaggrin cause ichthyosis vulgaris // Nat. Genet. 2006. Vol. 38 (3); р. 337–342.
- Nemoto-Hasebe I., Akiyama M., Nomura T. et al. Clinical severity correlates with impaired barrier in? laggrin-related eczema // J. Invest. Dermatol. 2009. Vol. 129 (3); р. 682–689.
- Fallon P. G., Sasaki T., Sandilands A. et al. A homozygous frameshift mutation in the mouse Flg gene facilitates enhanced percutaneous allergen priming // Nat. Genet. 2009. Vol. 41 (5); р. 602–608.
- Kato A., Fukai K., Oiso N. et al. Association of SPINK5 gene polymorphisms with atopic dermatitis in the Japanese population // Br. J. Dermatol. 2003. Vol. 148; р. 665–669.
- Пампура А. Н., Чусляева А. А. Современные подходы к терапии атопического дерматита у детей // Медицинский вестник Башкортостана. 2014. Т. 9 (1); с. 93–98.
- Eberlein-Konig B., Schafer T., Huss-Marp J. et al. Skin surface pH, stratum corneum hydration, transepidermal water loss and skin roughness related to atopic eczema and skin dryness in a population of primary school children // Acta Dermatol. Venereol. 2000. Vol. 80; р. 188–191.
С. В. Левашева 1 , кандидат медицинских наук
Э. И. Эткина, доктор медицинских наук, профессор
Л. Л. Гурьева, кандидат медицинских наук
Л. И. Бабенкова, кандидат медицинских наук
Л. Я. Данилова
С. Э. Якута
В статье приводятся современные сведения о формировании барьерных свойств эпидермальных структур кожи. Раскрываются патогенетические особенности нарушений барьерных свойств кожи при воспалительных и десквамативных дерматозах в детском возрасте.
Disturbance of skin barrier properties as factor of chronization of dermatoses in children, treatment: theoretical and practical innovations
Current article describes up-to-date information about barrier properties forming in epidermal structures of the skin. Description of pathogenetic qualities of disturbance in skin barrier properties during inflammatory and desquamative dermatoses in children is given.
Кожа человека выполняет множество жизненно важных функций. Это основной орган, осуществляющий контакт с внешней средой, обеспечивающий барьер, что позволяет организму сохранять гомеостаз и предотвратить обезвоживание. Существенную роль в формировании барьерных свойств кожи играет эпидермальный барьер — это собирательное понятие, характеризующее роговой слой, его состояние и происходящие в нем процессы кератинизации, синтез высокоспециализированных межклеточных липидов, образование натурального увлажняющего фактора, десквамацию [1]. Осуществление барьерных функций кожи в целом обеспечивается посредством многочисленных кооперативных взаимодействий различных структур эпидермиса, дермы, клеток местного иммунологического надзора, экскреторной функцией сальных и потовых желез и т. д. [2].
Особое патогенетическое значение имеет понимание дермальных изменений, происходящих в эпидермисе пациентов, страдающих дерматозами, в основе которых лежат воспалительные и десквамативные процессы, происходящие в эпидермисе.
В еще большей степени это касается детей первых лет жизни, имеющих ряд анатомо-конституциональных особенностей строения кожи, обусловливающих незрелость эпидермальных и дермальных барьерных структур. Среди них: нежный и рыхлый эпидермис, тонкая базальная мембрана, нейтральная или слабощелочная рН, повышенная проницаемость эндотелия сосудов, высокая резорбционная способность жирорастворимых веществ и ряд других.
Как упоминалось выше, одно из ведущих мест среди защитных барьеров эпидермиса в настоящее время отводят роговому слою. Ранее считалось, что роговой слой это отмершие участки кожи с аморфной массой кератиновых нитей, исследования последних лет показали, что это живая, динамичная и очень активная ткань с выраженным метаболизмом липидов в межкератиноцитарном матриксе, таких как церамиды, гликосилкерамиды, свободные сфингоидные основания, холестерол и его сульфаты, жирные кислоты, фосфолипиды, некоторые другие, а также упорядоченной структурой и движением кератиноцитов [3–5]. Известно, что процессы естественной кератинизации в эпителиальных клетках обеспечиваются белком филаггрином, осуществляющим агрегацию филаментов — компонентов цитоскелета. В результате этого процесса формируются постклеточные белковые структуры, в которых отсутствуют органеллы — корнеоциты. «Мертвыми» эти клетки считают потому, что они не синтезируют белки и не реагируют на влияния различных сигнальных молекул [2].
Двойные ковалентные связи жирных кислот прочно, подобно «цементу», скрепляют липидные пласты между собой и с роговыми «кирпичиками» корнеоцитов, образуя подобие кирпичной кладки, тем самым обеспечивается механическая прочность рогового слоя. Важно отметить также тот факт, что высокоспециализированные липиды рогового слоя образуют биполярную прослойку между кератиноцитами таким образом, что более полярная гидрофильная фаза располагается между двумя кристаллическими, наподобие «сэндвича» по A. Rawlings, 2003 [2].
Указанная структура позволяет препятствовать трансэпидермальной потере воды, проникновению через кожу водорастворимых веществ и обеспечивает целостность кожи.
В обеспечении надежности эпидермального барьера также важное значение имеет наличие на его поверхности водно-липидной мантии Маркионини, являющейся смесью кожного сала, секрета эккринных потовых желез и церамидов рогового слоя [3, 6]. Эмульгирование кожного сала происходит благодаря гидрофильным высокомолекулярным спиртам и холестеролу, входящему в его состав. При этом на поверхности кожного покрова создается слабокислый рН (4,5–5,5). Благодаря такому составу данная водно-липидная эмульсионная пленка выполняет ряд уникальных функций:
- поддержание нормальной эластичности кожи, препятствие ее пересушиванию;
- поддержание постоянной температуры тела (за счет изменений ее физического состава);
- нейтрализация щелочей органическими жирными кислотами, поддержание постоянного слабокислого pH;
- подавление размножения микроорганизмов благодаря свободным низшим жирным кислотам кожного сала;
- один из путей экскреции продуктов метаболизма, лекарственных и токсических веществ.
Таким образом, сложная динамическая система межклеточных взаимодействий и межкератиноцитарного обмена липидов создает стойкий, малопроницаемый эпидермальный барьер, надежно защищающий от воздействия факторов внешней среды, а также предотвращающий от трансэпидермальной потери влаги.
Одним из частых клинических проявлений многих кожных болезней, например, таких как ихтиоз, кератодермии, атопический дерматит, экзема, псориаз, хейлит, болезнь Дарье, болезнь Девержи и др., является сухость кожи следствие изменения соотношения и содержания липидов [4].
Сухая кожа — это истонченная кожа с шелушением и/или мелкими трещинами и субъективным ощущением стягивания. Причинами сухости, как правило, являются дегидратация рогового слоя и нарушения кератинизации, свидетельствующие о нарушении барьерной функции кожи. В некоторых случаях нарушение проницаемости является первичным патогенетическим звеном, влекущим за собой комплекс патологических изменений, в других случаях нарушение барьерной функции рогового слоя ухудшает течение уже существующих заболеваний [6]. В последнее время все большее число исследователей доказывают, что во многих случаях в развитии воспаления и гиперплазии эпидермиса существенную роль играют цитокины, вырабатываемые самими кератиноцитами при повреждении эпидермального барьера. Установлено, что сразу после повреждения рогового слоя повышается концентрация интерлейкина-1α (ИЛ-1α), фактора некроза опухоли α, которые действуют по сигнальному механизму: каждая сигнальная молекула способна стимулировать выработку других сигнальных молекул с различными функциями, которые в свою очередь побуждают клетки к секреции новых биологически активных веществ [6, 7].
При повреждении рогового слоя в эпидермисе разворачивается ответная реакция, направленная на восстановление его липидных структур. Если восстановление происходит недостаточно быстро, то клетки эпидермиса подвергаются массированной атаке со стороны микроорганизмов и токсинов, в процессе которой поврежденные кератиноциты начинают секретировать цитокины, запускающие воспалительную реакцию. Воспаление всегда сопровождается продукцией свободных радикалов, что приводит к дальнейшему повреждению клеток эпидермиса, которые уже не могут обеспечить полное восстановление липидного барьера, поэтому эпидермис постепенно обезвоживается. Кожа становится сухой, шелушащейся и воспаленной.
Наиболее распространенным заболеванием кожи в детской дерматологической практике является атопический дерматит [8]. Нарушения барьерных свойств кожи при этом дерматозе связаны со сложными и многогранными процессами, протекающими в эпидермисе. Так, в роговом слое отмечается снижение уровня свободных церамидов, в частности С1?линолеата, который играет важную роль в формировании билипидного слоя и которому принадлежит особо важная роль в защитном механизме при повторном раздражении. Именно с его недостатком связывают предрасположенность кожи к экзематозным реакциям под воздействием различных ирритантов. Отмечается повышение активности фермента сфингомиелиназы, свободных жирных кислот, сфингозина, фосфатидилхолина, на которые в значительной степени влияют рН и осмотическое давление [2, 6]. Все это в значительной степени изменяет нормальную регуляцию метаболизма липидов, гидролитическую деградацию корнеодесмосом при терминальном разъединении роговых клеток и высвобождение кератиноцитами ИЛ-1α, активирующего ответ эпидермиса на внешние раздражители. Кроме того, имеются данные о дефиците филаггрина у пациентов, страдающих атопическим дерматитом. В процессе деградации этого белка образуется натуральный увлажняющий фактор (natural moisturizing factor, NMF): высвобождающиеся аминокислоты, которые в норме создают высокое осмотическое давление в клетке, осуществляют приток воды в корнеоциты по градиенту концентраций, делая роговые чешуйки упругими. В свою очередь, обезвоживание эпидермиса стимулирует выброс провоспалительных цитокинов, способствуя формированию кожных патологических реакций [4, 7].
Указанные изменения приводят к формированию атопического ксероза, снижению барьерных функций кожи, проявляющемуся агрессией различных микробных агентов, играющих важную роль в хронизации воспаления, носящего атопический или неатопический характер. Сегодня общеизвестным является тот факт, что практически в 100% случаев кожный покров больных атопическим дерматитом колонизирован штаммами золотистого стафилококка, он высеивается как с пораженных, так и с непораженных участков кожи. При этом клинические признаки инфекционного процесса на коже нередко отсутствуют [8, 9].
Колонизация золотистого стафилококка возможна вследствие наличия на клеточной стенке бактерий — рецепторов-адгезинов к ламинину и фибронектину эпидермиса, формирования фолликулярных структур между клетками золотистого стафилококка и корнеоцитами, что приводит к формированию бактериальной биопленки, участвующей в адгезии стафилококка [10]. Также колонизация стафилококка возможна вследствие снижения экспрессии факторов врожденного иммунитета в коже, в частности антимикробных пептидов — дефензинов и кателицидина.
Кроме стафилококка, при атопическом дерматите высеваются и другие микроорганизмы, среди которых наиболее часто встречается стрептококк. Зачастую в очагах поражения обнаруживается микст-инфекция.
Нарушения барьерных свойств кожи также наблюдаются и у пациентов с псориазом. Эти изменения происходят вследствие снижения концентрации свободных и связанных церамидов: C3b, C5 и церамидов В соответственно. Вместе с тем отмечается снижение уровня экспрессии свободных церамидов — C2, C3a и C4; кислот — гидроксикислот, жирных кислот (олеатов и линолеатов, ковалентно связанных с корнеоцитами). Совокупность указанных трансформаций приводит к изменениям сцепления корнеоцитов и нарушениям десквамации.
Особенностями нарушений барьерных свойств кожи при ихтиозе являются снижения уровней свободных церамидов: C3b, C5 и уровня сфингозина, на фоне повышенной концентрации свободных церамидов — C2, C3a и C4. Результатом этих процессов является формирование ретенционного гиперкератоза [3].
Кроме того, нарушения эпидермального барьера у детей, страдающих воспалительными дерматозами, вызывают многочисленные внешние воздействия, приводящие к повреждению, в том числе этому способствуют расчесы, травмы, различные аллергены и ирританты, вторичная инфекция, а зачастую и неправильный уход за кожей [1, 4]. Нарушают, в известной степени, барьерные свойства кожи и беспорядочное использование больными наружных лечебных и косметических средств. В особенности это касается так часто применяемых глюкокортикостероидных лекарственных препаратов, которые вызывают изменения липидного барьера кожи.
Целью наружной терапии воспалительных и десквамативных дерматозов и состояний кожи в детском возрасте являются купирование воспаления и зуда путем назначения противовоспалительных средств, восстановление водно-липидного слоя и повышение барьерной функции кожи посредством использования смягчающих питательных средств. Важен также и последующий адекватный уход за кожей путем назначения очищающих и увлажняющих средств, позволяющих адекватно реабилитировать пациентов и пролонгировать ремиссию [11].
Для проведения рациональной наружной терапии необходимо оценивать характер и локализацию морфологических изменений кожи, выбрать лекарственное средство, учитывая механизмы его действия, подобрать адекватную лекарственную форму в зависимости от активности воспалительного процесса, выраженности клинической симптоматики нарушений барьерных свойств кожи.
В качестве современных средств увлажнения кожи используют различные лечебные косметические формы. Одни из них — средства непосредственного увлажнения — хумиктанты. В их основе натуральные увлажняющие факторы (пирролидонкарболовая кислота, мочевина, производные молочной кислоты), липосомы, полиолы, полисахариды, макромолекулы (хондроитинсульфаты, полисахариды, коллаген, эластин, др.). Средства, препятствующие потере воды, в состав которых входят вещества, образующие пленку, — воски, вазелин, парафин, пергидросквален, ланолин, многоатомные спирты, жирные кислоты, триглицериды, силиконы; либо препараты с кератолитическим действием [2].
Особое внимание в детской дерматологической практике отводится средствам на основе декспантенола, который в клетках кожи быстро превращается в пантотеновую кислоту, являющуюся составной частью коэнзима А и играет важную роль как в формировании, так и в заживлении поврежденного кожного покрова; стимулирует регенерацию кожи, нормализует клеточный метаболизм. Этим требованиям отвечает, например, крем Бепантен, являющийся важной составляющей комплексной наружной терапии ряда воспалительных и десквамативных заболеваний кожи с хроническим течением в детском возрасте. Вместе с тем фармакологические свойства препаратов для наружного лечения на основе декспантенола важны не только как лечебные, но и как профилактические средства, например, при пеленочном дерматите. Декспантенол в виде мази Бепантен формирует защитный барьер против внешних раздражителей (моча, фекалии), а мазевая основа Бепантена, представленная ланолином и мягким белым парафином, предотвращает трансэпидермальную потерю воды [12].
Особенностью современных тенденций создания средств лечебной косметики является комбинация биосовместимых увлажнителей и пленкообразующих веществ, многие из них в своем составе содержат микроэлементы. Тем самым достигается наибольшая эффективность увлажнения и дополнительная модификация действия посредством включения тех или иных микроэлементов [13].
Тем не менее, если обратиться к динамике восстановления кожи, будет видно, что эффективное восстановление барьерной функции кожи наблюдается лишь при использовании смеси трех ключевых липидов (церамидов, холестерина и жирных кислот), взятых в эквимолярном соотношении [6].
Среди аллергологов, педиатров и дерматологов остро дискутируется вопрос о частоте использования воды для очищения как пораженной, так и здоровой кожи [2, 4, 8, 11]. В исследованиях C. Chiang и L. E. Eichenfield (2009) было продемонстрировано уменьшение гидратации рогового слоя у пациентов, страдающих атопическим дерматитом [2, 14]. Мытье кожи водой без последующего нанесения увлажняющих средств резко снижало параметры ее увлажненности, вместе с тем увлажнение без предшествующего очищения с помощью воды существенно увеличивало содержание воды в роговом слое [2, 14, 15].
Также установлено, что скорость восстановления структур кожи, обеспечивающих барьерную функцию, значительно замедляется при наложении окклюзионной повязки на область повреждения. Дело в том, что репаративные процессы инициируются при увеличении трансэпидермальной потери воды. При снижении скорости трансэпидермальной потери воды выработка высокоспециализированных липидов рогового слоя тормозится [2, 15]. Этот факт следует учитывать, например, при выборе памперса при пеленочном дерматите или при выборе повязок в процессе лечения травматических поражений или после хирургических манипуляций.
Несмотря на все косметологические инновации последних лет, важно помнить, что не все кремы, состоящие из вышеуказанных ингредиентов современной фармакокосметологии, могут одинаково применяться и хорошо переноситься всеми пациентами. Так, соотношение одних и тех же ингредиентов для пациентов детского возраста, назначенных в прогрессирующую стадию псориаза, может привести к ухудшению течения кожного патологического процесса, а примененного в стационарную стадию — к улучшению и ускорить разрешение поражений кожи. Аналогично назначение врачом эмолентов должно учитывать состояние кожного покрова у детей в различные стадии и возрастные фазы течения атопического дерматита, важно также учитывать и анатомическую область поражений при назначении того или иного средства.
Адекватное использование местного лечения с применением современных дерматологических технологий имеет высокую безопасность, обеспечивает стойкую ремиссию заболеваний, предупреждает их рецидивирование и значительно улучшает качество жизни маленьких пациентов и членов их семей.
Литература
- Аравийская Е. Р., Е. В. Соколовский, Соколов Г. Н. и соавт. Эритема лица, особенности диагностики и ухода за кожей // Клиническая дерматология и венерология. 2003. № 3. С. 69–73.
- Аравийская Е. Р., Соколовский Е. В. Барьерные свойства кожи и базовый уход: инновации в теории и практике // Вестник дерматологии и венерологии. 2010; 6; 135–139.
- Скрипкин Ю. К. Кожные и венерические болезни. Рук-во для врачей в 4-х т. Т. 3. М.: Медицина. 1995. С. 239–292.
- Суворова К. Н., Тогоева Л. Т., Гришко Т. Н. и соавт. Корнеотерапия при воспалительных и десквамативных дерматозах у детей // Вопросы современной педиатрии. 2005. Т. 4. № 6. С. 39–44.
- Kligman A. M. The biology of the stratum corneum. In: Montagna W., Lobitz M. C. The Epidermis. Jerusalem–New York: Academic press 1964; 387–433.
- Эрнандес Е., Марголина А., Петрухина А. Липидный барьер кожи и косметические средства. М.: ИД «Косметика и медицина», 2005. С. 9–37.
- Nickoloff B. J., Naidu Y. Perturbation of epidermal barrier function correlates with initiation of cytokine cascade in human skin // J. Am. Acad. Dermatol. 1994; 30 (4): 535–546.
- Намазова Л. С., Вознесенская Н. И., Сурков А. Г. Атопический дерматит // Лечащий Врач. 2006. № 4. С. 72–78.
- Мазитова Л. П. Роль микробной гиперсенсибилизации в развитии аллергодерматозов у детей // Вестник дерматологии и венерологии. 2007. № 2. С. 36–38.
- Leyden J. E., Marples R. R., Kligmann A. M. Stafhylococcus aureus in the lesion of atopic dermatitis // Br. J. Dermatol. 1974. Vol. 90. P. 525–530.
- Смирнова Г. И. Современные технологии местного лечения атопического дерматита у детей // Иммунопатология, аллергология, инфектология. 2003. № 3. С. 75–82.
- Галлямова Ю. А. Пеленочный дерматит и травматизация кожи у детей // Лечащий Врач. 2013; 9; 24.
- Mao-Qiang M., Feingold C. R., Thornfeld C. R., Tlias P. M. Optimization of physiological lipid mixtures for barrier repair // J. Invest. Dermatol. 1996. Vol. 106. P.1096–1101.
- Chang C., Eichenfield L. E. Quantitative assessment of combination bathing and moisturizing regimens on skin hydration in atopic dermatitis // Pediatric Derm. 2009; 26: 3: 273–278.
- Grubauer G., Elias P. M., Feingold K. R. Transepidermal water loss: the signal for recovery of barrier structure and function // J. Lipid. Res. 1989; 30: 323–330.
Н. Н. Мурашкин, доктор медицинских наук, профессор
Читайте также:

