Что такое рубцы на поджелудочной железе
Обновлено: 27.04.2024
Послеоперационный панкреатит (ПП) является одним из наиболее тяжелых послеоперационных осложнений, которое наблюдается не только после абдоминальных операций, но и после вмешательств на органах грудной клетки, периферических сосудах [4, 12, 14, 18]. Наиболее часто ПП возникает после операций на поджелудочной железе (ПЖ). Частота возникновения ПП в этих ситуациях, по данным разных авторов, составляет от 1,9 до 50% [4, 16]. Отличительной особенностью ПП после операций на ПЖ является тяжелое течение этого осложнения, возникновение на его фоне несостоятельности швов анастомозов, аррозионных внутрибрюшных кровотечений, а в более поздний период - панкреатических свищей [12, 15, 20, 21]. В то же время в публикациях последних лет, посвященных хирургическому лечению заболеваний ПЖ, ПП не рассматривается в числе осложнений, учитываются лишь его последствия: панкреатические свищи, абсцессы брюшной полости [20, 23].
Хирургическое лечение больных доброкачественными и злокачественными заболеваниями ПЖ является одним из приоритетных направлений отдела абдоминальной хирургии Института хирургии им. А.В. Вишневского. К сожалению, избежать возникновения ПП не удается, несмотря на соблюдение необходимых мер предосторожности. Мы задались целью выяснить причины возникновения ПП, его ранние клинические, биохимические проявления, а также признаки, выявляемые при лучевых методах диагностики, принципы лечения осложнения.
Материал и методы
Во время операции оценивали исходное состояние паренхимы ПЖ и главного протока поджелудочной железы (ГПП) - проявление атрофии и склерозирования, наличие панкреатической гипертензии, калькулеза. В последующем наличие фиброза и атрофии ткани ПЖ контролировали при морфологическом исследовании.
В качестве интраоперационной профилактики ПП у 229 (73,1%) пациентов при резекции или пересечении ПЖ использовали октреотид. Применение препарата было одинаковым у всех больных и заключалось во введении синтетического октапептида, производного сонатостатина по 0,1 мг перед мобилизацией ПЖ и перед пересечением/рассечением ее паренхимы. Отказались от превентивного введения преперата у 73 больных с выраженными склеротическими и атрофическими изменениями паренхимы органа. В послеоперационном периоде все оперированные больные получали препарат по 0,1 мг 3-4 раза в сутки в течение 3-4 дней. В ходе операции регистрировали реакцию ПЖ на операционную травму - появление «субкапсулярного» отека, бляшек стеатонекроза.
С первых часов после операции учитывали состояние больных. Клиническими проявлениями ПП считали спутанность сознания, оглушенность, заторможенность; неэффективность самостоятельного дыхания или невозможность «снять больного» с аппаратного дыхания; стойкую тахикардию, нестабильную гемодинамику, несмотря на адекватное обезболивание и инфузионную терапию; боли в верхних отделах живота опоясывающего характера или в поясничной области; выделение застойного желудочного содержимого по назогастральному зонду, отсутствие восстановления перистальтической активности кишечника; выделение по дренажам брюшной полости (сальниковой сумки) отделяемого цвета чая или «мясных помоев».
Лабораторные диагностические критерии включали мониторинг уровня лейкоцитов крови, амилазы крови и отделяемого по дренажам в 1-5-е сутки послеоперационного периода. У всех больных определяли уровень амилазы по методу B. Smith и I. Roe в модификации А.М. Уголева.
УЗИ органов брюшной полости в динамике проводили 302 (100%) больным в первые послеоперационные сутки на аппаратах Voluson 730 pro V фирмы «General Electric» (США), Sonoline Elegra, Sonoline Sienna фирмы «Siemens» (Германия) с мультичастотными датчиками на частоте 3,5 МГц. В дальнейшем ультразвуковую диагностику использовали при нетипичном течении послеоперационного периода.
При исследовании оценивали степень неоднородности паренхимы ПЖ, ее отечность, наличие жидкостных скоплений в зоне операции и свободной брюшной полости. При наличии жидкости производили диагностическую пункцию, определяли в ней уровень амилазы. Ультразвуковой контроль за состоянием ткани ПЖ выполняли первый раз через 12-16 ч после операции всем больным, в последующем - по мере необходимости.
Компьютерная томография (КТ) выполнена 27 больным на компьютерных томографах Secura и Tomoskan SR 7000 (Германия), Brilliance (Голландия) при наличии клинико-лабораторных и ультразвуковых проявлений ПП. Результаты КТ оценивали с использованием КТ-индекса тяжести Balthazar (1994), ранжируя ее по степени от А до Е с применением балльной шкалы от 0 до 4. Полученные баллы суммировали с баллами, отражающими величину некроза ПЖ [9-11, 19].
Лечение ПП включало интенсивную инфузионную и спазмолитическую терапию, превентивное введение антибактериальных препаратов, стимуляцию моторной функции кишечника. При угрозе развития полиорганной недостаточности использовали методы экстракорпоральной детоксикации (плазмаферез, ультрагемофильтрацию). При возникновении аррозионного кровотечения, послеоперационного перитонита выполняли экстренную операцию.
Тяжесть возникших осложнений оценивали по классификации D. Dindo и соавт. [23].
Результаты и обсуждение
При интраоперационной и последующей морфологической оценке состояния ткани ПЖ установлено, что из 302 больных, оперированных по поводу опухолей ПЖ и хронического панкреатита, у 217 (71,8%) она была мало измененной, диаметр ГПП не превышал 4-5 мм; среди этих больных ПП возник у 168 (77,4%). Выраженные склеротические и атрофические изменения ткани и расширение ГПП около 10 мм отмечены у 85 больных, среди которых ПП возник лишь у 10 (11,8%).
К моменту завершения операции у 7 больных был отмечен субкапсулярный отек, у 1 больного даже появились единичные бляшки стеатонекроза. В послеоперационном периоде у всех этих больных неизбежно возник тяжелый ПП, соответствовавший панкреонекрозу.
Из 178 больных ПП интраоперационно превентивно применяли синтетический октапептид производный сонатостатина у 137, при этом у всех этих больных паренхима железы оценивалась как мало измененная.
Отделяемое по дренажам брюшной полости в это время всегда имело геморрагический характер, его количество колебалось от 50 до 650 мл. Активность амилазы в жидкости, выделяющейся по дренажам, была повышенной у 198 больных и составляла в среднем 1137±1,96 ед., у 104 больных с выраженной атрофией ткани ПЖ уровень амилазы не превышал нормальных значений.

К исходу 1-х суток после операции, когда практически все больные были переведены на самостоятельное дыхание и стали доступны для общения, появлялась возможность оценить клинические проявления, характерные для ПП. Выявленные симптомы у больных ПП отражены в табл. 2.
Как оказалось, бесспорным проявлением ПП являлось сочетание повышения уровня амилазы крови и в отделяемом по дренажам с синдромом нарушения моторной функции кишечника, включавшим гастростаз (отрыжку, икоту, выделение застойного отделяемого по желудочному зонду до 1500 мл в сутки), угнетение перистальтической активности тонкой кишки.
Выделение по дренажам из брюшной полости выпота темно-бурого цвета или цвета «мясных помоев» через сутки после операции было у 68 больных и являлось патогномоничным признаком панкреонекроза.
На основании данных клинико-инструментальных методов обследования диагноз ПП к исходу 1-х суток после операции установлен у 178 (58,9%) больных.
На 2-е и 3-и сутки после операции состояние 105 (58,9%) из 178 больных ПП существенно улучшилось, клинические проявления панкреатита регрессировали, что соответствовало отечной форме острого панкреатита.
Несмотря на интенсивную консервативную терапию, у 73 (41,1%) больных клинические проявления ПП сохранялись и позднее 3-х суток после операции. Объем выделяющегося темного геморрагического или цвета чая экссудата с повышенным содержанием амилазы не имел тенденции к уменьшению. При инструментальном обследовании обнаруживали изменения паренхимы ПЖ, соответствующие панкреонекрозу.
При быстром развитии некротического процесса в ПЖ при УЗИ жидкость в плевральных полостях выявлялась у 31 (42,4%) больного, в брюшной полости и сальниковой сумке - у 71 (97,2%) больного. Такая картина сохранялась до 5-х суток заболевания у 46 (64%) пациентов. Зоны некроза при УЗИ выявлялись только на 5-7-е сутки в виде гипоэхогенных (51,6%) либо гиперэхогенных (48,4%) зон.
Для уточнения диагноза, особенно когда выполнение УЗИ было затруднено из-за наличия большого количества газа в кишке, 27 (8,9%) больным выполнена КТ. В нативную фазу контрастирования, со 2-3-х суток, в зоне операции определялась инфильтрация и негомогенность ткани ПЖ плотностью 20-40 ед.H без четко дифференцированной структуры.
В первые 5 сут размер ПЖ увеличивался у всех пациентов, на отдельных участках органа неотчетливо визуализировался ее внешний контур (у 4 больных, в динамике патологический процесс прогрессировал). Плотность ПЖ была понижена, но при контрастном усилении накопление препарата в паренхиме железы было равномерным, хотя и сниженным. Размер ПЖ был значительно увеличен, у всех пациентов контуры железы теряли четкость, при этом структура стенки двенадцатиперстной кишки не дифференцировалась у 4 больных. Неравномерное накопление контрастного вещества за счет наличия очагов некроза позволяло точно оценить объем поражения органа. Ткань ПЖ сниженной плотности и зона, не накапливающая контрастное вещество у 14 пациентов локализовались в области хвоста и тела ПЖ, у 13 - в области головки ПЖ. У 2 больных зона поражения составляла 30%, у 14 больных - 30-50%, в 5 наблюдениях некроз превышал 50% по Balthazar.

Больные получали интенсивную консервативную терапию, которая при отечной форме ПП давала отчетливый положительный эффект. При ПП, соответствующем панкреонекрозу, лечебные консервативные мероприятия позволяли добиться снижения эндогенной интоксикации, применение экстракорпоральной детоксикации обеспечивало разрешение полиорганной недостаточности. При выраженном ПП больным проводили сбалансированную нутритивную поддержку с использованием раннего энтерального зондового питания, что эффективно восполняло энергитические потери организма, особенно в случае присоединения моно- или полиорганной недостаточности. Однако ни в одном наблюдении не удалось избежать тех или иных осложнений, которые зачастую имели множественный каскадный характер. Как правило, первично возникала несостоятельность швов панкреато- и/или билиодигестивного анастомоза, затем следовали аррозионные кровотечения, образование панкреатических свищей (табл. 3).
При несостоятельности швов проявлялось характерное патологическое отделяемое по дренажам. Как правило, отделяемое, манифестировавшее панкреонекроз (бурого или грязно-геморрагического оттенка), изменяло внешний вид за счет примеси желчи или панкреатического сока. Надежное отграничение от свободной брюшной полости к этому времени у 23 больных позволило избежать повторных операций, при этом в 12 наблюдениях потребовалось дополнительное дренирование, которое выполнялось под контролем УЗИ. В последующем у 16 из 23 больных сформировались панкреатические свищи.
Распространения кишечного содержимого по брюшной полости не удалось избежать у 5 больных, которые были экстренно оперированы, выполнялось дополнительное дренирование.
Кровотечения из области панкреатоеюноанастомоза или культи ПЖ у 8 больных, имевшие аррозионный характер, требовали немедленного хирургического лечения. Выполнены релапаротомии, гемостаз обеспечивался лигированием с прошиванием. В последующем рецидивов кровотечения не возникало. Верхняя брыжеечная или воротная вена явилась источником кровотечения у 3 больных. Оно возникало из культи ранее перевязанного притока магистральной вены, лизированной панкреатическим соком. Аналогичный механизм кровотечений был в 2 наблюдениях, в которых его источником явилась печеночная артерия и почечная артерия. Выполнить экстирпацию культи ПЖ было невозможно из-за тяжести состояния больных, у них возникал рецидив кровотечения, оба больных умерли.
По классификации D. Dindo, ПП, возникший у 302 оперированных больных, привел к осложнениям I-II степени тяжести у 86 (28,5%), III a-b степени у 31 (10,3%), IV степени у 1 (0,3%), V степени тяжести - у 17 (5,6%) больных.
Из 178 больных ПП умерли 17 (9,5%). У 4 из них ПП соответствовал отечной форме, смерть была обусловлена декомпенсацией тяжелых сопутствующих заболеваний. Панкреонекроз и его осложнения послужили причиной летального исхода в 13 наблюдениях.
Хирургические вмешательства на ПЖ всегда были и остаются областью повышенной опасности для пациентов. В начале развития хирургической панкреатологии послеоперационная летальность достигала 10-15% [3, 5, 6, 17], количество больных с осложнениями в ближайшем послеоперационном периоде составляло 50-60% [2, 13, 16, 25, 26]. По мере приобретения опыта, разработки оптимальной хирургической тактики и техники оперирования, появления современных методов хирургического гемостаза, качественного шовного материала в ведущих клиниках, занимающихся хирургической панкреатологией, летальность существенно снизилась и колеблется от 0 до 10%. При этом послеоперационные осложнения отмечаются в 30-50% наблюдений [2, 22, 28].
Обладая высокой функциональной активностью, ПЖ чрезвычайно чувствительна к повреждающим механическим воздействиям. Хирургические вмешательства на ПЖ, сохранившей функциональную активность, всегда чреваты повышенной опасностью развития ПП [1, 29, 31]. Даже использование миниинвазивных технологий, таких как роботохирургия и лапароскопия, не гарантирует отсутствие ПП. Принятый в литературе термин «мягкая железа», подразумевает отсутствие выраженного склерозирования и атрофии ткани ПЖ [24, 30, 32, 33]. Она розового цвета с сохраненной дольчатостью, диаметр ГПП не превышает 3-4 мм. Листок париетальной брюшины, покрывающий вентральную поверхность ПЖ, тонкий, прозрачный, отсутствуют спаечные сращения с желудком и брыжейкой поперечной ободочной кишки; при пальпации ткань железы мягкоэластической консистенции.
По нашему мнению, ПП инициируется во время операции, при этом характер поражения ПЖ изначально «закладывается» как отечный панкреатит или панкреонекроз. Эффективность превентивного интраоперационного и тем более послеоперационного применения октреотида вызывает сомнения [7, 27]. В то же время чем больше выражены склерозирование и атрофия ткани ПЖ, шире ГПП, тем меньше вероятность развития ПП.
Повышение уровня амилазы в отделяемом по дренажам и в плазме крови на протяжении 1-х суток после операции без клинических проявлений ПП не служило абсолютным признаком возникновения этого осложнения, в то время как сочетание повышения содержания амилазы в отделяемом по дренажам и в плазме со стойкой тахикардией, нестабильным артериальным давлением, гастростазом и угнетением моторной активности кишечника безусловно свидетельствовало о развившемся ПП. УЗИ и КТ позволяли уточнить диагноз, определить степень поражения ПЖ, парапанкреатической клетчатки, наличие жидкостных скоплений [8, 9, 11].
Широко принятая на сегодняшний день классификация осложнений после операций на ПЖ, предложенная D. Dindo (2004), построена на оценке объема лечебных мероприятий, потребовавшихся для их устранения, но не отражает характер самих осложнений [13, 23]. По нашим данным, основным осложнением в ближайшем послеоперационном периоде являются ПП и его последствия. При этом отечная форма ПП хорошо поддается консервативной терапии и не удлиняет послеоперационное пребывание в стационаре. В то же время панкреонекроз приводит к тяжелым, часто смертельным осложнениям. Несостоятельность панкреатоеюноанастомоза в сочетании с аррозионным кровотечением из магистральных сосудов является наиболее тяжелым осложнением. Единственный радикальный метод устранения этого осложнения - экстирпация культи ПЖ.
Таким образом, послеоперационный панкреатит является частым осложнением после операций на поджелудочной железе, возникающим в 58,9% наблюдений. Его причиной служит интраоперационная травма поджелудочной железы. При мало измененной паренхиме поджелудочной железы вероятность возникновения послеоперационного панкреатита достигает 77,4%, в то время как при склеротических изменениях железы его частота составляет лишь 11,8%. Послеоперационный панкреонекроз неизбежно приводит к возникновению несостоятельности швов анастомозов при панкреатодуоденальных резекциях и резекциях головки ПЖ и образованию панкреатических свищей при дистальных резекциях.
Атрофия поджелудочной железы – это уменьшение объема органа, проявляющееся недостаточностью внешнесекреторной (продукция пищеварительных ферментов, бикарбоната) и внутрисекреторной (синтез инсулина, глюкагона) функции. Наиболее частыми причинами патологии являются хронический панкреатит, сахарный диабет, соматические заболевания с выраженным истощением, а также цирроз печени, нарушение кровоснабжения, сдавление опухолью. Диагностика основана на лабораторных данных, выявляющих дефицит ферментов и низкий уровень инсулина, УЗИ поджелудочной железы, результатах биопсии. Лечение заключается в назначении заместительной терапии: ферментных препаратов, инсулина; восстановлении кишечной флоры; коррекции дефицита нутриентов.
МКБ-10

Общие сведения
Атрофия поджелудочной железы – состояние, характеризующееся уменьшением размеров органа, уплотнением его структуры и недостаточностью функций. Данный процесс может развиваться вследствие физиологических возрастных изменений, а также заболеваний, сопровождающихся повреждением паренхимы, сдавлением, нарушением кровоснабжения, при длительно протекающих истощающих заболеваниях. При этом вес железы, который в норме составляет около 80-90 г, уменьшается до 30-40 и ниже.
Причины
Атрофия поджелудочной железы может быть физиологической, развивающейся в результате естественных процессов старения организма. Она сопровождает тяжелые истощающие заболевания (кахектическая форма). Также атрофия является исходом всех форм хронического панкреатита, при этом значительная часть стромы замещается фиброзной тканью, что сопровождается прогрессированием эндокринной и экзокринной недостаточности.
Своеобразным типом атрофии является липоматоз, при котором большая часть паренхимы органа замещена жировой тканью. Отдельное место занимает атрофия панкреас при сахарном диабете. К более редким случаям заболевания в гастроэнтерологии относится атрофия железы при циррозе печени, системной склеродермии, сдавлении опухолью, перекрытии выводных протоков конкрементами.
Патанатомия
Данная патология сопровождается существенным уменьшением размеров железы – до 20-18 г, консистенция значительно уплотнена, поверхность органа бугристая, капсула сращена с окружающей ее жировой тканью, а также соседними органами. Изменяется структура поджелудочной железы, характерно избыточное развитие соединительной ткани, которая может пролиферировать вокруг долек (перилобулярный склероз) либо диффузно (интралобулярный склероз). На микроскопическом уровне поражение характеризуется диффузным разрастанием фиброзной ткани (интраацинозный склероз), гибелью клеток железистой паренхимы.
При липоматозе, несмотря на то, что данное состояние характеризуется сохранением или даже увеличением размеров органа (псевдогипертрофия), его большая часть замещена жировой тканью, в которой находятся отдельные железистые участки. По наблюдениям специалистов в области клинической гастроэнтерологии и эндокринологии, большинстве случаев при данной патологии сохраняется островковый аппарат и эндокринная функция органа.
Симптомы атрофии
Клиническая картина атрофии поджелудочной железы определяется причиной ее развития (сахарный диабет, хронический панкреатит и другие). Однако в любом случае характерными симптомами являются экзокринная и эндокринная недостаточность. Экзокринная (внешнесекреторная) недостаточность железы характеризуется пониженной продукцией пищеварительных ферментов, а также бикарбонатов и других электролитов, которые нейтрализуют содержимое желудка, обеспечивая благоприятную для действия панкреатических ферментов среду. Типичными симптомами являются послабление стула, ухудшение аппетита, снижение веса.
Ранним симптомом недостаточности внешнесекреторной функции является стеаторея (повышенное выведение жиров с калом). Этот признак развивается при снижении секреции на 10% от нормы. Снижение веса происходит вследствие нарушения переваривания пищи, всасывания веществ в кишечнике, потери аппетита. При длительно существующей патологии развиваются признаки дефицита витаминов.
Эндокринная (внутрисекреторная) недостаточность проявляется нарушениями углеводного обмена, протекающими по типу гипергликемического синдрома. При этом симптомы сахарного диабета развиваются лишь у половины пациентов. Это объясняется тем, что инсулинпродуцирующие клетки обладают способностью лучше сохраняться при патологии в сравнении с ацинарными. Развивается дефицит инсулина, глюкагона. Пациента может беспокоить выраженная слабость, головокружение, жажда.
Диагностика
При обследовании пациента с атрофией поджелудочной железы определяется дефицит массы тела. Кожные покровы сухие, шелушащиеся. При уменьшении размеров железы пропальпировать ее не удается. Если причиной состояния стал панкреатит, возможна болезненность при прощупывании. Алгоритм диагностики включает:
- Анализы. При проведении биохимических анализов крови определяется снижение активности панкреатических ферментов. Характерными симптомами являются выявляемые при проведении копрограммы стеаторея (обнаружение в кале более 9% жиров от суточного употребления) и креаторея (большое содержание в кале мышечных волокон). Зачастую диагностируется повышение уровня глюкозы крови, что является поводом для консультации у эндокринолога или диабетолога.
- Визуализирующие методики. При УЗИ поджелудочной железы определяется уменьшение ее размеров, уплотнение структуры, повышение эхогенности, неровность контуров. Для более детальной визуализации органа, выяснения причины атрофии проводится МРТ поджелудочной железы. С целью оценки состояния протоковой системы, изменения которой характерны для хронического панкреатита, показана РХПГ - эндоскопическая ретроградная холангиопанкреатография (контрастное рентгенологическое исследование). С ее помощью можно выявить сужение главного панкреатического протока, неровность стенок, извилистость. Для исключения новообразований панкреаса проводится ангиография.
- Биопсию. Важным диагностическим методом является биопсия поджелудочной железы. При исследовании биоптата оценивается степень фиброза и деструкции паренхимы, степень повреждения железистых элементов, островков Лангерганса (инсулинпродуцирующие зоны). В случае липоматоза обнаруживается жировая дистрофия органа. Проведение биопсии позволяет оценить прогноз заболевания.

Лечение атрофии поджелудочной железы
Консервативные мероприятия
При атрофии панкреас обязательно назначается диетотерапия. Питание должно быть с минимальным содержанием жиров. Достаточно внимания следует уделять белково-энергетическому дефициту, коррекции гиповитаминозов. Обязательным мероприятием является полное прекращение курения, поскольку никотин нарушает продукцию бикарбонатов поджелудочной железой, в следствие чего значительно повышается кислотность содержимого двенадцатиперстной кишки.
Основным направлением терапии данной патологии является замещение экзокринной и эндокринной секреции поджелудочной железы. Для компенсации нарушенных процессов полостного пищеварения врач-гастроэнтеролог назначает ферментные препараты. Для достижения клинического эффекта препараты должны обладать высокой активностью липазы, быть устойчивыми к действию желудочного сока, обеспечивать быстрое высвобождение ферментов в тонкой кишке, активно содействовать полостному пищеварению. Данным требованиям соответствуют ферменты в виде микрогранул.
Поскольку именно липаза из всех ферментов панкреаса быстрее всего теряет активность, коррекция производится с учетом ее концентрации в препарате и выраженности стеатореи. Эффективность лечения оценивается по содержанию эластазы в кале и степени уменьшения стеатореи. Действие ферментных препаратов направлено и на устранение болевого синдрома, уменьшение вторичного энтерита, создание условий для нормализации кишечного микробиоценоза, улучшение углеводного обмена.
Коррекция эндокринной недостаточности проводится путем инсулинотерапии. При атрофии поджелудочной железы частично сохраняются островки Лангерганса, поэтому инсулин в организме продуцируется, но в малых количествах. Дозировка и режим введения инсулина определяются индивидуально в зависимости от течения патологии, этиологического фактора, данных суточного мониторирования глюкозы крови. Назначение ферментных препаратов значительно улучшает функцию поджелудочной железы в целом и углеводный обмен в том числе. Поэтому режим инсулинотерапии определяется в зависимости от дозировки и эффективности заместительной ферментной терапии.
Важным условием эффективной коррекции пищеварительных функций является нормализация микробиоценоза кишечника, поскольку на фоне приема ферментов создаются благоприятные условия для заселения патогенной флоры. Применяются пробиотики, пребиотики. Обязательно назначается витаминотерапия инъекционно, а также препараты магния, цинка, меди.
Хирургическое лечение
Хирургическое лечение данной патологии проводится в специализированных центрах. Осуществляется трансплантация островков Лангерганса с последующим удалением железы и заместительной ферментной терапией. Однако, поскольку атрофия зачастую является следствием тяжелых заболеваний с выраженным нарушением общего состояния пациента, такое лечение проводится редко.
Прогноз и профилактика
Прогноз при атрофии поджелудочной железы определяется степенью поражения экзокринных и эндокринных структур органа. Поскольку островковый аппарат частично сохранен, существует и остаточный синтез инсулина. Ввиду этого редко развивается кетоацидоз, но часто возникают гипогликемические состояния. Определение этиологии заболевания, устранение основной патологии, своевременное начало лечения позволяют достичь хороших результатов.
Профилактика заключается в своевременном лечении заболеваний, которые могут стать причиной атрофии панкреас. При наличии хронического панкреатита обязателен полный отказ от алкоголя, соблюдение диеты, поддержание достаточного уровня ферментативной активности железы.
Фиброз поджелудочной железы – это диффузное пери- и интралобулярное замещение здоровой функционирующей ткани поджелудочной железы соединительнотканными очагами. Основными симптомами являются выраженная экзокринная (нарушение пищеварения, снижение веса, диарея) и эндокринная недостаточность органа (нарушение углеводного обмена). Диагностика включает проведение лабораторных исследований, УЗИ поджелудочной железы, КТ, биопсии. Лечение направлено на коррекцию внешнесекреторной недостаточности (ферментные препараты), гипергликемии. Прогноз неблагоприятный: полное излечение невозможно, при адекватной терапии достижима компенсация панкреатической недостаточности.
МКБ-10
Общие сведения
Фиброз поджелудочной железы – клинико-морфологическая форма хронического воспалительного процесса панкреас, являющаяся исходом, завершающим этапом течения основного заболевания. Распространенность фиброза поджелудочной железы неуклонно растет в связи с увеличивающейся частотой острых и хронических панкреатитов; данная патология диагностируется более чем у 40% пациентов с заболеваниями панкреас.
При злоупотреблении спиртными напитками полное замещение паренхимы поджелудочной железы фиброзной тканью развивается в течение 15-20 лет, что приводит к инвалидизации и летальному исходу. Росту заболеваемости способствует неэффективное лечение основной патологии, несоблюдение пациентами рекомендаций, зачастую – продолжение алкоголизации. Лечением фиброза поджелудочной железы занимаются специалисты в области клинической гастроэнтерологии, терапии, хирургии.

Причины
Основной причиной развития фиброза поджелудочной железы является хронический панкреатит. Специалистами доказано, что очаги замещения функционирующих элементов соединительной тканью формируются в периоды обострения воспаления, и их распространенность зависит от стажа заболевания.
Фиброз поджелудочной железы также может развиваться при заболеваниях, сопровождающихся повышением давления в протоковой системе панкреас (при патологии желчевыводящих путей и желчного пузыря): панкреатическая гипертензия приводит к нарушению целостности протоков, повреждению паренхимы, воспалению. К редким причинам фиброза поджелудочной железы относят гиперлипидемию, муковисцидоз, воздействие токсических веществ (в том числе лекарственных препаратов: гипотиазида, ацетилсалициловой кислоты и других), травмы.
Факторы риска
К рецидивированию основной патологии и прогрессированию фиброза поджелудочной железы чаще всего приводит:
- употребление алкоголя;
- обилие в рационе жирной пищи;
- недостаток витаминов и антиоксидантов, микроэлементов;
- табакокурение, которое нарушает секрецию бикарбонатов поджелудочной железой.
Патогенез
Независимо от провоцирующих факторов, фиброз поджелудочной железы является следствием аутолиза ее паренхимы при активации протеолитических ферментов, отека, некроза и инфильтрации. Патогенез заболевания при воздействии алкоголя имеет особенности: в результате алкогольного повреждения снижается содержание в панкреатическом соке бикарбонатов и повышается уровень белка, вследствие чего белковые преципитаты в виде пробок обтурируют мелкие протоки, создавая условия для формирования фиброза поджелудочной железы.
Симптомы
Клиническая картина фиброза поджелудочной железы определяется внешнесекреторной недостаточностью (снижением секреции ферментов, бикарбонатов и уменьшением объема панкреатического сока) и нарушением углеводного обмена. Объем продуцируемых ферментов снижается на 80-90% и более, поэтому симптомы экзокринной недостаточности при фиброзе поджелудочной железы выражены существенно: снижается масса тела, имеет место диарея до восьми раз в сутки (при приеме ферментных препаратов и соблюдении пациентом диеты данный признак может быть менее выраженным или даже отсутствовать), стеаторея.
Вследствие нарушения секреции бикарбонатов снижается интрадуоденальный уровень рН, что приводит к активации цАМФ клеток кишечной стенки и секреторной диарее: наблюдается водянистый стул. Снижение массы тела вызвано не только нарушением переваривания пищи и ее всасывания в кишечнике, но и ограничением ее объема при болевом синдроме.
Осложнения
Длительная стеаторея при фиброзе поджелудочной железы приводит к дефициту жирорастворимых витаминов (К, А, Е, D), что проявляется нарушением адаптации зрения в условиях темноты, повышенной кровоточивостью, развитием остеопороза. У подавляющего большинства пациентов имеет место нарушение углеводного обмена, а у двух третей – признаки сахарного диабета (сухость во рту, жажда, общая слабость, кожный зуд, сонливость). Поскольку фиброзные изменения затрагивают все клетки островкового аппарата железы, снижается секреция и инсулина, и глюкагона. Диабет при фиброзе поджелудочной железы редко сопровождается гипогликемическими состояниями, кетоацидозом, ангиопатией.
Диагностика
Консультация гастроэнтеролога при фиброзе поджелудочной железы позволяет выявить некоторые объективные признаки патологии: дистрофические изменения (вплоть до кахексии), сухость кожи, языка, цианоз, покраснение лица, атрофию подкожной клетчатки в области проекции панкреас. Поджелудочная железа пальпируется в виде плотного тяжа. Лабораторно-инструментальная диагностика:
- Биохимические пробы. В лабораторных анализах определяется выраженное уменьшение содержания белка крови, снижение альбумино-глобулинового коэффициента. Активность панкреатических ферментов, в том числе амилазы, низкая (это неблагоприятный признак, свидетельствующий о тотальном поражении поджелудочной железы).
- УЗИ. Важный метод диагностики фиброза поджелудочной железы – УЗИ брюшной полости. Определяется диффузное повышение эхогенности органа, структура неоднородная, размеры уменьшены; возможно выявление расширения вирсунгова протока. Более информативна эндоскопическая ультросонография, которая позволяет выявить линейные тяжистые включения разной протяженности и формы, бугристость контуров, гиперэхогенность паренхимы.
- Рентгенодиагностика. При проведении ЭРХПГ выявляются изменения протокового аппарата, вызванные образованием рубцов. Для подтверждения диагноза может проводиться КТ поджелудочной железы.
- Пункционная биопсия. Если данный метод диагностики не дает необходимой информации, выполняется биопсия поджелудочной железы, которая является «золотым стандартом» диагностики фиброза поджелудочной железы и позволяет получить достоверные данные о морфологических изменениях органа.
Лечение фиброза поджелудочной железы
Лечение фиброза поджелудочной железы направлено на восполнение внешне- и внутрисекреторной недостаточности. Назначается диета № 5п, включающая стимулирующие секрецию ферментов блюда, продукты с высоким содержанием белка. Ограничиваются легкоусвояемые углеводы. При выраженной кахексии питание парентеральное. Этиотропное лечение заключается в устранении причин патологии (исключение употребления алкоголя, проведение холецистэктомии при желчнокаменной болезни, хирургическое лечение папиллостеноза и т. д.).
С целью замещения экзокринной недостаточности назначаются ферментные препараты: панкреатин, липаза и другие. При абсолютной недостаточности поджелудочной железы данные препараты применяются постоянно в максимальных дозировках. Критериями эффективности заместительной терапии являются прекращение снижения массы тела, снижение диспепсических явлений, устранение диареи. Коррекция нарушений углеводного обмена проводится пероральными сахароснижающими препаратами; крайне редко требуется инсулинотерапия. Вне эпизодов обострения основного заболевания показано санаторно-курортное лечение.
При выраженном болевом синдроме, неэффективности консервативной терапии, стремительном снижении веса, частых рецидивах панкреатита проводится хирургическое лечение фиброза (резекция поджелудочной железы в различных объемах).
Прогноз и профилактика
Прогноз при фиброзе поджелудочной железы определяется объемом функционирующей ткани, а также соблюдением пациентом рекомендованного лечения. При полном пожизненном отказе от алкоголя, правильном применении ферментных препаратов возможно длительное течение заболевания без существенного прогрессирования. Однако не существует методов, позволяющих устранить фиброз.
Профилактика патологии заключается в отказе от алкоголя, своевременном лечении заболеваний, которые могут стать причиной фиброза поджелудочной железы. Пациенты с диагностированным фиброзом подлежат диспансеризации. Дважды в год необходимо профилактическое обследование с оценкой наличия или отсутствия прогрессирования и проведением коррекции терапии (при необходимости).
Опухоли поджелудочной железы – новообразования с различной степенью клеточной дифференцировки, исходящие из тканей эндокринной либо экзокринной части поджелудочной железы. Доброкачественные новообразования часто никак не проявляются до достижения больших размеров; злокачественные - характеризуются опухолевой интоксикацией, синдромом сдавления окружающих сосудов, нервов, органов. В диагностике используют выявление онкомаркеров, ультрасонографию поджелудочной железы и желчных путей, РХПГ, МРПХГ, МРТ, КТ, пункционную биопсию поджелудочной железы. Лечение хирургическое либо комбинированное (в сочетании с химио- и лучевой терапией).
Общие сведения
Опухоли поджелудочной железы могут формироваться как в эндокринной, так и в экзокринной ее части, но преобладают экзокринные новообразования. Среди них превалируют злокачественные опухоли, в 90% случаев представленные аденокарциномой панкреатических протоков. Доброкачественные опухоли встречаются редко, развиваются в основном из клеток, производящих пищеварительные ферменты, а также выстилки протоков (цистаденома). Опухоли, сформировавшиеся из клеток Лангерганса (эндокринной части поджелудочной железы), могут быть гормонально активными или инертными. Гормонально активные опухоли имеют наиболее яркую клинику, так как продуцируют огромное количество биологически активных веществ и вызывают «гормональную бурю» в организме. Исследования в области онкопатологии поджелудочной железы подтверждают, что новообразования этого органа у женщин выявляются в два раза чаще, чем у мужчин, а пик заболеваемости приходится на 35-50 лет.
Классификация опухолей поджелудочной железы
Все новообразования по своему происхождению подразделяются на доброкачественные (высокодифференцированные) и злокачественные (недифференцированные). Кроме того, опухоли поджелудочной железы классифицируют по локализации, гистологическому строению, функциональным нарушениям. Новообразование поджелудочной железы может быть расположено в головке, теле, хвосте, островках Лангерганса, протоках; либо же локализация опухолевого узла может быть не уточнена.
По гистологическому строению в 80% случаев опухоли поджелудочной железы имеют эпителиальное происхождение (из ацинарных и эндокринных клеток, протокового эпителия, неясного или смешанного генеза), источником могут служить неэпителиальные ткани, кровеносные и лимфатические сосуды, также новообразования могут иметь дизонтогенетическое и метастатическое происхождение.
Выделяют следующие виды опухолей поджелудочной железы эпителиального генеза: из ацинарных клеток (доброкачественные – аденомы, злокачественные – ацинарно-клеточный рак), эпителия протоков (доброкачественные – цистаденомы, злокачественные – аденокарцинома, скирр, плоскоклеточный и анапластический рак).
Эндокринные опухоли поджелудочной железы могут происходить из клеток островков Лангерганса (инсулиномы, гастриномы, випомы) или быть диффузными (карциноид). По степени дифференцировки клеток они могут быть высоко-, средне- и низкодифференцированными; также встречаются эндокринные опухоли смешанного и неясного генеза, мукокарциноиды, недифференцированные виды рака, опухолевидные состояния (гиперплазия и эктопия эндокринных клеток поджелудочной железы, синдром полиэндокринной неоплазии).
Функциональная классификация опухолей поджелудочной железы включает в себя следующие состояния: отсутствие нарушений; неопределенное функциональное состояние; нарушение функций поджелудочной железы: гипофункция, гиперфункция (гипогликемия и гипергиликемия, ахлоргидрия, диарея, синдром Золлингера-Эллисона на фоне гастриномы, синдром Вернера–Моррисона на фоне полиэндокринной неоплазии, гиперсекреция серотонина).
Реже всего встречаются доброкачественные, лимфоидные и неэпителиальные опухоли поджелудочной железы, цистаденокарциномы, плоскоклеточный и ацинарный рак – описаны единичные случаи этих новообразований. Гормонально активные опухоли обычно хорошо отграничены от здоровых тканей, составляют не более 0,3% всех новообразований поджелудочной железы, в трех случаях их четырех представлены инсулиномой. Определить клинически злокачественную природу гормонально активных новообразований можно только по наличию гематогенных метастазов (чаще всего печеночных). Злокачественные новообразования протоков составляют 90% опухолей поджелудочной железы и 80% - панкреатобилиарной зоны.
Симптомы опухолей поджелудочной железы
Большинство опухолей поджелудочной железы могут никак себя не проявлять долгие годы. Если же клиника новообразования появилась, в пользу доброкачественного генеза опухоли говорят следующие факты: отсутствие рака поджелудочной железы в анамнезе по родственной линии, отсутствие выраженной клиники заболевания и признаков опухолевой интоксикации, медленный рост новообразования.
Аденомы панкреатического происхождения не имеют клинических проявлений, часто случайно обнаруживаются на операции либо аутопсии. Цистаденомы и цистаденокарциномы могут достигать огромных размеров и за счет этого визуализироваться и пальпироваться через переднюю брюшную стенку. При этом клиническая картина длительное время отсутствует и появляется на поздних стадиях, когда опухоль начинает сдавливать холедох и панкреатический проток, кишечник, близлежащие сосуды и нервы.
Наиболее яркую клинику имеют гормонально активные опухоли: перманентно повышенный уровень инсулина при инсулиноме приводит к гипогликемии, гастринома выражается в развитии синдрома Золлингера-Эллисона (пептические язвы, значительная гиперсекреция желудочного сока, злокачественное течение заболевания); випомы проявляются синдромом Вернера–Моррисона (диарея, гипокалиемия, ахлоргидрия); карциноид - гиперсеротонинемией и карциноидным синдромом (приливы по типу менопаузальных, диарея, спазматические боли в животе, недостаточность клапанного аппарата правых отделов сердца).
Клиника злокачественных опухолей панкреатических протоков обычно появляется только на поздних стадиях заболевания, имеет как общие проявления, так и признаки поражения соседних органов. Общие симптомы связаны с опухолевой интоксикацией: боли в животе, иррадиирующие в спину, похудение, астения, анемия, отсутствие аппетита. Прорастание опухоли в окружающие органы и ткани манифестирует симптомами поражения этих органов (асцит при сдавлении сосудов, желтуха и экзокринная недостаточность поджелудочной железы при обтурации опухолью холедоха и общего желчного протока, симптомы поражения желудка и т. д.).
Диагностика опухолей поджелудочной железы
Для своевременной диагностики и точного определения типа опухоли поджелудочной железы требуется слаженная работа гастроэнтеролога, хирурга и врача-эндоскописта. Без использования современных способов визуализиции и химического типирования новообразований выявить опухоль поджелудочной железы практически невозможно. Следует помнить о том, что даже самые современные диагностические аппараты и методики не всегда способны дать ответ на вопрос о характере поражения органа, большое значение при диагностировании новообразований панкреатической зоны имеет и клинический опыт лечащего врача.
На поражение поджелудочной железы укажут такие исследования, как биохимический анализ крови, копрограмма, исследование секреции пищеварительных соков при эзофагогастродуоденоскопии. Следующим этапом будет назначение таких неинвазивных методов исследования, как гастрография и дуоденография, магнитно-резонансная панкреатохолангиография, магнитно-резонансная томография поджелудочной железы, компьютерная томография желчевыводящих путей. После выявления опухоли в тканях поджелудочной железы (размеры новообразования могут варьировать от 2 мм до 200 мм) производят определение в крови уровня гомонов и метаболитов (адреналин, норадреналин, серотонин, кортизол, гастрин, вазоактивный пептид, инсулин, глюкагон, панкреатический и С-пептид, соматостатин и др.) и онкомаркеров (СА19-9, СА 50, СА 242, СЕА).
Для уточнения характера поражения используются также и инвазивные методики: эндоскопическая ретроградная холангиопанкреатография; целиакография с взятием крови из панкреатических вен и определением в ней гормонов; чрескожная чреспеченочная холангиография; пункционная биопсия поджелудочной железы; лапароскопия. Огромное количество исследований, необходимых для выявления опухоли поджелудочной железы, говорит о том, что диагностика этого состояния является очень сложной, а единой схемы диагностического поиска на сегодняшний день еще не найдено.
Дифференцировать опухоли поджелудочной железы следует с хроническим панкреатитом, панкреатическими кистами, внеорганными забрюшинными опухолями и опухолями брыжейки кишечника, пенетрацией язвы желудка или ДПК, аневризмами крупных сосудов, эхинококкозом и цистицеркозом с поражением гепато-панреатической зоны.
Лечение опухолей поджелудочной железы
Лечение доброкачественных опухолей только хирургическое: дистальная резекция поджелудочной железы, резекция головки поджелудочной железы, панкреатодуоденальная резекция, энуклеация опухоли. После операции проводится обязательное гистологическое исследование для уточнения типа новообразования.
При злокачественных новообразованиях основные направления терапии выбираются, исходя из клинической ситуации. Если у пациента выявляется злокачественный карциноид либо гормонально активный рак, локализованный в головке панкреас, производится панкреатодуоденальная резекция с сохранением пилорического отдела желудка. При гастриномах часто осуществляется гастрэктомия, селективная ваготомия, панкреатодуоденальная резекция, однако ведущими гастроэнтерологами и хирургами по сей день ведутся споры об эффективности и целесообразности указанных оперативных пособий.
В комплексную терапию опухолей поджелудочной железы могут включать лучевую и полихимиотерапию (при высоком коэффициенте пролиферации, активном синтезе гормонов, малигнизации и метастазировании новообразования). Паллиативное лечение злокачественных новообразований преследует цель восстановления оттока желчи и панкреатических соков, устранение воспалительного процесса в желчных путях, улучшение качества жизни пациента. С паллиативной целью проводятся такие операции: наружное дренирование желчных протоков по Керру и по Холстеду, чрескожное транспеченочное дренирование желчных протоков, холецистэктомия, эндоскопическое бужирование опухолевой стриктуры внепеченочных желчных протоков, эндоскопическое стентирование холедоха и др.
Консервативная терапия доброкачественных нейроэндокринных опухолей с низким уровнем продукции гормонов, невыраженным проявлением эндокринной гиперсекреции включает в себя комбинацию сандостатина и омепразола. В лечении такой опухоли, как гастринома, активно используют комбинацию Н2-блокаторов гистаминовых рецепторов, холинолитиков и ингибиторов протонной помпы.
Прогноз и профилактика опухолей поджелудочной железы
Прогноз при злокачественных опухолях поджелудочной железы крайне неблагоприятный, что связано с бессимптомным их течением и поздней диагностикой. Радикальное удаление опухоли возможно только у каждого десятого пациента, у каждого второго новообразование рецидивирует, а у 95% в течение первых 12 месяцев после операции обнаруживаются отдаленные метастазы. Комплексная терапия не намного улучшает показатели выживаемости: в течение пяти лет в живых остается не более 5% пациентов со злокачественными опухолями панкреатической зоны.
Прогноз при доброкачественных опухолях поджелудочной железы благоприятный – у девяти больных из десяти удается добиться полного излечения. Кроме того, доброкачественные новообразования этой локализации встречаются казуистически редко. Специфической профилактики опухолей поджелудочной железы не существует, однако соблюдение здорового образа жизни, правильное питание, достаточный отдых снижают вероятность формирования любых новообразований в организме.
Кафедра хирургических болезней с курсом урологии Омской государственной медицинской академии;
Областная клиническая больница, Омск
Областная клиническая больница, Омск, кафедра факультетской хирургии с курсом урологии Омской государственной медицинской академии
ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
Редкое осложнение хронического панкреатита
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2013;(3): 92‑94
Никулина С.А., Пропп А.Р., Деговцов Е.Н. Редкое осложнение хронического панкреатита. Хирургия. Журнал им. Н.И. Пирогова. 2013;(3):92‑94.
Nikulina SA, Propp AR, Degovtsov EN. The rare complication of chronic pancreatitis. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2013;(3):92‑94. (In Russ.).
Кафедра хирургических болезней с курсом урологии Омской государственной медицинской академии;
Областная клиническая больница, Омск
Кафедра хирургических болезней с курсом урологии Омской государственной медицинской академии;
Областная клиническая больница, Омск
Областная клиническая больница, Омск, кафедра факультетской хирургии с курсом урологии Омской государственной медицинской академии
ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
Больной Ш., 32 лет, поступил в стационар Омска с жалобами на боль в эпигастральной области и правом подреберье с иррадиацией в поясницу, рвоту, похудание. Боли в животе беспокоили последние 2 года. В 2009 г. диагностирована желчнокаменная болезнь, в 2010 г. выполнена диагностическая лапароскопия по поводу панкреатита. В феврале 2012 г. на фоне обострения ХП впервые появилась желтушность кожного покрова. На фоне консервативного лечения желтуха уменьшилась, но боли сохранялись. Появилась рвота после еды, приносящая кратковременное облегчение. За 1,5 мес больной похудел на 20 кг.
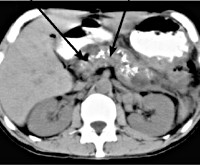
В апреле 2012 г. доставлен в Областную клиническую больницу с декомпенсированным стенозом выходного отдела желудка. В биохимических тестах гипербилирубинемия до 89 мкмоль/л, высокий уровень амилазы мочи (7350 ед/л). Содержание онкомаркера СА 19-9 менее 2,7 Е/мл (при норме 0,00-39,00 Е/мл). На основании данных фиброгастродуоденоскопии отмечено сдавление двенадцатиперстной кишки. При УЗИ органов брюшной полости обнаружены конкременты в желчном пузыре и увеличение головки поджелудочной железы. По данным мультиспиральной компьютерной томографии в проекции головки поджелудочной железы выявлено объемное образование размером 72×67×95 мм, неоднородной плотности с жидкостным компонентом в центре, инфильтрацией парапанкреатической клетчатки, отсутствием дифференцировки тканей между головкой поджелудочной железы и стенкой вертикальной ветви двенадцатиперстной кишки (рис. 1, а). Рисунок 1. Компьютерные томограммы. а - с внутривенным болюсным контрастированием. Киста головки поджелудочной железы, инфильтрация стенки двенадцатиперстной кишки. Также диагностированы расширение протока поджелудочной железы до 5 мм и билиарная гипертензия с увеличением размеров желчного пузыря до 98×36 мм и общего желчного протока до 13 мм (рис. 1, б). Рисунок 1. Компьютерные томограммы. б - признаки внутрипротоковой и билиарной гипертензии.

Показанием к неотложной операции 25.04 послужили боли в животе и декомпенсированный стеноз выходного отдела желудка. Произведена верхнесреднесрединная лапаротомия. При ревизии выявлены увеличенный желчный пузырь с конкрементами, расширение общего желчного протока до 13 мм. В области головки поджелудочной железы инфильтрат размером до 7 см, в который вовлечены двенадцатиперстная кишка, большой сальник, печеночный изгиб ободочной кишки. При мобилизации головки поджелудочной железы по Кохеру вскрылась ретропанкреатическая киста головки поджелудочной железы диаметром 3 см с имеющейся прикрытой перфорацией задней стенки вертикальной ветви двенадцатиперстной кишки (рис. 2). Рисунок 2. Интраоперационная фотография. Перфорация стенки двенадцатиперстной кишки. Интраоперационный диагноз: ХП с преимущественным поражением головки поджелудочной железы. Ретропанкреатическая киста головки поджелудочной железы с прикрытой перфорацией задней стенки вертикальной ветви двенадцатиперстной кишки. Декомпенсированный стеноз выходного отдела желудка. Желчнокаменная болезнь. Единственным верным вариантом хирургического лечения было выполнение панкреатодуоденальной резекции, что и было сделано.

Макропрепарат: панкреатодуоденальный комплекс - на разрезе головка поджелудочной железы плотная, фиброзно-измененная, диаметром до 6 см, в центре гнойная полость (киста) диаметром до 25 мм (рис. 3). Рисунок 3. Макропрепарат: панкреатодуоденальный комплекс. Гистологическое заключение: морфологическая картина ХП с массивными участками фиброза, поражением островковой части, наличием очагов микроабсцедирования. Послеоперационный период протекал удовлетворительно. Рана зажила первичным натяжением. На 16-й день после операции больной выписан в удовлетворительном состоянии.
Комментарий
В клиническом наблюдении представлен вариант неблагоприятного течения хронического панкреатита с развитием панкреатической, билиарной гипертензий и стенозированием просвета двенадцатиперстной кишки. С учетом описанных клинических проявлений заболевания (постоянные боли в животе, механическая желтуха, нарушение эвакуации из желудка), в совокупности с результатами компьютерной томографии (кистозная трансформация головки поджелудочной железы с отсутствием «дифференцировки тканей между головкой поджелудочной железы и стенкой вертикальной ветви двенадцатиперстной кишки») у больного, страдающего хроническим панкреатитом, имелась дуоденальная дистрофия. К сожалению, в приведенном наблюдении в протоколе КТ отсутствуют указания на состояние стенок вертикальной части двенадцатиперстной кишки (ДПК), а в протоколе операции нет детального описания состояния ткани головки поджелудочной железы и ДПК. Поскольку морфологическое исследование ткани ДПК не проводилось (?) или не описано в статье, об окончательной верификации диагноза говорить невозможно. С высокой степенью вероятности можно предположить, что киста, которая была вскрыта при мобилизации ДПК по Кохеру, исходила из стенки ДПК, а не из головки поджелудочной железы.
Дуоденальная дистрофия описана Potet и Duclert в 1970 г. и является следствием гетеротопии ткани поджелудочной железы в стенку вертикальной части ДПК [1] . Как правило, дуоденальная дистрофия возникает у больных, страдающих хроническим панкреатитом, значительно реже она бывает как самостоятельное заболевание. Воспаление эктопированной ткани поджелудочной железы и ретенция секрета приводят к образованию кист в толще стенки ДПК (кистозная форма) или воспалительных инфильтратов (солидная форма). В результате просвет ДПК стенозируется, возникает нарушение эвакуации на уровне вертикальной части ДПК. Основным клиническим признаком дуоденальной дистрофии является нарушение эвакуации из желудка, что требует дифференциальной диагностики со стенозом привратника язвенной этиологии или стенозирующей опухолью выходного отдела желудка. Диагноз устанавливается при компьютерной или магнитно-резонансной томографии и верифицируется при эндосонографическом исследовании, которое обладает наибольшей информативностью. При сочетании дуоденальной дистрофии с хроническим панкреатитом операцией выбора является пилоросохраняющая панкреатодуоденальная резекция, а в специализированных стационарах - резекция головки поджелудочной железы с резекцией вертикальной части ДПК. При кистозной форме дуоденальной дистрофии без сопутствующего хронического панкреатита целесообразно выполнение эндоскопической фенестрации кист, располагающихся в стенке ДПК.
Описанное авторами клиническое наблюдение подчеркивает актуальность поиска различных осложнений хронического панкреатита и пограничных с ним заболеваний. К сожалению, врачи поликлиник и муниципальных стационаров, как правило, не имеют представления об этом заболевании. В то время как при наличии настороженности в плане выявления дуоденальной дистрофии и целенаправленном диагностическом поиске правильный диагноз не представляет большого труда и принесет удовлетворение лечащему врачу и надежду на выздоровление пациенту. Хирургическое лечение больных с осложненными формами хронического панкреатита и дуоденальной дистрофией целесообразно проводить в специализированных хирургических стационарах.
Проф. А.Г. Кригер
[1] Potet F., Duclert N. Cystic dystrophy on aberrant pancreas of the duodenal wall. Arch Fr Mai App Dig 1970; 59: 223—238.
Читайте также:

