Что такое ороговение плоского эпителия
Обновлено: 27.04.2024
Гиперкератоз плоского эпителия или лейкоплакия – распространенная гинекологическая патология среди женщин детородного возраста. Болезнь часто обнаруживается при профилактическом гинекологическом осмотре. Визуально патологию определяют по наличию на слизистой нижнего сегмента матки белых выпуклых бляшек, разного размера и формы. Никаких симптомов женщина может не испытывать. Для постановки окончательного диагноза проводятся дополнительные анализы: соскоб шейки матки, кольпоскопия и биопсия. Выбор лечения зависит от разновидности гиперкератоза: от антибактериальных и гормональных препаратов до хирургических методов.
Что такое лейкоплакия шейки матки
Болезнь представляет собой разрастание, утолщение и ороговение эпителиального слоя слизистой влагалищного или нижнего отдела матки, реже – цервикального канала. Нарушение развивается из-за отложения в эпителиальной ткани кератина, жиров и постепенной перестройки клеток, в результате которой образуются плотные чешуйки. Опасность лейкоплакии заключается в высоком риске преобразования патологии в рак, поэтому в гинекологии этому нарушению уделяют повышенное внимание.

Признаки патологии
Болезнь чаще протекает бессимптомно. В редких случаях нарушение сопровождается обильными жидкими выделениями белого цвета с неприятным запахом. Иногда наблюдается выделение крови после полового контакта.
Чаще обнаруживается гиперкератоз во время гинекологического осмотра с помощью зеркал. Визуально патологию определяют по наличию на слизистой нижнего сегмента матки белых выпуклых бляшек, разного размера и формы.
Причины болезни
Развитие лейкоплакии часто связывают с инфицированием вирусом папилломы человека (ВПЧ). Этот патоген попадает в организм при незащищенном половом акте и обнаруживается у половины женщин репродуктивного возраста. Серьезную опасность представляют разновидности вируса с высоким онкогенным риском, ведь именно они часто обнаруживаются у пациенток с гиперкератозом. Попав в организм, ВПЧ часто не вызывает никаких симптомов. В отдельных случаях у инфицированных обнаруживаются кондиломы - характерные образования на слизистой половых органов.
Как правило, в течение 2 лет ВПЧ подавляется естественным иммунитетом и не представляет опасности, однако иногда вирус так и остается в организме, что повышает риск развития гиперкератоза плоского эпителия.
Помимо этого также выделяют ряд факторов, благоприятствующих возникновению болезни:
- гормональные нарушения, в том числе сбои в работе щитовидной железы и сахарный диабет;
- нарушение регуляции менструального цикла на уровне гипоталамуса и гипофиза;
- те или иные нарушения менструального цикла, в том числе и аменорея – отсутствие месячных в течение полугода;
- инфекции, передающиеся половым путем: трихомониаз, гонорея, хламидиоз, герпес, цитомегаловирусная инфекция и др.;
- эрозии и эктопии;
- снижение местного иммунитета;
- воспаления влагалища и цервикального канала;
- травмы слизистой, полученные в результате абортов, выскабливания и других агрессивных гинекологических вмешательств.
Также повышают риск развития лейкоплакии регулярные грубые половые акты и хаотичная интимная жизнь без применения барьерных средств контрацепции.

Виды лейкоплакии
Эпителий нижней зоны влагалищной части матки или эктоцервикса состоит из нескольких слоев: поверхностный, промежуточный, парабазальный и базальный. Исходя из того, какие слои оказались поражены, выделяют два типа гиперкератоза плоского эпителия:
- Простой. Характеризуется поражением клеток поверхностного слоя и отсутствием патологических изменений в остальных слоях. В этом случае нарушение считается фоновым, то есть повышающим риск развития онкологии при наличии других неблагоприятных факторов.
- Пролиферативный. При этой форме кератоза поражаются все слои эпителия эктоцервикса. Нарушается деление и дифференцировка клеток.
Пролиферативный гиперкератоз также называют дисплазией шейки и расценивают это состояние как предраковое. В этом случае требуется хирургическое вмешательство и тщательное наблюдение.
Диагностика
Первичный метод диагностики – визуальный гинекологический осмотр.
Для постановки окончательного диагноза назначаются следующие способы исследования:
- Анализ соскоба шейки матки на наличие атипичных клеток. При патологии в исследуемом материале определяются клетки с признаками ороговения, плотные чешуйки.
- Кольпоскопия – метод исследования нижнего сегмента матки с помощью специального прибора – кольпоскопа, позволяющего рассмотреть ткани под увеличением. В диагностике гиперкератоза применяется для определения характера и оценки размеров пораженной ткани.
- Шиллер–тест. Проводится в ходе кольпоскопии и заключается в нанесении на слизистую нижней части матки йодного раствора. Атипичные участки не окрашиваются йодом.
- Выскабливание цервикального канала – способ, подразумевающий удаление верхнего эпителиального слоя с цервикального канала для исследования удаленной ткани на наличие раковых клеток.
- Биопсия. Главный метод исследования при подозрении на гиперкератоз шейки матки, исключающий или подтверждающий онкологический процесс.
Также пациенткам назначается анализ отделяемого цервикального канала на ВПЧ, микроскопическое и бактериологическое исследование мазков, гормональные и иммунологические исследования.
Лечение
Выбор тактики терапии зависит от разновидности диагностированного гиперкератоза. В любом случае врачебная помощь будет направлена на лечение болезней, вызвавших нарушение, и устранение очагов лейкоплакии.

При наличии бактериальных инфекций назначаются антибиотики, при цитомегаловирусной инфекции или присутствии в организме ВПЧ проводится противовирусная терапия. Также пролечиваются воспалительные болезни женских половых органов и, по возможности, стабилизируется гормональный фон. Сами очаги гиперкератоза при необходимости устраняются с помощью следующих хирургических методов:
- криогенное воздействие – прижигание пораженных участков жидким азотом;
- радиоволновая деструкция – разрушение патологической ткани с помощью радиоволн;
- аргоноплазменная коагуляция – относительно новый метод разрушения пораженных тканей с помощью радиоволн и газа аргона;
- лазерная вапоризация – «выпаривание» патологических участков с помощью лазера;
- диатермокоагуляция – прижигание электрическим током;
- химическое прижигание;
- конизация – удаление части шейки матки и цервикального канала с помощью радиоволн или хирургического скальпеля;
- ампутация шейки матки – удаление конусовидного сегмента нижней части матки вместе с пораженной слизистой цервикального канала, которая спустя время после операции самостоятельно заменяется здоровой.
Последние 2 варианта применяются в тяжелых случаях. После любого из хирургических вмешательств пациенткам назначается половой покой до 2 месяцев, в зависимости от масштаба поражения.
Перечисленные процедуры не лишают женщину возможности забеременеть и вести полноценную интимную жизнь в будущем.
Профилактика
Чтобы предотвратить гиперкератоз плоского эпителия, следует вовремя лечить инфекционные и воспалительные болезни женских половых органов. При этом не заниматься самолечением, которое может только усугубить ситуацию, а обращаться за помощью к врачу-гинекологу. Кроме того, для предупреждения болезни следует соблюдать следующие рекомендации:
- избегать случайных половых связей;
- пользоваться презервативами;
- избегать стрессов;
- не допускать переохлаждений;
- не применять гормональные контрацептивы без предварительной консультации врача.
После обнаружения и хирургического лечения гиперкератоза пациентке 2 раза в год назначают кольпоскопию, анализы на ВПЧ и на наличие онкологических клеток в отделяемом цервикального канала. При отсутствии осложнений в течение 2 лет женщину переводят на обычный режим наблюдения.
Раннее выявление лейкоплакии имеет большое значение в профилактике рака шейки матки, поэтому для женщин крайне важны регулярные гинекологические осмотры. Посещать врача нужно 1–2 раза в год.
При обнаружении гиперкератоза следует соблюдать указания доктора и вовремя проходить назначенные обследования. Вовремя диагностированное нарушение при грамотном лечении и устранении первопричины не представляет опасности для жизни пациентки, а также не лишает ее возможности забеременеть и родить здорового ребенка.
Видео

* Представленная информация не может быть использована для самостоятельной постановки диагноза, определения лечения и не заменяет обращение к врачу!
Жизнь измеряется не количеством вдохов, которые мы делаем, а моментами, от которых у нас перехватывает дыхание
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
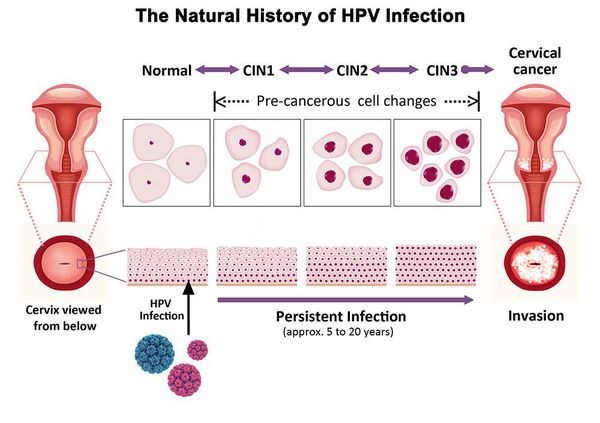
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Причины дисплазии шейки матки
Папилломавирусная инфекция (ВПЧ) — основная причина дисплазии и рака шейки матки. К болезни приводит длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
К факторам риска дисплазии шейки матки относится длительный приём контрацептивов и курение. Выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Другие факторы риска — раннее начало половой жизни, большое число и частая смена половых партнеров, употребление алкоголя, сопутствующие половые инфекции, много беременностей и родов. Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
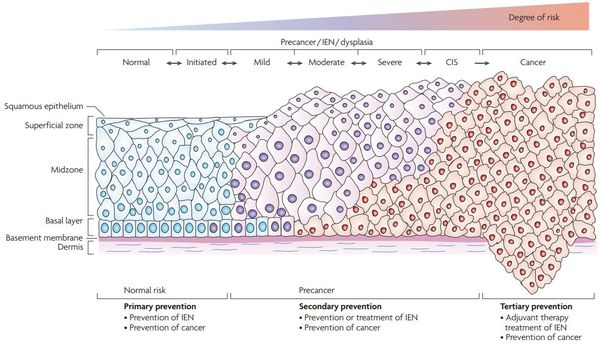
Классификация и стадии развития дисплазии шейки матки
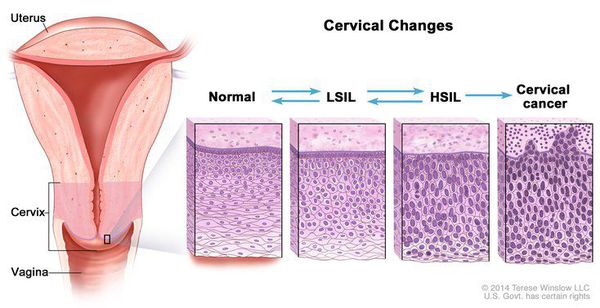
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
- нормальные мазки, без изменений клеток шейки матки (NILM, Negative for intraepithelial lesion or malignancy);
- «непонятные» мазки без определенного значения, по которым нельзя определить характер поражения, однако они при этом не являются нормой (ASC-US, Atypical Squamous Cells of Undetermined Significance) или, что хуже, ASC-H, Atypical squamous cells cannot exclude HSIL, обнаружение атипичных клеток плоского эпителия, не исключающее SIL высокой степени);
- предраки низкой (LSIL, Low Grade Squamous Intraepithelial Lesion) и высокой (HSIL, High Grade Squamous Intraepithelial Lesion) степени.
Классификация Папаниколау
- 1-й класс — нормальная цитологическая картина (отрицательный результат);
- 2-й класс — изменение морфологии клеток, которое обусловлено воспалением во влагалище и (или) шейке матки;
- 3-й класс — единичные клетки с аномалией ядер и цитоплазмы (подозрение на злокачественное новообразование);
- 4-й класс — отдельные клетки с явными признаками озлокачествления;
- 5-й класс — много типично раковых клеток (злокачественное новообразование).
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя выделяют три степени дисплазии шейки матки:
- ЦИН 1 (дисплазия слабой степени) — признаки папилломавирусной инфекции (койлоцитоз и дискератоз). Поражение до 1/3 толщины клеточного пласта;
- ЦИН 2 (дисплазия средней степени) — поражена 1/2 толщины клеточного слоя;
- ЦИН 3 (дисплазия тяжелой степени) — поражение более 2/3 клеточного слоя. [8]
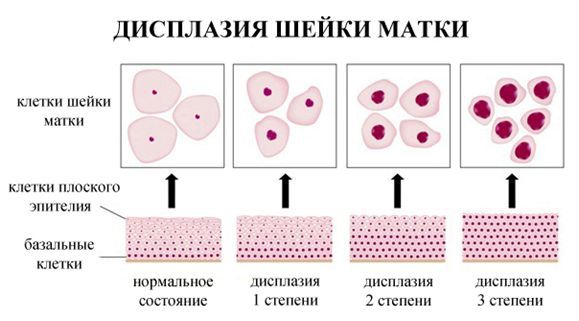
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
| Система Папаниколау | Описательная система ВОЗ | CIN | Терминологи- ческая система Бетесда (ТСБ) |
|---|---|---|---|
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
| Класс 2 (метаплазия эпителия, воспалительный тип) | Атипия, связанная с воспалением | Реактивные изменения клеток ASC: ASC - US, ASC - H | |
| Класс 3 ("дискариоз") | Слабая дисплазия | CIN 1 койлоцитоз | LSIL |
| Умеренная дисплазия | CIN 2 | HSIL | |
| Тяжелая дисплазия | CIN 3 | ||
| Класс 4 (клетки, подозрительные на рак или карцинома in situ | Карцинома in situ | ||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
Осложнения дисплазии шейки матки
Последствия дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
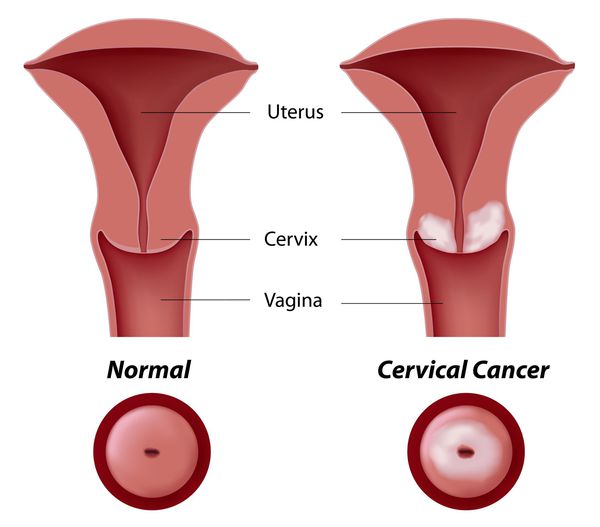
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
Методы диагностики дисплазии шейки матки
В России система цервикального скрининга включает последовательность действий:
- Цитологическое исследование: РАР-тест;
- ВПЧ-тестирование: в США и странах Евросоюза ВПЧ-тест применяется для первичного скрининга рака шейки матки (РШМ). В России его использование вариативно: при первичном скрининге в сочетании с РАР-тестом, в качестве самостоятельного теста, при ведении пациенток с неясными результатами РАР-теста (ASCUS) и для наблюдения паценток после лечения HSIL;
- Кольпоскопия: показаниями к исследованию являются положительные результаты РАР-теста (класс 2-5). Метод основан на осмотре шейки матки при помощи увеличивающих оптических систем и проведения диагностических проб с растворами уксусной кислоты и йода (Люголя). С помощью кольпоскопии определяют локализацию поражения, его размер, выбирают участок для проведения биопсии, определяют тактику лечения.
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
- Зона трансформации 1 типа — переходная зона видна полностью. Это самый оптимальный и прогностически «благоприятный» вариант кольпоскопического заключения.
- Зона трансформации 2 типа — переходная зона частично скрыта в канале шейки матки. Адекватно оценить такую картину сложно, так как наиболее измененные участки могут быть не видны и пропущены.
- Зона трансформации 3 типа — переходная зона находится глубоко в канале шейки матки и оценить её кольпоскопически невозможно. Кольпоскопия в этом случае считается неинформативной, поскольку глубина залегания патологического очага остается неизвестной.
- Биопсия: прицельная или расширенная биопсия (конизация) всегда должна выполняться под контролем кольпоскопии. Выбор метода биопсии зависит от типа поражения, возраста пациентки и зоны трансформации. Важной информацией, которую дает биопсия, является возможность иммуногистохимического определения маркера ранней диагностики дисплазии с высокой степенью риска озлокачествления: p16INK4a.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии.
Хирургическое лечение дисплазии
При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
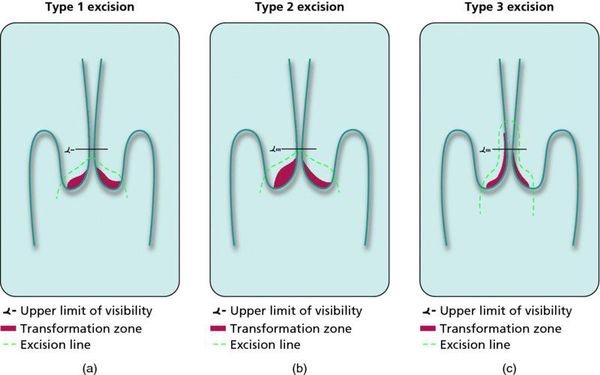
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
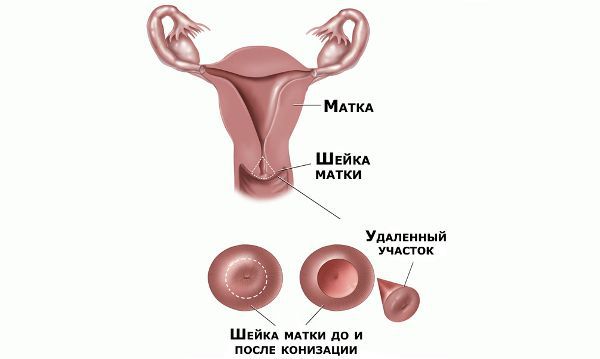
Реабилитация после хирургического лечения
В течение месяца после операции следует воздержаться от спринцеваний, половых контактов и не пользоваться тампонами. На 2–3 недели исключают тяжёлые физические нагрузки и тепловые процедуры. Незначительные сукровичные выделения, усиливающиеся иногда до менструальноподобных, в течение 10–20 дней после операции — это нормальное явление.
При реабилитации после хирургического лечения шейки матки эффективны препараты, содержащие антисептик и стимулятор регенерации эпителия.
После лечения возможен рецидив, поэтому необходимо пожизненное наблюдение: цитологический мазок через 6 и 12 месяцев после операции, затем раз в год в течение 10 лет, далее раз в 3 года.
Планировать беременность после операции на шейке матки можно не ранее, чем через 3–6 месяцев. Эти сроки будут зависеть от глубины эксцизии или конизации и длины шейки матки [9] .
Лечение дисплазии при беременности
В большинстве случаев лечение должно быть отложено на послеродовый период. При беременности на фоне дисплазии шейки матки каждые три месяца проводится кольпоскопический и цитологический контроль. При выявлении рака шейки матки пациентку консультирует онкогинеколог. Доктор подбирает тактику лечения, может потребоваться прервать беременность по онкологическим показаниям [9] .
Прогноз. Профилактика
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
- курение;
- длительное использование гормональных контрацептивов;
- многократные травматичные роды;
- ВИЧ-инфекция.
- У пациенток с ЦИН часто обнаруживают вирус простого герпеса 2 типа, цитомегаловирусную инфекцию, хламидийную урогенитальную инфекцию, бактериальный вагиноз, ассоциированный с резким снижением или отсутствием вагинальной лактофлоры, повышенным ростом во влагалище Gardnerella vaginalis и Atopobium vaginae, повышение концентрации в бакпосеве грибов рода Candida, Mycoplasma hominis.
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан "Об утверждении порядка проведения диспансеризации определенных групп взрослого населения", осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Лейкоплакия — поражение слизистой оболочки, проявляющееся очаговым ороговением многослойного плоского эпителия. Цвет кератина ороговевшего эпителия обуславливает белый или сероватый цвет очагов лейкоплакии. Заболевание встречается на слизистой полости рта, дыхательных путей, моче-половых органов, в области анального отверстия. Лейкоплакия относится к предраковым заболеваниям и может подвергаться злокачественному перерождению. В связи с этим большое диагностическое значение имеет биопсия пораженных участков слизистой с последующим гистологическим и цитологическим исследованием полученного материала. При выявлении в ходе исследования клеточной атипии показано удаление пораженного лейкоплакией участка.
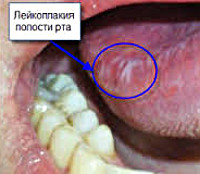
Общие сведения
Лейкоплакия является дискератозам, то есть нарушениям ороговения. Она развивается чаще у людей среднего и пожилого возраста. Так лейкоплакия шейки матки наиболее часто встречается у женщин в возрасте 40 лет. Она занимает 6% от всех заболеваний шейки матки. Лейкоплакия гортани составляет треть всех предраковых состояний гортани. По данным различных наблюдений трансформация лейкоплакии в рак происходит в 3-20% случаев. Однако выделяют случаи простой лейкоплакии, которая не сопровождается атипией клеток и не являются предраковыми состояниям, а относятся к фоновым процессам организма.

Причины возникновения лейкоплакии
Причины и механизм возникновения лейкоплакии до конца не выяснены. Большую роль в развитии заболевания отводят воздействию внешних провоцирующих факторов: механического, химического, термического и др. раздражения слизистых. Например, по наблюдению гинекологов треть женщин с лейкоплакией шейки матки имеют в анамнезе данные про проведение диатермокоагуляции. Это же подтверждают случаи лейкоплакии, связанные с профессиональными вредностями (воздействие на слизистые каменноугольной смолы, пека и др.).
Особенно опасно сочетанное влияние на слизистую сразу нескольких факторов. Так возникновение лейкоплакии слизистой рта часто обусловлено образующимся от разнородных металлических протезов гальваническим током и механической травматизацией слизистой этими протезами. У курильщиков обычно наблюдается лейкоплакия красной каймы губ. Она обусловлена воздействием на слизистую химических веществ табачного дыма и термического фактора (особенно регулярного прижигание губы, происходящего при полном выкуривании сигареты), а также хронического травмирования слизистой сигаретой или мундштуком трубки.
Причиной лейкоплакии могут быть хронические воспалительные и нейродистрофические изменения слизистой оболочки (например, при стоматите, гингивите, вагините, хроническом цистите и др.) Вероятно, определенную роль в развитии лейкоплакии имеют наследственные факторы, поскольку ее возникновение наблюдается у пациентов с врожденными дискератозами.
Не последнюю роль в развитии лейкоплакии играют и внутренние факторы, связанные с состоянием организма человека. Это недостаточность витамина А, гормональные отклонения, инволюционная перестройка слизистой половых органов, гастроэнтерологические заболевания, вызывающие снижение устойчивости слизистых оболочек к внешним раздражающим факторам.
Классификация лейкоплакии
По особенностям морфологических проявлений выделяют следующие формы лейкоплакии:
- плоская;
- веррукозная (бородавчатая);
- эрозивная
Каждая последующая форма заболевания развивается на фоне предыдущей и является одним из этапов происходящего патологического процесса.
Симптомы лейкоплакии
Чаще всего лейкоплакия поражает слизистую оболочку полости рта в области щек, углов рта, нижней губы, реже в процесс вовлекается боковая поверхность и спинка языка, слизистая в области альвеолярных отростков. Лейкоплакия мочеполовых органов может располагаться на слизистой клитора, вульвы, влагалища, шейки матки, головки полового члена, уретры и мочевого пузыря. Лейкоплакия дыхательных путей чаще локализуется в области голосовых связок и на надгортаннике, редко в нижнем отделе гортани.
Лейкоплакия представляет собой единичные или множественные белесоватые или бело-серые очаги с четкими контурами. Они могут быть различной формы и размеров. Как правило, изменения слизистой развиваются незаметно, не вызывая никаких негативных ощущений. В связи с этим заболевание часто бывает случайной диагностической находкой при посещении стоматолога, проведении кольпоскопии, операции по обрезанию крайней плоти (циркумцизио) и т. п. Исключениями являются лейкоплакия слизистой ладьевидной ямки мочеиспускательного канала, которая приводить к затруднению мочеиспускания, и лейкоплакия гортани, вызывающая кашель, охриплость голоса и дискомфорт при разговоре.
Процесс развития лейкоплакии состоит из нескольких переходящих один в другой этапов. Он начинается с появления на участке слизистой оболочки небольшого, неярко выраженного воспаления. В дальнейшем происходит ороговение эпителия воспаленного участка с формированием характерного белого очага плоской лейкоплакии. Часто белый цвет измененной слизистой напоминает налет или пленку. Однако попытка снять «налет» шпателем не удается.
Со временем на фоне плоской лейкоплакии развивается веррукозная. При этом очаг поражения уплотняется и немного приподнимается над поверхностью слизистой. Формируется белесоватая бугристая бляшка с бородавчатыми разрастаниями высотой 2-3 мм. На фоне очагов ороговения могут возникать эрозии и болезненные трещины, характерные для эрозивной формы лейкоплакии.
Основной опасностью лейкоплакии является возможность ее злокачественной трансформации. Период времени, через который начинается злокачественное перерождение, очень индивидуален и зависит от формы заболевания. Лейкоплакия может существовать десятилетиями, не превращаясь в злокачественное новообразование. Наиболее склонны к переходу в рак веррукозная и язвенная формы, а самый высокий процент озлокачествления наблюдается при лейкоплакии языка.
Существует ряд признаков, по которым можно заподозрить злокачественную трансформацию той или иной формы лейкоплакии. К таким признакам относится внезапное появление уплотнений или эрозий в очаге плоской лейкоплакии, ее неравномерное уплотнение, захватывающее лишь один край очага. Для эрозивной формы признаками озлокачествления являются: появление в центре эрозии уплотнений, изъязвление поверхности, образование сосочковых разрастаний, резкое увеличение размеров эрозии. Следует отметить, что отсутствие перечисленных признаков не является гарантией доброкачественности процесса и может наблюдаться на ранних стадиях злокачественного перерождения лейкоплакии.
Диагностика лейкоплакии
При локализации лейкоплакии в доступных осмотру местах (ротовая полость, головка полового члена, клитор) диагноз обычно не вызывает затруднений. Окончательный диагноз устанавливается на основании цитологии и гистологического изучения материала, полученного во время биопсии участка измененной слизистой оболочки.
Цитологическое исследование является обязательным в диагностике лейкоплакии. Оно позволяет выявить характерную для предраковых заболеваний клеточную атипию. В ходе цитологического исследования мазков с пораженного участка слизистой обнаруживают большое количество клеток многослойного эпителия с признаками ороговения. Однако в мазок обычно не попадают клетки из ниже расположенных слоев слизистой, где могут располагаться атипичные клетки. Поэтому при лейкоплакии важно проведение цитологического исследования не мазка, а биопсийного материала.
При гистологии биопсийного материала выявляется ороговевающий эпителий, не имеющий поверхностного функционального слоя, так как верхние слои эпителия находятся в состоянии паракератоза или гиперкератоза. Может быть обнаружена различная степень атипии базальных клеток и базально-клеточная гиперактивность, свидетельствующие о возможности злокачественной трансформации образования. Выраженная атипия является показанием для консультации у онколога.
Лейкоплакия шейки матки диагностируется гинекологом при осмотре в зеркалах и в ходе кольпоскопии. Проведение Шиллер теста выявляет участки слизистой, не подверженные окрашиванию йодом. При подозрении на лейкоплакию шейки матки проводят не только биопсию подозрительных участков, но и выскабливание цервикального канала. Цель такого исследования — исключение предраковых и раковых изменений эндоцервикса.
При подозрении на лейкоплакию гортани проводят ларингоскопию, выявляющую участки белого плотно спаянного с подлежащими тканями налета. Исследование дополняют биопсией. Диагностику лейкоплакии уретры или мочевого пузыря осуществляют при помощи уретро- и цистоскопии с биопсией пораженного участка.
Лечение лейкоплакии
Лейкоплакия любой формы и локализации требует комплексного лечения. Оно заключается в устранении факторов, спровоцировавших развитие лейкоплакии, и сопутствующих нарушений. Сюда относится: освобождение полости рта от металлических протезов, отказ от курения, устранение гиповитаминоза А, терапия патологии желудочно-кишечного тракта, лечение эндокринных и соматических заболеваний, а также инфекционных и воспалительных процессов.
Простая лейкоплакия без клеточной атипии часто не требует радикальных лечебных мероприятий. Но такие пациенты должны наблюдаться и периодически проходить обследование. Выявление в ходе гистологического исследования базально-клеточной гиперактивности и клеточной атипии является показанием для удаления очага лейкоплакии в ближайшее время.
Удаление пораженных участков слизистой может проводиться при помощи лазера или радиоволнового метода, путем диатермокоагуляции и электроэкзиции (иссечение электроножом). Нежелательно применение криодеструкции, поскольку после воздействия жидкого азота на слизистой остаются грубые рубцы. В отдельных случаях требуется хирургическое иссечение не только слизистой, но и участка пораженного органа (уретры, влагалища, мочевого пузыря), что влечет за собой проведение реконструктивно-пластической операции. Признаки злокачественной транформации лейкоплакии являются показанием для радикальных операций с последующей рентгентерапией.
Локализация лейкоплакии на слизистой гортани требует проведения микроларингохирургической операции. Коагуляция пораженных участков слизистой мочевого пузыря возможна в ходе цистоскопии. В лечении лейкоплакии мочевого пузыря успешно применяют введение в мочевой пузырь озонированного масла или жидкости, а также газообразного озона. Однако в случае упорного течения заболевания требуется резекция мочевого пузыря.
Своевременное и адекватное лечение лейкоплакии дает положительный результат. Однако нельзя исключить возникновение рецидивов заболевания. Поэтому в дальнейшем пациенту необходимо наблюдение. С осторожностью следует относиться к народным методам лечения и тепловым процедурам. Они могут способствовать злокачественной трансформации лейкоплакии и усугубить течение заболевания.
Гиперкератоз – это чрезмерное утолщение рогового слоя эпидермиса. Понятие гиперкератоз происходит от двух греческих слов hyper – много и keratosis – образование кератина. Клетки рогового слоя начинают усиленно делиться, что в сочетании с нарушениями слущивания эпидермиса и приводит к утолщению, которое может быть от нескольких миллиметров до нескольких сантиметров. Различают фолликулярный, лентикулярный и дессеминированный гиперкератоз. В основе заболевания лежит нарушение процесса слущивания поверхностного эпителия кожи, которое может возникнуть при избыточном сдавливании участка кожи, например, тесной одеждой или обувью.



Общие сведения
Гиперкератоз – это чрезмерное утолщение рогового слоя эпидермиса. Понятие гиперкератоз происходит от двух греческих слов hyper – много и keratosis – образование кератина. Клетки рогового слоя начинают усиленно делиться, что в сочетании с нарушениями слущивания эпидермиса и приводит к утолщению, которое может быть от нескольких миллиметров до нескольких сантиметров.
Причины гиперкератозов
Гиперкератоз не является самостоятельным заболеванием. Утолщение рогового слоя и нарушение процесса ороговения наблюдаются при ихтиозе, лишаях, эритродермиях и других заболеваниях. Даже у здоровых людей гиперкератоз проявляется в той или иной мере на локтях, стопах, иногда на коленях.
Экзогенные причины гиперкератозов, то есть причины, возникающие извне – это длительное и избыточное давление на кожу стоп, иногда на кожу тела из-за тесной или грубой одежды. Давление, как и любая внешняя агрессия, провоцирует защитные механизмы организма, в данном случае – усиленное деление клеток. Нарушается естественный процесс слущивания клеток: когда поверхностные клетки отшелушиваются, а вновь образующиеся клетки приходят на их место. И, как результат, происходит утолщение рогового слоя эпидермиса – гиперкератоз.
Поскольку большая часть нагрузки приходится на ступни, то именно они подвержены образованию гиперкератоза. Узкая, тесная и наоборот обувь большего, чем нужно, размера вызывают утолщение кожи стопы. Избыточная масса тела, особенно при высоком росте так же многократно увеличивают нагрузку на стопу. У людей с патологиями стопы, например при плоскостопии, из-за нарушений амортизационных свойств позвоночника гиперкератоз ступней встречается гораздо чаще. Приобретенные патологии стопы, а так же хромота приводят к перераспределению нагрузок на стопу, вследствие чего возникают зоны повышенного давления и локализованный гиперкератоз.
К эндогенным причинам гиперкератозов относятся различные системные заболевания, протекающие хронически. Наиболее часто эндогенной причиной гиперкератоза является сахарный диабет, так как в результате нарушения обмена веществ развивается целый комплекс причин ведущих к нарушению чувствительности. Притупляется тактильная и болевая чувствительность, развиваются нарушения обменных процессов, нарушается питание кожи и развивается ее сухость. Эти факторы являются основными при развитии гиперкератоза стоп при сахарном диабете.
Более редкими причинами гиперкератозов являются наследственные нарушения в образовании кератина, кератодермии, ихтиоз кожи, псориаз и другие заболевания при которых изменяется состояние эпидермиса.
Фолликулярный гиперкератоз

Фолликулярный гиперкератоз – это один из клинических симптомов кожных заболеваний, хотя гиперкератоз фолликулов наблюдается и как самостоятельный симптомом. В результате избыточного ороговения и нарушения отслойки верхних слоев эпидермиса происходит закупорка протока фолликула чешуйками кожи. У людей, чьи родственники страдали фолликулярным гиперкератозом, процент заболеваемости выше. Дефицит витамина А и С, а так же нарушения личной гигиены тоже являются факторами риска. При воздействии на кожу холода, жесткой воды и других физических факторов фолликулярный гиперкератоз может развиваться и у людей с неизмененными функциями кожи. После восстановления прежнего режима жизни симптомы гиперкератоза исчезают.
Клинически фолликулярный гиперкератоз проявляется в виде мелких красных прыщиков-бугорков на месте фолликулов, кожа становится похожей на гусиную. Поражаются участки тела склонные к сухости кожи. Это область локтевых и коленных суставов, ягодицы и наружная поверхность бедер. При длительном воздействии неблагоприятных факторов гиперкератоз фолликулов приобретает распространенный характер, поражается кожа рук и нижних конечностей. Вокруг узелков формируется красный, иногда воспаленный, ободок. Если же наряду с симптомами гиперкератоза имеется постоянное механическое воздействие, например грубой одеждой, то кожа становится шершавой и напоминает жабью кожу. Узелки фолликулярного гиперкератоза инфицируются при самостоятельном выдавливании или же при непроизвольной травматизации, что может привести к пиодермиям вторичного характера.
Фолликулярный гиперкератоз не является опасным для жизни состоянием, но между тем требует лечения, так как косметические дефекты могут послужить причиной психологических травм. Диагноз ставится на основании клинических проявлений. На сегодняшний день нет препаратов, которые бы могли решить проблему пациентов с фолликулярным гиперкератозом. В том случае, если этот симптом является одним из проявлений заболеваний внутренних органов, то их лечение или коррекция способны полностью устранить проявления фолликулярного гиперкератоза. А потому пациентам с фолликулярным гиперкератозом, который имеет длительное течение, необходимо обследование, как у дерматолога, так и у эндокринолога и терапевта.
Лечение фолликулярного гиперкератоза направлено на коррекцию работы внутренних органов и в применении смягчающих мазей и местных препаратов, которые содержат молочные и фруктовые кислоты, обладающие эффектом пилинга. Использование механических скрабов и пемзы при фолликулярном гиперкератозе противопоказано, так как травматизация может привести к инфицированию или к прогрессированию симптоматики.
Витамины А и С, принимаемые как внутрь, так и наружно в виде мазей способны скорректировать процесс слущивания эпителия и процесс образования новых клеток. Лечением фолликулярного гиперкератоза занимаются косметологи и дерматокосметологи, но с возрастом симптоматика гиперкератоза фолликулов обычно снижается или исчезает полностью. Это связано со снижением салообразования и снижением скорости деления клеток эпидермиса.
Лентикулярный и диссеминированный гиперкератоз
Причины этих гиперкератозов не изучены, в основе патогенеза лежит нарушение процессов образования кератина неясного происхождения, связанных с изменениями генома человека. Эти виды гиперкератозов диагностируются в основном у мужчин старшего возраста, но нередко симптомы начинают проявляться в юности.
Заболевание протекает хронически, без тенденций к регрессу, после инсоляции отмечаются обострения. В местах фолликулов появляются роговые папулы размером от 1 до 5 мм красновато-коричневого или желто-оранжевого цвета. Поражается тыльная поверхность стоп, голени и бедра, реже поражаются фолликулы рук, туловища и ушных раковин. В единичных случаях лентикулярный гиперкератоз диагностируют на слизистой оболочке рта. При удалении роговой пробки обнажается слегка влажное углубление с точечным кровотечением в центре. Папулы носят рассеянный характер, не склонны к слиянию, болезненных ощущений не вызывают. Незначительная часть пациентов отмечает небольшой зуд на пораженных лентикулярным гиперкератозом участках.
При диссеминированном гиперкератозе на коже появляются полиморфные элементы, напоминающие короткие и толстые волосы, которые располагаются изолированно без тенденции к слиянию на коже туловища и конечностей. Иногда имеются скопления группами в виде кисточки из 3-6 пораженных фолликулов. Для дифференциации диссеминированного и лентикулярного гиперкератозов от папиллом, ихтиоза и бородавок прибегают к гистологическому исследованию.
Лечение заключается в применении мазей, содержащих глюкокортикостероиды и ароматические ретиноиды. Опасности для жизни гиперкератозы не несут, однако являются косметическим дефектом. Химические пилинги, проводимые дерматокосметологами и процедуры, направленные на увлажнение и смягчение кожи при регулярном применении способны решить проблему. Следует помнить, что механическое воздействие, применение скрабов и пемзы являются крайне нежелательными, так как ведут к обострениям и к присоединению вторичных пиодермий.
Гиперкератоз стоп

Подошвенный гиперкератоз чаще всего является косметическим дефектом, хотя состояние кожи стопы часто свидетельствует о состоянии организма в целом. Поскольку гиперкератоз стопы может достигать нескольких сантиметров, то сухая кожа из-за давления тела склонна к образованию болезненных и кровоточащих трещин, что ведет к болям при ходьбе и к инфицированию.
Около 40% женщин и 20% мужчин после двадцати лет отмечают у себя клинические проявления подошвенного гиперкератоза, который помимо утолщения кожи клинически проявляется трещинами, болью и жжением при ходьбе и чувством скованности стоп.
Основными причинами гиперкератоза стоп является тесная и неудобная обувь, нерегулярный уход за ногами, наследственные и приобретенные патологии стопы, избыточная масса тела и заболевания внутренних органов при которых нарушается образование кератина.
Огрубение и утолщение кожи начинается постепенно. С возрастом кожа «сдается» и появляются симптомы гиперкератоза. Но, однако, правильный и адекватный уход за кожей ног способен полностью решить эту проблему, по крайней мере, клинически.
Если подошвенный гиперкератоз и появление омозолелостей наблюдается по всей поверхности пяток, то наиболее вероятной причиной является грибковое заболевание стоп или же эндокринные нарушения. Гиперкератоз по наружному краю пятки свидетельствует о развороте пятки вовнутрь вовремя ходьбы. И, чем отчетливее клинические проявления, тем больше изменен двигательный стереотип; основной причиной является врожденная или приобретенная косолапость и травмы двигательного аппарата.
Гиперкератоз внутреннего края стопы появляется при неправильном положении пятки, слабых связках голеностопного сустава и мышц голени. Избыточная масса тела, плоскостопие и высокие нагрузки на голеностопный сустав, как правило, являются основными причинами появления подошвенного гиперкератоза этой зоны. У пациентов с подобными проблемами быстро изнашивается внутренняя часть каблука, и обувь приходит в негодность. При гиперкератозе заднего края пятки достаточно изменить обувь на более удобную, чтобы состояние кожи стопы нормализовалось, так как обувь, при ношении которой единственной точкой опоры является пятка или основание пальцев является непригодной для постоянного ношения. Продольное плоскостопие ведет к огрубению средней части стопы.

Лечение подошвенного гиперкератоза проводится в кабинете врача-подолога. Это является симптоматической терапией, а потому необходимо устранить основную причину гиперкератоза стопы. Если это связано только с неудобной обувью, то необходимо выбирать для ежедневного ношения обувь, при которой нагрузка на стопу распределяется равномерно. Если имеются ортопедические заболевания, то их коррекцией должен заниматься врач-ортопед. Так же необходимо лечение или коррекция эндокринных нарушения, противогрибковая терапия, в том случае если причиной гиперкератоза является микотические поражения стоп.
При появлении трещин используют аппликации с синтомициновой мазью и смазывание пораженных участков раствором ретинола. После заживления трещин необходимо удалить избыток кожных масс. Лечение в домашних условиях несколько длительное и требует терпения. Применяются солевые ножные ванночки с прохладной водой, пемза и механическая шлифовка. Увлажнение кожи стоп и применение кератолитических мазей так же входят в схему лечения.
При устранении симптомов гиперкератоза в условиях кабинета подолога применяются более агрессивные размягчители, что позволяет за несколько процедур полностью избавиться от проявлений подошвенного гиперкератоза. Однако без должного ухода и профилактических процедур гиперкератоз стоп может вернуться вновь. Следует помнить, что с возрастом огрубение кожи стоп проявляется более отчетливо, а профилактикой гиперкератоза стоп является должный уход за ногами и ношение удобной обуви. Коррекция избыточной массы тела и профилактика грибковых заболеваний тоже помогают сохранить красоту и здоровье ног.
Плоскоклеточный рак шейки матки – злокачественная неоплазия, формирующаяся из клеток плоского эпителия, приобретающих различную степень атипии. Плоскоклеточный рак шейки матки может носить «немое» течение. В клинически выраженных случаях проявляется кровянистыми выделениями, белями разного характера, при запущенном онкопроцессе – болями в области таза, нарушением функции мочевого пузыря и прямой кишки. Патология диагностируется по данным вагинального осмотра, ПАП-теста, кольпоскопии, биопсии, определения уровня онкомаркера SCС в крови. Методы лечения плоскоклеточного РШМ - хирургические вмешательства (конизация шейки матки, трахелэктомия, гистерэктомия), химиолучевая терапия.
Общие сведения
Плоскоклеточный рак шейки матки – гистологическая разновидность цервикального рака, происходящего из многослойного плоского эпителия, выстилающего влагалищную часть шейки матки. В структуре инвазивного РШМ данный гистологический тип диагностируется в 70-80% случаев, в 10-20% встречается аденокарцинома шейки матки, в 10% - низкодифференцированный рак, прочие злокачественные опухоли шейки матки составляют менее 1%. Максимальная заболеваемость плоскоклеточным раком шейки матки приходится на женщин в возрасте 40-60 лет. Длительный период «немого» течения приводит к тому, что свыше 35% случаев плоскоклеточного рака шейки матки диагностируется уже в запущенной стадии, что оказывает негативное влияние на прогноз и исход заболевания. Разработка стратегии профилактики и проведение массового скрининга женского населения на РШМ являются приоритетными задачами практической гинекологии и онкологии.

Причины плоскоклеточного рака шейки матки
Однозначные причины возникновения плоскоклеточного рака шейки матки не определены, однако на современном этапе достаточно хорошо изучены факторы, запускающие процесс малигнизации многослойного плоского эпителия. В первую очередь, к таким факторам принадлежит вирус папилломы человека (HPV), главным образом 16 и 18 типов, реже - 31 и 33 типов. В большинстве случаев при плоскоклеточном раке шейки матки идентифицируется HPV-16. Среди других вирусных агентов, передаваемых половым путем, роль онкогенов могут играть вирус простого герпеса II типа, цитомегаловирус и др. Фоновыми процессами, при которых в дальнейшем может развиваться плоскоклеточный рак шейки матки, служат эрозия, эктропион, полип цервикального канала, лейкоплакия, цервицит и др.
Кроме этого, клеточному перерождению способствуют и другие факторы: гормональные расстройства, курение, прием иммуносупрессоров (глюкокортикостероидов, цитостатиков), иммунодефицит. Определенную негативную роль играет травматизация шейки матки при многократных родах, установке ВМС, проведении оперативных вмешательств: абортов, диагностических выскабливаний, диатермокоагуляции и диатермоконизации и пр. В группу риска по возникновению плоскоклеточного рака шейки матки входят женщины, рано начавшие сексуальную жизнь, часто меняющие половых партнеров, пренебрегающие методами барьерной контрацепции, перенесшие ЗППП.
Классификация плоскоклеточного рака шейки матки
Внутри рассматриваемого гистологического типа выделяют плоскоклеточный с ороговением и плоскоклеточный без ороговения РШМ. В микроскопическом отношении плоскоклеточный ороговевающий рак шейки матки отличается наличием признаков кератинизации клеток – «раковых жемчужин» и кератогиалиновых гранул. Эпителиальные клетки аномально крупные, плеоморфные, с неровными контурами. Митотические фигуры представлены скудно. В препаратах неороговевающего плоскоклеточного рака шейки матки отсутствуют кератиновые «перлы». Раковые клетки преимущественно крупные, полигональной или овальной формы. Отмечается их высокая митотическая активность. Степень дифференцировки РШМ может быть высокой, умеренной или низкой.
С учетом направления опухолевого роста различают экзофитную, эндофитную и смешанную формы плоскоклеточного рака шейки матки. Язвенно-инфильтративная форма характерна для запущенных стадий РШМ; обычно она формируется при распаде и некрозе эндофитно растущей опухоли.
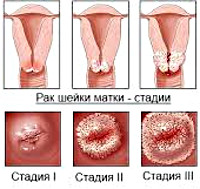
В своем развитии РШМ проходит четыре клинических стадии. Также выделяют нулевую, или начальную стадию (внутриэпителиальный рак), при которой поражаются только клетки покровного эпителия без инвазии в базальную пластинку. Первая стадия подразделяется на два периода: микроинвазивный рак с глубиной проникновения в строму до 3 мм (стадия 1А) и инвазивный рак с инвазией более 3 мм (стадия 1В). Признаком второй стадии служит распространение опухолевого процесса на тело матки. Третью стадию РШМ характеризует прорастание опухоли в малый таз; при сдавлении или обтурации мочеточника развивается гидронефроз. В течение четвертой стадии отмечается инвазия в прямую кишку и крестец, распад опухоли, появление отдаленных метастазов.
Симптомы плоскоклеточного рака шейки матки
В нулевой и 1А стадии клинические проявления РШМ, как правило, отсутствуют. В этот период диагностика плоскоклеточного рака шейки матки возможна во время планового обследования у врача-гинеколога. В дальнейшем, по мере углубления инвазии и экспансивного роста опухоли появляется характерная патологическая триада: бели, кровотечения и болевой синдром. Выделения из половых путей могут иметь различный характер: быть серозными прозрачными или с примесью крови (в виде «мясных помоев»). В случае присоединения инфекции или распада опухолевого узла бели могут приобретать мутный, гноевидный характер и зловонный запах.
Кровотечение из половых путей при плоскоклеточном раке шейки матки различаются своей интенсивностью – от мажущих выделений до ациклических или менопаузальных кровотечений. Чаще кровотечения имеют контактное происхождение и провоцируются гинекологическим осмотром, половым актом, спринцеванием, натуживанием при дефекации.
Болевой синдром при плоскоклеточном раке шейки матки также может носить различную выраженность и локализацию (в области поясницы, крестца, промежности). Как правило, он свидетельствует о запущенности онкопроцесса, прорастании параметральной клетчатки и поражении поясничных, крестцовых или копчиковых нервных сплетений. При прорастании рака в соседние органы могут отмечаться дизурические расстройства, запоры, образование мочеполовых свищей. В терминальной стадии развивается раковая интоксикация и кахексия.
Диагностика плоскоклеточного рака шейки матки
Клинически «немые» формы плоскоклеточного рака шейки матки можно обнаружить при проведении кольпоскопии или по результатам цитологического ПАП-мазка. Важную роль в диагностике играет тщательно собранный гинекологический анамнез (количество сексуальных партнеров, родов, абортов, перенесенные ЗППП), а также обнаружение высокоонкогенных штаммов ВПЧ в исследуемом соскобе методом ПЦР.
При осмотре в зеркалах плоскоклеточный рак шейки матки определяется в виде папилломатозного или полиповидного разрастания либо язвенного образования. Эдофитные опухоли деформируют шейку матки, придавая ей бочкообразную форму. При контакте новообразование кровоточит. Для определения стадии онкозаболевания и исключения метастазов в органы малого таза проводится двуручное влагалищное и влагалищно-прямокишечное исследование. Во всех случаях обнаружения патологически измененной шейки матки в обязательном порядке проводится расширенная кольпоскопия, забор мазка на онкоцитологию, прицельная биопсия и выскабливание цервикального канала. Для морфологического подтверждения диагноза биоптат и соскоб направляются на гистологическое исследование.
Определенную информативность имеет определение уровня SCC (маркера плоскоклеточного рака) в сыворотке крови. Методами уточняющей диагностики плоскоклеточного рака шейки матки, призванными оценить степень распространенности неоплазии и помочь в выборе оптимального метода лечения пациентки, служат трансвагинальное УЗИ, КТ или МРТ малого таза, экскреторная урография, рентгенография легких, цистоскопия, ректороманоскопия.
Лечение плоскоклеточного рака шейки матки
При плоскоклеточном раке шейки матки может использоваться хирургическое, лучевое, химиотерапевтическое и комбинированное лечение. Выбор того или иного метода либо их сочетаний определяется распространенностью и морфологическим типом опухоли, а также возрастом и репродуктивными планами пациентки.
При стадиях 0 – IA у пациенток детородного возраста выполняется конизация или ампутация шейки матки. На стадиях IB-II оптимальный объем вмешательства - гистерэктомия с верхней третью влагалища, иногда требуется проведение неоадъювантной химиотерапии; в постменопаузе показана пангистерэктомия - удаление матки с аднексэктомией. При III–IV стадиях плоскоклеточного рака шейки матки стандартом является химиолучевая терапия (лучевое лечение + цисплатин), однако некоторые авторы допускают потенциальную возможность оперативного лечения. При поражении мочеотводящих путей может потребоваться проведение стентирования мочеточника.
В функционально неоперабельных случаях, обусловленных сопутствующими заболеваниями, назначается внутриполостная лучевая терапия. При рецидивах РШМ показано выполнение экзентерации малого таза, проведение паллиативной химиолучевой и симптоматической терапии.
Прогноз и профилактика
По окончании лечения динамическое наблюдение за пациенткой производится ежеквартально в течение первых 2-х лет, а затем раз в полгода до 5-летнего срока. Если плоскоклеточный рак шейки матки обнаружен на нулевой стадии, то своевременно проведенное лечение дает шансы на практически 100% выздоровление. Процент безрецидивной пятилетней выживаемости при РШМ I стадии составляет 85%, II стадии – 75%, III - менее 40%. При IV стадии заболевания можно говорить лишь о продлении жизни, но не излечении. Рак культи шейки матки развивается менее чем у 5% пациенток.
Профилактика плоскоклеточного рака шейки матки заключается в проведении массового и регулярного цитологического скрининга женского населения, диспансеризации женщин, имеющих фоновые и предраковые заболевания шейки матки. Большую превентивную роль играет отказ от курения, предупреждение ЗППП и проведение профилактический вакцинации против РШМ в подростковом возрасте.
Читайте также:

