Что такое интактные участки кожи
Обновлено: 25.04.2024
Патологическое восприятие тактильных раздражений. Патологические ощущения в теле.
Нормальное восприятие тактильных раздражений на половине тела может быть нарушено. В основе этого явления лежит поражение центральных структур:
• При синдроме игнорирования половины пространства пациент может «не замечать» прикосновений к пораженной половине тела. При изолированном тактильном раздражении пораженных конечностей они воспринимаются пациентом, однако при одновременном прикосновении к аналогичным точкам на обеих сторонах на пораженной стороне он их не ощущает. Это служит признаком поражения теменной доли и, как правило, сопровождается другими признаками синдрома игнорирования (зрительное игнорирование).
• При астереогнозии тактильная чувствительность руки сохранена, но при ощупывании предмета с закрытыми глазами пациент не может его идентифицировать. В основе этого нарушения в большинстве случаев лежит поражение теменной доли противоположного полушария (см. главы 1 и 9). Однако нарушение функции шейного отдела спинного мозга также может вызывать астереогноз.
• При аллохории раздражение какого-либо участка кожи постоянно ощущается не только в этой точке, но и на симметричном участке на противоположной половине тела или на той же, но в удалении от места раздражения. Этот феномен был описан при спинной сухотке, но иногда наблюдается и у здоровых лиц. В последнем случае он не имеет клинического значения.
Патологические ощущения в какой-либо части тела
Подобные явления могут быть обусловлены очаговым поражением таламуса или спиноталамических путей. Парестезии при этом не имеют четких границ и носят в большинстве случаев жгучий характер. Особенно характерны парестезии кисти и угла рта (хейрооральный синдром) при поражении теменной доли, таламуса или развиваюшиеся остро при кровоизлиянии в заднебоковые отделы покрышки моста. Они могут быть и двусторонними при кровоизлиянии в области медиальной петли.
Ишемическое поражение области коркового представительства чувствительности или таламокорковых афферентных путей может вызывать длительно сохраняющиеся парестезии в ограниченных регионах тела, особенно часто в области лица или кисти. Они развиваются как при транзиторных ишемических атаках, так и при ассоциированной мигрени (в том числе и без головной боли, «мигрень без головной боли»).
Эти феномены следует отличать от гораздо более кратковременных приступов фокальной сенсорной эпилепсии, которые появляются в виде сенсорных джексоновских припадков с быстрым распространением парестезии на другие части тела.
Более частой причиной подобных локализованных парестезии служит поражение периферических чувствительных аксонов или спинальных ганглиев. Нам достаточно трудно было определить, какие из этих ощущений должны быть описаны в данной главе и какие (в качестве болевых синдромов). Можно предложить следующую классификацию, основанную на локализации поражений:
• В области лица невропатия тройничного нерва может быть признаком локального поражения области ядер или корешков тройничного нерва, а также системных заболеваний, таких как саркоидоз или системный склероз. Симметричные парестезии мышц лица возможны при поражении шейных межпозвонковых дисков, отравлении растворителями и при базилярной мигрени.
• Жгучие парестезии в конечностях, прежде всего в кистях и стопах, наблюдаются при многих полиневропатиях. Кроме того, они наблюдаются при упоминавшейся выше диффузной ангиокератоме Фабри (церамидтригексозидоз). При этом заболевании, наследуемом по Х-сцепленному типу, отсутствует лизосомальный фермент альфа-галактозидаза А. Вызванное этим накопление гликосфинголипидов в клетках различных органов становится уже в первые два десятилетия жизни причиной мучительных приступов боли в конечностях (наряду с диффузной постоянной болью и другими симптомами: нарушением секреции потовых желез, коликами в животе, сердечными аритмиями и кардиомиопатией).
Основным диагностическим признаком служат ангиокератомы от темно-красного до коричнево-голубоватого цвета в области пупка, коленей и особенно лобка. Для обеих групп заболеваний характерно нарастание симптомов в жару, при спинной сухотке наблюдается похолодание и онемение, а также парестезии, особенно в стопах.
• Прогрессирующие нарушения чувствительности, чаше всего тактильной, в кистях характерны для сенсорной невропатии, миелопатии при шейном спондилезе или для двустороннего синдрома запястного канала.
• Дизестезии в строго ограниченных участках кожи наблюдаются при постоянном раздражении ветвей нервов, несущих чувствительные волокна. Особенно характерны эти ощущения для парестетической хейралгии по лучевому краю большого пальца, например при постоянном сдавлении ножницами. Парестезии в области мизинца и полоктевому краю предплечья появляются при хроническом сдавлении локтевого нерва, например, когда человек опирается на локти, при «вывихе» нерва из его ложа или при патологических процессах в периневральном пространстве.
На туловище парестезии могут возникать вследствие хронической компрессии чувствительных кожных ветвей при их прохождении через фасции. В области брюшной стенки могут быть сдавлены передние ветви нижних грудных спинномозговых нервов.
Отдельный синдром представляет собой парестетическая ноталгия, при которой хроническое сдавление сенсорных задних ветвей спинномозговых нервов вызывает болезненные парестезии в участке кожи размером с ладонь в районе медиального края лопатки. При этом определяются и объективные нарушения чувствительности. Подобные парестезии на определенных участках кожи наблюдаются и в нижних конечностях. Например, парестетическая мералгия представляет собой синдром ущемления наружного кожного нерва бедра в паховой связке (жгучие парестезии и нарушение чувствительности на передненаружной поверхности бедра, которые уменьшаются при сгибании бедра).
Болезненные ощущения в зонах Геда наблюдаются при заболеваниях внутренних органов. Они представляют собой важный диагностический критерий в общей терапии. Отраженная боль носит обычно тупой характер, ее локализацию трудно точно определить.
Иногда при головной боли наблюдается неприятное ощущение «прострела» от затылка в спину, вдоль позвоночника, а также в ноги и/или руки. Этот признак, обозначаемый как феномен Лермитта, был описан выше.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Злокачественные новообразования — это группа заболеваний, насчитывающая несколько тысяч видов опухолей разных типов и разной степени злокачественности. Они подразделяются на большие группы в зависимости от того из каких тканей они развиваются: если из эпителиальных (барьерных) — то это раки, если из соединительных тканей (мягких тканей и костей) – саркомы, если из лимфоидных (иммунных) – лимфомы/лейкозы. От того насколько правильно верифицирована опухоль (определен ее тип, степень злокачественности и другие характеристики) зависит правильность и эффективность лечения. Важную роль в этом играют гистологические исследования.
О том, как проходят гистологические исследования, какие задачи кроме диагностических они позволяют решать, что влияет на сроки их выполнения рассказывает заведующая патологоанатомическим отделением с прозектурой НМИЦ онкологии им. Н.Н. Петрова, к.м.н. Анна Сергеевна Артемьева.
Что служит материалом для патоморфологических (гистологических) исследований?
Кусочек ткани пациента: кожи, слизистых оболочек, внутренних органов, костей, головного и спинного мозга и т.п., так называемый биоптат.
Процесс получения фрагмента ткани (биоптата) — биопсия – это несколько разных способов забора материала для гистологического исследования.
- Пункционная биопсия – «тычок», тонкой или толстой иглой. Пункционные биоптаты редко имеют диаметр больше 1-2 мм.
- Ножевая биопсия – открытая или эндоскопическая (малоинвазивная), в том числе лапароторако-медиастиноскопия.
Биопсию внутренних органов делают под УЗИ-навигацией, либо с помощью хирургического вмешательства.
Операционный материал – это все что удалено во время операции, как правило, орган или его часть, или несколько органов и/или их частей с образованием (опухолью) или без него.
Как обрабатывают эти материалы для проведения гистологического исследования?
1 Этап. Фиксация — «консервирование» биоптата в формалине — специальном химическом растворе, который предотвращает гниение, позволяет сохранить структуры ткани.
Фиксация биоптата может занимать от 6 до 24 часов – в зависимости от его вида и размера.
Операционный материал фиксируется дольше, в несколько этапов. Сначала предварительная фиксация, которая занимает примерно 12 часов. Затем вырезка нужных фрагментов и повторная фиксация еще 24 часа.
Соотношение объема материала к объему формалина должно быть 1:20.
2 Этап. Процессинг — процесс обезвоживания, обезжиривания и пропитки материала парафином. Автомат перемещает кусочек материала из раствора в раствор.
В качестве растворов применяются: абсолютированный изопропиловый спирт (6-8 смен), ксилол (2 смены), расплавленный парафин (2 смены).
Программа разнится для «жирного» материала (к которым относятся, например, ткани молочной железы) и «нежирного» – 36 и 24 часа соответственно.

Процесс получения парафиновых блоков.
3 Этап. Изготовление парафинового блока. Кусок материала помещается в форму с расплавленным парафином (уже другим нежели во время процессинга – с более высокой температурой плавления) и охлаждается. Выполняется вручную, сложно ускорить.

4 Этап. Изготовление срезов. Толщина образца — кусочка ткани, залитого в парафин – 1-3 мм. Толщина каждого среза 4-5 мкм (0,004-0,005 мм). Выполняет лаборант с использованием специального инструмента – микротома.
Срезы монтируются на стекла и должны высохнуть.
Несмотря на то, что часть материала теряется при выравнивании в микротоме, при должном профессионализме, из одного образца — материала от одной биопсии, операционного материала от одной опухоли, возможно изготовить около 100 стекол (микропрепаратов).
Для чего делаются срезы?
Срезы делаются для рутинной окраски гематоксилинном и эозином, иммуногистохимического исследования и других видов исследований.
Срезы для всех исследований используются одинаковые, различается окраска, могут отличаться стекла, на которые они монтируются, так для ИГХ и FISH нужны специальные адгезивные стекла или заряженные стекла.

Блоки и стекла способны храниться долгие годы и использоваться для проведения дополнительных гистологических исследований, пересмотров, а также в научных целях.

Архив гистологических материалов собирается в НМИЦ онкологии им. Н.Н. Петрова с 1927 года и содержит более 10 млн единиц хранения (микропрепараты — стекла, парафиновые блоки, архивные карточки, влажный архив).
Какие виды гистологических исследований наиболее информативны?
- Гистологическое исследование
- Иммуногистохимия (ИГХ)
- Флуоресцентная гибридизация in situ (FISH), может быть хромофобной (принцип тот же, другой тип метки)
Что позволяют определить разные виды гистологических исследований
Гистологическое исследование – что это такое?
Позволяет верифицировать опухоль – то есть определить из каких клеток она состоит (из какой ткани она развивается), степень ее дифференцировки (зрелости).
Рутинная окраска, выполняющаяся при гистологическом исследовании, позволяет выявить патологический процесс в анализируемом материале (биоптате, операционном материале):
- воспаление,
- специфическое воспаление,
- аномалия развития,
- опухоль.
Также, в большинстве случаев, благодаря рутинной окраске, можно определить степень злокачественности опухоли и, если она достаточно зрелая, то какова ее природа.
Окрашенные срезы под микроскопом
Инвазивный протоковый рак er 100%.
Карцинома сигмовидной кишки.
Крупноклеточная нейроэндокринная опухоль.
МТС крупноклеточной нейроэндокринной опухоли.
Неспецифический рак молочной железы. Участок in situ карциномы внутри протока, криброзного типа.
Низкодифферинцированный рак пищевода.
При гистологическом исследовании биоптата и операционного материала можно оценить распространенность: размер опухоли и прорастание в окружающие ткани, насколько затронуты лимфоузлы и есть ли метастазы в отдаленные органы (если эти все структуры присланы для гистологического исследования). При консультации готовых микропрепаратов – стекол, это, как правило, невозможно, если опухоль больше размеров гистологической кассеты или рассечена предыдущим исследователем и не предоставлены данные макроскопического исследования.
Во время гистологического исследования изучаются все стекла от одного образца – материала, полученного от одного вмешательства — одной операции или одной биопсии, вне зависимости от их количества, это считается одной консультацией.
Сроки выполнения гистологического исследования зависят от количества микропрепаратов и от категории сложности того процесса, который в них обнаруживается, сроки могут удлиняться, особенно при необходимости использования дополнительных методов исследования и анализа дополнительных сведений. На сроки выполнения гистологического исследования влияет полнота предоставленной пациентом клинической информации, в том числе данных уже проведенных исследований.
Иммуногистохимия (ИГХ)
Сложное многоэтапное исследование, выполняется после гистологического исследования на том же материале. Опухолевые срезы окрашиваются антителами, которые способны связываться антигенами (белками), которые несут опухолевые клетки. Разные опухолевые клетки несут разные антигены, к каждому из которых подобно ключа к замку подходит антитело.

Один из этапов ИГХ
ИГХ исследование — это комбинаторика. 100% специфичных и чувствительных к какой-то опухоли маркеров не существует, но есть набор антигенов, которые в определенном типе опухоль должны быть и набор тех, которых там быть не должно, таким образом ИГХ-панель строится так чтобы включать несколько антител, которые должны быть позитивны и несколько, которые должны быть негативны. Для разных опухолей различаются эти наборы позитивных/негативных маркеров.
При проведении прогностической ИГХ – выявлении маркеров чувствительности к терапии определяется набор таких маркеров для конкретных опухолей, например, рака молочной железы: рецепторы стероидных гормонов (эстроген, прогестерон), рецептор эпидермального фактора роста (HER2) и индекс пролиферативной активности Ki67 (скорости деления клеток).
Стекла окрашиваются последовательно — различными антителами красятся наборы маркеров в несколько этапов, процесс окраски стекол одним антителом занимает 48 часов.
Таким образом, каждое антитело наносится на отдельный срез ткани, монтированный на отдельное стекло, как правило с соответствующим внешним контролем, количество реакций (используемых антител) и этапов окраски может существенно варьировать в зависимости от конкретной диагностической ситуации, все зависит от индивидуальных особенностей опухоли. Проводится такое количество окрасок, которое необходимо для того, чтобы выявить наиболее характерный для определенной опухоли набор позитивных и негативных маркеров.
Кому-то для этого будет достаточно 5 антител, а кому-то необходимо сделать 20 окрасок и более. Максимальное количество окрасок, которое нам приходилось делать – 212.
Поэтому точные сроки и стоимость этого исследования невозможно определить заранее. Разные по течению и прогнозу опухоли могут быть очень похожи друг на друга, только минимальные различия в окрашивании, с учетом клинических данных и данных других методов обследования, могут позволить установить верный диагноз.
Есть целый ряд доброкачественных опухолей, симулирующих злокачественные, в том числе высокоагрессивные, а некоторые злокачественные высоко дифференцированные опухоли трудно отличить от воспалительных и реактивных процессов. В таких ситуациях только опыт и квалификация патоморфолога, анализ всего комплекса доступной информации (снимки КТ, МРТ, рентген, протокол операции, и др.) позволяют поставить диагноз.
В грамотной интерпретации результатов ИГХ очень важна роль эксперта, ведь те случаи, с которыми приходится работать, в большинстве своем, сложные. Практически не существует антител, которые могут выступать в качестве 100%-х маркеров той или иной опухоли, врачу всегда приходится взвешивать различные вероятности.
Что определяется с помощью ИГХ?
- Наличие рецепторов гормонов прогестерона и эстрогена при раке молочной железы;
- Экспрессию HER-2/neu в клетках при раке молочной железы, раке желудка;
- Определить ходжкинские и неходжкинские лимфомы — установить точный диагноз лимфомы на сегодняшний день невозможно без применения этого вида исследования.
- Определить первичная это опухоль или метастазы, тканевую принадлежность метастазов.
Иммуногистохимия позволяет оценить потенциальный темп роста опухоли, ответ на химио-, таргетную, гормональную терапию.
Флуоресцентная гибридизация in situ (FISH-тест)
Это метод молекулярно-генетической диагностики в ткани.
FISH проводится в срезе ткани и позволяет привязать генетическую перестройку к конкретной опухолевой клетке.
В этом тесте также используются специальные красители, которые связываются только с определенными участками хромосом. Их называют зондами, которые могут быть помечены флуоресцентным или хромогенным красителем, визуализирующимися при помощи флуоресцентного или светового микроскопа.
Технические операции по подготовке гистологических стекол к этому исследованию занимает 2 рабочих дня.

Анализ препарата с помощью многоголового микроскопа.
Полученные микропрепараты очень чувствительны к внешней среде – они могут выцвести со временем, чтобы избежать потерь информации все FISH-препараты сканируются, создается их цифровая копия, которая доступна для внешнего пересмотра. Специалисты просматривают флуоресцирующий материал в темном поле, в анализе препарата принимают участие как минимум 2 специалиста. При необходимости используется и цифровой анализ.
Что определяется с помощью FISH-теста?
FISH-тест позволят диагностировать некоторые виды опухолей, определяет целесообразность использования некоторых химиотерапевтических препаратов.
- определяется наличие амплификации HER2 в случаях пограничного результата по данным ИГХ, что необходимо для назначения таргетной терапии;
- проводится диагностика, то есть выявление генетических перестроек специфичных для определенного типа опухолей, когда невозможно окончательно установить диагноз при помощи более простых методик, чаще всего это саркомы мягких тканей и опухоли головного мозга;
- генетические отклонения, вызывающие рак того или иного органа;
- при лимфомах эта методика используется в диагностических целях и для выявления факторов неблагоприятного прогноза, то есть показаний для ранней интенсификации лечения.
Проведение гистологического исследования, и в первую очередь FISH-теста — это экспертная работа, которая зависит от квалификации специалиста. Очень многие мутации, которые выявляются в опухолях, не всегда являются метками опухолей, они могут находиться и в доброкачественных образованиях или нормальных тканях.
За год патологоанатомическое отделение НМИЦ онкологии имени Н.Н. Петрова выполняет около 20000 гистологических исследований (пациентов), из них около 5000 консультативных случаев (пересмотров), более 30000 ИГХ исследований, а также участвует в программе внешнего контроля качества ИГХ исследований NordIQ.
Специалисты отделения обладают огромным опытом проведения гистологических исследований и экспертными компетенциями.
Помните! Гистологические исследования – это отправная точка, от того насколько грамотно они выполнены зависит точность поставленного диагноза и эффективность назначенного лечения.
Скорость выполнения гистологических исследований и адекватность гистологического заключения зависят от ряда факторов:
- Качества стекол и блоков;
- Комплектности предоставления стекол (необходимо предоставить все стекла и блоки);
- Предоставление пациентом дополнительной информации, которая поможет верно интерпретировать данные гистологического исследования, ИГХ и FISH-теста, а именно: данные анамнеза заболевания, данные о сопутствующих заболеваниях, в первую очередь инфекционных (ВИЧ, гепатиты); все данные всех проведенных обследований и вмешательств: снимки — рентген, КТ, МРТ, УЗИ, протоколы операций, выписки.
После выполнения гистологического исследования пациент получает гистологическое заключение/протокол исследования гистологического материала.
Расшифровка гистологического исследования: на что обратить внимание?
Гистологическое заключение включает в себя несколько рубрик (полей):
Макроскопическое описание
Заполняется как для биоптатов — не обязательно, так и для операционного материала, для которого имеет крайне важное значение в ряде случаев.
Микроскопическое описание
Описание изменений на микроскопическом уровне, не обязательно к заполнению, так как вся необходимая информация может быть отражена в поле «заключение».
Результаты иммуногистохимического исследования
В этом поле описано какие антитела использовались в данном случае и каков результат окрашивания: наличие окрашивание или его отсутствие, локализация в клетке при необходимости, а также процент позитивных клеток и интенсивность реакции, когда это имеет значение.
Патологоанатомическое заключение
Содержит нозологическую/классификационную единицу, если ее возможно установить по исследованному материалу, то есть дает ответы на вопросы:
- Это первичная опухоль или метастаз?
- Где локализован первичный опухолевый очаг?
- Каков гистологический тип опухоли (из клеток какого типа она состоит).
Также приводятся все необходимые прогностические данные: степень дифференцировки, параметры, влияющие на стадию, состояние краев резекции, если возможно их оценить и т.п.
Дополнительные замечания и рекомендации
Поле может содержать комментарии, относительно возможного направления дальнейшего обследования, вероятности того или иного диагноза, необходимости ознакомиться с теми или иными клиническими данными и др.
Мы не рекомендуем пациентам самостоятельно заниматься расшифровкой показателей гистологического исследования, используя информацию, полученную на различных Интернет-сайтах и форумах пациентов, так как на интерпретацию данных влияет большое количество факторов, в том числе, возраст пациента, данные других исследований и др.
Расшифровкой исследования может заниматься только специалист – врач онколог по профилю заболевания!

Авторская публикация:
АРТЕМЬЕВА АННА СЕРГЕЕВНА
заведующий патологоанатомического отделения с прозектурой ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, кандидат медицинских наук
Меланома кожи, от древнегреческого «melas» (черный) и «oma» (опухоль), агрессивное злокачественное образование, развивающееся в результате необратимого генетического перерождения меланобластов и меланоцитов. Данные клетки продуцируют пигмент меланин и отвечают за цвет кожи, способность к загару и образование невусов (родинок). На протяжении последних десятилетий наблюдается неуклонный рост заболеваемости. Эту тенденцию чаще всего объясняют возросшим воздействием ультрафиолетовых лучей и модой на загар.
Меланома, что это такое?
Меланоциты синтезируют пигменты, отвечающие за окрашивание кожи, цвет глаз, волос. Пигментированные образования, переполненные меланином, называются родинками и могут проявляться в течение всей жизни. Определенные причинные факторы экзогенного (от греч. «exo» — внешнего) и эндогенного («endo» — внутреннего) характера способны вызвать озлокачествление невусов. Вследствие этого, риску развития меланомы подвергаются участки тела, где имеются врожденные или приобретенные невусы: кожа, реже слизистые оболочки и сетчатка глаза. Измененные клетки способны бесконтрольно размножаться и расти, формируя опухоль, метастазируя. Чаще всего, среди доброкачественных «собратьев», обнаруживают одиночное злокачественное новообразование.

Клиническая картина разнообразна. Размеры, очертание, поверхность, пигментация, плотность опухоли варьируются в широких пределах. Любые изменения, происходящие с родинкой, должны насторожить.
Характерные черты
Опухоль меланома, развивающаяся из невуса, отличается продолжительным нарастанием изменений (вплоть до нескольких лет) и последующей агрессивной трансформацией (1-2 месяца). Ранняя самодиагностика и своевременный осмотр у специалиста помогут выявить симптомы меланомы:
- Гладкая зеркальная поверхность, с исчезновением кожных борозд.
- Увеличение размеров, рост по поверхности.
- Неприятные ощущения в области родинки: зуд, покалывание, жжение.
- Сухость, шелушение.
- Изъязвление, кровотечение.
- Признаки воспалительного процесса в области родинки и окружающих ее тканей.
- Появление дочерних образований.
Внезапное появление подкожных уплотнений и узелков также может свидетельствовать о развивающемся заболевании.
Клиническая классификация. Виды меланомы
Меланома проявляется в различных формах, выделяют 3 основных типа:
Опухоль меланоцитарного происхождения. Наиболее часто встречающееся заболевание (от 70 до 75% случаев) среди людей европеоидной расы, среднего возраста. Сравнительно небольшая, сложной формы с неровными краями. Окрас неравномерный, рыже-бурый или бурый, с мелкими вкраплениями синюшного оттенка. Новообразование имеет тенденцию к дефекту ткани, сопровождающемуся выделениями (чаще кровянистыми). Рост возможен как по поверхности, так и вглубь. Переход к фазе вертикального роста может занимать месяцы и даже годы.
Как выглядит меланома на фото?
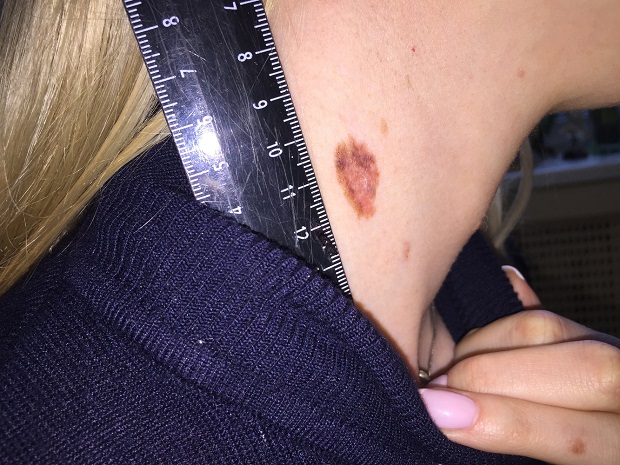
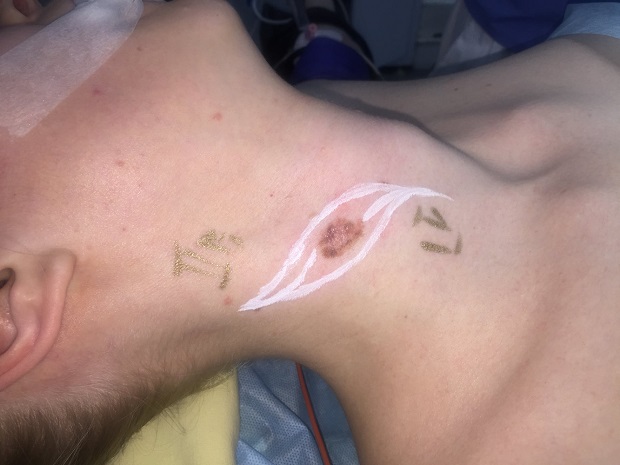
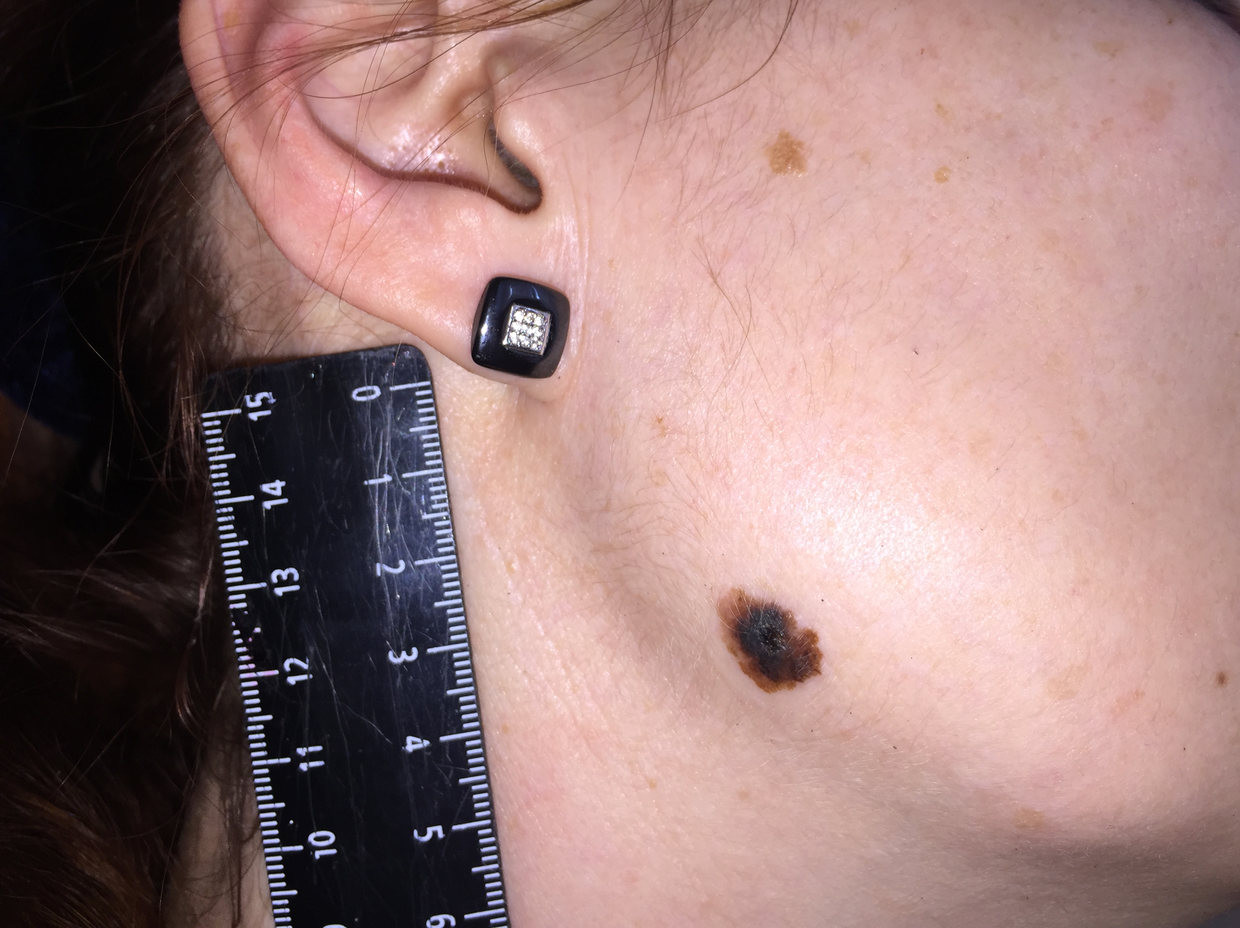
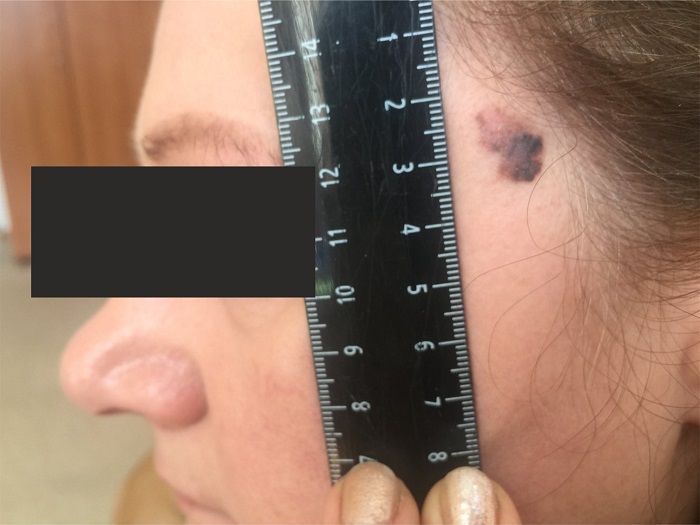
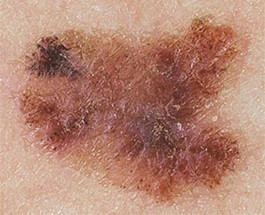
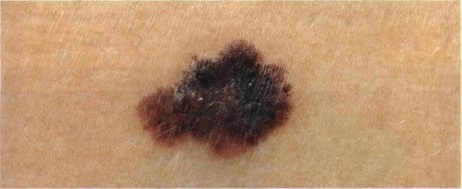
Нодулярное (уменьшительное от лат. «nodus» — узел) образование встречается реже (14-30%). Наиболее агрессивная форма. Рак меланома характеризуется быстрым ростом (от 4 месяцев до 2 лет). Развивается на объективно неизмененной коже без видимых повреждений или из пигментного невуса. Рост вертикальный. Окрас равномерный, темно-синий или черный. В редких случаях подобная опухоль, имеющая сходство с узелком или папулой может быть не пигментированной.
Заболеванию подвержены лица пожилого возраста (после 60 лет) и выявляется в 5-10% случаев. Открытые участки кожного покрова (лицо, шею, руки) захватывают узелки темно-синего, темно- или светло-коричневого цвета диаметром до 3мм. Медленный радиальный рост опухоли в верхних отделах кожи (20 лет и дольше до вертикальной инвазии в глубокие слои дермы) может захватывать волосяные фоликулы.
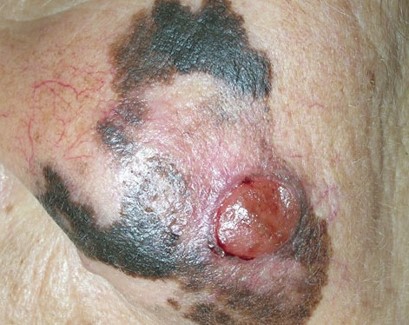
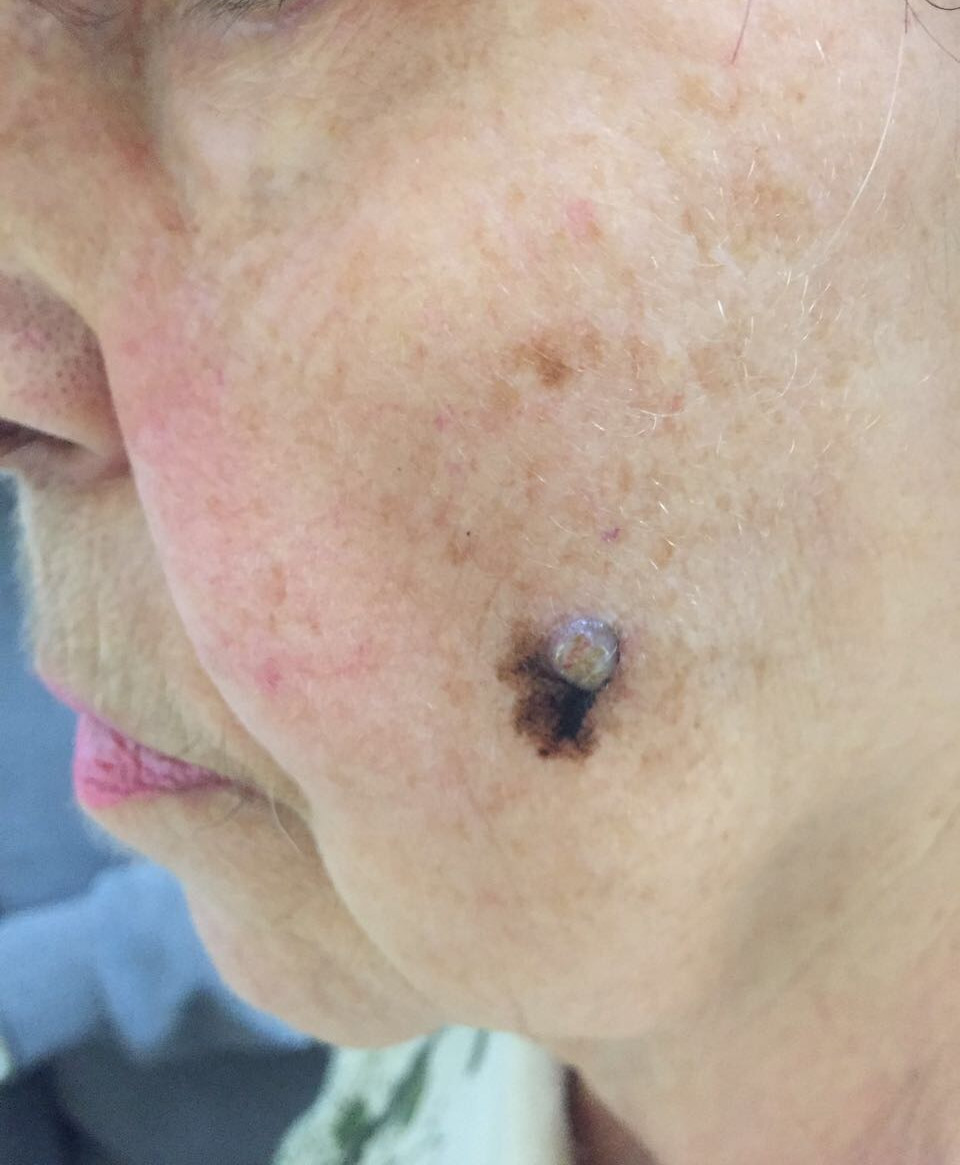
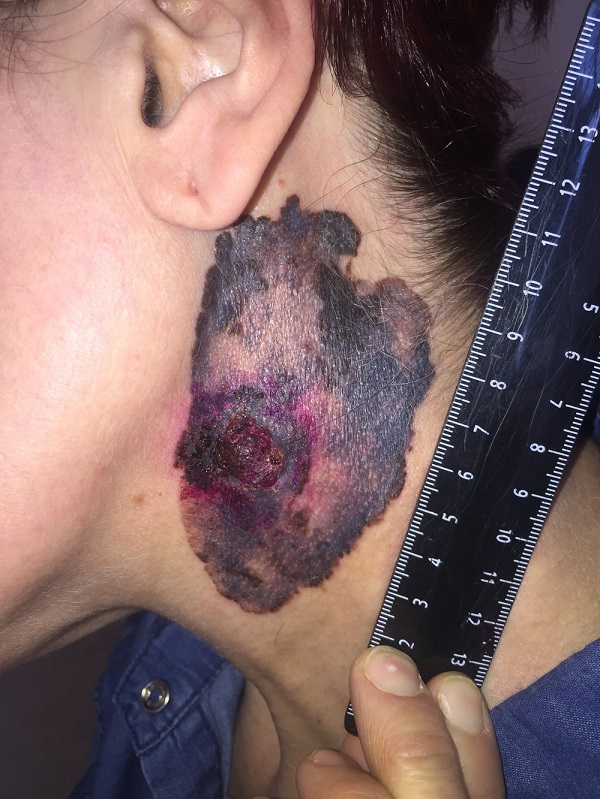
Первые признаки меланомы
Меланома – это приобретение клетками неблагоприятных признаков малигнизации (свойств озлокачествления), выраженное различными симптомами.
Для удобства запоминания признаков меланомы используют правило «ФИГАРО»:
Форма – вздутая над поверхностью;
Изменения – ускоренный рост;
Границы – ажурные, неправильные, изрезанные;
Асимметрия – отсутствие зеркальной схожести двух половинок образования;
Размер – критической величиной считается образование диаметром более, чем 6 мм;
Окраска – неравномерность цвета, включение беспорядочных пятен черного, синего, розового, красного цвета.
В широкой практике также популярен англоязычный вариант, суммирующий основные, наиболее типичные признаки – «правило ABCDE»:
Asymmetry – асимметричность, при которой, если провести воображаемую черту, делящую образование пополам, одна половина не будет похожа на другую.
Border irregularity – край неровный, фестончатый.
Color – цвет, отличный от других пигментных образований. Возможны вкрапления участков синего, белого, красного цветов.
Diameter – диаметр. Любое образование более 6 мм требует дополнительного наблюдения.
Evolution – изменчивость, развитие: плотности, структуры, размера.

Без специальных исследований сложно определить тип невуса, но вовремя замеченные изменения в характере пятна помогут обнаружить озлокачествление.
Диагностика
- Визуальный метод. Осмотр кожных покровов, с использованием «правила злокачественности».
- Физический метод. Пальпация доступных групп лимфоузлов.
- Дерматоскопия. Оптическое неинвазивное поверхностное исследование эпидермиса при помощи специальных приборов, дающих 10-40-кратное увеличение.
- Сиаскопия. Аппаратный спектрофотометрический анализ, заключающийся в интракутантном (глубинном) сканировании образования.





- Рентген.
- УЗИ внутренних органов и регионарных лимфоузлов.
- Биопсия. Возможен как забор образования целиком, так и его части (эксцизионная или инцизионная).
Стадии меланомы
Опухоль имеет несколько стадий развития.
- При нулевой и первой – клетки опухоли располагаются во внешнем слое дермы (локально);
- На второй и третьей – развитие изъязвлений в поражении, распространением на ближайшие лимфоузлы (локально-регионально);
- На четвертой – поражение лимфоузлов, органов, других участков кожи человека (отдаленное метастазирование).
Лечение
- Лечение локальных местных повреждений состоит в своевременном выявлении и хирургическом вмешательстве. Удаление чаще всего проводится под инфильтрационной анестезией. Для иссечения образований большого размера возможно применение общего обезболивания. Помимо злокачественных образований, существует ряд предмеланомных заболеваний, в которых показан хирургический метод.
- Локально-регионарные повреждения. Лечение включает в себя иссечение с увеличенным захватом площади и лимфодиссекцию пораженных лимфатических узлов. Разновидности нерезектабельных, транзиторно метастазирующих опухолей подвергают изолированной регионарной химиоперфузии. В определенных случаях отлично зарекомендовал себя комбинированный подход, с проведением дополнительной терапии, стимулирующей иммунитет.
- Лечение отдаленных метастазов выполняется монорежимной химиотерапией. Определенные виды мутаций подвергаются воздействию прицельных таргетных препаратов.
Меланома. Прогноз выживаемости
Толщина новообразования, глубина инвазии, локализация, наличие изъязвлений и радикальность вмешательства при лечении болезни имеет важное прогностическое значение.
Радикальное воздействие на поверхностные меланомы обеспечивает пятилетнюю выживаемость в 95 процентах заболеваемости. Опухоль с поражением лимфатических узлов снижает этот процент до 40.
Противопоказания
Принадлежность человека к светочувствительному фототипу, большое количество невусов, атипичные родинки, наличие наследственной предрасположенности, иммунных и эндокринных нарушений – дополнительные факторы в пользу внимательного отношения к кожным новообразованиям. Противопоказано:
- Травматизация
- Самодеятельное удаление родинок
- Длительное пребывание под УФ-излучением без средств защиты кожи
Лечение после операции
При локальных стадиях наблюдение проводится в течение 5 лет. 10 лет – при других формах. Этот срок считается достаточным для обнаружения появления рецидива заболевания. Пациент инструктируется о применении соответствующих средств защиты от УФ лучей, в условиях естественного и искусственного излучения.


Авторская публикация:
ГАФТОН ИВАН ГЕОРГИЕВИЧ
врач-онколог
НМИЦ онкологии им Н.Н. Петрова

Фотографии из личного архива:
РАДЖАБОВА ЗАМИРА АХМЕДОВНА
врач-онколог, заведующий хирургическим отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
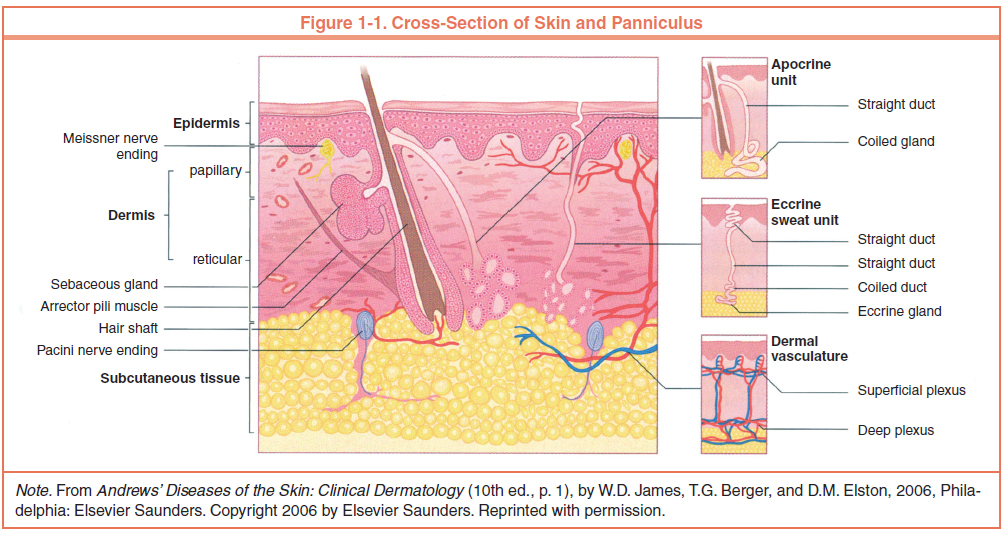
Рис.1. Структура кожи
Эпидермис
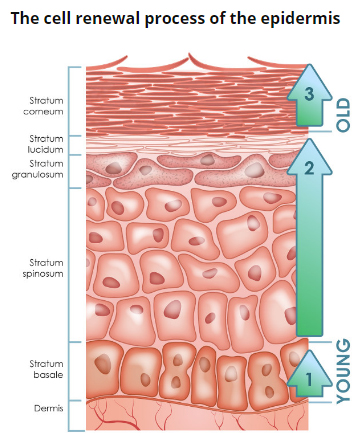
Рис. 2. Эпидермис
Эпидермис – постоянно слущивающийся эпителиальный слой кожи, в котором представлены в основном из 2 типа клеток – кератиноциты и дендритные клетки. В небольшом количестве в эпидермисе присутствуют меланоциты, клетки Лангерганса, клетки Меркеля, внутриэпидермальные Т-лимфоциты. Структурно эпидермис разделяется на 5 слоев: базальный, шиповатый, зернистый, блестящий и роговой , различающиеся положением и степенью дифференцировки кератиноцитов, основной клеточной популяции эпидермиса (рис. 2).
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
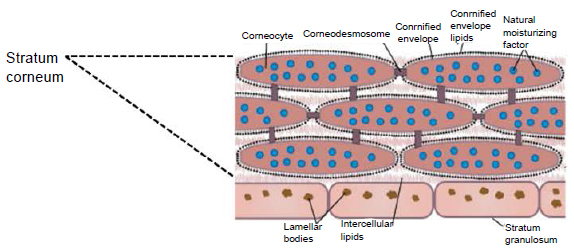
Рис. 3. Схематичное изображение рогового слоя с нижележащим зернистым слоем эпидермиса.
Регуляция пролиферации и дифференцировки кератиноцитов эпидермиса . Являясь непрерывно обновляющейся тканью, эпидермис содержит относительно постоянное число клеток и регулирует все взаимодействия и контакты между ними: адгезию между кератиноцитами, взаимодействие между кератиноцитами и мигрирующими клетками, адгезию с базальной мембраной и подлежащей дермой, процесс терминальной дифференцировки в корнеоциты. Основной механизм регуляции гомеостаза в эпидермисе поддерживается рядом сигнальных молекул – гормонами, факторами роста и цитокинами. Кроме этого, эпидермальный морфогенез и дифференцировка частично регулируются подлежащей дермой, которая играет критическую роль в поддержании постнатальной структуры и функции кожи.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Внеклеточный матрикс (ВКМ) дермы , или межклеточное вещество, в состав которого входят различные белки (главным образом коллаген, эластин), гликозаминогликаны, самым известным из которых является гиалуроновая кислота, и протеогликаны (фибронектин, ламинин, декорин, версикан, фибриллин). Все эти вещества секретируются фибробластами дермы. ВКМ представляет собой не беспорядочное скопление всех компонентов, а сложноорганизованную сеть, состав и архитектоника которой определяют такие биомеханические свойства кожи, как жесткость, растяжимость и упругость. К белкам ВКМ прикрепляются кератиноциты эпидермиса, которые тесно состыкованы друг с другом. Именно они и формируют плотный защитный слой кожи. Структура ВКМ также способна оказывать регулирующее влияние на погруженные в него клетки. Регуляция может быть как прямой, так и косвенной. В первом случае белки и гликозаминогликаны ВКМ непосредственно взаимодействуют с рецепторами клеток и инициируют в них специфические пути передачи сигнала. Косвенная регуляция осуществляется посредством действия цитокинов и ростовых факторов, удерживаемых в ячейках сети ВКМ и высвобождаемых в определенный момент для взаимодействия с рецепторами клеток. Структурная сеть ВКМ подвергается ремоделированию ферментами из семейства матриксных металлопротеиназ (ММР). В частности, ММР-1 и ММР-13 инициируют деградацию коллагенов I и III типов. Плотность сети ВКМ дермы неравномерна – в папиллярном слое она более рыхлая, в ретикулярном - значительно плотнее как за счет более близкого расположения волокон структурных белков, так и за счет увеличения диаметра этих волокон.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
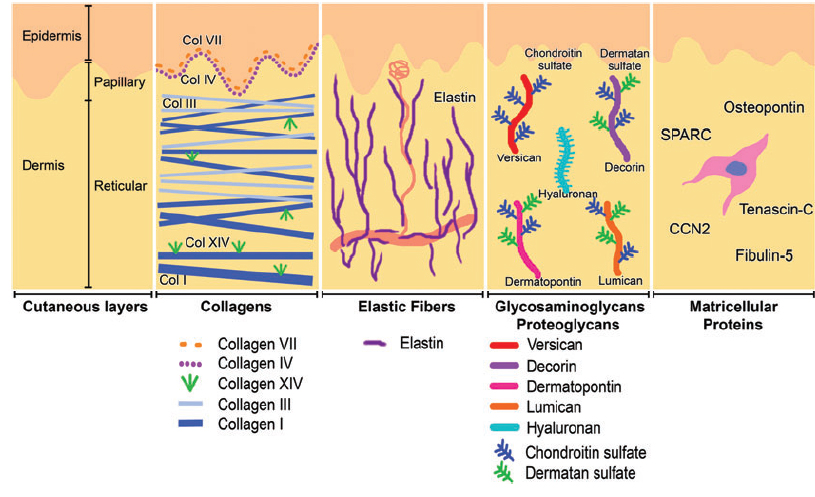
Рис. 4. Схематичное представление слоев кожи и распределения коллагенов разных типов.
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
Гиалуроновая кислота (ГК) представляет собой линейный полисахарид, состоящий из повторяющихся димеров D-глюкуроновой кислоты и N-ацетилглюкозамина. Количество димеров в полимере варьирует, что приводит к образованию молекул ГК разного молекулярного веса и длины - 1х10 5 -10 7 Да (2-25 мкм), оказывающих, соответственно, различный биологический эффект.
ГК - высокогидрофильное вещество, влияющее на движение и распределение воды в матриксе дермы. Благодаря этому ее свойству наша кожа в норме и в молодости обладает высоким тургором и сопротивляемостью механическому давлению.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
Подкожно-жировая клетчатка
Подкожно-жировая клетчатка , или гиподерма, - самый нижний слой кожи, располагается под дермой. Состоит из жировых долек, разделенных между собой соединительнотканными септами, содержащими коллаген и пронизанными крупными сосудами. Главными клетками жировых долек являются адипоциты, количество которых варьирует в различных областях тела. В настоящее время ПЖК рассматривают не только как энергетическое депо, но и как эндокринный орган, адипоциты которого участвуют в выработке ряда гормонов (лептина, адипонектина, резистина), цитокинов и медиаторов, оказывающих влияние на метаболизм, чувствительность к инсулину, функциональную активность репродуктивной и иммунной систем.
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения
Филиал "Вешняковский" Московского научно-практического центра дерматовенерологии и косметологии Департамента здравоохранения Москвы
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения
ФГУ "Федеральный научный центр трансплантологии и искусственных органов им. В.И. Шумакова" Минздрава России, Москва
Особенности течения и диагностики приобретенного буллезного эпидермолиза (клинико-иммунопатологическое наблюдение)
Журнал: Клиническая дерматология и венерология. 2013;11(2): 92‑97
Махнева Н.В., Нефедова Е.Д., Померанцев О.Н., Белецкая Л.В. Особенности течения и диагностики приобретенного буллезного эпидермолиза (клинико-иммунопатологическое наблюдение). Клиническая дерматология и венерология. 2013;11(2):92‑97.
Makhneva NV, Nefedova ED, Pomerantsev ON, Beletskaia LV. The course and diagnosis of acquired epidermolysis bullosa (a clinical and immunopathological observation). Klinicheskaya Dermatologiya i Venerologiya. 2013;11(2):92‑97. (In Russ.).
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения
Представлен клинический случай приобретенного буллезного эпидермолиза смешанного генеза с участием IgG/IgA-аутоантител, имитирующего клиническую картину вульгарной пузырчатки, торпидно протекающего на фоне иммуносупрессивной терапии. Рассматривая вопросы этиопатогенеза, авторы подчеркивают важную роль иммунофлюоресценции в диагностике и дифференциальной диагностике аутоиммунных буллезных дерматозов.
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения
Филиал "Вешняковский" Московского научно-практического центра дерматовенерологии и косметологии Департамента здравоохранения Москвы
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения
ФГУ "Федеральный научный центр трансплантологии и искусственных органов им. В.И. Шумакова" Минздрава России, Москва
Приобретенный буллезный эпидермолиз (ПБЭ) — редкое аутоиммунное буллезное заболевание кожи и слизистых оболочек, встречающееся в 0,17—0,26% случаев на 1 млн человек в Северной и Западной Европе [1, 2]. Несмотря на то что не обнаружено преимуществ выявления этого дерматоза в зависимости от расовой и половой принадлежности, отмечено его широкое распространение среди корейской популяции [3]. В Московской области за 1992—2006 гг. диагностировано всего 9 случаев ПБЭ при клинико-лабораторном обследовании 267 больных, страдающих аутоиммунными буллезными дерматозами [4].
Причина возникновения ПБЭ до конца не известна. Однако наличие в сыворотке крови у больных ПБЭ аутоантител, направленных к компонентам базальной мембраны кожи человека и животных (к детерминантам коллагена VII типа), свидетельствует о том, что буллезный дерматоз имеет аутоиммунный механизм развития [5—8]. Антитела больных ПБЭ относятся в основном к IgG [9, 10].
Основным клиническим признаком ПБЭ является возникновение спонтанных или травмоиндуцированных пузырей в зрелом возрасте (в 40—50 лет) с отсутствием семейной предрасположенности и исключением других буллезных дерматозов [11—13]. Как правило, в патологический процесс вовлекаются кожа и слизистая оболочка. При классическом варианте ПБЭ основным клиническим отличительным признаком является первичное возникновение пузырей и эрозивных дефектов на месте травм без или с минимальным проявлением воспалительного процесса. Это связано с физической слабостью кожного покрова, особенно в выступающих местах и местах сдавления (локтевых и коленных сгибов, сводов стоп) с образованием рубцов, милиа и/или эритемы [13—15]. Возможно развитие ониходистрофии и рубцовой алопеции [16, 17].
При воспалительном варианте ПБЭ пузыри, как правило, возникают на воспаленном участке кожи без травматизации на открытых ее участках. Клиническая картина отличается полиморфизмом и напоминает буллезный или рубцующийся пемфигоид [14, 18, 19].
Мы наблюдали за пациентом с ПЭБ смешанного генеза с участием IgG/IgA-аутоантител, имитирующего клиническую картину вульгарной пузырчатки, торпидно протекающего на фоне иммуносупрессивной терапии.
Обследован больной Ш., 54 лет. Болен около 6 лет (с 2006 г.). Впервые появились буллезные элементы на слизистой оболочке полости рта, коже волосистой части головы и верхней трети спины. Начало заболевания пациент связывает с избыточной инсоляцией и нервным перенапряжением. Клинически диагностирована вульгарная пузырчатка.
В Городской клинической больнице №14 им. В.Г. Короленко проведено лечение преднизолоном в максимальной начальной дозе (100 мг/сут внутрь) с постепенным ее снижением. Больной выписан с клинически положительным эффектом (эпителизацией эрозивных дефектов и отсутствием свежих буллезных элементов при дозе преднизолона 35 мг/сут). В течение 3 мес после выписки доза преднизолона была снижена до поддерживающей (10 мг/сут внутрь), на фоне которой периодически возникали единичные пузыри на коже конечностей, которые эпителизировались после применения спрея оксикорт. Патологический процесс постепенно прогрессировал и в 2009 г. пациент с обострением процесса госпитализирован в кожную клинику МИА им. И.М. Сеченова для обследования и коррекции терапии. При обследовании данных, свидетельствующих за паранеопластический процесс, не выявлено. Иммуноморфологическая картина интактного участка кожи свидетельствовала в пользу буллезного пемфигоида. Обнаружена фиксация IgG, IgA и С3-компонента комплемента в зоне базальной мембраны эпидермиса. Однако клинический диагноз «вульгарная пузырчатка» не был снят. Проведено лечение: метипред 20 таблеток в сутки (80 мг) в течение 21 дня. В связи с торпидным течением и отсутствием положительной динамики от проводимой терапии назначена комбинированная терапия преднизолоном (80 мг/сут) и азатиоприном (150 мг/сут). Однако патологический процесс прогрессировал.
К лечению были добавлены дипроспан (2,0 мл внутримышечно 1 раз в 5 дней, №3) и плазмаферез (8 сеансов). На фоне указанной терапии достигнут клинически положительный эффект (отсутствие свежих высыпаний, полная эпителизация эрозий). Пациент выписан на дозе преднизолона 25 мг/сут внутрь с рекомендациями о ее постепенном снижении. С 2010 г. пациент находится на поддерживающей терапии преднизолона (10 мг/сут внутрь). В течение последующих 1,5 лет у пациента периодически возникают единичные буллезные элементы и эрозивные дефекты на коже конечностей в местах травмирования, которые эпителизировались на фоне топических глюкокортикостероидов. С декабря 2011 г. отмечено обострение патологического процесса. Больной госпитализирован с диагнозом «вульгарная пузырчатка, обострение».

01.06.12 больной поступил в 1-е стационарное отделение филиала «Вешняковский» Московского научно-практического центра дерматовенерологии и косметологии Департамента здравоохранения Москвы (история болезни №12/246). Общее состояние удовлетворительное. Ведущие жалобы: высыпания на коже волосистой части головы, верхних и нижних конечностей, слизистой оболочке полости рта, жжение в местах высыпаний, боли при глотании и в эпигастрии. Пациент отмечал появление пузырей и эрозий непосредственно в местах ушиба или сдавления. При осмотре: процесс носит распространенный, подостровоспалительный характер с локализацией на коже волосистой части головы, туловища, верхних и нижних конечностей, слизистой оболочке полости рта. На коже волосистой части головы в проекции теменных зон процесс представлен эритематозно-сквамозными очагами и единичными эрозиями, расположенными на воспалительном фоне, покрытыми серозно-геморрагическими корочками размером до 1,5 см в диаметре (рис. 1, a). Рисунок 1. Клинические проявления ПБЭ. a — лобно-теменная зона: единичные эрозивные дефекты (до 0,5 см) на эритематозном фоне с серозно-геморрагическими корочками, эритематозносквамозные очаги; б — кожа правой кисти: эрозии (до 0,7 см в диаметре) с серозным отделяемым, серозно-геморрагическими корочками; поствоспалительные гиперпигментированные и эритематозные пятна (диаметром до 1,5 см), милиумы (до 0,3 см в диаметре); ногтевые пластины дистрофичны (тусклые, желтоватые, истонченные, продольно исчерченные); в — левая стопа: ногтевые пластины тусклые, деформированы, с продольной исчерченностью, множественными лейконихиями и крошащимися краями; г — полость рта. На коже туловища, конечностей — единичные эрозии до 0,7 см в диаметре, частично покрытые серозно-геморрагическими корочками с серозным отделяемым; на месте бывших высыпаний — гиперпигментированные пятна диаметром до 1,5 см. Симптом Никольского отрицательный. На коже кистей — милиумы (см. рис. 1, б). Ногтевые пластины тусклые, деформированы, продольно исчерчены, крошатся (см. рис. 1, в). На слизистой оболочке полости рта (щек, мягкого и твердого неба) патологический процесс представлен эрозиями с ярко-розовым дном размером до 0,7 см в диаметре, окаймленными по периферии обрывками эпителия беловатого цвета (см. рис. 1, г).
Из анамнеза: острые респираторные вирусные инфекции до 5—6 раз в год; в 2011 г. — операция по поводу правосторонней паховой грыжи.
Для исключения неопластического процесса как одного из факторов, провоцирующих буллезный дерматоз, пациенту проведено комплексное обследование. Диагностированы ишемическая болезнь сердца; стенокардия напряжения I—II функционального класса; гипертоническая болезнь II ст.; язвенная болезнь двенадцатиперстной кишки, рубцовая деформация луковицы двенадцатиперстной кишки; хронический панкреатит в ремиссии; мочекаменная болезнь, конкременты почек, киста синуса левой почки; хронический субатрофический фарингит. По данным эзофагогастродуоденоскопии, рубцовая деформация луковицы двенадцатиперстной кишки, поверхностный гастрит и косвенные признаки хронического панкреатита. В клиническом анализе крови — лейкоцитоз (до 15,3×10 9 /л). Данных за онкопатологию не обнаружено.
При цитологическом исследовании мазков-отпечатков со дна эрозий слизистой оболочки полости рта и кожи акантолитические клетки (клетки Тцанка) не обнаружены. При микроскопическом исследовании гладкой кожи и ногтевых пластин стоп грибы не выявлены.
На основании анамнеза, клинико-морфологической картины, особенности течения болезни и результатов ранее проведенного иммуногистохимического исследования пациенту выставлен диагноз ПБЭ.
Проведено лечение преднизолоном (60 мг/сут внутрь) с постепенным снижением дозы (до 50 мг/сут), на фоне которого на слизистой оболочке полости рта сохранялись эрозивные дефекты. Пациент переведен на комбинированную терапию глюкокортикостероидами: преднизолон (30 мг/сут) и метипред (16 мг/сут) внутрь. Лечение без эффекта. К терапии присоединен сандиммун-неорал в дозе 400 мг/сут ежедневно с последующим ее снижением до 300 мг/сут. На фоне приема сандиммун-неорала появились боли в эпигастральной и поясничной областях, и препарат был постепенно отменен. Комбинированный прием преднизолона (30 мг/сут внутрь) и метипреда (16 мг/сут внутрь) продолжен.
Из сопутствующей терапии: гемодез (200,0 мл внутривенно капельно через сутки, №3), трентал (5,0 мл внутривенно капельно с 200 мл физиологического раствора, №10), актовегин (5,0 мл внутримышечно ежедневно, №10), эссенциале (5,0 мл внутривенно струйно, №15), витамины В1 и В6 (по 1,0 мл внутримышечно, чередование), фолиевая кислота 1 мг (по 1 таблетке 2 раза в сутки), аспаркам (по 1 таблетке 3 раза в сутки), форкан 150 мг (1 капсула в неделю), омепразол 20 мг (1 капсула 2 раза в сутки), фосфалюгель (1 пакетик 3 раза в сутки), кальций D3-никомед 0,5 мг (по 1 таблетке 2 раза в сутки), эналаприл (10 мг 2 раза в сутки), индапамид (1,5 мг утром), гипотиазид (25 мг утром), нитроглицерин (0,5 мг при болях в области сердца). Местная терапия: на эрозивные дефекты на коже волосистой части головы, туловища — водный раствор метиленового синего, спрей оксикорт. Обработка слизистой оболочки полости рта тетраборатом натрия, полоскание полости рта отварами трав (шалфей, ромашка).
На фоне терапии эрозии на коже туловища, конечностей эпителизировались, на месте бывших высыпаний остались поствоспалительные пятна розово-красного цвета, милиумы на коже кистей, предплечий. На слизистой оболочке полости рта — эрозии в стадии эпителизации. Боли при глотании значительно уменьшились. Больной выписан с положительным клиническим эффектом на комбинированной терапии преднизолоном (30 мг/сут внутрь) и метипредом (16 мг/сут внутрь) под наблюдение дерматолога по месту жительства. Даны рекомендации.
ПБЭ — крайне редкая патология. Впервые ПБЭ описан во II половине XX века и получил свое название в связи с клиническим сходством с дистрофической формой врожденного буллезного эпидермолиза [20], который развивается у детей вследствие врожденного дефекта в гене, кодирующем коллаген VII типа (якорные фибриллы). Коллагены (фибриллярные и нефибриллярные) являются структурными элементами большинства форм соединительной ткани в организме человека и мутации в генах, кодирующих их, являются причиной развития разных заболеваний человека [21—25]. Это могут быть несовершенный остеогенез, некоторые формы остеопороза, хондродисплазия, сосудистые аневризмы, заболевание почек и буллезный эпидермолиз [26, 27]. В последнем случае дефектное связывание волокон коллагена VII типа с недостаточным количеством якорных фибрилл вызывает несостоятельность кожного покрова — его неустойчивость к механическим воздействиям с развитием травмоиндуцированных пузырей, которые могут располагаться как на спокойном, так и на минимально воспаленном фоне с образованием рубцов и милиа [13, 14, 16, 17]. Возможно развитие и ониходистрофии [11, 16, 17], что подтверждает и представленный нами клинический случай.
Ультраструктурное изучение кожи при ПБЭ позволило обнаружить аморфное состояние электронно-плотной полосы непосредственно под lamina densa с недостаточным количеством якорных фибрилл, которые крепят эпидермис к дерме, пересекая базальную мембрану [28—30]. Однако выявление в сыворотке крови у пациентов с данной патологией IgG-аутоантител к коллагену VII типа позволило предположить, что ПБЭ имеет аутоиммунный механизм развития, в котором якорные фибриллы скорее скомпрометированы аутоантителами, чем дефектами гена [6, 31]. Антитела не являются специфичными только для антигенов базальной мембраны эпидермиса. Они также взаимодействуют с антигенами базальных мембран слизистой оболочки полости рта, пищевода, влагалища [6, 12]. Ответственность аутоантител за проявления ПБЭ подтверждена экспериментально in vivo на новорожденных мышах [31—34]. Проведена пассивная передача аутоантител (очищенный IgG) от пациентов с ПБЭ новорожденным мышам. При этом у животных развивался процесс с гистологическими и иммунопатологическими изменениями, характерными для этого заболевания.

По мнению ряда авторов [35—37], в некоторых случаях патогенетическая роль при ПБЭ принадлежит циркулирующим аутоантителам класса A или одновременно IgA и IgG. Последнее подтверждает и описанный нами случай. С помощью методов меченых антител (прямой метод иммунофлюоресценции) в зоне базальной мембраны эпидермиса обнаружены связанные с тканями иммуноглобулины (IgA, IgG) и С3-компонент комплемента. Базальная мембрана эпидермиса является антигеном-мишенью для аутоантител буллезного пемфигоида и приобретенного буллезного эпидермолиза (рис. 2, a). Рисунок 2. Криостатные срезы кожи больных аутоиммунными буллезными дерматозами (для сравнительного контроля). Участки клинически непораженной кожи. Обработка меченой сывороткой против Ig G человека. Прямой метод иммунофлюоресценции (×400). a — буллезный пемфигоид: фиксация IgG в зоне базальной мембраны эпидермиса; б — в месте образовании пузыря фиксированный иммуноглобулин выявляется на покрышке в связи с фиксацией его в lamina lucida; в — фиксация IgG на дне подэпидермального пузыря (широкая щель) при ПБЭ; г — фиксация IgG в межклеточной субстанции всех слоев эпидермиса и на поверхности кожи при аутоиммунной пузырчатке. При этом фиксация аутоантител в lamina lucida и сохранение фиксированного иммуноглобулина на покрышке пузыря свидетельствуют о наличии буллезного пемфигоида (см. рис. 2, б), в то время как при ПБЭ фиксированный иммуноглобулин сохраняется на дне пузыря (см. рис. 2, в). При ПБЭ мишенью антител является lamina densa [38, 39].
В описанном нами случае ранее использованный метод меченых антител позволил исключить у пациента наличие аутоиммунной пузырчатки, для которой характерна картина фиксации IgG в межклеточной субстанции многослойного плоского эпителия (см. рис. 2, г) и заподозрить аутоиммунный буллезный дерматоз дермо-эпидермального соединения, в частности буллезный пемфигоид. Отсутствие подэпидермального микропузыря в криостатных срезах клинически интактного участка кожи пациента, к сожалению, не позволило иммуногистохимически уточнить мишень для фиксированных иммунных комплексов. Тем не менее тщательно собранный анамнез с указанием пациента на легкую ранимость кожного покрова, клинические проявления (рубцы, милиум, ониходистрофия), волнообразное течение болезни и торпидность патологического процесса к иммуносупрессивной терапии свидетельствовали в пользу ПБЭ.
Таким образом, ПБЭ — редкий буллезный дерматоз, имеющий специфические и неспецифические клинические проявления, лечение которого для врача представляет сложности. Это связано с волнообразным течением данного дерматоза, торпидного к иммуносупрессивной терапии. Неуклонное прогрессирование патологического процесса с вовлечением слизистых оболочек, угрожающего жизни пациента, требует от специалистов постановки точного диагноза с использованием молекулярно-биологических методов исследования, а от исследователей — изучения этиопатогенетических механизмов болезни с целью разработки более совершенных методов диагностики и лечения.
Читайте также:

